Сполуки з аналгетичною дією, фармацевтична композиція на основі цих сполук та спосіб лікування
Номер патенту: 71650
Опубліковано: 15.12.2004
Автори: Волпоул Крістофер, Браун Вілл'ям, Плобек Ніклас
Формула / Реферат
1. Сполука згідно з формулою І
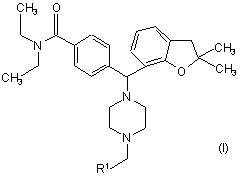 ,
,
де R1 вибрано з
(і) фенілу;
(іі) піридинілу
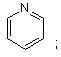
(ііі) тіофенілу
![]()
(iv) фуранілу
![]()
(v) імідазолілу
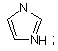
(vi) триазолілу
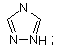
де кожне R1 фенільне кільце і R1 гетероароматичне кільце може бути, як варіант, незалежно заміщеним 1, 2 чи 3 замісниками, вибраними з лінійних та розгалужених С1-С6алкілу, NO2, СF3, С1-С6алкоксилу, хлору, флуору, брому та йоду,
замісники на фенільному кільці та на гетероароматичному кільці можуть знаходитися у будь-якій позиції на зазначених кільцевих системах;
а також їх фармацевтично прийнятні солі та їх ізомери.
2. Сполука за п.1, яка відрізняється тим, що необов'язковий замісник (і) ароматичного або гетероароматичного кільця(кілець) вибрано з NО2, ізобутилу, СF3, метоксилу, метилу або хлору.
3. Сполука за п. 1 або 2, яка відрізняється тим, що вибрана з групи:
дигідрохлорид 4-[(4-бензил-1-піперазиніл) (2,2-диметил-2,3-дигідро-1-бензофуран-7-іл)метил]-N,N-діетилбензамід (сполука 6);
дигідрохлорид 4-{(2,2-диметил-2,3-дигідро-1-бензофуран-7-іл)[4-(4-йодобензил)-1-піперазиніл]метил}-N,N-діетилбензамід (сполука 7);
дигідрохлорид 4-{(2,2-диметил-2,3-дигідро-1-бензофуран-7-іл)[4-(3-піридинілметил)-1-піперазиніл]метил}-N,N-діетилбензамід (сполука 8), та
дигідрохлорид 4-{(2,2-диметил-2,3-дигідро-1-бензофуран-7-іл)[4-(2-піридинілметил)-1-піперазиніл]метил}-N,N-діетилбензамід (сполука 9).
4. Сполука за будь-яким з пунктів 1-3, яка відрізняється тим, що є (+)-енантіомером.
5. Сполука за будь-яким з пунктів 1-3, яка відрізняється тим, що є (-)-енантіомером.
6. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що існує у формі гідрохлориду, сульфату, тартрату або цитрату.
7. Сполука за будь-яким з пп.1-6, яка відрізняється тим, що призначена для використання у терапії.
8. Сполука за п. 7, яка відрізняється тим, що терапія полягає у вгамуванні болю.
9. Сполука за п. 7, яка відрізняється тим, що терапію спрямовано проти шлунково-кишкових розладів.
10. Сполука за п. 7, яка відрізняється тим, що терапію спрямовано проти пошкоджень спинного мозку.
11. Сполука за п. 7, яка відрізняється тим, що терапію спрямовано проти розладів симпатичної нервової системи.
12. Використання сполуки формули І за п. 1 у виготовленні медикаменту для використання при вгамуванні болю.
13. Використання сполуки формули І за п. 1 у виготовленні медикаменту для використання у лікуванні шлунково-кишкових розладів.
14. Використання сполуки формули І за п.1 у виготовленні медикаменту для використання при лікуванні пошкоджень спинного мозку.
15. Фармацевтична композиція, яка містить як активний інгредієнт сполуку формули І за п. 1 разом з фармакологічно і фармацевтично прийнятним носієм.
16. Спосіб лікування болю, який полягає в тому, що пацієнту для вгамування болю уводять ефективну кількість сполуки формули І за п.1.
17. Спосіб лікування шлунково-кишкових розладів, який полягає в тому, що пацієнту, який страждає від шлунково-кишкового розладу, уводять ефективну кількість сполуки формули І за п. 1.
18. Спосіб лікування пошкоджень спинного мозку, який полягає в тому, що пацієнту, який страждає від пошкодження спинного мозку, уводять ефективну кількість сполуки формули І за п.1.
Текст
1. Сполука згідно з формулою І 3 71650 4 9. Сполука за п. 7, яка відрізняється тим, що те15. Фармацевтична композиція, яка містить як акрапію спрямовано проти шлунково-кишкових розтивний інгредієнт сполуку формули І за п. 1 разом ладів. з фармакологічно і фармацевтично прийнятним 10. Сполука за п. 7, яка відрізняється тим, що носієм. терапію спрямовано проти пошкоджень спинного 16. Спосіб лікування болю, який полягає в тому, мозку. що пацієнту для вгамування болю уводять ефек11. Сполука за п. 7, яка відрізняється тим, що тивну кількість сполуки формули І за п.1. терапію спрямовано проти розладів симпатичної 17. Спосіб лікування шлунково-кишкових розладів, нервової системи. який полягає в тому, що пацієнту, який страждає 12. Використання сполуки формули І за п. 1 у вивід шлунково-кишкового розладу, уводять ефектиготовленні медикаменту для використання при вну кількість сполуки формули І за п. 1. вгамуванні болю. 18. Спосіб лікування пошкоджень спинного мозку, 13. Використання сполуки формули І за п. 1 у виякий полягає в тому, що пацієнту, який страждає готовленні медикаменту для використання у лікувід пошкодження спинного мозку, уводять ефективанні шлунково-кишкових розладів. вну кількість сполуки формули І за п.1. 14. Використання сполуки формули І за п.1 у виготовленні медикаменту для використання при лікуванні пошкоджень спинного мозку. Винахід стосується нових сполук, способу їх одержання та застосування, а також фармацевтичних композицій, що їх містять. Нові сполуки прийнятні для використання у терапії, і зокрема, для вгамування болю. Було визначено, що δ-рецептор грає роль у таких функціях організму як серцево-судинній та больовій системах. Тому ліганди для δ-рецептора можуть знайти потенційне застосування як анальгетики та/або як гіпотензивні засіби. Також було визначено, що ліганди для δ-рецептора мають імуномодулювальну активність. Зараз чітко встановлено принаймні три різних популяції опіоїдних рецепторів (μ, δ та к), і присутність усіх трьох рецепторів як у центральній, так і у периферійній нервових системах багатьох видів включно з людиною, є очевидною. У багатьох видах тварин спостерігали анальгезію, коли активізувались один або більше таких рецепторів. Сьогодні відомі селективні опіоїдні δ-ліганди, які за незначним винятком мають пептидне походження і неприйнятні для введення системним шляхом. Одним з прикладів непептидного δагоніста є SNC80 (Bilsky EJ.et al., Journal of Pharmacology and Experimental Therapeutics, 273(1), pp.359-366 (1995)). Проте, все ще залишається потреба в селективних δ-агоністах, які б мали не тільки поліпшену селективність, але й покращенний профіль побічної дії. Отже, метою цього винаходу є одержання нових анальгетиків, які б мали поліпшений знеболювальний ефект, а також покращенний профіль побічної дії, ніж відомі μ-агоністи, а також удосконалену системну ефективність. Анальгетики, що визначені та відомі з прототипу, мають багато вад, які полягають у поганій фармакокінетиці та відсутності знеболювання при введення системним шляхом. Також було повідомлено, що бажані сполуки δ-агоністу, описані в прототипі, виявляють значний конвульсивний ефект при систематичному введенні. Стало відомо, що певні сполуки неспецифічно описані, але включені в межі документу WO98/28270, виявляють поліпшені властивості δагоністу та in vivo активність відносно сполук описаних у WO98/28270 при систематичному введенні. Сполуки згідно даного винаходу, виявляють значні та неочікувано високі рівні агонізму дельтарецептору та метаболічної стійкості. Нові сполуки згідно з винаходом визначено формулою І де кожне фенільне кільце R1 та гетероароматичне кільце R1 може бути, як варіант, незалежно заміщеним 1, 2 чи 3 замісниками, вибраними з лінійних та розгалужених С 1-С6алкілу, NO2, CF3, С1-С6алкоксилу, хлору, флуору, брому та йоду. Заміщення на фенільному та гетероароматичному кільці може знаходитися у будь-якій позиції кільцевих систем. Також в межах винаходу представлено фармацевтично прийнятні солі сполук формули І, а також її ізомери. 5 71650 6 У випадку заміщення фенільного та гетероСпособи одержання ароматичного кільця (кілець), бажані замісники Сполуки згідно з винаходом можуть бути одевибирають з будь-чого з CF3, метилу, йоду, брому, ржати синтетичним способом, описаним у С хемі І. флуору, та хлор у. Цей спосіб описано у Katritsky, A.R., Lan, X. У переважному втіленні винаходу сполуки фоChem.Soc.Rev,, pp.363-373 (1994) і, який включено рмули І представлені як (+)-енантіомер або як (-)тут як посилання. енантіомер. "Ізомерами" ми позначаємо сполуки формули І, які відрізняються позицією своєї функціональної групи та/або орієнтацією. Під "орієнтацією" ми розуміємо стереоізомери, діастереоізомери, регіоізомери та енантіомери. Згідно з представленим винаходом, нові сполуки прийнятні для використання в терапії, особливо для лікування таких різних больових станів, як: хронічний біль, невропатичний біль, гострий біль, біль викликаний раком, ревматоїдним артритом, мігренню, вісцеральний біль тощо. Не слід вважати цей перелік вичерпаним. Згідно з представленим винаходом, нові сполуки корисні як імуномодулятори, особливо при таких автоімунних хворобах як артрит, при трансплантації ділянок шкіри, органів та при схожих хіΡ = протектуюча гр упа типу Bn, Boc, CBz рургічних потребах, при хворобах сполучних ткаΜ = Li, Mg, Zn нин, різноманітних алергіях, сполуки також корисні X = Br, I як протипухлинні та як противірусні засіби. L = Cl, Br, OMs, OTs, I Згідно з представленим винаходом, нові споR1 визначено формулою (І), наведеною вище луки корисні у таких станах захворювання, де має Приклади місце дегенерація або дисфункція опіоїдних рецеНаступні приклади розкриють винахід більш пторів, що наявна або включена в парадигму. Модетально, проте не слід розглядати їх як такі, що жна припустити застосування мічених ізотопами обмежують винахід. варіантів сполук за винаходом у методиці діагносСполуки згідно з Прикладами 1-3 одержували тики та діагностиці позитроно-емісійною томограсинтетичним способом, описаним на Схемі 1. фією (ПЕТ). Сполуки за винаходом, прийнятні для лікування діареї, депресії, тривожності, нетримання сечі, різноманітних розумових хвороб, кашлю, набряку легенів, різних шлунково-кишечних розладів, порушення спинного мозку та залежності від медичних препаратів, включно з лікуванням залежності від алкоголю, нікотину, опію та інших ліків, а також для порушень симпатичної нервової системи, наприклад, гіпертензії. Сполуки, згідно з представленим винаходом, корисні як знеболювальний засіб для застосування під час загального наркозу та контролювання стану анастезії. Комбінації засобів з різними властивостями часто використовують для досягнення рівноваги ефектів, потрібних для підтримання стану знеболення (наприклад, амнезія, анальгезія, міорелаксація та заспокоєння). До цієї комбінації також відносять анастезуючі засоби для вдихання, снодійні засоби, транквілізатори, нервово-м'язові блокатори та опіоїди. Винахід також стосується використання будьякої з сполук за формулою І у виготовлення медикаменту для лікування будь-якого зі станів описаних ви ще. Приклад 1 Ще одним об'єктом винаходу є спосіб лікуванОдержання дигідрохлориду 4-[(4-бензил-1ня хворих, які страждають на будь-який зі станів піперазиніл)(2,2-диметил-2,3-дигідро-1описаних вище, який полягає у введенні ефективбензофуран-7-іл)метил]-N,N-діетилбензаміду ної кількості сполуки формули І, хворому, який (сполука 6) потребує такого лікування. (і) Одержання 2,2-диметил-2,3-дигідро-1Винахід також стосується будь-якої нової пробензофуран-7-ілу три флуорметансульфонату міжної сполуки описаної далі у Схемі І, корисної у (сполука 1) синтезі сполук формули І. 7 71650 8 2,2-диметил-2,3-дигідро-1-бензофуран-7-ол 24моль) додавали по краплях. Через 30 хвилин (19г, 0,11моль) та піридин (18мл, 0,23моль) розчидодавали NH4CI (водн.). Після концентрації у вакунили у СН2СІ2 при температурі 0°. Трифлурооцтоумі, екстрагування ЕtOАс/водою, сушіння (MrSO4) вий ангідрид (23мл, 0,14моль) додавали по крапта випарювання органічної фази залишок очищулях. Після перемішування протягом 1 години при вали хроматографією на діоксиді силіцію (сполука температурі 25°С суміш розводили СН 2СІ2 та об4) (6.1г, 17моль). Після оброблення SOCI2 (1.5мл, робляли НСІ (водн.), висушували (Mg SO4) та ви20моль) у сухому СН 2СІ2 (200мл) при температурі парювали у вакуумі. від 0 до 25°С. протягом 1 години розчинник випаОдержані 32г сполуки 1 (96%), що не потребує рювали у вакуумі. Залишок розчиняли у MeCN очищення, використовували безпосередньо на (100мл) та вводили у реакцію з піперазином (5.8г, наступному етапі. 68моль) при температурі 80°С протягом 12 годин. 1 Після концентрації у вакуумі та хроматографії на Н ЯМР (CDC13) d1,50 (s, 6Н), 3.09 (s, 2Н), 6.81 (m, 1Н), 7.03 (т, 1Н), 7.11 (m, 1Н), діоксиді силіцію (від 0 до 15% МеОН у СН2СІ2, з 1% NH4OH) одержували (сполуку 5) (4.9г, 11моль). МС (ЕІ) m/е 296, 163, 135, 107. Дигідрохлорид одержували за допомогою НСІ (іі) Одержання метилу 2,2-диметил-2,3(водн.) та ліофілізації. дигідро-1-бензофуран-7-карбоксилату (сполука 2) Точка плавлення 130-40°С (дигідрохлорид). Сполуку 1, одержану на попередньому етапі (32г, 0,11моль), розчиняли у диметилсульфоксиді Ниже надо исправить: ІЧ (ІЧ) N MR IR (KBr, vmax) 2982, 2722, 2481,1628, 1450, (ДМСО) (200мл), МеОН (100мл) та Et3N (34мл, 1371,1292,1140. 0,25моль). Оксид карбону пропускали крізь розчин 1 протягом 2-3хв., далі додавали ацетат паладію H NMR (CD3OD) d 1.1,1.2 (2m, 6H), 1,36,1.43 (0,24г) та dppf (1,1г) та суміш підігрівали при тем(2s, 6H), 2.72 (m, 4H), 2.95 (m, 2H), 3.25 пературі 70°С у атмосфері CO. Через 4 години, (m, 6Н), 3.5 (m, 2H), 4.8 (s, 1H), 6.74-7.60 (m, додавали ще ацетат паладію (0,10г) та dppf 7Н). Анал. (С26Н35К 3O2) С, Η, Ν. (0,50г). Через 12 годин, додавали ЕtOАс та воду, а (vi) Одержання сполуки 4-[(4-бензил-1органічну фазу промивали НСІ (водн.), розсолом, піперазиніл)(2,2-диметил-2,3-дигідро-1висушували (MgSO4) та випарювали. Хроматогбензофуран-7-іл)метил]- N,N-діетилбензамід дигірафія на діоксиді силіцію (0-20% ЕtOАс у гептані) дрохлориду (сполука 6) дала 12г (52%) сполуки 2. Сполуку 5 (0.62г, 1.5моль) та триетиламін 1 Н ЯМР (CDCI3) δ 1.52 (s, 6Н), 3.00 (s, 2Н), 3.88 (0.41мл, 2.9моль) розчиняли у MeCN (5мл) та вво(s, 3Н), 6.82 (m, 1H), 7.27 (m,1H), 7.70 (m, 1H). МС дили у реакцію з бензилбромідом (0.17мл, (ЕІ) m/e 206, 174, 159,146,131. 1.5моль) при температурі 25°С. Через 2 години (iiі) Одержання 2,2-диметил-2,3-дигідро-1додавали другу частину бензилброміду, а через 4 бензофуран-7-карбальдегіду (сполука 3) години реакційну суміш концентрували у вакуумі Сполуку 2 (5,0г, 24моль) розчиняли у толуолі та хроматографували на діоксиді силіцію (від 0 до (100мл) та додавали DIBAL у толуолі (33мл, 1,5М, 10% МеОН у СН 2СІ2), щоб одержати сполуку 6 50моль) при температурі -78°С у атмосфері азоту. (0.49г, 0.95моль). Дигідрохлорид одержували за Через 30 хвилин, реакційну суміш обробляли додопомогою НСІ (водн.) та ліофілізації. МС (ES) даванням НСІ (водн.), органічну фазу висушували 512.08 (МН+). (MgSO4) та випаровували у вакуумі. Залишок розІЧ (NaCI, вільний амін, vmax) чиняли у СН2СІ2 (50мл) та додавали по частинах 2969,2806,2360,1630,1451,1368,1289, 1135 cm-1. 1 дрібно розмелений дихромат піридину (ДП) (11г, Н ЯМР (CDCI3, вільний амін) d 1.1, 1.2 (2m, 29моль). Суміш підігрівали при температурі 40°С 6Н, амід-Ме), 1.36, 1.46 (2s, 6H, Ме2С), 2.5 (m, 8Н, та частини ДП (1г) додавали доки не закінчиться піперазин-Н), 2.92 (m, 2Н, АrCН2), 3.2, 3.5 (2m, реакція. Розбавлення гептаном, фільтрування амід-СН2), 3.51 (s, 2H, крізь діоксид силіцію та випарювання давали сиArCH2N), 4.62 (s, 1Н, Аr2СН), 6.72-7.52 (m, 7Н, рий продукт, який очищували хроматографією на Аr-Н). діоксиді силіцію (0-20% ЕtOАс у гептані), щоб одеАнал. (С33Н41N 3O2 х 3.4 НСІ) С, Η; Ν: обчисл., ржати сполуку 3 (3,3г, 19моль, 67% зі сполуки 2. 6.61; виявлено, 7.19. Почему-то нижеидущая строка дана как рисуПриклад 2 нок, поэтому надо как-то исправить NMR і MS Одержання 4-{(2.2-диметил-2,3-дигідро-11 H NMR (CDCI3) d 1.54 (s, 6H), 3.03 (s, 2H), 6.88 бензофуран-7-іл)[4-(4-йодобензил)-1(m, 1H), 7.34 (m, 1H), 7.58 (m, 1H), 10.22 (s, 1H). піперазиніл]метил} N,N-діетилбензамід дигідрохMS (El) m/e 176,161, 147,130. лориду (сполука 7) (iv) та (ν) Одержання 4-[(2,2-диметил-2,3Спосіб як для сполуки 6. Сполуку 5 (0.12г, дигідро-1-бензофуран-7-іл)(гідрокси)метил]-N,N0.29моль) вводили в реакцію з 4діетилбензаміду(сполука 4) та 4-[(2,2-диметил-2,3йодобензилбромидом (96мг, 0,32моль) протягом дигідро-1-бензофуран-7-іл)(1-ліперазиніл)метил]48 годин, щоб одержати сполуку 7 (56мг, N,N-діетилбензаміду (сполука 5) 88мкмоль). Ν,Ν-діетил-4-йодобензамід (сполука І) (14г, МС (ES) 638.24 (МН+). ІЧ (NaCI, вільний амін, 47моль) розчиняли у тетрагідрофурані (ТГФ) vmax) 2969, 2810, 1630, 1451, 1288, 1135, 1007cm -1. 1 (150мл) та охолоджували до температури -78°С у НЯМР (CDCI3, вільний амін) δ 1.1, 1.2 (2m, 6Н, атмосфері азоту. Додавали краплями н-BuLi амід-Ме), 1.36, 1.45 (2s, 6H, Ме2С), 2.4 (m, 8Н, (21мл, 2.2Μ розчин у гексані, 47моль). Протягом piperazine-H), 2.94 (m, 2Н, АrCН2), 3.2, 3.5 (2m, 30 хвилин перемішували при температурі -78°С. amide-CH2), 3.43 (s, 2H, ArCH2N), і 4.62 (s, 1Н, Розчинений у ТГФ (2мл) альдегід (сполука 3) (4.1г, Аr2СН), 6.73 (т, 1Н, Аr-Н), 6.94 (d, J=7.3 Hz, 1Н, 9 71650 10 АrН), 7.05 (d, J=8.0 H z, 2H, АrН), 7.19 (d, J=6.6 Hz, складності захворювання, віку та маси хворого, та 1Н, АrН), 7.25 (d, J=8.0 Hz, 2H, АrН), 7.48 (d, J=8.0 інших факторів, звичайно враховуваних штатним Hz, 2H, ArH), 7.61 (d, J= 8.0 H z, 2H, ArH). Anal. лікарем лікарні, при встановленні індивідуального (C26H37CI 2N3O 2) С, Η, Ν. режиму та дози, найбільш придатних для конкретПриклад 3 ного хворого. Одержання 4-{(2.2-диметил-2.3-дигідро-1Для одержання фармацевтичних композицій із бензо(руран-7-іл)[4-(3сполук згідно з даним винаходом, інертні фармапіридинілметил)-1-піперазиніл]метил)-N,Nцевтично прийнятні носії можуть бути твердими діетилбензамид дигідрохлориду (сполука 8) або рідкими. До препарату, що має тверду форму, Сполуку 5 (0.20г, 0.47моль) розчиняли у МеОН належать порошки, таблетки, здатні до дисперсії (2мл) з 3-піридинкарбоксальдегідом (90мкл, 0.9 гранули, капсули, крохмальні облатки та моль) та НОАс (3мкЛ, 50мкмоль). Цианоборогідсупозиторії. рид натрію (60мг, 0.95моль) додавали при темпеТвердий носій може включати одну або більше ратурі 0°С і реакційну суміш перемішували протяречовин, які також можуть діяти як розріджувачі, гом 48 годин при температурі 25°С. Реакційну коригенти, розчинники, змащувальні речовини, суміш концентрували у вакуумі, екстрагували затримувальні речовини, зв'язуючі речовини або (СН2СІ2/К2СО3 (водн.)) та хроматографували на дезинтегратори таблеток, також це можуть бути діоксиді силіцію (від 0 до 10% МеОН у СН 2СІ2), капсулюючі речовини. щоб одержати сполуку 8 (82г, 0.16моль). ДигідрохВ порошках носієм є подрібнена тверда речолорид одержували за допомогою НСІ (водн.) та вина, яка знаходиться у суміші з подрібненим акліофілізації. тивним компонентом. В таблетках активний комМС 513.25 (МН+). ІЧ (NaCI, вільний амін, Vmax) понент змішано з носієм, який має необхідні в 2970, 2808, 2360, 1631, 1452, 1425, 1290, належних пропорціях зв'язуючі властивості й ско1135,1096,1009cm-1. мпонований у бажану форму й розмір. 1 Н ЯМР (CDC13, вільний амін) 5 1.1,1.2 (2m, Для одержання супозиторних композицій низь6Н, амідо-Ме), 1.36,1.46 (2s, 6Н, Ме2С), 2.5 (m, 8Н, коплавлюючий віск, наприклад, суміш глицеридів піперазино-Н), 2.94 (m, 2Н, АrСН2), 3.2, 3.5 (2m, жирних кислот й масла какао, спочатку розплавамідо-СН2), 3.51 (s, 2H, ArCH2N), 4.64 (s, 1Н, ляють, а активний інгредієнт диспергують, наприАr2СН), 6.72-7.66 (m, 9Н, Аr-Н), 8.44-8.54 (m, 2Н, клад, змішуванням. Розплавлену однорідну суміш Ar-Η). Анал. (C32H42CI 2N4O 2) С, Н, N, після злиття в форму відповідного розміру, залиExample 4 Одержання of 4-{(2.2-диметил-2.3шають охолоджуватися і твердіти. дигідро-1-бензоФуран-7-іл)[4-(2Придатними носіями є: карбонат магнію, стеаПіридинілметил]}-1-піперазиніл]метил}-N,Nрат магнію, тальк, лактоза, сахароза, пектин, декдіетилбензаміду дитрифлуорацетат стрин, крохмаль, трагакант, метилцелюлоза, натрій-карбоксиметилцелюлоза, низькоплавкий віск, масло какао та подібне. Фармацевтично придатними солями є ацетат, бензолосульфонат, бензоат, бікарбонат, бітартрат, бромід, ацетат кальція, кемсилат, карбонат, хлорид, сіль лимонної кислоти, дигідрохлорид, едетат, едісилат, істолат, ісилат, фумарат, глюкаптат, глюконат, глютамат, гліколіларзанілат, гексилрезорцинат, гідробамін, гідробромід, гідрохло(сполука (9) рид, гідроксинафтоат, йодид, ізетіонат, лактат, Сполуку 9 одержали за допомогою розчинення лактобіонат, малат, малеат, манделат, мезилат, сполуки 5 (0.45г, 0.98моль) в МеОН (10мл) з 2метилбромід, метилнітрат, метилсульфат, мукат, піридин карбоксалдегідом (110мкЛ, 1.18моль) і напсилат, нітрат, памоат (ембонат), пантотенат, НОАс (3мкЛ, 50мкмоль). Цианоборогідрид натрію фосфа т/діфосфат, полігалактуронат, саліцилат, (70мг, 1.18моль) додавали при температурі 0°С і стеарат, субацетат, сукцинат, сульфат, таннат, реакційну суміш перемішували протягом 48 годин тартрат, теоклат, тріетіодид, бензатин, хлорпрокапри температурі 25°С. Реакційну суміш концентруін, холін, діетаноламін, етиленедіамін, меглумін, вали у вакуумі екстрагували (СН2СІ2/К2СО3 (водн.)) прокаін, алюміній, кальцій, літіум, магній, калій, та хроматографували за допомогою оберненонатрій й цинк. Бажаними фармацевтично прийнятфазової ВЕРХ, щоб одержати сполуку ними солями є гідрохлориди та дитартрати. Особ9,461мг(63%). ливо прийнятними солями є гідрохлориди. МС 513.04(МН+). Термін композиція включає композицію активФармацевтичні композиції ного компоненту з капсулюючим матеріалом, з Нові сполуки згідно винаходу можна уводити капсулою як носієм, в якій активний компонент (з перорально, внутрішньом'язово, підшкірно, місцеіншими носіями або без них) оточений носієм, який во, через ніс, інтраперитонально, через грудну тому пов'язаний з ним. Подібним чином, включено клітину, внутрішньовенно, епидурально, інтратекрохмальні облатки. кально, інтрацеребровентрикулярно та ін'єкцією в Таблетки, порошки, крохмальні облатки і капсуглоби. сули також можуть бути використані як тверді доПереважним способом введення є пероральзовані форми, придатні для перорального застоне, внутрішньовенне та внутрішньом’язове ввесування. дення. Рідкі композиції включають розчини, суспенції Доза буде залежати від способу уведення, 11 71650 12 та емульсії. Можна згадати, наприклад, стерілізоти (1мл) в поліпропіленових пробірках були замовану воду або водно-пропіленогліколеві розчини рожені в сухому льоді/етанолі й зберігали при активних сполук як рідку частину препаратів, притемпературі -70°С до використання. Концентрації датних для парентерального уведення. Рідкі комбілків було визначено модифікованим аналізом позиції також можна створити як розчин у водноЛоурі з SDS. поліетиленгілоколевому розчині. Аналіз зв'язування Водні розчини для перорального вживання Мембрани розморожували при температурі можуть бути виготовлені розчиненням активного 37°С, охолоджували на льоді, пропускали через компоненту в воді й додаванням придатних барвголку 25 розміру 3 рази та розбавляли зв'язуючим ників, ароматизаторів, стабілізаторів та згущувабуфером (50мМ Трис, 3мМ МдСІ2 , 1мг/мл BSA чів, за бажанням. Водні суспензії для перорально(Sigma А-7888), рН 7.4, який зберігали при темпего вживання можуть бути виготовлені ратурі 4°С після фільтрування через 0.22м фільтр і диспергуванням активного компоненту в воді з до якого було додано 5мкгр/мл апротиніну, 10мкМ в'язким матеріалом, наприклад, природними синбестатіну, 10мкМ дипротину А без DTT. Аліквоти тетичними камедями, смолами, метилцелюлозою, по 100 мкл (для мкл білку, див. Таблиця 1) було натрій-карбоксиметилцелюлозою та іншими судодано у охолоджні льодом поліпропіленові туби спендувальними засобами, відомими у рівні фар12x75мм, що містять 100мкл відповідного радіолімацевтичної техніки. ганду (див. Таблиця 1) і 100мкл тестованих пептиБажані фармацевтичні композиції представледів різних концентрацій. Загальне (33) та неспено у формі дозованих одиниць. В такій формі комцифічне (НС) зв'язування визначали у відсутності і позицію поділено на одиничні дози, що містять присутності 10мкМ налоксану, відповідно. Туби прийнятну кількість активного компоненту. Дозострушували та інкубували при 25°С протягом 60вана одиниця може бути упакованим препаратом, 75хв., після чого вміст швиденько фільтрували у упаковка містить дискретну кількість препаратів, вакуумі та промивали приблизно 12мл/тубу льонаприклад, упаковані таблетки, капсули й порошки дяним буфером для промивання (50мМ Tris, рН в пузирьках або ампулах. Дозована одиниця також 7,0, 3мМ МдСІ2) через фільтри GF/B (WhatMan), сама може бути капсулою, саше або таблеткою, попередньо просочених протягом щонайменше 2 або це може бути прийнятним числом цих упакогодин у 0,1% поліетиленіміні. Радіоактивність ваних форм. (dрм), що залишилась на фільтрах, було визначеБіологічна оцінка но бета-лічильником, після промочування фільтрів Модель in vitro протягом щонайменше 12 годин в мінісклянках, що Культура клітин містять 6-7мл сцинтиляційної рідини. Якщо аналіз Клітини 293S людини, які експресують клонопроведено у планшетах з 96 глибокими комірками, вані людські рецептори μ, δ та k, та є резистентфільтрування здійснювали на 96-місцевих попеними до неоміцину, було вирощено в суспензії при редньо просочених РЕІ уніфільтрах, які було протемпературі 37°С та 5% СО2 у стр ущуваних колмито 3´1мл промивочним буфером, і висушено у бах, що містять вільний від кальцію DMEM10% сушильній шафі при 55°С протягом 2 годин. FBS, 5% BCS, 0.1% Плуронік F-68, та 600мг/мл Фільтр-плати було підраховано лічильником Topгенетицину. Count (Packard) після додавання 50мкл/комірку Одержання мембран сцинтиляційної рідини MS-20. Усі біологічні дані Клітини гранулювали та повторно суспендувазафіксовано у Таблиці 1. ли в лізисному буфері (50мМ Трис, рН 7.0, 2.5мМ Результати аналізу EDTA, з PMSF, що додають безпосередньо перед Специфічне зв'язування (С3) було обчислено використанням до 0.1мМ з 0.1Μ ви хідного розчину як TB-NS, і С3 у присутності різних тестованих в етанолі), інкубували на льоді протягом 15хв., пептидів було виражено як процент від контрольпотім гомогенізували з політроном протягом 30с. ного С3. Значення ІК50 і коефіцієнту Хілла (nн) для Суспензію центрифугували (прокручували) при лігандів при витісненні специфічно зв'язаного ра1000 g. (макс.) протягом 10хв. при 4°С. Надосаддіоліганду було обчислено за логіт-перетворенням кова рідина була збережена на льоді, а гранули графіків або програмами підгонки кривих, наприповторно суспендували і центрифугували як раніклад, Ligand, GraphPad PrisM, SigiwaPlot, або ше. Супернатант з двох центрифугувань, було ReceptorFit. Значення Кi було обчислено за рівпоєднано і центрифуговано при 46000 g (макс.) нянням Ченга-Пруссофа. Значення ± стандартна протягом 30хв. Гранули було повторно суспендопохибка величин ІК50, К, та nн повідомлено для вано у холодному буфері Трис (50мМ Трис/СІ, рН лігандів, тестованих за щонайменше трьома кри7.0) і центрифуговано знову. Отримані гранули вими заміщення. було повторно суспендовано в буфері для мембран (50мМ Трис, 0.32Μ сахароза, рН 7.0). Алікво 13 71650 14 Таблиця 1 Біологічні дані для лігандів Приклад Н№ Дельта Н-дельта ЕС50 3 4 3.519 3.264 19.47 7.38 % Eмакс 103.1 103.9 Мозок щура ЕС50 133.72 72.59 % Емакс 92.97 118.04 Таблиця 1. Зведення біологічних даних. Експерименти на насичення рецепторів Значення радіоліганду Кd було визначено на основі проведення аналізу зв'язування на мембранах клітин з прийнятними радіолігандами при концентраціях в межах 0,2-5 разів оціненого Кd (до 10 разів, якщо кількості необхідного радіоліганду є допустимими). Специфічне зв'язування радіолігандів було виражено як пмоль/мг мембранного білку. Значення Кd і Вмакс з окремих експериментів було отримано з нелінійних пригінок специфічно зв'язаного (В) проти нМ вільного радіоліганду (F) від індивідуалу згідно з одномісцевою моделлю. Визначення механо-алодинії, використовуючи тестування вон-фрея Тестування проводили між 08:00 і 16:00, застосовуючи спосіб, описаний Chaplan et al. (1994). Щурів помістили у клітки з плексигласу на сітчасте дно з дроту, яке дає доступ до лапи, і залишили там для звикання на 10-15хв. Зоною тестування було вибрано середину підошви лівої задньої лапи, уникаючи менш чутливих подушечок ступні. До лап торкалися набором з 8 волосинок Вон Фрея з логарифмічно зростаючою жорсткістю (0,41, 0,69, 1,20, 2,04, 3,63, 5,50, 8,51, і 15,14г.; Stoelting, III, USA). Волосинку Вон Фрея підкладали з під-низу сітчастої підлоги, перпендикулярно до поверхні підошви, з достатньою силою, щоб спричинити таким чином легкий вигин лапи, і тримали приблизно 6-8сек. Позитивну реакцію було помічено, коли лапа різко відсмикувалася. Відсмикування відразу після усування волосинки, також приймалося за позитивну реакцію. Рухомість вважали сумнівною реакцією, і у таких випадках подразнення повторювали знову. Протокол тестування Тварин тестували в день 1 після операції для FCA-лікувальної групи. 50% поріг здригання визначали, використовуючи понижуючий спосіб Діксона (1980). Тестування почали з волосинки 2,04г, у середині набору. Стимули завжди представляли у послідовному напрямку, при зростанні чи зменшенні. У відсутність реакції відсмикування лапи на спочатку вибрану волосинку, спостерігали сильне збуджування; якщо лапа відсмикувалася, спостерігали наступне слабше збудження. Для обчислення оптимального порогу на основі цього способу необхідно 6 реакцій у безпосередній близькості до 50% порогу, і підраховування 6 реакцій почалося тоді, коли відбулася перша зміна реакції, наприклад, поріг було вперше перейдено. У випадках, коли пороги виходили за межі стимулів, значення 15,14 (нормальна чутливість) або 0,41 (максима Мозок Миші ЕС50 % Емак с 144.13 118.5 ML M RLM 10000 % 100000 % 10000 % 100000 rem. rem. rem. % rem. 44.5 93 42.5 90.5 льна алодинічна) задавалися відповідно. Отриману картину позитивної та негативної реакцій було занесено у таблицю, використовуючи умовні позначення, X = ніякого здригання; 0 = відсмикування, а 50% поріг відсмикування було уведено, використовуючи формулу: 50% г поріг = IO(Xf+к d /10,000 де Xf = значення останньої використаної волосинки вон Фрея (у логарифмічних одиницях); k = табличне значення (з Chaplan et al. (1994)) для зразка позитивної/негативної реакцій; і δ = слабка різниця між стимулами (у логарифмічних одиницях). Тут δ = 0,224. Пороги вон Фрея було перетворено у процент максимально можливої дії (% МРЕ), згідно з Chaplan et al. 1994. Наступне рівняння було використано для обчислення % МРЕ: % МРЕ = Поріг обробки ліками (g) - поріг алодинії fg) X 100 поріг для контролю (g) - поріг алодинії (g) Уведення тест-речовини Щурам робили ін'єкції (підшкірно, інтраперитонально, внутрішньовенно або перорально) з тестречовиною до початку тестування за von Frey, час між уведенням тест-сполуки і тестом von Fre y змінювали, залежно від природи тест-сполуки. Тест вритинга Оцтова кислота призвела би до абдомінальних скорочень при інтраперитональному уведенні мишам, витягуючи таким чином їх тіло у типовій картині. Коли уводять аналгезивні ліки, цю описану зміну спостерігали рідше, і ліки вибирали як потенційно гарний засіб. Повним і типовим рефлекс Вритинга вважають лише тоді, коли присутні наступні елементи: тварина не рухається; нижча частина спини послаблена; видно підошву обох лап. (і) Виготовлення розчинів Оцтова кислота (АсОН): 120мкл Оцтової кислоти додають до 19,88мл дистильованої води для того, щоб отримати кінцевий об'єм 20мл з кінцевою концентрацією 0,6% АсОН. Розчин тоді змішують (перемішують мішалкою) і він готовий для ін'єкцій. Сполука (лікувальний засіб): Кожну сполуку виготовляють і розчиняють у найпридатнішому носії згідно зі стандартними способами. (іі) Уведення розчинів Сполуку (лікувальний засіб) уводять перорально, інтраперитонально (і.р.), підшкірно (s.c.) або внутрішньовенно (i.v.)) при 10мл/кг (враховуючи середню масу тіла мишей) за 20, 30 або 40хв. (згідно з класом сполук і їх характеристиками) перед тестуванням. Коли сполуку уводять центральним 15 71650 16 шляхом: інтравентркулярно (i.c.v.) або інтратека20хв. і записували кількість випадків (рефлекс льно (i.t.) уводять об'єм 5мкл. Вритинга), і компілювали під кінець експерименту. АсОН уводять інтраперитонально (і.р.) у дво х Мишей тримали в індивідуальних клітках типу "комісцях при концентрації 10мл/кг (враховуючи серобка для взуття" з контактною підкладкою. Всього редню масу тіла мишей) відразу до тестування. спостерігали за 4 мишами протягом того самого (ііі) Тестування часу: одна контрольна і три для доз лікувального За твариною (мишею) спостерігали протягом засобу. Комп’ютерна в ерстка Л. Купенко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds with analgetic activity, pharmaceutical composition based on these compounds and a method for treatment
Автори англійськоюPlobeck Niklas
Назва патенту російськоюСоединения с аналгетическим действием, фармацевтическая композиция на основе этих соединений и способ лечения
Автори російськоюПлобек Никлас
МПК / Мітки
МПК: A61P 25/04, A61P 11/00, C07D 409/12, A61P 23/00, A61P 25/16, A61K 31/496, A61P 19/08, A61P 13/02, A61P 31/12, A61P 37/02, A61P 25/02, A61P 25/34, A61P 25/18, C07D 307/79, C07D 405/12, A61P 25/22, A61P 29/00, A61P 1/12, A61P 25/36, A61P 35/00, A61P 43/00, A61P 25/32, A61P 37/08, A61P 1/04, A61P 25/24
Мітки: лікування, сполуки, композиція, сполук, дією, основі, цих, аналгетичною, спосіб, фармацевтична
Код посилання
<a href="https://ua.patents.su/8-71650-spoluki-z-analgetichnoyu-diehyu-farmacevtichna-kompoziciya-na-osnovi-cikh-spoluk-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Сполуки з аналгетичною дією, фармацевтична композиція на основі цих сполук та спосіб лікування</a>
Попередній патент: Амінопропілфосфінові кислоти та фармацевтична композиція на їх основі
Наступний патент: Електронно-променевий пристрій для нанесення покриття на вироби конденсацією із парової фази
Випадковий патент: Спосіб обробки скла












