Фармацевтична композиція, що містить флібансерин у поліморфній модифікації а
Формула / Реферат
1. Фармацевтична композиція для перорального застосування у вигляді таблетки, яка складається із серцевини, що містить флібансерин у поліморфній модифікації А, ендотермічний максимум якої за даними аналізу диференціальною сканувальною калориметрією припадає на температуру 161 °С, у суміші щонайменше з однією фармацевтично прийнятною допоміжною речовиною, і плівкового покриття, у яке поміщена ця серцевина.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтично прийнятна допоміжна речовина являє собою наповнювач, вибраний із групи, що включає моногідрат лактози як у вигляді тонкоподрібненого матеріалу або модифікованої лактози, такої як лактоза розпилювального сушіння, так й у вигляді агломерованої лактози (таблетози), безводну лактозу, мікрокристалічну целюлозу, двохосновний фосфат кальцію, кукурудзяний крохмаль, цукроспирти та їх суміші.
3. Фармацевтична композиція за п. 1 або 2, яка відрізняється тим, що вміст поліморфної модифікації А флібансерину складає від 1 до 50 мас. % у перерахунку на загальну масу серцевини.
4. Фармацевтична композиція за будь-яким з пп. 1, 2 та 3, яка відрізняється тим, що вміст наповнювача в серцевині складає від 50 до 99 мас. % у перерахунку на загальну її масу.
5. Фармацевтична композиція за будь-яким з пп. 1, 2, 3 та 4, яка відрізняється тим, що серцевина додатково містить зв'язуюче, вибране із групи, що включає повідон, коповідон, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, кукурудзяний крохмаль та їх суміші.
6. Фармацевтична композиція за будь-яким з пп. 1-5, яка відрізняється тим, що серцевина додатково містить розпушувач, вибраний із групи, що включає натрійкрохмальгліколят, кросповідон, натрієву сіль кроскармелози, натрійкарбоксиметилцелюлозу, висушений кукурудзяний крохмаль та їх суміші.
7. Фармацевтична композиція за будь-яким з пп. 1-6, яка відрізняється тим, що серцевина додатково містить регулятори плинності, мастильні речовини та мастила для відділення від форми або антиадгезиви із групи речовин, що включає діоксид кремнію, тальк, стеарат магнію та їх суміші.
8. Фармацевтична композиція за будь-яким з пп. 1-7, яка відрізняється тим, що плівкове покриття, у яке поміщена серцевина, містить щонайменше один плівкоутворювач із групи речовин, що включає гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, метилцелюлозу, гідроксиметилцелюлозу, гідроксіетилцелюлозу та співполімер етилакрилату й метилметакрилату.
9. Застосування композиції, що містить флібансерин у поліморфній модифікації А, за будь-яким з пп. 1-8 для лікування захворювань, при яких застосування сполук, що проявляють спорідненість до 5-НТ1А- та 5-НТ2-рецептора, виявляє позитивну терапевтичну дію.
10. Застосування за п. 9, яке відрізняється тим, що захворювання вибране із групи, що включає депресію, шизофренію, хворобу Паркінсона, стан тривоги або страху, порушення сну, статеві та психічні розлади та вікові порушення пам'яті.
Текст
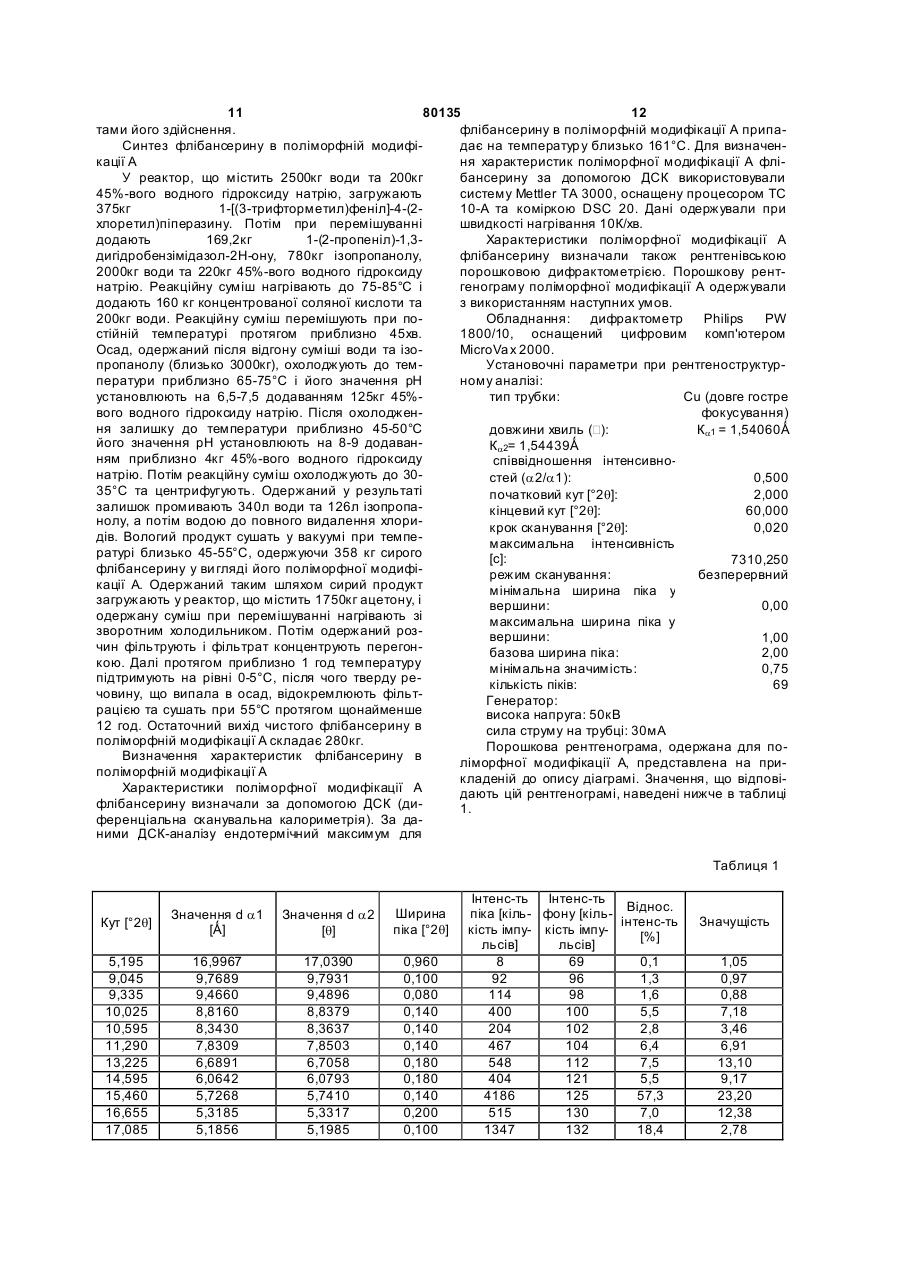
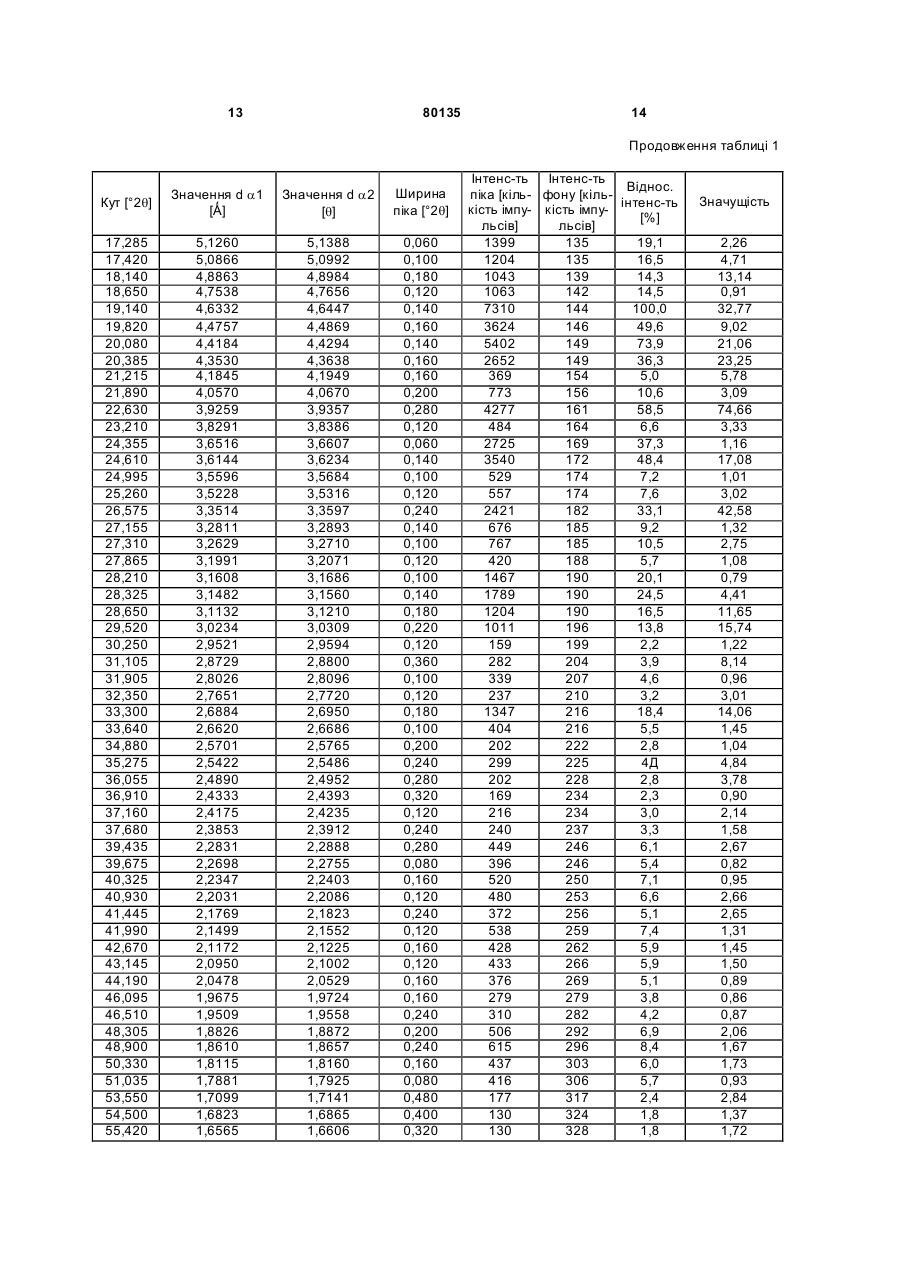
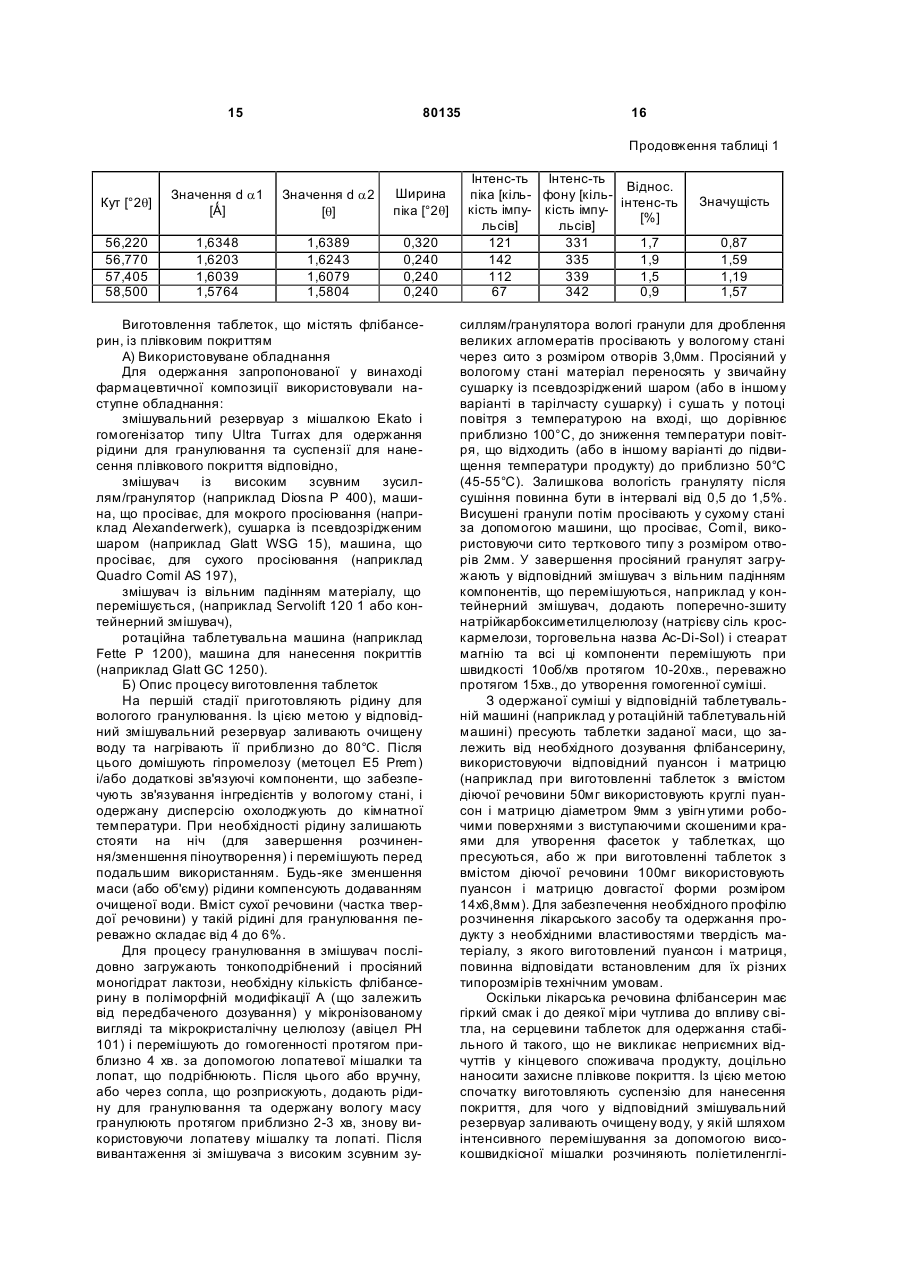
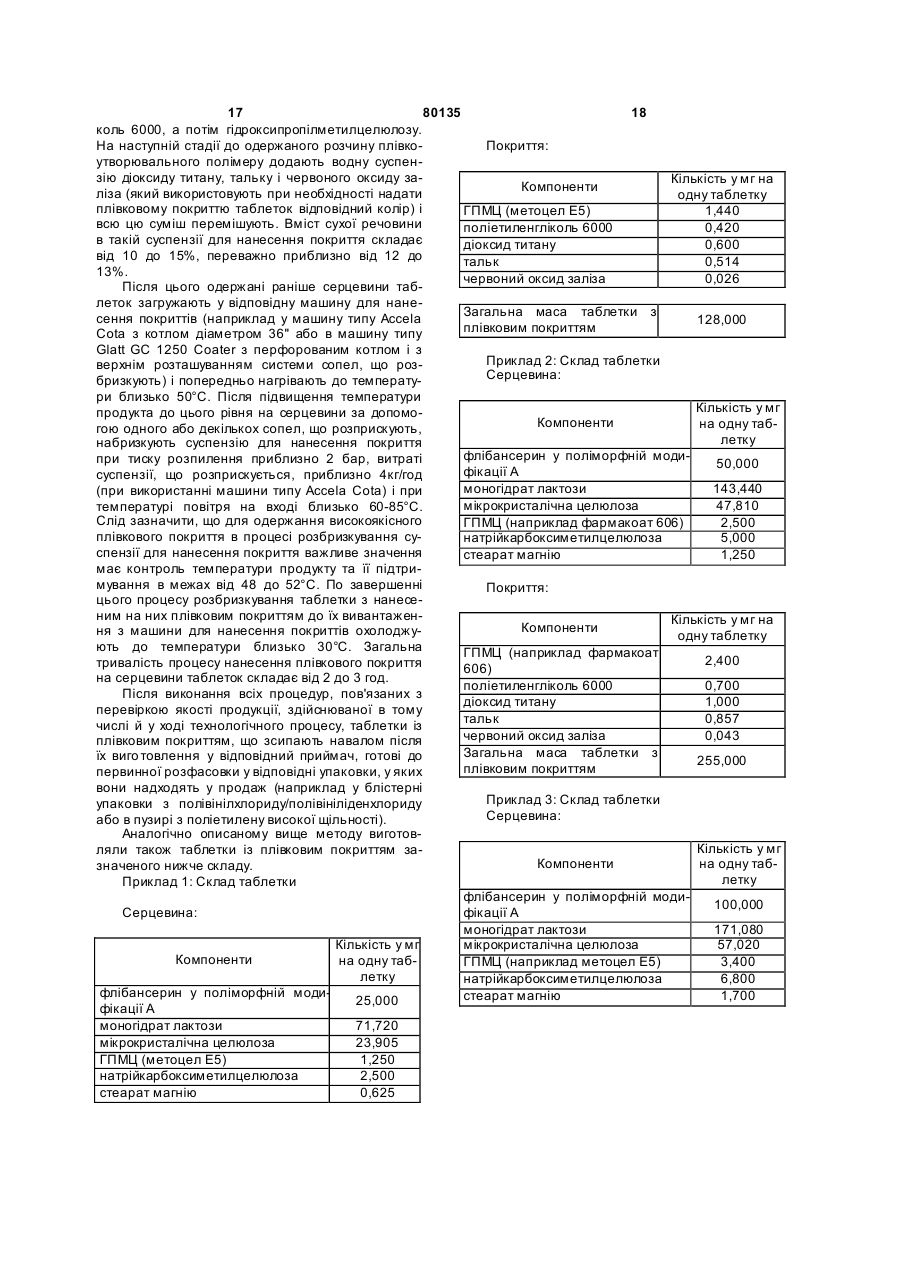
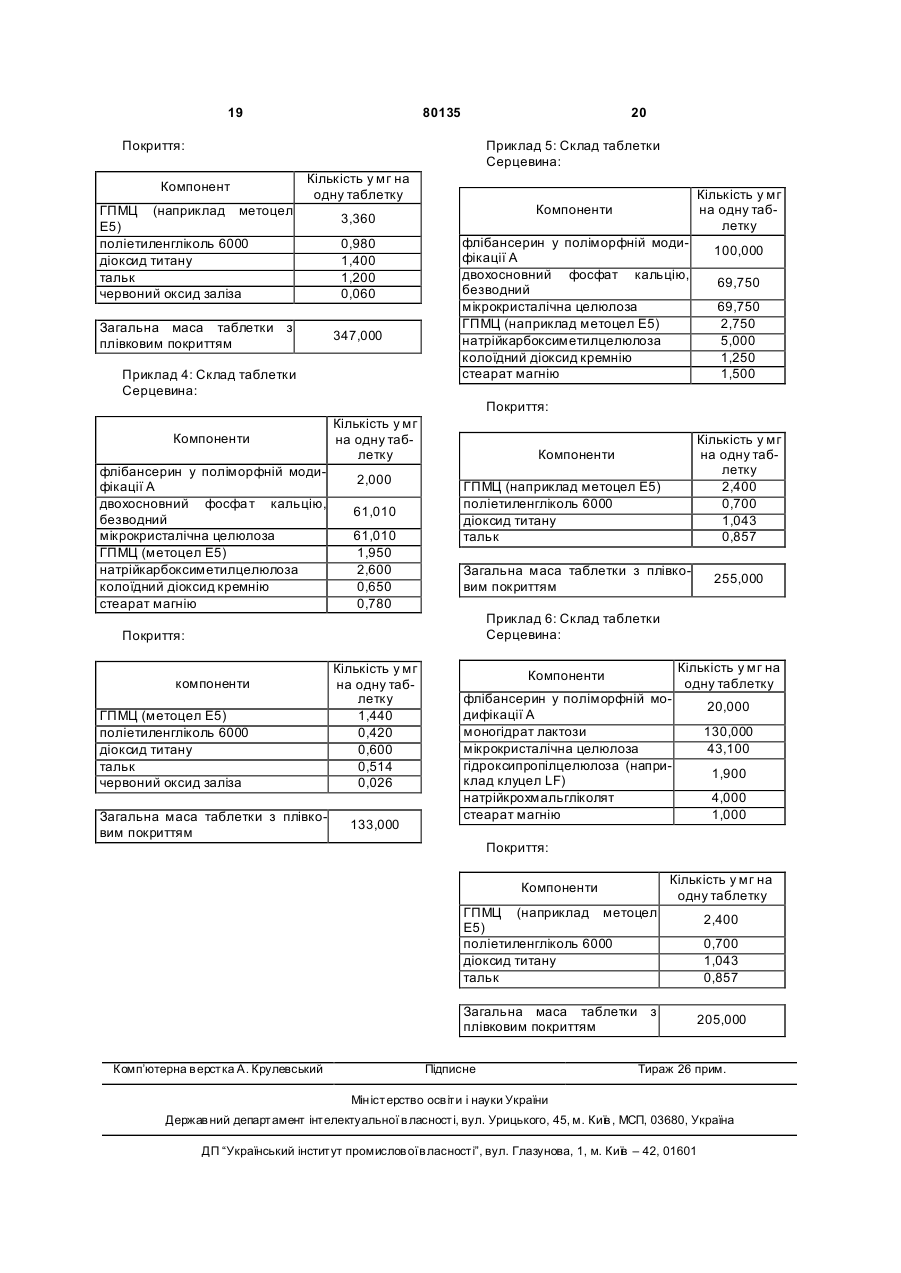
1. Фармацевтична композиція для перорального застосування у вигляді таблетки, яка складається із серцевини, що містить флібансерин у поліморфній модифікації А, ендотермічний максимум якої за даними аналізу диференціальною сканувальною калориметрією припадає на температуру 161 °С, у суміші щонайменше з однією фармацевтично прийнятною допоміжною речовиною, і плівкового покриття, у яке поміщена ця серцевина. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що фармацевтично прийнятна допоміжна речовина являє собою наповнювач, вибраний із групи, що включає моногідрат лактози як у вигляді тонкоподрібненого матеріалу або модифікованої лактози, такої як лактоза розпилювального сушіння, так й у вигляді агломерованої лактози (таблетози), безводну лактозу, мікрокристалічну целюлозу, двохосновний фосфат кальцію, кукурудзяний крохмаль, цукроспирти та їх суміші. 3. Фармацевтична композиція за п. 1 або 2, яка відрізняє ться тим, що вміст поліморфної модифікації А флібансерину складає від 1 до 50 мас. % у перерахунку на загальну масу серцевини. 4. Фармацевтична композиція за будь-яким з пп. 1, 2 та 3, яка відрізняє ться тим, що вміст наповню 2 (19) 1 3 80135 Даний винахід відноситься до фармацевтичних композицій для перорального застосування, що містять флібансерин, способів їх одержання та їх застосування як лікарський засіб. Сполука 1-[2-(4-(3трифторметилфеніл)піперазин-1-іл)етил]-2,3дигідро-1Н-бензімідазол-2-он (флібансерин) описана у формі її гідрохлориду в заявці ЕР-А 526434 і має наступну хімічну стр уктур у: Флібансерин проявляє спорідненість (афінність) до 5-НТ1А- та 5-НТ2-рецепторів. З врахуванням цього така сполука є перспективним терапевтичним агентом, який може використовуватися для лікування різних захворювань, наприклад депресії, шизофренії, хвороби Паркінсона, станів тривоги, порушення сну, сексуальних та психічних розладів, а також вікових порушень пам'яті. Очевидно, що основною попередньою умовою, дотримання якої служить необхідною передумовою для початку комерційного виробництва фармацевтичної діючої речовини та її надходження в продаж як апробованого лікарського засобу, є точне визначення її фармацевтичної активності. Однак до фармацевтичної діючої речовини пред'являється і цілий ряд різних інших вимог. Подібні вимоги, яким повинна задовольняти фармацевтична діюча речовина, засновані на різних параметрах, пов'язаних із природою самої діючої речовини. Як приклад таких параметрів можна назвати, але не обмежуючись тільки ними, стабільність діючої речовини в різних навколишніх умовах, її стабільність у процесі приготування лікарського засобу, а також її стабільність у складі кінцевих лікарських препаратів. Фармацевтична діюча речовина, що використовується для одержання фармацевтичних препаратів або композицій, повинна мати максимально можливу ступінь чистоти, а також повинна залишатися стабільною при її тривалому зберіганні в різних навколишніх умовах. Обов'язкове дотримання цієї вимоги обумовлено необхідністю виключити застосування лікарських препаратів, у яких поряд із власно діючою речовиною присутні, наприклад, продукти її розкладу. У цих випадках лікарський препарат може містити діючу речовину в меншій кількості, ніж зазначена виробником. Важливе значення має далі рівномірний розподіл діючої речовини в лікарській композиції та, зокрема, при необхідності введення лікарського засобу в низькому дозуванні. Забезпечити рівномірний розподіл діючої речовини в лікарській композиції можна за рахунок зменшення розміру її часток до прийнятного рівня, наприклад подрібнюванням. Оскільки при приготуванні лікарського 4 засобу потрібно по можливості практично повністю виключити прояв таких ефектів, що супутні подрібнюванню (або мікронізації) фармацевтичної діючої речовини, як її розкладання і/або перехід в аморфний стан, обов'язковою вимогою, якій повинна задовольняти діюча речовина, є її висока стабільність у процесі подрібнювання незважаючи на наявність жорстких умов, необхідних для проведення цього процесу. Одержання гомогенної фармацевтичної композиції з постійно відтвореним заданим вмістом у ній діючої речовини можливо тільки при досить високій її стабільності в процесі її подрібнювання. Крім цього від властивостей фармацевтичної композиції як такої прямо залежить біодоступність діючої речовини, що входить в її склад, й тим самим ефективність лікарського засобу при її передбаченому медичному застосуванні. Виходячи з вищесказаного, в основу даного винаходу було покладено завдання запропонувати нову, що містить флібансерин композицію для перорального застосування, яка задовольняла б зазначеним вище строгим вимогам, що пред'являються до фармацевтичних композицій. Відповідно до винаходу несподівано було встановлено, що флібансерин у вигляді вільної основи в певній поліморфній модифікації повною мірою відповідає тим вимогам, які він повинен задовольняти в складі пропонованої у винаході фармацевтичної композиції. Флібансерин у подібній певній поліморфній модифікації (поліморфної модифікації А) можна одержувати за рахунок вибору особливих умов проведення реакції, які більш докладно описані нижче. Поряд з іншими особливостями для флібансерину в такій його поліморфній модифікації характерна наявність ендотермічного максимуму, що за даними термічного аналізу диференціальною сканувальною калориметрією (ДСК) припадає на температуру 161°С. Пропонована у винаході фармацевтична композиція являє собою таблетку для перорального застосування, яка складається із серцевини, що містить флібансерин у поліморфній модифікації А, ендотермічний максимум якої за даними ДСКаналізу припадає на температуру 161°С, у суміші щонайменше з однією фармацевтично прийнятною допоміжною речовиною, і плівкового покриття, у яке поміщена ця серцевина. Вміст поліморфної модифікації А флібансерину в серцевині пропонованих у винаході таблеток із плівковим покриттям (фільмтаблеток) складає від 1 до 50 мас.%, краще від 5 до 45 мас.%, найкраще приблизно від 10 до 40 мас.%, у перерахунку на загальну масу серцевини. В особливо кращому варіанті вміст поліморфної модифікації А флібансерину складає від 15 до 35 мас.%, найкраще від 17 до 32 мас.%, у перерахунку на загальну масу серцевини. Серцевина таблетки, у вигляді якої представлена пропонована у винаході фармацевтична композиція, крім флібансерину в поліморфній мо 5 80135 6 дифікації А містить щонайменше одну допоміжну серин у поліморфній модифікації А у суміші з моречовину як наповнювач/сухе зв'язуюче. ногідратом лактози та мікрокристалічною целюлоЯк приклад типових наповнювачів, які можуть зою як фармацевтично прийнятні допоміжні використовува тися в пропонованій у винаході фаречовини. У таблетках пропонованого у винаході рмацевтичній композиції, можна назвати моногідскладу, що містять суміш моногідрату лактози та рат лактози як у вигляді тонкоподрібненого матемікрокристалічної целюлози як наповнювачі (або ріалу або модифікованої лактози, такої як лактоза фармацевтично прийнятні допоміжні речовини), розпилювального сушіння, так і у вигляді агломеспіввідношення між моногідратом лактози та мікрованої лактози (таблетози), безводну лактозу, рокристалічною целюлозою складає, наприклад, мікрокристалічну целюлозу, дво хосновний фосфат від приблизно 15:1 до приблизно 1:5, краще від кальцію, кукурудзяний крохмаль, цукроспирти, такі приблизно 10:1 до приблизно 1:3, найкраще від як маніт і сорбіт, та їх суміші. Наповнювач, що приблизно 6:1 до приблизно 1:1. входить до складу пропонованої у винаході фарВ іншому кращому варіанті здійснення винамацевтичної композиції, краще вибирати із групи, ходу таблетка пропонованого в ньому складу місяка включає лактозу різних типів, мікрокристалічну тить флібансерин у поліморфній модифікації А у целюлозу, кукур удзяний крохмаль, цукроспирти та суміші з моногідратом лактози, мікрокристалічною їх суміші. Найкраще вибирати наповнювач, що целюлозою та ГПМЦ як фармацевтично прийнятні використовується у пропонованій у винаході фардопоміжні речовини. У найбільш кращих пропономацевтичній композиції із групи, яка включає лакваних у винаході композиціях, що містять суміш тозу різних типів, мікрокристалічну целюлозу та їх моногідрату лактози, мікрокристалічної целюлози суміші. При використанні лактози як наповнювача та ГПМЦ як наповнювачі/зв'язуючі (або фармацевїї краще застосовува ти у формі її моногідрату у тично прийнятні допоміжні речовини), кількість вигляді тонкоподрібненого матеріалу (що прохомоногідрату лактози складає, наприклад, від 50 до дить, наприклад, через сито 200 меш). 95 мас.%, краще від 60 до 90 мас.%, найкраще Серцевина пропонованої у винаході таблетки приблизно від 65 до 85 мас.%, у перерахунку на із плівковим покриттям може також містити зв'язузагальну масу наповнювача/зв'язуючого, що викоючі, що забезпечують зв'язування інгредієнтів у ристовуються для одержання серцевини. В особсухому стані і/або зв'язуючі, що забезпечують зв'яливо кращому варіанті таблетки подібного складу зування інгредієнтів у вологомустані, такі як помістять моногідрат лактози в кількості приблизно відон (наприклад колідон К 25), коповідон (напривід 70 до 80 мас.% у перерахунку на загальну масу клад колідон VA 64), наповнювача/зв'язуючого, що використовуються гідроксипропілметилцелюлоза, гідроксипропілцедля одержання серцевини. У найбільш кращих люлоза, кукурудзяний крохмаль та їх суміші. У пропонованих у винаході композиціях, що містять кращому варіанті зв'язуючі вибирають із групи, яка суміш моногідрату лактози, мікрокристалічної цевключає повідон, гідроксипропілметилцелюлозу, люлози та ГПМЦ як наповнювачі/зв'язуючі (або гідроксипропілетилцелюлозу, гідроксипропілцелюфармацевтично прийнятні допоміжні речовини), лозу та їх суміші. Найкраще використовувати як кількість мікрокристалічної целюлози складає, назв'язуюче гідроксипропілметилцелюлозу. При виприклад, від 5 до 45 мас.%, краще від 15 до 35 користанні гідроксипропілметилцелюлози (ГГГМЦ) мас.%, найкраще приблизно від 20 до 30 мас.%, у особливий інтерес являє застосування ГПМЦперерахунку на загальну масу наповнюваполімерів USP2910 та USP2208, таких, наприклад, ча/зв'язуючого, що використовуються для одеряк метоцел Е5, Е4М, Е15М (К15М та К100М), що жання серцевини. В особливо кращому варіанті випускаються, зокрема, компанією Dow Chemical таблетки подібного складу містять мікрокристалічCompany. У наведених ви ще абревіатурах познану целюлозу в кількості приблизно від 22 до 28 чення "Е" відповідає USP2910, а позначення "К" мас.% у перерахунку на загальну масу наповнювідповідає USP2208. Числа, що позначають відповача/зв'язуючого, що використовуються для одервідний матеріал вказують на його в'язкість в 2%жання серцевини. У найбільш кращих пропонованому водному розчині (наприклад "5" відповідає них у винаході композиціях, що містять суміш в'язкості, що дорівнює 5 сП, а "15М" відповідає моногідрату лактози, мікрокристалічної целюлози в'язкості, що дорівнює 15000 сП). та ГПМЦ як наповнювачі/зв'язуючі (або фармацевВміст наповнювача в серцевині пропонованих тично прийнятні допоміжні речовини), кількість у винаході таблеток із плівковим покриттям краще ГПМЦ складає, наприклад, від 0,5 до 5 мас.%, складає від 50 до 99 мас.%, більш краще від 55 до краще від 1,0 до 4,5 мас.%, у перерахунку на зага95 мас.%, найкраще від 60 до 90 мас.%, у переральну масу наповнювача/зв'язуючого, що викорисхунку на загальну масу серцевини в особливо товуються для одержання серцевини. В особливо кращому варіанті сумарний вміст наповнювача кращому варіанті таблетки подібного складу місскладає від 65 до 85 мас.%, більш краще від 68 до тять ГПМЦ у кількості приблизно від 1 до 3 мас.% 80 мас.%, у перерахунку на загальну масу серцеу перерахунку на загальну масу наповнювавини. ча/зв'язуючого, що використовуються для одерУ кращому варіанті серцевина таблетки прожання серцевини. понованого у винаході складу містить флібансерин Серцевина пропонованої у винаході таблетки у поліморфній модифікації А у суміші з моногідраіз плівковим покриттям на додаток до згаданих том лактози як фармацевтично прийнятна допомівище інгредієнтам може містити також розпушуважна речовина. чі. У контексті даного винаходу подібні розпушуваУ найкращому варіанті серцевина таблетки чі за певних умов можуть бути також відомі як агепропонованого у винаході складу містить флібаннти, що сприяють розпаду таблеток. Такі речовини 7 80135 8 відповідно до винаходу переважно вибирають із ксипропілцелюлоза, гідроксиметилцелюлоза та групи, яка включає натрійкрохмальгліколят, кросгідроксіетилцелюлоза, серед яких у пропонованих повідон, натрієву сіль кроскармелози, натрійкару винаході таблетках найбільш краще використобоксиметилцелюлозу, висушений кукурудзяний вувати як плівкоутворювачі гідроксипропілметилкрохмаль та їх суміші. Найбільш краще відповідно целюлозу та гідроксипропілцелюлозу. Вищевказадо винаходу використовувати натрійкрохмальгліні плівкоутворювачі можна використовувати колят, кросповідон, натрійкарбоксиметилцелюлозу окремо або у вигляді їх сумішей. При використанні та натрієву сіль кроскармелози, краще натрієву тільки одного з перерахованих вище плівкоутвосіль кроскармелози. При використанні вищезазнарювачів як такого особливо краще відповідно до чених розпушувачів їх масова кількість у переравинаходу застосовувати гідроксипропілметилцехунку на загальну масу серцевини пропонованої у люлозу. Масова кількість плівкоутворювачів у певинаході таблетки із плівковим покриттям складає, рерахунку на загальну масу плівкового покриття наприклад, приблизно від 0,1 до 10 мас.%, краще пропонованої у винаході таблетки краще складає приблизно від 0,5 до 5 мас.%, найкраще приблизприблизно від 20 до 95 мас.%, найкраще від 30 до но від 1 до 3 мас.%. 90 мас.%. Серцевина пропонованої у винаході таблетки Плівкове покриття, у яке поміщена серцевина із плівковим покриттям може також містити як дотаблетки, може також містити емульгатори і/або даткові інгредієнти регулятори плинності. Як припластифікатори, такі, наприклад, як поліетиленгліклад таких регуляторів плинності, які можуть викоколь, гліцерин та пропіленгліколь, необов'язково у ристовуватися відповідно до винаходу, можна вигляді їх сумішей. Як пластифікатори краще виназвати діоксид кремнію, тальк, стеарат магнію та користовувати поліетиленгліколі. Прикладами їх суміші. Відповідно до винаходу краще викориснайбільш кращих поліетиленгліколей, що не обтовувати діоксид кремнію, найбільш краще в коломежують об'єм винаходу, служать поліетиленгліїдній, високодисперсній формі. При використанні коль 400 та поліетиленгліколь 6000. У контексті вищевказаних регуляторів плинності їх масова даного винаходу термін "макрогол" повинен розкількість у перерахунку на загальну масу серцевиглядатися як еквівалентний терміну "поліетиленгни пропонованої у винаході таблетки із плівковим ліколь". Зазначені вище числа 400 та 6000 відповіпокриттям краще складає приблизно від 0,1 до 5 дають середній молекулярній масі мас.%, більш краще приблизно від 0,3 до 2 мас.%, поліетиленгліколю, що використовується. Масова найкраще від 0,4 до 1,5 мас.%. кількість пластифікатора в перерахунку на загальСерцевина пропонованої у винаході таблетки ну масу плівкового покриття пропонованої у винаіз плівковим покриттям може також містити як доході таблетки краще складає приблизно від 1 до даткові інгредієнти добавки, що підвищують плин50 мас.%, більш краще від 5 до 40 мас.%, найкраність, мастильні речовини та мастило для відоще від 10 до 30 мас.%. У кращому варіанті кількремлення від форми або антиадгезиви. Як кість пластифікатора складає приблизно від 10 до приклад таких матеріалів, які можуть використову25 мас.%, більш краще приблизно від 12 до 18 ватися відповідно до винаходу, можна назвати, мас.%, у перерахунку на загальну масу плівкового стеаринову кислоту, стеарат магнію, стеарат покриття таблетки. кальцію, стеарилфумарат натрію, трибегенат гліПлівкове покриття пропонованої у винаході церину, тальк та їх суміші. Відповідно до винаходу таблетки може також містити барвники та допомікраще використовувати стеаринову кислоту та жні речовини, що забарвлюють. Як приклад при стеарат магнію. При використанні одного або декіцьому можна назвати оксид заліза, діоксид титану, лькох вищевказаних інгредієнтів його(їх) масова тальк та їх суміші. При використанні тальку його кількість краще складає приблизно від 0,01 до 5 кількість складає, зокрема, приблизно від 5 до 50 мас.%, більш краще приблизно від 0,05 до 3 мас.%, краще від 10 до 40 мас.%, найбільш краще мас.%, найкраще приблизно від 0,1 до 2 мас.%, у від 15 до 30 мас.%, у перерахунку на загальну маперерахунку на загальну масу серцевини пропосу плівкового покриття таблетки. У кращому варіанованої у винаході таблетки із плівковим покритнті кількість тальку складає приблизно від 15 до 20 тям. При використанні насамперед стеарату магмас.% у перерахунку на загальну масу плівкового нію його кількість переважно складає приблизно покриття таблетки. При використанні діоксиду тивід 0,2 до 1,5 мас.% у перерахунку на загальну тану його кількість складає, зокрема, приблизно масу серцевини таблетки із плівковим покриттям. від 5 до 55 мас.%, краще від 10 до 40 мас.%, найПлівкове покриття, у яке поміщена серцевина більш краще від 15 до 35 мас.%, у перерахунку на пропонованих у винаході таблеток, містить щозагальну масу плівкового покриття таблетки. У найменше один плівкоутворювач, що вибраний із кращому варіанті кількість діоксиду титану складає групи речовин, яка включає гідроксипропілметилприблизно від 20 до 30 мас.% у перерахунку на целюлозу, гідроксипропілцелюлозу, метилцелюлозагальну масу плівкового покриття таблетки. При зу, гідроксиметилцелюлозу, гідроксіетилцелюлозу використанні оксиду заліза його кількість складає, та співполімер етилакрилату та метилметакрилазокрема, приблизно від 0,1 до 5 мас.%, краще ту, причому як такий може використовуватися, приблизно від 0,25 до 3 мас.%, більш краще принаприклад, еудрагіт NE 30 D. В іншому варіанті близно від 0,5 до 1,5 мас.%, у перерахунку на заможна використовувати, наприклад, еудрагіт RL 30 гальну масу плівкового покриття таблетки. D або еудрагіт Е 12.5. Зазначені вище інгредієнти Вособливо кращому варіанті плівкове покритв деяких випадках можна також використовувати у тя, в яке поміщена серцевина пропонованої у вивигляді їх сумішей. До кращих плівкоутворювачів наході таблетки, містить гідроксипропілметилцевідносяться гідроксипропілметилцелюлоза, гідролюлозу, поліетиленгліколь та діоксид титану. В 9 80135 10 іншому варіанті здійснення винаходу плівкове пофлібансерин у поліморфній модифікації А. криття, в яке поміщена серцевина пропонованої у Наступним об'єктом даного винаходу є спосіб винаході таблетки, містить гідроксипропілметиллікування захворювання, що вибраний із групи, яка целюлозу, поліетиленгліколь, діоксид титану та включає депресію, шизофренію, хворобу Паркінтальк. У наступному варіанті здійснення винаходу сона, стан тривоги, порушення сну, сексуальні та плівкове покриття, в яке поміщена серцевина пропсихічні розлади та вікові порушення пам'яті, який понованої у винаході таблетки, містить гідроксипполягає у введенні в організм пропонованих у виропілметилцелюлозу, поліетиленгліколь, діоксид наході композицій, що містять флібансерин у потитану, тальк та оксиди заліза, переважно черволіморфній модифікації А. ний оксид заліза. У даному винаході пропонується, зокрема, Пропоновану у винаході фармацевтичну комспосіб лікування розладів статевого потягу, який позицію можна одержувати способом, який доклаполягає у введенні в організм пропонованих у видно розглянутий у наступному описі в розділі, принаході композицій, що містять флібансерин у посвяченому експериментальній частині. ліморфній модифікації А. З урахуванням фармацевтичної ефективності У кращому варіанті у винаході пропонується флібансерину ще одним об'єктом даного винаходу спосіб лікування порушень і розладів, що вибрані є застосування пропонованих у ньому композицій, із групи, яка включає гіпоактивний статевий потяг, що містять флібансерин у поліморфній модифікавтрату статево го потягу, відсутність статевого поції А, як лікарський засіб. тягу, зниження статевого потягу, придушення стаНаступним об'єктом даного винаходу є застотевого потяга, втрату лібідо, порушення лібідо та сування пропонованих у ньому композицій, що фригідність, що полягає у введенні в організм промістять флібансерин у поліморфній модифікації А, понованих у винаході композицій, що містять флідля лікування захворювань, при яких застосування бансерин у поліморфній модифікації А. сполук, що володіють спорідненістю до 5-НТ1A- та У найбільш кращому варіанті здійснення вина5-НТ2-рецепторів, може виявляти ефективну тераходу в ньому пропонується спосіб лікування порупевтичну дію. шень і розладів, що вибрані із групи, яка включає Ще одним об'єктом даного винаходу є застогіпоактивний статевий потяг, втрату статевого посування пропонованих у ньому композицій, що тягу, відсутність статевого потягу, зниження статемістять флібансерин у поліморфній модифікації А, вого потягу та придушення статевого потягу, який для лікування захворювання, вибраного із групи, полягає у введенні в організм пропонованих у вищо включає депресію, шизофренію, хворобу Парнаході композицій, що містять флібансерин у покінсона, стани тривоги, порушення сну, сексуальні ліморфній модифікації А. та психічні розлади та вікові порушення пам'яті. В особливо кращому варіанті здійснення винаДаний винахід відноситься, зокрема, до застоходу в ньому пропонується спосіб лікування порусування пропонованих у ньому композицій, що шень і розладів, що вибрані із групи, яка включає містять флібансерин у поліморфній модифікації А, гіпоактивний статевий потяг і втрату статевого для лікування розладів статевого потягу. потягу, який полягає у введенні в організм пропоУ кращому варіанті даний винахід відноситься нованих у винаході композицій, що містять флібадо застосування пропонованих у ньому композинсерин у поліморфній модифікації А. цій, що містять флібансерин у поліморфній модиЗгаданий вище терапевтичний ефект від зафікації А, для лікування порушень і розладів, що стосування пропонованих у винаході композицій, вибрані із групи, яка включає гіпоактивний статещо містять флібансерин у поліморфній модифікавий потяг, втрату стате вого потягу, відсутність ції А, може однаковою мірою проявлятися й при статевого потягу, зниження статевого потягу, прилікуванні чоловіків, і при лікуванні жінок. душення статевого потягу, втрату лібідо, поруОднак у відповідності ще з одним об'єктом дашення лібідо та фригідність. ного винаходу кращим є застосування пропоноваНайбільш кращимє відповідно до винаходу них у ньому композицій, що містять флібансерин у застосування пропонованих у ньому композицій, поліморфній модифікації А, для лікування сексуащо містять флібансерин у поліморфній модифікальної дисфункції у жінок. ції А, для лікування порушень і розладів, що вибПозитивний ефект від застосування пропонорані із групи, яка включає гіпоактивний статевий ваних у винаході композицій, що містять флібанпотяг, втрату статевого потягу, відсутність статесерин у поліморфній модифікації А, можна спостевого потягу, зниження статевого потягу та придурігати поза залежності від того, чи є той або інший шення статевого потягу. В особливо кращому варозлад або порушення природженим або ж набуріанті винахід відноситься до застосування тим, а також поза залежністю від його етіології (чи пропонованих у ньому композицій, що містять обумовлено воно органічними факторами, до яких флібансерин у поліморфній модифікації А, для відносяться і фізичні, і індуковані ліками фактори, лікування порушень і розладів, що вибрані із групсихогенними факторами, сполученням органічних пи, яка включає гіпоактивний статевий потяг і факторів, до яких відносяться і фізичні, і індуковані втрату статевого потягу. ліками фактори, і психогенних факторів або ж неЩе одним об'єктом даного винаходу є спосіб встановленими факторами). лікування захворювань, при яких застосування Нижче винахід проілюстровано на прикладах. сполук, що володіють спорідненістю до 5-НТ1А- і 5У цих прикладах розглянуті деякі кращі варіанти НТ2-рецепторів, може виявляти ефективну тераздійснення винаходу. Очевидно, однак, що об'єм певтичну дію, що полягає у введенні в організм даного винаходу необмежений розглянутими в пропонованих у винаході композицій, що містять наведених нижче прикладах конкретними варіан 11 80135 12 тами його здійснення. флібансерину в поліморфній модифікації А припаСинтез флібансерину в поліморфній модифідає на температур у близько 161°С. Для визначенкації А ня характеристик поліморфної модифікації А фліУ реактор, що містить 2500кг води та 200кг бансерину за допомогою ДСК використовували 45%-вого водного гідроксиду натрію, загружають систему Mettler ТА 3000, оснащену процесором ТС 375кг 1-[(3-трифторметил)феніл]-4-(210-А та коміркою DSC 20. Дані одержували при хлоретил)піперазину. Потім при перемішуванні швидкості нагрівання 10К/хв. додають 169,2кг 1-(2-пропеніл)-1,3Характеристики поліморфної модифікації А дигідробензімідазол-2Н-ону, 780кг ізопропанолу, флібансерину визначали також рентгенівською 2000кг води та 220кг 45%-вого водного гідроксиду порошковою дифрактометрією. Порошкову рентнатрію. Реакційну суміш нагрівають до 75-85°С і генограму поліморфної модифікації А одержували додають 160 кг концентрованої соляної кислоти та з використанням наступних умов. 200кг води. Реакційну суміш перемішують при поОбладнання: дифрактометр Philips PW стійній температурі протягом приблизно 45хв. 1800/10, оснащений цифровим комп'ютером Осад, одержаний після відгону суміші води та ізоMicroVa x 2000. пропанолу (близько 3000кг), охолоджують до темУстановочні параметри при рентгеноструктурператури приблизно 65-75°С і його значення рН ному аналізі: установлюють на 6,5-7,5 додаванням 125кг 45%тип трубки: Сu (довге гостре вого водного гідроксиду натрію. Після охолодженфокусування) ня залишку до температури приблизно 45-50°С довжини хвиль (): Кa1 = 1,54060Ǻ його значення рН установлюють на 8-9 додаванКa2= 1,54439Ǻ ням приблизно 4кг 45%-вого водного гідроксиду співвідношення інтенсивнонатрію. Потім реакційну суміш охолоджують до 30стей (a2/a1): 0,500 35°С та центрифугують. Одержаний у результаті початковий кут [°2q]: 2,000 залишок промивають 340л води та 126л ізопропакінцевий кут [°2q]: 60,000 нолу, а потім водою до повного видалення хлорикрок сканування [°2q]: 0,020 дів. Вологий продукт сушать у вакуумі при темпемаксимальна інтенсивність ратурі близько 45-55°С, одержуючи 358 кг сирого [с]: 7310,250 флібансерину у ви гляді його поліморфної модифірежим сканування: безперервний кації А. Одержаний таким шляхом сирий продукт мінімальна ширина піка у загружають у реактор, що містить 1750кг ацетону, і вершини: 0,00 одержану суміш при перемішуванні нагрівають зі максимальна ширина піка у зворотним холодильником. Потім одержаний розвершини: 1,00 чин фільтрують і фільтрат концентрують перегонбазова ширина піка: 2,00 кою. Далі протягом приблизно 1 год температуру мінімальна значимість: 0,75 підтримують на рівні 0-5°С, після чого тверду рекількість піків: 69 човину, що випала в осад, відокремлюють фільтГенератор: рацією та сушать при 55°С протягом щонайменше висока напруга: 50кВ 12 год. Остаточний вихід чистого флібансерину в сила струму на трубці: 30мА поліморфній модифікації А складає 280кг. Порошкова рентгенограма, одержана для поВизначення характеристик флібансерину в ліморфної модифікації А, представлена на приполіморфній модифікації А кладеній до опису діаграмі. Значення, що відповіХарактеристики поліморфної модифікації А дають цій рентгенограмі, наведені нижче в таблиці флібансерину визначали за допомогою ДСК (ди1. ференціальна сканувальна калориметрія). За даними ДСК-аналізу ендотермічний максимум для Таблиця 1 Кут [°2q] Значення d a1 [Ǻ] Значення d a2 [q] Ширина піка [°2q] 5,195 9,045 9,335 10,025 10,595 11,290 13,225 14,595 15,460 16,655 17,085 16,9967 9,7689 9,4660 8,8160 8,3430 7,8309 6,6891 6,0642 5,7268 5,3185 5,1856 17,0390 9,7931 9,4896 8,8379 8,3637 7,8503 6,7058 6,0793 5,7410 5,3317 5,1985 0,960 0,100 0,080 0,140 0,140 0,140 0,180 0,180 0,140 0,200 0,100 Інтенс-ть Інтенс-ть піка [кіль- фону [кіль- Віднос. інтенс-ть кість імпу- кість імпу[%] льсів] льсів] 8 69 0,1 92 96 1,3 114 98 1,6 400 100 5,5 204 102 2,8 467 104 6,4 548 112 7,5 404 121 5,5 4186 125 57,3 515 130 7,0 1347 132 18,4 Значущість 1,05 0,97 0,88 7,18 3,46 6,91 13,10 9,17 23,20 12,38 2,78 13 80135 14 Продовження таблиці 1 Кут [°2q] Значення d a1 [Ǻ] Значення d a2 [q] Ширина піка [°2q] 17,285 17,420 18,140 18,650 19,140 19,820 20,080 20,385 21,215 21,890 22,630 23,210 24,355 24,610 24,995 25,260 26,575 27,155 27,310 27,865 28,210 28,325 28,650 29,520 30,250 31,105 31,905 32,350 33,300 33,640 34,880 35,275 36,055 36,910 37,160 37,680 39,435 39,675 40,325 40,930 41,445 41,990 42,670 43,145 44,190 46,095 46,510 48,305 48,900 50,330 51,035 53,550 54,500 55,420 5,1260 5,0866 4,8863 4,7538 4,6332 4,4757 4,4184 4,3530 4,1845 4,0570 3,9259 3,8291 3,6516 3,6144 3,5596 3,5228 3,3514 3,2811 3,2629 3,1991 3,1608 3,1482 3,1132 3,0234 2,9521 2,8729 2,8026 2,7651 2,6884 2,6620 2,5701 2,5422 2,4890 2,4333 2,4175 2,3853 2,2831 2,2698 2,2347 2,2031 2,1769 2,1499 2,1172 2,0950 2,0478 1,9675 1,9509 1,8826 1,8610 1,8115 1,7881 1,7099 1,6823 1,6565 5,1388 5,0992 4,8984 4,7656 4,6447 4,4869 4,4294 4,3638 4,1949 4,0670 3,9357 3,8386 3,6607 3,6234 3,5684 3,5316 3,3597 3,2893 3,2710 3,2071 3,1686 3,1560 3,1210 3,0309 2,9594 2,8800 2,8096 2,7720 2,6950 2,6686 2,5765 2,5486 2,4952 2,4393 2,4235 2,3912 2,2888 2,2755 2,2403 2,2086 2,1823 2,1552 2,1225 2,1002 2,0529 1,9724 1,9558 1,8872 1,8657 1,8160 1,7925 1,7141 1,6865 1,6606 0,060 0,100 0,180 0,120 0,140 0,160 0,140 0,160 0,160 0,200 0,280 0,120 0,060 0,140 0,100 0,120 0,240 0,140 0,100 0,120 0,100 0,140 0,180 0,220 0,120 0,360 0,100 0,120 0,180 0,100 0,200 0,240 0,280 0,320 0,120 0,240 0,280 0,080 0,160 0,120 0,240 0,120 0,160 0,120 0,160 0,160 0,240 0,200 0,240 0,160 0,080 0,480 0,400 0,320 Інтенс-ть Інтенс-ть Віднос. піка [кіль- фону [кільінтенс-ть кість імпу- кість імпу[%] льсів] льсів] 1399 135 19,1 1204 135 16,5 1043 139 14,3 1063 142 14,5 7310 144 100,0 3624 146 49,6 5402 149 73,9 2652 149 36,3 369 154 5,0 773 156 10,6 4277 161 58,5 484 164 6,6 2725 169 37,3 3540 172 48,4 529 174 7,2 557 174 7,6 2421 182 33,1 676 185 9,2 767 185 10,5 420 188 5,7 1467 190 20,1 1789 190 24,5 1204 190 16,5 1011 196 13,8 159 199 2,2 282 204 3,9 339 207 4,6 237 210 3,2 1347 216 18,4 404 216 5,5 202 222 2,8 299 225 4Д 202 228 2,8 169 234 2,3 216 234 3,0 240 237 3,3 449 246 6,1 396 246 5,4 520 250 7,1 480 253 6,6 372 256 5,1 538 259 7,4 428 262 5,9 433 266 5,9 376 269 5,1 279 279 3,8 310 282 4,2 506 292 6,9 615 296 8,4 437 303 6,0 416 306 5,7 177 317 2,4 130 324 1,8 130 328 1,8 Значущість 2,26 4,71 13,14 0,91 32,77 9,02 21,06 23,25 5,78 3,09 74,66 3,33 1,16 17,08 1,01 3,02 42,58 1,32 2,75 1,08 0,79 4,41 11,65 15,74 1,22 8,14 0,96 3,01 14,06 1,45 1,04 4,84 3,78 0,90 2,14 1,58 2,67 0,82 0,95 2,66 2,65 1,31 1,45 1,50 0,89 0,86 0,87 2,06 1,67 1,73 0,93 2,84 1,37 1,72 15 80135 16 Продовження таблиці 1 Кут [°2q] Значення d a1 [Ǻ] Значення d a2 [q] Ширина піка [°2q] 56,220 56,770 57,405 58,500 1,6348 1,6203 1,6039 1,5764 1,6389 1,6243 1,6079 1,5804 0,320 0,240 0,240 0,240 Виготовлення таблеток, що містять флібансерин, із плівковим покриттям А) Використовуване обладнання Для одержання запропонованої у винаході фармацевтичної композиції використовували наступне обладнання: змішувальний резервуар з мішалкою Ekato і гомогенізатор типу Ultra Turrax для одержання рідини для гранулювання та суспензії для нанесення плівкового покриття відповідно, змішувач із високим зсувним зусиллям/гранулятор (наприклад Diosna P 400), машина, що просіває, для мокрого просіювання (наприклад Alexanderwerk), сушарка із псевдозрідженим шаром (наприклад Glatt WSG 15), машина, що просіває, для сухого просіювання (наприклад Quadro Соmil AS 197), змішувач із вільним падінням матеріалу, що перемішується, (наприклад Servolift 120 1 або контейнерний змішувач), ротаційна таблетувальна машина (наприклад Fette P 1200), машина для нанесення покриттів (наприклад Glatt GC 1250). Б) Опис процесу виготовлення таблеток На першій стадії приготовляють рідину для вологого гранулювання. Із цією метою у відповідний змішувальний резервуар заливають очищену воду та нагрівають її приблизно до 80°С. Після цього домішують гіпромелозу (метоцел Е5 Prem) і/або додаткові зв'язуючі компоненти, що забезпечують зв'язування інгредієнтів у вологому стані, і одержану дисперсію охолоджують до кімнатної температури. При необхідності рідину залишають стояти на ніч (для завершення розчинення/зменшення піноутворення) і перемішують перед подальшим використанням. Будь-яке зменшення маси (або об'єму) рідини компенсують додаванням очищеної води. Вміст сухої речовини (частка твердої речовини) у такій рідині для гранулювання переважно складає від 4 до 6%. Для процесу гранулювання в змішувач послідовно загружають тонкоподрібнений і просіяний моногідрат лактози, необхідну кількість флібансерину в поліморфній модифікації А (що залежить від передбаченого дозування) у мікронізованому вигляді та мікрокристалічну целюлозу (авіцел РН 101) і перемішують до гомогенності протягом приблизно 4 хв. за допомогою лопатевої мішалки та лопат, що подрібнюють. Після цього або вручну, або через сопла, що розприскують, додають рідину для гранулювання та одержану вологу масу гранулюють протягом приблизно 2-3 хв, знову використовуючи лопатеву мішалку та лопаті. Після вивантаження зі змішувача з високим зсувним зу Інтенс-ть Інтенс-ть Віднос. піка [кіль- фону [кільінтенс-ть кість імпу- кість імпу[%] льсів] льсів] 121 331 1,7 142 335 1,9 112 339 1,5 67 342 0,9 Значущість 0,87 1,59 1,19 1,57 силлям/гранулятора вологі гранули для дроблення великих агломератів просівають у вологому стані через сито з розміром отворів 3,0мм. Просіяний у вологому стані матеріал переносять у звичайну сушарку із псевдозріджений шаром (або в іншому варіанті в тарілчасту сушарку) і суша ть у потоці повітря з температурою на вході, що дорівнює приблизно 100°С, до зниження температури повітря, що відходить (або в іншому варіанті до підвищення температури продукту) до приблизно 50°С (45-55°С). Залишкова вологість грануляту після сушіння повинна бути в інтервалі від 0,5 до 1,5%. Висушені гранули потім просівають у сухому стані за допомогою машини, що просіває, Соmil, використовуючи сито терткового типу з розміром отворів 2мм. У завершення просіяний гранулят загружають у відповідний змішувач з вільним падінням компонентів, що перемішуються, наприклад у контейнерний змішувач, додають поперечно-зшиту натрійкарбоксиметилцелюлозу (натрієву сіль кроскармелози, торговельна назва Ac-Di-Sol) і стеарат магнію та всі ці компоненти перемішують при швидкості 10об/хв протягом 10-20хв., переважно протягом 15хв., до утворення гомогенної суміші. З одержаної суміші у відповідній таблетувальній машині (наприклад у ротаційній таблетувальній машині) пресують таблетки заданої маси, що залежить від необхідного дозування флібансерину, використовуючи відповідний пуансон і матрицю (наприклад при виготовленні таблеток з вмістом діючої речовини 50мг використовують круглі пуансон і матрицю діаметром 9мм з увігн утими робочими поверхнями з виступаючими скошеними краями для утворення фасеток у таблетках, що пресуються, або ж при виготовленні таблеток з вмістом діючої речовини 100мг використовують пуансон і матрицю довгастої форми розміром 14x6,8мм). Для забезпечення необхідного профілю розчинення лікарського засобу та одержання продукту з необхідними властивостями твердість матеріалу, з якого виготовлений пуансон і матриця, повинна відповідати встановленим для їх різних типорозмірів технічним умовам. Оскільки лікарська речовина флібансерин має гіркий смак і до деякої міри чутлива до впливу світла, на серцевини таблеток для одержання стабільного й такого, що не викликає неприємних відчуттів у кінцевого споживача продукту, доцільно наносити захисне плівкове покриття. Із цією метою спочатку виготовляють суспензію для нанесення покриття, для чого у відповідний змішувальний резервуар заливають очищену воду, у якій шляхом інтенсивного перемішування за допомогою високошвидкісної мішалки розчиняють поліетиленглі 17 80135 18 коль 6000, а потім гідроксипропілметилцелюлозу. На наступній стадії до одержаного розчину плівкоПокриття: утворювального полімеру додають водну суспензію діоксиду титану, тальку і червоного оксиду заКількість у мг на Компоненти ліза (який використовують при необхідності надати одну таблетку плівковому покриттю таблеток відповідний колір) і ГПМЦ (метоцел Е5) 1,440 всю цю суміш перемішують. Вміст сухої речовини поліетиленгліколь 6000 0,420 в такій суспензії для нанесення покриття складає діоксид титану 0,600 від 10 до 15%, переважно приблизно від 12 до тальк 0,514 13%. червоний оксид заліза 0,026 Після цього одержані раніше серцевини таблеток загружають у відповідну машину для нанеЗагальна маса таблетки з сення покриттів (наприклад у машину типу Accela 128,000 плівковим покриттям Cota з котлом діаметром 36" або в машину типу Glatt GC 1250 Coater з перфорованим котлом і з Приклад 2: Склад таблетки верхнім розташуванням системи сопел, що розСерцевина: бризкують) і попередньо нагрівають до температури близько 50°С. Після підвищення температури Кількість у мг продукта до цього рівня на серцевини за допомоКомпоненти на одну табгою одного або декількох сопел, що розприскують, летку набризкують суспензію для нанесення покриття флібансерин у поліморфній модипри тиску розпилення приблизно 2 бар, витраті 50,000 фікації А суспензії, що розприскується, приблизно 4кг/год моногідрат лактози 143,440 (при використанні машини типу Accela Cota) і при мікрокристалічна целюлоза 47,810 температурі повітря на вході близько 60-85°С. Слід зазначити, що для одержання високоякісного ГПМЦ (наприклад фармакоат 606) 2,500 плівкового покриття в процесі розбризкування сунатрійкарбоксиметилцелюлоза 5,000 спензії для нанесення покриття важливе значення стеарат магнію 1,250 має контроль температури продукту та її підтримування в межах від 48 до 52°С. По завершенні Покриття: цього процесу розбризкування таблетки з нанесеним на них плівковим покриттям до їх вивантаженКількість у мг на Компоненти ня з машини для нанесення покриттів охолоджуодну таблетку ють до температури близько 30°С. Загальна ГПМЦ (наприклад фармакоат 2,400 тривалість процесу нанесення плівкового покриття 606) на серцевини таблеток складає від 2 до 3 год. поліетиленгліколь 6000 0,700 Після виконання всіх процедур, пов'язаних з діоксид титану 1,000 перевіркою якості продукції, здійснюваної в тому тальк 0,857 числі й у ході технологічного процесу, таблетки із червоний оксид заліза 0,043 плівковим покриттям, що зсипають навалом після Загальна маса таблетки з їх виго товлення у відповідний приймач, готові до 255,000 плівковим покриттям первинної розфасовки у відповідні упаковки, у яких вони надходять у продаж (наприклад у блістерні Приклад 3: Склад таблетки упаковки з полівінілхлориду/полівініліденхлориду Серцевина: або в пузирі з поліетилену високої щільності). Аналогічно описаному вище методу виготовКількість у мг ляли також таблетки із плівковим покриттям заКомпоненти на одну табзначеного нижче складу. летку Приклад 1: Склад таблетки флібансерин у поліморфній моди100,000 Серцевина: фікації А моногідрат лактози 171,080 Кількість у мг мікрокристалічна целюлоза 57,020 Компоненти на одну табГПМЦ (наприклад метоцел Е5) 3,400 летку натрійкарбоксиметилцелюлоза 6,800 флібансерин у поліморфній модистеарат магнію 1,700 25,000 фікації А моногідрат лактози 71,720 мікрокристалічна целюлоза 23,905 ГПМЦ (метоцел Е5) 1,250 натрійкарбоксиметилцелюлоза 2,500 стеарат магнію 0,625 19 80135 20 Покриття: Приклад 5: Склад таблетки Серцевина: Компонент Кількість у мг на одну таблетку ГПМЦ (наприклад метоцел Е5) поліетиленгліколь 6000 діоксид титану тальк червоний оксид заліза Загальна маса таблетки з плівковим покриттям 0,980 1,400 1,200 0,060 347,000 Приклад 4: Склад таблетки Серцевина: Кількість у мг на одну таблетку Компоненти 3,360 флібансерин у поліморфній модифікації А двохосновний фосфат кальцію, безводний мікрокристалічна целюлоза ГПМЦ (наприклад метоцел Е5) натрійкарбоксиметилцелюлоза колоїдний діоксид кремнію стеарат магнію 100,000 69,750 69,750 2,750 5,000 1,250 1,500 Покриття: Компоненти флібансерин у поліморфній модифікації А двохосновний фосфа т кальцію, безводний мікрокристалічна целюлоза ГПМЦ (метоцел Е5) натрійкарбоксиметилцелюлоза колоїдний діоксид кремнію стеарат магнію Кількість у мг на одну таблетку 2,000 61,010 61,010 1,950 2,600 0,650 0,780 ГПМЦ (наприклад метоцел Е5) поліетиленгліколь 6000 діоксид титану тальк Загальна маса таблетки з плівковим покриттям ГПМЦ (метоцел Е5) поліетиленгліколь 6000 діоксид титану тальк червоний оксид заліза Загальна маса таблетки з плівковим покриттям Кількість у мг на одну таблетку 1,440 0,420 0,600 0,514 0,026 133,000 255,000 Приклад 6: Склад таблетки Серцевина: Покриття: компоненти Кількість у мг на одну таблетку 2,400 0,700 1,043 0,857 Компоненти Кількість у мг на одну таблетку Компоненти флібансерин у поліморфній модифікації А моногідрат лактози мікрокристалічна целюлоза гідроксипропілцелюлоза (наприклад клуцел LF) натрійкрохмальгліколят стеарат магнію 20,000 130,000 43,100 1,900 4,000 1,000 Покриття: Кількість у мг на одну таблетку Компоненти ГПМЦ (наприклад метоцел Е5) поліетиленгліколь 6000 діоксид титану тальк Загальна маса таблетки з плівковим покриттям Комп’ютерна в ерстка А. Крулевський Підписне 2,400 0,700 1,043 0,857 205,000 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition containing flibanserin polymorph a
Автори англійськоюFriedl Thomas
Назва патенту російськоюФармацевтическая композиция, которая содержит флибансерин в полиморфной модификации а
Автори російськоюФридль Томас
МПК / Мітки
МПК: A61P 15/00, A61K 9/20, A61P 25/18, A61P 25/16, A61K 31/496
Мітки: композиція, флібансерин, містить, модифікації, поліморфній, фармацевтична
Код посилання
<a href="https://ua.patents.su/10-80135-farmacevtichna-kompoziciya-shho-mistit-flibanserin-u-polimorfnijj-modifikaci-a.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить флібансерин у поліморфній модифікації а</a>
Попередній патент: Спосіб очищення газів від сірководню
Наступний патент: Висівний апарат
Випадковий патент: Установка прямої плавки