Вірусні антигени
Формула / Реферат
1. Композиція вакцини, яка містить
ВПЧ ПВЛ 16,
ВПЧ ПВЛ 18,
ВПЧ ПВЛ 31,
ВПЧ ПВЛ 45 та ад'ювант.
2. Композиція вакцини, яка містить ВПЧ ПВЛ 16, яка включає ПВЛ 16 L1 білок або функціональне похідне ПВЛ 16 L1 білка, ВПЧ ПВЛ 18, яка включає ПВЛ 18 L1 білок або функціональне похідне ПВЛ 18 L1 білка, ВПЧ ПВЛ 31, яка включає ПВЛ 31 L1 білок або функціональне похідне ПВЛ 31 L1 білка, ВПЧ ПВЛ 45, яка включає ПВЛ 45 L1 білок або функціональне похідне ПВЛ 45 L1 білка, та ад'ювант.
3. Композиція вакцини за п. 1, в якій ВПЧ ПВЛ 16 складається з ПВЛ 16 L1 білка або функціонального похідного ПВЛ 16 L1 білка, ВПЧ ПВЛ 18 складається з ПВЛ 18 L1 білка або функціонального похідного ПВЛ 18 L1 білка, ВПЧ ПВЛ 31 складається з ПВЛ 31 L1 білка або функціонального похідного ПВЛ 31 L1 білка, ВПЧ ПВЛ 45 складається з ПВЛ 45 L1 білка або функціонального похідного ПВЛ 45 L1 білка.
4. Композиція вакцини за п. 1, в якій принаймні одна ВПЧ містить усічений L1 білок.
5. Композиція вакцини за п. 1, де композиція додатково містить одну або кілька ВПЧ від одного або кількох додаткових генотипів ПВЛ.
6. Композиція вакцини за п. 5, в якій одна або кілька ВПЧ вибрані з групи, яку складають ВПЧ ПВЛ 33, ВПЧ ПВЛ 35, ВПЧ ПВЛ 52, ВПЧ ПВЛ 53, ВПЧ ПВЛ 56, ВПЧ ПВЛ 58 та ВПЧ ПВЛ 59.
7. Композиція вакцини за п. 1, яка має ефективність принаймні 60 % у попередженні цервікального раку.
8. Композиція вакцини за п. 1, яка додатково містить ранній антиген ПВЛ або його імунологічно активний фрагмент, де антиген вибраний з групи, яку складають Е1, Е2, ЕЗ, Е4, Е5, Е6, Е7 або Е8.
9. Композиція вакцини за п. 1, яка сформована з антигеном, похідним від організму, що спричинює хворобу, яка передається сексуальним шляхом.
10. Композиція вакцини за п. 9, в якій антигеном є антиген ВПГ або його імунологічно активний фрагмент.
11. Композиція вакцини за п. 9, в якій антигеном є антиген хламідії або його імунологічно активний фрагмент.
12. Композиція вакцини за п. 1, в якій принаймні одна ВПЧ додатково містить білок L2 ПВЛ або його фрагмент.
13. Композиція вакцини за п. 1, в якій ад'ювант містить сіль алюмінію.
14. Композиція вакцини за п. 1, в якій ад'ювант містить гідроксид алюмінію.
15. Композиція вакцини за п. 1, в якій ад'ювант містить 3D-MPL.
16. Спосіб виготовлення композиції вакцини за п. 1, який включає комбінування ВПЧ ПВЛ 16, ВПЧ ПВЛ 18, ВПЧ ПВЛ 31, ВПЧ ПВЛ 45 та ад'юванту.
17. Спосіб за п. 16, в якому ВПЧ перед комбінуванням адсорбують на гідроксиді алюмінію.
18. Спосіб попередження ПВЛ-інфекції або лікування ПВЛ, який включає введення індивідууму при ризику його інфікування ефективної кількості композиції вакцини за п. 1.
19. Композиція вакцини за п. 1, в якій реакція на антитіло проти даного типу ВПЧ у вакцині складає принаймні 50 % від реакції на антитіло того ж типу ВПЧ, виміряної окремо.
20. Композиція вакцини за п. 1, в якій імунна реакція, створювана вакциною, знаходиться на рівні, на якому ще спостерігається захисна дія кожного типу ВПЧ.
21. Композиція вакцини за п. 1, в якій ад'ювант містить сіль алюмінію та 3D-MPL.
22. Композиція вакцини за п. 1, в якій ад'ювант містить QS21.
Текст
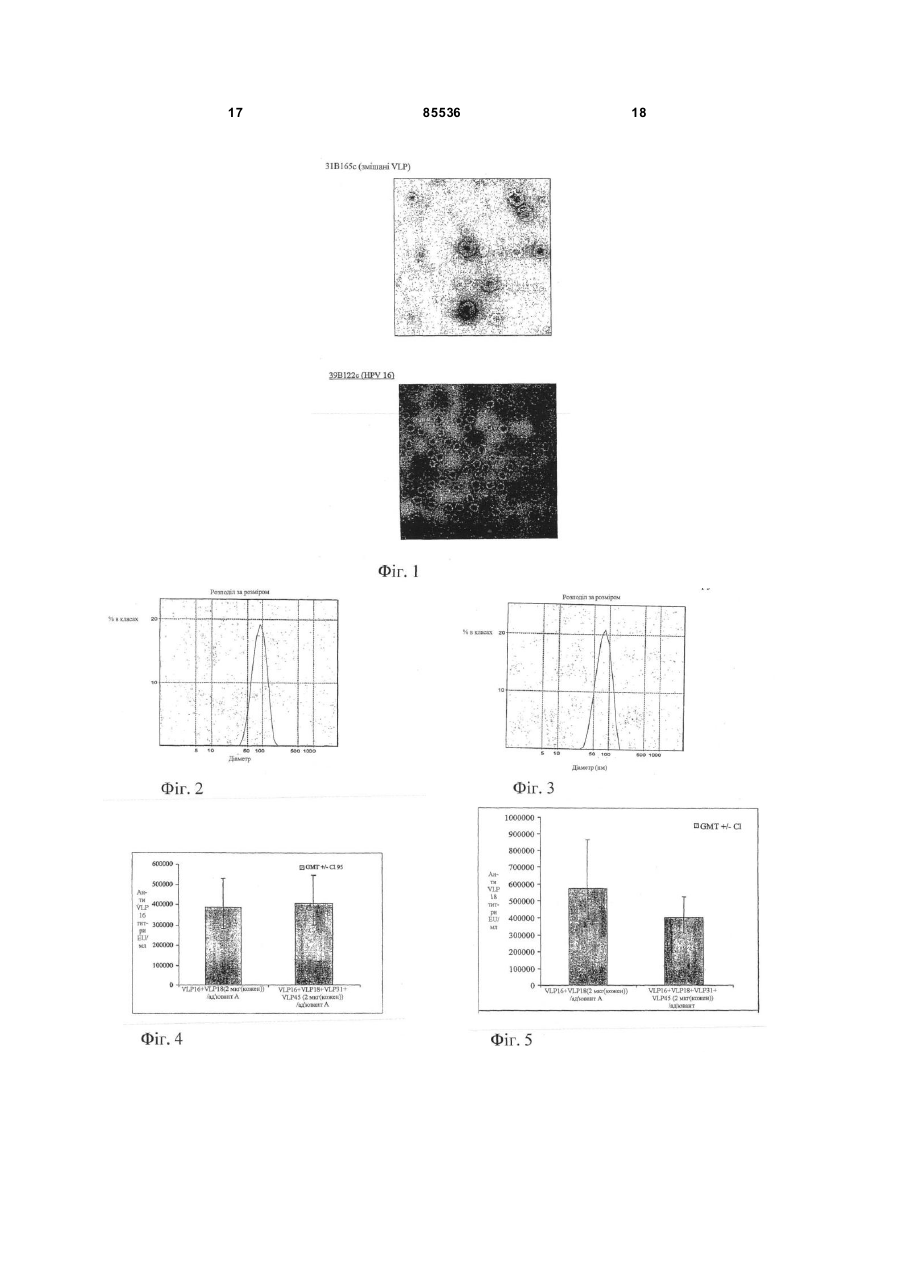
1. Композиція вакцини, яка містить ВПЧ ПВЛ 16, 2 (19) 1 3 85536 4 9. Композиція вакцини за п. 1, яка сформована з антигеном, похідним від організму, що спричинює хворобу, яка передається сексуальним шляхом. 10. Композиція вакцини за п. 9, в якій антигеном є антиген ВПГ або його імунологічно активний фрагмент. 11. Композиція вакцини за п. 9, в якій антигеном є антиген хламідії або його імунологічно активний фрагмент. 12. Композиція вакцини за п. 1, в якій принаймні одна ВПЧ додатково містить білок L2 ПВЛ або його фрагмент. 13. Композиція вакцини за п. 1, в якій ад'ювант містить сіль алюмінію. 14. Композиція вакцини за п. 1, в якій ад'ювант містить гідроксид алюмінію. 15. Композиція вакцини за п. 1, в якій ад'ювант містить 3Д-MPL. 16. Спосіб виготовлення композиції вакцини за п. 1, який включає комбінування ВПЧ ПВЛ 16, ВПЧ ПВЛ 18, ВПЧ ПВЛ 31, ВПЧ ПВЛ 45 та ад'юванту. 17. Спосіб за п. 16 , в яком у ВП Ч перед комбін уванням адсор бують на гідроксиді алюмінію. 18. Спосіб попередження ПВЛ-інфекції або лікування ПВЛ, який включає вве дення індивідууму при ризику його інфікування ефективної кількості композиції вакцини за п. 1. 19. Композиція вакцини за п. 1, в якій реакція на антитіло проти даного тип у ВПЧ у вакцині складає принаймні 50% від реакції на антитіло того ж типу ВПЧ, виміряної окремо. 20. Композиція вакцини за п. 1, в якій імунна реакція, створювана вакциною, знаходиться на рівні, на якому ще спостерігається захисна дія кожного типу ВПЧ. 21. Композиція вакцини за п. 1, в якій ад'ювант містить сіль алюмінію та 3Д-MPL. 22. Композиція вакцини за п. 1, в якій ад'ювант містить QS21. Представлений винахід стосується вакцин проти ПВЛ. Зокрема, винахід стосується вакцин, що містять вірусоподібні частинки (ВПЧ). особливо, вір усоподібні частинки, що містять білки папіломовірусу людини (ПВЛ). Папіломовірусами є маленькі ДНК-віруси пухлин, які є високо специфічними різновидами. Поки що описано більше 100 індивідуальних генотипів папіломовірусів людини (ПВЛ) ПВЛ-віруси звичайно специфічні, як для шкіри (ПВЛ-1 та ПВЛ-2), так і для поверхні слизової оболонки (ПВЛ-6 та ПВЛ11), і звичайно викликають доброякісні пухлини (бородавки), які продовжують існувати кілька місяців або років. Такі доброякісні пухлини можуть викликати занепокоєння особи, але не складають, за деяким виключенням, загрози для життя Деякі ПВЛ-віруси асоціюються з раком. Найбільш сильні позитивні асоціації між ПВЛ , і раком людини - ті, які існують між ПВЛ-16 і ПВЛ-18 та цервікальною карциномою. Церві-кальна карцинома - найбільш розповсюджене злоякісне захворювання в розвинених країнах, це - близько 500000 нових випадків захворювання у світі кожен рік. Зараз технічно можливо вести боротьбу з первинною інфекцією ПВЛ-16 і, навіть, визначити рак, викликаний ПВЛ-16, використовуючи вакцину. Огляд досліджень профілактики та терапевтичної вакцинації проти ПВЛ-16 дивись у Cason J. Clin. Immunother. 1994: 1 (4) 293-306 і Hegenesse Μ.Ε., Infection in Medicine 1997 14 (7) 555-556, 559-564. Хоч і зустрічаються незначні варіації, усі описані геноми ПВЛ-вірусів мають принаймні вісім ранніх генів, від Е1 до Е8, та два пізніх гени L1 і L2. Окрім того, підвищувально-регуляторний регіон містить регуляторні послідовності, що виявлені, як такі, що контролюють більшість випадків транскрипції геному ПВЛ. Вакцини, що базуються на ПВЛ L1, розкриті у WO94/00152, WO94/20137, WO93/02184 і WO94/05792. Такі вакцини можуть містити антиген L1 у вигляді мономеру ι капсомеру або вірусоподібної частинки. Способи виготовлення ВПЧ добре відомі та включають розкладання та формування ВПЧ для підвищення гомогенізації, наприклад, як це описано у WO9913056 і US6245568. Такі частинки можуть додатково містити білки L2. Вакцини, які базуються на L2, наприклад, описані у WO93/00436. Інші ПВЛ-вакцини базуються на таких ранніх білках, як Е7, або таких конденсованих білках, як L2-E7. Незважаючи на роботи з вакцин ПВЛ, ще немає широко ефективної вакцини проти цервікальної карциноми. Представлений винахід стосується удосконаленої вакцини проти вірусу папіломи людини. Згідно з першим аспектом представлений винахід стосується композиції вакцини, що містить ВПЧ, які включають білки L1 або функціональні похідні білків L1 із ПВЛ 16, ПВЛ 18, ПВЛ 31 та ПВЛ 45. Винахід також стосується способу виготовлення вакцини, спосіб залучає поєднання ВПЧ, що містять білки L1 або функціональні похідні білків L1 із ПВЛ 16, ПВЛ 18, ПВЛ 31 та ПВЛ 45. Подалі винахід стосується застосування суміші ВПЧ, що містять білки L1 або функціональні похідні білків L1 із ПВЛ 16, ПВЛ 18, ПВЛ 31 та ПВЛ 45 при виготовленні вакцини для запобігання цервікального раку. Подалі винахід стосується способу запобігання цервікального раку, спосіб залучає уведення індивідууму при ризику цервікального раку ефективної кількості вакцини, описаної вище, як-то вакцина, що містить суміш ВПЧ ПВЛ 16, ПВЛ 18, ПВЛ 31 та ПВЛ 45. ВПЧ представленого винаходу можна сформувати з білку L1 повної довжини або з відповідних похідних L1, використовуючи стандартні спо 5 85536 соби, наприклад, як розкрито у WO99/13056, який тут включено як посилання. Краще, щоб застосований для утворення ВПЧ білок L1 був усіченим. Краще, якщо принаймні одна з ВПЧ містить усічений білок L1, краще, якщо усі білки у композиції вакцини є усіченими білками L1. Переважно усічення видаляє сигнал ядерної локалізації. Переважним є усічення С-кінця. Переважно усічення С-кінця видаляє менш ніж 50 амінокислот, ще краще - менш ніж 40 амінокислот. Найпереважнішим є усічення С-кінця, що видаляє 34 амінокислоти з ПВЛ 16 і 35 амінокислот із ПВЛ 18. Усічені білки L1 є, відповідно, функціональними похідними білків L1. Функціональні похідні білків L1 здатні підвищити імунний відгук (якщо це є необхідним і, відповідно, корисним), названий імунний відгук - це здатність розпізнавання ВПЧ, що містить білок L1 повної довжини, та/або типу ПВЛ, який є джерелом білку L1. ВПЧ винаходу також можуть містити інші типи функціональних похідних білків, включаючи мутанти білків повної довжини або усічені L1 ПВЛ, як-то мутанти внаслідок делецій, заміщень або вставок. Відповідні похідні включають також оптимізовані послідовності кодону. Білок L1 або похідне може також бути конденсованим білком, як-то конденсат білку L1 із L2, або раннім білком. Кращими є конденсовані білки, що містять білки тільки з одного генотипу ПВЛ. Вакцина ВПЧ, зроблена з химерних білків L1, де білки L1 з одного генотипу зв'язані з білками іншого генотипу, не є кращою. Білок L1 або функціональне похідне білку здатні утворювати ВПЧ, і утворення ВПЧ визначають за допомогою стандартної техніки, наприклад, електронного мікроскопу та динамічного розсіювання лазерного світла. Кращою є полідисперсність ВПЧ, що менша ніж 0,15, найкраще - менше ніж 0,1, ще краще менше ніж 0,08, якщо виміри виконують із використанням Malvern Zetasizer 3000HS в умовах, які тут наведені. Використання терміну "білок" або посилання на специфічний білок "L1" у подальшому слугує для посилання на функціональні похідні білків, якщо інакше не позначено або ясно не видно з контексту. Згідно з кращим аспектом винаходу вакцина винаходу має тільки чотири типи ВПЧ - ВПЧ ПВЛ 16, ПВЛ 18, ПВЛ 31 і ПВЛ 45. Переважно, ВПЧ представляють тільки ВПЧ L1 із кожних цих чотирьох генотипів. Альтернативно і найкраще, якщо вакцина містить додаткову ПВЛ-валентність, утворюючи п'ятивалентну вакцину. Переважно, додатковою валентністю є ВПЧ, що містить вищенаведені білок L1 або функціональне похідне з одного із ПВЛ 52, 53, 58, 33, 35, 56, і 59. Кращим 5-им генотипом є ПВЛ 33, коли вакцина призначена для використання у Південній Америці, або ПВЛ 52, 53, або 58, коли вакцина призначена для використання в Азії. Представлений винахід також поширюється на вакцини, що містять 2 або більше додаткових валентностей, щоб забезпечити вакцину з 6-ма або більшою кількістю генотипів. 6 В одній кращій композиції комбінація виключає ВПЧ із генотипів ПВЛ 6а, 6b або ПВЛ 11. Кращою вакциною винаходу є вакцина, що має принаймні 55% ефективність у запобіганні цервікального раку, ще кращою - 60%, 65%6 70%, 75%, краще - 80% або навіть більшу е фективність у запобіганні цервікального раку. Щоб позбутися сумніву, % ефективності у запобіганні цервікального раку означає захист проти усього цервікального раку, викликаного інфекцією ПВЛ, а не тільки від раку, обумовленого одним генотипом Запобігання можна відповідно оцінювати через рік після початкової вакцинації, хоча кращі вакцини однаково ефективні через 2, 3, 4, 5 або більше років. % ефективності може бути підвищений шляхом селекції відповідних генотипів ПВЛ із метою створення вакцини для особливих географічних зон. Переважно комбінація ВПЧ у вакцині не знижує імуногенності кожного типу ВПЧ Зокрема, краще, щоб не було взаємодії між ВПЧ ПВЛ у комбінації винаходу, за умови, щоб ця комбінована ВПЧ-вакцина винаходу була здатною ефективно захищати від інфікування кожним представленим у вакцині генотипом ПВЛ. Відповідно імунний відгук даного типу ВПЧ у комбінації, принаймні, дорівнює імунному відгуку того ж типу ВПЧ, що визначають індивідуально, краще - 100% або по суті - 100%. Щодо відгуків на ВПЧ ПВЛ 16 і ПВЛ 18, комбінована вакцина винаходу стимулює імунний відгук, котрий, у крайньому разі, на 50% забезпечений комбінованою ВПЧ-вакциною ПВЛ 16/ПВЛ 18. Відповідно, імунний відгук, генерований вакциною винаходу, знаходиться на такому рівні, де ще видно захисний ефект кожного типу ВПЧ. Імунний відгук, відповідно, може бути виміряний, наприклад, відгуком на антитіла, як тут пояснено. Вакцина винаходу може бути використана для лікування або упередження інфекції та/або хвороби. Наприклад, вакцина може бути використана терапевтично для послаблення вірусного навантаження та/або інфекцій, що призводять до цервікальної карциноми або ускладнень CIN III. Також, винахід відноситься до застосування вакцини винаходу у терапевтичному лікуванні хвороб, пов'язаних з інфікуванням ПВЛ та у профілактиці інфікування або хвороби. Винахід також відноситься до використання комбінації ВПЧ винаходу у генерації імунного відгук у проти ПВЛ 16, 18, 31 та 45. Вакцина винаходу, як варіант, може бути комбінованою з ВПЧ, які створюють захист проти генітальних бородавок, як наприклад, ВПЧ, що містить білок L1 із генотипів ПВЛ 6а, 6b, та/або ПВЛ 11. Переважно ВПЧ містять тільки білок L1 ПВЛ та не містять білку L2 або фрагментів білку. Вакцини винаходу можуть містити інші білки або фрагменти білків додатково до білку L1 або похідного. Білки/пептиди можуть бути виготовлені у химерній формі з білками L1 у ВПЧ, інкапсульованими у ВПЧ або співсформованими у суміші з ВПЧ Інші білки або пептиди можуть бути співзастосованими з вакциною винаходу. Згідно з одним аспектом вакцина містить білок L2 або похідне L2 ПВЛ, як-то пептид L2, наприклад, як це було описано у K. Kawana та ін. Vaccine 19, (2001) р.1496-1502, що уведено, як поси 7 85536 лання. Подальшою перевагою вакцини винаходу може бути співформування з такими ранніми антигенами ПВЛ, як Е1, Е2, ЕЗ, Е4, Е5, Е6 Е7, Е8 або їх імунологічно активними похідними. Коли виготовляють химерну форму, краще використовувати імуногенний фрагмент з 30-60 амінокислотами раннього антигену. Як варіант, вакцина може бути співформованою або співзастосованою з антигенами не-ПВЛ. Відповідно, ці антигени можуть забезпечувати захист проти інших хвороб, найкраще проти хвороб, що розповсюджуються сексуальним шляхом, як-то вірус простого герпесу, хламідій та ВІЛ. Ми вважаємо переважним, якщо вакцина містить gD або його усічення від ВГЛ, кращим є білок gD2t, як це описано в WO 99/45957. Таким чином, вакцина забезпечує захист проти ПВЛ і ВГЛ. Кращий антиген ВІЛ описано у WO/9916884 і WO/0154719. Представлений винахід, взагалі, стосується суміші ВПЧ, що містить капсидні білки з ПВЛ 16, 18, 31 і 45, наприклад, як ВПЧ тільки з L1. В особливо кращому втіленні винахід забезпечує вакцину, що містить суміш ВПЧ ПВЛ 16 ВПЧ, ПВЛ 18 ВПЧ, ПВЛ 31 ВПЧ і ПВЛ 45 ВПЧ. Посилання щодо "ПВЛ 16 ВПЧ", наприклад, є посиланням на L1 ВПЧ, у якому білок L1 або похідне L1 - від ПВЛ 16. Такий самий номенклатурний принцип поширюють на інші описані тут ВПЧ, наприклад, ПВЛ 18, ПВЛ 31 і ПВЛ 45 ВПЧ. Переважно кожний ВПЧ містить білок L1 тільки з одного генотипу ПВЛ. Така вакцина може бути співсформованою продукуванням індивідуальних ВПЧ з ПВЛ 16, 18, 31 і 45 із наступним об'єднанням таких ВПЧ. Переважно у ВПЧ нема інших білків, крім, L1. Також кращим є ВПЧ, що містить білки тільки з одного ПВЛ-генотипу, наприклад, ВПЧ із L1 і L2 від ПВЛ 16. Однак, в альтернативному втіленні винаходу ВПЧ можуть бути змішаним ВПЧ, змішана ВПЧ містить білок L1 з одного генотипу у комбінації з білком L1 із другого генотипу, де різні білки L1 не є химерними білками L1, але поєднані разом у межах самої капсидної структури, утворюючи імуногенні ВПЧ. Краща комбінація охоплює будь-які пермутації генотипів 16, 18, 31 і 45, наприклад, винахід може містити змішані ВПЧ ПВЛ 16/ПВЛ 18 у комбінації зі змішаними ВПЧ ПВЛ 31/ПВЛ 45, або змішані ВПЧ 16/31 у комбінації зі змішаними ВПЧ 18/45. Також можлива комбінація більш двох Li-генотипів в одній ВПЧ. Змішані ВПЧ можна одержати окремою експресією індивідуальних білків L1 та подальшою комбінацією з утворенням ВПЧ, як у наведеному тут прикладі. Альтернативно, складні білки L1 можна експресувати у тій же клітині з однієї або більше ДНК. Наприклад, складні констракти ДНК можуть бути трансформовані або трансфектовані у клітини-"господарі", причому кожен вектор кодує відмінний білок L1. Альтернативно, одиничний вектор, що має складні Li-гени, контрольований спільним промотором або багатьма індивідуальними промоторами, можна застосовувати. IRESелементи також можна інкорпорувати у вектор, за 8 прийнятністю. Використовуючи таку стратегію експресування, коекспресресовані білки L1 можна співочищати для наступного формування відповідних ВПЧ, або можна спонтанно формувати змішані ВПЧ, які потім можна очищати. Якщо використовують змішані ВПЧ, кращий процес одержання змішаних ВПЧ містить приготування ВПЧ білків L1 або похідних, наприклад, білків L1, із різних генотипів папіломовірусів, змішуючи білки, якщо необхідно, і комплектування білків для одержання змішаних ВПЧ. Білки L1 можуть бути у вигляді неочищеного екстракту, частково очищеного або очищеного до змішування. Кращими є білки, у крайньому разі, частково очищені перед виконанням змішування. Як варіант, подальше очищення змішаних ВПЧ може бути виконаним після збору. Якщо використовують додаткові антигени, їх можна додавати, де це необхідно. У одному втіленні змішані ВПЧ можуть бути зроблені роз'єднанням двох або більше ВПЧ із наступним комбінуванням роз'єднаних компонентів ВПЧ у будь-який момент перед комбінуванням. Цей підхід є придатним, коли ВПЧ утворюються спонтанно, якщо білок L1 експресується, як це, наприклад, відбувається у деяких штамах дріжджів. Якщо експресія білку L1 не призводить до спонтанного формування ВПЧ, препарати білків L1 або капсомерів можуть бути скомбіновані до компонування у ВПЧ. Компонування ВПЧ успішно досягають видаленням редукувальних засобів. По суті при продукуванні змішаних ВПЧ змішування білків переважно провадять до видалення редукувальних засобів із суміші білків. Переважно, продукування змішаних ВПЧ містить етап створення змішаних ВПЧ із суміші дисоцийованих білків L1 видаленням редукувального засобу із суміші в умовах, що забезпечують створення ВПЧ. Переважно, процес повторного комбінування є результатом видалення редукувального засобу, наприклад, β-меркаптоетанолу. Однак, відомо, що створення ВПЧ залежить від рН, іонів металу, засоленості, а також від присутності редукувального засобу. По суті у деяких обставинах, можливо передбачити утворення ВПЧ у присутності редукувального засобу. Для винаходу важливо тільки те, що змішування білків від різних генотипів виконують перед зміною зовнішніх умов, що дозволяє утворитися змішаним ВПЧ, незалежно від того, чи то є рН, іони металу, засоленість, редукувальний засіб або їх комбінація. Якщо використовують змішані ВПЧ, краще змішува ти компоненти ВПЧ у пропорціях, що потрібні у кінцевій змішаній ВПЧ. Наприклад, суміш однакової кількості частково очищених білків L1 із ПВЛ 16 та ПВЛ 18 забезпечує змішана ВПЧ із приблизно однаковою кількістю кожного білку. Розчин вакцини, що містить змішану ВПЧ, може бути стабілізований відомою композицією, наприклад, як у WO 98/44944, WO 00/45841, які включені тут, як посилання. Перевагою усіх вакцин винаходу є їх використання для вакцинації дівчаток юнацького віку -1015 років, краще - 10-13 років. Вакцина також може бути призначена жінкам із аномальним мазком із 9 85536 соска грудей або після хірургічного видалення пошкоджень, викликаних ПВЛ. Переважно вакцину приймають у 2-х - 3-хдозовому режимі, наприклад, у 0, 1-місячному режимі або 0, 1- і 6-місячному режимі відповідно. Відповідно, режим вакцинації охоплює бустерні ін'єкції після 5-10 років, краще -10 років. Кращою є вакцина у вигляді рідини, хоч вакцина може бути ліо філізованою і відтвореною перед застосуванням. Вакцини винаходу можуть також містити ад'юванти у комбінації з ВПЧ. Відповідно, ВПЧ винаходу використовують у комбінації з алюмінієм, і вона, відповідно, адсорбована або частково адсорбована на алюмінієвих ад'ювантах. Також кращими є ад'юванти, які стимулюють відгук типа Th1, наприклад, 3Д-MPL або QS21. Відповідно, ад'ювант сіль алюмінію, краще - у комбінації з 3Д-MPL, наприклад, - фосфат алюмінію і 3Д-MPL. Кращим підсилювачем є гідроксид алюмінію, особливо кращою є комбінація гідроксиду алюмінію з 3Д-MPL. Коли ВПЧ адсорбована на алюмініє-вмісних ад'ювантах, ад'ювант краще додавати перед змішуванням ВПЧ для утворення кінцевого продукту вакцини. Вакцина також може містити алюміній або сполуки алюмінію у якості стабілізаторів ι представлений винахід також відноситься до стабілізованої комбінованої вакцини, де ВПЧ адсорбована на солі алюмінію. Відповідно, ВПЧ є більш стабільною у часі після адсорбції сіллю алюмінію ніж у її відсутності. Кращі стабілізовані ВПЧ одержують або їх можна одержувати, згідно прикладу 1 розділу С3. Вакцини винаходу можна вживати декількома різними шляхами - перорально, місцево, крізь слизову (звичайно внутрішньовагінально), внутрішньовенно, внутрішньом'язово, назальним шляхом, під язик, інтрадермально, у вигляді свічок. Кращим шляхом є вн утрішньом'язовий, та інтрадермальний. Дози ВПЧ та інших білків змінюються в залежності від умов, статі, віку та ваги особи, призначеного способу вживання та вакцини ПВЛ. Кількість також може змінюватися в залежності відкількості типів ВПЧ. Відповідною є та кількість ВПЧ, що необхідна для генерації захисного імунологічного відгук у. Відповідно, кожна доза вакцини містить 1100мкг кожного ВПЧ, кращим є 5-80мкг, ще кращим є 5-30мкг кожної ВПЧ, найкращим є 5-20мкг кожної ВПЧ, а 5мкг, 6мкг, 10мкг, 15мкг або 20мкг є особливо переважними. Багатовалентну вакцину представленого винаходу відповідно створюють комбінуванням очищених L1 ВПЧ. Способи створення L1 ВПЧ добре відомі та охоплюють, наприклад, способи надані в WO9531532, WO9615247, WO00/09671 і US5888526, повну суть яких охоплено тут. Відповідно, ВПЧ винаходу виготовляють шляхом декомпонування та повторного компонування ВПЧ. Приклади відповідних процесів надані у WO0057906, US6245568 і WO9913056. Переважно ВПЧ одержують з клітин комах, наприклад, клітин Sf-9 або Ні-5, хоч будь-які при 10 датні клітини, як-то Е.соІі або клітини дріжджів, наприклад, S.cereviciae, S.pombe або Pichia sp., також можуть бути використані. Переважно очищення ВПЧ після експресії L1 залучає один або більше етапів аніонообмінної хроматографії (діметиламіноетил - ДМАЕ), аніонообмінної хроматографії (триметиламіноетил ТМАЕ), гидроксіапатитної хроматографії, фільтрації, наприклад, манометричної фільтрації або ультрафільтрації, хроматографії з гідрофобною взаємодією. Переважно при очистці виконують принаймні один етап аніонного обміну, ще краще використовува ти два етапи аніонного обміну: Переважно принаймні один етап аніонного обміну виконують до змішування білків. Як варіант, можна провадити один етап УФ-опромінювання. Щоб позбутися сумнівів, повний зміст усіх документів, що відносяться до цього, включено, як посилання. Представлений винахід ілюстровано наступними не обмежуючими прикладами та фігурами: Фіг.1 ілюструє змішані ВПЧ у порівнянні з ВПЧ ПВЛ 16, що оцінено за допомогою ЕМ. Фіг.2 і 3 ілюструють розподіл змішаних ВПЧ за розміром; Фіг.4 ілюструє відгуки антитіл проти ВПЧ 16 у змішаній комбінованій вакцині ПВЛ 16, 18, 36, 45 відносно контролю ПВЛ 16; Фіг.5 ілюструє відгуки антитіл проти ВПЧ 18 у змішаній комбінованій вакцині ПВЛ 16, 18, 36, 45 відносно контролю ПВЛ 18. Фіг.6 ілюструє відгуки антитіл проти ВПЧ 31 у змішаній комбінованій вакцині ПВЛ 16, 18, 36, 45 відносно контролю ПВЛ 31; Фіг.7 ілюструє відгук антитіл проти ВПЧ 45 у змішаній комбінованій вакцині ПВЛ 16, 18, 31, 45 відносно контролю ПВЛ 45. Приклад 1 Тут детально розглянута комбінація ВПЧ ПВЛ 16 і ПВЛ 18 L1. Білки L1 із генотипів інших ПВЛ можна легко одержати подібними вже відомими способами. А. Одержання ВПЧ L1 ПВЛ 16/18 Приготування ВПЧ ПВЛ 16 і ПВЛ 18 провадять із використанням стандартних прописів, наприклад, див. WO9913056. Білки ПВЛ 16/18 експресуються у клітинах Trichopluciani (High Five™) (густина приблизно 350000 клітин/мл), інфікованих рекомбінантним бакуло-вірусом Baculovirus (МОІ 0.3), що кодує потрібний ген L1 ПВЛ 16 або 18. Клітини збирали приблизно через 72 години після інфікування. В. Збір клітин / екстракція антигену Антиген (L1-16/18) екстрагують із клітин НІ5 шляхом триступінчастого процесу - концентруванням, екстракцією, освітленням. Етап концентрування містить видалення до 90% культиваційного середовища. Освітлення виконують фільтрацією тангенційним потоком. С. Очи щення Процес очищення виконують при кімнатній температурі, β-меркаптоетанол (масова частка 4%) додають до екстракту з метою розкомпонування ВПЧ у капсомери для двох антигенів L-16/18. Глі 11 85536 церин додають до масової частки 10% перед додаванням β-меркаптоетанолу. Усі використані буфери фільтрують на фільтрах 0,22мкм перед зберіганням при 2°С-8°С. Перед кожним очищенням матриці гелю дезінфікують і урівноважують відповідним буфером до завантаження зразку. Режим очищення надано для роздільного очищення L1 як від ПВЛ 16, так і від ПВЛ 18. Ці схеми у загальних рисах подібні і містять наступні етапи: Аніонообмінну хроматографію (диметиламіноетил - DMAE), Аніонообмінну хроматографію (триметиламіноетил - ТМАЕ), Гідроксоапатитну хроматографію, Нанометричну фільтрацію (Planova), Ультрафільтрацію, Хроматографію гідрофобної взаємодії (використання Октил-сефарози) для ПВЛ 18 або Аніонообмінну хроматографію (ДЕАЕ) для ПВЛ 16; і Стерильну фільтрацію. Конкретно: С. Очи щення антигену L1-18 Аніонообмінна хроматографія DMAE. Очищений екстракт (концентрація білку приблизно 1мкг/мл, з білком L1 - приблизно 150 мг/мл) переносять в аніонообмінну колонку (диметиламіноетил). Елюювання здійснюють буфером із рН 7,9±0,2 (Трис 20мМ | NaCI 200мМ | 4% βмеркаптоетанолу ВМЕ). Антиген елюють об'ємом, що приблизно дорівнює об'єму п'яти колонок. Профіль елюювання контролюють при 280нм. Аніонообмінна хроматографія ТМАЕ Елюат першого етапу розбавляють одним об'ємом 4% Н2О/ВМЕ. Розбавлений елюат далі переносять на другу аніонообмінну колонку (триметиламіноетил). Елюювання виконують буфером із рН 7,9±0,2 (Трис 20мМ | NaCI 200мМ | 4% ВМЕ). Антиген елюють об'ємом, що дорівнює об'єму 4 колонок і профіль елюювання контролюють при 280 нм. Гідроксіапатитна хроматографія Елюат після етапу ТМАЕ переносять у гідроксіапатитну колонку. Після розміщення зразка гель елюють об'ємом буфер у з рН 6,0±0,2 (NaH2PO4 100мМ | NaCI 10мМ | 4% ВМЕ), що дорівнює об'єму 2,5 колонок. Манометричне фільтрування Елюат НА розбавляють таким чином, щоб досягти відповідних умов: буфер (NaH2PO4 25мМ | NaCI 10мМ | 4% ВМЕ) із рН 7,5±0,2. Далі послідовно виконують фільтрування, спочатку на фільтрі 0,2мкм і далі - на фільтрі Planova 15N 0,12м 2. Фільтрування виконують при постійному тиску 200мбар±20мбар. Ультрафільтрування Ультрафільтрування виконують системою ультрафільтрування тангенційним потоком, забезпеченою поліефірсульфоновими мембранами (Centramate cassette 0,1м 2, 100кДа). Елюат після фільтра Planova оброблюють для створення наступних умов: буфер (NaH2PO4 100мМ | NaCI 30мМ | 4%ВМЕ), рН 6,0±0,2; далі його завантажують у систему, концентрують у 5 разів з безперер 12 вним уведенням 10 початкових об'ємів буферу (NaH2PO4 20мМ | NaCI 500мМ) із рН 6,0±0,2. Хроматографія гідрофобної дії Після ультрафільтрації продукт переносять у колонку з Октил-сефарозою. Цей етап хроматографії проходить у негативному режимі, приблизно, з 5 об'ємами колонок буферу (№Н3РО4 20мМ | NaCI 500мМ), рН 6,0±0,2. Стерильна фільтрація Очищений розчин антигену L1-18 стерилізують фільтрацією через мембрану 0,22мкм. С2 очищення антигену L1-16 Аніонообмінна хроматографія ДМАЕ Очищений екстракт переносять в аніонообмінну колонку (диметиламіноетил). Елюювання виконують буфером (Трис 20мМ | NaCI 180мМ | 4% ВМЕ), рН 7,9±0,2. Антиген елюють приблизно 4 об'ємами колонки, профіль елюювання відстежують при 280нм. Аніонообмінна хроматографія ТМАЕ Елюат першого етапу розбавляють 1 об'ємом Н2О/ВМЕ 4%. Розбавлений елюат далі переносять у др угу аніонообмінну колонку ( триметиламіноетил). Елюювання виконують буфером (20мМ Трис | NaCI 180мМ | 4% ВМЕ), рН 7,9±0,2. Антиген елюють об'ємом, що приблизно дорівнює об'ємам 5 колонок і профіль елюювання контролюють при 280нм Гідроксіапатитна хроматографія (НА) Елюат етапу ТМАЕ переносять у колонку НА. Після розміщення зразку гель елюють приблизно 3 об'ємами колонки буфером (NaH2PO4 100мМ | NaCI 30мМ | 4% ВМЕ), рН 6,0±0,2. Манометрична фільтрація (Planova) Елюат НА розбавляють для одержання наступних кондицій: буфер (NaH2PO4 25мМ | NaCI 10мМ | 4% ВМЕ), рН 7,5±0,2. Далі його фільтрують відповідно на попередньому фільтрі 0,2мкм і на фільтрі Planova 15N 0,12м 2. Фільтрацію виконують при постійному тиску 200±20мбар. Ультрафільтрування Ультрафільтрацію виконують ультрафільтраційною системою, забезпеченою поліефірсульфоновими мембранами (Centramat cassette 0,1м 2, 100кДа). Елюат оброблюють для забезпечення наступних кондицій: (NaH2PO4 100мМ | NaCI 30мМ | 4% ВМЕ), рН 6,0±0,2; далі його завантажують у систему, концентрують п'ятикратно, діафільтруюгь шляхом подовженого інжектування приблизно 10 початкових об'ємів буферу (NaH?PO4 20мМ | NaCI 550мМ), рН 6,0±0,2. Аніонообмінна хроматографія ДЕАЕ Ультрафільтрований елюат регулюють до електропровідності урівноважуючого буферу (Na3PO4 20мМ | NaCI 250мМ), рН 6,0±0,2 і переносять в аніонообмінну колонку (діетиламіноетил). Елюювання виконують буфером (NaH2PO4 20мМ | NaCI 500мМ), рН 6,0±0,2. Антиген елюють приблизно 3 об'ємами колонок і профіль елюювання контролюють при 280нм. Стерильна фільтрація Очищений розчин антигену L1-16 стерилізують фільтрацією через мембрану 0,22мкм. С3 13 85536 Кожний різновид ВПЧ адсорбують окремо для продукування концентрованого адсорбованого моновалентного. Одержання концентрованого адсорбованого моновалентого ВПЧ 16: 60мкг очищеного ВПЧ від ПВЛ 16 адсорбують на 150мкг АІ(3+) з АІ(ОН)3 при рН 6,0±0,2 протягом одної години при кімнатній температурі й обережному перемішуванні. Цей концентрований адсорбований моновалент зберігають при +4°С. Адсорбцію завершують центрифугуванням препарату і кількісним визначенням ВПЧ у надосадковому шарі. Одержання концентрованого адсорбованого моноваленту ВПЧ 18: 60мкг очищених ВПЧ із ПВЛ 18 адсорбують на 150мкг АІ(3+) із АІ(ОН)3 при рН 6,0±0,2 одну годину при кімнатній температурі й обережному перемішуванні. Цей концентрований адсорбований моновалент зберігають при +4°С. Адсорбція завершується центрифугуванням препарату і кількісним визначенням ВПЧ у надосадковому шарі. D. ОДЕРЖАННЯ КІНЦЕВОЇ ВАКЦИНИ Концентрований адсорбований моновалент, одержаний наведеним вище способом, комбінують з утворенням суспензії, що містить 20мкг кожної дози ВПЧ. Кінцеву вакцину зберігають при +4°С. Додавання ВПЧ від ПВЛ 31 і 45 при концентрації кожної ВПЧ 20мкг комплектує тетравалентну вакцину. Комбіновані адсорбовані порції або індивідуальні адсорбовані порції далі можна змішувати з ад'ютантами, наприклад, з 3Д-MPL. Приклад 2 А. Одержання ПВЛ 16/18 L1 ВПЧ Продукування ПВЛ 16 і 18 виконують, використовуючи ви щенаведені стандартні протоколи. В. Утворення змішаних ВПЧ Процес винаходу охоплює розкомпонування та повторне компонування ПВЛ 16 і 18, наприклад, рекомбінування ПВЛ 16 і 18 виконують разом, що дозволяє утворити змішаний ВПЧ. У наведеному вище процесі ПВЛ 16 і ПВЛ 18 ВПЧ можна комбінувати у будь-який необхідний момент до рекомбінування ВПЧ. У відповідності з прикладом 2 специфічні стратегії перевірили: змішування обох антигенів після етапу НА. Спираючись на вміст L1 у складових НА, два компоненти змішують до одержання рівних концентрацій ПВЛ 16 і 18 до початку етапу UF У цьому випадку після етапу ультрафільтрації застосовують етап Октил-сефарози, як для очищення ПВЛ 18 відповідно етапу DEAE, так і в процедурі - для ПВЛ 16. змішування обох екстрактів та співочищення. Спираючись на вміст L1 в екстрактах, дві валентності змішують до одержання рівних концентрацій ПВЛ 16 і 18 до початку етапу D MAE Знову після етапу ультрафільтрації застосовують етап Октилсефарози, як для ПВЛ 18 відповідно етапу DEAE, так і в процедурі - для ПВЛ 16. Змішування ВПЧ ПВЛ 16-ПВЛ 18 на етапі УФ. 14 Змішування ВПЧ ПВЛ 16-ПВЛ 18 на етапі ДМАЕ Застосовують той же самий спосіб, але змішування виконують на етапі ДМАЕ замість етапу УФ. Концентрація, застосована для елюції при аніонообмінні на етапах DMAE і ТМАЕ дорівнює 200мМ. Результати Змішування ВПЧ ПВЛ 16-ПВЛ 18 на етапі УФ. 2 партії ВПЧ (номери партій 31b165с і 31b166с) одержують комбінуванням білків L1 ПВЛ 16 і ПВЛ 18. Чистота відповідно SDS-Page Чистота змішаних ВПЧ така ж висока, як обох порцій "класичних" ПВЛ 16 або ПВЛ 18. Чистота порцій вища ніж 95%. Дані ЕМ - Фіг.1 Партія ЕМ-31В165С (збережений продукт УФ після розвитку) співставлена з класичною партією ПВЛ 16 (39В122с). ВПЧ - були гарно сформовані, гомогенні за розміром, неагреговані; кілька шматочків капсомерів присутні в обох експериментах. Розподіл за розміром Розподіл ВПЧ за розміром визначають за допомогою Malvern Zetasizer 3000 HS. Зразки вимірювали нерозбавленими у пластикових кюветах для Malvern-аналізу (800мкл/кювету). Технічними умовами були: довжина хвилі лазеру: 532нм, потужність лазеру: 50мВт, вимірювання розсіяного світла при 90°, температура: 25°С, тривалість: автоматичне вимірювання за допомогою програмного забезпечення, кількість: 3 послідовних виміри, середній діаметр: кумулянтним аналізом, 15 85536 розподіл за розміром: методом Contin. Класичні результати для ВПЧ L1 ПВЛ 18 такі: 70-80нм з гарною полідисперсністю (
ДивитисяДодаткова інформація
Назва патенту англійськоюViral antigens
Автори англійськоюWettendorff Martine Anne Cecil
Назва патенту російськоюВирусные антигены
Автори російськоюВеттендорфф Мартине Анне Сесиль
МПК / Мітки
МПК: A61P 31/12, C12N 7/04, A61K 39/21, C07K 14/025, A61K 39/118, A61K 39/295, A61K 39/12, A61P 35/00, A61K 39/23
Код посилання
<a href="https://ua.patents.su/10-85536-virusni-antigeni.html" target="_blank" rel="follow" title="База патентів України">Вірусні антигени</a>
Попередній патент: Пристрій для з’єднання за допомогою болта і гайки
Наступний патент: Спосіб тривалого ослаблення розсіяного склерозу або хвороби крона із застосуванням антитіла, що зв’язується з інтегрином альфа-4
Випадковий патент: Спосіб одержання стабільних рекомбінантних штамів бактерій escherichia coli, із геном mycoplasma hominis для продукування аргініндезимінази