Спосіб отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів
Номер патенту: 86783
Опубліковано: 10.01.2014
Автори: Сандомирський Борис Петрович, Рошаль Олександр Давидович, Шканд Тетяна Віталіївна, Чиж Микола Олексійович
Формула / Реферат
1. Спосіб отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів, що полягає у створенні композиції шляхом введення біологічно активних компонентів пептидного походження до біодеградуючої полімерної основи, який відрізняється тим, що як біодеградуючу полімерну основу використовують біогенний полімер рослинного походження - натрієву сіль альгінової кислоти, до якої вводять розчин біологічно активних пептидних компонентів, перемішуючи за допомогою механічної мішалки для пришвидшення процесу гелеутворення, а потім утримуючи протягом кількох годин в ультразвуковій бані при частоті коливань 40 кГц при температурі 40-50 °C для остаточної гомогенізації, з наступним перенесенням отриманої композиції до металевої, скляної або полімерної ємності, що має форму майбутнього імпланта, та залишаючи її на 1 добу для остаточного структурування.
2. Спосіб за п. 1, який відрізняється тим, що для приготування біодеградуючої полімерної основи до ізотонічного розчину з масовою часткою хлориду натрію 0,9 % додають 5-15 % альгінату натрію.
3. Спосіб за п. 1 або 2, який відрізняється тим, що масову частку біологічно активних пептидних компонентів у готовому імпланті доводять до 3 %.
4. Спосіб за п. 3, який відрізняється тим, що як біологічно активні пептидні компоненти використовують екстракт поліпептидів із серця новонароджених поросят.
5. Спосіб за пп. 1-4, який відрізняється тим, що готовий імплант зберігають при температурі 3-5 °C.
6. Спосіб за пп. 1-5, який відрізняється тим, що перед використанням імплант стерилізують протягом 20 хвилин при температурі 110-115 °C у скляному посуді в паровому стерилізаторі.
Текст
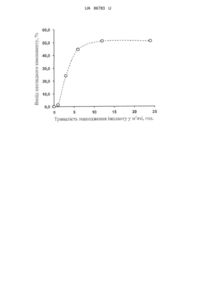
Реферат: Спосіб отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів полягає у створенні композиції шляхом введення біологічно активних компонентів пептидного походження до біодеградуючої полімерної основи. Як біодеградуючу полімерну основу використовують біогенний полімер рослинного походження - натрієву сіль альгінової кислоти, до якої вводять розчин біологічно активних пептидних компонентів. Перемішують за допомогою механічної мішалки для пришвидшення процесу гелеутворення. Утримують протягом кількох годин в ультразвуковій бані при частоті коливань 40 кГц при температурі 4050 °C для остаточної гомогенізації, з наступним перенесенням отриманої композиції до металевої, скляної або полімерної ємності, що має форму майбутнього імпланта, та залишаючи її на 1 добу для остаточного структурування. UA 86783 U (12) UA 86783 U UA 86783 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель, що пропонується, належить до галузі медицини та фармакології, зокрема до способів отримання біоінженерних імплантів на основі рослинних біодеградуючих полімерів, що містять біологічно активні високомолекулярні сполуки (поліпептиди, суміші поліпептидів або поліпептидні екстракти) здатні протягом певного часу дифундувати з полімерної матриці і надавати додатковий терапевтичний ефект у зоні знаходження імпланта. Відомі способи створення імплантів на основі біодеградуючих полімерних композицій з уповільненим виділенням біоактивного компоненту [1, 2]. Більшість з використовуваних біодеградуючих полімерів мають абіогенне походження - полікапролактон (капрон, найлон) [3], різноманітні поліестери [2], поліестери-співполімери на основі капролактаму і гліколіду [1], стирену і гліколевої кислоти [4], співполімери гліколевої і молочної кислоти [5]. Біодеградація таких полімерів призводить до отримання абіогенних напівпродуктів, що можуть викликати алергічну реакцію у пацієнтів з підвищеною індивідуальною чутливістю. Як правило, для досягнення необхідної в'язкості та щільності кінцевого продукту необхідним є додавання допоміжних компонентів - біоадгезивних добавок [6, 7], розріджувачів [6, 7], структуроутворюючих [3] та гелеутворюючих [7] полімерних компонентів. Це підвищує кількість напівпродуктів, що утворюються при біодеградації композицій, ускладнює і здорожує їх виготовлення. В деяких способах уповільненого виділення біологічно активних добавок - поліпептидів і протеїнів, досягають за рахунок їх хімічного зв'язування з абіогенними полімерами. В цьому випадку вивільнення активного компоненту відбувається разом з деградацією полімерної основи, і тому час виділення активного компонента визначається часом деградації полімерної основи та залежить від біологічного оточення імпланта або лікарської форми [1, 2]. Хімічне зв'язування, кон'югація пептидів є високотехнологічним і дорогим процесом. Крім цього конформація і, як наслідок, біологічна активність пептиду під час його хімічного зв'язування з полімерною основою може змінюватися. Існують також полімерні композиції з уповільненим виділенням біологічно активного компонента, що базуються на біогенних полімерах тваринного (рибний желатин) [8] або рослинного (целюлоза, альгінати) [6, 7, 9] походження. Також використовують модифіковані рослинні полімери - похідні целюлози [10]. На відміну від синтетичних полімерів, біогенні полімери мають задані, незмінні властивості, тому варіювання консистенції, або інших фізичних параметрів кінцевого продукту найчастіше досягається додаванням абіогенних компонентів. В протилежному випадку отриманий продукт використовують для уповільненої десорбції низькомолекулярних біоактивних сполук [6], крім того він має консистенцію неприйнятну для використання як імплантату [9]. Також вивільнення активного компонента може бути неконтрольованим і достатньо швидким [8]. Найближчим відомим аналогом до способу, що пропонується, є спосіб отримання композицій пролонгованого звільнення у вигляді імпланта [5], що полягає у створенні композиції шляхом введення біологічно активних компонентів (БАК) пептидного походження до біодеградуючої полімерної основи. За наведеним відомий способом [5] отримують імпланти на основі біодеградуючого співполімеру 70-80 % молочної (лактатної), і 20-30 % гліколевої (гліколятної) кислот - лактидногліколідний полімер - полілактилгліколід (ПЛГА), який містить різні біологічно активні компоненти пептидної будови. Імпланти, що отримані за найближчим аналогом [5], характеризуються простотою хімічного складу, що робить зазначений спосіб подібним до способу, що заявляється. Однак для способу [5] характерні наступні недоліки. 1. Основною імпланта є абіогенний співполімер ПЛГА. Синтез та очистка такого співполімеру є складним процесом, що призводить до здороження кінцевого продукту. Продукти розкладу ПЛГА - похідні гліколевої та молочної кислот мають власну біологічну активність, що може впливати на біохімічні процеси в зоні ураження, де використовують імплант. Треба також прийняти до уваги підвищену кислотність співполімеру, що в деяких випадках може провокувати подразнення тканин, що контактують з імплантом. 2. Біоактивні пептидні компоненти імпланта не утворюють однофазної чи хоча б колоїдної системи з полімерною основою. Тому водні розчини пептидного компонента або пептидної фракції піддають заморожуванню рідким азотом та ліофільній сушці, і далі, для підвищення ефективності імпланта за рахунок зростання активної поверхні пептидного компонента, тверді або попередньо ліофілізовані сухі пептиди далі піддають ультразвуковому диспергуванню. Диспергування проводять до досягнення частинками розмірів менше 10 мкм. Процедури ліофільної сушки та диспергування потребують спеціального коштовного обладнання, що здорожує продукт і ускладнює його виготовлення. 1 UA 86783 U 5 10 15 20 25 30 35 40 45 50 55 60 3. Об'єднання ПЛГА з біоактивними пептидами проводять внесенням останніх у розчин полімеру в дихлорметані та додаванням силіконового масла для мікрокапсулювання пептидів та їх коацервації. Отриману суміш виливають у гексан, де відбувається остаточне утворення капсул та їх осадження. Утворені капсули або коацервати з капсул фільтрують, сушать і отримують кінцевий продукт. З опису способу витікає необхідність використання великих об'ємів токсичних органічних в тому числі і хлоровмісних розчинників. Так для коацервації та осадження полімеру, що містить 0,35 г пептиду потрібні 2 л гептану; об'єм дихлорометану залежить від кількості ПЛГА і може сягати 2-3 л. Використання токсичних органічних розчинників ускладнює виготовлення кінцевого продукту, бо ця стадія потребує спеціальних умов для праці з токсичними речовинами. Виготовлення кінцевого продукту має проходити ще одну додаткову стадію - аналіз присутності в ньому слідів органічних розчинників та хлору. 4. Наявність мікрокапсул біологічно активного пептиду в полімерній основі, що є іншою фазою, не дозволяє виникненню дифузії його назовні. Тому вивільнення активного пептиду відбувається по мірі деградації полімеру, що може тривати протягом декількох місяців. Тобто, використання отриманих імплантатів не дає швидкої терапевтичної дії після їх встановлення. Другим наслідком мікрокапсулярної структури імпланта і його низької швидкості біодеградації є необхідність підвищувати вміст активного пептиду до 30 % маси і зменшувати розміри імплантів - до 0,8-1,2 мм у діаметрі при довжині у середньому до 3,5 см. Для формування таких імплантів використовують метод екструзії, що також ускладнює виготовлення кінцевого продукту. Таким чином, підсумовуючи вказані недоліки зазначеного способу [5], можна зробити висновок про підвищену складність виготовлення імплантів, необхідність використання спеціального коштовного обладнання, проведення хімічного аналізу отриманого продукту. Утворений імплант має низьку швидкість вивільнення біологічно активних компонентів. Крім цього в способі [5] не вказано про можливість стерилізації таких імплантів, що потребує додаткового їх дослідження перед використанням. В основу корисної моделі поставлено задачу удосконалення способу отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів, в якому шляхом змінення хімічного складу полімерного носія та за рахунок створення нової сукупності ознак, було б досягнуто спрощення процесу виготовлення імпланта та забезпечення оптимізації процесу вивільнення біологічно активних компонентів при використанні імпланта за призначенням. Для вирішення поставленої задачі в способі отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів [5], що полягає у створенні композиції шляхом введення біологічно активних компонентів пептидного походження до біодеградуючої полімерної основи, згідно з корисною моделлю, як біодеградуючу полімерну основу використовують біогенний полімер рослинного походження - натрієву сіль альгінової кислоти, до якої вводять розчин біологічно активних пептидних компонентів, перемішуючи їхз основою за допомогою механічної мішалки для пришвидшення процесу гелеутворення, а потім утримуючи протягом кількох годин в ультразвуковій бані при частоті коливань 40 кГц при температурі 40-50 °C для остаточної гомогенізації, з наступним перенесенням отриманої композиції до металевої, скляної або полімерної ємності, що має форму майбутнього імпланта, та залишаючи її на 1 добу для остаточного структурування. Найкраще, коли для приготування біодеградуючої полімерної основи до ізотонічного водного розчину з масовою часткою хлориду натрію 0,9 % додають 5-15 % альгінату натрію. Найкраще, коли масова частка біологічно активних пептидних компонентів у готовому імпланті не перевищує 3 %. Найкраще, коли як біологічно активні пептидні компоненти використовують екстракт поліпептидів із серця новонароджених поросят. Причому готовий імплант зберігають при температурі 3-5 °C. Крім цього перед використанням імплант стерилізують протягом 20 хвилин при температурі 110-115 °C у скляному посуді в паровому стерилізаторі. Спосіб, що пропонується, має наступні відмінності. 1. Альгінати є солями альгінової кислоті - полімеру біогенного, рослинного походження (виділяється з деяких сортів водоростей), який є полісахаридом, що піддається повній біодеградації. Завдяки цьому альгінати широко використовуються при виготовленні різних лікарських форм. Альгінати з водними розчинами в указаних у способі межах утворюють структурований гель, тому при виготовленні імплантів не потребуються такі допоміжні компоненти як гелеутворювачі чи пластифікатори. В результаті цього склад імпланта суттєво спрощується, і його виробництво здешевлюється. 2 UA 86783 U 5 10 15 20 25 30 35 40 45 50 55 2. Гелі альгінатів є проникними для високомолекулярних сполук, що забезпечує вивільнення біологічно-активного пептидного компонента за рахунок дифузії. Тому, на відміну від найближчого аналога, вихід біологічно активного компонента не залежить від швидкості деструкції полімерної основи імпланта. В способі, що пропонується, вивільнення пептидного компонента залежить від кількості альгінату в гелю, але воно ніяк не залежить від стану гелю і не пов'язано з механічними властивостями імпланта. В залежності від співвідношення альгінат: ізотонічний розчин при виготовленні гелю вихід пептидних компонентів може відбуватися за рахунок конвективної або молекулярної дифузії. В другому випадку виділення пептидів є нелінійним - перші 5-6 годин імплант виділяє велику кількість пептидних компонентів (інтенсивний вплив), а далі - більш низьку "підтримуючу" концентрацію останніх. Склад гелю в способі, що пропонується, забезпечує нелінійний вихід активних компонентів, що підвищує ефективність дії імпланта. 3. Гель, масова частка альгінату в якому складає більш ніж 5 %, є стійким при кімнатній температурі і є досить щільним, тому він дозволяє виробляти імпланти будь-якого розміру. При підвищенні температури до 37° пластичність гелю підвищується, і тому імплант поступово приймає форму лакуни, де він знаходиться. Це забезпечує максимальний контакт імпланта з тканинами. 4. Гелі вказаного складу є стійкими до стандартних умов стерилізації. При зменшенні кількості альгінату в гелі нижче вказаної норми, стійкість останнього до високих температур різко зменшується. 5. Кількість пептидних компонентів може змінюватися в залежності від їх біологічної активності, необхідної для пацієнта дози і т.д. Однак при масовій частці пептидних компонентів більше ніж 3 масових % динаміка молекулярної дифузії (тобто виходу цих компонентів з імпланта до тканин) порушується. Підсумовуючи доцільність використання наведених ознак корисної моделі, можна зробити висновок, що здійснення всіх цих ознак дозволяє спростити і здешевити виготовлення імпланта, який може мати будь-який розмір, приймає при використанні форму необхідну для максимального контакту з тканинами і витримує стандартні умові стерилізації. Вивільнення активних пептидних компонентів проходить нелінійно - на початку імплант виділяє високу "терапевтичну" концентрацію біологічно-активної речовини (або суміші речовин), а далі виділяє низьку "підтримуючу" концентрацію компонентів. Процес виділення не залежить від стану чи ступеню біодеградації гелю. Суть корисної моделі пояснюється прикладами. Приклад 1. Виготовлення імпланта з додаванням біоактивного компонента - екстракту поліпептидів з серця новонароджених поросят, що прискорює процеси загоєння ран і відновлення тканин [11]. Концентрований екстракт поліпептидів перемішують з ізотонічним розчином хлориду натрію в таких пропорціях, щоб отримати вміст біоактивного компоненту із розрахунку 100 мкг суми поліпептидів на 1 мл розчину. Для виготовлення 10 г гелю з масовою часткою альгінату 10 % беруть 9 мл отриманого, як описано вище, розчину екстракту поліпептидів та 1 г альгінату натрію. Суміш перемішують механічною мішалкою для пришвидшення процесу набухання полімеру та наступного гелеутворення. Після отримання гомогенного гелю, його тримають в ультразвуковій бані (40 кГц) протягом кількох годин при температурі 40-50 °C для виділення пузирів повітря та остаточної гомогенізації суміші. Швидкість гелеутворення та тривалість ультразвукової обробки гелю залежать від кількості альгінату. Зі зростанням вмісту альгінату в гелі час обробки підвищується. Гель переносять у металічну, скляну або полімерну ємність, що має форму майбутнього імпланта, та залишають на 1 добу для остаточного структурування гелю. Отриманий імплант зберігають при температурі 3-5 °C. Перед використанням імпланта його стерилізують протягом 20 хвилин при температурі 110115 °C бажано у скляній формі в паровому стерилізаторі. Приклад 2. Дослідження фізико-хімічних властивостей гелю для виготовлення імпланта в залежності від концентрації альгінату натрію. Гелі з різними кількостями альгінату натрію було отримано, як описано в прикладі 1. Фізикохімічні властивості гелів наведено в табл. 1. Дані свідчать, що гель з масовою часткою альгінату менш ніж 5 % має рідку або желеподібну консистенцію, завдяки чому отриманий імплант не утримує надану форму і не може бути використаний для потреб хірургії. 3 UA 86783 U 5 10 Постадійна екстракція біоактивного пептидного компонента ізотонічним розчином хлориду натрію з наступним кількісним аналізом концентрації пептиду в розчині [12] і подальшим математичним аналізом отриманих значень [13] дозволило встановити тип дифузії та оцінити ступінь масопереносу пептиду через поверхню гелю у зовнішнє середовище. Показник типу дифузії може змінюватися в межах від 1,0 (конвективна дифузія) до 0,5 (молекулярна дифузія). Як витікає з даних табл. 1, гелі з масовою часткою альгінатів від 0,5 до 2,5 % мають конвективний тип дифузії. В цьому випадку вивільнення біологічно активного компоненту відбувається лінійно в часі, а швидкість його виділення залежить від зовнішніх факторів, наприклад від швидкості локального кровообігу. У гелів, що містять більше ніж 5 % альгінату, показник змінюється в межах 0,5-0,7, що характерно для переважно молекулярного механізму дифузії. В цьому разі кількість виділеного пептидного компонента є високою на початку, але потім поступового зменшується. Це дозволяє імпланту надавати початковий інтенсивний терапевтичний ефект, а з часом, виділяти більш низькі "підтримуючі" дози компонента. 15 Таблиця 1 Фізико-хімічні властивості гелів в залежності від концентрації альгінату натрію Масова частка альгінату, % 0,5 1,0 2,5 Консистенція Рідка Желеподібна Здатність утримувати Форма не зберігається форму імпланта Показник типу дифузії 0,900 0,847 0,886 Показник масопереносу 1,74 1,75 1,81 6 2 (×10 ), кг/с 20 25 30 35 5,0 7,0 10,0 Тверда легко деформуюча Форма утримується 0,726 0,687 0,536 1,74 1,70 1,10 Показник масопереносу для гелів з масовою часткою альгінату 0,5-2,5 % складає 1,7-1,8 2 кг/с і не залежить від складу гелю. Для гелів з масовою часткою 5,0-20,0 % цей показник 2 змінюється від 1,7 до 0,8 кг/с , тому динаміку вивільнення біоактивного компонента з імпланта можна регулювати кількісним складом гелю. Приклад 3. Кількісні характеристики імпланта в біологічних об'єктах Для дослідження поведінки імпланта в біологічних об'єктах було виготовлено гель з масовою часткою альгінату 20 %, що містить замість біологічно-активного компонента флуоресціюючий пептид фікоеритрин з емісію при довжині хвиль 570 нм. Отриманий, як в прикладі 1, імплант занурювали в m. gluteus щурам-самцям лінії Вістар в міжфасціальні простори на глибину 1 см з подальшим закриттям операційної рани шкіряним клаптем. Далі, через певний проміжок часу імплант видаляли з м'язу і аналізували залишковий вміст пептиду у гелю за інтенсивністю флуоресценції його розчину (після розчинення імпланта у надлишку води). Результати випробування наведені у табл. 2 та на ілюстрації, де графічно зображена залежність виходу біоактивного пептидного компонента з імпланта від тривалості знаходження імпланта в м'язі щура. Дані в табл. 2, а також графік показують, що протягом перших шести годин відбувається швидке виділення поліпептиду з приблизно однаковою швидкістю 8-9 % БАК за годину. Далі вихід поліпептиду знижується і протікає зі швидкістю 0,2-0,3 % за годину. При видаленні гелю з м'язу було відмічено, що за 12 годин завдяки підвищенню температури м'яза та його рухливій активності імпланти повністю прийняли форму, що відповідає розміщенню тканин м'язу. Було також встановлено, що імплант, в якому масова частка альгінату складає граничну вартість - 5 %, змінює свою форму протягом 2-3 годин. 4 UA 86783 U Таблиця 2 Динаміка вивільнення пептидного компонента з імпланта Тривалість знаходження імпланта у м'язі, годин Залишок пептиду у гелю після видалення імпланта, % Вихід пептиду з імпланта, % 5 10 15 20 25 30 0 1 3 6 12 24 100,00 98,57 75,92 55,61 49,09 48,89 0,00 1,43 24,08 44,39 50,91 51,11 Приклад 4. Вплив стерилізації на властивості імпланта. Стерилізація була проведена в стандартних умовах - протягом 20 хвилин при температурі 110-115 °C у скляній формі в паровому стерилізаторі. Для порівняння були використані гелі з екстрактом поліпептидів з серця новонароджених поросят, в яких масова частка альгінату складала 0,5 % та 5,0. Приготування гелів описано в прикладі 1. Після стерилізації для обох гелів були отримані показники масопереносу (див. приклад 2). Також показники масопереносу були визначені для відповідних гелів, що не зазнавали процедури стерилізації. Було встановлено, що для гелю, в якому масова частка альгінату складає 5,0 %, показник -6 -6 2 масопереносу до і після стерилізації складає 1,94×10 і 1,67×10 кг/с , відповідно. Таким чином, швидкість вивільнення поліпептидного екстракту після стерилізації дещо зменшується, що пояснюється зміцненням альгінатного скелету гелю. У випадку гелю, в якому масова частка -6 2 альгінату складає 0,5 %, показник масопереносу зростає у 5,5 разів - від 1,74×10 кг/с (до -6 2 стерилізації) до 9,66×10 кг/с (після стерилізації), що може пояснюватися протилежним процесом - деструкцією гелю. Таким чином, гелі, що містять малі кількості альгінатів не витримують процедури стерилізації. Гелі, що містять 5 % альгінатів (нижча межа концентрації альгінатів, що пропонується у способі корисної моделі) витримують процедуру стерилізації без значних змін показників переносу. Приклад 5. Порівняння характеристик запропонованого способу та найближчого аналога. Порівняльні характеристики запропонованого способу отримання імплантів і найближчого аналога підсумовані у табл. 3. Порівняльні характеристики імплантів, виготовлених за способом, що пропонується, та за найближчим аналогом наведено у табл. 4. Дані, наведені у табл. 3, свідчать про те що спосіб, що пропонується, є простішим, ніж найближчий аналог, для виготовлення імпланта потрібні легкодоступні природні полімери, полімерна основа імпланта формується простим гелеутворенням без використання органічних розчинників і емульгаторів. Отриманий імплант піддається стерилізації при стандартних умовах і не потребує додаткового хімічного контролю на вміст токсичних, в тому числі й хлоровмісних, розчинників. Таблиця 3 Порівняльні характеристики способів виготовлення імплантів Показник Спосіб, що пропонується Найближчий аналог Абіогенний, біодеградуючий співполімер молочної і гліколевої кислот 1. Природа полімерної Біогенний, біодеградуючий основи гель солі альгінової кислоти 2. Доступність полімеру Загальнодоступний природний полімер, що виділяють з водоростей. Синтетичний співполімер. 3. Стан БАК в полімерній основі Гомогенна система Гетерогенна система 5 UA 86783 U Продовження таблиці 3 4. 5. Приготування композиції 6. Умови стерилізації 7. 5 Введення БАК в полімерну основу Умови контролю хімічної безпеки Замороження рідким азотом, Розчинення у ізотонічному низькотемпературна ліофільна сушка розчині хлориду натрію разом та наступне диспергування БАК у з полімером розчині співполімеру в органічному розчиннику Утворення мікрокапсул або Механічне та ультразвукове коацерватів пептидного компонента з перемішування суміші підчас додаванням силіконового масла. гелеутворення Переливання суміші в гексан, осадження і фільтрація мікрокапсул Стандартні Не визначені. Необхідним є аналіз слідів органічних Не потрібні розчинників, а також хлоровмісної органіки Дані в табл. 4 показують, що імплант, отриманий запропонованим способом, може бути будь-якої форми і розміру, біоактивний компонент виділяється з перемінною швидкістю спочатку в терапевтичних, потім у підтримуючих дозах і не залежить від ступеня і швидкості біодеградації полімерної матриці. Швидкість виділення біоактивного компонента може регулюватися на стадії виготовлення імпланта шляхом зміни концентрації альгінату натрію у розчині. Длярегулювання швидкості виділення біоактивного компонента у способі найближчому аналога потрібним є синтез нового співполімеру з іншим співвідношенням фрагментів молочної та гліколевої кислот. 10 Таблиця 4 Порівняльні характеристики імплантів виготовлених за способом, що пропонується, та за найближчим аналогом 1. Показник Структура імпланта Спосіб, що пропонується Желеподібна 2. Форма і розміри імпланта Будь-які 3. 4. 5. 15 20 Шляхом молекулярної дифузії незалежно від Виділення пептидного БАК біодеградації полімерної матриці Після 5-6 годин від початку використання імпланта Швидкість виділення масова частка компонента пептидного компонента дорівнює 8-9 % за годину, відповідно, через 12 годин 0,2-0,3 % за годину Найближчий аналог Агрегат мікрокапсул Ниткоподібні - 0,8-1,2 мм у діаметрі при довжині у середньому до 3,5 см Шляхом біодеградації полімеру, одночасно з біодеградацією полімеру Протягом днів або тижнів в залежності від швидкості біодеградації полімерної матриці Синтезом нового Зміна швидкості виділення Шляхом зміни масової частки співполімеру з іншим пептидного компонента альгінатів при гелеутворенні співвідношенням мономерів молочної і гліколевої кислот Джерела інформації: 1. Патент RU № 2237681, C08G63/08, C08G63/64, А61К47/48, 2000. - Ионные молекулярные коньюгаты биодеградируемых сложных полиэфиров и биоактивных полипептидов. 2. Патент RU № 2456018, А61К38/00, А61К47/48, 2007. Фармацевтические композиции для доставки пептидов с замедленным высвобождением. 3. Патент RU № 2318535, А61К38/43, А61К47/30, 61Р31/04, 2006. - Биологически активная полимерная композиция. 4. Патент RU № 2230550, А61К9/22, А61К47/12, А61К47/30, 1999. - Композиции длительного высвобождения, способ их получения и применение. 6 UA 86783 U 5 10 15 20 5. Патент RU № 2198678, А61К38/00, А61К38/09, А61К47/30, А61К9/52, А61К9/16, А61К 9/19, A61L 27/14, 1998. - Композиции пролонгированного высвобождения и способ их получения. 6. Патент RU № 2420267, А61К9/22, А61К45/08, А61К31/522, А61К31/4468, А61К31/4178, А61К47/04, А61К47/30, А61К47/36, А61К47/42, А61Р31/12, 2007. - Биоадгезивный носитель с замедленным высвобождением для слизистых оболочек, предназначенный для доставки активных компонентов. 7. Патент US № 4792452А, А61К9/22, А61К9/20, А61К47/38, А61К47/00, А61К9/28, 1988. Controlled release formulation. 8. Патент RU № 2242969, A61K9/20, A61K47/42, 2000. - Быстродиспергируемые лекарственные формы, содержащие рыбий желатин. 9. Патент RU № 2476235, А61К38/36, А61К31/734, А61К9/14, 2009. - Композиции на основе биосовместимых микрочастиц альгиновой кислоты, предназначенные для регулируемого высвобождения активных ингредиентов при внутривенном введении. 10. Патент RU № 2285519, А61К9/26, А61К31/496, А61К45/06, A61K47/38, 61P9/00, A61P25/00 Фармацевтическая композиция с пролонгированным высвобождением, независимым от ионной силы. 11. Патент UA № 64381, А61К35/12, 2003. - Спосіб отримання екстрактів ксеногенних органів. 12. Патент SU № 1776351, G01N33/02, 1991. - Способ определения пчелиного маточного молочка в фармацевтических препаратах и медопродуктах. 13. Новый справочник химика и технолога. Процессы и аппараты химических технологий. Ч.1. / под ред. Б.П. Никольского. - СПб.: АНО "Профессионал", 2004. - 848 с. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 25 30 35 40 45 1. Спосіб отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів, що полягає у створенні композиції шляхом введення біологічно активних компонентів пептидного походження до біодеградуючої полімерної основи, який відрізняється тим, що як біодеградуючу полімерну основу використовують біогенний полімер рослинного походження - натрієву сіль альгінової кислоти, до якої вводять розчин біологічно активних пептидних компонентів, перемішуючи за допомогою механічної мішалки для пришвидшення процесу гелеутворення, а потім утримуючи протягом кількох годин в ультразвуковій бані при частоті коливань 40 кГц при температурі 40-50 °C для остаточної гомогенізації, з наступним перенесенням отриманої композиції до металевої, скляної або полімерної ємності, що має форму майбутнього імпланта, та залишаючи її на 1 добу для остаточного структурування. 2. Спосіб за п. 1, який відрізняється тим, що для приготування біодеградуючої полімерної основи до ізотонічного розчину з масовою часткою хлориду натрію 0,9 % додають 5-15 % альгінату натрію. 3. Спосіб за п. 1 або 2, який відрізняється тим, що масову частку біологічно активних пептидних компонентів у готовому імпланті доводять до 3 %. 4. Спосіб за п. 3, який відрізняється тим, що як біологічно активні пептидні компоненти використовують екстракт поліпептидів із серця новонароджених поросят. 5. Спосіб за пп. 1-4, який відрізняється тим, що готовий імплант зберігають при температурі 35 °C. 6. Спосіб за пп. 1-5, який відрізняється тим, що перед використанням імплант стерилізують протягом 20 хвилин при температурі 110-115 °C у скляному посуді в паровому стерилізаторі. 7 UA 86783 U Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюRoshal Oleksandr Davydovych, Chyzh Mykola Oleksiiovych, Sandomyrskyi Borys Petrovych
Автори російськоюРошаль Александр Давидович, Чиж Николай Алексеевич, Сандомирский Борис Петрович
МПК / Мітки
МПК: A61L 27/00, A61K 38/02, A61K 38/17
Мітки: компонентів, біологічно, звільненням, пептидних, імпланта, спосіб, отримання, пролонгованим, активних
Код посилання
<a href="https://ua.patents.su/10-86783-sposib-otrimannya-implanta-z-prolongovanim-zvilnennyam-biologichno-aktivnikh-peptidnikh-komponentiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання імпланта з пролонгованим звільненням біологічно активних пептидних компонентів</a>
Попередній патент: Спосіб електрохімічного синтезу порошку цинку високої частоти
Наступний патент: Спосіб корекції стану глутатіонової системи антиоксидантного захисту у молодняку великої рогатої худоби при гострому нітратно-нітритному токсикозі
Випадковий патент: Спосіб ремедіації ґрунту