Пегильований ліпосомальний доксорубіцин в комбінації з ектеїнасцидином 743 (ecteinescidin 743)
Номер патенту: 87877
Опубліковано: 25.08.2009
Автори: Жилль Ерар, ван де Вельде Хельгі, Тайтельбаум Ейпріл, Стернас Ларс-Аксель, Тріфан Овід
Формула / Реферат
1. Спосіб лікування організму людини від ракового захворювання, який включає введення терапевтично ефективної кількості пегильованої ліпосомальної форми антрацикліну доксорубіцину (PLD), в комбінації з терапевтично ефективною кількістю ЕТ-743.
2. Спосіб за п. 1, де вказані терапевтично ефективні кількості ЕТ-743 і PLD вводять як частину одного і того ж лікарського засобу.
3. Спосіб за п. 1, де вказані терапевтично ефективні кількості ЕТ-743 і PLD надають у вигляді окремих лікарських засобів для введення в різний час.
4. Спосіб за п. 3, де вказану терапевтично ефективну кількість PLD вводять перед введенням вказаної терапевтично ефективної кількості ЕТ-743.
5. Спосіб за п. 2, де вказані терапевтично ефективні кількості PLD і ЕТ-743 вводять шляхом внутрішньовенної ін'єкції.
6. Спосіб за п. 3, де вказані терапевтично ефективні кількості PLD і ЕТ-743 вводять шляхом внутрішньовенної ін'єкції.
7. Спосіб за п. 4, де вказані терапевтично ефективні кількості PLD і ЕТ-743 вводять шляхом внутрішньовенної ін'єкції.
8. Спосіб за п. 7, де час інфузії для внутрішньовенної ін'єкції складає аж до 6 годин для вказаної терапевтично ефективної кількості PLD і аж до 24 годин для вказаної терапевтично ефективної кількості ЕТ-743.
9. Спосіб за п. 8, де час інфузії для внутрішньовенної ін'єкції складає 1-2 години для вказаної терапевтично ефективної кількості PLD і близько 3 годин для вказаної терапевтично ефективної кількості ЕТ-743.
10. Спосіб за п. 7, де інфузії проводять з інтервалом від 3 до 4 тижнів.
11. Спосіб за п. 8, де інфузії проводять з інтервалом від 3 до 4 тижнів.
12. Спосіб за п. 9, де інфузії проводять з інтервалом від 3 до 4 тижнів.
13. Спосіб за будь-яким з пп. 1-12, де терапевтично ефективну кількість PLD вводять в дозі до 50 мг/м2 з подальшим введенням терапевтично ефективної кількості ЕТ-743 в дозі до 1,3 мг/м2.
14. Спосіб за п. 13, де вказану терапевтично ефективну кількість PLD вводять в дозі 30-40 мг/м2 за час інфузії 1-2 години з подальшим введенням терапевтично ефективної кількості ЕТ-743 в дозі приблизно 1,1 мг/м2 за час інфузії близько 3 годин.
15. Спосіб за п. 14, де вказану терапевтично ефективну кількість PLD вводять в дозі приблизно 30 мг/м2 за час інфузії близько 1 години з подальшим введенням вказаної терапевтично ефективної кількості ЕТ-743 в дозі приблизно 1,1 мг/м2 за час інфузії близько 3 годин.
16. Спосіб за п. 13, де пацієнт страждає раковим захворюванням, вибраним з саркоми м'яких тканин і раку голови та шиї.
17. Спосіб за п. 13, де пацієнт має рак яєчників.
18. Спосіб за п. 14, де пацієнт страждає раковим захворюванням, вибраним з саркоми м'яких тканин і раку голови та шиї.
19. Спосіб за п. 14, де пацієнт має рак яєчників.
20. Спосіб за п. 15, де пацієнт страждає раковим захворюванням, вибраним з саркоми м'яких тканин та раку голови та шиї.
21. Спосіб за п. 15, де пацієнт має рак яєчників.
22. Застосування ЕТ-743 для одержання лікарського засобу для ефективного лікування організму людини від ракового захворювання за допомогою комбінованої терапії з використанням ЕТ-743 з пегильованою ліпосомальною формою антрацикліну доксорубіцину (PLD).
23. Застосування PLD для одержання лікарського засобу для ефективного лікування організму людини від ракового захворювання за допомогою комбінованої терапії з використанням PLD з ЕТ-743.
24. Застосування за п. 22, де комбінація ЕТ-743 з PLD є синергічною.
25. Застосування за п. 23, де комбінація ЕТ-743 з PLD є синергічною.
26. Застосування за будь-яким з пп. 22-25, де ЕТ-743 утворює частину того ж лікарського засобу або надається у вигляді окремого лікарського засобу для введення в один і той же час або в різний час з PLD.
27. Застосування за п. 26, де пацієнт страждає раковим захворюванням, вибраним з саркоми м'яких тканин, раку яєчників і раку тканин голови і шиї.
28. Композиція для лікування організму людини від ракового захворювання, що містить ЕТ-743 і PLD, яка є ефективною при зниженій токсичності в порівнянні з токсичністю, що спостерігається при використанні комбінації ЕТ-743 і доксорубіцину.
29. Медичний набір для введення ЕТ-743 в комбінації з PLD, який включає ЕТ-743 в лікарських формах щонайменше для одного циклу, де лікарська форма містить відповідну кількість ЕТ-743 для встановленого лікування і фармацевтично прийнятний носій, і друковані інструкції з прийому ЕТ-743 відповідно до режиму дозування.
30. Спосіб підвищення протипухлинної ефективності ЕТ-743 при лікуванні організму людини від ракового захворювання, який включає введення терапевтично ефективної кількості ЕТ-743 в комбінації з терапевтично ефективною кількістю PLD.
31. Спосіб максимального збільшення переносимої дози ЕТ-743 при лікуванні організму людини від ракового захворювання, який включає введення терапевтично ефективної кількості ЕТ-743 в комбінації з пегильованою ліпосомальною формою антрацикліну доксорубіцину (PLD).
32. Медичний набір для введення ЕТ-743 в комбінації з PLD, який включає доставку ЕТ-743 в лікарських формах, де кожна з вказаних лікарських форм містить кількість ЕТ-743 для його терапевтично ефективного введення в комбінації з PLD.
33. Медичний набір для введення PLD в комбінації з ЕТ-743, який включає доставку PLD в лікарських формах, де кожна з вказаних лікарських форм містить кількість PLD для його терапевтично ефективного введення в комбінації з ЕТ-743.
34. Медичний набір для введення ЕТ-743 в комбінації з PLD, який включає як доставку ЕТ-743 згідно з п. 32, так і PLD згідно з п. 33.
35. Медичний набір за п. 32 або п. 34, який додатково містить інструкції по введенню ЕТ-743 відповідно до режиму дозування.
36. Медичний набір за п. 33 або п. 34, який додатково містить інструкції по введенню PLD відповідно до режиму дозування.
37. Комбінація для лікування організму людини від ракового захворювання, яка містить терапевтично ефективні кількості ЕТ-743 і PLD, які є частиною одного лікарського засобу або надаються у вигляді окремих лікарських засобів для введення в один і той же час або в різний час.
38. Комбінація за п. 37, де вказані терапевтично ефективні кількості ЕТ-743 і PLD надаються у вигляді окремих лікарських засобів для введення в один і той же час або в різний час.
39. Комбінація за п. 38, де вказані терапевтично ефективні кількості ЕТ-743 і PLD надаються у вигляді окремих лікарських засобів для введення в різний час.
40. Комбінація за п. 39, де вказану ефективну кількість PLD вводять перед введенням вказаної терапевтично ефективної кількості ЕТ-743.
41. Комбінація за будь-яким з пп. 37-40, де вказані терапевтично ефективні кількості PLD і ЕТ-743 вводять шляхом внутрішньовенної ін'єкції.
Текст
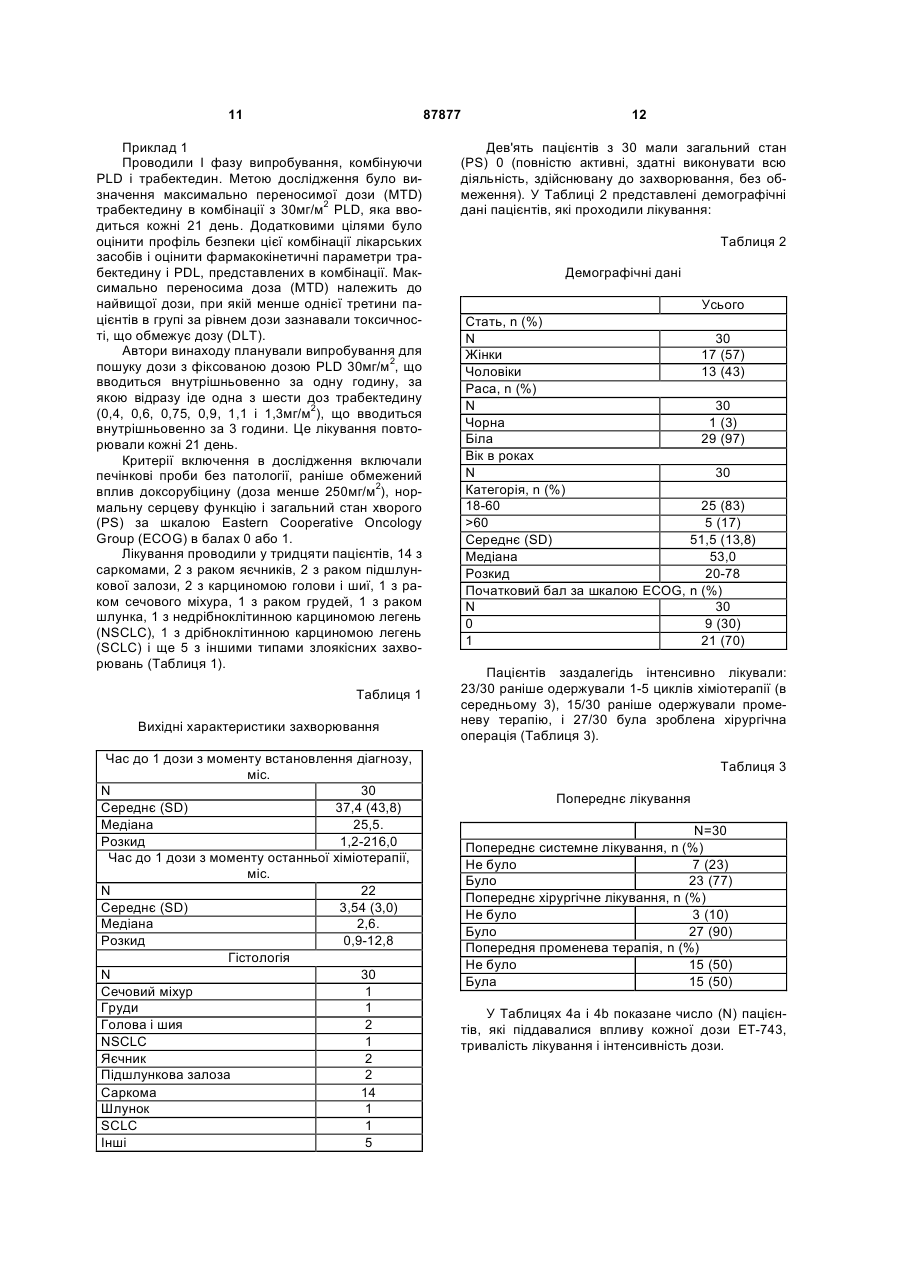
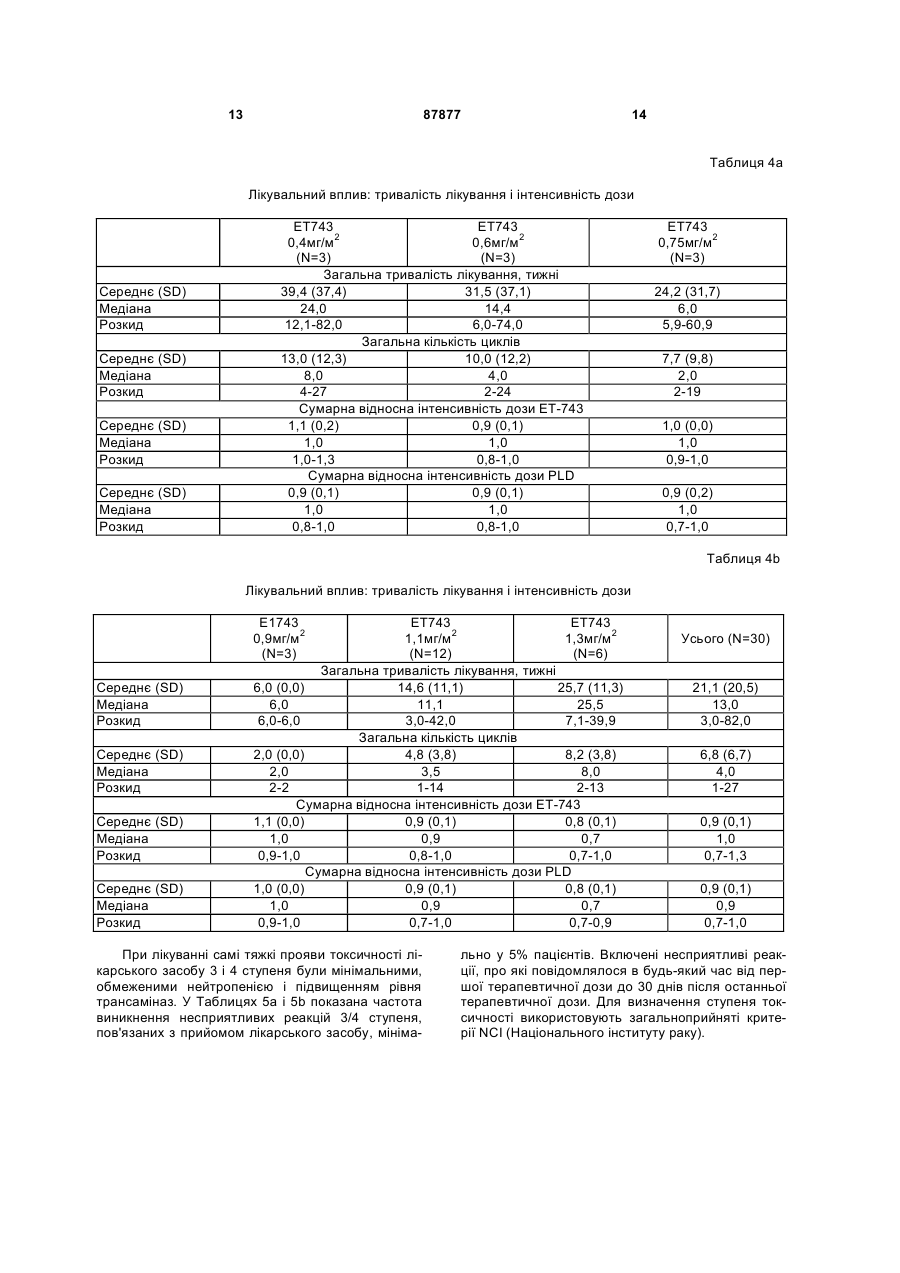
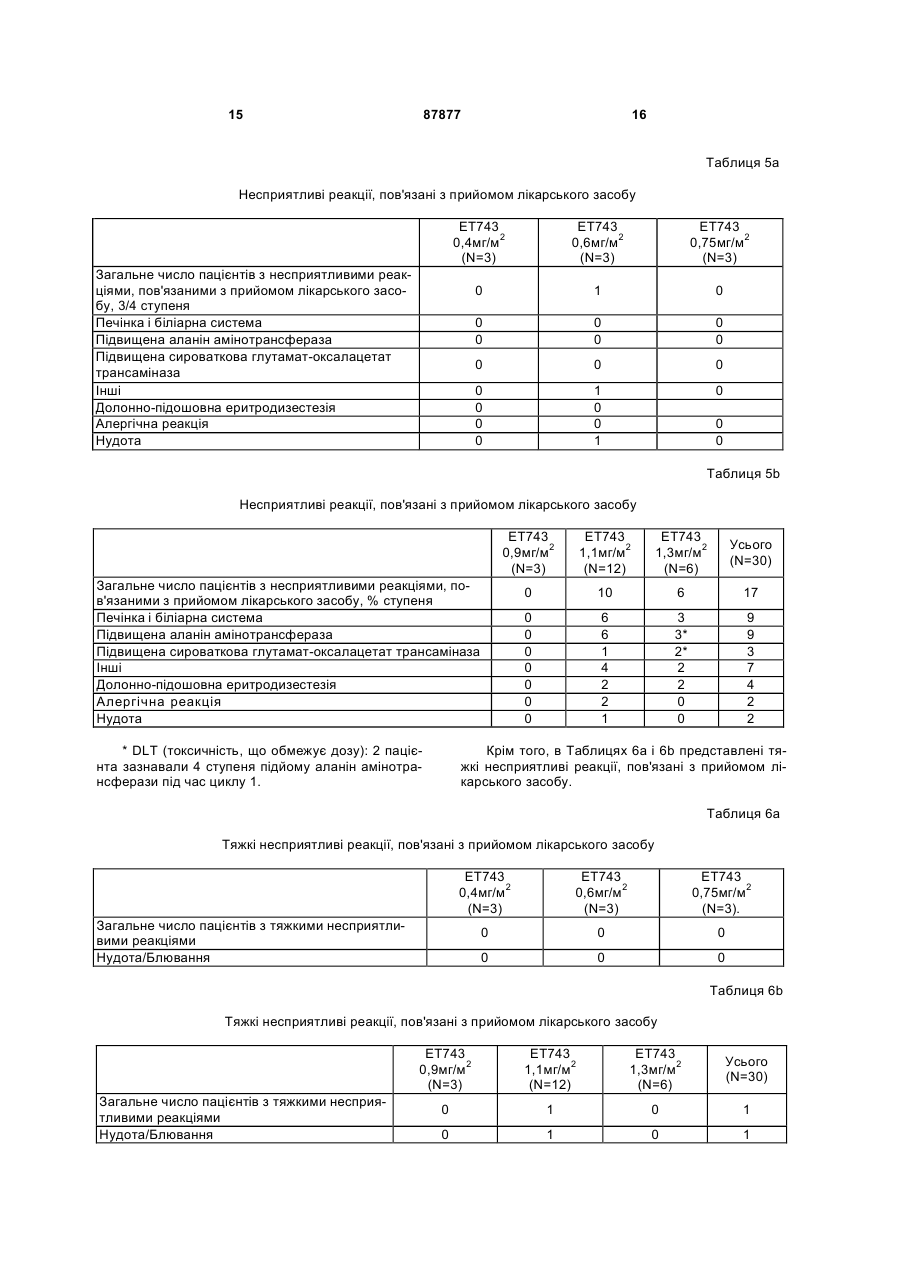
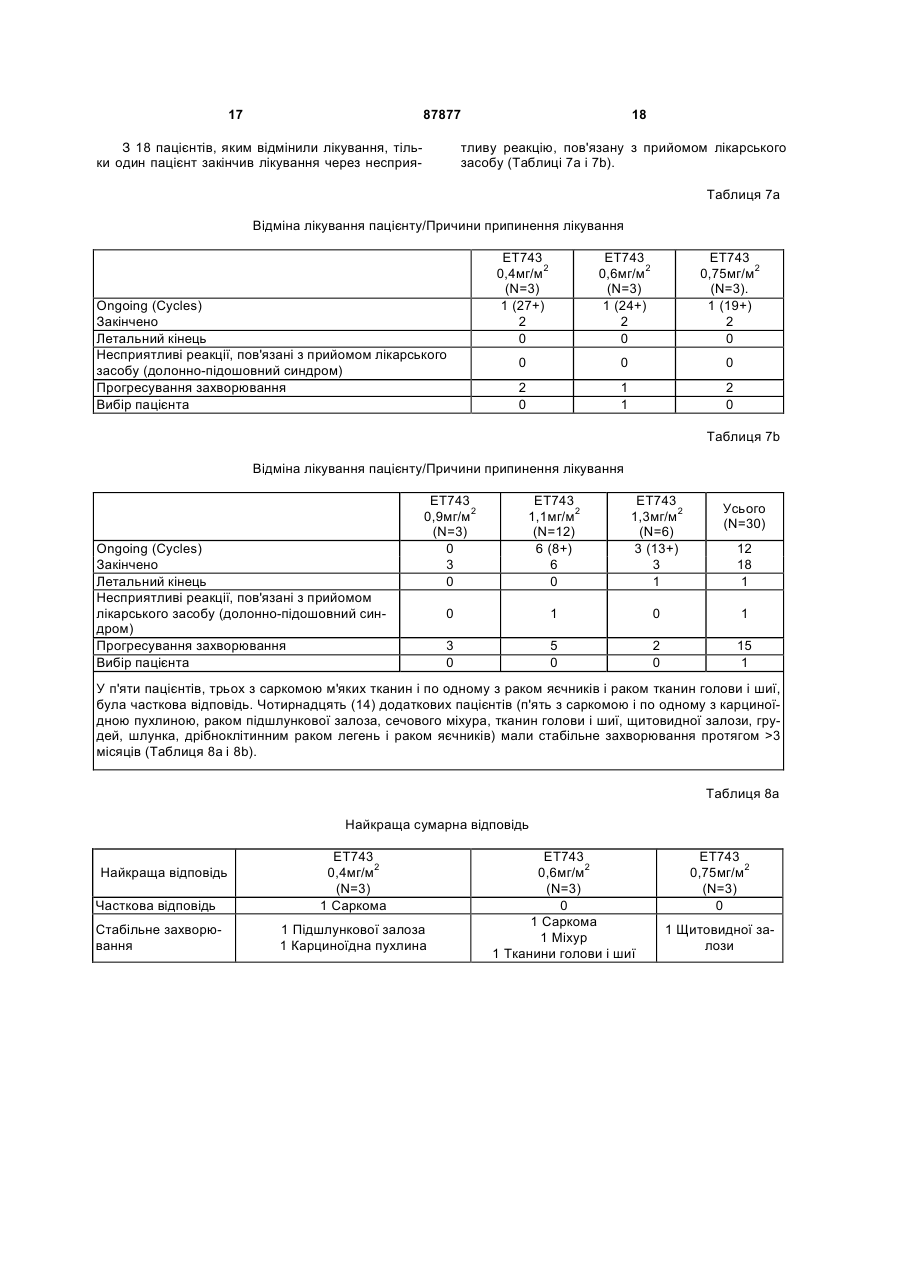
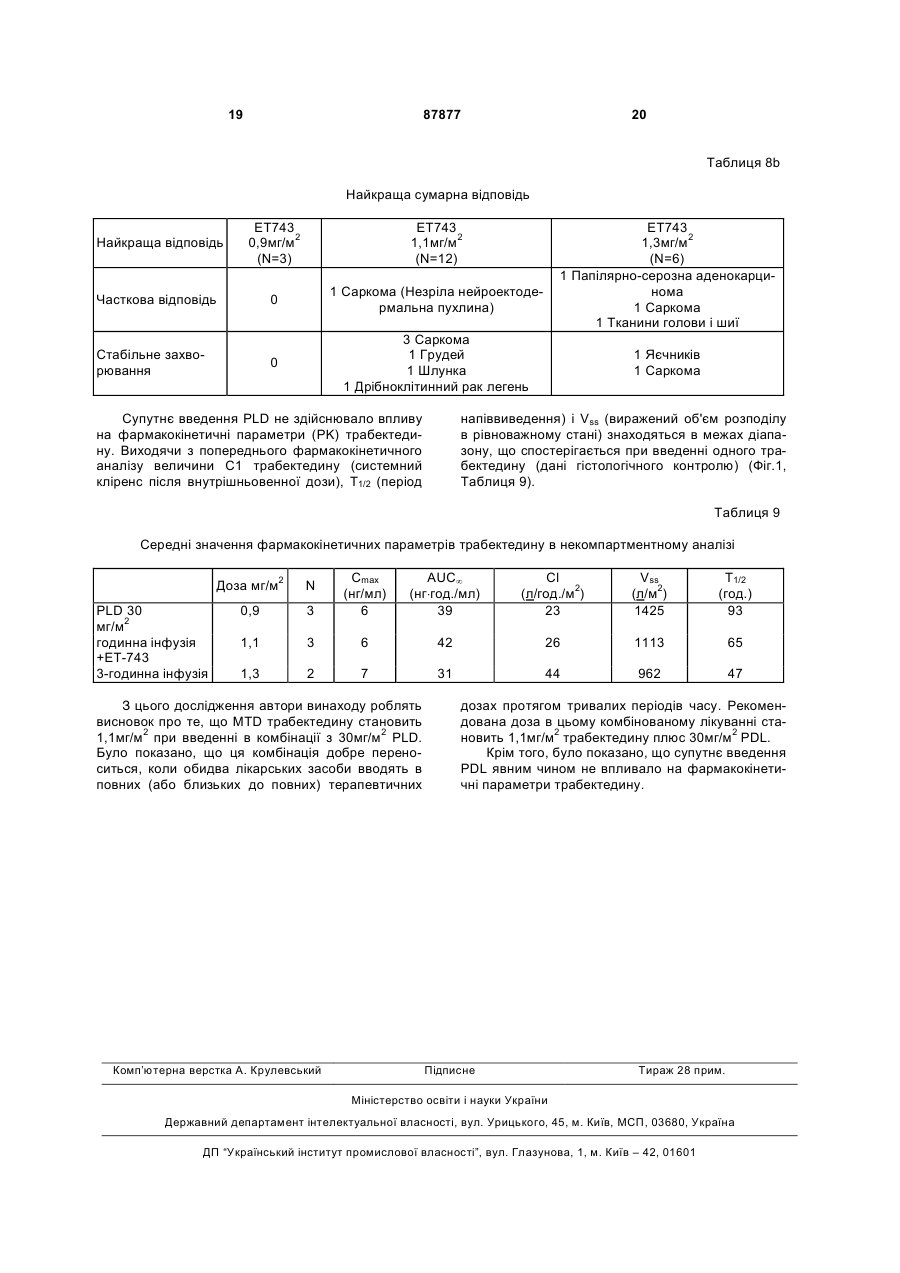
Чоловіки 13 (43) Раса, n (%) N 30 Чорна 1 (3) Біла 29 (97) Вік в роках N 30 Категорія, n (%) 18-60 25 (83) >60 5 (17) Середнє (SD) 51,5 (13,8) Медіана 53,0 Розкид 20-78 Початковий бал за шкалою ECOG, n (%) N 30 0 9 (30) 1 21 (70) Пацієнтів заздалегідь інтенсивно лікували: 23/30 раніше одержували 1-5 циклів хіміотерапії (в середньому 3), 15/30 раніше одержували променеву терапію, і 27/30 була зроблена хірургічна операція (Таблиця 3). Таблиця 3 Попереднє лікування N=30 Попереднє системне лікування, n (%) Не було 7 (23) Було 23 (77) Попереднє хірургічне лікування, n (%) Не було 3 (10) Було 27 (90) Попередня променева терапія, n (%) Не було 15 (50) Була 15 (50) У Таблицях 4а і 4b показане число (N) пацієнтів, які піддавалися впливу кожної дози ЕТ-743, тривалість лікування і інтенсивність дози. 13 87877 14 Таблиця 4а Лікувальний вплив: тривалість лікування і інтенсивність дози Середнє (SD) Медіана Розкид Середнє (SD) Медіана Розкид Середнє (SD) Медіана Розкид Середнє (SD) Медіана Розкид ЕТ743 ЕТ743 0,4мг/м2 0,6мг/м2 (N=3) (N=3) Загальна тривалість лікування, тижні 39,4 (37,4) 31,5 (37,1) 24,0 14,4 12,1-82,0 6,0-74,0 Загальна кількість циклів 13,0 (12,3) 10,0 (12,2) 8,0 4,0 4-27 2-24 Сумарна відносна інтенсивність дози ЕТ-743 1,1 (0,2) 0,9 (0,1) 1,0 1,0 1,0-1,3 0,8-1,0 Сумарна відносна інтенсивність дози PLD 0,9 (0,1) 0,9 (0,1) 1,0 1,0 0,8-1,0 0,8-1,0 ЕТ743 0,75мг/м2 (N=3) 24,2 (31,7) 6,0 5,9-60,9 7,7 (9,8) 2,0 2-19 1,0 (0,0) 1,0 0,9-1,0 0,9 (0,2) 1,0 0,7-1,0 Таблиця 4b Лікувальний вплив: тривалість лікування і інтенсивність дози Е1743 0,9мг/м2 (N=3) Середнє (SD) Медіана Розкид Середнє (SD) Медіана Розкид Середнє (SD) Медіана Розкид Середнє (SD) Медіана Розкид ЕТ743 ЕТ743 1,1мг/м2 1,3мг/м2 (N=12) (N=6) Загальна тривалість лікування, тижні 6,0 (0,0) 14,6 (11,1) 25,7 (11,3) 6,0 11,1 25,5 6,0-6,0 3,0-42,0 7,1-39,9 Загальна кількість циклів 2,0 (0,0) 4,8 (3,8) 8,2 (3,8) 2,0 3,5 8,0 2-2 1-14 2-13 Сумарна відносна інтенсивність дози ЕТ-743 1,1 (0,0) 0,9 (0,1) 0,8 (0,1) 1,0 0,9 0,7 0,9-1,0 0,8-1,0 0,7-1,0 Сумарна відносна інтенсивність дози PLD 1,0 (0,0) 0,9 (0,1) 0,8 (0,1) 1,0 0,9 0,7 0,9-1,0 0,7-1,0 0,7-0,9 При лікуванні самі тяжкі прояви токсичності лікарського засобу 3 і 4 ступеня були мінімальними, обмеженими нейтропенією і підвищенням рівня трансаміназ. У Таблицях 5а і 5b показана частота виникнення несприятливих реакцій 3/4 ступеня, пов'язаних з прийомом лікарського засобу, мініма Усього (N=30) 21,1 (20,5) 13,0 3,0-82,0 6,8 (6,7) 4,0 1-27 0,9 (0,1) 1,0 0,7-1,3 0,9 (0,1) 0,9 0,7-1,0 льно у 5% пацієнтів. Включені несприятливі реакції, про які повідомлялося в будь-який час від першої терапевтичної дози до 30 днів після останньої терапевтичної дози. Для визначення ступеня токсичності використовують загальноприйняті критерії NCI (Національного інституту раку). 15 87877 16 Таблиця 5а Несприятливі реакції, пов'язані з прийомом лікарського засобу ЕТ743 0,4мг/м2 (N=3) ЕТ743 0,6мг/м2 (N=3) ЕТ743 0,75мг/м2 (N=3) 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 Загальне число пацієнтів з несприятливими реакціями, пов'язаними з прийомом лікарського засобу, 3/4 ступеня Печінка і біліарна система Підвищена аланін амінотрансфераза Підвищена сироваткова глутамат-оксалацетат трансаміназа Інші Долонно-підошовна еритродизестезія Алергічна реакція Нудота 0 0 Таблиця 5b Несприятливі реакції, пов'язані з прийомом лікарського засобу ЕТ743 0,9мг/м2 (N=3) ЕТ743 1,1мг/м2 (N=12) ЕТ743 1,3мг/м2 (N=6) Усього (N=30) 0 10 6 17 0 0 0 0 0 0 0 6 6 1 4 2 2 1 3 3* 2* 2 2 0 0 9 9 3 7 4 2 2 Загальне число пацієнтів з несприятливими реакціями, пов'язаними з прийомом лікарського засобу, % ступеня Печінка і біліарна система Підвищена аланін амінотрансфераза Підвищена сироваткова глутамат-оксалацетат трансаміназа Інші Долонно-підошовна еритродизестезія Алергічна реакція Нудота * DLT (токсичність, що обмежує дозу): 2 пацієнта зазнавали 4 ступеня підйому аланін амінотрансферази під час циклу 1. Крім того, в Таблицях 6а і 6b представлені тяжкі несприятливі реакції, пов'язані з прийомом лікарського засобу. Таблиця 6а Тяжкі несприятливі реакції, пов'язані з прийомом лікарського засобу ЕТ743 0,4мг/м2 (N=3) ЕТ743 0,6мг/м2 (N=3) ЕТ743 0,75мг/м2 (N=3). 0 0 0 0 0 0 Загальне число пацієнтів з тяжкими несприятливими реакціями Нудота/Блювання Таблиця 6b Тяжкі несприятливі реакції, пов'язані з прийомом лікарського засобу ЕТ743 0,9мг/м2 (N=3) Загальне число пацієнтів з тяжкими несприятливими реакціями Нудота/Блювання ЕТ743 1,1мг/м2 (N=12) ЕТ743 1,3мг/м2 (N=6) Усього (N=30) 0 1 0 1 0 1 0 1 17 87877 З 18 пацієнтів, яким відмінили лікування, тільки один пацієнт закінчив лікування через несприя 18 тливу реакцію, пов'язану з прийомом лікарського засобу (Таблиці 7а і 7b). Таблиця 7а Відміна лікування пацієнту/Причини припинення лікування Ongoing (Cycles) Закінчено Летальний кінець Несприятливі реакції, пов'язані з прийомом лікарського засобу (долонно-підошовний синдром) Прогресування захворювання Вибір пацієнта ЕТ743 0,4мг/м2 (N=3) 1 (27+) 2 0 ЕТ743 0,6мг/м2 (N=3) 1 (24+) 2 0 ЕТ743 0,75мг/м2 (N=3). 1 (19+) 2 0 0 0 0 2 0 1 1 2 0 Таблиця 7b Відміна лікування пацієнту/Причини припинення лікування Ongoing (Cycles) Закінчено Летальний кінець Несприятливі реакції, пов'язані з прийомом лікарського засобу (долонно-підошовний синдром) Прогресування захворювання Вибір пацієнта ЕТ743 0,9мг/м2 (N=3) 0 3 0 ЕТ743 1,1мг/м2 (N=12) 6 (8+) 6 0 ЕТ743 1,3мг/м2 (N=6) 3 (13+) 3 1 0 1 0 1 3 0 5 0 2 0 15 1 Усього (N=30) 12 18 1 У п'яти пацієнтів, трьох з саркомою м'яких тканин і по одному з раком яєчників і раком тканин голови і шиї, була часткова відповідь. Чотирнадцять (14) додаткових пацієнтів (п'ять з саркомою і по одному з карциноїдною пухлиною, раком підшлункової залоза, сечового міхура, тканин голови і шиї, щитовидної залози, грудей, шлунка, дрібноклітинним раком легень і раком яєчників) мали стабільне захворювання протягом >3 місяців (Таблиця 8а і 8b). Таблиця 8а Найкраща сумарна відповідь Часткова відповідь ЕТ743 0,4мг/м2 (N=3) 1 Саркома Стабільне захворювання 1 Підшлункової залоза 1 Карциноїдна пухлина Найкраща відповідь ЕТ743 0,6мг/м2 (N=3) 0 1 Саркома 1 Міхур 1 Тканини голови і шиї ЕТ743 0,75мг/м2 (N=3) 0 1 Щитовидної залози 19 87877 20 Таблиця 8b Найкраща сумарна відповідь Найкраща відповідь ЕТ743 0,9мг/м2 (N=3) ЕТ743 1,1мг/м2 (N=12) Часткова відповідь 0 1 Саркома (Незріла нейроектодермальна пухлина) 0 3 Саркома 1 Грудей 1 Шлунка 1 Дрібноклітинний рак легень Стабільне захворювання Супутнє введення PLD не здійснювало впливу на фармакокінетичні параметри (PK) трабектедину. Виходячи з попереднього фармакокінетичного аналізу величини C1 трабектедину (системний кліренс після внутрішньовенної дози), T1/2 (період ЕТ743 1,3мг/м2 (N=6) 1 Папілярно-серозна аденокарцинома 1 Саркома 1 Тканини голови і шиї 1 Яєчників 1 Саркома напіввиведення) і Vss (виражений об'єм розподілу в рівноважному стані) знаходяться в межах діапазону, що спостерігається при введенні одного трабектедину (дані гістологічного контролю) (Фіг.1, Таблиця 9). Таблиця 9 Середні значення фармакокінетичних параметрів трабектедину в некомпартментному аналізі 3 Cmax (нг/мл) 6 AUC¥ (нг×год./мл) 39 Cl (л/год./м2) 23 Vss (л/м2) 1425 Т1/2 (год.) 93 1,1 3 6 42 26 1113 65 1,3 2 7 31 44 962 47 Доза мг/м2 PLD 30 мг/м2 годинна інфузія +ЕТ-743 3-годинна інфузія N 0,9 З цього дослідження автори винаходу роблять висновок про те, що MTD трабектедину становить 1,1мг/м2 при введенні в комбінації з 30мг/м2 PLD. Було показано, що ця комбінація добре переноситься, коли обидва лікарських засоби вводять в повних (або близьких до повних) терапевтичних Комп’ютерна верстка А. Крулевський дозах протягом тривалих періодів часу. Рекомендована доза в цьому комбінованому лікуванні становить 1,1мг/м2 трабектедину плюс 30мг/м2 PDL. Крім того, було показано, що супутнє введення PDL явним чином не впливало на фармакокінетичні параметри трабектедину. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPegylated liposomal doxorubicin in combination with ecteinescidin 743
Автори англійськоюGilles Erard, Sternas Lars-Axel, Trifan Ovid, De Velde Helgi Van, Teitelbaum April
Назва патенту російськоюПегилированный липосомальный доксорубицин в комбинации с эктеинасцидином 743 (ecteinescidin 743)
Автори російськоюЖилль Эрар, Стернас Ларс-Аксель, Трифан Овид, ван де Вельде Хельги, Тайтельбаум Эйприл
МПК / Мітки
МПК: A61P 35/00, A61K 31/495, A61K 31/351
Мітки: лiпосомальнiй, доксорубіцин, ектеїнасцидином, ecteinescidin, комбінації, пегильований
Код посилання
<a href="https://ua.patents.su/10-87877-pegilovanijj-liposomalnijj-doksorubicin-v-kombinaci-z-ektenascidinom-743-ecteinescidin-743.html" target="_blank" rel="follow" title="База патентів України">Пегильований ліпосомальний доксорубіцин в комбінації з ектеїнасцидином 743 (ecteinescidin 743)</a>
Попередній патент: 4-хлор -n-(2′-карбокси-4′-бромфеніл) антранілова кислота, що проявляє протизапальну, аналгетичну, діуретичну та протигрибкову активність
Наступний патент: Шаруватий композиційний матеріал для каталізу, процес виготовлення каталізатора та виготовлення алкенілалканоатів
Випадковий патент: Спосіб відкритої розробки покладів корисних копалин