Похідні 5-піридазиніл-1-азабіцикло[3.2.1]октану, їх одержання і застосування в терапії
Номер патенту: 92360
Опубліковано: 25.10.2010
Автори: Локхед Алістер В., Леклерк Оділь, Ваше Жюльєн, Галлі Фредерік
Формула / Реферат
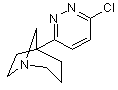
1. Сполука, відповідна формулі (І)
 , (І)
, (І)
де:
R являє собою
атом водню або галогену або
феніл, заміщений при необхідності одним або декількома атомами галогенів, однією або декількома групами, вибраними з (С1-С6)алкілу, (С1-С6)алкокси, нітро, аміно, ді(С1-С3)алкіламіно, трифторметилу, трифторметокси, ціано, гідрокси, ацетилу або метилендіокси;
або групу, вибрану з піридинілу, піразолілу, імідазолілу, триазолілу, тетразолілу, оксазолілу, тіазолілу, оксадіазолілу, тіадіазолілу, тієнілу, фурилу, ізоксазолілу, ізотіазолілу, піролілу, нафтилу, причому така група при необхідності може бути заміщеною однією або декількома групами, вибраними з атомів галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що
R являє собою
атом галогену або
феніл, заміщений при необхідності одним або декількома атомами галогенів, однією або декількома групами, вибраними з (С1-С6)алкілу, (С1-С6)алкокси;
або групу, вибрану з піридинілу, піразолілу, імідазолілу, триазолілу, тетразолілу, оксазолілу, тіазолілу, оксадіазолілу, тіадіазолілу, тієнілу, фурилу, ізоксазолілу, ізотіазолілу, піролілу, нафтилу, причому така група при необхідності може бути заміщеною одним або декількома (С1-С6)алкілами;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
3. Сполука формули (І) за пп. 1 або 2, яка відрізняється тим, що
R являє собою
атом галогену або
феніл, заміщений при необхідності одним або декількома атомами галогенів, однією або декількома групами, вибраними з (С1-С6)алкілу, (С1-С6)алкокси;
або групу, вибрану з піридинілу, піразолілу, імідазолілу, тієнілу, фурилу, піролілу, причому така група при необхідності може бути заміщеною одним або декількома (С1-С6)алкілами;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
4. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-3, який відрізняється тим, що сполуку формули (VII)
 (VII)
(VII)
вводять в реакцію з бороновою кислотою формули R-B(OH)2, в якій R є таким, як визначено в загальній формулі (І), в присутності паладієвого каталізатора;
або із сполукою формули R-H, в якій R є таким, як визначено в загальній формулі (І), в присутності сильної основи в розчиннику;
або з похідним олова формули R-Sn[(СН2)3(СН3)]3, в якій R є таким, як визначено в загальній формулі (І), в присутності паладієвого каталізатора;
або із сполукою формули R-H, в якій R є таким, як визначено в загальній формулі (І), в присутності н-бутиллітію, хлориду цинку і паладієвого каталізатора.
5. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-3 або адитивну сіль такої сполуки з фармацевтично прийнятною кислотою або також гідрат або сольват сполуки формули (І).
6. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-3 або фармацевтично прийнятну сіль, гідрат або сольват такої сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
7. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування і профілактики когнітивних розладів; порушень процесів, що визначають увагу; розладів виконавчих функцій, пов'язаних з хворобою Альцгеймера, патологічним або нормальним старінням, синдромом Паркінсона, трисомією 21, психічними патологіями, алкогольним синдромом Корсакова, судинними деменціями, черепними травмами; рухових розладів, що спостерігаються при хворобі Паркінсона або інших неврологічних хворобах або анатомо-гістопатологічних ураженнях, пов'язаних з вказаними нейродегенеративними хворобами.
8. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування або профілактики судинних ушкоджень головного мозку, випадків гіпоксії головного мозку, психічних патологій.
9. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування або профілактики симптомів, зумовлених позбавленням тютюну, алкоголю, різних субстанцій, що викликають залежність.
10. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування болю.
11. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування ішемії нижніх кінцівок, облітеруючого артеріїту нижніх кінцівок, ішемії серця, інфаркту міокарда, серцевої недостатності, погіршення загоєння уражень шкіри у хворих на діабет, варикозних виразок при венозній недостатності.
12. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування запальних процесів.
Текст
1. Сполука, відповідна формулі (І) 2 UA 1 N (VII) вводять в реакцію з бороновою кислотою формули R-B(OH)2, в якій R є таким, як визначено в загальній формулі (І), в присутності паладієвого каталізатора; 3 92360 4 або із сполукою формули R-H, в якій R є таким, як ми травмами; рухових розладів, що спостерігавизначено в загальній формулі (І), в присутності ються при хворобі Паркінсона або інших невролосильної основи в розчиннику; гічних хворобах або анатомо-гістопатологічних або з похідним олова формули R-Sn[(СН2)3(СН3)]3, ураженнях, пов'язаних з вказаними нейродегенев якій R є таким, як визначено в загальній формулі ративними хворобами. (І), в присутності паладієвого каталізатора; 8. Застосування сполуки формули (І) за будь-яким або із сполукою формули R-H, в якій R є таким, як з пп. 1-3 для одержання лікарського засобу, призвизначено в загальній формулі (І), в присутності нначеного для лікування або профілактики судинбутиллітію, хлориду цинку і паладієвого каталізаних ушкоджень головного мозку, випадків гіпоксії тора. головного мозку, психічних патологій. 5. Лікарський засіб, який відрізняється тим, що 9. Застосування сполуки формули (І) за будь-яким він містить сполуку формули (І) за будь-яким з пп. з пп. 1-3 для одержання лікарського засобу, приз1-3 або адитивну сіль такої сполуки з фармацевначеного для лікування або профілактики симптотично прийнятною кислотою або також гідрат або мів, зумовлених позбавленням тютюну, алкоголю, сольват сполуки формули (І). різних субстанцій, що викликають залежність. 6. Фармацевтична композиція, яка відрізняється 10. Застосування сполуки формули (І) за будьтим, що вона містить сполуку формули (І) за будьяким з пп. 1-3 для одержання лікарського засобу, яким з пп. 1-3 або фармацевтично прийнятну сіль, призначеного для лікування болю. гідрат або сольват такої сполуки, а також щонай11. Застосування сполуки формули (І) за будьменше один фармацевтично прийнятний ексципіяким з пп. 1-3 для одержання лікарського засобу, єнт. призначеного для лікування ішемії нижніх кінцівок, 7. Застосування сполуки формули (І) за будь-яким облітеруючого артеріїту нижніх кінцівок, ішемії сез пп. 1-3 для одержання лікарського засобу, призрця, інфаркту міокарда, серцевої недостатності, наченого для лікування і профілактики когнітивних погіршення загоєння уражень шкіри у хворих на розладів; порушень процесів, що визначають увадіабет, варикозних виразок при венозній недостагу; розладів виконавчих функцій, пов'язаних з хвотності. робою Альцгеймера, патологічним або нормаль12. Застосування сполуки формули (І) за будьним старінням, синдромом Паркінсона, трисомією яким з пп. 1-3 для одержання лікарського засобу, 21, психічними патологіями, алкогольним синдропризначеного для лікування запальних процесів. мом Корсакова, судинними деменціями, черепни Даний винахід належить до похідних 5піридазиніл-1-азабіцикло[3.2.1]октану, їх одержання і застосування в терапії. Винахід належить до сполук, відповідних загальній формулі (І) де: R являє собою атом водню або галогену; або феніл, заміщений при необхідності одним або декількома атомами галогенів, однією або декількома групами, вибраними з (С1-С6)алкілу, (С1-С6)алкокси, нітро, аміно, ді(С1-С3)алкіламіно, трифторметилу, трифторметокси, ціано, гідрокси, ацетилу або метилендіокси; або групу, вибрану з піридинілу, піразолілу, імідазолілу, триазолілу, тетразолілу, оксазолілу, тіазолілу, оксадіазолілу, тіадіазолілу, тієнілу, фурилу, ізоксазолілу, ізотіазолілу, піролілу, нафтилу, причому така група при необхідності може бути заміщеною однією або декількома групами, вибра ними з атомів галогенів, (С1-С6)алкілу, (С1С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно. У той же час атом вуглецю в позиції 5 циклу азабіцикло[3.2.1]октану є асиметричним, так що сполуки за даним винаходом можуть існувати у вигляді двох енантіомерів або їх суміші. Такі енантіомери, а також їх суміші, включаючи рацемічні суміші, становлять частину даного винаходу. Сполуки формули (І) можуть існувати також у вигляді основ або кислотно-адитивних солей. Такі адитивні солі становлять частину даного винаходу. Як ці солі, які можуть бути одержані з фармацевтично прийнятними кислотами, так і солі інших кислот, наприклад, застосовуваних для очищення або виділення сполук формули (І), також становлять частину даного винаходу. Сполуки формули (І) можуть існувати також у вигляді гідратів або сольватів, а саме, у вигляді асоціатів або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також становлять частину даного винаходу. У межах даного винаходу розуміють під: - атомом галогену атом фтору, хлору, брому або йоду; - алкілом аліфатичну насичену лінійну або розгалужену групу. Як приклади можна згадати метильну, етильну, пропільну, ізопропільну, бутильну, ізобутильну, трет-бутильну, пентильну групи і т. д.; 5 92360 6 - алкоксигрупою О-алкіл, в якому алкіл є тавом гетеролітичного зв'язку з видаленням електким, як визначено раніше. ронної пари. Така група також може бути легко Серед сполук формули (І), що є об'єктами дазаміщена іншою групою, наприклад, по реакції ного винаходу, першу підгрупу сполук складають заміщення. Такими відхідними групами є, наприсполуки, в яких: клад, галогени або активна гідроксигрупа, така як R являє собою метансульфонат, бензолсульфонат, патом галогену, більш переважно хлор; толуолсульфонат, трифлат, ацетат і т. д. Приклаабо феніл, заміщений при необхідності одним ди відхідних груп, а також довідкова інформація по або декількома атомами галогенів, більш переваїх одержанню наведені у виданні "Advanced in жно хлору або фтору, однією або декількома груOrganic Chemistry", J. March, 3rd Edition, Wiley пами, вибраними з (С1-С6)алкілу, більш переважно Interscience, 1985, p. 310-316. метилу, (С1-С6)алкокси, більш переважно метокси; За даним винаходом сполуки загальної форабо групу, вибрану з піридинілу, піразолілу, мули (І) можна одержати способом, який проілюсімідазолілу, триазолілу, тетразолілу, оксазолілу, трований наведеною далі схемою 1. тіазолілу, оксадіазолілу, тіадіазолілу, тієнілу, фуСполуку формули (II), в якій PPh3 означає рилу, ізоксазолілу, ізотіазолілу, піролілу, нафтилу, трифенілфосфінову групу, приводять у взаємодію причому така група при необхідності може бути з етилгліоксилатом для одержання сполуки форзаміщеною одним або декількома (С1-С6)алкілами, мули (III). Відновлення подвійного етиленового більш переважно метильними групами. зв'язку дає сполуку формули (IV), яку приводять у Серед сполук формули (І), що є об'єктами давзаємодію з гідразингідратом для одержання споного винаходу, другу підгрупу сполук складають луки формули (V). Останню сполуку обробляють сполуки, в яких: бромом в оцтовій кислоті для одержання сполуки R являє собою формули (VI). Обробка одержаної сполуки оксихатом галогену, більш переважно хлор; лоридом фосфору приводить до сполуки формули або феніл, заміщений при необхідності одним (VII). Сполуки формули (І) можуть бути одержані або декількома атомами галогенів, більш перевапотім, виходячи із сполуки формули (VII), будьжно хлору або фтору, однією або декількома груякими відомими способами, наприклад: пами, вибраними з (С1-С6)алкілу, більш переважно - з бороновою кислотою формули R-B(OH)2, в метилу, (С1-С6)алкокси, більш переважно метокси; якій R є таким, як визначено в загальній формулі або групу, вибрану з піридинілу, піразолілу, (І), в присутності паладієвого каталізатора, наприімідазолілу, тієнілу, фурилу, піролілу, причому таклад тетракистрифенілфосфінпаладію; ка група при необхідності може бути заміщеною - із сполукою формули R-H, в якій R є таким, як одним або декількома (С1-С6)алкілами, більш певизначено в загальній формулі (І), в присутності реважно метильними групами. сильної основи, наприклад гідриду натрію, в розПід захисною групою далі розуміють групу, чиннику, наприклад в диметилформаміді; яка, з одного боку, дозволяє захищати в ході синз похідним олова формули Rтезу активну функціональну групу, таку як гідрокSn[(CH2)3(CH3)]3, в якій R є таким, як визначено в си- або аміногрупа, і, з іншого боку, дозволяє відзагальній формулі (І), в присутності паладієвого новлювати активну функціональну групу без зміни каталізатора, наприклад в кінці синтезу. Приклади захисних груп, а також біс(трифенілфосфін)дихлорпаладію; методики введення і видалення захисних груп на- із сполукою формули R-H, в якій R є таким, як ведені у виданні "Protective Groups in Organic визначено в загальній формулі (І), в присутності нSynthesis", Green et al, 2nd Edition (John Wiley & бутиллітію, хлориду цинку і паладієвого каталізаSons; Inc., New York), 1991. тора, наприклад тетракистрифенілфосфінпаладію. Під відхідною групою далі розуміють групу, яка може бути легко відщеплена від молекули розри 7 Сполуку формули (II) одержують способами, описаними в літературних джерелах, наприклад в J. Med. Chem. 1992, 2392. Вказані на схемі 1 вихідні речовини і реагенти, способи одержання яких не описані, є в продажу або описані в літературі, або можуть бути одержані способами, описаними або відомими фахівцеві в даній галузі техніки. Даний винахід в одному з інших своїх аспектів належить також до сполук формул (II)-(VII). Такі сполуки є корисними як проміжні сполуки в синтезі сполук загальної формули (І). У подальших прикладах описане одержання деяких сполук за даним винаходом. Дані приклади не є обмежувальними і наведені тільки для ілюстрації даного винаходу. Вказані в заголовках номери сполук, наведені в дужках, відповідають номерам, вказаним в першому стовпці таблиці, наведеної далі для ілюстрації хімічної структури і фізичних властивостей деяких сполук за даним винаходом. Приклад 1 (сполука № 1) 5-(6-Фенілпіридазин-3-іл)-1азабіцикло[3.2.1]октан 1.1. Етил-(2E)-4-(1-азабіцикло[3.2.1]окт-5-ил)4-оксобут-2-еноат У тригорлу колбу місткістю 100 мл помішують розчин 5,00 г (12,09 ммоль) 1-(1азабіцикло[3.2.1]окт-5-ил)-2(трифенілфосфініліден)етанону в 20 мл хлороформу і 20 мл толуолу. Додають 1,36 г (13,3 ммоль) етилгліоксилату і перемішують реакційну масу при кімнатній температурі протягом 15 хв. Розчинник 92360 8 видаляють випарюванням при зниженому тиску і одержаний залишок очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю хлороформу, метанолу і аміаку в пропорції 89/2/0,2. Одержують 1,44 г продукту у вигляді твердої аморфної речовини. 1.2. Етил-4-(1-азабіцикло[3.2.1]окт-5-ил)-4оксобутаноат У реактор гідрування помішують розчин 2,95 г (12,43 ммоль) етил-(2E)-4-(1-забіцикло[3.2.1]окт-5ил)-4-оксобут-2-еноату, одержаного на стадії 1.1, в 100 мл етилового спирту в присутності 0,4 г паладію, адсорбованого із вмістом 5% на вугіллі. Реакційну масу перемішують при тиску водню приблизно 0,28 МПа протягом 1 год. при кімнатній температурі, потім фільтрують через діатоміт і розчинник видаляють випарюванням при зниженому тиску. Одержують 2,97 г необхідного продукту у вигляді твердої аморфної речовини. 1.3. 6-(1-Азабіцикло[3.2.1]окт-5-ил)-4,5дигідропіридазин-3-ол У тригорлу колбу місткістю 250 мл помішують розчин 2,90 г (12,12 ммоль) етил-4-(1азабіцикло[3.2.1]окт-5-ил)-4-оксобутаноату, одержаного на стадії 1.2, в 50 мл етилового спирту. Потім додають 1,94 г (60,59 ммоль) гідразингідрату і реакційну суміш нагрівають із зворотним холодильником протягом 15 год. Розчинник випарюють досуха при зниженому тиску і залишок очищають хроматографуванням на колонці з силікагелем, 9 92360 10 елююючи сумішшю хлороформу, метанолу і аміаку хроматографуванням на колонці з силікагелем, в пропорції 90/10/1. елююючи сумішшю хлороформу, метанолу і аміаку Одержують 1,6 г необхідного продукту у вив пропорції 95/5/0,5. гляді твердої аморфної речовини. Таким чином, одержують 0,32 г необхідного 1.4. Гідробромід (1:1) 6-(1-азабіцикло[3.2.1]октпродукту у вигляді кристалів. 5-ил)піридазин-3-олу Температура плавлення: 133-134°С. У тригорлу колбу місткістю 50 мл помішують ЯМР-1Н (CDCl3) (м. ч.): 8,15 (2Н, д); 7,85 (1Н, розчин 1,54 г (7,43 ммоль) 6-(1д); 7,60-7,40 (4Н, м); 3,40-2,80 (6Н, м); 2,30 (2Н, т); азабіцикло[3.2.1]окт-5-ил)-4,5-дигідропіридазин-32,15-1,85 (2Н, м); 1,80 (1Н, с); 1,70-1,50 (1Н, м). олу, одержаного на стадії 1.3, в 20 мл оцтової кисСполуки №№ 2, 3 і 14 були одержані за метолоти. Реакційну масу нагрівають до 70°С і додають дикою, описаною в прикладі 1. 1,31 г (8,17 ммоль) брому. Перемішують протягом Приклад 2 (сполука № 5) 15 хв. і додають додатково 1,31 г (8,17 ммоль) Гідрохлорид (1:1) 5-[6-(5-метил-2брому. Потім реакційну суміш нагрівають при тієніл)піридазин-3-іл]-1-азабіцикло[3.2.1]октан 100°С протягом 2 год. Розчинник видаляють фільДану сполуку одержують за методикою, опитруванням і залишок розтирають в метанолі. Одесаною на стадії 1.6 прикладу 1, виходячи з 5-(6ржані кристали відділяють фільтруванням при хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану, зниженому тиску. одержаного на стадії 1.5 прикладу 1, і 5Одержують 2 г необхідного продукту. метилсульфаніл-2-тієнілборонової кислоти. ГідроТемпература плавлення: 196-198°С. хлорид одержують обробкою основи розчином 1.5. 5-(6-Хлорпіридазин-3-іл)-1соляної кислоти в пропан-2-олі, одержані кристали азабіцикло[3.2.1]октан відділяють фільтруванням і сушать у вакуумі. У тригорлу колбу місткістю 50 мл помішують Температура плавлення: 245-246°С. розчин 2,1 г (7,34 ммоль) гідроброміду (1:1) 6-(1ЯМР-1Н (ДМСО) (м. ч.): 8,15 (1Η, д); 7,75 (1Н, азабіцикло[3.2.1]окт-5-ил)піридазин-3-олу, одерд); 7,75 (1Н, д); 6,95 (1Н, д); 3,75-3,25 (6Н, м); 2,45 жаного на стадії 1.4, в 15 мл оксихлориду фосфо(3Н, с); 2,15-1,85 (6Н, м). ру. Реакційну суміш нагрівають при 130°С протяСполуки №№ 6-11 були одержані за методигом 30 хв. і потім виливають в 500 мл льодяної кою, описаною в прикладі 2. води. Потім водний шар підлуговують додаванням Сполуки №№ 12, 13, 16, 17, 22 і 23 були одер30%-го водного розчину гідроксиду натрію і екстражані за методикою, описаною в прикладі 2, вихогують хлороформом. Об'єднані органічні шари дячи з (+)-5-(6-хлорпіридазин-3-іл)-1сушать над сульфатом магнію, фільтрують і коназабіцикло[3.2.1]октану, одержаного розділенням центрують при зниженому тиску. рацемічної суміші (одержаної на стадії 1.5 приклаОдержують 1,56 г продукту у вигляді твердої ду 1) рідинною хроматографією на хіральній неруречовини. хомій фазі. Температура плавлення: 139-141°С. Сполуки №№ 15, 20 і 21 були одержані за ме1.6. (+) або (-)-5-(6-хлорпіридазин-3-іл)-1тодикою, описаною в прикладі 2, виходячи з (-)-5азабіцикло[3.2.1]октан (6-хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану, Рацемічну суміш 5-(6-хлорпіридазин-3-іл)-1одержаного розділенням рацемічної суміші (одеразабіцикло[3.2.1]октану, одержану на стадії 1.5, жаної на стадії 1.5 прикладу 1) рідинною хроматорозділяють рідинною хроматографією на хіральній графією на хіральній нерухомій фазі. нерухомій фазі для одержання правообертального Приклад 3 (сполука № 25) і лівообертального енантіомерів, (+)-5-(6(+)-5-[6-(1Н-імідазол-1-іл)піридазин-3-іл]-1хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану і (-)азабіцикло[3.2.1]октан 5-(6-хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану У тригорлу колбу місткістю 10 мл поміщують відповідно. розчин 0,228 г (3,35 ммоль) імідазолу в 4 мл диме(+)-5-(6-Хлорпіридазин-3-іл)-1тилформаміду. Потім додають 0,137 г (3,42 ммоль) азабіцикло[3.2.1]октан: [ 20D]=+30,9°(с=1, СН3ОН); гідриду натрію у вигляді 60%-ої дисперсії в маслі і (-)-5-(6-Хлорпіридазин-3-іл)-1перемішують при кімнатній температурі протягом 1 азабіцикло[3.2.1]октан: [[ 20D]=-17°(c=1, CH3OH). години. Потім суміш додають до розчину (+)-5-(61.7. 5-(6-Фенілпіридазин-3-іл)-1хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану азабіцикло[3.2.1]октан (одержаного розділенням рацемічної суміші, одеУ тригорлу колбу місткістю 25 мл поміщують ржаної на стадії 1.5 прикладу 1, рідинною хроматопослідовно 0,3 г (1,34 ммоль) 5-(6-хлорпіридазинграфією на хіральній нерухомій фазі) (0,15 г, 0,67 3-іл)-1-азабіцикло[3.2.1]октану, одержаного на ммоль) в диметилформаміді і реакційну суміш настадії 1.5, і 0,245 г (2,01 ммоль) фенілборонової грівають при 90°С протягом 15 годин і далі при кислоти, розчиняючи в 8 мл толуолу. Потім дода110°С протягом 3 годин, потім розчинник випарюють 1,42 мл (2,84 ммоль) 2 Μ водного розчину кають при зниженому тиску. Залишок обробляють 10 рбонату натрію, 1,5 мл етанолу і 0,0465 г (0,04 мл хлороформу і 10 мл насиченого водного розчиммоль) тетракис(трифенілфосфін)паладію. Суміш ну карбонату натрію. Водний шар екстрагують донагрівають із зворотним холодильником протягом датково 10 мл хлороформу і об'єднані органічні 20 год., охолоджують до кімнатної температури і шари промивають насиченим водним розчином виливають в 20 мл води. Водний шар екстрагують хлориду натрію, сушать над сульфатом натрію, три рази по 30 мл хлороформу, об'єднані органічні фільтрують і концентрують при зниженому тиску. шари сушать над сульфатом магнію і концентруЗалишок очищають хроматографуванням на силіють при зниженому тиску. Залишок очищають кагелевій пластині, елююючи сумішшю хлорофор 11 92360 12 му, метанолу і аміаку в пропорції 85/15/1,5. ОдерУ тригорлу колбу місткістю 25 мл поміщують жують 0,111 г необхідного продукту. розчин 0,39 г (2,23 ммоль) 1Температура плавлення: 177-179°С. (диметиламіносульфоніл)імідазолу в 10 мл тетрагідрофурану. Реакційну суміш охолоджують до ЯМР-1Н (ДМСО) (м. ч.): 8,55 (1Н, с); 8,10 (1Н, 78°С і додають по краплях 1,4 мл 1,6 Μ розчину нд); 8,00 (1Н, с); 7,85 (1Н, д); 7,15 (1Н, с); 3,15-2,70 бутиллітію в гексані протягом 20 хвилин. Потім (6Н, м); 2,25-1,75 (5Н, м); 1,60-1,35 (1Н, т). додають розчин 0,31 г (2,32 ммоль) хлориду цинку Сполука № 26 була одержана за методикою, в 4 мл тетрагідрофурану. Перемішують, даючи описаною в прикладі 3. температурі підвищитися до 20°С, потім додають Приклад 4 (сполука № 19) послідовно 0,48 г (3,58 ммоль) хлориду цинку, 0,06 Гідрохлорид (2:1) (+)-5-[6-(1Н-імідазол-4г (0,05 ммоль) тетракис(трифенілфосфін)паладію і іл)піридазин-3-іл]-1-азабіцикло[3.2.1]октану 0,2 г (0,89 ммоль) (-)-5-(6-хлорпіридазин-3-іл)-14.1. (+)-5-[6-(1-трифенілметилімідазол-4азабіцикло[3.2.1]октану (одержаного розділенням іл)піридазин-3-іл]-1-азабіцикло[3.2.1]октан рацемічної суміші, одержаної на стадії 1.5 приклаУ тригорлу колбу місткістю 10 мл поміщують ду 1, рідинною хроматографією на хіральній нерупослідовно розчин 0,14 г (0,63 ммоль) (+)-5-(6хомій фазі), розчиняючи в 5 мл тетрагідрофурану. хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану Потім суміш нагрівають із зворотним холодильни(одержаного розділенням рацемічної суміші, одеком протягом 24 годин і далі охолоджують до кімржаної на стадії 1.5 прикладу 1, рідинною хроматонатної температури. Додають 30 мл 30%-го воднографією на хіральній нерухомій фазі) (0,15 г, 0,67 го розчину гідроксиду натрію і 50 мл хлороформу. ммоль) в 3 мл тетрагідрофурану, 0,94 г (1,56 Водний шар екстрагують хлороформом і об'єднані ммоль) 1-трифенілметил-4органічні шари промивають насиченим водним трибутилстанілімідазолу і 0,027 г (0,037 ммоль) розчином хлориду натрію, сушать над сульфатом біс(трифенілфосфін)дихлорпаладію. Потім суміш натрію, фільтрують і концентрують при зниженому нагрівають при 100°С в атмосфері аргону протятиску. гом 15 годин, після чого додають 10 мл хлорофоОдержаний залишок переводять в розчин 10 рму і 10 мл насиченого водного розчину карбонату мл діоксану і 1,5 мл 2 н. водного розчину соляної натрію. Водний шар екстрагують додатково 10 мл кислоти. Реакційну масу перемішують при кімнатхлороформу і об'єднані органічні шари промиваній температурі протягом 16 годин і потім розчинють насиченим водним розчином хлориду натрію, ник випарюють при зниженому тиску. Залишок сушать над сульфатом натрію, фільтрують і конобробляють 30 мл хлороформу і 30 мл насиченого центрують при зниженому тиску. Залишок очищаводного розчину карбонату натрію. Водний шар ють хроматографуванням на колонці з силікагеекстрагують хлороформом і об'єднані органічні лем, елююючи сумішшю хлороформу, метанолу і шари сушать над сульфатом натрію, фільтрують і аміаку в пропорції 96/4/0,4. Одержують необхідний концентрують при зниженому тиску. Залишок очипродукт, забруднений надлишком 1щають хроматографуванням на колонці з силікатрифенілметил-4-трибутилстанілімідазолу, у вигелем, елююючи сумішшю хлороформу, метанолу гляді твердої аморфної речовини. і аміаку в пропорції 90/10/1. Одержують 0,033 г 4.2. Гідрохлорид (2:1) (+)-5-[6-(1Н-імідазол-4необхідного продукту, який розчиняють в 3 мл ізоіл)піридазин-3-іл]-1-азабіцикло[3.2.1]октану пропілового спирту з подальшим додаванням У тригорлу колбу місткістю 10 мл поміщують 0,045 мл 5,7 н. розчину бромоводневої кислоти в розчин (+)-5-[6-(1-трифенілметилімідазол-4оцтовій кислоті. Кристали, що утворилися, віддііл)піридазин-3-іл]-1-азабіцикло[3.2.1]октану у виляють фільтруванням і сушать у вакуумі. Одержугляді залишку, одержаного на стадії 4.1, в 4 мл ють 0,027 г продукту. метанолу. Потім додають 0,6 мл 6 н. розчину соТемпература плавлення: 290-292°С. ляної кислоти в ізопропіловому спирті і реакційну ЯМР-1Н (ДМСО) (м. ч.): 10,15 (1Н, с); 8,40 суміш нагрівають при 80°С протягом 3 годин. Розчин концентрують при зниженому тиску і залишок (1Н, д); 8,05 (1Н, д); 7,80 (2Н, с); 3,80 (1Н, с); 3,70розтирають в діетиловому ефірі. Одержані криста3,50 (2Н, т); 3,35 (2Н, д); 2,45-1,85 (6Н, м). ли відділяють фільтруванням і сушать у вакуумі. Представлена далі таблиця 1 наведена для Одержують 0,12 г продукту. ілюстрації хімічної структури і фізичних властивосТемпература плавлення: 269-271°С. тей деяких сполук за даним винаходом. У згаданій таблиці: ЯМР-1Н (ДМСО) (м. ч.): 11,20 (1Н, с); 9,10 - значення, вказані в стовпці із заголовком (1Н, с); 8,45 (1Н, с); 8,35 (1Н, д); 7,95 (1Н, д); 3,70 [ 20D] (CH3OH), характеризують обертальну здат(2Н, с); 3,60-3,45 (2Н, т); 3,30 (2Н, д); 2,45-1,85 (6Н, м). ність сполуки, причому концентрація в г/100 мл Сполука №№ 18 була одержана за методиметанолу, при якій здійснювали вимірювання, вкакою, описаною в прикладі 4, виходячи з (-)-5-(6зана в дужках; сполуки, для яких в даному стовпці хлорпіридазин-3-іл)-1-азабіцикло[3.2.1]октану, відомості відсутні, являють собою рацемати; одержаного розділенням рацемічної суміші (одер- знак "-" в стовпці "Сіль" означає сполуку у вижаної на стадії 1.5 прикладу 1) рідинною хроматогляді основи, "НВr" означає гідробромід, а "НСІ" графією на хіральній нерухомій фазі. означає гідрохлорид. Молярні співвідношення "киПриклад 5 (сполука № 24) слота:основа" вказані поряд. Гідробромід (2:1) (-)-5-[6-(1Н-імідазол-2іл)піридазин-3-іл]-1-азабіцикло[3.2.1]-октан 13 Сполуки за даним винаходом були об'єктом фармакологічних випробувань, які виявили їх перспективність як активних речовин лікарських засобів. Також вони були вивчені відносно їх спорідненості до нікотинових рецепторів, що містять субодиницю 7, згідно з методиками, описаними Mark і Collins у виданні J. Pharmacol Exp. Ther. 1982, 22, 564 і Marks et coll. у виданні Mol. Pharmacol. 1986, 30, 427. Здійснюють декапітацію щурів-самців лінії OFA з масою тіла від 150 до 200 г, швидко відбирають весь головний мозок, гомогенізують його за допомогою подрібнювача Polytron в 15 об'ємах 0,32 Μ розчину сахарози при 4°С і потім центрифугують при 1000 g протягом 10 хв. Осад відділяють і супернатант центрифугують при 8000 g протягом 20 хв. при 4°С. Осад виділяють, гомогенізують його за допомогою подрібнювача Polytron в 15 об'ємах 92360 14 бідистильованої води при 4°С і потім центрифугують при 8000 g протягом 20 хв. Осад відділяють і центрифугують супернатант і лейкоцитарну плівку ("buffy coat") при 40000 g протягом 20 хв. при 4°С. Осад виділяють, знов переводять в суспензію з 15 об'ємами бідистильованої води при 4°С і центрифугують ще раз при 40000 g протягом 20 хв. перед консервацією при -80°С. У день експерименту повільно розморожують тканину і переводять в суспензію в 5 об'ємах буфера. Преінкубують 150 мкл такої мембранної суспензії при 37°С протягом 30 хв. в темряві в присутності або за відсутності випробуваної сполуки. Потім мембрани інкубують протягом 60 хв. при 37°С в темряві в присутності 50 мкл [3Н]- бунгаротоксину з концентрацією 1 нМ в кінцевому об'ємі 250 мкл 20 мМ буфера HEPES і з 0,05% поліетиленіміну. Реакцію зупиняють фільтруванням через фільтри Whatman GF/C , попередньо 15 92360 16 оброблені протягом 3 год. 0,05%-м розчином поліcoat) при 40000 g протягом 20 хв., осад виділяють, етиленіміну. Фільтри обполіскують два рази по 5 знов переводять в суспензію з 15 мл бідистильомл буфера при 4°С і вимірюють радіоактивність, ваної води і центрифугують ще раз при 40000 g поглинену кожним фільтром, рідинною сцинтиграпротягом 20 хв. перед консервацією при -80°С. фією. Визначають неспецифічні зв'язки в присутУ день експерименту повільно розморожують тканину і переводять в суспензію в 3 об'ємах буності -бунгаротоксину з кінцевою концентрацією 1 фера. Інкубують 150 мкл такої мембранної суспенмкМ; неспецифічні зв'язки становлять приблизно зії при 4°С протягом 120 хв. в присутності 100 мкл 60% всіх зв'язків, що виявляються на фільтрі. Для [3Н]-цитизину з концентрацією 1 нМ в кінцевому кожної концентрації досліджуваної сполуки визнаоб'ємі 500 мкл буфера в присутності або за відсутчають процентну частку інгібування специфічних ності випробуваної сполуки. Реакцію зупиняють зв'язків [3Н]- -бунгаротоксину, потім розраховують фільтруванням через фільтри Whatman GF/C , СІ50, тобто концентрацію сполуки, при якій інгібупопередньо оброблені поліетиленіміном, фільтри ється 50% специфічних зв'язків. обполіскують два рази по 5 мл буфера при 4°С і Концентрації СІ50 для сполук за даним винаховимірюють радіоактивність, поглинену фільтром, дом, які мають найбільшу спорідненість, знахорідинною сцинтиграфією. Визначають неспецифідяться в інтервалі від 0,001 до 1 мкМ. чні зв'язки в присутності (-)-нікотину з концентраціСполуки за даним винаходом були вивчені таєю 10 мкМ; неспецифічні зв'язки складають від 75 кож відносно їх спорідненості до нікотинових рецедо 85% всіх зв'язків, що виявляються на фільтрі. пторів, що містять субодиницю ( 4 2, згідно з меДля кожної концентрації досліджуваної сполуки тодиками, описаними Anderson і Arneric у виданні визначають процентну частку інгібування специфіEur. J. Pharmacol. 1994, 253, 261 і Hall et coll. у вичних зв'язків [3Н]-цитизину в дозах від 1 до 10 мкМ. данні Brain Res. 1993, 600, 127. Для найбільш афінних сполук за даним винаходом Здійснюють декапітацію щурів-самців лінії розраховують СІ50, тобто концентрацію сполуки, Sprague Dawley з масою тіла від 150 до 200 г, при якій інгібується 50% специфічних зв'язків. швидко відбирають весь головний мозок, гомогеніКонцентрації СІ50 для найбільш афінних спозують його в 15 об'ємах 0,32 Μ розчину сахарози лук за даним винаходом знаходяться в інтервалі при 4°С і потім центрифугують при 1000 g протявід 0,2 до 10 мкМ. гом 10 хв. Осад відділяють і супернатант центриУ представленій далі таблиці 2 наведені ексфугують при 20000 g протягом 20 хв. при 4°С. периментальні дані для деяких специфічних споОсад виділяють, гомогенізують його за допомогою лук. подрібнювача Polytron в 15 об'ємах бідистильованої води при 4°С і потім центрифугують при 8000 g протягом 20 хв. Осад відділяють і центрифугують супернатант і лейкоцитарну плівку (buffy Сполуки за даним винаходом були вивчені також відносно їх спорідненості до периферичних нікотинових рецепторів гангліонарного типу згідно з методикою, описаною Houghtling et coll. у виданні Mol Pharmacol. 1995, 48,280. Розморожують бичачі надниркові залози, що зберігалися при -80°С, гомогенізують їх за допомогою подрібнювача Polytron в 20 об'ємах 50 мМ буфера Tris-HCl з рН=7,4 при 4°С і потім центрифугують при 35000 g протягом 10 хв. Видаляють супернатант, осад знов переводять в суспензію в 30 об'ємах 50 мМ буфера Tris-HCl при 4°С і знов гомогенізують перед повторним центрифугуванням при 35000 g протягом 10 хв. Останній осад розчиняють в 10 об'ємах буфера Tris-HCl при 4°С. Інкубують 100 мкл мембранного препарату або 10 мг свіжої тканини при 24°С протягом 3 год. в присутності 50 мкл [3Н]-епібатидину з кінцевою концентрацією 0,66 нМ в кінцевому об'ємі 250 мкл буфера в присутності або за відсутності випробуваної сполуки. Реакцію зупиняють розбав ленням зразків 50 мкМ буфером Tris-HCl з рН=7,4 при 4°С, потім фільтрують через фільтри Whatman GF/3 , попередньо оброблені протягом 3 годин 0,5%-м розчином поліетиленіміну. Фільтри обполіскують два рази по 5 мл буфера і вимірюють радіоактивність, поглинену фільтром, рідинною сцинтиграфією. Визначають неспецифічні зв'язки в присутності (-)-нікотину з кінцевою концентрацією 2 мМ; неспецифічні зв'язки складають від 30 до 40% всіх зв'язків, що виявляються на фільтрі. Для кожної концентрації досліджуваної сполуки визначають процентну частку інгібування специфічних зв'язків [3Н]-епібатидину, потім розраховують СІ50, тобто концентрацію сполуки, при якій інгібується 50% специфічних зв'язків. Концентрації СІ50 для сполук за даним винаходом знаходяться в інтервалі від 1 до 10 мкМ. Одержані результати показують, що деякі сполуки за даним винаходом являють собою селективні ліганди для субодиниці 7 нікотинового рецеп 17 92360 18 тора і що інші сполуки є змішаними лігандами для порушень, пов'язаних з дисфункцією нікотинових рецепторів, зокрема раніше згаданих порушень. субодиниць 4 2 і 7. Також даний винахід в одному з інших своїх Такі результати передбачають застосування аспектів належить до лікарських засобів, що міссполук при лікуванні або профілактиці порушень, тять сполуку формули (І) або адитивну сіль такої пов'язаних з дисфункцією нікотинових рецепторів, сполуки з фармацевтично прийнятною кислотою зокрема на рівні центральної нервової системи. або також гідрат або сольват сполуки формули (І). До таких порушень належать когнітивні розлаТакі лікарські засоби знаходять своє застосуди, більш конкретно, мнестичні порушення (набування в терапії, зокрема при лікуванні або профівання, закріплення і пригадування), а також уралактиці порушень, пов'язаних з дисфункцією нікоження процесів, що визначають увагу, і розлади тинових рецепторів, зокрема раніше згаданих виконавчих функцій, пов'язаних з хворобою Альцпорушень. геймера, патологічним старінням (Age Associated Даний винахід в одному з інших своїх аспектів Memory Impairment, AAMI (вікові порушення пам'яналежить до фармацевтичних композицій, що місті)) або нормальним старінням (старече недоумсттять як активну речовину сполуку за даним винаво), синдромом Паркінсона, трисомією 21 (синдходом. ром Дауна), психічними патологіями (зокрема Такі фармацевтичні композиції містять ефеккогнітивні розлади, пов'язані з шизофренією), алтивну дозу щонайменше однієї сполуки за даним когольним синдромом Корсакова, судинними девинаходом або фармацевтично прийнятної солі, менціями (мультиінфарктна деменція, MDI), черегідрату або сольвату згаданої сполуки, а також пними травмами. щонайменше один фармацевтично прийнятний Сполуки за даним винаходом можливо мають ексципієнт. Згадані ексципієнти вибирають з тракорисний ефект при лікуванні рухових розладів, диційних ексципієнтів, відомих фахівцеві в даній що спостерігаються при хворобі Паркінсона або галузі техніки, відповідно до необхідних фармацеінших неврологічних хворобах, таких як хорея Генвтичної форми і способу введення. тінгтона, синдром Туретта, пізня дискінезія і гіперУ фармацевтичних композиціях за даним викінезія. находом, призначених для перорального, сублінгВони можуть також виявляти терапевтичну вального, підшкірного, внутрішньом'язового, внутнейрозахисну активність відносно анатоморішньовенного, топічного, місцевого, гістопатологічних уражень, пов'язаних із згаданими інтратрахеального, інтраназального, черезшкірнораніше нейродегенеративними хворобами. го або ректального введення, раніше згадана акСполуки за даним винаходом також можуть тивна речовина формули (І) або її можливі сіль, бути використані в лікувальній або симптоматичній сольват або гідрат можуть вводитися в стандарттерапії судинних ушкоджень головного мозку і у ній лікарській формі в суміші з традиційними фарвипадках гіпоксії головного мозку. Вони можуть мацевтичними ексципієнтами тваринам і людям бути використані у випадках психічних патологій, для профілактики або лікування раніше згаданих таких, як: порушень або захворювань. шизофренія (з позитивними і/або негативними Відповідні стандартні лікарські форми для симптомами), біполярні розлади, депресія, тривовведення включають в себе форми для пероральжний стан, напади паніки, розлади уваги в поєдного прийому, такі як таблетки, капсули з м'якою нанні з гіперактивністю, компульсивна і маніакальабо твердою желатиновою оболонкою, порошки, на поведінка. гранули і розчини або суспензії для прийому всеВони можуть бути використані для профілакредину, форми для прийому сублінгвально, транстики симптомів, зумовлених позбавленням тютюбукально, інтратрахеально, інтраокулярно, інтрану, алкоголю, різних субстанцій, що викликають назально, шляхом інгаляції, форми для введення залежність, таких як кокаїн, ЛСД, коноплі, бензодітопічним, черезшкірним, підшкірним, внутрішньоазепіни. м'язовим або внутрішньовенним шляхом, форми Вони можуть мати корисний ефект при лікудля введення ректально і імплантати. Для топічнованні болів різного походження (включаючи хроніго нанесення сполуки за даним винаходом можна чні, нейропатичні або запальні болі). використовувати у вигляді кремів, гелів, помад або У той же час, сполуки за даним винаходом лосьйонів. можуть бути використані для лікування ішемії нижЯк приклад стандартна лікарська форма споніх кінцівок, облітеруючого артеріїту нижніх кінцілуки за даним винаходом у формі таблеток може вок (PAD: peripheral arterial disease (хвороба пемістити наступні компоненти: риферичних судин)), ішемії серця (angor stable сполука за даним винаходом 50,0 мг; (стенокардії)), інфаркту міокарда, серцевої недоманіт 223,75 мг; статності, погіршення загоєння уражень шкіри у кроскармелоза натрію 6,0 мг; діабетичних хворих, варикозних виразок при венокукурудзяний крохмаль 15,0 мг; зній недостатності. гідроксипропілметилцелюлоза 2,25 мг; Сполуки за даним винаходом також можуть стеарат магнію 3,0 мг. бути використані для лікування запальних процеЗгадані стандартні лікарські форми вводять сів різного походження, зокрема запалень, які стодля забезпечення введення добової дози в інтерсуються центральної нервової системи. валі від 0,01 до 20 мг діючої речовини на кг маси Таким чином, сполуки за даним винаходом тіла відповідно до галенової форми. можуть бути використані для одержання лікарсьМожуть мати місце особливі випадки, в яких ких засобів, зокрема лікарських засобів, що мають дози встановлюють збільшеними або зменшеникорисний ефект при лікуванні або профілактиці 19 92360 20 ми; такі дози даний винахід також охоплює. По раніше патологій, який включає в себе введення прийнятій практиці відповідні дози для кожного пацієнту ефективної дози сполуки за даним винахворого визначаються лікарем залежно від спосоходом або однієї з його фармацевтично прийнятбу введення, маси тіла і реакції хворого. них солей або гідратів, або сольватів. Даний винахід в одному з інших своїх аспектів належить також до способу лікування згаданих Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 5-pyridazinyl-1-azabicyclo[3.2.1]octane, preparation method thereof and use of same in therapeutics
Автори англійськоюGalli Frederic, Leclerc Odile, Lochead Alistair W., Vache Julien
Назва патенту російськоюПроизводные 5-пиридазинил-1-азабицикло[3.2.1]октана, их получение и применение в терапии
Автори російськоюГалли Фредерик, Леклерк Одиль, Локхед Алистер В., Ваше Жюльен
МПК / Мітки
МПК: C07D 471/18, A61P 25/00, A61K 31/439
Мітки: похідні, терапії, 5-піридазиніл-1-азабіцикло[3.2.1]октану, застосування, одержання
Код посилання
<a href="https://ua.patents.su/10-92360-pokhidni-5-piridazinil-1-azabiciklo321oktanu-kh-oderzhannya-i-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні 5-піридазиніл-1-азабіцикло[3.2.1]октану, їх одержання і застосування в терапії</a>
Попередній патент: Спосіб і пристрій для одночасного зв’язку за допомогою множини систем безпровідного зв’язку
Наступний патент: Спосіб і пристрій для вибору віртуальних антен
Випадковий патент: Поліморфи n-(2-метоксибензоїл)-4-[(метиламінокарбоніл)аміно]бензолсульфонаміду












