Похідні піридоіндолону, заміщені у положенні 6, їх одержання і застосування у терапії
Номер патенту: 85709
Опубліковано: 25.02.2009
Автори: Дерок Жан-Марі, Буррі Бернар, Вермют Камілль-Жорж, Мюно Іветт, Чіапетті Паола, Жегам Самір, Сазелла П'єр
Формула / Реферат
1. Сполука, яка відповідає формулі:
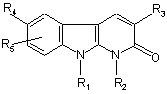 , (I)
, (I)
де:
R1 являє собою атом водню, (С1-С4)-алкіл, групу -(СН2)mОН, групу -(CH2)mCN, групу -(CH2)mNR9R10;
R2 являє собою атом водню або (С1-С4)-алкіл;
R3 являє собою феніл, заміщений радикалами R6, R7, R8;
R4 являє собою:
групу 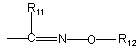 ;
;
гетероциклічний радикал, вибраний з радикалів:
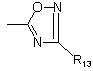 ;
;
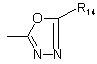 ;
;
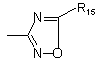 ;
;
R5 являє собою атом водню або (С1-С4)-алкіл;
R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, групу -(CH2)nNR9R10, групу -O-(CH2)mNR9Rl0;
R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом;
R11 являє собою атом водню або (С1-С4)-алкіл;
R12 являє собою атом водню, (С1-С4)-алкіл, групу -(CH2)m-CO-R16;
R13 являє собою атом водню, (С1-С4)-алкіл, феніл, групу -NR17R18, групу
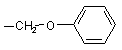 ;
;
R14 являє собою атом водню, (С1-С4)-алкіл, групу -NR17R18;
R15 являє собою атом водню, (С1-С4)-алкіл, групу -NR19R20, -СОО(С1-С4)-алкіл;
R16 являє собою гідроксил, (С1-С4)-алкокси, групу -NR9R10;
R17 і R18 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
R18 може також являти собою групу -COR21, групу -SO2R22;
R19 і R20 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
R20 може також являти собою (С3-С6)-циклоалкіл, (С3-С6)-циклоалкілметил, групу -(CH2)mNR9R10;
R21 являє собою (С1-С4)-алкіл, (С3-С6)-циклоалкіл, групу -(CH2)mNR9 R10;
R22 являє собою (С1-С4)-алкіл;
m дорівнює 1, 2 або 3;
n дорівнює 1, 2 або 3;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
2. Сполука за п. 1, яка відрізняється тим, що:
R1 являє собою атом водню, метил, етил, ціанометил, 2-морфолін-4-ілетил;
R2 являє собою метил;
R3 являє собою феніл, 3-бромфеніл, 4-бромфеніл, 2-хлорфеніл, 3-хлорфеніл, 4-хлорфеніл, 3-фторфеніл, 4-фторфеніл, 3-метилфеніл, 2-метоксифеніл, 3-метоксифеніл, 4-метоксифеніл, 3-ціанофеніл, 4-ціанофеніл, 2,4-дихлорфеніл, 3,5-дифторфеніл, 2,4-диметилфеніл, 2,4-диметоксифеніл, 2-метил-5-фторфеніл, 3-фтор-4-метилфеніл, 3-метил-4-фторфеніл, 4-(амінометил)феніл, 4-(морфолін-4-ілметил)феніл, 4-(2-морфолін-4-ілетокси)феніл;
R4 являє собою:
(гідроксііміно)метил, N-гідроксіетанімідоїл, (етоксііміно)метил, N-етоксіетанімідоїл, (ізобутоксііміно)метил, [(карбоксиметокси)іміно]метил, [(2-етоксі-2-оксоетоксі)іміно]метил, [(2-морфолін-4-іл-2-оксоетоксі)іміно]метил;
3-метил-1,2,4-оксадіазол-5-іл, 3-феніл-1,2,4-оксадіазол-5-іл, 3-аміно-1,2,4-оксадіазол-5-іл, 3-(диметиламіно)-1,2,4-оксадіазол-5-іл, 3-[(циклопропілкарбоніл)аміно]-1,2,4-оксадіазол-5-іл, 3-[(N,N-диметилгліцил)аміно]-1,2,4-оксадіазол-5-іл, 3-[(метилсульфоніл)аміно]-1,2,4-оксадіазол-5-іл, 3-(феноксиметил)-1,2,4-оксадіазол-5-іл;
5-метил-1,3,4-оксадіазол-2-іл, 5-аміно-1,3,4-оксадіазол-2-іл;
5-метил-1,2,4-оксадіазол-3-іл, 5-аміно-1,2,4-оксадіазол-3-іл, 5-(диметиламіно)-1,2,4-оксадіазол-3-іл, 5-(циклопропіламіно)-1,2,4-оксадіазол-3-іл, 5-[(циклопропілметил)аміно]-1,2,4-оксадіазол-3-іл, 5-[(3-морфолін-4-ілпропіл)аміно]-1,2,4-оксадіазол-3-іл, 5-[[2-(диметиламіно)етил]аміно]-1,2,4-оксадіазол-3-іл, 5-(етоксикарбоніл)-1,2,4-оксадіазол-3-іл;
R5 являє собою атом водню;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
3. Сполука формули (І) за п. 1, вибрана з наступних сполук:
6-(3-аміно-1,2,4-оксадіазол-5-іл)-3-(2,4-дихлорфеніл)-1,9-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
3-(2,4-дихлорфеніл)-1,9-диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбальдегідоксим;
3-(2,4-дихлорфеніл)-1,9-диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід-О-етилоксим;
5-[3-(4-дихлорфеніл)-1,9-диметил-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,3,4-оксадіазол-3-амін;
5-[3-(3-фторфеніл)-1,9-диметил-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін;
5-[1,9-диметил-3-(3-метилфеніл)-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін;
3-[4-(амінометил)феніл]-6-(3-аміно-1,2,4-оксадіазол-5-іл)-1,9-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
5-[1,9-диметил-3-[4-(морфолін-4-ілметил)феніл]-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін;
5-[3-(2,4-дихлорфеніл)-1,9-диметил-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,3,4-оксадіазол-2-амін;
N'-[3-[3-(2,4-дихлорфеніл)-1,9-диметил-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-5-іл]-N,N-диметилетан-1,2-діамін;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
4. Спосіб одержання сполук формули (І) за будь-яким з пп. 1-3, де R4 являє собою групу -CR11=N-O-R12, який відрізняється тим, що:
приводять у взаємодію сполуку формули:
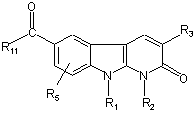 , (II)
, (II)
де R1 R2, R3, R5 і R11 мають такі ж значення, як і визначені для сполуки формули (І) за п. 1,
з похідним гідроксиламіну формули:
H2N-O-R12, (III)
де R12 має таке ж значення, як і визначене для сполуки формули (І) за п. 1.
5. Спосіб одержання сполук формули (І) за будь-яким з пп. 1-3,
де R4 = 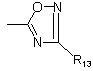 , який відрізняється тим, що:
, який відрізняється тим, що:
приводять у взаємодію сполуку формули:
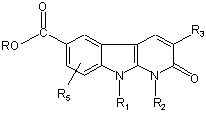 , (IV)
, (IV)
де R1 R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І) за п. 1, і R являє собою атом водню або (С1-С4)-алкіл,
з похідним оксиму формули:
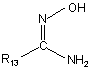 , (V)
, (V)
де R13 має таке ж значення, як і визначене для сполуки формули (І) за п. 1.
6. Спосіб одержання сполук формули (І) за будь-яким з пп. 1-3,
де R4 =  , який відрізняється тим, що:
, який відрізняється тим, що:
здійснюють замикання у цикл у сполуці формули:
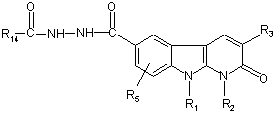 , (IX)
, (IX)
де R1 R2, R3, R5 і R14 мають такі ж значення, як і визначені для сполуки формули (І) за п. 1.
7. Спосіб одержання сполук формули (І) за будь-яким з пп. 1-3, де
R4 = 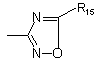 , який відрізняється тим, що:
, який відрізняється тим, що:
приводять у взаємодію сполуку формули:
де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І) за п. 1, з:
а) трихлорацетилхлоридом у присутності основи з одержанням сполуки формули:
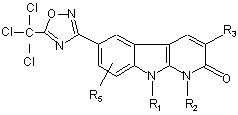 , (XII)
, (XII)
і одержану таким чином сполуку формули (XII) приводять у взаємодію з аміном формули HNR19R20 за необхідності одержання сполуки формули (І), де R15 = HNR19R20;
b) ангідридом формули (R15CO)2O за необхідності одержання сполуки формули (І), де R15 = (С1-С4)-aлкiл;
c) похідним щавлевої кислоти формули ![]() (С1-С4)-алкіл, де Hal являє собою атом галогену, за необхідності одержання сполуки формули (І), де R15 = СОО(С1-С4)-алкіл.
(С1-С4)-алкіл, де Hal являє собою атом галогену, за необхідності одержання сполуки формули (І), де R15 = СОО(С1-С4)-алкіл.
8. Сполука формули:
 , (IX)
, (IX)
де:
R1 являє собою атом водню, (С1-С4)-алкіл, групу -(СН2)mОН, групу -(CH2)mCN, групу -(CH2)mNR9R10;
R2 являє собою атом водню або (С1-С4)-алкіл;
R3 являє собою феніл, заміщений радикалами R6, R7, R8;
R5 являє собою атом водню або (С1-С4)-алкіл;
R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, групу -(CH2)nNR9R10, групу -O-(CH2)mNR9R10;
R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом;
R14 являє собою атом водню, (С1-С4)-алкіл, групу -NR17R18;
R17 і R18 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
R18 може також являти собою групу -COR21, групу -SO2R22;
R21 являє собою (С1-С4)-алкіл, (С3-С6)-циклоалкіл, групу -(CH2)mNR9 R10;
R22 являє собою (С1-С4)-алкіл;
m дорівнює 1, 2 або 3;
n дорівнює 1, 2 або 3.
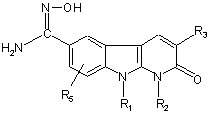
9. Сполука формули:
 , (X)
, (X)
де:
R1 являє собою атом водню, (С1-С4)-алкіл, групу -(СН2)mОН, групу -(CH2)mCN, групу -(CH2)mNR9R10;
R2 являє собою атом водню або (С1-С4)-алкіл;
R3 являє собою феніл, заміщений радикалами R6, R7, R8;
R5 являє собою атом водню або (С1-С4)-алкіл;
R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, групу -(CH2)nNR9R10, групу -O-(CH2)mNR9R10;
R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом;
m дорівнює 1, 2 або 3;
n дорівнює 1, 2 або 3.
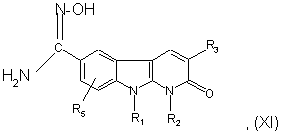
10. Сполука формули:
 , (XI)
, (XI)
де:
R1 являє собою атом водню, (С1-С4)-алкіл, групу -(СН2)mОН, групу -(CH2)mCN, групу -(CH2)mNR9R10;
R2 являє собою атом водню або (С1-С4)-алкіл;
R3 являє собою феніл, заміщений радикалами R6, R7, R8;
R5 являє собою атом водню або (С1-С4)-алкіл;
R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, групу -(CH2)nNR9R10, групу -O-(CH2)mNR9R10;
R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом;
m дорівнює 1, 2 або 3;
n дорівнює 1, 2 або 3.
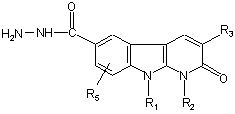
11. Сполука формули:
 , (XII)
, (XII)
де:
R1 являє собою атом водню, (С1-С4)-алкіл, групу -(СН2)mОН, групу -(CH2)mCN, групу -(CH2)mNR9R10;
R2 являє собою атом водню або (С1-С4)-алкіл;
R3 являє собою феніл, заміщений радикалами R6, R7, R8;
R5 являє собою атом водню або (С1-С4)-алкіл;
R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, групу -(CH2)nNR9R10, групу -O-(CH2)mNR9R10;
R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл;
або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом;
m дорівнює 1, 2 або 3;
n дорівнює 1, 2 або 3.
12. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-3 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат, або сольват сполуки формули (І).
13. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-3 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
14. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для одержання лікарського засобу, призначеного для лікування або профілактики захворювань, що викликаються або загострюються проліферацією пухлинних клітин.
Текст
1. Сполука, яка відповідає формулі: 3 85709 4 фтор феніл, 4-фтор феніл, 3-метилфеніл, 24. Спосіб одержання сполук формули (І) за будьметоксифеніл, 3-метоксифеніл, 4-метоксифеніл, 3яким з пп. 1-3, де R4 являє собою груп у -CR11=N-Oціанофеніл, 4-ціанофеніл, 2,4-дихлорфеніл, 3,5R12, який відрізняється тим, що: дифторфеніл, 2,4-диметилфеніл, 2,4приводять у взаємодію сполуку формули: O диметоксифеніл, 2-метил-5-фторфеніл, 3-фтор-4метилфеніл, 3-метил-4-фторфеніл, 4R3 C (амінометил)феніл, 4-(морфолін-4-ілметил)феніл, R11 4-(2-морфолін-4-ілетокси)феніл; (II) R4 являє собою: N N O (гідроксііміно)метил, N-гідроксіетанімідоїл, (етоксіR5 іміно)метил, N-етоксіетанімідоїл, (ізобутоксііміR1 R2 но)метил, [(карбоксиметокси)іміно]метил, [(2, де R1 R2, R3, R5 і R11 мають такі ж значення, як і етоксі-2-оксоетоксі)іміно]метил, [(2-морфолін-4-іл2-оксоетоксі)іміно]метил; визначені для сполуки формули (І) за п. 1, 3-метил-1,2,4-оксадіазол-5-іл, 3-феніл-1,2,4з похідним гідроксиламіну формули: оксадіазол-5-іл, 3-аміно-1,2,4-оксадіазол-5-іл, 3H2N-O-R12, (III) де R12 має таке ж значення, як і визначене для (диметиламіно)-1,2,4-оксадіазол-5-іл, 3сполуки формули (І) за п. 1. [(циклопропілкарбоніл)аміно]-1,2,4-оксадіазол-5-іл, 3-[(N,N-диметилгліцил)аміно]-1,2,4-оксадіазол-5-іл, 5. Спосіб одержання сполук формули (І) за будь3-[(метилсульфоніл)аміно]-1,2,4-оксадіазол-5-іл, 3яким з пп. 1-3, O N (феноксиметил)-1,2,4-оксадіазол-5-іл; 5-метил-1,3,4-оксадіазол-2-іл, 5-аміно-1,3,4де R4 = , який відрізняється тим, що: N оксадіазол-2-іл; R 13 5-метил-1,2,4-оксадіазол-3-іл, 5-аміно-1,2,4приводять у взаємодію сполуку формули: оксадіазол-3-іл, 5-(диметиламіно)-1,2,4O оксадіазол-3-іл, 5-(циклопропіламіно)-1,2,4оксадіазол-3-іл, 5-[(циклопропілметил)аміно]-1,2,4R3 C оксадіазол-3-іл, 5-[(3-морфолін-4-ілпропіл)аміно]RO 1,2,4-оксадіазол-3-іл, 5-[[2(IV) (диметиламіно)етил]аміно]-1,2,4-оксадіазол-3-іл, 5N N O (етоксикарбоніл)-1,2,4-оксадіазол-3-іл; R5 R5 являє собою атом водню; R1 R2 , у вигляді основи або кислотно-адитивної солі, а де R1 R2, R3 і R5 мають такі ж значення, як і визнатакож у вигляді гідрату або сольвату. чені для сполуки формули (І) за п. 1, і R являє со3. Сполука формули (І) за п. 1, вибрана з наступбою атом водню або (С1-С4)-алкіл, них сполук: з похідним оксиму формули: 6-(3-аміно-1,2,4-оксадіазол-5-іл)-3-(2,4OH дихлорфеніл)-1,9-диметил-1,9-дигідро-2НN піридо[2,3-b]індол-2-он; (V) 3-(2,4-дихлорфеніл)-1,9-диметил-2-оксо-2,9C дигідро-1Н-піридо[2,3-b]індол-6R13 NH2 , карбальдегідоксим; де R13 має таке ж значення, як і визначене для 3-(2,4-дихлорфеніл)-1,9-диметил-2-оксо-2,9сполуки формули (І) за п. 1. дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід-О6. Спосіб одержання сполук формули (І) за будьетилоксим; яким з пп. 1-3, 5-[3-(4-дихлорфеніл)-1,9-диметил-2,9-дигідро-1НR14 піридо[2,3-b]індол-6-іл]-1,3,4-оксадіазол-3-амін; O 5-[3-(3-фторфеніл)-1,9-диметил-2,9-дигідро-1Нде R4 = , який відрізняється тим, піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін; N N 5-[1,9-диметил-3-(3-метилфеніл)-2,9-дигідро-1Нщо: піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін; здійснюють замикання у цикл у сполуці формули: 3-[4-(амінометил)феніл]-6-(3-аміно-1,2,4O O оксадіазол-5-іл)-1,9-диметил-1,9-дигідро-2Нпіридо[2,3-b]індол-2-он; R3 R14 C NH NH C 5-[1,9-диметил-3-[4-(морфолін-4-ілметил)феніл](IX) 2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4оксадіазол-3-амін; N N O 5-[3-(2,4-дихлорфеніл)-1,9-диметил-2,9-дигідроR5 R1 R2 1Н-піридо[2,3-b]індол-6-іл]-1,3,4-оксадіазол-2-амін; , N'-[3-[3-(2,4-дихлорфеніл)-1,9-диметил-2,9-дигідроде R1 R2, R3, R5 і R14 мають такі ж значення, як і 1Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-5-іл]визначені для сполуки формули (І) за п. 1. N,N-диметилетан-1,2-діамін; 7. Спосіб одержання сполук формули (І) за будьу вигляді основи або кислотно-адитивної солі, а яким з пп. 1-3, де також у вигляді гідрату або сольвату. 5 R 15 N R4 = , який відрізняється тим, що: N O приводять у взаємодію сполуку формули: N-OH R3 C H2N N N R1 R5 R2 O , (XI) де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І) за п. 1, з: а) трихлорацетилхлоридом у присутності основи з одержанням сполуки формули: Cl Cl C O H2N NH (X) N N (XII) N N R1 R2 O , і одержану таким чином сполуку формули (XII) приводять у взаємодію з аміном формули HNR19R20 за необхідності одержання сполуки формули (І), де R15 = HNR19R20; b) ангідридом формули (R15CO)2O за необхідності одержання сполуки формули (І), де R15 = (С1-С4)aлкiл; c) похідним щавлевої кислоти формули O O (С1-С4)-алкіл, де Hal являє собою Hal C C O атом галогену, за необхідності одержання сполуки формули (І), де R15 = СОО(С 1-С4)-алкіл. 8. Сполука формули: O O NH NH R3 C R5 N R1 R2 R2 N OH R3 C H2N O , де: R1 являє собою атом водню, (С1-С4)-алкіл, групу (СН2)mОН, груп у -(CH 2)mCN, гр упу -(CH2) mNR9R10 ; R2 являє собою атом водню або (С1-С4)-алкіл; R3 являє собою феніл, заміщений радикалами R6, R7, R8; R5 являє собою атом водню або (С1-С4)-алкіл; R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1С4)-алкокси, гідроксил, ціаногрупу, гр упу (CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом; O , де: R1 являє собою атом водню, (С1-С4)-алкіл, групу (СН2)mОН, груп у -(CH 2)mCN, гр упу -(CH2) mNR9R10 ; R2 являє собою атом водню або (С1-С4)-алкіл; R3 являє собою феніл, заміщений радикалами R6, R7, R8; R5 являє собою атом водню або (С1-С4)-алкіл; R6, R7 і R 8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1С4)-алкокси, гідроксил, ціаногрупу, гр упу (CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом; m дорівнює 1, 2 або 3; n дорівнює 1, 2 або 3. 10. Сполука формули: (IX) N N R1 R5 R3 R5 R3 C O N Cl R14 C 85709 6 R14 являє собою атом водню, (С1-С4)-алкіл, групу NR17R18; R17 і R18 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; R18 може також являти собою групу -COR21, груп у SO2R22 ; R21 являє собою (С1-С4)-алкіл, (С3-С6)-циклоалкіл, груп у -(CH2)mNR9 R 10; R22 являє собою (С1-С4)-алкіл; m дорівнює 1, 2 або 3; n дорівнює 1, 2 або 3. 9. Сполука формули: (XI) N R5 N R1 R2 O , де: R1 являє собою атом водню, (С1-С4)-алкіл, групу (СН2)mОН, груп у -(CH 2)mCN, гр упу -(CH2) mNR9R10 ; R2 являє собою атом водню або (С1-С4)-алкіл; R3 являє собою феніл, заміщений радикалами R6, R7, R8; R5 являє собою атом водню або (С1-С4)-алкіл; R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)-алкіл, (С1С4)-алкокси, гідроксил, ціаногрупу, гр упу (CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін 7 85709 8 4-ілу або піперазин-1-ілу, незаміщеного або заміR9 і R10 являють собою незалежно один від одного щеного у положенні 4 (С1-С4)-алкілом; атом водню або (С1-С4)-алкіл; m дорівнює 1, 2 або 3; або R9 і R10 спільно з атомом азоту, з яким вони n дорівнює 1, 2 або 3. зв'язані, утворюють гетероциклічний радикал, виб11. Сполука формули: раний з піролідин-1-ілу, піперидин-1-ілу, морфолінCl 4-ілу або піперазин-1-ілу, незаміщеного або заміO N щеного у положенні 4 (С1-С4)-алкілом; R3 Cl C m дорівнює 1, 2 або 3; N n дорівнює 1, 2 або 3. (XII) Cl 12. Лікарський засіб, який відрізняється тим, що N N O він містить сполуку формули (І) за будь-яким з пп. R5 1-3 або адитивну сіль цієї сполуки з фармацевтичR1 R2 , но прийнятною кислотою, або гідрат, або сольват де: сполуки формули (І). R1 являє собою атом водню, (С1-С4)-алкіл, групу 13. Фармацевтична композиція, яка відрізняється (СН2)mОН, груп у -(CH 2)mCN, гр упу -(CH2) mNR9R10 ; тим, що вона містить сполуку формули (І) за будьR2 являє собою атом водню або (С1-С4)-алкіл; яким з пп. 1-3 або фармацевтично прийнятну сіль, R3 являє собою феніл, заміщений радикалами R6, гідрат або сольват цієї сполуки, а також щонаймеR7, R8; нше один фармацевтично прийнятний ексципієнт. R5 являє собою атом водню або (С1-С4)-алкіл; 14. Застосування сполуки формули (І) за будьR6, R7 і R8 являють собою незалежно один від одяким з пп. 1-3 для одержання лікарського засобу, ного атом водню, атом галогену, (С1-С4)-алкіл, (С1призначеного для лікування або профілактики заС4)-алкокси, гідроксил, ціаногрупу, гр упу хворювань, що викликаються або загострюються (CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; проліферацією пухлинних клітин. Даний винахід стосується похідних піридоіндолону, заміщених у положенні 6, їх одержання і застосування у терапії. У [французькому патенті №9708409] описані сполуки формули: де: - x являє собою атом водню або хлору або метильну груп у або метоксигрупу; - r1 являє собою атом водню або метильну або етильну груп у; - r2 являє собою метильну або етильну групу; або - r1 і r 2 разом утворюють груп у (СН2) 3; - r3 являє собою або фенільну групу, заміщену за необхідності атомом галогену або метильною групою або метоксигрупою, або тієнільну гр упу. В описі цього патенту згадано, що сполуки формули (А), які мають спорідненість до сайтів модуляторів омега, асоційованих з рецепторами ГАМКА, можуть бути використані при лікуванні захворювань, пов'язаних з порушеннями ГАМКергічної передачі, асоційованими з підтипом рецепторів ГАМКA, таких, як тривожні стани, порушення сну, епілепсія і т.д. У [міжнародних заявках WO 2002/087574 і WO 2002/087575] описане застосування сполук формули (А) як протиракових засобів і їх поєднання з іншими протираковими засобами. У [міжнародній заявці WO 2004/041817] описані сполуки формули: д е Ra, Rb, Rc, Rd i Re мають структури, що відрізняються. Дані сполуки виявляють протиракову дію. Даний винахід відноситься до сполук, що відповідають формулі: де: - R1 являє собою атом водню, (С1-С4)-алкіл, груп у -(СН2)mОН, гр уп у -(CH2)mCN, груп у (CH2)mNR9R10; - R2 являє собою атом водню або (С1-С4)алкіл; - R3 являє собою феніл, заміщений радикалами R6, R7, R8; - R4 являє собою: . гр упу ; . гетероциклічний радикал, вибраний з радикалів: 9 85709 10 У межах даного винаходу мається на увазі, що: - R5 являє собою атом водню або (С1-С4)алкіл; - R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, гр упу -(CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; - R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; - або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом; - R11 являє собою атом водню або (С1-С4)алкіл; - R12 являє собою атом водню, (С1-С4)-алкіл, груп у -(CH2)m-CO-R16; - R13 являє собою атом водню, (С1-С4)-алкіл, феніл, гр упу -NR 17R18 , гр упу ; - R14 являє собою атом водню, (С1-С4)-алкіл, груп у -NR17R18; - R15 являє собою атом водню, (С1-С4)-алкіл, груп у -NR19R20, -COO(С1-С4)-алкіл; - R16 являє собою гідроксил, (С1-С4)алкоксигрупу, гр упу -NR9R10; - R17 і R18 являють собою незалежно один від одного атом водню або (С1-С4)- і алкіл; R18 може також являти собою групу -COR 21 , груп у -SO 2R22 ; - R19 і R20 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; R20 може також являти собою (С3-С6)-циклоалкіл, (С3-С6)циклоалкілметил, груп у -(CH2)mNR9R!0; - R21 являє собою (С1-С4)-алкіл, (С3-С6)циклоалкіл, групу -(CH2)mNR9R10; - R22 являє собою (С1-С4)-алкіл; - m дорівнює 1. 2 або 3; - n дорівнює 1, 2 або 3. Сполуки формули (І) можуть містити один або декілька асиметричних атомів вуглецю. Вони можуть, таким чином, існувати у формі енантіомерів або діастереоізомерів. Ці енантіомери, діастереоізомери, а також їх суміші, включаючи рацемічні суміші, становлять частину даного винаходу. Сполуки формули (І) можуть існувати у вигляді основ або кислотно-адитивних солей. Такі адитивні солі становлять частину винаходу. Як ці солі, відповідним чином одержані з фармацевтично прийнятними кислотами, так і солі інших кислот, наприклад, придатні для очищення або виділення сполук формули (І), у рівній мірі становлять частину даного винаходу. Сполуки формули (І) можуть існувати рівним чином у вигляді гідратів або сольватів, а саме, у вигляді асоціатів або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати становлять у рівній мірі частину винаходу. - атом галогену означає фтор, хлор, бром або йод; - (С1-С4)-алкіл означає аліфатичну насичену лінійну або розгалужену групу, що містить від 1 до 4 атомів вуглецю. Як приклади можна згадати метильну, етильну, пропільну, ізопропільну, бутильну, ізобутильну, трет-б утильну гр упи; - (С1-С4)-алкокси означає О-алкіл, де алкільна група є такою, як визначено вище; - (С3-С6)-циклоалкіл означає циклічну алкільну груп у, що містить від 3 до 6 атомів вуглецю, таку як циклопропіл, циклобутил, циклопентил або циклогексил. Серед сполук формули (І) як об'єктів винаходу можна згадати переважні сполуки, що визначаються наступним чином: - R1 являє собою атом водню або (С1-С4)алкіл; - R2 являє собою атом водню або (С1-С4)алкіл; - R3 являє собою феніл, заміщений радикалами R6, R7, R8; - R4 являє собою гідроксіімідоформіл, (С1-С4)алкоксіімідоформіл, оксадіазоліл, незаміщений або заміщений (С1-С4)-алкілом, фенілом або аміногрупою; - R5 являє собою атом водню або (С1-С4)алкіл; - R6, R7 і R8 являють собою незалежно один від одного атом водню або атом галогену, (С1-С4)алкіл, (С1-С4)-алкокси, аміно-, монометиламіно-, диметиламіногрупу. Серед сполук формули (І) як об'єктів винаходу можна також згадати переважні сполуки, що визначаються наступним чином: - R1 являє собою атом водню, метил, етил, ціанометил, 2-морфолін-4-ілетил; - і/або R2 являє собою метил; - і/або R3 являє собою феніл, 3-бромфеніл, 4бромфеніл, 2-хлорфеніл, 3-хлорфеніл, 4хлорфеніл, 3-фторфеніл, 4-фторфеніл, 3метилфеніл, 2-метоксифеніл, 3-метоксифеніл, 4метоксифеніл, 3-ціанофеніл, 4-ціанофеніл, 2,4дихлорфеніл, 3,5-дифторфеніл, 2,4-диметилфеніл, 2,4-диметоксифеніл, 2-метил-5-фторфеніл, 3фтор-4-метилфеніл, 3-метил-4-фторфеніл, 4(амінометил)феніл, 4-(морфолін-4-ілметил)феніл, 4-(2-морфолін-4-ілетокси)феніл; - і/або R4 являє собою: . (гідроксііміно)метил, N-гідроксіетанімідоїл, (етоксііміно)метил, N-етоксіетанімідоїл, (ізобутоксііміно)метил, [(карбоксиметокси)іміно]метил, [(2етоксі-2-оксоетокси)іміно]метил, [(2-морфолін-4-іл2-оксоетокси)іміно]метил; . 3-метил-1,2,4-оксадіазол-5-іл, 3-феніл-1,2,4оксадіазол-5-іл, 3-аміно-1,2,4-оксадіазол-5-іл, 3(диметиламіно)-1,2,4-оксадіазол-5-іл, 3[(циклопропіл-карбоніл)аміно]-1,2,4-оксадіазол-5іл, 3-[(N,N-диметилгліцил)аміно]-1,2,4-оксадіазол5-іл, 3-[(метилсульфоніл)аміно]-1,2,4-оксадіазол-5іл, 3-(феноксиметил)-1,2,4-оксадіазол-5-іл; . 5-метил-1,3,4-оксадіазол-2-іл, 5-аміно-1,3,4оксадіазол-2-іл; 11 85709 12 . 5-метил-1,2,4-оксадіазол-3-іл, 5-аміно-1,2,4- 5-[3-(3-фторфеніл)-1,9-диметил-2,9-дигідрооксадіазол-3-іл, 5-(диметил-аміно)-1,2,41Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін; оксадіазол-3-іл, 5-(циклопропіламіно)-1,2,4- 5-[1,9-диметил-3-(3-метилфеніл)-2,9-дигідрооксадіазол-3-іл, 5-[(циклопропілметил)аміно]-1,2,41Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін; оксадіазол-3-іл, 5-[(3-морфолін-4-ілпропіл)аміно]3-[4-(амінометил)феніл]-6-(3-аміно-1,2,41,2,4-оксадіазол-3-іл, 5-[[2оксадіазол-5-іл)-1,9-диметил-1,9-дигідро-2Н(диметиламіно)етил]аміно]-1,2,4-оксадіазол-3-іл, 5піридо[2,3-b]індол-2-он; (етоксикарбоніл)-1,2,4-оксадіазол-3-іл; 5-[1,9-диметил-3-[4-(морфолін-4- і/або R5 являє собою атом водню; ілметил)феніл]-2,9-дигідро-1H-піридо[2,3-b]індолу вигляді основи або кислотно-адитивної солі, 6-іл]-1,2,4-оксадіазол-3-амін; а також у вигляді гідрату або сольвату. -5 -[3-(2,4-дихлорфеніл)-1,9-диметил-2,9Серед сполук останньої групи можна згадати дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,3,4сполуки формули (І), де: оксадіазол-2-амін; - R1 являє собою атом водню, метил, етил, ціN'-[3-[3-(2,4-дихлорфеніл)-1,9-диметил-2,9анометил, 2-морфолін-4-ілетил; дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4- R2 являє собою метил; оксадіазол-5-іл]-N, N-диметилетан-1,2-діамін; - R3 являє собою феніл, 3-бромфеніл, 4у вигляді основи або кислотно-адитивної солі, бромфеніл, 2-хлорфеніл, 3-хлорфеніл. 4а також у вигляді гідрату або сольвату. хлорфеніл, 3-фторфеніл, 4-фторфеніл, 3Під захисною групою Gp або G'p далі розуміметилфеніл, 2-метоксифеніл, 3-метоксифеніл, 4ють групу, яка, з одного боку, захищає у ході синметоксифеніл, 3-ціанофеніл, 4-ціанофеніл, 2,4тезу функціональну груп у, таку, як гідрокси- або дихлорфеніл, 3,5-дифторфеніл, 2,4-диметилфеніл, аміногрупа, і, з іншого боку, дозволяє відновлюва2,4-диметоксифеніл, 2-метил-5-фторфеніл, 3ти функціональну груп у без зміни у кінці синтезу. фтор-4-метилфеніл, 3-метил-4-фторфеніл, 4Приклади захисних гр уп, також як і методи вве(амінометил)феніл, 4-(морфолін-4-ілметил)феніл, дення і видалення захисних груп, наведені у [ви4-(2-морфолін-4-ілетокси)феніл; данні «Protective Groups in Organic Synthesis», - R4 являє собою: Green et al., 2nd Edition (John Wiley & Sons; Inc., . (гідроксііміно)метил, N-гідроксіетанімідоїл, New York, 1991)]. (етоксііміно)метил, N-етоксіетанімідоїл, (ізобутоксіПід відхідною групою далі розуміється група, іміно)метил, [(карбоксиметокси)іміно]метил, [(2яка може бути легко відщеплена від молекули етоксі-2-оксоетокси)іміно]метил, [(2-морфолін-4-ілрозривом гетеролітичного зв'язку, з видаленням 2-оксоетокси)іміно]метил; електронної пари. Така група також може бути . 3-метил-1,2,4-оксадіазол-5-іл, 3-феніл-1,2,4легко замінена іншою групою, наприклад, за реакоксадіазол-5-іл, 3-аміно-1,2,4-оксадіазол-5-іл, 3цією заміщення. Такими відхідними групами є, на(диметиламіно)-1,2,4-оксадіазол-5-іл, 3приклад, галогени або активна гідроксигрупа, така, [(циклопропіл-карбоніл)аміно]-1,2,4-оксадіазол-5як метансульфонат, бензолсульфонат, піл, 3-[(N,N-диметилгліцил)аміно]-1,2,4-оксадіазолтолуолсульфонат, трифла т, ацетат і т.д. Приклади 5-іл, 3-[(метилсульфоніл)аміно]-1,2,4-оксадіазол-5відхідних груп, також як і способи їх одержання, іл, 3-(феноксиметил)-1,2,4-оксадіазол-5-іл, наведені у [виданні «Advanced Organic Chemistry», . 5-метил-1,3,4-оксадіазол-2-іл, 5-аміно-1,3,4J. March, 3rd Edition, Wiley Interscience, p. 310-316, оксадіазол-2-іл; 1985]. . 5-метил-1,2,4-оксадіазол-3-іл, 5-аміно-1,2,4За даним винаходом сполуки загальної фороксадіазол-3-іл, 5-(диметил-аміно)-1,2,4мули (І) можна одержати наведеними далі спосооксадіазол-3-іл, 5-(циклопропіламіно)-1,2,4бами. оксадіазол-3-іл, 5-[(циклопропілметил)аміно]-1,2,4За даним винаходом сполуки формули (І), де оксадіазол-3-іл, 5-[(3-морфолін-4-ілпропіл)аміно]R4 являє собою групу -CR11=N-O-R 12 , можна одер1,2,4-оксадіазол-3-іл, 5-[[2жати способом, який відрізняється тим, що: (диметиламіно)етил]аміно]-1,2,4-оксадіазол-3-іл, 5приводять у взаємодію сполуку формули: (етоксикарбоніл)-1,2,4-оксадіазол-3-іл; - R5 являє собою атом водню; у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату. Серед сполук формули (І) як об'єктів винаходу можна, зокрема, згадати наступні сполуки: 6-(3-аміно-1,2,4-оксадіазол-5-іл)-3-(2,4дихлорфеніл)-1,9-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; - 3-(2,4-дихлорфеніл)-1,9-диметил-2-оксо-2,9де R1, R2, R3, R5 і R 11 мають такі ж значення, як дигідро-1H-піридо[2,3-b]індол-6і визначені для сполуки формули (І), з похідним карбальдегідоксим; гідроксиламіну формули: - 3-(2,4-дихлорфеніл)-1,9-диметил-2-оксо-2,9дигідро-1H-піридо[2,3-b]індол-6-карбальдегід-Оетилоксим; - 5-[3-(4-хлорфеніл)-1,9-диметил-2,9-дигідроде R12 має таке ж значення, як і визначене для 1Н-піридо[2,3-b]індол-6-іл]-1,2,4-оксадіазол-3-амін; сполуки формули (І). 13 85709 14 При R11=Н взаємодія здійснюється у полярно етилат натрію, у присутності вологопоглинаючого му розчиннику, такому, як спирт, наприклад, метаагента, такого, як цеоліт, у розчиннику, такому, як нол або етанол, при температурі в інтервалі від діоксан, тетрагідрофуран або етанол, при темпекімнатної температури до температури кипіння ратурі в інтервалі від кімнатної температури до розчинника. температури кипіння розчинника. При R11=(С1-С4)-aлкiл взаємодія здійснюється Відповідно до одного варіанту здійснення цьоу полярному розчиннику, такому, як етанол, у приго способу, за умови, що R1 і/або R2 Η, можна одесутності основи, такої, як карбонат лужного металу, наприклад, карбонат калію, при температурі в ржати сполуку формули (І), де: R4= , інтервалі від кімнатної температури до температури кипіння розчинника. де R17 і/або R18 являють собою (С1-С4)-алкіл, взаВідповідно до одного варіанту здійснення цього способу, за умови, що R1 і/або R2 Η, можна одержати сполуку формули (І), де R4 являє собою ємодією сполуки формули (І), де R4= ,з груп у -CR11=N-O-R 12, де R12 являє собою (С1-С4)алкіл або групу -(CH2)mCOR 16, взаємодією сполуки (С1-С4)-алкілгалогенідом у присутності основи, формули (І), де R4 являє собою групу -CR11=N-OH, такої, як гідрид натрію, у розчиннику, такому, як з галогенпохідним формули Hal-R12, де Hal являє Ν,Ν-диметилформамід, при температурі в інтерсобою атом галогену, переважно хлор або бром, у валі від кімнатної температури до температури присутності основи, такої, як гідрид лужного метакипіння розчинника. Таким же чином, взаємодією зі лу, наприклад, гідрид натрію, у розчиннику, такосполукою формули R21COHal або R22SO2Hal, де му, як Ν,Ν-диметилформамід, при температурі в Hal являє собою атом галогену, у присутності осінтервалі від кімнатної температури до температунови, такої, як піридин або триетиламін, у розчинри кипіння розчинника. нику, такому, як дихлорметан або Ν,ΝЗа даним винаходом сполуки формули (І), де диметилформамід, при температурі в інтервалі від кімнатної температури до температури кипіння R4= , можна одержати способом, який розчинника можна одержати сполуки формули (І), відрізняється тим, що: приводять у взаємодію сполуку формули: де R4= , де R18=-COR21 або -SO2R22. Зокрема, рівним чином можна одержати сполуку формули (І), де R4= , відповідно до різних стадій способу, описаного далі на схемі І. де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І), і R являє собою атом водню або (С1-С4)-алкіл, з похідним оксиму формули: де R13 має таке ж значення, як і визначене для сполуки формули (І). У тому випадку, коли у сполуці формули (IV) R являє собою атом водню, взаємодія здійснюється у присутності зв'язувального агента, такого, як дициклогексилкарбодіімід, карбонілдіімідазол, гексафторфосфат бензотриазол-1ілокситрис(диметиламіно)фосфонію або гексафторфосфат бензотриазол-1ілокситрипіролідинофосфонію, у розчиннику, такому, як дихлорметан або Ν,Ν-диметилформамід, при температурі в інтервалі від кімнатної температури до [ температури кипіння розчинника. У тому випадку, коли у сполуці формули (IV) R являє собою (С1-С4)-алкіл, взаємодія здійснюється у присутності основи, такої, як гідрид натрію або На стадії а) схеми І приводять у взасмодію кислоту формули (IV) з тіонілхлоридом у розчиннику, такому, як тетрагідрофуран, при температурі в інтервалі від 0°С до кімнатної температури для одержання хлорангідриду відповідної кислоти. На стадії b) взаємодія хлорангідриду кислоти з ціанамідом без розчинника або у розчиннику, такому, як THF, при температурі в інтервалі від кімнатної температури до температури кипіння розчинника або при температурі плавлення ціанаміду дозволяє одержати відповідне похідне Nціанокарбоксаміду, яке на стадії с) взаємодією з гідроксиламіном у розчиннику, і акому як піридин, 15 85709 16 при температурі в інтервалі від кімнатної темпералуол-4-суль фонова кислота, при температурі в тури до 120°С дозволяє одержати необхідну споінтервалі від кімнатної температури до 150°С. луку формули (І). За варіантом здійснення способу, за умови, За даним винаходом сполуки формули (І), де що R1 і/або R2 H, можна одержати сполуку загальR4= , можна одержати способом, який відрізняється тим, що: здійснюють замикання у цикл у сполуці формули: ної формули (І), де R 4= , де R17 і/або R18 являють собою (С1-С4)-алкіл або R18 може до того ж являти собою групу -COR21 , груп у -SO2R 22, виходячи зі сполуки формули (І), де R4= , за раніше описаними способами. За даним винаходом сполуку формули (І), де R4= де R1, R2, R3, R5 і R 14 мають такі ж значення, як і визначені для сполуки формули (І). Реакція замикання у цикл здійснюється у загальному випадку у присутності каталітичної кількості кислоти, такої, як толуол-4-сульфонова кислота, у розчиннику, такому, як толуол, при температурі в інтервалі від кімнатної температури до температури кипіння розчинника з видаленням води, що утворюється, зв'язуванням в азеотроп. За одним з варіантів способу замикання у цикл здійснюють взаємодією сполуки формули (IX) з толуол-4-сульфонілхлоридом у присутності основи, такої, як триетиламін, у розчиннику, такому, як дихлорметан, при температурі в інтервалі від кімнатної температури до температури кипіння розчинника. За іншим варіантом способу замикання у цикл здійснюють у присутності оксихлориду фосфору способом, описаним у [виданні J. Org. Chem. USSR, 1989, 25 (5), 935-940]. Зокрема, сполуку формули (І), де R4= , можна одержати взаємодією спо луки формули: , можна одержати способом, який відрізняється тим, що: приводять у взаємодію сполуку формули: де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І), з: а) трихлорацетилхлоридом у присутності основи для одержання сполуки формули: і одержану таким чином сполуку формули (XII) приводять у взаємодію з аміном формули HNR19R20 за необхідності одержання сполуки формули (І), де R15=HNR19R20; b) ангідридом формули (R15CO)2O за необхідності одержання сполуки формули (І), де R15=(С1С4)-алкіл; c) похідним щавлевої кислоти формули (С1-С4)-алкіл, де Hal являє собою атом де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І), з ціанбромідом у розчиннику, такому, як метанол, при температурі в інтервалі від кімнатної температури до температури кипіння розчинника, з подальшим гідролізом у лужному середовищі. Також, зокрема, сполуку формули (І), де R4= , можна одержати взаємодією спо луки формули (X) з триетилортоацетатом у присутності каталітичної кількості кислоти, такої, як то галогену, за необхідності одержання сполуки формули (І), де R15=СОО(С1-С4)-алкіл. На стадії а) взаємодія здійснюється у присутності основи, такої, як піридин або Nметилпіролідин-2-он, у розчиннику, такому, як діоксан, при температурі в інтервалі від кімнатної температури до температури кипіння розчинника. Далі взаємодія сполуки (XII) з аміном здійснюється у розчиннику, такому, як тетрагідрофуран або Ν,Νдиметилформамід, при температурі в інтервалі від -78°С до кімнатної температури. На стадії b) взаємодія здійснюється у присутності кислоти, такої, як оцтова кислота, при температурі в інтервалі від кімнатної температури до температури кипіння реакційної суміші. 17 85709 18 На стадії с) взаємодія здійснюється у присутбою груп у -COR11 або (С1-С4)-алкоксикарбоніл, ності основи, такої, як піридин, у розчиннику, такоприводять у взаємодію зі складним ефіром форму, як 1,2-дихлоретан, при температурі в інтервалі мули: від 0°С до температури кипіння розчинника. Сполуку формули (І), де R1 і/або R2 являють собою групу (С1-С4)-алкіл, можна одержати рівним чином взаємодією сполуки формули (І), де R1 і/або R2 являють собою атом водню, з (С1-С4)алкілгалогенідом, у присутності основи, такої, як гідрид натрію, у розчиннику, такому, як Ν,Νде R3 має таке ж значення, як і визначене для диметилформамід, при температурі в інтервалі від сполуки формули (І), і Alk являє собою (С1-С4)кімнатної температури до температури кипіння алкіл. розчинника. Сполука формули (І), де R1 являє собою групу Взаємодію здійснюють у полярному розчиннику, переважно, лужному, наприклад, у піридині, -(СН2)mОН, може бути одержана рівним чином при температурі в інтервалі від кімнатної темперавзаємодією сполуки формули (І), де R1=H, зі спотури до температури кипіння розчинника. лукою формули X-(CH2)mO-Gp, де X є відхідною Рівним чином можна одержати сполуки форгрупою, такою ж, як і визначена раніше, і Gp є Озахисною групою, у присутності основи, такої, як мули (II) або (IV) іншим способом, приводячи у взаємодію 2-аміноіндол формули: гідрид натрію, у розчиннику, такому, як Ν,Νдиметилформамід, при температурі в інтервалі від 0°С до температури кипіння розчинника з подальшою обробкою одержаної таким чином сполуки для видалення О-захисної групи відомими способами. Сполука формули (І), де R1 являє собою групу -(CH2)mCN, може бути одержана рівним чином взаємодією сполуки формули (І) Hal-(CH 2)mCN, де де R1, R2, RIV і R5 мають такі ж значення, як і Hal являє собою атом галогену, у присутності освизначені раніше, зі складним ефіром формули: нови, такої, як карбонат лужного металу, наприклад, карбонат калію, у розчиннику, такому, як Ν,Ν-диметилформамід, при температурі в інтервалі від кімнатної температури до температури кипіння розчинника. Сполука формули (І), де R1 являє собою групу -(CH2)mNR9R10, може бути одержана рівним чином взаємодією сполуки формули (І), де R1=H, зі сполукою формули X-(CH2)mNR9R10 , де X являє собою де R3 має таке ж значення, як і визначене для відхідну груп у, таку ж, як і визначена раніше, у сполуки формули (І), і Alk являє собою (С1-С4)присутності основи, такої, як карбонат лужного алкіл. металу, наприклад, карбонат калію, у розчиннику, Взаємодію здійснюють у полярному протонтакому, як Ν,Ν-диметилформамід, при температурі ному розчиннику, переважно, у кислому середов інтервалі від 0°С до температури кипіння розвищі, при температурі в інтервалі від кімнатної чинника. температури до температури кипіння розчинника. Одержані таким чином сполуки формули (І) Одержання сполуки формули (VIII) здійснюдалі можуть бути виділені з реакційної маси і очиється з використанням диметокси-Ν,Νщені традиційними способами, наприклад, кристадиметилметанаміну за способом, подібним до лізацією або хроматографією. описаного у [виданні J. Org. Chem., 1982, 47, 2846Одержані таким чином сполуки формули (І) 2851], або з використанням реактиву Бредерека виділяють у вигляді вільної основи або солі тради(трет-бутоксибіс(диметиламіно)метан) відповідно ційними способами. до [видання Liebigs Ann. Chem., 1980, 3, 344-357]. Сполуки формули (II) і (IV) можуть бути одерУ загальному випадку, рівним чином можна жані способами, описаними у [французькому патеодержати сполуку формули: нті №9708409 або у міжнародній заявці WO 2004/041817]. За цим способом 2-аміноіндол формули: де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І), і RIV являє со де замісники R'1, R'2, R'3, R'4 , R'5 є попередниками замісників R1, R2, R3, R4, R5, визначених для сполуки формули (І), способами, що трансформуються далі, відомими фахівцеві у даній галузі тех 19 85709 20 ніки, для одержання замісників R1, R2, R3, R4 , R5, При R=(С1-С4)-алкіл складний ефір формули необхідних для сполуки формули (І). (IV) приводять у взаємодію з гідразином у розчинСполуки формули (XIV), де R4 є ціаногрупою, нику, такому, як етанол, при температурі в інтерможуть бути перетворені у сполуки формули (II), валі від кімнатної температури до температури де R11=H, дією нікелю Ренея у присутності гіпофокипіння розчинника. сфіту натрію. Сполуки формули (XI) одержують взаємодією Сполука формули (II), де R11 являє собою (С1сполуки формули: С4)-алкіл, може бути одержана рівним чином взаємодією сполуки формули (XIV), де R' 4=H, зі сполукою формули R11COCl у присутності АІСl3 у розчиннику, такому, як дихлорметан. при температурі в інтервалі від 0°С до кімнатної температури. Сполуки формули (III) відомі або їх одержують відомими способами. Сполуки формули (V) відомі або їх одержують де R'1, R'2 , R'3 і R'5 мають такі ж значення, як і відомими способами. визначені раніше, з гідроксиламіном у присутності Сполуки формули (VII) відомі або їх одержуоснови, такої, як триетиламін, у розчиннику, такоють способами, описаними у [заявці WO му, як етанол, при температурі в інтервалі від кім2004/041817]. натної температури до температури кипіння розСполуки формули (IX) одержують взаємодією чинника. сполуки формули: Сполуки формули (XIV: R' 4=CN) відомі або їх одержують способами, описаними у [заявці WO 2004/041817]. Даний винахід в одному з інших його аспектів відноситься у рівній мірі до сполук формули (IX), (X), (XI) і (XII). Ці сполуки можуть бути використані як проміжні продукти у синтезі сполук формули (І). Таким чином, винахід відноситься до сполук формули: де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І), з кислотою або функціональним похідним даної кислоти формули: де R14 має таке ж значення, як і визначене для сполуки формули (І), за традиційними способами ацилювання. Сполуки формули (X) одержують, виходячи зі сполук формули: де R1, R2, R3 і R5 мають такі ж значення, як і визначені для сполуки формули (І), і R являє собою атом водню або (С1-С4)-алкіл. При R=H саму кислоту формули (IV) або функціональне похідне цієї кислоти приводять у взаємодію зі сполукою формули: де Pg являє собою N-захисну гр упу, таку, як трет-бутилоксикарбоніл, за традиційними способами пептидного зв'язування і з одержаної проміжної сполуки видаляють захисну гр упу традиційними способами. де: - R1 являє собою атом водню, (С1-С4)-алкіл, груп у -(СН2)mОН, гр уп у -(CH2)mCN, груп у (CH2)mNR9R10; - R2 являє собою атом водню або (С1-С4)алкіл; - R3 являє собою феніл, заміщений радикалами R6, R7, R8; - R5 являє собою атом водню або (С1-С4)алкіл; - R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, гр упу -(CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; - R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; - або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом; - R14 являє собою атом водню, (С1-С4)-алкіл, груп у -NR17R18; - R17 і R18 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; R18 може також являти собою групу -COR 21 , груп у -SO 2R22 ; 21 85709 22 - R21 являє собою (С1-С4)-алкіл. (С3-С6)- або R9 і R10 спільно з атомом азоту, з яким циклоалкіл, групу -(CH2)mNR9R10; вони зв'язані, утворюють гетероциклічний радикал, - R22 являє собою (С1-С4)-алкіл; вибраний з піролідин-1-ілу, піперидин-1-ілу, мор- m дорівнює 1, 2 або 3; фолін-4-ілу або піперазин-1-ілу, незаміщеного або - n дорівнює 1, 2 або 3. заміщеного у положенні 4 (С1-С4)-алкілом; Винахід також стосується сполук формули: - m дорівнює 1, 2 або 3; - n дорівнює 1, 2 або 3. Винахід також стосується сполук формули: де: - R1 являє собою атом водню, (С1-С4)-алкіл, груп у -(СН2)mОН, гр уп у -(CH2)mCN, груп у (CH2)mNR9R10; - R2 являє собою атом водню або (С1-С4)алкіл; - R3 являє собою феніл, заміщений радикалами R6, R7, R8; - R5 являє собою атом водню або (С1-С4)алкіл; - R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, гр упу (CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; - R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; - або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом; - m дорівнює 1, 2 або 3; - n дорівнює 1, 2 або 3. Винахід також стосується сполук формули: де: - R1 являє собою атом водню, (С1-С4)-алкіл, груп у -(СН2)mОН, гр уп у -(CH2)mCN, груп у (CH2)mNR9R10; - R2 являє собою атом водню або (С1-С4)алкіл; - R3 являє собою феніл, заміщений радикалами R6, R7, R8; - R5 являє собою атом водню або (С1-С4)алкіл; - R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, гр упу (CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; - R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; де: - R1 являє собою атом водню, (С1-С4)-алкіл, груп у -(СН2)mОН, гр уп у -(CH2)mCN. груп у (CH2)mNR9R10; - R2 являє собою атом водню або (С1-С4)алкіл; - R3 являє собою феніл, заміщений радикалами R6, R7, R8; - R5 являє собою атом водню або (С1-С4)алкіл; - R6, R7 і R8 являють собою незалежно один від одного атом водню, атом галогену, (С1-С4)алкіл, (С1-С4)-алкокси, гідроксил, ціаногрупу, гр упу -(CH2)nNR9R10, груп у -O-(CH 2)mNR9R10 ; - R9 і R10 являють собою незалежно один від одного атом водню або (С1-С4)-алкіл; - або R9 і R10 спільно з атомом азоту, з яким вони зв'язані, утворюють гетероциклічний радикал, вибраний з піролідин-1-ілу, піперидин-1-ілу, морфолін-4-ілу або піперазин-1-ілу, незаміщеного або заміщеного у положенні 4 (С1-С4)-алкілом; - m дорівнює 1, 2 або 3; - n дорівнює 1, 2 або 3. Якщо не вказано інше, спектри ядерного магнітного резонансу (ЯМР 1H) протону записані у ДМСО-d6 , стандарт вміщений у ДМСО-d6 і відповідає 2,5м.ч. тетраметилсилану. Сигнали ЯМР, що спостерігаються, також позначені як: с: синглет; с ушир.: уширений синглет; д: дублет; дд: дубль дублетів; т: триплет; тд: дубль триплетів; кв: квартет; м: масив; мт: мультиплет. У наступних прикладах описане одержання деяких сполук за даним винаходом. Ці приклади не є вичерпними і наведені тільки для ілюстрації даного винаходу. Номери сполук у наведених прикладах відповідають номерам таблиці, наведеної далі для ілюстрації хімічної структури і фізичних властивостей деяких сполук за даним винаходом. У дослідах і прикладах, наведених далі, використані наступні скорочення: DIPEA: діізопропілетиламін TEA: триетиламін DMA: диметилацетамід DMF: диметилформамід ЕР: петролейний ефір DMFD MA: диметилформамід-диметилацеталь NMP: N-метилпіролідин-2-он LAH: гідрид літію-алюмінію THF: тетрагідрофуран 23 85709 24 Ether: діетиловий ефір Розчиняють 9г сполуки, одержаної на попереDCM: ди хлорметан дній стадії, у 50мл РОСl3 і нагрівають при 80°С CDI: карбонілдіімідазол протягом 2 годин. Після охолоджування до кімнатAcOEt: е тилацетат ної температури додають діетиловий ефір, утвоАсОН: оцтова кислота рений осад відфільтровують, потім промивають dppp: 1,3-трис(дифенілфосфіно)пропан діетиловим ефіром. Одержують 8,2г необхідної iРrOН: ізопропіловий спирт сполуки. реактив Бредерека: третЯМР CDCl3 (300МГц): 4,31м.ч.: с: 3H; 7,14бутоксибіс(диметиламіно)метан 7,87м.ч.: м: 4Н; 10,70м.ч.: м: 1Н; 12,62м.ч.: с: 1Н. DDQ: 2,3-дихлор-5,6-диціано-1,4-бензохінон Дослід 1.2 РуВОР: гексафторфосфат(бензотриазол-1Метил-1-метил-2-(метиламіно)-1H-індол-5ілокси)трипіролідинофосфонію карбоксилат ТА: кімнатна температура A) Ме тил-4-(2-ацетилгідразино)бензоат F: температура плавлення Розчиняють 5,5г метил-4-гідразинбензоату в Одержання сполук формули (VI) 38,2мл АсОН, що містить 2,4г ацетату натрію, наСполуки загальної формули (VI) можуть існугрівають протягом 18 годин при 80°С. Тверду фазу вати у 2 та утомерних формах: відділяють від рідини, потім випарюють і обробляють мінімальною кількістю Еt2О. Відділяють від рідини з одержанням 7,97г необхідної сполуки. B) Метил-4-(2-ацетил-1,2диметилгідразино)бензоат Суспендують 2,95г 95%-ного NaH у 90мл DMF і додають по краплях 8,135г сполуки, одержаної на або попередній стадії, у вигляді розчину у мінімальній кількості DMF, потім через декілька хвилин додають по краплях 9,75мл метилйодиду. Перемішують протягом 1 години при кімнатній температурі. Виливають реакційну масу у насичений розчин NH4Cl і екстрагують AcOEt. Органічну фаз у промивають NaCl, сушать і випарюють з одержанням 5,4г необхідної сполуки. Дослід 1.1 C) Метил-1-метил-2-(метиламіно)-1Н-індол-5Гідрохлорид N-метил-5-бром-1Н-індол-2-аміну карбоксилат А) N'-(4-Бромфеніл)-N-формілгідразин Змішують 5,4г сполуки, одержаної на попереРозчиняють 10г гідрохлориду 4дній стадії, з 62мл оксихлориду фосфору і нагрібромфенілгідразину у 30мл води, додають 6,2г вають протягом 2 з половиною годин при 80°С. K2СО3 і 36мл метилформіату, потім нагрівають зі Реакційну масу випарюють і обробляють AcOEt. зворотним холодильником протягом 1 години, далі Утворену тверду речовину відділяють від рідини, витримують при кімнатній температурі протягом 12 промивають AcOEt і сушать з одержанням 4г негодин. Утворений осад відфільтровують, потім обхідної сполуки. промивають сумішшю ізопропанол/ЕР (50/50 ЯМР MeOD (250МГц): 3,2м.ч.: с: 3H; 3,6м.ч.: с: об./об.)· Одержують 10,5г необхідної сполуки. 3H; 3,9м.ч.: с: 3H; 7,3-7,4м.ч.: м: 2Н; 8,1-8,2м.ч.: м: ЯМР CDCl3 (300МГц): 6,73-6,77м.ч.: м: 2Н; 2Н. 7,34-7.41м.ч.: м: 2Н; 8,33м.ч.: м: 1Н. Дослід 1.3 В) N-Метил-N'-(4-бромфеніл)ацетогідразин Метил-2-(метиламіно)-1Н-індол-5-карбоксилат Нагрівають зі зворотним холодильником розA) Метил-4-(2-ацетил-2чин 80мл LAH у THF, додають 10,5г сполуки, одеметилгідразино)бензоат ржаної на стадії А, у вигляді суспензії у 60мл THF, Розчиняють 10г сполуки, одержаної на стадії A потім нагрівають зі зворотним холодильником продосліду 1.2, в 60мл безводного DMF і охолоджутягом 15 годин. Охолоджують реакційну масу, поють до 0°С. Додають малими порціями 1,9г 60%тім додають по краплях 12мл води і 9мл 1N розчиного NaH і перемішують до припинення виділення ну NaOH. Фільтрують через CeliteÒ для видалення газу. Додають 4,5мл СН 3І і перемішують протягом нерозчиненої речовини, потім промивають AcOEt і 20 хвилин при 0°С. Реакційну масу виливають у реакційну масу випарюють досуха. Обробляють насичений розчин NH 4CI, потім екстрагують AcOEt. 80мл АсОН і додають розчин 17г K2СО3 у 80мл Органічну фазу промивають насиченим розчином води, потім додають 4мл оцтового ангідриду і пеNaCl, сушать над MgSO4, потім очищають хромаремішують протягом 1 години при кімнатній темтографією на діоксиді кремнію, елююючи сумішшю пературі. Декантують, потім органічну фазу сушать AcOEt/циклогексан спочатку у співвідношенні над MgSO4 і випарюють досуха. Додають петро(50/50 об./об.), потім у співвідношенні (75/25 лейний ефір, потім утворену кристалічну речовину об./об.). Одержують 6,2г необхідної сполуки. відфільтровують і одержують 9г необхідної сполуЯМР ДМСО (300МГц): 2,15м.ч.: с: 3H; 3,17м.ч.: ки. с: 3H; 3,89 мл.: с: 3H; 6,11м.ч.: с: 1Н; 6,71м.ч.: д: ЯМР CDCl3 (300МГц): 2,15м.ч.: с: 3H; 3,13м.ч.: 2Н; 7,98м.ч.: д: 2Н. с: 3H; 6,57-6,62м.ч.: м: 2Н; 7,32-7,40м.ч.: м: 2Н. B) Метил-2-(метиламіно)-1H-індол-5С) Гідрохлорид N-метил-5-бром-1Н-індол-2карбоксилат аміну 25 85709 26 Розчиняють 5,3г сполуки, одержаної на попегують AcOEt і сушагь над MgSO4. Одержують 5,2г редній стадії, у 30мл РОСI3 і нагрівають протягом необхідної сполуки у вигляді рідини. 2 годин при 80°С. Після охолоджування реакційної ЯМР CDCl3 (300МГц): 1,18м.ч.: т: 3H; 3,50м.ч.: маси додають діетиловий ефір і перемішують. с: 2Н; 4,08м.ч.: кв: 2Н; 7,09-7,37м.ч.: м: 4Н. Утворений осад відфільтровують, потім промиваВ) Етил-2-(3-бромфеніл)-3-гідрокси-2ють діетиловим ефіром з одержанням 3,2г необпропеноат хідної сполуки. Розчиняють 5,2г сполуки, одержаної на попеЯМР ДМСО (300МГц): 3,08м.ч.: с: 3H; 3,85м.ч.: редній стадії, у 70мл етилформіату і додають мас: 3H; 4,25м.ч.: с: 2Н; 6,29м.ч.: д: 1Н; 8м.ч.: м: 2Н; лими порціями 1,7г 60%-ного NaH. Перемішують 10,78м.ч.: с: 1Н; 12,64м.ч.: с: 1Н. при кімнатній температурі протягом 5 годин. РеакДослід 1.4 ційну суміш виливають у 100мл 1N розчину HCl, 1-Метил-2-(метиламіно)-1Н-індол-5погім екстрагують AcOEt, сушать над MgSO4 і викарбонітрил парюють досуха. Одержують 5,8г необхідної споА) N'-(4-Ціанофеніл)-ацетогідразид луки у вигляді маслоподібного продукту. До розчину 5г гідрохлориду 4-ціанофенілі ідЯМР CDCl3 (300МГц): 1,9м.ч.: т: 3H; 4,20м.ч.: разину у 40мл оцтової кислоти додають 2,7г ацекв: 2Н; 7,11-7,42м.ч.: м: 2Н; 12,06м.ч.: д: 1Н. тату натрію, потім нагрівають при 80°С протягом Дослід 2.2 20 годин. Реакційну суміш концентрують у вакуумі, Етил-2-(2,4-диметилфеніл)-3залишок обробляють водою, екстрагують AcOEt, диметиламіноакрилат (VIII) органічну фазу промивають насиченим розчином A) 1-Бромметил-2,4-диметилбензол NaCl, сушать над MgSO 4 і випарюють розчинник у Розчиняють 5г (2,4-диметилфеніл)метанолу у вакуумі. Залишок розтирають у суміші EP/AcOEt 100мл діетилового ефіру. Реакційну масу охоло(90/10 об./об.) і утворений осад відділяють від ріджують до 0°С. Додають по краплях 5,2мл тридини. Одержують 4,8г необхідної сполуки. броміду фосфору. Перемішують при кімнатній температурі протягом ночі. Реакційну масу ЯМР 1H: CDCl3 (300МГц): d (м.ч.): 1,92: с: 3H; виливають на лід і екстрагують AcOEt. Органічну 6,75: д: 2Н; 7,53: д: 2Н; 8,25: с: 1Н;9,76:с: 1Н. фазу промивають насиченим розчином NaCl. ПоВ) N'-(4-Цiaнофеніл)-N,N'диметилацетогідразид тім органічну фазу суша ть над MgSO4, фільтр ують і випарюють досуха. Одержують 7,3г необхідної До суспензії 2,8г NaH у вигляді масла з концесполуки. нтрацією 60% у 50мл DMF додають по краплях при ЯМР CDCl3 (300МГц): 2,28м.ч.: с: 3H; 2,35м.ч.: кімнатній температурі розчин 4,8 і сполуки, одерс: 3H; 4,48м.ч.: с: 2Н; 6,90-7,22м.ч.: м: 3H. жаної на попередній стадії, у 20мл DMF і перемішують до припинення виділення газу. Далі додаB) (2,4-Диметилфеніл)ацетонітрил Розчиняють 7,3г сполуки, одержаної на попеють 6,8мл метилйодиду, потім перемішують редній стадії, у 120мл етанолу і 30мл води. Додапротягом 2 годин при кімнатній температурі. Реакють 4,7г ціаніду калію. Нагрівають зі зворотним ційну суміш виливають у насичений розчин NH4CI, холодильником протягом 5 годин. Випарюють етаекстрагують етилацетатом AcOEt, органічну фазу промивають насиченим розчином NaCl, сушать нол і залишок обробляють водою. Екстрагують AcOEt, потім органічну фазу промивають насиченад MgSO4 і випарюють розчинник у вакуумі. Заним розчином NaCl. Органічну фазу сушать над лишок обробляють ЕР і утворений осад відділяють MgSO4 , фільтрують і випарюють досуха. Одержувід рідини. Одержуюіь 4,5г необхідної сполуки. ють 5,3г необхідної сполуки. ЯМР 1H: CDCl3 (300МГц): d (м.ч.): 2,04: с: 3H; ЯМР CDCl3 (300МГц): 2,37м.ч.: с: 6Н; 3,68м.ч.: 3,03м.ч.: с: 3H; 3,21: с: 3H; 6,70: д: 3H; 7,57: д: 2Н. с: 2Н; 7,00-7,32м.ч.: м: 3H. С) 1-Метил-2-(метиламіно)-1Н-індол-5C) Етил-(2,4-диметилфеніл)ацетат карбонітрил Розчиняють 5,3г сполуки, одержаної на стадії Нагрівають при 75°С протягом 1 години 30 В досліду 2.2, у 120мл етанолу і 7мл H2SO4. Нагріхвилин розчин 4,0г сполуки, одержаної на поперевають зі зворотним холодильником протягом 10 дній стадії, в 30мл РОСI3. Після охолоджування до днів. Випарюють етанол і залишок обробляють кімнатної температури утворений осад відділяють насиченим розчином K2СО3. Екстрагують AcOEt, від рідини і промивають діетиловим ефіром. Одеорганічну фазу промивають насиченим розчином ржують 3,4г необхідної сполуки. NaCl. Органічну фаз у сушать над MgSO 4, фільтДослід 1.5 рують і випарюють досуха. Одержують 6,0г жовтоΝ,1-Диметил-1Н-індол-2-амін го маслоподібного продукту. Дану сполуку одержують за методиками, опиЯМP CDCl3 (300МГц): 1,25м.ч.: т: 3H; 2,27 мл.: саними у [заявці WO 2004/041817], F=249°C. 2с: 6Н; 3,56 мл.: с: 2Н; 4,14м.ч.: кв: 2Н; 6,91Одержання сполук формули (VII) або (VIII) 7,27м.ч.: м: 3H. Дослід 2.1 D) Етил-2-(2,4-диметилфеніл)-3Етил-2-(3-бромфеніл)-3-гідрокси-2-пропеноат диметиламіноакрилат (VII) Розчиняють 6,0г сполуки, одержаної на попеА) Етил-3-бромфенілацетат редній стадії, у 9мл реактиву Бредерека. НагріваРозчиняють 5г 3-бромфенілоцтовоі кислоти у ють при 100°С протягом 15 годин. Випарюють до80мл етанолу, додають 3мл концентрованої суха. Очи щають на колонці з діоксидом кремнію, H2SO4, потім нагрівають зі зворотним холодильниелююючи сумішшю AcOEt/циклогексан (10/90 ком протягом 2 годин. Випарюють етанол, нейтраоб./об.). Одержують 6,7г жовтого маслоподібного лізують насиченим розчином K2СО3, потім екстрапродукту. 27 85709 28 ЯМР CDCl3 (300МГц): 1,21м.ч.: т: 3H; 2,16м.ч.: Відповідно до раніше описаних дослідів одерс: 3H; 2,29м.ч.: с: 3H; 2,60м.ч.: с: 6Н; 4,09м.ч.: кв: жують проміжні сполуки формули (VII) або (VIII), 2Н; 6,90-7,57м.ч.: м: 4Н. вказані у наведеній далі таблиці. 29 85709 Дослід 2.20 Етил-3-(диметиламіно)-2-[4-(2-морфолін-4ілетокси)феніл]акрилат А) Етил-[4-(2-морфолін-4ілетокси)феніл]ацетат До розчину 1г етил-(4-гідроксифеніл)ацетату у 20мл EtOH, додають 2,5г K2СО3, 1,68г гідрохлориду 4-(2-хлоретил)морфоліну і 0,01г йодиду тетрабутиламонію, потім нагрівають зі зворотним холодильником протягом 5 годин. Після охолоджування до кімнатної температури відфільтровують K2СО3, промивають ЕtOH і концентрують фільтрат у вакуумі. Залишок обробляють водою, екстрагують AcOEt, органічну фазу промивають водою, сушать над MgSO4 і випарюють розчинник у вакуумі. Одержують 1,5г необхідної сполуки у вигляді безбарвного маслоподібного продукту. ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 1,17: т: 3H; 2,44: м: 4Н; 2,67: т: 2Η; 3,53-3,59: м: 6Н; 4,024,09: м: 4Н; 6,88: д: 2Н; 7,15: д: 2Н. В) Етил-3-(диметиламіно)-2-[4-(2-морфолін-4ілетокси)феніл]акрилат Нагрівають при 100°С протягом ночі суміш 1,5г сполуки, одержаної на попередній стадії, в 1мл реактиву Бредерека. Після охолоджування до кімнатної температури додають EtOH і концентрують у вакуумі. Одержують 1,9г необхідної сполуки у вигляді оранжевого маслоподібного продукту. Одержання сполук формули (XIV), (X) і (XI) Дослід 3.1 3-(2,4-Диметоксифеніл)-1-метил-2-оксо-2,9дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід А) 6-Бром-3-(2,4-диметоксифеніл)-1-метил-1,9дигідропіридо[2,3-b]індол-2-он Розчиняють 4,0г сполуки, одержаної у досліді 1.1, в 30мл оцтової кислоти. Нагрівають при 100°С протягом 15 хвилин, потім додають 3,6г сполуки, 30 одержаної у досліді 2.4. Нагрівають зі зворотним холодильником протягом 2 годин 30 хвилин. Реакційну масу охолоджують, потім відфільтровують осад, що утворився. Одержують 3,3г необхідної сполуки. ЯМР ДМСО (300МГц): 3,58м.ч.: с: 3H; 3,65м.ч.: с: 3H; 3,80м.ч.: с: 3H; 6,53м.ч.: дд: 1Н; 6,60м.ч.: с: 1Н; 7,10м.ч.: д: 1Н; 7,29м.ч.: д: 1Н; 7,43м.ч.: д: 1Н; 8,04м.ч.:с:2Н; 12,21м.ч.: с: 1Н. B) 3-(2,4-Диметоксифеніл)-1-метил-2-оксо-2,9дигідро-1Н-піридо[2,3-b]індол-6-карбонітрил Розчиняють 3,0г сполуки, одержаної на попередній стадії, у 70мл NMP. Додають 1,3г CuCN, потім нагрівають при 200°С протягом 24 годин. Реакційну масу виливають у воду і екстрагують продукт AcOEt. Очи щають хроматографією на колонці з діоксидом кремнію, елююючи спочатку чистим AcOEt, потім сумішшю AcOEt/MeOH (98/2 об./об.)· Одержують 0,82г бежевого порошку. ЯМР ДМСО (300МГц): 3,66м.ч.: с: 3H; 3,70м.ч.: с: 3H; 3,80м.ч.: с: 3H; 6,55м.ч.: дд: 1Н; 6,62м.ч.: д: 1Н; 7,13м.ч.: д: 1Н; 7,55-7,62м.ч.: м: 2Н; 8,10м.ч.: с: 1Н; 8,37м.ч.:с: 1Н; 12,53м.ч.: с: 1Н. C) 3-(2,4-Диметоксифеніл)-1-метил-2-оксо-2,9дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід Розчиняють 0,4г сполуки, одержаної на попередній стадії, у 30мл піридину, 10мл оцтової кислоти і 6мл води. Додають 2,6г NaH2PO2 і 2,0г нікелю Ренея. Нагрівають при 65°С протягом 40 годин. Відфільтровують каталізатор з гарячої суміші через Celite, промивають метанолом і випарюють досуха, залишок обробляють AcOEt, потім промивають насиченим розчином NaCl. Сушать над MgSO4 , потім очищають хроматографією на колонці з діоксидом кремнію, елююючи спочатку AcOEt, потім сумішшю AcOEt/MeOH (98/2 об./об.). Одержують 160мг необхідної сполуки. 31 85709 32 ЯМР ДМСО (300МГц): 3,67м.ч.: с: 3H; 3,70м.ч.: д: 1Н; 7,54м.ч.: д: 1Н; 8,15м.ч.: с: 1Н; 8,49м.ч.: с: с: 3H; 3,80м.ч.: с: 3H; 6,55м.ч.: д: 1Н; 6,62м.ч.: с: 1Н; 8,83м.ч.: д: 1Н; 12,33м.ч.: с: 1Н. 1Н; 7,16м.ч.: д: 1Н; 7,61м.ч.: д: 1Н; 7,75м.ч.: д: 1Н; C) Етил-3-(2,4-диметоксифеніл)-1,9-диметил8,13м.ч.: с: 1Н; 8,43м.ч.: с: 1Н; 10,00м.ч.: с: 1Н; 2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-612,47м.ч.: с: 1Н. карбоксилат Дослід 3.2 Суспендують 15мг 60%-ного NaH у 5мл DMF. Етил-3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксоДодають 0,1г сполуки, одержаної на стадії В до2,9-дигідро-1H-піридо[2,3-b]індол-6-карбоксилат сліду 3.2, потім після припинення виділення газу А) 3-(2,4-Диметоксифеніл)-1-метил-2-оксо-2,9додають 0,03мл СН3І. Перемішують при кімнатній дигідро-1Н-піридо[2,3-b]індол-6-карбонова кислота температурі протягом 1 години. Реакційну масу Розчиняють 5,0г KОН в 15мл Н2О, потім додавиливають у воду, утворений білий осад відфільтють 2,2г сполуки, одержаної на стадії В досліду ровують, промивають водою, потім осад обробля3.1, і 1,1 мл 35%-ного водного розчину Н 2О2 . Нають AcOEt і невеликою кількістю метанолу. Сугрівають при 130°С протягом 2 днів. Реакційну шать над MgSO4, потім випарюють досуха. Осад масу охолоджують, потім додають воду. Екстрагуобробляють сумішшю AcOEt/EP (10/90 об./об.) і ють AcOEt, потім підкисляють водну фазу 1N розфільтрують. Одержують 0,1г необхідної сполуки. чином HCl. Утворений осад відфільтровують, проЯМР ДМСО (300МГц): 1,35м.ч.: т: 3H; 3,70м.ч.: мивають водою, потім обробляють сумішшю с: 3H; 3,81м.ч.: с: 3H; 3,94м.ч.: с: 3H; 3,99м.ч.: с: AcOEt/MeOH у співвідношенні 50/50. Сушать над 3H; 4,32м.ч.: кв: 2Н; 6,54-6,57м.ч.: дд: 1Н; 6,62м.ч.: MgSO4 , потім випарюють досуха. Одержують 1,1г д: 1Н; 7,16м.ч.: д: 1Н; 7,68м.ч.: д: 1Н; 7,85-7,89м.ч.: необхідної сполуки у вигляді порошку. дд: 1Н; 8,18м.ч.: с: 1Н; 8,49м.ч.: с: 1Н. ЯМР ДМСО (300МГц): 3,67м.ч.: с: 3H; 3,70м.ч.: Дослід 3.3 с: 3H; 3,80м.ч.: с: 3H; 6,54м.ч.: д: 1Н; 6,61м.ч.: с: Метил-3-(2,4-диметилфеніл)-1-метил-2-оксо1Н; 7,19м.ч.: д: 1Н; 7,41м.ч.: д: 1Н; 7,90-7,96м.ч.: м: 2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбоксилат 2Н; 8,42м.ч.: с: 1Н. Розчиняють 1,3г сполуки, одержаної у досліді B) Етил-3-(2,4-диметоксифеніл)-1-метил-21.3, у 10мл льодяної АсОН, нагрівають до 110°С, оксо-2,9-дигідро-1H-піридо[2,3-b]індол-6потім додають 1,18г сполуки, одержаної у досліді карбоксилат 2.2, і нагрівають при 110°С протягом ночі. ЕкстраРозчиняють 0,4г сполуки, одержаної на попегують AcOEt, органічну фазу сушать над MgSO4, редній стадії, у 30мл етанолу і 0,5мл концентровафільтрують і випарюють досуха. Хрома гографуної H2SO4. Нагрівають зі зворотним холодильниють на діоксиді кремнію, елююючи сумішшю ком протягом 5 годин. Випарюють етанол, AcOEt/циклогексан (75/25 об./об.). Одержують нейтралізують насиченим розчином K2СО3, потім 100мг необхідної сполуки. екстрагують AcOEt. Очищають хроматографією на ЯМР ДМСО (300МГц)· 2,14м.ч.: с: 3H; 2,31м.ч.: колонці з діоксидом кремнію, елююючи AcOEt. с: 3H; 3,70м.ч.: с: 3H; 3,86м.ч.: с: 3H; 7,04м.ч.: м: Одержують 0,21г необхідної сполуки у вигляді по3H; 7,55м.ч.: д: 1Н; 7,85м.ч.: дд: 1Н; 8,18м.ч.: с: 1Н; рошку. 8,53м.ч.:с: 1Н; 12,40м.ч.: с: 1Н. ЯМР ДМСО (300МГц): 1,36м.ч.: т: 3H; 3,67м.ч.: Відповідно до раніше описаних дослідів 3 одес: 3H; 3,70м.ч.: с: 3H; 3,80м.ч.: с: 3H; 4,32м.ч.: кв: ржують проміжні сполуки формули (ІI') або (IV), 2Н; 6,52-6.56м.ч.: дд: 1Н; 6,61м.ч.: д: 1Н; 7,16м.ч.: вказані у наведеній далі таблиці. 33 85709 34 35 85709 36 37 85709 Дослід 3.26 Метил-3-(2,4-дихлорфеніл)-1,9-диметил-2оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6карбоксилат Нагрівають протягом 2 годин при 100°С суміш 25,47г сполуки, одержаної у досліді 1.2, і 27,4г сполуки, одержаної у досліді 2.3 (VIII), у 100мл оцтової кислоти. Гарячу реакційну суміш виливають у 500мл суміші вода/лід, утворений осад відділяють від рідини, промивають спочатку водою, потім діетиловим ефіром і сушать. Одержують 22г необхідної сполуки. Дослід 3.27 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо-2,9дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід А) 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбонітрил Нагрівають при 100°С протягом 15 хвилин суміш 0,4г сполуки, одержаної у досліді 1.4, в 4мл оцтової кислоти, потім додають 0,43г сполуки, одержаної у досліді 2.3 (VIII), і нагрівають при 100°С протягом 3 годин. Після охолоджування до кімнатної температури до реакційної суміші додають воду, утворений бежевий осад відділяють від рідини і промивають водою. Осад обробляють МеОН і концентрують розчин у вакуумі. Одержують 0,5г необхідної сполуки. ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,02: с: 3H; 4,21: с: 3H; 7,42-7,51: м: 2Н; 7,66-7,70: м: 2Н; 7,83: д: 1Н; 8,31: с: 1Н; 8,42: с: 1Н. В) 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід До розчину 0,45г сполуки, одержаної на попередній стадії, у 30мл піридину, 10мл оцтової кислоти і 6мл води додають 3,4г NaH2PO2 і 1,7г нікелю Ренея Ò і нагрівають при 65°С протягом 36 годин. Відфільтровують каталізатор, промивають МеОН і концентрують фільтрат у вакуумі. Залишок обробляють водою, екстрагують AcOEt, органічну фазу промивають насиченим розчином NaCl, сушать над MgSO4 і випарюють розчинник у вакуумі. Залишок обробляють сумішшю AcOEt/EP (50/50 об./об.) і утворений осад відділяють від рідини. Одержують 0,2г необхідної сполуки. Дослід 3.28 Метил-3-(2,4-диметоксифеніл)-1,9-диметил-2оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6карбоксилат Нагрівають при 110°С протягом 10 хвилин розчин 1,83г сполуки, одержаної у досліді 1.2, в 9мл оцтової кислоти, потім додають 2г сполуки, одержаної у досліді 2.4 (VIII), і нагрівають при 110°С протягом 12 годин. Після охолоджування до кімнатної температури додають воду, утворений осад відділяють від рідини, промивають водою, потім сумішшю ЕР/пропан-2-ол (50/50 об./об.) і 38 сушать у вакуумі. Одержують 2,76г необхідної сполуки. ЯМР 1H ДМСО-d6 (300МГц): d (м.ч.): 3,71: с: 3H; 3,81: с: 3H; 3,86: с: 3H; 3,99: с: 3H; 4,19: с 3H; 6,56: дд: 1Н; 6,62: д: 1Н; 7,16: д: 1Н; 7,70: д: 1Н; 7,87: дд: 1Н; 8,19: с: 1Н;8,51:д: 1Н. Дослід 3.29 Метил-3-[4-[[біс(4метоксибензил)аміно]мегил]феніл|-1,9-диметил-2оксо-2,9-дигідро-1H-піридо[2,3-b]індол-6карбоксилат А) Метил-3-[4-(амінометил)феніл]-1,9диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол6-карбоксилат Гідрують при 30°С і тиску 50бар суміш 1г сполуки, одержаної у досліді 3.22, 0,3г нікелю РенеяÒ , 5мл концентрованого NaOH в 50 мл МеОН. Відфільтровують каталізатор, фільтрат доводять до рН=7 доданням концентрованої HCl і концентрують у вакуумі. Залишок обробляють водою, утворений осад відділяють від рідини і сушать. Одержаний продукт обробляють 10мл МеОН, додають по краплях 0,565г тіонілхлориду і перемішують протягом 2 годин при кімнатній температурі. Концентрують у вакуумі, сушать і використовують одержану сполуку у такому стані. В) Метил-3-[4-[[біс(4метоксибензил)аміно]метил]феніл]-1,9-диметил-2оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6карбоксилат Нагрівають при 100°С протягом 18 годин суміш сполуки, одержаної на попередній стадії, 1,48г K2СО3 і 0,841г 4-метоксибензилхлориду 10мл DMF. Реакційну суміш виливають у воду, утворений осад відділяють від рідини і сушать. Одержують 0,5г необхідної сполуки. Дослід 3.30 Метил-1,9-диметил-3-[4-(морфолін-4ілметил)феніл]-2-оксо-2,9-дигідро-1Н-піридо[2,3b]індол-6-карбоксилат A) Метил-3-(4-формілфеніл)-1,9-диметил-2оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6карбоксилат Нагрівають при 65°С протягом 18 годин суміш 1,87г сполуки, одержаної у досліді 3.22, 7,53 гіпофосфі ту натрію і 7г нікелю РенеяÒ в 190мл суміші піридин/АсОН/вода (30/10/6 об./об./об.). Відділяють каталізатор і концентрують фільтрат у вакуумі. Залишок обробляють водою, утворений осад відділяють від рідини і сушать. Одержують 1,6г необхідної сполуки, F=230°C. B) Ме тил-1,9-диметил-3-[4-(морфолін-4ілметил)феніл]-2-оксо-2,9-дигідро-1H-піридо[2,3b]індол-6-карбоксилат До суміші 0,374г сполуки, одержаної на попередній стадії, 0,174мл морфоліну і 0,255г триаце 39 85709 40 токсиборогідриду натрію в 5мл DMF додають 1г 1Н; 7,76-7,82: м: 3H; 8,40: с: 1Н; 8.51: с: 1Н; 8,91: с: цеоліту з пористістю 4А і перемішують протягом 18 1Н; 10,11: с: 1Н. годин при кімнатній температурі. Реакційну суміш С) 1,9-Диметил-2-оксо-3-феніл-2,9-дигідро-1Hфільтрують і фільтрат концентрують у вакуумі. піридо[2,3-b]індол-6-карбогідразид Залишок обробляють водою, утворений осад відНагрівають при 80°С протягом 2 годин суміш діляють від рідини, промивають EtOH і сушать. 1,9г сполуки, одержаної на попередній стадії, у Одержують 0,29г необхідної сполуки, F=175°C. 100мл МеОН і 10мл 6N розчину HCl. Реакційну Дослід 3.31 суміш концентрують у вакуумі, залишок обробля6-Ацетил-3-(2,4-дихлорфеніл)-1,9-диметилють МеОН, доводять до рН=7 доданням триети1,9-дигідро-2Н-піридо[2,3-b]індол-2-он ламіну і концентрують у вакуумі. Залишок хромаА) 3-(2,4-Дихлорфеніл)-1,9-диметил-1,9тографують на силікагелі, елююючи спочатку дигідро-2Н-піридо[2,3-b]індол-2-он AcOEt, потім сумішшю AcOEt/MeOH/NH 4OH, 28%, Дану сполуку одержують за методиками, опи(90/10/1 об./об./об.). Одержують необхідну сполусаними у [заявці WO 2004/041817, сполука №28], ку. F=241°C. ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,00: с: В) 6-Ацетил-3-(2,4-дихлорфеніл)-1,9-диметил3H; 4,14: с: 3H; 7,26-7,76: м: 7Н; 8,39: с: 1Н; 8,47: с: 1,9-дигідро-2Н-піридо[2,3-b]індол-2-он 1Н; 9,68: с: 1Н. Охолоджують до 0°С розчин 0,5г сполуки, Дослід 3.33 одержаної на попередній стадії, у 20мл безводного 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо-2,9DCM. додають 0,75г хлориду алюмінію і 0,2мл дигідро-1Н-піридо[2,3-b]індол-6-карбогідразид ацетилхлориду і перемішують протягом 3 годин A) Трет-бутил-2-[[3-(2,4-дихлорфеніл)-1,9при кімнатній температурі. Реакційну суміш вилидиметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індолвають на лід, екстрагують DCM, органічну фазу 6-іл]карбоніл]гідразинкарбоксилат промивають насиченим розчином NaCl, сушать Дану сполуку одержують за методикою, опинад Na2SO4 і випарюють розчинник у вакуумі. саною на стадії В досліду 3.32, виходячи зі сполуОдержують 0,6г необхідної сполуки. ки, одержаної на стадії А варіанту прикладу 5. ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 2,63: с: Одержують 0,33г необхідної сполуки. 3H; 4,02: с: 3H; 4,20: с: 3H; 7,43-7,50: м: 2Н; 7,69ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 1,44: с: 7,73: м: 2Н; 7,89: дд: 1Н; 8,38: с: 1Н; 8,62: с: 1Н. 9Н; 4,03: с: 3H; 4,26: с: 3H; 7,43-7,50: м: 2Н; 7,68Дослід 3.32 7,72: м: 2Н; 7,80-7,82: м: 1Н; 8,23: с: 1Н; 8,43: с: 1,9-Диметил-2-оксо-3-феніл-2,9-дигідро-1Н1Н; 8,86: с: 1Н; 10,08: с: 1Н. піридо[2,3-b]індол-6-карбогідразид B) 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксоA) 1,9-диметил-2-оксо-3-феніл-2,9-дигідро-1Н2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбогідразид піридо[2,3-b]індол-6-карбонова кислота Дану сполуку одержують за методикою, опиДо розчину 1,6г сполуки, одержаної у досліді саною на стадії С досліду 3.32, виходячи зі сполу3.7, в 75мл МеОН і 18мл води додають 0,8г LiOH, ки, одержаної на попередній стадії. H2O, потім нагрівають зі зворотним холодильником ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,02: с: протягом 3 годин. Концентрують метанол МеОН у 3H; 4,18: с: 3H; 7,42-7,50: м: 2Н; 7,65-7,79: м: 3H; вакуумі, підкислюють до рН=1 доданням 1N роз8,21: с: 1Н; 8,38: д: 1Н; 9,64: с: 1Н. чину HCl і утворений осад відділяють від рідини. Дослід 3.34 Осад обробляють метанолом МеОН, випарюють 3-(2,4-Диметоксифеніл)-1-метил-2-оксо-2,9розчинник у вакуумі, залишок розтирають у суміші дигідро-1Н-піридо[2,3-b]індол-6-карбогідразид EP/AcOEt (90/10 об./об.) і відділяють від рідини. A) 3-(2,4-Диметоксифеніл)-1-метил-2-оксо-2,9Одержують 1,5г необхідної сполуки. дигідро-1Н-піридо[2,3-b]індол-6-карбонова кислота ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,01: с: До суспензії 0,9г сполуки, одержаної на стадії 3H; 4,16: с: 3H; 7,28-7,42 м: 3H; 7,62: д: 1Н; 7,77В досліду 3.1, у 6мл води додають 2г KОН, потім 7,80: м: 2Н; 7,89: дд: 1Н; 8,50-8,57: м: 2Н. 0,5мл 35%-ного розчину Н 2О2 і нагрівають при B) Трет-бутил-2-[[1,9-диметил-2-оксо-3-феніл130°С протягом 2 днів. Після охолоджування до 2,9-дигідро-1Н-піридо[2,3-b]індол-6кімнатної температури підлуговують доданням іл]карбоніл]гідразинкарбоксилат концентрованого розчину NaOH, водну фазу проДо розчину 1,5г сполуки, одержаної на попемивають AcOEt, підкисляють доданням 1N розчину редній стадії, у 40мл DCM і 10мл DMF додають HCl. Утворений осад відділяють від рідини і про0.66г трет-бутилгідразинкарбоксилату, 2,5г РуВОР мивають водою. Осад обробляють МеОН і випаі 0,9мл DIPEA, потім перемішують протягом 4 горюють розчинник у вакуумі. Осад обробляють судин при кімнатній температурі. Реакційну суміш мішшю пропан-2-ол/ЕР (50/50 об./об.), розтирають виливають у насичений розчин NH 4Cl, екстрагують і відділяють від рідини. Одержують 0,9г необхідної DCM, органічну фазу сушать над MgSO 4 і випарюсполуки. ють розчинник у вакуумі. Залишок хроматографуЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 3,69-3,80: ють на силікагелі, елююючи сумішшю AcOEt/MeOH м: 9H; 6,53-6,61: м: 2Н; 7,20: д: 1Н; 7,35: д: 1Н; (95/5 об./об.)· Одержаний продукт обробляють 7,80: д: 1Н: 7,94: с: 1Н; 8,30: с: 1Н. сумішшю AcOEt/циклогексан (75/25 об./об.) і утвоB) Трет-бутил-2-[[3-(2,4-диметоксифеніл)-1рений осад відділяють від рідини. Одержують 1,9г метил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6необхідної сполуки. іл]карбоніл]гідразинкарбоксилат ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 1,39: с: Дану сполуку одержують за методикою, опи9Н; 4,06: с: 3H; 4,17: с: 3H; 7,29-7,42: м: 3H; 7,67: д: саною на стадії В досліду 3.32, виходячи зі сполуки, одержаної на попередній стадії. 41 85709 42 Дослід 4.2 ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 1,43: с: N'-Гідрокси-2-феноксіетанімідамід 9Н; 3,68: с: 3H; 3,71: с: 3H; 3,81: с: 3H; 6,54-6,63: м: 2Н; 7,18: д: 1Н; 7,51: д: 1Н; 7.69-7,74: м 1Н; 7,98: с: Нагрівають зі зворотним холодильником протягом 3 годин суміш 1г феноксіацетонітрилу, 2,4г 1Н; 8,27: с: 1Н; 8,84: с ушир.: 1Н; 10,00: с ушир.: K2СО3 і 1,2г гідрохлориду гідроксиламіну у 60мл 1Н; 12,23: с ушир.: 1Н. EtOH і 10мл води. Реакційну суміш концентрують у C) 3-(2,4-Диметоксифеніл)-1-меіил-2-оксо-2,9вакуумі, залишок обробляють водою, екстрагують дигідро-1Н-піридо[2,3-b]індол-6-карбогідразид Перемішують протягом ночі при кімнатній темAcOEt. Органічну фазу екстрагують 1N розчином HCl, водну фазу підлуговують доданням 1N розчипературі суміш 0,39г сполуки, одержаної на попену NaOH, екстрагують AcOEt, суша ть над MgSO4 і редній стадії, у 15мл метанолу МеОН і 1мл 6 N випарюють розчинник у вакуумі. Одержують 0,9г розчину HCl. Реакційну суміш концентрують у ванеобхідної сполуки у вигляді безбарвного маслокуумі, залишок обробляють триетиламіном і піридином до розчинення і хроматографують на силіподібного продукту, що кристалізується. кагелі, елююючи сумішшю AcOEt/MeOH/NH 4OH, ЯМР 1H: CDCI3 (300МГц): d (м.ч.): 4,56: с: 2Н; 28%, (90/10/1 об./об./об.). Одержують 0,2г необ4,90: с: 2Н; 6,95-7,02: м. 3H, 7,26-7,32: м: 2Н. хідної сполуки. Приклад 1: Сполука №7 Дослід 3.35 3-(2,4-Димегоксифеніл)-1-метил-2-оксо-2,93-(2,4-Дихлорфеніл)-N'-гідрокси-1,9-диметилдигідро-1Н-піридо[2,3-b]індол-6-карбальдегід-О2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6етилоксим карбоксіімідамід Розчиняють 0,3г сполуки, одержаної у досліді До суспензії 1г сполуки, одержаної на стадії А 3.1, в 20мл етанолу, додають 0,4г гідрохлориду Одосліду 3.27, у 20мл безводного EtOH, додають етилгідроксиламіну, розчиненого в 1мл води, і пе0,91г гідрохлориду гідроксиламіну і 1,82мл триетиремішують протягом 2 годин при кімнатній темпеламіну і нагрівають зі зворотним холодильником ратурі. Випарюють етанол, обробляють водою, протягом 3 днів. Після охолоджування до кімнатної потім екстрагують AcOEt. Хроматографують на температури до реакційної суміші додають МеОН і діоксиді кремнію, елююючи спочатку AcOEt, потім піридин і хроматографують на силікагелі, елюююсумішшю AcOEt/MeOH (98/2 об./об.). Одержують чи сумішшю AcOEt/MeOH/триетиламін (90/10/2 70мг необхідної сполуки. об./об./об.). Одержаний продукт обробляють воЯМР 1H: ДМСО (300МГц): 1,26м.ч.: т: 311; дою і розтирають, утворений осад відділяють від 3,66м.ч.: с: 3H; 3,70м.ч.: с: 3H; 3,80м.ч.: с: 3H; рідини і промивають сумішшю пропан-2-ол/ЕР 4,13м.ч.: кв: 2Н; 6,52-6,56м.ч.: дд: 1Н; 6,60м.ч.: д· (50/50 об./об.). Одержують 0,7г необхідної сполу1Н; 7,16м.ч.: д: 1Н; 7,48м.ч.: с: 2Н; 8м.ч.: с: 2Н; ки. 8,26м.ч.: с: 1Н; 12,14м.ч.: с: 1Н. Приклад 2: Сполука №8 ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,02: с: 3-(2,4-Димегоксифеніл)-1-метил-6-(3-феніл-13H; 4,20: с: 3H; 7,41-7,50: м: 2Н; 7,65-7,68: м: 2Н; [1,2,4]оксадіазол-5-іл)-1,9-дигідро-2Н-піридо[2,37,82: д: 1Н; 8,30: с: 1Н; 8,41: с: 1Н. b]індол-2-он Одержання сполук формули (V) Розчиняють 0,5г сполуки, одержаної на стадії Дослід 4.1 А досліду 3.2, в 10мл DMF, додають 0,29г CDI, N''-Гідрокси-N,N-біс(4-метоксибензил)гуанідин потім перемішують протягом 30 хвилин при кімна(V) тній температурі. Додають 0,22г N'A) біс-(4-Метоксибензил)ціанамід гідроксибензолкарбоксімідаміду, розчиненого у До розчину 1г ціанаміду у 50мл DMF додають 4мл DMF, перемішують при кімнатній температурі 13,1г K2СО3 в 6,5мл 4-метоксибензилхлориду, попротягом 6 годин, потім додають 0,26г CDI і нагрітім нагрівають при 80°С протягом 20 годин. Після вають при 115°С протягом 18 годин. Додають воохолоджування до кімнатної температури реакційду, екстрагують діетиловим ефіром, потім сушать ну суміш виливають у воду, екстрагують AcOEt, над MgSO4 і хроматографують на діоксиді креморганічну фазу суша ть над MgSO4 і випарюють нію, елююючи спочатку AcOEt, потім сумішшю розчинник у вакуумі. Залишок хроматографують AcOEt/MeOH (98/2 об./об.). Одержаний залишок на силікагелі, елююючи сумішшю розтирають у суміші AcOEt/циклогексан (50/50 АсОЕt/циклогексан (75/25 об./об.). Одержують 6,5г об./об.), потім фільтрують. Одержують 0,15г необнеобхідної сполуки у вигляді маслоподібного прохідної сполуки. дукту. ЯМР 1H: ДМСО (300МГц): 3,69м.ч.: с: 311; ЯМР CDCl3 (300МГц): d (м.ч.): 3,73: с: 6Н; 3,95: 3,72м.ч.: с: 3H; 3,81м.ч.: с: 3H; 6,55-6,59м.ч.: дд: с: 411; 6,82: д: 4Н; 7,16: д: 4Н. 1Н; 6,63м.ч.: д: 1Н; 7,18м.ч.: д: 1Н; 7,55-7,62м.ч.: м: B) N''-Гідрокси-N,N-біс(43H; 7,68м.ч.: д: 1Н; 8,01-8,05м.ч.: дд: 1Н; 8,10метоксибензил)гуанідин (V) 8,16м.ч.: м: 2Н; 8,25м.ч.: с: 1Н; 8,73м.ч.: д: 1Н; До розчину 6,5г сполуки, одержаної на попе12,48м.ч.: с: 1Н. редній стадії, у 40мл EtOH додають 3,2г гідрохлоПриклад 3: Сполука №3 риду гідроксиламіну і 6,4мл триетиламіну, потім 3-(2,4-Дихлорфеніл)-1-метил-6-(3-метилперемішують протягом 5 годин при кімнатній тем[1,2,4]оксадіазол-5-іл)-1,9-дигідро-2Н-піридо[2,3пературі. Реакційну суміш концентрують у вакуумі, b]індол-2-он залишок обробляють водою, екстрагують AcOEt, Суспендують 0,12г 60%-ного NaH у 12мл безсушать над MgSO4 і випарюють розчинник у вакуводного THF, додають 0,32г цеоліту, потім 0,22г умі. Одержують 3,6г необхідної сполуки. N'-гідроксіетанімідаміду і нагрівають при 70°С проЯМР CDCI3 (300МГц): d (м.ч.): 3,80: с: 6Н; 4,24: тягом 1 години з половиною. Додають 0,4г сполус: 4Н; 6,84: д: 4Н; 7,16: д: 4Н. 43 85709 44 ки, одержаної у досліді 3.5, потім нагрівають при B) 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо80°С протягом 2 годин. Додають воду, екстрагують 2,9-дигідро-1Н-піридо[2,3-b]індол-6AcOEt, потім хроматографують на діоксиді кремкарбонілхлорид нію, елююючи спочатку сумішшю Охолоджують на бані з льодом суспензію 9,1г AcOEt/циклогексан (60/40 об./об.), потім чистим сполуки, одержаної на попередній стадії, у 100мл AcOEt. Одержують 120мг необхідної сполуки. безводного THF, додають по краплях розчин 45мл ЯМР 1H: ДМСО (300МГц): 2,47м.ч.: с: 3H; тіонілхлориду у 45мл THF, перемішують протягом 3,77м.ч.: с 3H; 7,49-7,56м.ч.: м: 2Н; 7,71-7,75м.ч.: 15 хвилин і концентрують у вакуумі при кімнатній м: 2Н; 8,01м.ч.: д: 1Н; 8,45м.ч.: с: 1Н; 8,73м.ч.: с: температурі. Залишок обробляють 40мл DCM і 1Н; 12,64м.ч.: с: 1Н. випарюють розчинник у вакуумі. Одержують необПриклад 4: Сполука №2 хідну сполуку, яку використовують у такому стані. 3-(2,4-Дихлорфеніл)-1,9-диметил-6-(3-феніл-1C) N-Ціано-3-(2,4-Дихлорфеніл)-1,9-диметил[1,2,4]оксадіазол-5-іл)-1,9-дигідро-2Н-піридо[2,32-оксо-2,9-дигідро-1H-піридо[2,3-b]індол-6b]індол-2-он карбоксамід Суспендують 7мг 60%-ного NaH у 2мл DMF і До розчину сполуки, одержаної на попередній додають 50г сполуки, одержаної у прикладі 3, постадії, у 100мл безводного THF додають розчин тім 0,02мл СН3І і перемішують при кімнатній тем10г ціанаміду у 50мл THF і нагрівають при 60°С в пературі протягом 2 годин. Реакційну суміш вилиатмосфері аргону. Через 30 хвилин додають вають у воду, потім відфільтровують утворений 100мл THF і одержану суспензію концентрують у осад. Промивають водою, потім сумішшю вакуумі. Залишок обробляють 200мл EtOH, переAcOEt/циклогексан (50/50 об./об.) з одержанням мішують протягом ночі при кімнатній температурі, 30мг необхідної сполуки. утворений осад відділяють від рідини, промивають ЯМР 1H: ДМСО (300МГц): 2,27м.ч.: с: 3H; EtOH і сушать у вакуумі. Одержаний продукт об4,03м.ч.: с: 3H; 4,22м.ч.: с: 3H; 7,43-7,50м.ч.: м: 2Н; робляють водою, осад відділяють від рідини і су7,69м.ч.: с: 1Н; 7,84м.ч.: д: 1Н; 7,98м.ч.: д: 1Н; шать. Одержують 8,3г необхідної сполуки. 8,44м.ч.: с: 1Н;8,69м.ч.:с: 1Н. D) 6-(3-Аміно-1,2,4-оксадіазол-5-іл)-3-(2,4Приклад 5: Сполука №14 дихлорфеніл)-1,9-диметил-1,9-дигідро-2Н6-(3-Аміно-1,2,4-оксадіазол-5-іл)-3-(2,4піридо[2,3-b]індол-2-он. дихлорфеніл)-1,9-диметил-1,9-дигідро-2ННагрівають при 120°С протягом 15 хвилин супіридо[2,3-b]індол-2-он міш 3г сполуки, одержаної на попередній стадії, і До суміші 3г цеоліту у 15мл етанолу додають 0,9г гідрохлориду гідроксиламіну у 60мл піридину. 0,26г натрію і перемішують протягом 15 хвилин Далі додають 30г основного оксиду алюмінію вепри кімнатній температурі. Далі додають 0,9г геміличиною 60мкм і концентрують у вакуумі до сухого сульфату-гемігідрату N''-гідроксигуанідину і перестану. Залишок хроматографують на основному мішують протягом 1 години при кімнатній темпераоксиді алюмінію величиною 60мкм, елююючи спотурі. Потім додають 0,4г сполуки, одержаної у чатку AcOEt, потім сумішшю AcOEt/МеОН зі змідосліді 3.26, і нагрівають зі зворотним холодильнюваним співвідношенням до (97/3 об./об.). Одерником протягом 4 днів. Після охолоджування до жують 1,2г необхідної сполуки. кімнатної температури до реакційної суміші додаПриклад 6: Сполука №20 ють воду, екстрагують AcOEt, органічну фаз у су3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо-2,9шать над MgSO4 і випарюють розчинник у вакуумі. дигідро-1Н-піридо[2,3-b]індол-6-карбальдегідоксим Залишок хроматографують на силікагелі, елюююДо розчину 0,2г сполуки, одержаної у досліді чи сумішшю AcOEt/циклогексан (75/25 об./об.). 3.27, в 15мл 96%-ного EtOH додають 0,18г гідроОдержують 0,02г необхідного продукту. хлориду гідроксиламіну і перемішують протягом 3 годин при кімнатній температурі. Концентрують у ЯМР 1H: ДМСО-d6 (300МГц): d (мл.): 4,04: с: вакуумі, залишок обробляють водою і утворений 3H; 4,22: с: 3H; 6,32: с: 2Н: 7,43-7,51: м: 2Н; 7,70: д: осад відділяють від рідини. Осад розчиняють у 1Н; 7,81: д: 1Н; 7,90: дд: 1Н; 8 ,42: с: 1Н; 8,5: д: 1Н. Рівним чином можна одержати сполуку №14 суміші МеОН/піридин і одержаний розчин хроматографують на силікагелі, елююючи сумішшю за методиками, описаними далі на стадіях А, В, С і DCM/MeOH (98/2 об./об.). Одержують 0,14г необD. хідної сполуки, F=287-290°C. A) 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо2,9-дигідро-1H-піридо[2,3-b]індол-6-карбонова кисЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,01: с: лота 3H; 4,17: с: 3H; 5,76: с: 1Н; 7,42-7,49: м: 2Н; 7,53До суміші 9,5г сполуки, одержаної у досліді 7,57: дд: 1Н; 7,63-7,69: м: 2Н; 8,06: д: 1Н; 8,19-8,23: 3.26, у 100мл МеОН додають розчин 5,14г таблем: 2Н. тованого KОН у 90мл води і нагрівають зі зворотПриклад 7: Сполука №21 ним холодильником протягом 18 годин. Після охо3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо-2,9лоджування спочатку до кімнатної температури, дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід-Опотім на бані з льодом реакційну суміш підкислюетилоксим ють до рН=1 доданням 5N розчину HCl і розбавДо розчину 0,2г сполуки, одержаної у досліді ляють водою для забезпечення перемішування. 3.27, в 15мл EtOH додають 0,25г гідрохлориду ОУтворений осад відділяють від рідини, промивають етилгідроксиламіну і перемішують протягом 20 водою і сушать. Одержують 9,1г необхідної сполугодин при кімнатній температурі. Реакційну суміш ки. концентрують у вакуумі, залишок обробляють водою і утворений осад відділяють від рідини. Осад обробляють сумішшю АсОЕ/МеОН (50/50 об./об.) і 45 85709 46 одержаний розчин хроматографують на силікагелі, охолоджування до кімнатної температури до реакелююючи сумішшю AcOEt/циклогексан (75/25 ційної суміші додають DCM і АсОН, відфільтровуоб./об.). Одержаний продукт обробляють сумішшю ють цеоліт, промивають DCM, потім фільтрат проAcOEt/циклогексан (50/50 об./об.) і утворений осад мивають спочатку 1N розчином HCl, потім 2N відділяють від рідини. Одержують 0,1г необхідної розчином NaOH, органічну фазу суша ть над сполуки. MgSO4 і випарюють розчинник у вакуумі. Залишок хроматографують на силікагелі, елююючи сумішЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 1,27: т: 3H; 4,02: с: 3H; 4,12-4,22: м: 5Н; 7,42-8,48: м: 8Н. шю DCM/MeOH (97/3 об./об.). Одержаний продукт обробляють МеОН, розтирають, утворений осад Приклад 8: Сполука №22 відділяють від рідини, промивають МеОН і сушать 3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксо-2,9у вакуумі. Одержують 0,596г необхідної сполуки. дигідро-1Н-піридо[2,3-b]індол-6-карбальдегід-Оізобутилоксим ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 3,71: м: До розчину 0,14г сполуки №20 у 4мл DMF до9Н; 3,79· с: 3H; 3,99: с: 3H, 4,20: с: 3H; 4,48: с: 4Н; дають 0,017г гідриду натрію у вигляді масла з кон6,56: м: 1Н; 6,61: с: 1Н; 6,90: д: 4Н; 7,14: д: 1Н; центрацією 60% і перемішують протягом 10 хви7,23: д: 4Н; 7,79: д: 1Н; 7,91: д: 1Н; 8,24: с: 1Н; лин при кімнатній температурі. Далі додають 8,59: с: 1Н. 0,076г ізобутилброміду і перемішують протягом B) 6-(3-Аміно-1,2,4-оксадіазол-5-іл)-3-(2,4ночі при кімнатній температурі. Реакційну суміш диметоксифеніл)-1,9-диметил-1,9-дигідро-2Нвиливають у насичений розчин NH 4CI, екстрагують піридо[2,3-b]індол-2-он AcOEt, органічну фазу сушать над MgSO 4 і випаДо розчину 0,593 сполуки, одержаної на поперюють розчинник у вакуумі. Залишок хроматограредній стадії, у 10мл DCM і 2мл води додають 1г фують на силікагелі, елююючи сумішшю DDQ і нагрівають зі зворотним холодильником AcOEt/циклогексан (75/25 об./об.). Одержують протягом ночі. Після охолоджування до кімнатної 0,035г необхідної сполуки, F=100-110°С. температури утворений осад відділяють від рідини і промивають спочатку DCM, потім водою. Осад ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 0,92: с: розчиняють у МеОН і хроматографують на силіка3H; 0,94: с: 3H; 2,02: м: 1Н: 3,88: д: 2Н; 4,01: с: 3H; гелі, елююючи спочатку AcOEt, потім сумішшю 4,17: с: 3H; 7,42-7,50: м: 2Н; 7,54-7,57: дд: 1Н; 7,65AcOEt/MeOH (90/10 об./об.). Одержаний продукт 7,69: м: 2Н; 8,10: д: 1Н; 8,26: с: 1Н; 8,30: с: 1Н. обробляють МеОН, утворений осад відділяють від Приклад 9: Сполука №23 рідини і промивають МеОН. Одержують 0,094г [[[[3-(2,4-Ди хлорфеніл)-1,9-диметил-2-оксо-2,9необхідної сполуки, F=320-322°C. дигідро-1Н-піридо[2,3-b]індол-6іл]метилен]аміно]окси]оцтова кислота ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 3,76: с: До розчину 0,3г сполуки, одержаної у досліді 3H; 3,86: с: 3H; 4,05: с: 3H; 4,25: с: 3H; 6,39: с: 2Н; 3.27, в 25мл 96%-ного EtOH додають 0,426г гемігі6,62: дд: 1Н; 6,68: д: 1Н; 7,22: д: 1Н: 7,84: д: 1Н; дрохлориду О-(карбоксиметил)гідроксиламіну і 7,93: дд: 1Н; 8,26: с: 1Н; 8,57: с: 1Н. перемішують протягом ночі при кімнатній темпераПриклад 11: Сполука №39 турі. Реакційну суміш концентрують у вакуумі, за3-[4-(Амінометил)феніл]-6-(3-аміно-1,2,4лишок обробляють водою, розтирають і утворений оксадіазол-5-іл)-1,9-диметил-1,9-дигідро-2Носад відділяють від рідини. Осад обробляють 2N піридо[2,3-b]індол-2-он розчином NaOH, водну фазу промивають AcOEt, A) 3-[4-[[біс(4потім водну фазу підкислюють до рН=1 доданням Метоксибензил)аміно]метил]феніл]-6-[3-[біс(46N розчину HCl, утворений осад відділяють від метокси-бензил)аміно]-1,2,4-оксадіазол-5-іл]-1,9рідини і фільтрат екстрагують AcOEt. Об'єдн ують диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он осад і органічну фазу і випарюють розчинник у Дану сполуку одержують за методикою, опивакуумі. Залишок обробляють гарячим пропан-2саною на стадії А прикладу 10, виходячи зі сполуолом, утворений осад відділяють у гарячому стані ки, одержаної у досліді 3.29, і сполуки, одержаної у від рідини і промивають діетиловим ефіром. Одедосліді 4.1. ржують 0,135г необхідної сполуки. B) 3-[4-(Амінометил)феніл]-6-(3-аміно-1,2,4оксадіазол-5-іл)-1,9-диметил-1,9-дигідро-2НЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,01. с: піридо[2,3-b]індол-2-он 3H; 4,18: с: 3H; 4,64: с: 2Н, 7,42-7,49: м: 2Н; 7,55: Дану сполуку одержують за методикою, опидд: 1Н; 7,67-7,69: м: 2Н; 8,12: д: 1Н; 8,27: с: 1Н; 8,37: с: 1Н; 12,8: с ушир.: 1Н. саною на стадії В прикладу 10. Одержують 0,2г необхідної сполуки. Приклад 10: Сполука №26 6-(3-Аміно-1,2,4-оксадіазол-5-іл)-3-(2,4ЯМР 1H: ДМСО-d6/ТФО (200МГц): d (м.ч.): 3,9: димегоксифеніл)-1,9-диметил-1,9-дигідро-2Нс: 2Н; 4,0: с: 3H; 4,2: с: 3H, 7,5: д: 2Н; 7,8-8,0: м: піридо[2,3-b]індол-2-он 4Н; 8,65: д: 2Н. A) 6-[3-[біс(4-метоксибензил)аміно]-1,2,4Приклад 12: Сполука №41 оксадіазол-5-іл]-3-(2,4-диметокси-феніл)-1,93-(2,4-Дихлорфеніл)-6-[3-(диметиламіно)-1,2,4диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он оксадіазол-5-іл]-1,9-диметил-1,9-дигідро-2НДо суміші 6,3г цеоліту у 63мл безводного EtOH піридо[2,3-b]індол-2-он додають 0,78г натрію, потім, після розчинення, До розчину 0,09г сполуки №14 у 3мл DMF дододають 5,6г сполуки, одержаної у досліді 4.1, і дають 0,025г гідриду натрію у вигляді масла з конперемішують протягом 2 годин при кімнатній темцентрацією 60%, потім 0,04мл метилйодиду і пепературі в атмосфері аргону. Потім додають 1,2г ремішують протягом 2 годин при кімнатній сполуки, одержаної у досліді 3.28. і нагрівають зі температурі. До реакційної суміші додають воду, зворотним холодильником протягом ночі. Після утворений осад відділяють від рідини, промивають 47 85709 48 спочатку водою, потім сумішшю пропан-2-ол/ЕР Приклад 16: Сполука №50 (50/50 об./об.). Одержують 0,07г необхідної сполу3-(2,4-Дихлорфеніл)-1-метил-6-(3-метил-1,2,4ки, F=320-324°C. оксадіазол-5-іл)-9-(2-морфолін-4-ілетил)-1,9дигідро-2Н-піридо[2,3-b]індол-2-он ЯМР 1H: піридин-d5 (300МГц): d (м.ч.): 2,94: с: Нагрівають при 80°С протягом 4 днів суміш 6Н; 3,80: с: 3H; 3,82: с: 3H; 7,32: дд: 1Н; 7,47-7,52: 0,3г сполуки №3, 0,39г K2СО3 і 0,263г гідрохлориду м: 2Н; 7,58: д: 1Н; 7,95: с: 1Н; 8,09: дд: 1Н; 8,66: д: 2-хлоретилморфоліну у 15мл DMF. Після охоло1Н. Приклад 13: Сполука №42 джування до кімнатної температури реакційну суміш виливають у насичений розчин NaCl, утвореN-[5-[3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксоний осад відділяють від рідини і промивають 2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4водою. Осад обробляють МеОН і концентрують оксадіазол-3-іл]циклопропанкарбоксамід розчин у вакуумі. Залишок розтирають у суміші До розчину 0,1г сполуки №14 у 5мл піридину додають 0,4мл циклопропанкарбонілхлориду і напропан-2-ол/ЕР (50/50 об./об.) і утворений осад відділяють від рідини. Одержують 0,3г необхідної грівають при 50°С протягом 2 годин. Після охолосполуки. джування до кімнатної температури екстрагують AcOEt, органічну фазу промивають водою, сушать ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 2,35-2,42: над Na2SO4 і випарюють розчинник у вакуумі. Зам: 7Н; 2,73: т: 2Η; 3,42-3,44: м: 4Н; 4,01: с: 3H; лишок хроматографують на силікагелі, елююючи 4,75-4,79: м: 2Н; 7,43-7,51: м: 2Н; 7,69: д: 1Н; 7,87: сумішшю AcOEt/MeOH (90/10 об./об.). Одержаний д: 1Н; 8,00: дд: 1Н;8,46:с: 1Н; 8 ,70: д: 1Н. продукт обробляють сумішшю AcOEt/циклогексан Приклад 17: Сполука №53 (50/50 об./об.). розтирають і утворений осад віддіЗ -(2,4-Дихлорфеніл)-6-(N-гідроксіетанімідоїл)ляють від рідини. Одержують 0,065г необхідної 1,9-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он сполуки, F=292-295°C. До суспензії 0,28г сполуки, одержаної у досліді 3.31, у 30мл EtOH додають 0,15г гідрохлориду ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 0,86: м: гідроксиламіну, потім 0,3г K2СО3 і нагрівають зі 4Н; 1,99: м: 1Н; 4,03: с: 3H: 4,23: с: 3H; 7,43-7,51: зворотним холодильником протягом 3 годин. Після м: 2Н; 7,70: с: 1Н; 7,86: д: 1Н; 7,96: дд: 1Н; 8,45: с: охолоджування до кімнатної температури додають 1Н; 8,66: с: 1Н; 11.48: с: 1Н. воду і утворений осад відділяють від рідини. Осад Приклад 14: Сполука №44 розчиняють у суміші DCM/MeOH і хроматографуN-[5-[3-(2,4-Дихлорфеніл)-1,9-диметил-2-оксоють на силікагелі, елююючи сумішшю DCM/MeOH 2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,4(98/2 об./об.). Одержують 0,13 необхідної сполуки. оксадіазол-3-іл]метансульфонамід До розчину 0,1г сполуки №14 в 10мл піридину і ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 2,23: с: 1мл DCM додають 0,08мл метансульфонілхлориду 3H; 4,02: с: 3H; 4,17: с: 3H; 7,43-7,50: м: 2Н; 7,59і 0,025г DMAP і нагрівають при перемішуванні про7,70: м: 3H; 8,17: с: 1Н; 8,30: с: 1Н; 11,06: с: 1Н. тягом 96 годин при кімнатній температурі. РеакПриклад 18: Сполука №55 ційну суміш виливають у воду, екстрагують AcOEt, 6-(5-Аміно-1,3,4-оксадіазол-2-іл)-1,9-диметилорганічну фазу промивають насиченим розчином 3-феніл-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он NaCl, сушать над Na2SO4 і випарюють розчинник у До розчину 1,5г сполуки, одержаної у досліді вакуумі. Залишок хроматографують на силікагелі, 3.32, в 30мл безводного МеОН додають 0,46г ціаелююючи сумішшю DCM/MeOH (95/5 об./об.). нброміду і нагрівають зі зворотним холодильником Одержують 0,025г необхідної сполуки, F=263протягом 2 годин 30 хвилин. Реакційну суміш ви266°C. ливають у воду, підлуго вують доданням 28%-ного розчину ΝΗ 4ΟΗ і утворений осад відділяють від ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 3,22: с: рідини. Осад обробляють сумішшю 3H; 4,03: с: 3H; 4,23: с: 3H: 7,43-7,51: м:2Н; 7,69: д: MeOH/AcOEt/піридин, відфільтровують нерозчи1Н; 7,84: д: 1Н;7,95:д: 1Н; 8,47: с: 1Н; 8,64: с: 1Н; нену речовину і фільтрат хроматографують на 11,82: с: 1Н. Приклад 15: Сполука №49 силікагелі, елююючи сумішшю AcOEt/MeOH (90/10 об./об.). Одержують 0,5г необхідної сполуки, [3-(2,4-Дихлорфеніл)-1-метил-6-(3-метил-1,2,4F=308-309°C. оксадіазол-5-іл)-2-оксо-1,2-дигідро-9Н-піридо[2,3b]індол-9-іл]ацетонітрил ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,03: с: Нагрівають при 80°С протягом 4 днів суміш 3H; 4,18: с: 3H; 7,13: с: 2Н; 7,29-7,43: м: 3H; 7,720,3г сполуки №3, 0,195г K2СО3 і 0,1мл бромацею7,80: м: 4Н; 7,40: с: 1Н; 8,54: м: 1Н. нітрилу у 20мл DMF. Після охолоджування до кімПриклад 19: Сполука №58 натної температури реакційну суміш виливають у 3-(2,4-Дихлорфеніл)-1,9-диметил-6-(5-фенілнасичений розчин NH 4CI, екстрагують AcOEt, ор1,2,4-оксадіазол-2-іл)-1,9-дигідро-2Н-піридо[2,3ганічну фаз у промивають насиченим розчином b]індол-2-он NaCl, сушать над MgSO 4 і випарюють розчинник у До суспензії 0,2г сполуки, одержаної у досліді вакуумі. Залишок хроматографують на силікагелі, 3.33, і 2мл триетилортоацетату додають каталітиелююючи сумішшю AcOEt/циклогексан (75/25 чну кількість п-толуолсульфонової кислоти і нагріоб./об.). Одержаний продукт розтирають у цикловають при 140°С протягом ночі. Після охолоджугексані і утворений осад відділяють від рідини. вання до кімнатної температури утворений осад Одержують 0,09г необхідної сполуки. відділяють від рідини і промивають водою. Осад обробляють сумішшю пропан-2-ол/ЕР (50/50 ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 2,43: с: об./об.), розтирають і відділяють від рідини. Одер3H; 4,02: с: 3H; 6,01: с: 2Н; 7,45-7,53: м: 2Н; 7,71: д: жують 0,13г необхідної сполуки, F=311-316°С. 1Н; 8,00: д: 1Н; 8,09: дд: 1Н; 8,52: с: 1Н; 8,76: д: 1Н. 49 85709 50 Охолоджують до -78°С 5 мл безводного THF, ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 2,58 с: барботують аміак протягом 5 хвилин, потім дода3H; 4,03: с: 3H; 4,22: с: 3H, 7,43-7,51: м: 2Н; 7,69: с ушир.: 1Н; 7,81-7,91: м: 2Н; 8,44: с: 1Н; 8,55: с ють розчин 0,19г сполуки, одержаної на попередній стадії, у 5мл THF і перемішують протягом 2 ушир.: 1Н. годин, дозволяючи реакційній суміші нагрітися до Приклад 20: Сполука №59 кімнатної температури. Концентрують реакційну 3-(2,4-Дихлорфеніл)-1,9-диметил-6~(5-метилсуміш у вакуумі, залишок обробляють водою, оде1,2,4-оксадіазол-3-іл)-1,9-дигідро-2Н-піридо[2,3b]індол-2-он ржаний продукт розтирають, утворений осад відділяють від рідини, промивають спочатку сумішшю Нагрівають зі зворотним холодильником пропропан-2-ол/ЕР (50/50 об./об.), потім діетиловим тягом 2 годин суміш 0,4г сполуки, одержаної у доефіром. Одержують 0,08г необхідної сполуки, сліді 3.35, 10мл оцтового ангідриду і 1мл оцтової F=272-275°C. кислоти. Після охолоджування до кімнатної температури утворений осад відділяють від рідини і ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 4,03: с: промивають сумішшю AcOEt/MeOH (50/50; 3H; 4,21: с: 3H; 7,43-7,51: м: 2Н; 7,67-7,70: м: 2Н; об./об.). Одержують 0,24г необхідної сполуки, 7,82-7,86: м: 1Н; 8,26: с: 1Н; 8,37: с: 1H; 12,90: с F=306-307°C. ушир.: 1Н. Приклад 22: Сполука №66 ЯМР 1H: ДМСО-d6 (300МГц): d (м.ч.): 2,67: с: Етил-3-[3-(2,4-дихлорфеніл)-1,9-диметил-23H; 4,02: с: 3H; 4,20: с: 3H; 7,43-7,51: м: 2Н; 7,69: д: оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-іл]-1,2,41Н; 7,78: д: 1Н; 7,90: дд: 1Н; 8 ,41: с: 1Н; 8,55: с: 1Н. оксадіазол-5-карбоксилат Приклад 21: Сполука №60 Охолоджують до 0°С розчин 0,17г сполуки, 6-(5-Аміно-1,2,4-оксадіазол-3-іл)-3-(2,4одержаної у досліді 3.35, у 2мл 1,2-дихлоретану і дихлорфеніл)-1,9-диметил-1,9-дигідро-2Н0,1мл піридину, додають 0,09мл етилоксалілхлопіридо[2,3-b]індол-2-он риду і перемішують протягом 30 хвилин, дозволяA) 3-(2,4-Дихлорфеніл)-1,9-диметил-6-[5ючи реакційній суміші нагрітися до кімнатної тем(трихлорметил)-1,2,4-оксадіазол-3-іл)-1,9-дигідроператури. Потім нагрівають при 80°С протягом 2 2Н-піридо[2,3-b]індол-2-он годин. Після охолоджування до кімнатної темпераДо розчину 0,2г сполуки, одержаної у досліді тури утворений осад відділяють від рідини. Осад 3.35, у 5мл безводного діоксану і 0,6мл ΝΜΡ дорозчиняють у DCM і МеОН і хроматографують на дають 0,107мл трихлорацетилхлориду, потім силікагелі, елююючи сумішшю AcOEt/MeOH (95/10 0,082мл піридину і перемішують протягом 1 години об./об.). Одержують 0,14г необхідної сполуки. при кімнатній температурі. Реакційну суміш вилиТаблиця, наведена далі, подана для ілюстравають у воду, утворений осад відділяють від рідиції хімічної структури і фізичних властивостей дени, промивають спочатку водою, потім толуолом і яких сполук за даним винаходом. У даній таблиці діетиловим ефіром. Одержують 0,19г необхідної Me означає метильну груп у. сполуки. B) 6-(5-Аміно-1,2,4-оксадіазол-3-іл)-3-(2,4дихлорфеніл)-1,9-диметил-1,9-дигідро-2Нпіридо[2,3-b]індол-2-он 51 85709 52 53 85709 54 55 85709 56 57 85709 58 59 85709 ЯМР 1H: ДМСО-d6 (300МГц): Сполука №4: d (м.ч.): 2,15: с: 3Н; 2,32: с: 3Н; 2,41: с: 3H; 4,02: с: 3H; 4,22: с: 3H; 7,01-7,1: м: 3H; 7,82: д: 1Н; 7,96: дд: 1Н; 8,28: с: 1Н; 8,68: с: 1Н. ЯМР 1H: ДМСО-d6 (300МГц): Сполука №8: d (м.ч.): 3,69: с: 3H; 3,72: с: 3H; 3,81: с: 3H; 6,55-6,59: дд: 1Н; 6,63: д: 1Н; 7,18: д: 1Н; 7,55-7,62: м: 3H; 7,68: д: 1Н; 8,01-8,05: дд: 1Н; 8,10-8,16: м: 2Н; 8,25: с: 1Н; 8,73: д: 1Н; 12,48: с: 1Н. ЯМР 1H: ДМСО-d6 (300МГц): Сполука №12: d (м.ч.): 2,48: с: 3H; 3,79: с: 1Н; 7,37: д: 1Н; 7,44-7,49: м: 2Н; 7,69: д: 1Н; 7,72-7,84: м: 2Н; 7,99: д: 1Н; 8,67: с: 1Н; 8,81: с: 1Н; 12,6: с ушир.: 1Н. ЯМР 1H: ДМСО-d6 (300МГц): Сполука №18: d (м.ч.): 2,17: с: 3H; 2,40: с: 3H; 3,71: с: 3H; 7-7,25: м: 2Н; 7,6: д: 1Н; 7,25: д: 1Н; 7,9: д: 1Н; 8,75: с: 1Н; 8,65: с: 1Н. ЯМР 1H: ДМСО-d6 (300МГц): Сполука №25: d (м.ч.): 3,44: с ушир.: 4Н; 3,56: с ушир.: 4Н; 4,01: с: 3H; 4,17: с: 3H; 4,84: с: 2Н; 7,42-7,49: м: 2Н; 7,55: дд: 1Н; 7,66-7,69: м: 2Н; 8.10: д: 1Н; 8,26: с: 1Н; 8,38: с: 1Н. ЯМР 1H: ДМСО-d6 (200МГц): Сполука №31: d (м.ч.):; 4,0: с: 3H; 4,2: с: 3H: 6,3: с: 2Н; 7,5: д: 2Н; 7,7-8,0: м: 4Н; 8,65: д: 2Н. 60 ЯМР 1H: ДМСО-d6 (300МГц): Сполука №32: d (м.ч.): 4,04: с: 3H; 4,20: с: 3H; 6,33: с: 2Н; 7,12: т: 1Н; 7,44: кв: 1Н; 7,70: м: 2Н; 7,80: д: 1Н; 7,90: д: 1Н; 8,69: с: 1Н; 8,77: с: 1Н. ЯМР 1H: ДМСО-d6 (200МГц): Сполука №38: d (м.ч.):; 4,05: с: 3H; 4,15: с: 3H; 6,3: с: 2Н; 7,4: д: 2Н; 7,75-8,0: м: 4Н; 8,6: д: 2Н. ЯМР 1H: ДМСО-d6 /ТФО (200МГц): Сполука №40: d (м.ч.):; 3,95: с: 2Н, 3,55-3,7: м: 8Н; 4,1: с: 3H; 4,2: с: 3H; 7,55: д: 2Н; 7,8-7,95: м: 4Н; 8,6: д: 2Н. ЯМР 1H: ДМСО-d6 (300МГц): Сполука №43: d (м.ч.): 2,30: с: 6Н; 3,23: с: 2Н; 4,05: с: 3H; 4,25: с: 3H; 7,47-7,50: м: 2Н; 7,72: с: 1Н; 7,89: д: 1Н; 7,99: д: 1Н; 8,39: с: 1Н; 8,70: с: 1Н; 10,90: с: 1Н. ЯМР 1H: ДМСО-d6 (300МГц): Сполука №45: d (м.ч.): 2,42: с: 3H; 4,04: с: 3H; 4,21: с: 3H; 7,09-7,15: м: 1Н; 7,41-7,48: кв: 1Н; 7,71-7,75: м: 2Н; 7,83: д: 1Н; 7,97-8,00: дд: 1Н; 8,06: с: 2Н. ЯМР 1H: MeOD-d4 (300МГц): Сполука №46: d (м.ч.): 2,43: с: 3H; 2,63: т: 4Η; 2,84: т: 2Н; 3,74: т: 4Н; 4,07: с: 3H; 4,19: т: 5Н; 7,00: д: 2Н; 7,63: д: 3H; 8,00: д: 1Н; 8,22: с: 1Н; 8,47: с: 1Н. ЯМР 1Н: ДМСО-d6 (300МГц): Сполука №47: d (м.ч.): 1,47: т: 3H; 2,42: с: 3H; 3,99: с: 3H; 4,72: кв:
ДивитисяДодаткова інформація
Назва патенту англійською6-substituted pyridoindolone derivatives production and therapeutic use thereof
Автори англійськоюBourrie Bernard, Casellas Pierre, Ciapetti Paola, Derocq Jean Marie, Gegam Samir, Muneaux Yvette, Wermuth Camille-George
Назва патенту російськоюПроизводные пиридоиндолона, замещенные в положении 6, их получение и применение в терапии
Автори російськоюБурри Бернар, Сазелла Пьер, Чиапетти Паола, Дерок Жан Мари, Жегам Самир, Мюно Иветт, Вермют Камилль-Жорж
МПК / Мітки
МПК: A61K 31/437, C07D 471/04, A61K 31/407
Мітки: похідні, заміщені, положенні, одержання, піридоіндолону, терапії, застосування
Код посилання
<a href="https://ua.patents.su/32-85709-pokhidni-piridoindolonu-zamishheni-u-polozhenni-6-kh-oderzhannya-i-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні піридоіндолону, заміщені у положенні 6, їх одержання і застосування у терапії</a>
Попередній патент: Лікарські комбінації, які містять бензоксазини, для лікування захворювань дихальних шляхів
Наступний патент: Спосіб одержання тимосапоніну вii












