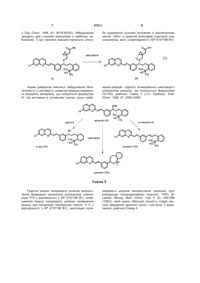
Спосіб одержання монтелукасту
Формула / Реферат
1. Спосіб одержання монтелукасту формули (І):
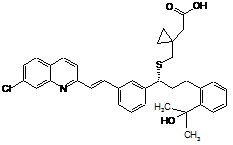 (І)
(І)
реакцією сполуки формули (III):
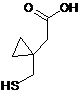 (III)
(III)
із сполукою формули (IX):
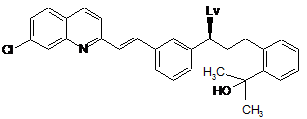 , (IX)
, (IX)
де Lv – група, що відходить, яку вибирають з групи, що містить метансульфоніл, толуолсульфоніл, хлор, бром або йод, який відрізняється тим, що реакцію проводять в присутності основи, такої як алкоксид лужного металу загальної формули ROM, де R означає алкіл і М означає лужний метал, що вибирають з групи, яка містить Na і K, інертного розчинника і компонента, що підвищує селективність процесу, такого як поліетер загальної формули (XIII):
 , (XIII)
, (XIII)
де R означає водень або алкіл і значення n змінюється від 1 до 40, або краун-етер, що описується формулою (XV), (XVI) або (XVII):
 ,
,
 ,
,
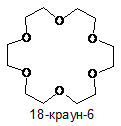
(XV)
(XVI)
(XVII).
2. Спосіб за п. 1, який відрізняється тим, що як компонент, який підвищує селективність процесу, використовують поліетиленгліколь загальної формули XIV, де n = 1-40.
 (XIV)
(XIV)
3. Спосіб за п. 1, який відрізняється тим, що як вихідну речовину використовують речовину формули (IV), де Ms означає метансульфонільну групу, що відходить.
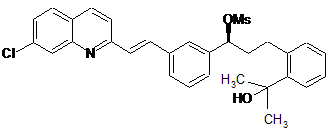 (IV)
(IV)
4. Спосіб за п. 1, який відрізняється тим, що як основу використовують алкоксид лужного металу загальної формули (XI) або (XII), де М означає лужний метал, що вибирають з групи, яка містить Na і K,
 ,
,
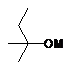 ,
,
(XI)
(XII)
![]() .
.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що як інертний органічний розчинник використовують ароматичний вуглеводень, етер, естер, амід або сульфоксид або їх суміші в будь-яких пропорціях.
6. Спосіб за п. 5, який відрізняється тим, що як інертний органічний розчинник використовують толуол, бензол, тетрагідрофуран, 2-метилтетрагідрофуран, диметилкарбонат, диметилформамід або диметилсульфоксид або їх суміші в будь-яких пропорціях.
7. Спосіб за п. 6, який відрізняється тим, що як інертний органічний розчинник використовують суміш толуолу і тетрагідрофурану.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що першу карбонову кислоту формули (III) змішують з основою ROM загальної формули (X) і поліетером формули (XIII) в інертному органічному розчиннику в атмосфері інертного газу, одержану суміш охолоджують і по краплям додають розчин речовини (IV) в органічному розчиннику, реакційну суміш потім перемішують в атмосфері інертного газу до витрати вихідних речовин.
9. Спосіб за п. 8, який відрізняється тим, що реакційні компоненти змішують при охолодженні, переважно нижче -5 °C, і реакцію далі проводять при температурі реакційної суміші від -5 до + 40 °C, переважно при кімнатній температурі приблизно 20-25 °C.
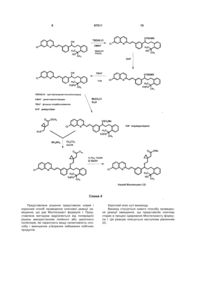
Текст
1. Спосіб одержання монтелукасту формули (І): , 3 97511 2. Спосіб за п. 1, який відрізняється тим, що як компонент, який підвищує селективність процесу, використовують поліетиленгліколь загальної формули XIV, де n = 1-40. H O O (XIV). H n , 3. Спосіб за п. 1, який відрізняється тим, що як вихідну речовину використовують речовину формули (IV), де Ms означає метансульфонільну групу, що відходить. OMs Cl N (IV). H3C HO CH3 , 4. Спосіб за п. 1, який відрізняється тим, що як основу використовують алкоксид лужного металу загальної формули (XI) або (XII), де М означає лужний метал, що вибирають з групи, яка містить Na і K, OM OM , (XI) 4 M= Na, K . 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що як інертний органічний розчинник використовують ароматичний вуглеводень, етер, естер, амід або сульфоксид або їх суміші в будь-яких пропорціях. 6. Спосіб за п. 5, який відрізняється тим, що як інертний органічний розчинник використовують толуол, бензол, тетрагідрофуран, 2метилтетрагідрофуран, диметилкарбонат, диметилформамід або диметилсульфоксид або їх суміші в будь-яких пропорціях. 7. Спосіб за п. 6, який відрізняється тим, що як інертний органічний розчинник використовують суміш толуолу і тетрагідрофурану. 8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що першу карбонову кислоту формули (III) змішують з основою ROM загальної формули (X) і поліетером формули (XIII) в інертному органічному розчиннику в атмосфері інертного газу, одержану суміш охолоджують і по краплям додають розчин речовини (IV) в органічному розчиннику, реакційну суміш потім перемішують в атмосфері інертного газу до витрати вихідних речовин. 9. Спосіб за п. 8, який відрізняється тим, що реакційні компоненти змішують при охолодженні, переважно нижче -5 °C, і реакцію далі проводять при температурі реакційної суміші від -5 до + 40 °C, переважно при кімнатній температурі приблизно 20-25 °C. , (XII) Галузь винаходу Винахід стосується нового способу одержання Монтелукасту формули І, тобто, речовини, що використовується для одержання медикаментів для лікування астми і алергій. Передумови створення винаходу Монтелукаст, хімічна назва [R-(Е)]-1-[[[1-[3-[2(7-хлор-2-хінолініл)етеніл]феніл]-3-[2-(1-гідрокси-1метилетил)феніл]пропіл]тіо]метил]циклопропаноцтова кислота формули І, є добре відомим протиастматичним і протиалергійним лікарським засобом. Це головним чином натрієва сіль Монтелукасту, що описується формулою II і що використовується в терапії. , . Натрієва сіль Монтелукасту, її одержання і різні форми, аморфна або кристалічна, описується в ряді патентів або заявок, наприклад, аморфний Натрію Монтелукаст описується в ЕР 0737186 В1 (MERCK, 1995), WO 03/066598 А1 (REDDY), WO 2004/108679 A1 (MOREPHEN, 2004), WO 2005/074893 A1 (CHEMAGIS). Кристалічні поліморфи Натрію Монтелукасту розглядаються в WO 2004/091618 А1 (MERCK), WO 2005/075427 А2 (TEVA). Перший спосіб хімічного синтезу Монтелукасту (І) був описаний в патенті № ЕР 0480717 В1 (MERCK, 1992) і надалі в спеціалізованій літературі (M.Labele, Bioorg. Med. Chem. Lett. 5 (3), 283-288 (1995)). З точки зору хімічного синтезу Монтелукасту формули І ключовою стадією є зв'язування двох конструктивних блоків (проміжних сполук) з 5 використанням новоутвореного зв'язку між атомами вуглецю і сірки під час чого абсолютна конфігурація зберігається або повністю інвертується. В принципі, існує два основні способи проведення ключової стадії синтезу Монтелукасту (І), які показані на Схемі 1. Перший спосіб зображає утворення зв'язку C-S, позначений як спосіб А) на діаграмі, другий спосіб позначений як спосіб Б). Обидва основні способи можна також розповсюдити на ряд варіантів, що в основному базуються 97511 6 на чергуванні порядку стадій реакції. Підхід, що базується на способі А) описується в ряді патентів: ЕР 0480717 В1 (MERCK, 1992), ЕР 0737186 В1 (MERCK, 1995), US 2005/0234241 А1 (REDDY, 2005), WO 2005/105751 A1 (TEVA, 2005), US 2005/0107612 A1 (REDDY, 2005). Підхід, що базується на способі Б) описується в двох патентних заявках фірми SYNTHON Company: WO 2005/105749 А2 (SYNTHON, 2005), WO 2005/105750 A1 (SYNTHON, 2005). . На практиці, головним чином використовують рішення, що характеризується тим, що використовують дилітієву сіль [1(меркаптометил)циклопропіл]оцтової кислоти формули ІІІ-диLі. Спосіб описується в патенті № ЕР 0737186В1 (MERCK, 1995); в скороченій формі він описується на Схемі 2. Це рішення також включає спосіб очищення неочищеного Монтелукасту формули І через його сіль з дициклогексиламіном, а також спосіб одержання натрієвої солі Монтелукасту формули II. . Спосіб одержання Монтелукасту формули І також як і якість одержаного продукту зазнають впливу небажаних реакцій як вихідних матеріалів, так і самого продукту, що можуть залежати від умов проведення реакції. Літературні джерела описують підвищену чутливість цільової речовини до кисню (дивіться рівняння (1)), речовина хімічної формули (V) описується як основний продукт окислення Монтелукасту формули І (E.D. Nelson, J.Pharm. Sci. 95, 1527-1539 (2006), С. Dufresne, 7 J. Org. Chem. 1996, 61, 8518-8525)). Забруднення продукту цим і іншими домішками є найбільш небажаним. З цієї причини використовуються спосо 97511 8 би одержання цільової речовини із виключенням кисню, тобто, в захисній атмосфері інертного газу (наприклад, азот, у відповідності з ЕР 0737186 В1). . Іншим джерелом хімічного забруднення Монтелукасту є нестійкість зазвичай використовуваного вихідного матеріалу, що описується формулою IV. Ця речовина в основному зазнає трьох неба жаних реакцій - гідроліз, елімінування і циклізація з утворенням домішок, що описуються формулами (VI-VIII), дивіться Схему 3 (J.O. Egekeze, Anal. Chem. 1995, 67, 2292-2295). . Гідроліз можна попередити шляхом використання безводних органічних розчинників (наприклад ТГФ у відповідності з ЕР 0737186 В1), елімінування можна попередити шляхом проведення реакції при пониженій температурі (нижче -5 °C у відповідності з ЕР 0737186 В1), циклізацію попе реджають шляхом використання захисних груп (наприклад тетрагідропіраніл (коротко, ТНР), М. Labele, Bioorg. Med. Chem. Lett. 5 (3), 283-288 (1995)), який однак, збільшує кількість стадій синтезу (введення захисної групи і наступне її видалення), дивіться Схему 4. 9 97511 10 , . Представлене рішення представляє новий і корисний спосіб проведення ключової реакції заміщення, що дає Монтелукаст формули І. Представлена методика відрізняється від попередніх рішень використанням лінійного або циклічного поліетерів, які гарантують вищу селективність способу і зменшення утворення небажаних побічних продуктів. Короткий опис суті винаходу Винахід стосується нового способу проведення реакції заміщення, що представляє ключову стадію в процесі одержання Монтелукасту формули І. Ця реакцію описується наступним рівнянням (2). 11 97511 12 . Як вихідний матеріал представленого процесу одержання Монтелукасту формули І може бути використана речовина описана загальною формулою IX, переважно речовина формули IV, що містить метансульфонову групу, як групу, що відхо дить. Вихідний матеріал IV одержують, наприклад, шляхом описаним в патентах № ЕР 0737186 В1 (MERCK, 1995), WO 2005/105751 А1 (TEVA, 2005) у відповідності з рівнянням (3). . Іншим вихідним матеріалом представленого процесу є [1-(меркаптометил)циклопропіл]оцтова кислота формули III, яка перетворюється у відповідну сіль під дією двох еквівалентів основи в реакційній суміші. Це перетворення описується рівнянням (4). Ця сіль представляє тільки активну форму реагенту. В залежності від використовуваного іону змінюються характеристики цих солей, в основному їх розчинність в реакційному середовищі. В той час як найбільша частина дилітієвої солі (ІІІ-диLi) розчиняється у використовуваних розчинниках, більша частина динатрієвої (ІІІ-диNа) і дикалієвої (ІІІ-диK) солі не розчиняються, що зменшує концентрацію активного агенту в розчині. Одержаний ефект зменшує швидкість реакції заміщення і зменшує її селективність. . Процес винаходу також характеризується використанням основ, що перетворюють кислоту формули III у відповідні солі (ІІІ-диМ, де М означає лужний метал). Як основа можуть бути використані різні речовини, наприклад, органометалічні сполуки, також як і гідроксиди лужних металів і алкоксиди формули X. Для гарантування прийнятної розчинності, придатними основами є алкоксиди металів, особливо алкоксиди, що характеризуються розгалуженим алкільним ланцюгом в їх структурі, наприклад, трет-бутоксиди і трет-амілати лужних металів (Li, Na, K), що описані формулами XI і XII. . Як реакційне середовище можуть бути використані інертні органічні розчинники, особливо ароматичні вуглеводні, етери, естери, аміди або сульфоксиди або їх суміші в будь-яких пропорціях. Наприклад, придатними є наступні розчинники: толуол, бензол, тетрагідрофуран, метилтетрагідрофуран, диметилкарбонат, диметилформамід або диметилсульфоксид. Використання суміші толуолу і тетрагідрофурану є особливо переважним. На відміну від попередніх рішень представлений спосіб використовує корисні властивості поліетерів загальної формули XII, що можуть бути або лінійними формули XIV або циклічними формули XV-XVII. Ці речовини відіграють роль каталізаторів фазового переносу комплексувальних агентів, що розчиняють іони металів, підвищуючи розчинність і реактивність використовуваного нуклеофільного реагенту, тобто (ІІІ-диМ). Підвищення реактивності реагенту призводить до підвищення селективності способу, тобто, пригнічують небажані конкурентні реакції, що призводять до утворення домішок. Завдяки додаванню поліетеру до реакційної суміші 13 ключова стадія синтезу відбувається в розчині, а не в суспензійній фазі. Як придатні лінійні поліетери можуть бути використані поліетиленгліколі формули XIV, що згадуються як PEG, що відрізняються один від одного за довжиною ланцюга або, більш точно, суміші 97511 14 поліетиленгліколів із вказаною середньої молекулярною масою, наприклад PEG-600 або PEG-1500. КРАУН етери формул XV-XVII з різними розмірами циклів можуть слугувати придатними циклічними поліетерами. . Реакції, що призводять до цільової речовини формули І, проводять у відповідності з методикою представленого винаходу таким чином, що першу карбонову кислоту формули III змішували з основою загальної формули X і поліетером формули XIII в середовищі інертного органічного розчинника і в атмосфері інертного газу. Одержану суміш охолоджували нижче -5 °C і потім по краплям додавали розчин речовини формули IV в придатному органічному розчиннику. Крім того, реакційну суміш перемішували в інертній атмосфері при температурі -5-40 °C протягом декількох годин і безперервно відбирали зразки для визначення перетворення і селективності реакції заміщення. Неочищений продукт формули І на кінець виділяли з реакційного середовища з виходом 65-75 % за допомогою загальновідомих методик, що були описані раніше в патентах № ЕР 0737186 В1, US 2005/0234241 А1, WO 2005/105751 А1. Спосіб представленого винаходу є корисним особливо завдяки додаванню поліетеру формули XIII до реакційної суміші, бажана реакція (заміщення) прискорюється порівняно з небажаними перетвореннями (гідроліз, елімінування, циклізація). Цей шлях обмежує негативний вплив конкурентних реакцій на кінцевий склад реакційної суміші в кінці реакції, тобто, під час використання вихідної речовини, наприклад, речовини формули IV. Циклічний або лінійний поліетери загальної формули XIII підвищують і розчинність, і реактивність (нуклеофільність) реагенту (ІІІ-диМ), які надалі підвищують селективність бажаної реакції. При проведенні ключової стадії одержання Монтелукасту формули І у відповідності з представленим винаходом, одержуваний склад реакційної суміші легко контролюється без необхідності довготривалого охолодження або використання захисних груп, який пов'язаний з використанням більшої кількості реакційних стадій. Окрім обмеження вмісту домішок в неочищеному продукті, наше рішення також характеризується кращим використанням вихідних речовин, тобто, дуже дорогої речовини формули IV, зокрема, надмірно використовуваної небажаними реакціями. Корисність нашого рішення демонструється в прикладах, а також на фігурах 1 і 2 додатку і в таблиці 1. Фігура 1 порівнює склад реакційних сумішей реакції без викори стання циклічного або лінійного поліетеру і реакції, коли ці речовини додаються до реакційної суміші. Фігура 2 порівнює залежності вмісту Монтелукасту в реакційних сумішах при різних умовах реакцій заміщення (у відповідності з прикладами 3, 4 і 6). Таблиця 1 порівнює перетворення і селективність виміряну після 24 годин від змішування компонентів в різних модифікаціях реакції заміщення, що призводить до Монтелукасту формули І у відповідності з прикладами 1-9. Короткий опис малюнків На фіг.1 показані ВЕРХ хроматограми реакційних сумішей реакції заміщення мезилату (IV) - А у відповідності з прикладом 4 через 48 годин (з компонентом, що підвищує селективність реакції: 18-КРАУН-6). - В у відповідності з прикладом 3 через 48 годин (без додавання компонента, що підвищує селективність реакцій). Послідовність піків: 1. спирт (VI), 2. мезилат (IV), 3. Монтелукаст (І), 4. елімінат (VII), 5. невідома домішка, 6. циклізат (VIII). На фіг.2 показана залежність вмісту Монтелукасту в реакційній суміші реакцій заміщення, що проводяться за різних умов (у відповідності з прикладами 3, 4 і 6). Приклади Об'єкт винаходу буде пояснений більш детально з використанням наступних прикладів, які однак, не мають будь-якого впливу на рамки винаходу визначені формулою винаходу. ПРИКЛАД 1 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г) і основу (трет-бутоксид літію, 0,31 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2-(7хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 2 15 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г), основу (трет-бутоксид літію, 0,31 г) і 12краун-4 (0,33 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2(7-хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 3 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г) і основу (трет-бутоксид натрію, 0,36 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2-(7хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 4 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г), основу (трет-бутоксид натрію, 0,36 г) і 18краун-6 (0,50 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2(7-хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 5 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г), основу (трет-бутоксид натрію, 0,36 г) і 15краун-5 (0,41 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2(7-хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 6 97511 16 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г), основу (трет-бутоксид натрію, 0,36 г) і PEG-600 (1,1 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2(7-хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 7 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г), основу (трет-бутоксид натрію, 0,36 г) і PEG-1500 (2,7 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3(2-(7-хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 8 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г) і основу (трет-амілат калію, 0,42 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2-(7хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. ПРИКЛАД 9 В 20 мл толуолу змішували [1(меркаптометил)циклопропіл]оцтову кислоту (0,28 г), основу (трет-амілат калію, 0,42 г) і 18краун-6 (0,50 г) і суміш перемішували в атмосфері аргону і охолоджували до приб.-10 °C. До одержаної суспензії потім додавали розчин 2-(3-(S)-(3-(2(7-хлорохінолініл)етеніл)феніл)-3-метансульфонілоксипропіл)феніл-2-пропанолу (1 г) в 5 мл тетрагідрофурану. Реакційну суміш повільно перемішували нагріваючи від -10 °C до кімнатної температури протягом години. Потім реакційну суміш перемішували при кімнатній температурі (приблизно 21 °C) протягом декількох годин. Реакційну суміш надалі аналізували за допомогою ВЕРХ. Порівняння перетворення і селективностей через 24 години після змішування компонентів в 17 різних модифікаціях реакції заміщення, що приз 97511 18 водять до Монтелукасту (І) Таблиця 1 Порівняння перетворення і селективностей через 24 години після змішування компонентів в різних модифікаціях реакції заміщення, що призводять до Монтелукасту (І) Приклад № 1 2 3 4 5 6 7 8 9 Компонент, що підвищує селективність реакції ----12-КРАУН-4 ----18-КРАУН-6 15-КРАУН-5 PEG-600 PEG-1500 ----18-КРАУН-6 Опис аналітичного способу Визначали перетворення і селективності в представленому способі одержання. Монтелукасту використовуючи ВЕРХ. Хроматограми знімали на пристрої EliteLachrom, що виготовляється Hitachi Перетворення (%) Селективність (%) 97,9 97,3 82,3 96,1 94,6 93,2 81,4 95,0 92,7 60,8 59,6 26,0 79,0 77,5 81,1 68,2 9,6 51,5 Company. Як рухому фазу використовували суміш ацетонітрилу (80 %) і 0,1 М водного розчину форміату амонію доведеного до рН 3,6 мурашиною кислотою (20 %). Вимірювання проводили ізократично із швидкістю потоку рухомої фази 1,5 мл/хв. 19 97511 20 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of preparation of montelukast
Автори англійськоюHalama Ales, Jirman, Josef
Назва патенту російськоюСпособ получения монтелукаста
Автори російськоюГалама Алес, Ирман Йосеф
МПК / Мітки
МПК: C07D 323/00, C07D 215/18
Мітки: монтелукасту, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/10-97511-sposib-oderzhannya-montelukastu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання монтелукасту</a>
Попередній патент: Спосіб функціонування вертикальної розмелювальної машини у режимі безперервного сухого перемелювання та вертикальна розмелювальна машина
Наступний патент: Підтримка численних ліній зв’язку для систем мережного керування мобільністю
Випадковий патент: Випарник абсорбційної холодильної машини