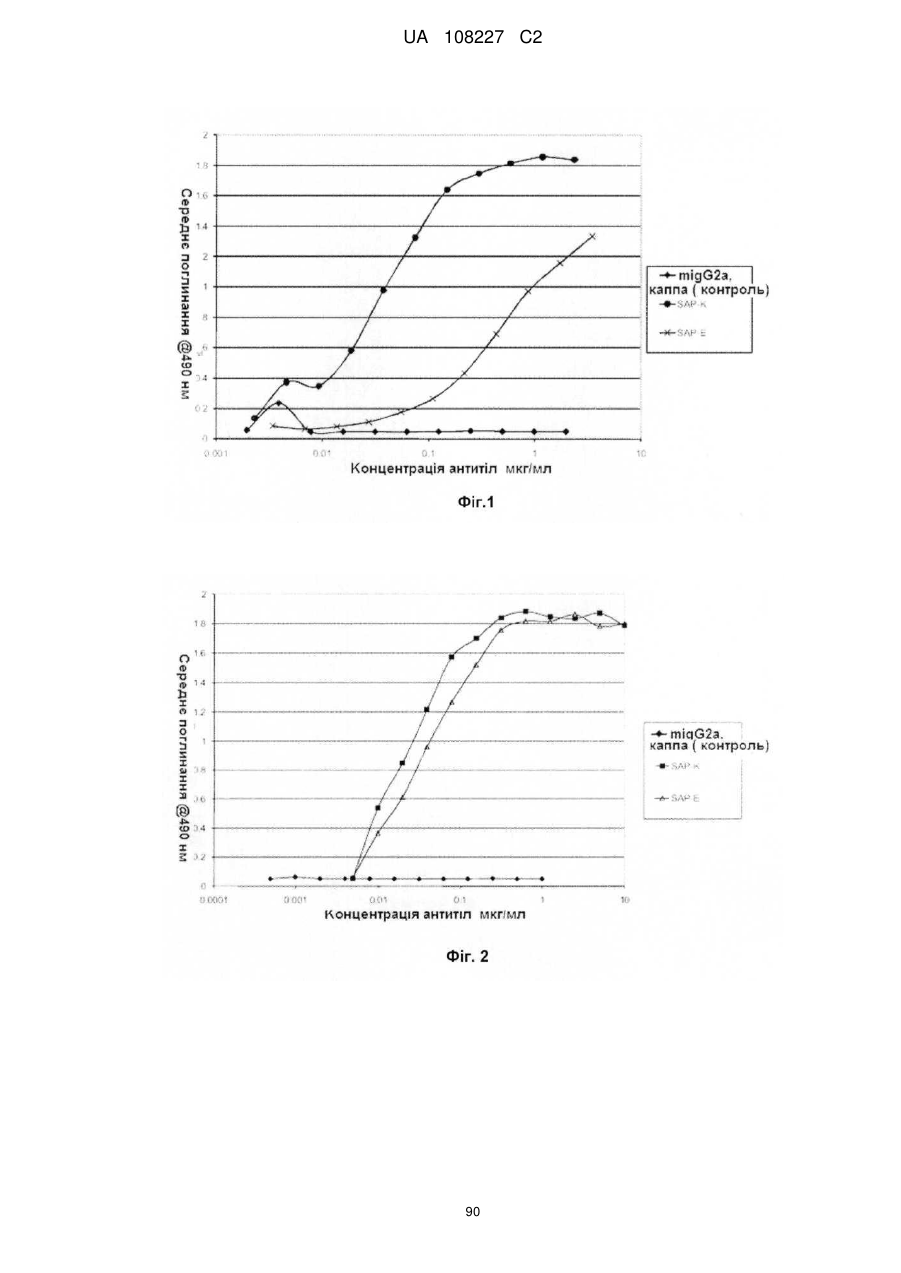
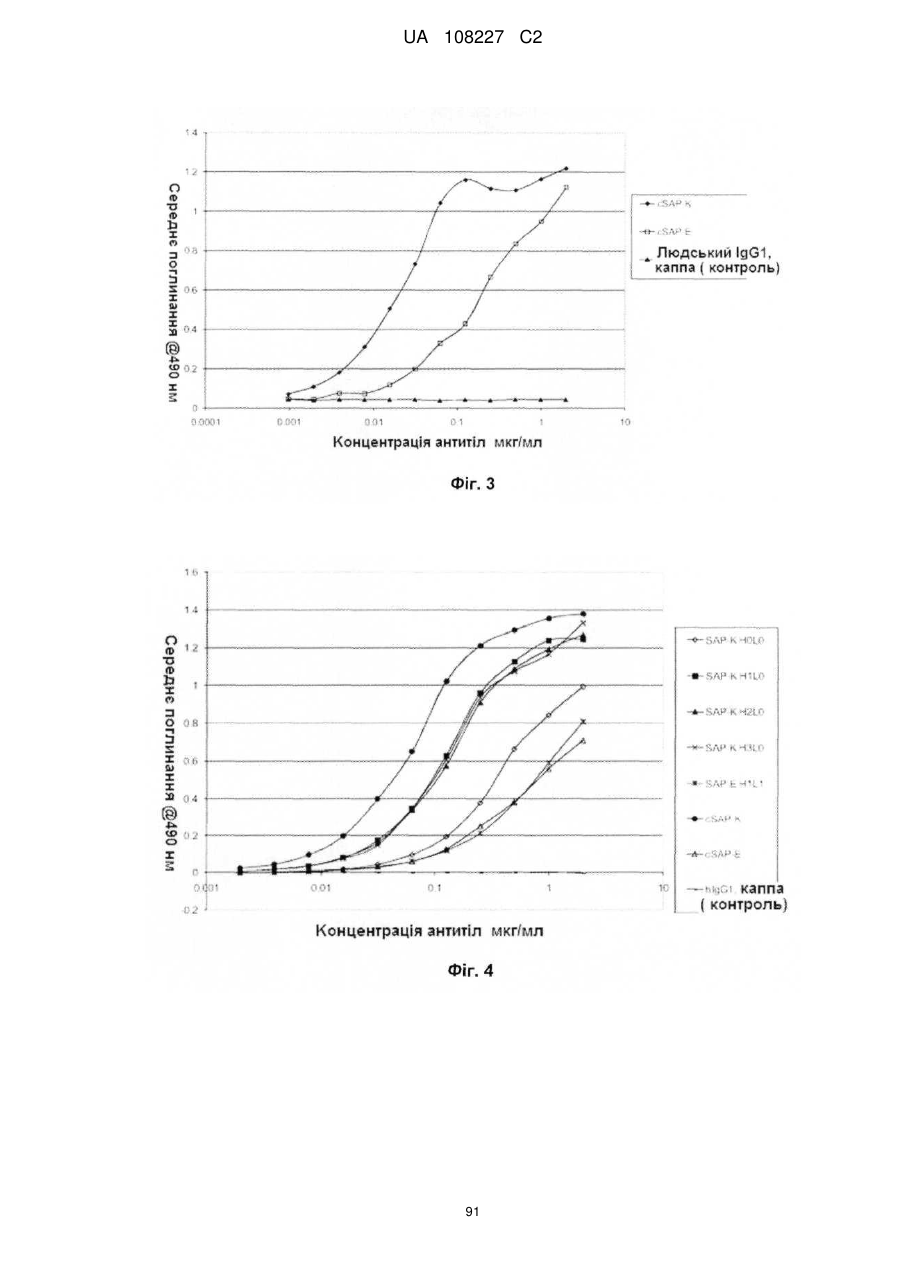
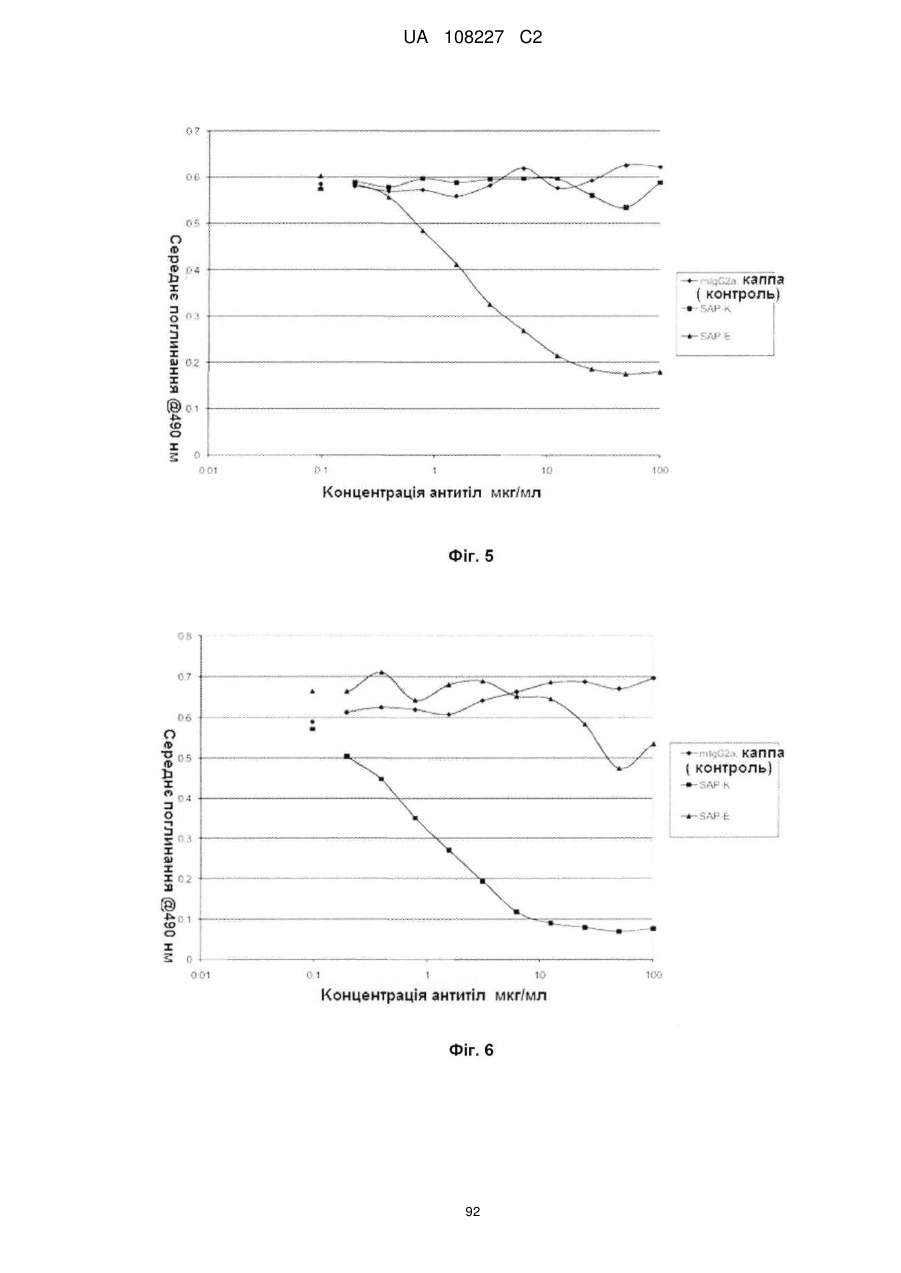
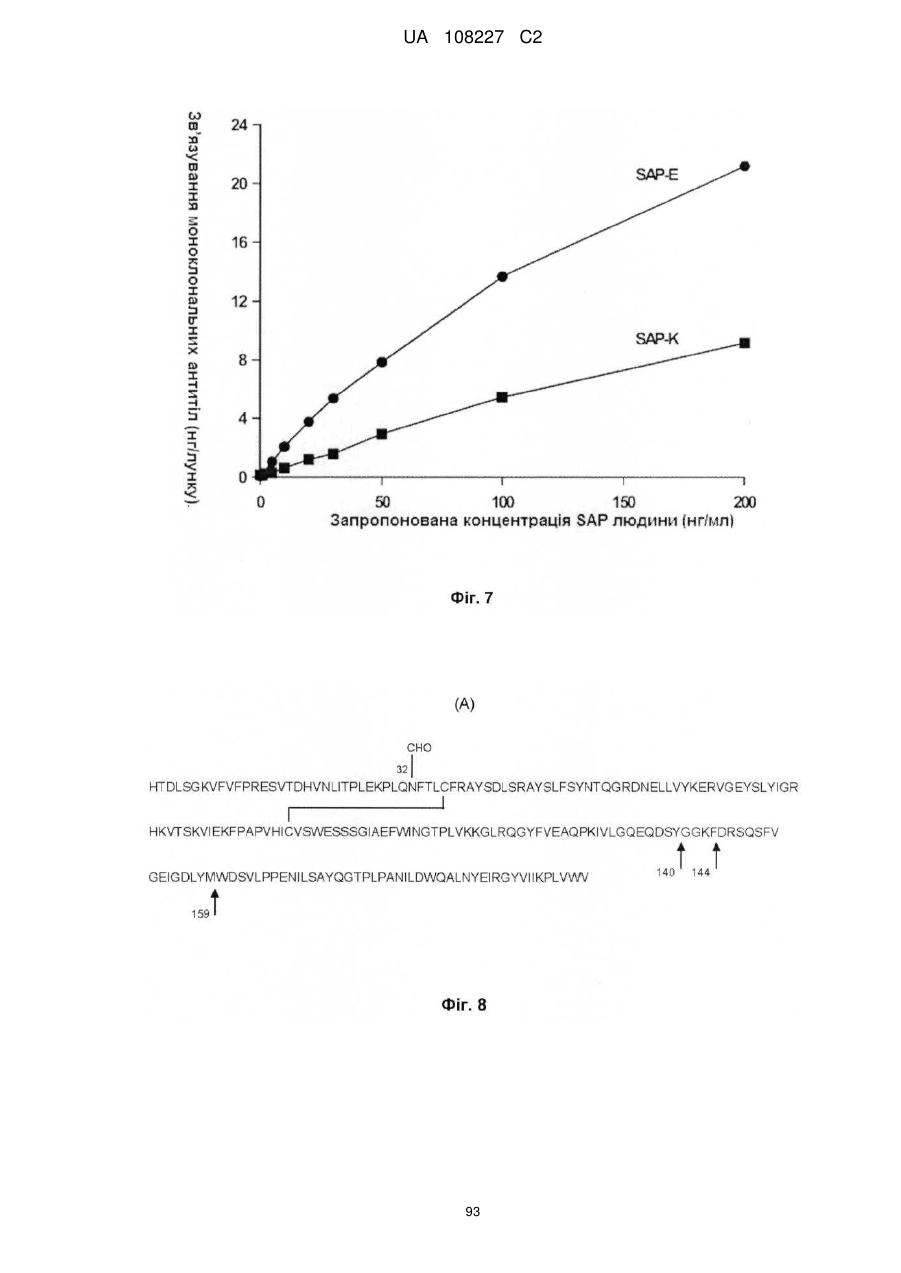
Антигензв’язуючий білок
Номер патенту: 108227
Опубліковано: 10.04.2015
Автори: Форд Сусанна Карен, Люіс Алан Пітер, ермашевскі Волкер, Піпіс Марк Брайан, Бхіндер Теджіндер Каур
Формула / Реферат
1. Немишачий антигензв'язуючий білок, що специфічно зв'язується з SAP та конкурує за зв'язування з SAP з еталонним антитілом, що включає послідовність варіабельної ділянки важкого ланцюга SEQ ID NO:7 та послідовність варіабельної ділянки легкого ланцюга SEQ ID NO:9.
2. Немишачий антигензв'язуючий білок, що зв'язується з SAP та включає CDRH1 (SEQ ID NO:1), CDRH2 (SEQ ID NO:2), CDRH3 (SEQ ID NO:3), CDRL1 (SEQ ID NO:4), CDRL2 (SEQ ID NO:5) та CDRL3 (SEQ ID NO:6); або його варіант, який зберігає усі функціональні властивості.
3. Антигензв'язуючий білок за п. 2, де:
(a) варіант CDRH1 є варіантом SEQ ID NO:1, де Туr 32 заміщено на Ile, His, Phe, Thr, Asn, Cys, Glu або Asp; Asn 33 заміщено на Tyr, Ala, Trp, Gly, Thr, Leu або Val; Met 34 заміщено на Ile, Val або Trp; та/або His 35 заміщено на Glu, Asn, Gln, Ser, Tyr або Thr;
(b) варіант CDRH2 є варіантом SEQ ID NO:2, де Туr 50 заміщено на Arg, Glu, Trp, Gly, Gln, Val, Leu, Asn, Lys або Ala; Ile51 заміщено на Leu, Val, Thr, Ser або Asn; Tyr 52 заміщено на Asp, Leu, Asn або Ser, Gly 53 заміщено на Ala, Tyr, Ser, Lys, Thr або Asn, Asp 54 заміщено на Asn, Ser, Thr, Lys або Gly; Asn 56 заміщено на Tyr, Arg, Glu, Asp, Gly, Val, Ser або Ala; та/або Asn 58 заміщено на Lys, Thr, Ser, Asp, Arg, Gly, Phe або Tyr;
(c) варіант CDRH3 є варіантом SEQ ID NO:3, де Ser 102 заміщено на Tyr, His, Val, Ile, Asp або Gly;
(d) варіант CDRL1 є варіантом SEQ ID NO:4, де Asn 28 заміщено на Ser, Asp, Thr або Glu; Ile 29 заміщено на Val; Tyr 30 заміщено на Asp, Leu, Val, Ile, Ser, Asn, Phe, His, Gly або Thr; Ser 31 заміщено на Asn, Thr, Lys або Gly; Tyr 32 заміщено на Phe, Asn, Ala, His, Ser або Arg; Leu 33 заміщено на Met, Val, Ile або Phe; та/або Ala 34 заміщено на Gly, Asn, Ser, His, Val або Phe;
(е) варіант CDRL2 є варіантом SEQ ID NO:5, де Ala 51 заміщено на Thr, Gly або Val; та/або
(f) варіант CDRL3 є варіантом SEQ ID NO:6, де Gln 89 заміщено на Ser, Gly, Phe або Leu; His 90 заміщено на Gln або Asn; His 91 заміщено на Asn, Phe, Gly, Ser, Arg, Asp, Thr, Tyr або Val; Туr 92 заміщено на Asn, Trp, Thr, Ser, Arg, Gln, His, Ala або Asp; Gly 93 заміщено на Glu, Asn, His, Thr, Ser, Arg або Ala; Ala 94 заміщено на Asp, Tyr, Thr, Val, Leu, His, Asn, Ile, Trp, Pro або Ser; та/або Leu 96 заміщено на Pro, Tyr, Arg, Ile, Trp або Phe.
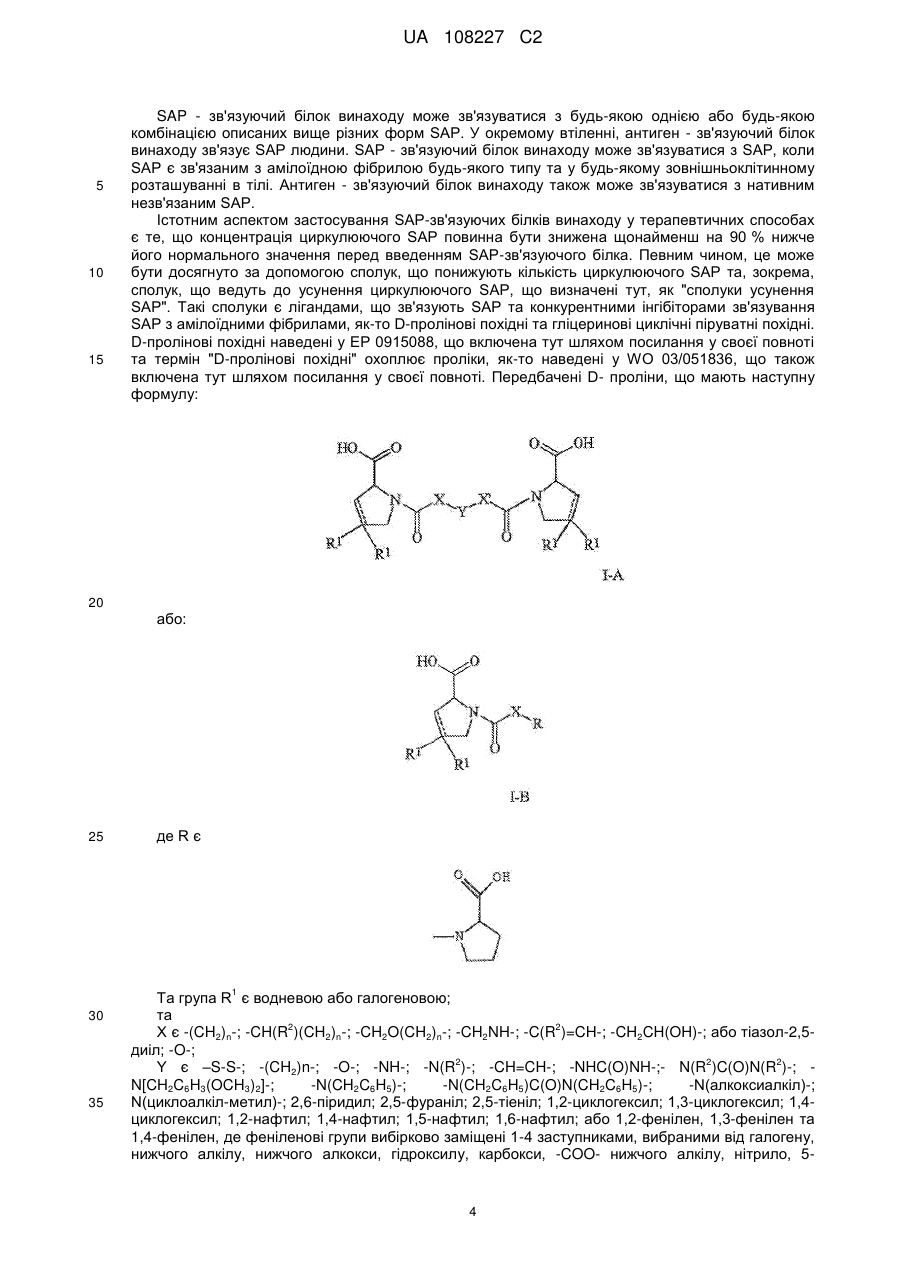
4. Антигензв'язуючий білок, що специфічно зв'язується з SAP, де антигензв'язуючий білок є химерним або гуманізованим антитілом, що включає послідовність SEQ ID NO:7 відповідних CDRH1, CDRH2 та CDRH3 варіабельного домену та послідовність SEQ ID NO:9 відповідних CDRL1, CDRL2, CDRL3 варіабельного домену.
5. Немишачий антигензв'язуючий білок, що специфічно зв'язується з SAP та включає одиницю зв'язування Н1, що містить залишки (у відповідності з Kabat) 31-32 SEQ ID NO:7, H2, що містить залишки (у відповідності з Kabat) 52-56 SEQ ID NO:7, H3, що містить залишки (у відповідності з Kabat) 95-101 SEQ ID NO:7, L1, що містить залишки (у відповідності з Kabat) 30-34 SEQ ID NO:9, L2, що містить залишки (у відповідності з Kabat) 50-55 SEQ ID NO:9; та L3, що містить залишки (у відповідності з Kabat) 89-96 SEQ ID NO:9.
6. Антигензв'язуючий білок за будь-яким з пп. 1-5, де антигензв'язуючий білок містить важкий ланцюг та/або легкий ланцюг, де:
(а) каркас важкого ланцюга включає наступні залишки: Val, Ile або Gly у положенні 2; Leu або Val у положенні 4; Leu, Ile, Met або Val у положенні 20; Cys у положенні 22; Thr, Ala, Val, Gly або Ser у положенні 24; Gly у положенні 26; Ile, Phe, Leu або Ser у положенні 29; Trp у положенні 36; Trp або Туr у положенні 47; Ile, Met, Val або Leu у положенні 48; Ile, Leu, Phe, Met абоVal у положенні 69; Val, Ala або Leu у положенні 71; Ala, Leu, Val, Tyr або Phe у положенні 78; Leu або Met у положенні 80; Туr або Phe у положенні 90; Cys у положенні 92; та/або Arg, Lys, Gly, Ser, His або Asn у положенні 94; та/або
(b) каркас легкого ланцюга містить наступні залишки: Ile, Leu або Val у положенні 2; Val, Gln, Leu або Glu у положенні 3; Met або Leu у положенні 4; Cys у положенні 23; Тrр у положенні 35; Tyr, Leu або Phe у положенні 36; Leu, Arg або Val у положенні 46; Tyr, His, Phe або Lys у положенні 49; Туr або Phe у положенні 71; Cys у положенні 88; та/або Phe у положенні 98.
7. Антигензв'язуючий білок за будь-яким з пп. 1-6, де: каркас важкого ланцюга містить наступні залишки: Val у положенні 2, Leu у положенні 4, Val у положенні 20, Cys у положенні 22, Ala у положенні 24, Gly у положенні 26, Phe у положенні 29, Тrр у положенні 36, Тrр у положенні 47, Met у положенні 48, Ile у положенні 69, Ala у положенні 71, Ala у положенні 78, Met у положенні 80, Туr у положенні 90, Cys у положенні 92, та Arg у положенні 94, та/або каркас легкого ланцюга містить наступні залишки: Ile у положенні 2, Gln у положенні 3, Met у положенні 4, Cys у положенні 23, Тrр у положенні 35, Туr у положенні 36, Leu у положенні 46, His у положенні 49, Phe у положенні 71, Cys у положенні 88, та Phe у положенні 98.
8. Антигензв'язуючий білок за будь-яким з пп. 1-7, що додатково містить каркас важкого ланцюга змінного домену антитіла, що має 75 % або більш високу ідентичність послідовності до каркасних ділянок, як показано у SEQ ID NO:25; та/або каркас легкого ланцюга змінного домену антитіла, що має 75 % або більш високу ідентичність послідовності до каркасних ділянок, як показано у SEQ ID NO:32.
9. Антигензв'язуючий білок за будь-яким з пп. 1-8, де SAP є людським SAP, що є зв'язаним з амілоїдними фібрилами in vivo.
10. Антигензв'язуючий білок за будь-яким з пп. 1-9, де антигензв'язуючий білок зв'язується зі стороною A SAP людини.
11. Антигензв'язуючий білок за будь-яким з пп. 1-10, де антигензв'язуючий білок активує систему комплементу людини.
12. Антигензв'язуючий білок за будь-яким з пп. 1-3, 5 або 9-11, який є химерним, гуманізованим або людським.
13. Антигензв'язуючий білок за будь-яким з попередніх пунктів, де антигензв'язуючий білок містить константний домен IgG1 або IgG3 людини.
14. Антигензв'язуючий білок, що специфічно зв'язується з SAP та включає варіабельну ділянку важкого ланцюга послідовності SEQ ID NO:28 та варіабельну ділянку легкого ланцюга послідовності SEQ ID NO:35.
15. Антигензв'язуючий білок, що специфічно зв'язується з SAP та включає важкий ланцюг послідовності SEQ ID NO:62 та легкий ланцюг послідовності SEQ ID NO:64.
16. Молекула нуклеїнової кислоти, що кодує антигензв'язуючий білок за будь-яким з пп. 1-15.
17. Молекула нуклеїнової кислоти за п. 16, де послідовність нуклеїнової кислоти включає SEQ ID NO:54 та/або SEQ ID NO:59.
18. Молекула нуклеїнової кислоти за п. 17, де послідовність нуклеїнової кислоти включає SEQ ID NO:61 та/або SEQ ID NO:63.
19. Вектор експресії, що включає молекулу нуклеїнової кислоти за будь-яким з пп. 16-18.
20. Рекомбінантна клітина-хазяїн, що містить вектор експресії за п. 19.
21. Спосіб отримання антигензв'язуючого білка за будь-яким з пп. 1-15, що включає стадію культивування клітини-хазяїна за п. 20 та стадію відновлення антигензв'язуючого білка.
22. Фармацевтична композиція, що містить антигензв'язуючий білок за будь-яким з пп. 1-15 та фармацевтично прийнятний носій.
23. Спосіб лікування суб'єкта, який страждає від хвороби, пов'язаної з відкладенням амілоїду, що включає етап введення вказаному суб'єкту терапевтично ефективної кількості антигензв'язуючого білка за будь-яким з пп. 1-15 або композиції за п. 22.
24. Спосіб запобігання хвороби, пов'язаної з відкладенням амілоїда у суб'єкта, що включає етап введення вказаному суб'єкту профілактично ефективної кількості антигензв'язуючого білка за будь-яким з пп. 1-15 або композиції за п. 22.
25. Спосіб за п. 23 або 24, де антигензв'язуючий білок вводиться зі сполукою, що виснажує SAP.
26. Антигензв'язуючий білок за будь-яким з пп. 1-15 для застосування у лікуванні або запобіганні хвороби, пов'язаної з відкладенням амілоїда, де вказаний антигензв'язуючий білок вводиться зі сполукою, що виснажує SAP.
27. Спосіб за п. 25, або антигензв'язуючий білок за п. 26, де введення антигензв'язуючого білка та сполуки, що виснажує SAP, є послідовним.
28. Спосіб або антигензв'язуючий білок за п. 27, де сполука, що виснажує SAP, вводиться першою.
29. Спосіб або антигензв'язуючий білок за п. 28, де антигензв'язуючий білок вводиться тоді, коли практично весь SAP, що знаходиться у системі циркуляції суб'єкта, виведений.
30. Спосіб за будь-яким з пп. 23, 24, 25, 27, 28 або 29, або антигензв'язуючий білок за будь-яким з пп. 26, 27, 28 або 29, де хвороба є вибраною згрупи, яка складається із: системного амілоїдозу, локалізованого амілоїдозу, хвороби Альцгеймера, діабету типу 2, амілоїдозу, пов'язаного з діалізом, амілоїдозу ланцюга моноклонального імуноглобуліну (AL) та церебральної амілоїдної ангіопатії.
31. Спосіб за будь-яким з пп. 25, 27, 28, 29 або 30, або антигензв'язуючий білок за будь-яким з пп. 26, 27, 28, 29 або 30, де сполука, що виснажує SAP, є похідною D-проліну або похідною гліцерол циклічного пірувату.
32. Спосіб або антигензв'язуючий білок за п. 31, де похідна D-проліну являє собою СРНРС.
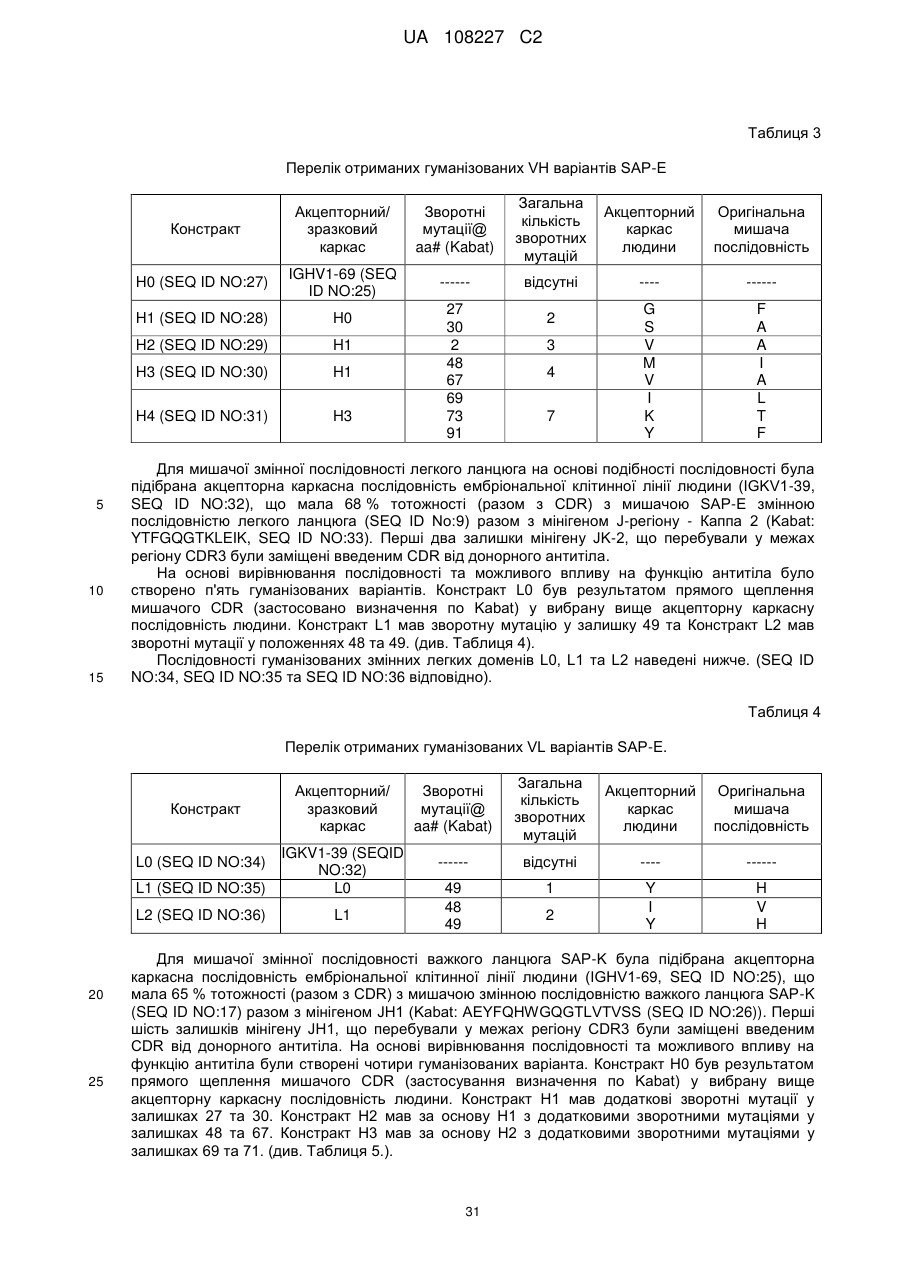
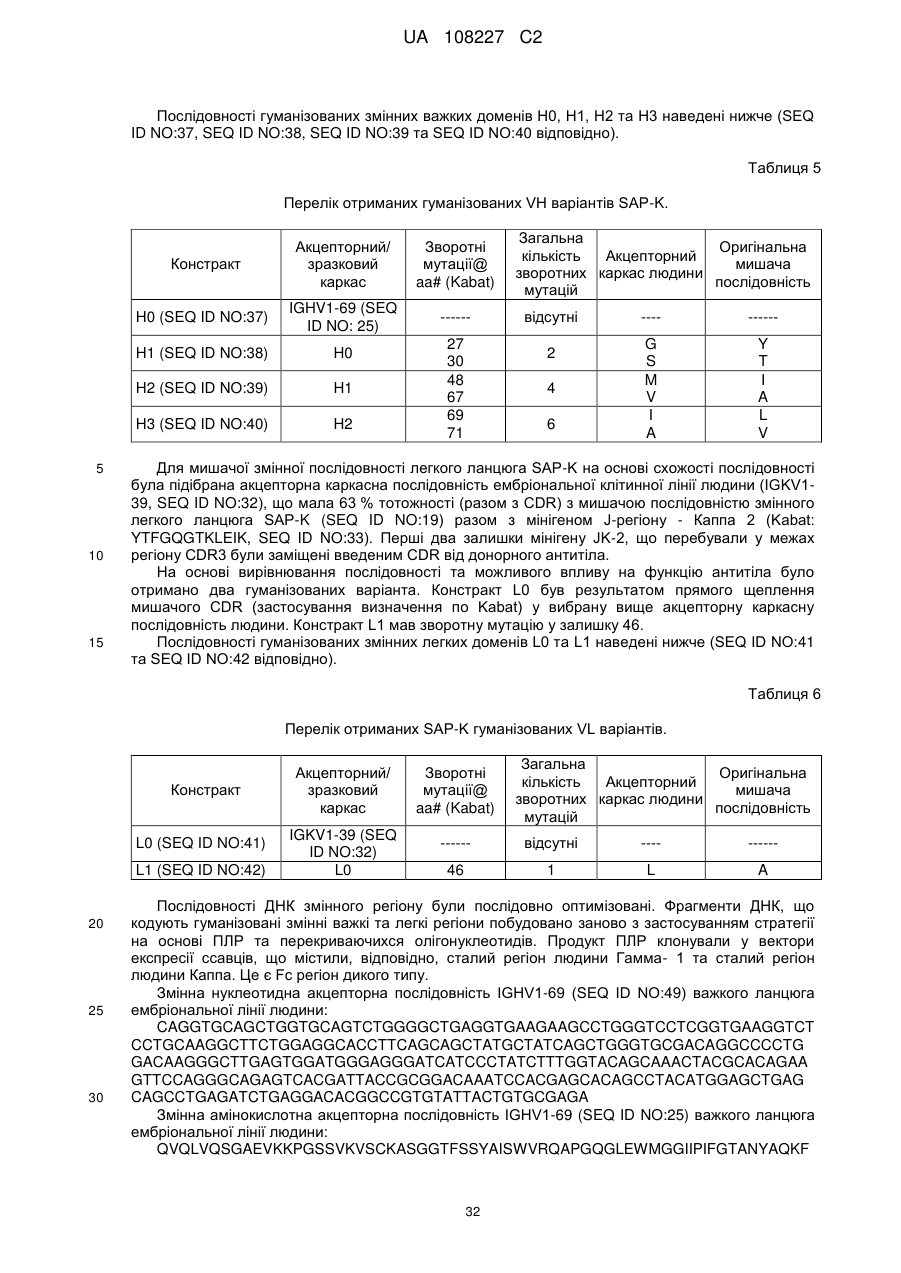
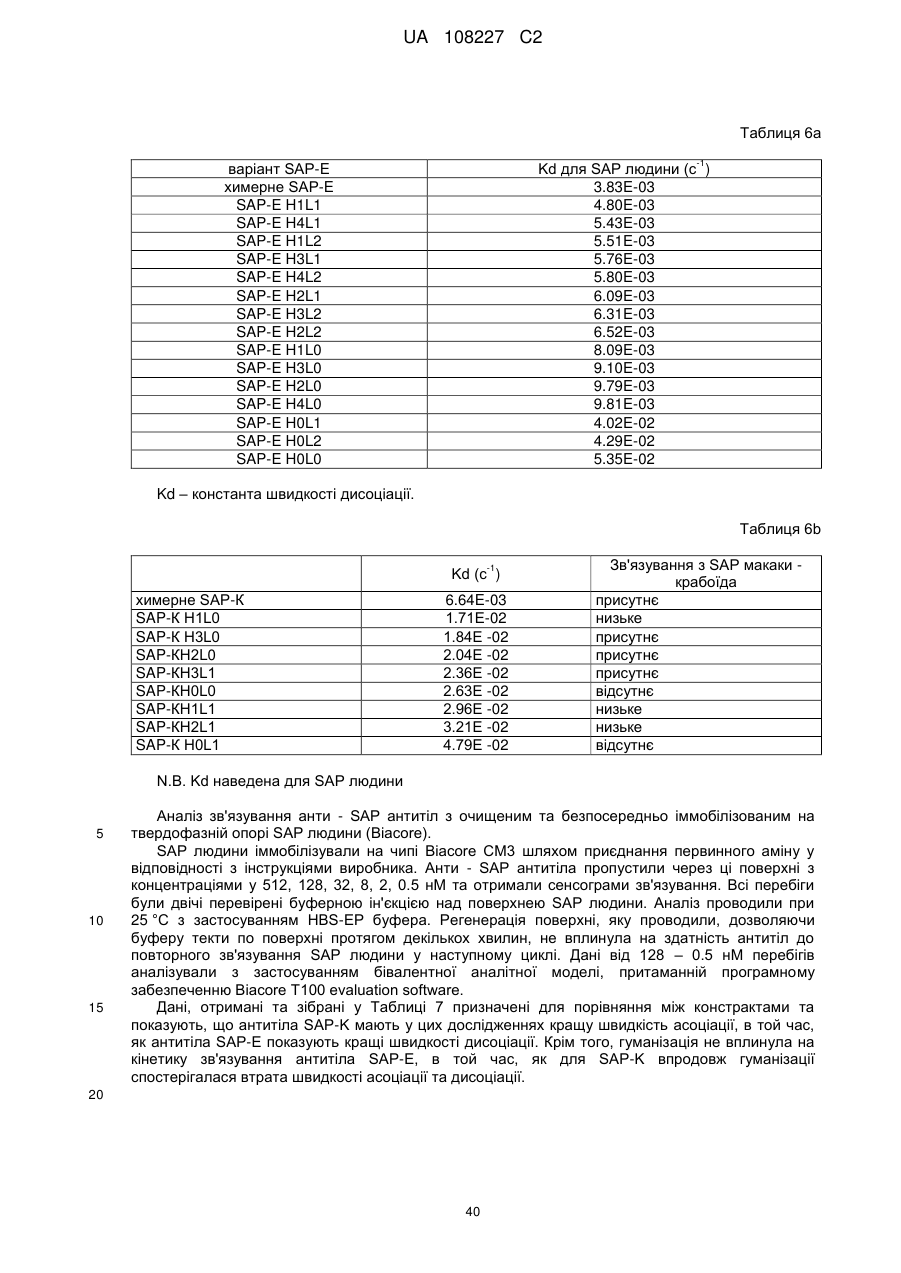
Текст
Реферат: Винахід стосується антигензв'язуючого білка, що зв'язується з сироватковим амілоїдним Ркомпонентом (SAP), молекули нуклеїнової кислоти, що кодує такий антигензв'язуючий білок, фармацевтичної композиції, що містить вказаний антигензв'язуючий білок, способу отримання антигензв'язуючого білка та способу лікування захворювання, пов'язаного з відкладенням амілоїду, зокрема системного амілоїдозу, локального амілоїдозу, хвороби Альцгеймера та діабету типу 2. UA 108227 C2 (12) UA 108227 C2 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується антиген - зв'язуючих білків, як-то антитіл, що зв'язуються з сироватковим амілоїдним Р - компонентом (SAP), полінуклеотидів, що кодують вказані антиген зв'язуючі білки, фармацевтичних композицій, що містять вказані антиген - зв'язуючі білки та способів виробництва. Заявлений винахід також стосується застосування вказаних антиген зв'язуючих білків у лікуванні або у профілактиці захворювань, пов'язаних з відкладанням амілоїду в тканинах, що охоплюють системний амілоїдоз, локальний амілоїдоз, хворобу Альцгеймера та діабет типу 2. Амілоїдоз є тяжкою та звичайно фатальною хворобою, спричиненою зовнішньоклітинним накопичуванням у тканинах аномальних нерозчинних білкових волокон, відомих, як амілоїдні фібрили. Вони походять від більш, ніж 20 різних білків у різних формах хвороби, але всі амілоїдні фібрили мають однакову хрестоподібну -β ядерну структуру та всі походять від неправильного згортання (фолдингу) нормальних розчинних білків - попередників (Pepys, M.B. (2006) Annu. Rev. Med., 57: 223-241). Нормальний, нефібрилярний білок плазми, сироватковий амілоїдний Р - компонент (SAP) також є завжди присутнім у місцях амілоїдного накопичування завдяки своєї специфічній, залежній від кальцію здатності зв'язуватися зі всіма типами амілоїдних фібрил (Pepys et al. (1979) Clin. Exp. Immunol., 38: 284-293; Pepys et al. (1997) Amyloid: Int. J. Exp. Clin. Invest., 4: 274-295). SAP людини є конститутивним білком у плазмі, з концентрацією приблизно у 20-40 мг/л (Nelson et al. (1991) Clin. Chim. Acta, 200:191-200) та з загальною кількістю приблизно у 50-100 мг, спільно у плазмі та у зовнішньосудинних порожнинах нормальних осіб та у пацієнтів з іншими, ніж амілоїдоз хворобами (Hawkins et al. (1990) J. Clin. Invest., 86: 1862-1869). У пацієнтів з амілоїдозом, SAP також певним чином зосереджений у місцях амілоїдного накопичування та у осіб з розвиненим системним амілоїдозом його концентрація може сягати до 20,000 мг SAP у амілоїді (Pepys et al. (1994) PNAS, 91: 5602-5606). Він реверсивно зв'язується з фібрилами та знаходиться у рівновазі з рідкофазним обсягом SAP. Нормальна фізіологічна функція циркулюючого SAP поки ще слабо досліджена, але експерименти на тваринах та дослідження in vitro наводять на думку про його роль у захисті хазяїна (Noursadeghi et al. (2000) PNAS, 97: 14584-14589)). SAP також є нормальною складовою тканевого матриксу, пов'язаною з еластичними фібрилами та клубочковою базальною мембраною, хоча його функція там поки ще не відома. При амілоїдозі, зовнішньоклітинні амілоїдні накопичування викликають хворобу шляхом прогресуючого накопичування, доки вони не пошкоджують структуру та, отже, функцію будь-якої тканини, яку вони займають (Pepys, M.B. (2006) Annu. Rev. Med., 57: 223-241). Будь-яка запальна відповідь або відповідь на “ чужорідне тіло “ по відношенню до амілоїдного накопичування відбувається дуже рідко або спостерігається локально у тканинах або викликається системними маркерами запалення. Системний амілоїдоз може виникати у будьякому органі, звичайно є фатальним та викликає ~1 на 1000 смертей у розвинутих країнах. Локалізований амілоїд, обмежений одиничним анатомічним розташуванням або типом тканини, також може бути дуже тяжким, наприклад, церебральна амілоїдна ангіопатія є важливою причиною геморагічного інсульту. Клінічні прояви амілоїдозу надзвичайно різноманітні та діагноз рідко встановлюють перед виникненням значних пошкоджень органу. Більш ніж 20 різних амілоїдних фібрілярних білків є відповідними за різні форми амілоїдозу, але лікування, що істотно знижують поширення відповідних амілоїдних фібрілярного білка - попередника призупиняють амілоїдне накопичування та воно може регресувати. На жаль, ефективні заходи є не завжди прийнятними та, коли вони дійсно існують, вони є токсичними або небезпечними та діють дуже повільно (Pepys, M.B (2006) Annu. Rev. Med., 57: 223-241). Отже, існує незадоволена потреба в лікарських засобах для лікування, що безпечно сприяють усуненню знайдених амілоїдних накопичувань. Крім того, є й інші хворобливі стани, де завжди присутні відкладення амілоїду, найбільш важливими з яких є хвороба Альцгеймера (AD) та цукровий діабет типу 2, у якому роль амілоїдного накопичування у патогенезі хвороби зі специфічною втратою когнітивної та панкреатичної функції підшлункової залози, відповідно, є невідомою (Pepys, M.B. (2006) Annu. Rev. Med., 57: 223-241). Проте, амілоїдні накопичування в іншому місці тіла є явно патогенними та, подібно до церебральних накопичувань при AD та острівцевих амілоїдних накопичувань при діабеті типу 2, також є шкідливими. Оскільки лікування, що усуває амілоїдні накопичування при системному амілоїдозі має, звичайно, бути терапевтичним (Pepys, M.B. (2006) Annu. Rev. Med., 57: 223-241), також клінічно бажаними повинні бути видалення амілоїдних накопичувань при AD та при діабеті типу 2. Зв'язування SAP стабілізує амілоїдні фібрили, захищає їх від протеолізу in vitro (Tennent et al., (1995) PNAS, 92: 4299-4303), а також може посилювати амілоїдний фібрилогенез in vitro (Myers et al., (2006), Biochemistry, 45: 2311-2321) та впливає на патогенез системного амілоїдозу 1 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 in vivo (Botto et al., (1997) Nature Med., 3: 855-859). Ці властивості SAP, пов'язані з його повсюдною присутністю у всіх місцях амілоїдного накопичування, роблять його привабливим терапевтичним об'єктом. Европейська патентна заявка EP 0915088 стосується D - пролінових похідних сполук, які є конкурентними інгібіторами зв'язування SAP з амілоїдними фібрилами, а також способів їх виробництва. Прийнятною сполукою, що наведена у EP 0915088 є (R)-1-[6-[(R)-2-карбоксипіролідин-1-іл]-6-оксо оксогексанойл] піролідин-2-карбонова кислота (CPHPC). Міжнародна патентна заявка WO 03/051836 стосується проліків для D - пролінових похідних сполук. Міжнародна патентна заявка WO 2004/099173 стосується гліцеринових циклічних піруватних похідних, які є конкурентними інгібіторами зв'язування SAP з амілоїдними фібрилами. Міжнародна патентна заявка WO 04/059318 описує прийнятні способи посилення утворення фіброцитів, що полягають у отриманні композицій, що зв'язують SAP. Такі композиції охоплюють анти - SAP антитіла та CPHPC. WO 04/059318 не висвітлює лікування хвороб, пов'язаних з амілоїдним накопичуванням. Крім того, існують переконливі клінічні докази та докази in vivo того, що ані SAP, ні зменшення його кількості не дають будь-якого впливу на фіброз у людини (Tennent et al., (2007) Arthritis Rheum., 56: 2013-2017; Pepys, M.B., Tennent, G.A. and Denton, C.P. (2007) Reply to Letter from Pilling, D., Buckley, C.D., Salmon, M. and Gomer, R.G., Serum amyloid P and fibrosis in systemic sclerosis: comment on the art Tennent et al. Arthritis Rheum., 56: 4229-4230). Наведена у перелічених вище патентах bis-D-пролінова сполука CPHPC, що пов'язана з високою спорідненістю до людського SAP, була розроблена як лікарський засіб для видалення SAP від амілоїдних накопичувань in vivo, тим самим полегшуючи їх очищення. Зв'язування SAP до CPHPC викликає швидке очищення комплексу печінкою з усуненням майже всього циркулюючого SAP доки сягає введення ліків та видалення більшості, але не всіх амілоїдів, пов'язаних з SAP (Pepys et al., (2002) Nature, 417: 254-259). У початкових клінічних дослідженнях (Gillmore et al., (2010) Brit. J. Haematol., doi:10.1111/j.1365-2141.2009.08036.x), введення CPHPC, здавалося, затримало амілоїдне накопичування але не спричинило амілоїдної регресії, отже CPHPC не повністю видаляє весь SAP від амілоїдних накопичувань та існує потреба іншого підходу до цієї проблеми. Міжнародна патентна заявка WO 2009/000926 стосується застосування сполук, що усувають SAP з циркуляції, як-то D-пролінові похідні, зокрема CPHPC, у комбінації зі специфічним для SAP антитілом для лікування або профілактики амілоїдозу. Відповідна міжнародна патентна заявка PCT/EP2008/011135 стосується різних мишачих моноклональних антитіл, що можуть бути застосовані у комбінації зі сполуками, що усувають SAP від циркуляції, як-то з D-проліновими похідними, зокрема з CPHPC, для лікування або профілактики амілоїдозу. Відповідно, існує потреба у антитілах, особливо у гуманізованих або у антитілах людини, що будуть специфічно поцілювати SAP та забезпечать поліпшення терапевтичної ефективності у пацієнтів, особливо людських пацієнтів із захворюваннями, пов'язаними з накопичуванням амілоїду з метою збереження функції органу та продовження життя. Заявлений винахід стосується, у першому аспекті, антиген - зв'язуючого білка, що специфічно зв'язується з SAP та конкурує за зв'язування з SAP з референсним антитілом, що містить послідовність змінного регіону важкого ланцюга SEQ ID NO:7 та послідовність змінного регіону легкого ланцюга SEQ ID NO:9. У другому аспекті винаходу, запропоновано антиген - зв'язуючий білок, що зв'язується з SAP та містить CDRH3, наведений у SEQ ID NO: 3 або функціональний варіант CDRH3. У третьому аспекті винаходу, запропоновано антиген - зв'язуючий білок, що специфічно зв'язується з SAP, де антиген - зв'язуючий білок є химерним або гуманізованим антитілом, що містить відповідний CDRH3 послідовності змінного домену SEQ ID NO:7 або функціональний варіант CDRH3. У четвертому аспекті винаходу, запропоновано антиген - зв'язуючий білок, що специфічно зв'язується з SAP та містить одиницю зв'язування H3, що містить залишки (система нумерування Kabat) 95-101 SEQ ID NO:7 або функціональний варіант одиниці зв'язування H3. У п'ятому аспект винаходу, запропоновано антиген - зв'язуючий білок, що специфічно зв'язується з SAP та містить змінний регіон важкого ланцюга, вибраний від SEQ ID NO:27-31; та/або змінний регіон легкого ланцюга, вибраний від SEQ ID NO:34-36; або варіант змінного регіону важкого ланцюга або змінного регіону легкого ланцюга з 75 % або більш високою тотожністю послідовності. У шостому аспекті винаходу, запропоновано антиген - зв'язуючий білок, що специфічно зв'язується з SAP та містить важкий ланцюг SEQ ID NO:62; та/або легкий ланцюг SEQ ID NO:64; 2 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 або варіант важкого ланцюга або легкого ланцюга з 75 % або більш високою тотожністю послідовності. Заявлений винахід також стосується молекули нуклеїнової кислоти, що кодує антиген зв'язуючий білок винаходу, векторів експресії, що її містять та клітин - хазяїв, що здатні виробляти антиген - зв'язуючі білки винаходу. У подальшому аспекті винаходу, надано фармацевтичну композицію, що містить антиген зв'язуючі білки, як визначено тут. Заявлений винахід також стосується способів запобігання та/або лікування суб'єкту, сприйнятливого до або страждаючого від хвороби, пов'язаної з амілоїдним накопичуванням, що містять етап введення вказаному суб'єкту профілактично або терапевтично ефективної кількості антиген - зв'язуючого білка. Також передбачено застосування антиген - зв'язуючого білка, як тут визначено, для запобігання та/або лікування суб'єкта, сприйнятливого до або страждаючого від хвороби, пов'язаної з амілоїдним накопичуванням. Також передбачено застосування антиген - зв'язуючого білка, як тут визначено, для виробництва ліків для запобігання та/або лікування суб'єкта, сприйнятливого до або страждаючого від хвороби, пов'язаної з амілоїдним накопичуванням. Стислий опис фігур. Фіг. 1 показує криві зв'язування для мишачих антитіл SAP-E та SAP-K при концентрації покриття людського SAP у 1 мкг/мл. Фіг. 2 показує криві зв'язування для мишачих антитіл SAP-E та SAP-K при концентрації покриття людського SAP у 5 мкг/мл. Фіг. 3 показує криві зв'язування для химерних антитіл cSAP-E та cSAP-K. Профіль кривих для химерних антитіл є подібним до профілю для еквівалентних гібридом. Фіг. 4 показує криві зв'язування для SAP-K H0L0, SAP-K H1L0, SAP-K H2L0 та SAP-K H3L0 порівняно з химерою SAP-K та SAP-E H1L1 порівняно з химерою SAP-E. Нерелевантне антитіло людини IgG1 Каппа застосували в якості негативного контролю. Фіг. 5 показує очищені мишачі моноклональні антитіла SAP-K та SAP-E у конкурентному ІФА - аналізі з химерою SAP-E. Фіг. 6 показує очищені мишачі моноклональні антитіла SAP-K та SAP-E у конкурентному ІФА - аналізі з химерою SAP-K. Фіг. 7 показує імунорадіометричний аналіз зв'язування моноклональних мишачих антитіл SAP-E та SAP-K до SAP людини, захоплених іммобілізованими поліклональними овечими антитілами анти - SAP людини. Фіг. 8 показує картування епітопу для моноклонального антитіла анти - SAP людини SAP-E. Фіг. 9 показує розташування епітопів SAP людини, що впізнаються SAP-K (A, виділено чорним) та SAP-E (B, позначено білим). Фіг. 10 показує активування C3 гуманізованими моноклональними анти - SAP людини антитілами у цільній сироватці людини. Фіг. 11 показує активування C3 низькою дозою гуманізованих моноклональних анти - SAP людини антитіл у цільній сироватці людини. Фіг. 12 показує активування C3 гуманізованими моноклональними анти - SAP людини антитілами у цільній мишачій сироватці, що збагачена чистим SAP людини. Заявлений винахід стосується антиген - зв'язуючого білка, що зв'язується з сироватковим амілоїдним Р - компонентом (SAP), наприклад, SAP людини, подібно його специфічному антигену (тобто, SAP - зв'язуючого білка). У терапевтичних застосуваннях винаходу, антиген зв'язуючий білок активує потужні механізми організму для очищення тканин від аномального забруднення. Антиген - зв'язуючий білок може бути антитілом, наприклад, моноклональним антитілом. Антиген - зв'язуючий білок винаходу не є мишачим антитілом. У втіленні, антиген зв'язуючий білок винаходу не є мишачим антиген - зв'язуючим білком. Зокрема, антиген зв'язуючий білок винаходу є химерним, гуманізованим або людським антиген - зв'язуючим білком. "Сироватковий амілоїдний Р – компонент" або "SAP" має відношення до гомопентамерного глікобілка плазми, що належить до пентраксинової родини. Кожна молекула складається з 5 ідентичних протомерів, де кожен з них має складку у вигляді приплющеної білкової просторової структури типу "бета - рулету" (β-jelly roll) та одиничну альфа-спираль, нековалентно пов'язану у дископодібне кільце з циклічною пентамерною симетрією (Hutchinson et al., (2000) Mol. Med., 6: 482-493); Pepys et al., (2002) Nature, 417: 254-259). Термін "SAP", як тут застосовано, також охоплює індивідуальну субодиницю, що кодується геном людини APCS (хромосома: 1; розташування: 1q21-q23) або гомологічними генами в інших організмах, наприклад, поліпептидну субодиницю SAP людини, що має послідовність, як наведено у SEQ ID NO:43, а також нативну пентамерну форму SAP та будь-які фрагменти та варіанти SAP, що зберігають біологічну активність зв'язування до амілоїдних фібрил in vivo. 3 UA 108227 C2 5 10 15 SAP - зв'язуючий білок винаходу може зв'язуватися з будь-якою однією або будь-якою комбінацією описаних вище різних форм SAP. У окремому втіленні, антиген - зв'язуючий білок винаходу зв'язує SAP людини. SAP - зв'язуючий білок винаходу може зв'язуватися з SAP, коли SAP є зв'язаним з амілоїдною фібрилою будь-якого типу та у будь-якому зовнішньоклітинному розташуванні в тілі. Антиген - зв'язуючий білок винаходу також може зв'язуватися з нативним незв'язаним SAP. Істотним аспектом застосування SAP-зв'язуючих білків винаходу у терапевтичних способах є те, що концентрація циркулюючого SAP повинна бути знижена щонайменш на 90 % нижче його нормального значення перед введенням SAP-зв'язуючого білка. Певним чином, це може бути досягнуто за допомогою сполук, що понижують кількість циркулюючого SAP та, зокрема, сполук, що ведуть до усунення циркулюючого SAP, що визначені тут, як "сполуки усунення SAP". Такі сполуки є лігандами, що зв'язують SAP та конкурентними інгібіторами зв'язування SAP з амілоїдними фібрилами, як-то D-пролінові похідні та гліцеринові циклічні піруватні похідні. D-пролінові похідні наведені у EP 0915088, що включена тут шляхом посилання у своєї повноті та термін "D-пролінові похідні" охоплює проліки, як-то наведені у WO 03/051836, що також включена тут шляхом посилання у своєї повноті. Передбачені D- проліни, що мають наступну формулу: 20 або: 25 де R є 1 30 35 Та група R є водневою або галогеновою; та 2 2 X є -(CH2)n-; -CH(R )(CH2)n-; -CH2O(CH2)n-; -CH2NH-; -C(R )=CH-; -CH2CH(OH)-; або тіазол-2,5диіл; -O-; 2 2 2 Y є –S-S-; -(CH2)n-; -O-; -NH-; -N(R )-; -CH=CH-; -NHC(O)NH-;- N(R )C(O)N(R )-; N[CH2C6H3(OCH3)2]-; -N(CH2C6H5)-; -N(CH2C6H5)C(O)N(CH2C6H5)-; -N(алкоксиалкіл)-; N(циклоалкіл-метил)-; 2,6-піридил; 2,5-фураніл; 2,5-тіеніл; 1,2-циклогексил; 1,3-циклогексил; 1,4циклогексил; 1,2-нафтил; 1,4-нафтил; 1,5-нафтил; 1,6-нафтил; або 1,2-фенілен, 1,3-фенілен та 1,4-фенілен, де феніленові групи вибірково заміщені 1-4 заступниками, вибраними від галогену, нижчого алкілу, нижчого алкокси, гідроксилу, карбокси, -COO- нижчого алкілу, нітрило, 5 4 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 тетразол, (2- карбонова кислота піролідин-1-іл)-2-оксо-етокси, N-гідроксикарбаміміодил, 5оксо[1,2,4оксадіазоліл, 2-оксо [1,2,3,5] оксатіадіаoзоліл, 5-тіоксо[1,2,4]oксадіазоліл та 5-тертбутил сульфаніл-[1,2,4]оксадіазоліл; 2 X' є –(CH2)n-; -(CH2)nCH(R2)-; -(CH2)nOCH2-; -NHCH2-; -CH=C(R )-; CH(OH)CH2; або тіазол-2,5диіл; -O-; 2 R є нижчим алкілом, нижчим алкокси або бензилом, n є 0-3 та де алкіл або нижчий алкіл є C1-6 алкілом; алкокси або нижчий алкокси є C1-6 алкокси; циклоалкіл є C3-6 циклоалкілом; галоген є F, Cl або Br; місце, де у формулі з'являється пунктирна лінія означає або одинарний або подвійний зв'язок; або їх фармацевтично прийнятна сіль або моно - або діефір. D- проліни наведеної вище формули I-A можуть бути записаними, як ліганд - лінкер - ліганд, де група X-Y-X' формули I-A утворює лінкер. Лінкер (X-Y-X') може бути довжиною у 4-20 лінійних атомів вуглецю, в тому числі довжиною у 4-15 лінійних атомів вуглецю, 5-10 лінійних атомів вуглецю, та 6-8 лінійних атомів вуглецю. Лінкер може бути прямим або розгалуженим ланцюгом або може вибірково утворювати одну або декілька кільцевих структур за умовами, що у лінкері присутні щонайменш 4 лінійних або розташованих у прямому ланцюзі атома вуглецю. Принаймні один з лінійних або розташованих у прямому ланцюзі атомів вуглецю може бути вибірково заміщений принаймні одним гетероатомом, вибраним від N, O, або S, бажано від O або S, бажано від O. Отже, "вибірково заміщений лінкер" може мати одне або більше заміщень, що ведуть до розгалуження та/або одне або більше заміщень, лінійних або розташованих у прямому ланцюзі лінкера атома (атомів) вуглецю, наприклад, лінкер може бути ефіром або заміщеним ефіром. (R)-1-[6-[(R)-2-карбокси-піролідин-1-іл]-6-оксо-гексанойл]піролідин-2-карбонова кислота (CPHPC) є специфічним D-проліном, передбаченим винаходом. У окремому втіленні, CPHPC може бути введений до пацієнта - людини. Гліцеринові циклічні піруватні похідні наведені у WO 2004/099173, що включена тут шляхом посилання у своєї повноті. Термін "антиген - зв'язуючий білок", як тут застосовано, має відношення до антитіла, фрагментів антитіла та до інших білкових констрактів, як-то домени, що здатні зв'язуватися з SAP. Термін "антитіло" застосований тут у широкому сенсі та має відношення до молекул з доменом, подібним до імуноглобуліну та охоплює моноклональні, рекомбінантні, поліклональні, химерні, гуманізовані, біспецифічні та гетерокон'югатні антитіла; одиничний змінний домен, доменне антитіло, антиген - зв'язувальні фрагменти, імунологічно - ефективні фрагменти, одноланцюгові Fv - фрагменти, діатіла, Tandabs™, тощо. (щодо переліку альтернативних форматів "антитіл" див. Holliger та Hudson, Nature Biotechnology, 2005, Vol 23, No. 9, 1126-1136). Фраза "одиничний змінний домен" має відношення до змінного домену антиген - зв'язуючого білка (наприклад, VH, VHH, VL), що специфічно зв'язує антиген або епітоп незалежно від іншого змінного регіону або домену. "Доменне антитіло" або "dAb" можна розглядати так само, як і "одиничний змінний домен", який є здатним до зв'язування з антигеном. Одиничний змінний домен може бути змінним доменом антитіла людини, але також охоплює одиничні змінні домени антитіл від інших видів, як-то гризунів (наприклад, як наведено у WO 00/29004), акули-няньки та VHH dAb верблюдових. VHH верблюдових є поліпептидами імуноглобулінового одиничного змінного домену, що походять від видів, що охоплюють верблюд, ламу, альпаку, дромадера та гуанако, що продукують важколанцюгові антитіла, природно позбавлені легких ланцюгів. Подібні VHH домени можуть бути гуманізовані з застосуванням стандартних способів, прийнятних у цій галузі та вважається, що такі домени є "доменними антитілами". Як тут застосовано, VH охоплює VHH домени верблюдових. Термін "домен", як тут застосовано, має відношення до згорнутої білкової структури, що має третинну структуру, незалежну від залишку білка. Головним чином, домени відповідають за дискретні функціональні властивості білків та у багатьох випадках їх можна додати, видалити або перемістити в інші білки без втрати функціональності залишку білка та/або домену. "Одиничний змінний домен" є згорнутим поліпептидним доменом, що містить послідовності, характерні для змінних доменів антитіл. Отже, він містить повні змінні домени антитіла та модифіковані змінні домени, наприклад, де одну або більше петель заміщено послідовностями, що не є характерними для змінних доменів антитіла, або змінні домени антитіл, що були усічені або містять N- або C- кінцеві розширення а також згорнуті фрагменти змінних доменів, що принаймні зберігають зв'язувальну активність та специфічність повнорозмірного домену. Домен може зв'язувати антиген або епітоп незалежно від іншого змінного регіону або домену. 5 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Aтиген - зв'язуючий фрагмент може бути отриманий шляхом розміщення одного або декількох CDR на білкових скафолдах, що не мають відношення до антитіл, як-то домен. Домен може бути доменним антитілом або може бути доменом - похідною скафолду, вибраного від групи, що охоплює CTLA-4, ліпокаїн, SpA, Affibody, авимер, GroEl, трансферин, GroES та фібронектин/аднектин, що був підданий білковій інженерії для отримання зв'язування з антигеном, як-то SAP, іншим, ніж природний ліганд. Aтиген - зв'язуючий фрагмент або імунологічно ефективний фрагмент може частково містити змінні послідовності важкого або легкого ланцюга довжиною принаймні 5, 6, 7, 8, 9 або 10 амінокислот. Альтернативно, фрагменти сягають принаймні 15, принаймні 20, принаймні 50, принаймні 75, або принаймні 100 амінокислот у довжину. Термін "специфічно зв'язується" в даній заявці застосований по відношенню до антиген зв'язуючих білків та означає, що антиген - зв'язуючий білок зв'язується з SAP з відсутністю або несуттєвим ступенем зв'язування до будь-яких інших білків, в тому числі, до тісно зв'язаних молекул, як-то C-реактивний білок (CRP), що має у людині 55 % певних залишків при гомології послідовності амінокислотних залишків та має по суті однакову білкову структуру. Рівноважна константа дисоціації (KD) взаємодії антиген - зв'язуючий білок - SAP може дорівнювати 1 мM або менше, 100 нM або менше, 10 нM або менше, 2 нM або менше або 1 нM або менше. Альтернативно, KD може бути у діапазоні 5-10 нM; або 1-2 нM. KD може бути у діапазоні 1 пM500 пM; або 500 пM-1 нM. TM Афінність зв'язування може бути виміряна за допомогою BIAcore , наприклад, шляхом зв'язування антигену з SAP, що сполучений з карбоксиметилдекстрановим чипом за допомогою приєднання первинного аміну та зв'язуванням антитіл до цієї поверхні. Альтернативно, TM афінність зв'язування може бути виміряна за допомогою BIAcore шляхом зв'язування анти SAP антитіл до SAP людини, що, в свою чергу, захоплений іммобілізованим на CM5 чипі Oфосфоетаноламіном. Для вимірювання афінності зв'язування також можна застосувати описані TM у Прикладі 8 способи BIAcore . -3 -1 -4 -1 Константа швидкості дисоціації (kd) може дорівнювати 1×10 s або менше, 1×10 s або -5 -1 -5 -1 -4 -1 -4 -1 менше або 1×10 s або менше. kd може бути у діапазоні 1×10 s - 1×10 s ; або 1×10 s -3 -1 1×10 s . Маленька kd може привести до повільної дисоціації комплексу антиген - зв'язуючий білок - ліганд та до поліпшення усунення зв'язаних з амілоїдом комплексів SAP. Фахівцям зрозуміло, що термін "походить" призначений для визначення не тільки джерела у сенсі того, що це фізичне походження матеріалу, але й для визначення матеріалу, що є структурно ідентичним матеріалу, але не походить з референсного джерела. Отже "залишки, знайдені у донорному антитілі" не обов'язково були очищені від донорного антитіла. Під "виділеним" мається на увазі, що молекула, як-то антиген - зв'язуючий білок, є видаленою від середовища, де вона може зустрічатися в природі. Наприклад, молекула може бути очищеною від речовин, з якими вона природно існує. Наприклад, маса молекули у пробі може дорівнювати 95 % від загальної маси. "Химерне антитіло" має відношення до типу штучно створених антитіл, що містять природний змінний регіон (легкий ланцюг та важкі ланцюги), що походить від донорного антитіла у поєднанні зі сталими регіонами легкого та важкого ланцюгів, що походять від акцепторного антитіла. "Гуманізоване антитіло" має відношення до типу штучно створених антитіл, що мають CDR, що походять від імуноглобулінового донора не-людинного походження та де решта імуноглобулінової частини молекули походить походить від одного або декількох імуноглобулінів(ну) людини. На додачу, каркасні підтримуючі залишки також можна змінити для збереження афінності зв'язування (див., наприклад, Queen et al. Proc. Natl Acad Sci USA, 86:10029-10032 (1989), Hodgson et al. Bio/Technology, 9:421(1991)). Прийнятне акцепторне антитіло людини можна вибрати з загальноприйнятної бази даних, наприклад, з бази даних KABAT®, з баз даних Los Alamos database та Swiss Protein database, по гомології до нуклеотиду та по амінокислотній послідовності донорного антитіла. Антитіло людини, що характеризується гомологією до каркасних регіонів донорного антитіла (на амінокислотній основі) може бути прийнятним для забезпечення сталого регіону важкого ланцюга та/або змінного каркасного регіону важкого ланцюга для вставки донорних CDR. Відповідне акцепторне антитіло, прийнятне для вилучення сталого або змінного каркасних регіонів легкого ланцюга можна відібрати подібним чином. Слід зазначити, що важкий та легкий ланцюги акцепторного антитіла не зобов'язані походити з того ж акцепторного антитіла. Попередні дослідники описали різні шляхи отримання таких гуманізованих антитіл - див. наприклад, EP-A-0239400 та EP-A-054951. Термін "донорне антитіло" має відношення до антитіла, що віддає амінокислотні послідовності своїх змінних регіонів, CDR або інші функціональні фрагменти або їх аналоги 6 UA 108227 C2 5 10 15 20 25 30 35 40 45 першому імуноглобуліновому партнеру. Отже, донор надає змінений імуноглобуліновий кодуючий регіон та можна отримати здатне до експресії змінене антитіло з антигенною специфічністю та характеристиками нейтралізуючої активності донорного антитіла. Термін "акцепторне антитіло" має відношення до антитіла, що є гетерологічним до донорного, яке віддає всі (або будь-яку частину) амінокислотній послідовності, що кодує його каркасні регіони важкого та/або легкого ланцюга та/або його сталі регіони важкого та/або легкого ланцюга першому імуноглобуліновому партнеру. Антитіло людини може бути акцепторним антитілом. Термін "антитіло людини" має відношення до антитіла, що походить від послідовності імуноглобулінового гена людини. В якості джерела терапевтичних антитіл низької імуногенності, ці повні антитіла людини являють собою альтернативу перебудованим або деімунізованим моноклональним антитілам гризунів (наприклад, гуманізованим антитілам) та їх можна легко отримати з застосуванням або фаг - дисплею або трансгенних мишачих платформ. У одному втіленні, антитіло винаходу є антитілом людини. Застосовані тут терміни "VH" та "VL" мають відношення до, відповідно, змінного регіону важкого ланцюга та змінного регіону легкого ланцюга антиген - зв'язуючого білка. "CDR" визначають, як регіон амінокислотній послідовності антиген - зв'язуючого білка, що визначає комплементарність. Це - гіперваріабельні регіони важкого та легкого імуноглобулінових ланцюгів. У змінній частині імуноглобуліну існують три CDR важкого ланцюга та три CDR легкого ланцюга (або CDR - регіони). Отже, визначення "CDR", як тут застосовано, має відношення до всіх трьох важколанцюгових CDR, всіх трьох легколанцюгових CDR, всіх важко- та легколанцюгових CDR або принаймні до двох CDR. У даній заявці, амінокислотні залишки послідовності змінного домену та повнорозмірні послідовності антитіл пронумеровані відповідно до системи нумерування Kabat. Крім того, терміни "CDR", "CDRL1", "CDRL2", "CDRL3", "CDRH1", "CDRH2", "CDRH3", що застосовані у Прикладах також пронумеровані відповідно до системи нумерування Kabat. Для додаткової інформації, див. Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). Проте, хоча в цій заявці ми застосували систему нумерування Kabat для амінокислотних залишків у послідовності змінного домену та у послідовності повнорозмірного антитіла, фахівцям зрозуміло, що існують альтернативні системи нумерування для амінокислотних залишків у послідовностях змінного домену та повнорозмірних послідовностях антитіл. Також існують альтернативні системи нумерування для послідовностей CDR, наприклад, наведені у Chothia et al. (1989) Nature 342: 877-883. Структура та фолдинг білка антитіла може означати, що інші залишки вважаються частиною послідовності CDR та це добре зрозуміло досвідченим фахівцям. Інші відомі фахівцям системи нумерування для послідовностей CDR охоплюють системи "AbM" (University of Bath) та "Сontact" (University College London). Мінімальний перекриваючийся регіон з застосуванням щонайменш двох систем нумерування, вибраних від Kabat, Chothia, AbM та Сontact можна визначити для забезпечення "мінімальної одиниці зв'язування". Мінімальна одиниця зв'язування може бути суб- частиною CDR. Таблиця 1 нижче показує одне з визначень з застосуванням кожної системи нумерування для кожного CDR або одиниці зв'язування. Для нумерування амінокислотної послідовності змінного домену у Таблиці 1 застосована схема нумерування Kabat. Слід зазначити, що деякі з визначень CDR можуть змінюватися в залежності від застосованого індивідуального видання. Таблиця 1 Kabat CDR H1 H2 H3 L1 L2 L3 Chothia CDR AbM CDR Contact CDR 31-35/35A/35B 50-65 95-102 24-34 50-56 89-97 26-32/33/34 52-56 95-102 24-34 50-56 89-97 26-35/35A/35B 50-58 95-102 24-34 50-56 89-97 30-35/35A/35B 47-58 93-101 30-36 46-55 89-96 мінімальна одиниця зв'язування 31-32 52-56 95-101 30-34 50-55 89-96 Як тут застосовано, термін "сайт зв'язування антигену" має відношення до сайту антиген зв'язуючого білка, що здатен до специфічного зв'язування з антигеном. Це може бути 7 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 одиничний домен (наприклад, епітоп - зв'язувальний домен) або одиноланцюгові Fv (ScFv) домени або це можуть бути спарені VH/VL домени, що можна знайти у стандартному антитілі. Термін "епітоп", як тут застосовано, має відношення до такої частини антигену, що утворює контакт з окремим зв'язувальним доменом антиген - зв'язуючого білка. Епітоп може бути лінійним, що містить головним чином лінійну амінокислотну послідовність антигену. Альтернативно, епітоп може бути конформаційним або преривчастим. Конформаційний епітоп, наприклад, містить амінокислотні залишки, що потребують елемент структурного обмеження. У випадку конформаційного епітопу, хоча залишки може бути від різних регіонів пептидного ланцюга, вони можуть перебувати в безпосередній близькості до тривимірної структурі антигену. У випадку мультимерних антигенів, як-то SAP, конформаційний епітоп може містити залишки від різних пептидних ланцюгів, що також можуть перебувати в безпосередній близькості до тривимірної структурі антигену. Такі структурно сусідні залишки можна визначити за допомогою програм комп'ютерного моделювання або тривимірних структур, отриманих відомими фахівцям способами, наприклад, рентгенівською кристалографією. Преривчастий епітоп містить амінокислотні залишки, відділені іншою послідовністю, тобто, що не знаходяться у вигляді суцільної послідовності у первинній послідовності антигену. У контексті третинної та четвертинної структур антигену, залишки преривчастого епітопу знаходяться достатньо близько один до одного для зв'язування з антиген - зв'язуючим білком. У втіленні, антиген - зв'язуючий білок винаходу зв'язується з епітопом у межах залишків 140158 SAP людини. Для нуклеотидної та амінокислотної послідовності, термін "ідентичність" або "ідентичність послідовності" вказує на рівень тотожності між двома нуклеїновими кислотами або двома амінокислотними послідовностями при оптимальному узгодженні відносно відповідних вставок або делецій. Відсоток тотожності між двома послідовностями є функцію кількості ідентичних положень, що зустрічаються у послідовності (тобто, % тотожності = кількість ідентичних положень / загальна кількість положень, помножена на 100), беручі до уваги кількість пробілів та довжину кожного пробілу, що необхідно ввести для оптимального узгодження двох послідовностей. Порівняння послідовностей та визначення відсотку тотожності між двома послідовності можна здійснити за допомогою описаного нижче математичного алгоритму. Відсоток тотожності між двома нуклеотидними послідовностями можна визначити з застосуванням програми GAP з набору програмного забезпечення GCG software package, з застосуванням матриці NWSgapdna.CMP з вагою пробілу у 40, 50, 60, 70, або 80 та з довжиною пробілу у 1, 2, 3, 4, 5, або 6. Відсоток тотожності між двома нуклеотидними або амінокислотними послідовностями також можна визначити з застосуванням алгоритму від E. Meyers та W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), що включений у програму ALIGN (версія 2.0), з застосуванням таблиці ваги залишків PAM120, зі штрафом за подовження пробілу = 12 та штрафом за пробіл = 4. На додачу, відсоток тотожності між двома амінокислотними послідовностями можна визначити з застосуванням алгоритму від Needleman та Wunsch (J. Mol. Biol. 48:444-453 (1970)), що включений у програму GAP у пакеті програмного забезпечення GCG, з застосуванням або матриці Blossum 62 або матриці PAM250 та з вагою пробілу у 16, 14, 12, 10, 8, 6 або 4 та з довжиною пробілу у 1, 2, 3, 4, 5 або 6. В якості прикладу, полінуклеотидна послідовність може бути ідентичною до референсної полінуклеотидної послідовності, як тут описано (див. наприклад, SEQ ID NO:8, 10, 18, 20, 45-48, 51-61, 63, 65-73), що є на 100 % ідентичною або може включати в себе до певного цілого числа нуклеотидних змін у порівнянні з еталонною послідовністю, що мають тотожність принаймні у 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98, або 99 %. Такі змінення вибрані від щонайменш однієї нуклеотидної делеції, заміщення, в тому числі трансляції та трансверсії або вставки та де вказане змінення може відбуватися на 5' або 3' кінцях референсної нуклеотидної послідовності або будь - де між цими кінцевими положеннями, що або індивідуально розташовані серед нуклеотидів референсної послідовності або знаходяться у однієї або у декількох суміжних групах у референсній послідовності. Кількість нуклеотидних змінень визначають шляхом множення загальної кількості нуклеотидів у референсній полінуклеотидній послідовності, як тут описано (див. наприклад, SEQ ID NO:8, 10, 18, 20, 45-48, 51-61, 63, 65-73), на численний відсоток відповідної відсоткової тотожності (розділений на 100) та відніманням цього продукту від вказаної загальної кількості нуклеотидів у референсній полінуклеотидній послідовності, як тут описано (див. наприклад, SEQ ID NO:8, 10, 18, 20, 45-48, 51-61, 63, 65-73) або: nn xn xn y , де nn є кількістю нуклеотидних змінень, 8 xn є загальною кількістю нуклеотидів у UA 108227 C2 референсній полінуклеотидній послідовності, як тут описано (див. наприклад, SEQ ID NO:8, 10, 18, 20, 45-48, 51-61, 63, 65-73), та y дорівнює 0.50 для 50 %, 0.60 для 60 %, 0.70 для 70 %, 0.75 для 75 %, 0.80 для 80 %, 0.85 для 85 %, 0.90 для 90 %, 0.95 для 95 %, 0.98 для 98 %, 0.99 для 99 % або 1.00 для 100 %, є символом операції множення та де будь-який нецілий продукт x n 5 10 15 20 25 30 35 та у округлено до найближчого цілого значення перед відніманням його від x n . Крім того, поліпептидна послідовність може бути ідентичною до поліпептидної референсній послідовності, як тут описано (див. наприклад, SEQ ID NO:1-7, 9, 11-17, 19, 21-24, 27-31, 34-42, 62, 64, 74), яка може бути ідентичною на 100 % або може містити певне ціле число амінокислотних змінень порівняно з референсною послідовністю, так що відсоток тотожності є меншим, ніж 100 %, як-то, принаймні 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98, або 99 % тотожності. Такі змінення вибрані від групи, що охоплює принаймні одну амінокислотну делецію, заміщення, в тому числі консервативне та неконсервативне заміщення або вставку та де вказані змінення можуть відбуватися у N- або C-термінальних положеннях референсної поліпептидної послідовності або будь - де між цими кінцевими положеннями, що або індивідуально розташовані серед нуклеотидів референсної послідовності або знаходяться у однієї або у декількох суміжних групах у референсній послідовності. Кількість амінокислотних змінень визначають шляхом множення загальної кількості амінокислот у поліпептидній послідовності, що кодується поліпептидною референсною послідовністю, як тут описано (див. наприклад, SEQ ID NO:1-7, 9, 11-17, 19, 21-24, 27-31, 34-42, 62, 64, 74), на численний відсоток відповідної відсоткової тотожності (розділений на 100) та наступним відніманням цього продукту від вказаної загальної кількості амінокислот у референсній поліпептидній послідовності, як тут описано (див. наприклад, SEQ ID NO:1-7, 9, 11-17, 19, 21-24, 27-31, 34-42, 62, 64, 74) або: na x a x a y , де na є кількістю амінокислотних змінень, x a є загальною кількістю амінокислот у референсній поліпептидній послідовності, як тут описано (див., наприклад, SEQ ID NO:1-7, 9, 11-17, 19, 21-24, 27-31, 34-42, 62, 64, 74), та y дорівнює 0.50 для 50 %, 0.60 для 60 %, 0.70 для 70 %, 0.75 для 75 %, 0.80 для 80 %, 0.85 для 85 %, 0.90 для 90 %, 0.95 для 95 %, 0.98 для 98 %, 0.99 для 99 %, або 1.00 для 100 %, є символом операції множення та де будь-який нецілий продукт x n та у округлено до найближчого цілого значення перед відніманням його від x n . Відсоток тотожності можна визначити по всій довжині послідовності. Кожен з термінів "пептид", "поліпептид" та "білок" має відношення до молекули, що містить два або більше амінокислотних залишка. Пептид може бути мономерним або полімерним. Фахівцям добре відомо, що деякі амінокислотні заміщення розглядаються, як "консервативні". Амінокислоти поділяють на групи на основі властивостей сталого бічного ланцюга та заміщення у групах, що зберігають всю або істотно всю афінність зв'язування антиген - зв'язуючого білка розглядаються, як консервативні заміщення, див., Таблицю 2 нижче: Таблиця 2 Бічний ланцюг Гідрофобні Нейтральні гідрофільні Кислі Основні Залишки, які впливають на орієнтацію ланцюга Ароматичні 40 45 Члени Met, Ala, Val, Leu, Ile Cys, Ser, Thr Aap, Glu Asn, Gln, His, Lys, Arg Gly, Pro Trp, Tyr, Phe Антиген - зв'язуючий білок може конкурувати за зв'язування до SAP з референсним антитілом, що містить послідовність змінного регіону важкого ланцюга SEQ ID NO: 7 та послідовність змінного регіону легкого ланцюга SEQ ID NO: 9. Альтернативно, антиген зв'язуючий білок може конкурувати за зв'язування до SAP з референсним антитілом, що містить послідовність змінного регіону важкого ланцюга SEQ ID NO: 17 та послідовність змінного регіону легкого ланцюга SEQ ID NO: 19. Конкурування між антиген - зв'язуючим білком та референсним антитілом можна визначити за допомогою конкурентного ІФА, флуоресцентного мікрообсягового аналізу (FMAT) або BIAcore. Конкуруючий антиген - зв'язуючий білок може зв'язуватися з тим саме епітопом, перекриваючимся епітопом або з епітопом у безпосередній близькості від епітопу, з яким зв'язується референсне антитіло. 9 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується з SAP та містить CDRH3 SEQ ID NO:3 або його варіантні CDR. Антиген - зв'язуючий білок може додатково містити один або більше CDR або всі CDR у будь-якій комбінації, вибрані з: CDRH1 (SEQ ID NO:1), CDRH2 (SEQ ID NO:2), CDRL1 (SEQ ID NO:4), CDRL2 (SEQ ID NO:5), та CDRL3 (SEQ ID NO:6); або їх варіант. Наприклад, антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:3) та CDRH1 (SEQ ID NO:1) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:3) та CDRH2 (SEQ ID NO:2) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH1 (SEQ ID NO:1), CDRH2 (SEQ ID NO:2) та CDRH3 (SEQ ID NO:3) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL1 (SEQ ID NO:4) та CDRL2 (SEQ ID NO:5) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL2 (SEQ ID NO:5) та CDRL3 (SEQ ID NO:6) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL1 (SEQ ID NO:4), CDRL2 (SEQ ID NO:5) та CDRL3 (SEQ ID NO:6) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:3) та CDRL3 (SEQ ID NO:6) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:3), CDRH2 (SEQ ID NO:2) та CDRL3 (SEQ ID NO:6) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:3), CDRH2 (SEQ ID NO:2), CDRL2 (SEQ ID NO:5) та CDRL3 (SEQ ID NO:6) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH1 (SEQ ID NO:1), CDRH2 (SEQ ID NO:2), CDRH3 (SEQ ID NO:3), CDRL1 (SEQ ID NO:4), CDRL2 (SEQ ID NO:5) та CDRL3 (SEQ ID NO:6) або їх варіанти. Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується з SAP та містить CDRH3 SEQ ID NO:13 або його варіантні CDR. Антиген - зв'язуючий білок може додатково містити один або більше CDR або всі CDR у будь-якої комбінації, вибрані з: CDRH1 (SEQ ID NO:11), CDRH2 (SEQ ID NO:12), CDRL1 (SEQ ID NO:14), CDRL2 (SEQ ID NO:15), та CDRL3 (SEQ ID NO:16); або їх варіант. Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується з SAP, де антиген - зв'язуючий білок є химерним або гуманізованим антитілом, що містить відповідний CDRH3 послідовності змінного домену SEQ ID NO:7 або варіантний CDRH3. Химерний або гуманізований антиген - зв'язуючий білок може додатково містити один або більше або всі відповідні CDR, вибрані від послідовностей змінного домену SEQ ID NO:7 або SEQ ID NO:9, або їх варіантні CDR. Наприклад, антиген - зв'язуючий білок може містити відповідний CDRH3 та відповідний CDRH1 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3 та відповідний CDRH2 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH1, відповідний CDRH2 та відповідний CDRH3; або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRL1 та відповідний CDRL2 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRL1, відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3, відповідний CDRH2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3, відповідний CDRH2, відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH1, відповідний CDRH2, відповідний CDRH3, відповідний CDRL1, відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Відповідний CDR можна визначити з посиланням на способи Kabat (1987), Chothia (1989), AbM або Сontact або на комбінації цих способів. Одне визначення цих способів можна знайти у Таблиці 1 та можна застосувати до референсного змінного домену важкого ланцюга SEQ ID NO:7 та до референсного змінного домену легкого ланцюга SEQ ID NO:9 для визначення відповідного CDR. Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується з SAP, де антиген - зв'язуючий білок є химерним або гуманізованим антитілом, що містить відповідний CDRH3 послідовності змінного домену SEQ ID NO:17 або варіантний CDRH3. Химерний або гуманізований антиген - зв'язуючий білок може додатково містити один або більше або всі відповідні CDR, вибрані від послідовностей змінного домену SEQ ID NO:17 або SEQ ID NO:19 або їх варіантні CDR. Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується з SAP та містить одиницю зв'язування H3, що містить залишки (система нумерування Kabat) 95 10 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 101 SEQ ID NO:7 або варіантну H3. Антиген - зв'язуючий білок може додатково містити один або більше або всі одиниці зв'язування, вибрані з: H1, що містить залишки (система нумерування Kabat) 31-32 SEQ ID NO:7, H2, що містить залишки (система нумерування Kabat) 52-56 SEQ ID NO:7, L1, що містить залишки (система нумерування Kabat) 30-34 SEQ ID NO:9, L2, що містить залишки (система нумерування Kabat) 50-55 SEQ ID NO:9 та L3, що містить залишки (система нумерування Kabat) 89-96 SEQ ID NO:9; або варіантні одиниці зв'язування. Наприклад, антиген - зв'язуючий білок може містити одиницю зв'язування H3, одиницю зв'язування H1 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3 та одиницю зв'язування H2 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H1, одиницю зв'язування H2 та одиницю зв'язування H3; або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування L1 та одиницю зв'язування L2 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування L2 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування L1, одиницю зв'язування L2 та одиницю зв'язування L3; або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3, одиницю зв'язування H2, та одиницю зв'язування L3; або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3, одиницю зв'язування H2, одиницю зв'язування L2, та одиницю зв'язування L3; або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H1, одиницю зв'язування H2, одиницю зв'язування H3, одиницю зв'язування L1, одиницю зв'язування L2 та одиницю зв'язування L3; або їх варіанти. Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується з SAP та містить одиницю зв'язування H3, що містить залишки (система нумерування Kabat) 95101 SEQ ID NO:17 або варіант H3. Антиген - зв'язуючий білок може додатково містити одну або більше або всі одиниці зв'язування, вибрані з: H1 що містить залишки (система нумерування Kabat) 31-32 SEQ ID NO:17, H2, що містить залишки (система нумерування Kabat) 52-56 SEQ ID NO:17, L1, що містить залишки (система нумерування Kabat) 30-34 SEQ ID NO:19, L2, що містить залишки (система нумерування Kabat) 50-55 SEQ ID NO:19 та L3, що містить залишки (система нумерування Kabat) 89-96 SEQ ID NO:19; або варіантну одиницю зв'язування. Варіантний CDR або варіантна одиниця зв'язування містить амінокислотну послідовність, модифіковану принаймні однією амінокислотою, де вказана модифікація може бути хімічною або являти собою часткове змінення амінокислотної послідовності (наприклад, змінення не більш, ніж 10 амінокислот), де модифікація дозволяє варіанту зберігати біологічні характеристики немодифікованої послідовності. Наприклад, варіант є функціональним варіантом, що специфічно зв'язується з SAP та активує очищення тканин від комплексів SAP, пов'язаних з амілоїдом. Часткове змінення CDR амінокислотної послідовності може бути виконано шляхом делеції або заміщення від однієї до декількох амінокислот або шляхом додавання або вставки від однієї до декількох амінокислот або їх комбінацією (наприклад, не більш, ніж для 10 амінокислот). Варіантний CDR або одиниця зв'язування може містити 1, 2, 3, 4, 5 або 6 амінокислотних заміщень, додавань або делецій у будь-якій комбінації у амінокислотній послідовності. Варіантний CDR або одиниця зв'язування може містити 1, 2 або 3 амінокислотних заміщення, додавання або делеції у будь-якій комбінації у амінокислотній послідовності. Заміщення у амінокислотних залишках можуть бути консервативними, наприклад, заміщення однієї гідрофобної амінокислоти на альтернативну гідрофобну амінокислоту. Наприклад, лейцин може бути заміщений валіном або ізолейцином. Один або більше з описаних тут CDR, відповідних CDR, варіантних CDR або одиниць зв'язування може бути присутнім у контексті каркасного регіону людини, наприклад, у вигляді гуманізованого або химерного змінного домену. Винаходом також передбачені та знаходяться у його межах повні антитіла людини, що містять один або декілька описаних тут CDR, відповідних CDR, варіантних CDR або одиниць зв'язування. CDR L1, L2, L3, H1 та H2, як правило, структурно представляють одну з обмеженої кількості основних конформацій ланцюга. Окремий канонічний структурний клас CDR визначений по довжині CDR та по пакуванню петель, визначається залишками, розташованими у ключових положеннях у CDR та у каркасних регіонах (SDR або залишки структурного визначення). Martin та Thornton (1996; J Mol Biol 263:800-815) генерують автоматичним способом до визначення канонічних зразків "ключового залишку". Кластерний аналіз застосовують для визначення канонічних класів для наборів CDR та після цього канонічні зразки ідентифікують за допомогою аналізу захованих гідрофобних залишків з водневими зв'язками та консервативних гліцинів та пролінів. Послідовності CDR антитіл можна віднести до канонічних класів шляхом порівняння 11 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності зі зразками ключових залишків та обчисленням кожного зразка з застосуванням матриць тотожності або подібності. Приклади канонічностей CDR у межах винаходу наведені нижче. Нумерування амінокислот надано по Kabat. Приклади канонічностей для CDRH1, що наведені у SEQ ID NO:1, для його варіанта CDRH1 з SEQ ID NO:7 або для відповідних CDR являють собою заміщення Tyr 32 на Ile, His, Phe, Thr, Asn, Cys, Glu або Asp; заміщення Asn 33 на Tyr, Ala, Trp, Gly, Thr, Leu або Val; заміщення Met 34 на Val або Trp; та/або заміщення His 35 на Glu, Asn, Gln, Ser, Tyr або Thr. Приклади канонічностей для CDRH2, що наведені у SEQ ID NO:2, для його варіанта CDRH2 з SEQ ID NO:7 або для відповідних CDR являють собою заміщення Tyr 50 на Arg, Glu, Trp, Gly, Gln, Val, Leu, Asn, Lys або Ala; заміщення Ile51 на Leu, Val, Thr, Ser або Asn; заміщення Tyr 52 на Asp, Leu, Asn або Ser; заміщення Gly 53 на Ala, Tyr, Ser, Lys, Thr або Asn; заміщення Asp 54 на Asn, Ser, Thr, Lys або Gly; заміщення Asn 56 на Tyr, Arg, Glu, Asp, Gly, Val, Ser або Ala; та/або заміщення Asn 58 на Lys, Thr, Ser, Asp, Arg, Gly, Phe або Tyr. Приклади канонічностей для CDRH3, що наведені у SEQ ID NO:3, для його варіанта CDRH3 з SEQ ID NO:7 або для відповідних CDR являють собою заміщення Ser 102 на Tyr, His, Val, Ile, Asp або Gly. Приклади канонічностей для CDRL1, що наведені у SEQ ID NO:4, для його варіанта CDRL1 з SEQ ID NO:9 або для відповідних CDR являють собою заміщення Asn 28 на Ser, Asp, Thr або Glu; заміщення Ile 29 на Val; заміщення Tyr 30 на Asp, Leu, Val, Ile, Ser, Asn, Phe, His, Gly або Thr; заміщення Ser 31 на Asn, Thr, Lys або Gly; заміщення Tyr 32 на Phe, Asn, Ala, His, Ser або Arg; заміщення Leu 33 на Met, Val, Ile або Phe; та/або заміщення Ala 34 на Gly, Asn, Ser, His, Val або Phe. Приклади канонічностей для CDRL2, наведені у SEQ ID NO:5, для його варіанта CDRL2 з SEQ ID NO:9 або для відповідних CDR являють собою заміщення Ala 51 на Thr, Gly або Val. Приклади канонічностей для CDRL3, наведені у SEQ ID NO:6, для його варіанта CDRL1 з SEQ ID NO:9 або для відповідних CDR являють собою заміщення Gln 89 на Ser, Gly, Phe або Leu; заміщення His 90 на Gln або Asn; заміщення His 91 на Asn, Phe, Gly, Ser, Arg, Asp, Thr, Tyr або Val; заміщення Tyr 92 на Asn, Trp, Thr, Ser, Arg, Gln, His, Ala або Asp; заміщення Gly 93 на Glu, Asn, His, Thr, Ser, Arg або Ala; заміщення Ala 94 на Asp, Tyr, Thr, Val, Leu, His, Asn, Ile, Trp, Pro або Ser; та/або заміщення Leu 96 на Pro, Tyr, Arg, Ile, Trp або Phe. Приклади канонічностей для CDRH1, наведені у SEQ ID NO:11, для його варіанта CDRH1 з SEQ ID NO:17 або для відповідних CDR являють собою заміщення Tyr 32 на Ile, His, Phe, Thr, Asn, Cys, Glu або Asp; заміщення Trp 33 на Tyr, Ala, Gly, Thr, Leu або Val; заміщення Met 34 на Ile, Val або Trp; та/або заміщення His 35 на Glu, Asn, Gln, Ser, Tyr або Thr. Приклади канонічностей для CDRH2, наведені у SEQ ID NO:12, для його варіанта CDRH1 з SEQ ID NO:17 або для відповідних CDR являють собою заміщення Met 50 на Arg, Glu, Trp, Tyr, Gly, Gln, Val, Leu, Asn, Lys або Ala; заміщення Ile51 на Leu, Val, Thr, Ser або Asn; заміщення His 52 на Asp, Leu, Asn, Ser або Tyr; заміщення Asn 53 на Ala, Gly, Tyr, Ser, Lys або Thr; заміщення Ser 54 на Asn, Thr, Lys, Asp або Gly; заміщення Asn 56 на Tyr, Arg, Glu, Asp, Gly, Val, Ser або Ala; та/або заміщення Asn 58 на Lys, Thr, Ser, Asp, Arg, Gly, Phe або Tyr. Приклади канонічностей для CDRH3, наведені у SEQ ID NO:13, для його варіанта CDRH1 з SEQ ID NO:17 або для відповідних CDR являють собою заміщення Val 102 на Tyr, His, Ile, Ser, Asp або Gly. Приклади канонічностей для CDRL1, наведені у SEQ ID NO:14, для його варіанта CDRL1 з SEQ ID NO:19 або для відповідних CDR являють собою заміщення Asn 28 на Ser, Asp, Thr або Glu; заміщення Val 29 на Ile; заміщення Asn 30 на Asp, Leu, Tyr, Val, Ile, Ser, Phe, His, Gly або Thr; заміщення Ser 31 на Asn, Thr, Lys або Gly; заміщення Asn 32 на Phe, Tyr, Ala, His, Ser або Arg; заміщення Val 33 на Met, Leu, Ile або Phe; заміщення Ala 34 на Gly, Asn, Ser, His, Val або Phe. Приклади канонічностей для CDRL2, наведені у SEQ ID NO:15, для його варіанта CDRL1 з SEQ ID NO:19 або для відповідних CDR являють собою заміщення Ala 51 на Thr, Gly або Val. Приклади канонічностей для CDRL3, наведені у SEQ ID NO:16, для його варіанта CDRL1 з SEQ ID NO:19 або для відповідних CDR являють собою заміщення Gln 89 на Ser, Gly, Phe або Leu; заміщення Gln 90 на Asn або His; заміщення Cys 91 на Asn, Phe, Gly, Ser, Arg, Asp, His, Thr, Tyr або Val; Asn 92 заміщено на Tyr, Trp, Thr, Ser, Arg, Gln, His, Ala або Asp; заміщення Asn 93 на Glu, Gly, His, Thr, Ser, Arg або Ala; заміщення Tyr 94 на Asp, Thr, Val, Leu, His, Asn, Ile, Trp, Pro або Ser; та/або заміщення Phe 96 на Pro, Leu, Tyr, Arg, Ile або Trp. Можуть існувати багато канонічних положень варіантного CDR для CDR, для відповідного CDR, для одиниці зв'язування, для змінного регіону важкого або легкого ланцюга, для важкого 12 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 або легкого ланцюга та для антиген - зв'язуючого білка, отже будь-яка комбінація заміщення може бути присутньою у антиген - зв'язуючому білку винаходу за умовах того, що канонічна структура CDR зберігається в такому вигляді, що антиген - зв'язуючий білок є здатним до специфічного зв'язування SAP. Як вже обговорювалося вище, окремий клас канонічних структур CDR визначають по довжині CDR та по пакуванню петель, що визначаються залишками, розташованими у ключових положеннях у CDR та у каркасних регіонах. Отже, на додачу до CDR, перелічених у SEQ ID NO: 1-6 або 11-16, CDR з SEQ ID NO:7, 9, 17 або 19, відповідних CDR, одиниць зв'язування або їх варіантів, канонічні каркасні залишки антиген - зв'язуючого білка винаходу можуть містити (з застосуванням нумерування по Kabat): Важкий ланцюг: Val, Ile або Gly у положенні 2; Leu або Val у положенні 4; Leu, Ile, Met або Val у положенні 20; Cys у положенні 22; Thr, Ala, Val, Gly або Ser у положенні 24; Gly у положенні 26; Ile, Phe, Leu або Ser у положенні 29; Trp у положенні 36; Trp або Tyr у положенні 47; Ile, Met, Val або Leu у положенні 48; Ile, Leu, Phe, Met або Val у положенні 69; Val, Ala або Leu у положенні 71; Ala, Leu, Val, Tyr або Phe у положенні 78; Leu або Met у положенні 80; Tyr або Phe у положенні 90; Cys у положенні 92; та/або Arg, Lys, Gly, Ser, His або Asn у положенні 94. Легкий ланцюг: Ile, Leu або Val у положенні 2; Val, Gln, Leu або Glu у положенні 3; Met або Leu у положенні 4; Cys у положенні 23; Trp у положенні 35; Tyr, Leu або Phe у положенні 36; Leu, Arg або Val у положенні 46; Tyr, His, Phe або Lys у положенні 49; Tyr або Phe у положенні 71; Cys у положенні 88; та/або Phe у положенні 98. У окремому втіленні, каркас важкого ланцюга містить наступні залишки: Val у положенні 2, Leu у положенні 4, Val у положенні 20, Cys у положенні 22, Ala у положенні 24, Gly у положенні 26, Phe у положенні 29, Trp у положенні 36, Trp у положенні 47, Met у положенні 48, Ile у положенні 69, Ala у положенні 71, Ala у положенні 78, Met у положенні 80, Tyr у положенні 90, Cys у положенні 92 та Arg у положенні 94; та каркас легкого ланцюга містить наступні залишки: Ile у положенні 2, Gln у положенні 3, Met у положенні 4, Cys у положенні 23, Trp у положенні 35, Tyr у положенні 36, Leu у положенні 46, His у положенні 49, Phe у положенні 71, Cys у положенні 88 та Phe у положенні 98. Будь-яке положення, будь-яка комбінація або всі з описаних вище каркасних положень може бути присутніми у антиген - зв'язуючому білку винаходу. Можуть існувати багато варіантів каркасних канонічних положень для змінного регіону важкого або легкого ланцюга, для важкого або легкого ланцюга та для антиген - зв'язуючого білка, отже будь-які комбінації можуть бути присутніми у антиген - зв'язуючому білку винаходу за умовах збереження канонічної структури каркасу. Гуманізований змінний домен важкого ланцюга може містити CDR, перелічені у SEQ ID NO:1-3; варіантні CDR; відповідні CDR у SEQ ID NO:7; одиниці зв'язування або їх варіанти у каркасі акцепторного антитіла, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності у каркасних регіонах до послідовності змінного акцепторного домену людини у SEQ ID NO:25. Гуманізований змінний домен легкого ланцюга може містити CDR, перелічені у SEQ ID NO:4-6; варіантні CDR; відповідні CDR у SEQ ID NO:9; одиниці зв'язування або їх варіанти у каркасі акцепторного антитіла, що мають 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності у каркасних регіонах до послідовності змінного домену акцептора людини у SEQ ID NO:32. Гуманізований змінний домен важкого ланцюга може містити CDR, перелічені у SEQ ID NO:11-13; варіантні CDR; відповідні CDR у SEQ ID NO:17; одиниці зв'язування або їх варіанти у каркасі акцепторного антитіла, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності у каркасних регіонах до послідовності змінного домену акцептора людини у SEQ ID NO:25. Гуманізований змінний домен легкого ланцюга може містити CDR, перелічені у SEQ ID NO:1416; варіантні CDR; відповідні CDR у SEQ ID NO:19; одиниці зв'язування або їх варіанти у каркасі акцепторного антитіла, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності у каркасних регіонах до послідовності змінного домену акцептора людини у SEQ ID NO:32. Винаходом також передбачено антиген - зв'язуючі білки, що специфічно зв'язуються з SAP та містять змінний регіон важкого ланцюга, вибраний від будь-якої однієї з SEQ ID NO:27-31. Антиген - зв'язуючий білок може містити змінний регіон легкого ланцюга, вибраний від будь-якої однієї з SEQ ID NO:34-36. Будь-який зі змінних регіонів важкого ланцюга може бути об'єднаним з будь-яким зі змінних регіонів легкого ланцюга. Антиген - зв'язуючий білок може містити будь-яку одну з наступних комбінацій змінного регіону важкого та легкого ланцюга: H0L0 (SEQ ID NO:27 та SEQ ID NO:34), H0L1 (SEQ ID NO:27 13 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 та SEQ ID NO:35), H0L2 (SEQ ID NO:27 та SEQ ID NO:36), H1L0 (SEQ ID NO:28 та SEQ ID NO:34), H1L1 (SEQ ID NO:28 та SEQ ID NO:35), H1L2 (SEQ ID NO:28 та SEQ ID NO:36), H2L0 (SEQ ID NO:29 та SEQ ID NO:34), H2L1 (SEQ ID NO:29 та SEQ ID NO:35), H2L2 (SEQ ID NO:29 та SEQ ID NO:36), H3L0 (SEQ ID NO:30 та SEQ ID NO:34), H3L1 (SEQ ID NO:30 та SEQ ID NO:35), H3L2 (SEQ ID NO:30 та SEQ ID NO:36), H4L0 (SEQ ID NO:31 та SEQ ID NO:34), H4L1 (SEQ ID NO:31 та SEQ ID NO:35), або H4L2 (SEQ ID NO:31 та SEQ ID NO:36). Винаходом також передбачено антиген - зв'язуючий білок, що специфічно зв'язується з SAP та містить змінний регіон важкого ланцюга, вибраний від будь-якої однієї з SEQ ID NO:37-40. Антиген - зв'язуючий білок може містити змінний регіон легкого ланцюга SEQ ID NO:41, SEQ ID NO:42 або SEQ ID NO:74. Будь-які змінні регіони важкого ланцюга можуть бути об'єднані з будьякими змінними регіонами легкого ланцюга. Антиген - зв'язуючий білок може містити будь-яку одну з наступних комбінацій змінного регіону важкого та легкого ланцюга: H0L0 (SEQ ID NO:37 та SEQ ID NO:41), H0L1 (SEQ ID NO:37 та SEQ ID NO:42), H1L0 (SEQ ID NO:38 та SEQ ID NO:41), H1L1 (SEQ ID NO:38 та SEQ ID NO:42), H2L0 (SEQ ID NO:39 та SEQ ID NO:41), H2L1 (SEQ ID NO:39 та SEQ ID NO:42), H3L0 (SEQ ID NO:40 та SEQ ID NO:41), або H3L1 (SEQ ID NO:40 та SEQ ID NO:42). L0 (SEQ ID NO:41) може бути заміщений на L0 91 (SEQ ID NO:74). Змінний регіон важкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності до SEQ ID NO:28. Змінний регіон легкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше, або 100 % тотожності до SEQ ID NO:35. Змінний регіон важкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності до SEQ ID NO:40. Змінний регіон легкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше, або 100 % тотожності до SEQ ID NO:41. Змінний регіон легкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше, або 100 % тотожності до SEQ ID NO:74. Змінний регіон важкого ланцюга антитіла може бути варіантом будь-якої однієї з послідовностей SEQ ID NO:27-31, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Змінний регіон легкого ланцюга антитіла може бути варіантом будь-якої однієї з послідовностей SEQ ID NO:34-36, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Змінний регіон важкого ланцюга антитіла може бути варіантом будь-якої однієї з послідовностей SEQ ID NO:37-40, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Змінний регіон легкого ланцюга антитіла може бути варіантом SEQ ID NO:41, 42 або 74, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Наприклад, канонічні CDR та канонічні каркасні залишкові заміщення, описані вище також можуть бути присутніми у варіантних змінних регіонах важкого або легкого ланцюга у вигляді варіантних послідовностей, що мають принаймні 75 % ідентичності або містять до 30 амінокислотних заміщень. Будь-які змінні регіони важкого ланцюга можуть бути об'єднані з прийнятним сталим регіоном людини. Будь-які змінні регіони легкого ланцюга можуть бути об'єднані з прийнятним сталим регіоном. Антиген - зв'язуючий білок винаходу може містити важкий ланцюг SEQ ID NO:62 та/або змінний регіон легкого ланцюга SEQ ID NO:64. Важкий ланцюг антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності до SEQ ID NO:62. Легкий ланцюг антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 96 % або більше, 97 % або більше, 98 % або більше, 99 % або більше, або 100 % тотожності до SEQ ID NO:64. Важкий ланцюг антитіла може бути варіантом будь-якої однієї з послідовностей SEQ ID NO:62, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Легкий ланцюг антитіла може бути варіантом будь-якої однієї з послідовностей SEQ ID NO:64, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, 14 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 вставку або делецію. Дископодібна молекула SAP має дві сторони. Одинична альфа - спіраль, присутня у кожному з 5 протомерів розміщена на стороні А. Залежна від кальцію кишеня зв'язування ліганду кожного протомеру розташована на стороні B та ця сторона, отже, закупорюється, коли SAP зв'язаний з амілоїдним волокном. Для того, щоб антиген - зв'язуючі білки заявленого винаходу мали терапевтичну корисність, бажано, щоб епітоп, якого впізнає описаний антиген зв'язуючий білок, був досяжним у SAP, якщо SAP є зв'язаним з амілоїдними накопичуваннями та, отже, щоб він був розміщений у молекулі SAP або на її кінцях. Потім антиген - зв'язуючий білок може впізнати та зв'язатися з SAP, пов'язаним з амілоїдом, що веде до активування комплементу, що викликає у тілі ефективний, залежний від макрофагів механізм очищення. Відповідно, у одному втіленні винаходу антиген - зв'язуючий білок зв'язує пов'язаний до амілоїдних фібрил in vivo SAP людини. У іншому втіленні винаходу, антиген - зв'язуючий білок зв'язується до сторони А SAP людини. Антиген - зв'язуючий білок може походити від щурів, мишей, кролів, верблюдів (або відповідних видів верблюдових тварин) або приматів (наприклад, від макаки - крабоїда, представників родини мавпових, людиноподібних мавп або людини). У окремому втіленні, антиген - зв'язуючий білок має мишаче походження. У іншому втіленні, антиген - зв'язуючий білок має людське походження. Антиген - зв'язуючий білок може бути гуманізованим або химерним антитілом. Антиген - зв'язуючий білок може бути антитілом людини. Антиген зв'язуючий білок не є мишачим антитілом. Антиген - зв'язуючий білок може містити сталий регіон, що може належати до будь-якого ізотипу або субкласу. Сталий регіон може бути IgG ізотипом, наприклад, IgG1, IgG2, IgG3, IgG4 або їх варіантами. Сталий регіон антиген - зв'язуючого білка може бути IgG1. У окремому втіленні винаходу, антиген - зв'язуючий білок містить сталий регіон, який є функціональним у активуванні комплементу, наприклад, IgG1, IgG2 або IgG3 людини. У іншому втіленні винаходу, антиген - зв'язуючий білок містить сталий регіон, який є функціональним у зв'язуванні макрофагів, наприклад, IgG1 або IgG3 людини. У подальшому втіленні винаходу, антиген - зв'язуючий білок містить сталий регіон, який є функціональним у активуванні комплементу та у зв'язуванні макрофагів наприклад, IgG1 або IgG3 людини. Антиген - зв'язуючий білок може містити одну або більше модифікацій, вибраних від мутованого сталого домену таким чином, що антитіло має змінені ефекторні функції s/ADCC та/або активування комплементу. Приклади прийнятних модифікацій описані у Shields et al. J. Biol. Chem (2001) 276: 6591-6604, Lazar et al. PNAS (2006) 103: 4005-4010 та US6737056, WO2004063351 та WO2004029207. Антиген - зв'язуючий білок може містити сталий домен зі зміненим профілем глюкозилування таким чином, що антиген - зв'язуючий білок має змінені ефекторні функції/ADCC та/або активування комплементу. Приклади прийнятних методологій отримання антиген - зв'язуючого білка зі зміненим профілем глюкозилування описані у WO2003/011878, WO2006/014679 та EP1229125. У втіленні винаходу, вибрано антиген - зв'язуючі білки, що не мають сприйнятливих до дезамідування залишків у регіонах, що розпізнаються для зв'язування антигену, наприклад CDR. У додатковому втіленні винаходу, вибрано антиген - зв'язуючі білки, що не мають сприйнятливих до дезамідування залишків у регіонах, що розпізнаються для активування комплементу. Заявлений винахід також стосується молекули нуклеїнової кислоти, що кодує описаний тут антиген - зв'язуючий білок. Молекула нуклеїнової кислоти може містити послідовності, що кодують змінну або повнорозмірну послідовність важкого ланцюга та змінну або повнорозмірну послідовність легкого ланцюга. Альтернативно, молекула нуклеїнової кислоти, що кодує описаний тут антиген - зв'язуючий білок може містити послідовності, що кодують змінну або повнорозмірну послідовність важкого ланцюга або змінну або повнорозмірну послідовність легкого ланцюга. Молекула нуклеїнової кислоти, що кодує змінний регіон важкого ланцюга може містити будьяку одну з послідовностей SEQ ID NO:51 або 53-57. Молекула нуклеїнової кислоти, що кодує змінний регіон легкого ланцюга може містити будь-яку одну з послідовностей SEQ ID NO:52 або 58-60. Молекула нуклеїнової кислоти, що кодує важкий ланцюг може містити послідовність SEQ ID NO:61. Молекула нуклеїнової кислоти, що кодує легкий ланцюг може містити послідовність SEQ ID NO:63. Молекула нуклеїнової кислоти, що кодує змінний регіон важкого ланцюга може містити будь 15 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 яку одну з послідовностей SEQ ID NO:65 або 67-70. Молекула нуклеїнової кислоти, що кодує змінний регіон легкого ланцюга може містити будь-яку одну з послідовностей SEQ ID NO:66 або 71-73. Молекула нуклеїнової кислоти також може містити одне або більше нуклеотидних заміщень, що не змінюють амінокислотну послідовність закодованого важкого та/або легкого ланцюга. Заявлений винахід також стосується вектора експресії, що містить молекулу нуклеїнової кислоти, як тут описано. Також передбачено рекомбінантну клітину - хазяїна, що містить вектор експресії, як тут описано. Описаний тут антиген - зв'язуючий білок можна отримати у прийнятній клітині – хазяїні. Спосіб отримання описаного тут антиген - зв'язуючого білка може містити етап культивування клітини - хазяїна та відновлення антиген - зв'язуючого білка. Рекомбінантна трансформована, трансфікована або трансдукована клітина - хазяїн може містити принаймні одну експресійну касету, де вказана експресійна касета містить полінуклеотид, що кодує важкий ланцюг описаного тут антиген - зв'язуючого білка та додатково містить полінуклеотид, що кодує легкий ланцюг описаного тут антиген - зв'язуючого білка. Альтернативно, рекомбінантна трансформована, трансфікована або трансдукована клітина - хазяїн може містити принаймні одну експресійну касету, де вказана експресійна касета містить полінуклеотид, що кодує важкий ланцюг описаного тут антиген - зв'язуючого білка та додатково містить іншу касету, що містить полінуклеотид, що кодує легкий ланцюг описаного тут антиген - зв'язуючого білка. Стабільно трансформована клітина - хазяїн може містити вектор, що містить одну або більше експресійних касет, що кодує важкий ланцюг та/або легкий ланцюг описаного тут антиген - зв'язуючого білка. Наприклад, така клітина - хазяїн може містити перший вектор, що кодує легкий ланцюг та другий вектор, що кодує важкий ланцюг. Клітина - хазяїн може бути еукаріотичною, наприклад, клітиною ссавців. Приклади таких клітинних ліній охоплюють клітини CHO або NS0. Клітину - хазяїна можна культивувати у культуральному середовищі, наприклад, у вільному від сироватки культуральному середовищі. Антиген - зв'язуючий білок може вивільнятися з клітини – хазяїна у культуральне середовище. Антиген - зв'язуючий білок можна очистити до принаймні 95 % або більше (наприклад, 98 % або більше) відносно вказаного культурального середовища, що містить антиген - зв'язуючий білок. Також може бути надана фармацевтична композиція, що містить антиген - зв'язуючий білок та фармацевтично прийнятний носій. Передбачено набор, що містить фармацевтичну композицію разом з інструкціями по застосуванню. Для зручності, набор може містити реагенти у заздалегідь визначених кількостях з інструкціями по їх застосуванню. Легкі ланцюги антитіл від більшості видів хребетних можуть бути віднесені до одного з двох типів, що мають назви Каппа та Лямбда на основі амінокислотної послідовності сталого регіону. В залежності від амінокислотної послідовності сталого регіону своїх важких ланцюгів, антитіла людини можна розподілити на 5 різних класів, IgA, IgD, IgE, IgG та IgM. IgG та IgA можна, в свою чергу, розділити на субкласи IgG1, IgG2, IgG3 та IgG4; та IgA1 та IgA2. Щурячі та мишачі варіанти видів мають принаймні IgG2a, IgG2b. Найбільш консервативні частини змінного регіону мають назву каркасних регіонів (FR). Кожен зі змінних доменів інтактних важкого та легкого ланцюгів містить чотири FR, об'єднаних трьома CDR. CDR у кожному ланцюзі скріплені FR регіонами у безпосередній близькості та разом з CDR від інших ланцюгів сприяють утворенню сайту зв'язування антигену у антитілі. Сталі регіони безпосередньо не беруть участі у зв'язуванні антитіла з антигеном але проявляють різні ефекторні функції, як-то приймають участь у залежній від антитіл клітинноопосередкованій цитотоксичності (ADCC), у фагоцитозі через зв'язування з Fcγ рецептором, впливають на співвідношення часу напівжиття/очищення через неонатальний Fc рецептор (FcRn) та у активуванні комплементу через C1q компонент, що веде до хемотаксичної, опсонічної та, теоретично, у випадку життєздатного клітинного цільового антигену, до цитолітичної дії комплементу. Антитіла людини класу IgG1 є найбільш впливовими у активуванні системи комплементу, отже, є бажаним ізотипом терапевтичного застосування антитіл заявленого винаходу. Сталий регіон IgG2 людини, як повідомляють, по суті позбавлений можливості активування комплементу класичним шляхом або до опосередкування залежної від антитіл клітинної цитотоксичності. Сталий регіон IgG2, як повідомляють, позбавлений можливості активування комплементу класичним шляхом та лише слабо опосередковує залежну від антитіл клітинну цитотоксичність. Антитіла, що істотно позбавлені цих ефекторних функцій можуть бути віднесені до "не - літичних" антитіл. Антитіла людини можна отримати за допомогою ряду відомих фахівцям способів. Антитіла можна отримати за допомогою гібридомного способу з застосуванням клітинних ліній мієломи 16 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 людини або мишачих - людинних клітинних ліній гетеромієломи, див. Kozbor (1984) J. Immunol 133, 3001, and Brodeur, Monoclonal Antibody Production Techniques and Applications, 51-63 (Marcel Dekker Inc, 1987). Альтернативні способи полягають у застосуванні фагових бібліотек або трансгенних мишей, де у обох підходах застосовують набори змінного регіону людини (див. Winter (1994) Annu. Rev. Immunol 12: 433-455; Green (1999) J. Immunol. Methods 231: 11-23). Зараз у наявності є деякі лінії трансгенних мишей, де їх мишачий імуноглобуловий локус заміщено сегментами гена імуноглобуліну людини (див. Tomizuka (2000) PNAS 97: 722-727; Fishwild (1996) Nature Biotechnol. 14: 845-851; Mendez (1997) Nature Genetics, 15: 146-156). При антигенному інфікуванні такі миші здатні продукувати набор антитіл людини, з якого можна вилучити інтересуючи антитіла. Для отримання антиген - зв'язуючих білків людини (та їх фрагментів) також можна застосувати фаг-дисплейну технологію див. McCafferty (1990) Nature 348: 552-553 та Griffiths et al. (1994) EMBO 13: 3245-3260. Спосіб афінного насичення (Marks Bio/technol (1992) 10: 779-783) можна застосувати для посилення афінності зв'язування, де афінність первинного антитіла людини поліпшують за допомогою послідовного заміщення змінних регіонів важкого (H) та легкого (L) ланцюгів з варіантів, що зустрічаються в природі на основі поліпшення афінностей зв'язування. Зараз також існують варіанти цього способу, як-то “ імпринтинг епітопу ”, див. наприклад, WO 93/06213; Waterhouse (1993) Nucl. Acids Res. 21: 2265-2266. Химерні антитіла звичайно отримують за допомогою способів рекомбінантної ДНК. ДНК, що кодує антитіла (наприклад кДНК) виділяють та секвенують з застосуванням загальноприйнятних процедур (наприклад, олігонуклеотидних зондів, що здатні до специфічного зв'язування з генами, що кодують H та L ланцюги антитіла. Типовими джерелами для отримання такої ДНК є клітини гібридоми. Після виділення, ДНК розташовують у вектори експресії, що потім трансфікують у клітини - хазяї, як-то клітини E. coli, COS, CHO або у клітини мієломи, що не спроможні іншим чином виробляти імуноглобуліновий білок для отримання синтезу антитіла. ДНК також можна модифікувати шляхом заміщення кодуючої послідовності L та H ланцюгів людини на відповідні H та L сталі регіони не - людинного походження (наприклад, мишачі), див., наприклад, Morrison (1984) PNAS 81: 6851. Сильного зниження імуногенності можна досягти шляхом щеплення лише CDR не людинного походження (наприклад, мишачого) антитіла ("донорного" антитіла) до каркасного ("акцепторний каркасний регіон") та сталого регіонів людини для отримання гуманізованих антитіл (див. Jones et al. (1986) Nature 321: 522-525; та Verhoeyen et al. (1988) Science 239: 15341536). Проте, саме по собі щеплення CDR може не привести до повного збереження антиген зв'язувальних властивостей та часто трапляється, що деякі каркасні залишки (іноді позначені, як "бічні мутації") донорного антитіла повинні бути збережені у гуманізованій молекулі, якщо треба відновити значну антиген - зв'язувальну афінність (див. Queen et al. (1989) PNAS 86: 10,029-10,033: Co et al. (1991) Nature 351: 501-502). У цьому разі, змінні регіони людини показують більшу гомологічність послідовності до донорного антитіла не - людинного походження, вибраного від баз даних з метою забезпечення людського каркасного регіону (FR). Відбір людських FR можна проводити або від консенсусних або від індивідуальних антитіл людини. При необхідності, ключові залишки донорного антитіла можна замінити на акцепторний каркас людини для збереження конформацій CDR. Для допомоги у ідентифікуванні подібних структурно важливих залишків можна застосувати комп'ютерне моделювання антитіл, див. WO 99/48523. Альтернативно, можна досягти гуманізації за допомогою способу "облицювання". Статистичний аналіз унікальних змінних регіонів людського та мишачого імуноглобулінового важкого та легкого ланцюгів показав, що точні моделі підданих впливу залишків у людських та у мишачих антитілах є різними та однак більшість індивідуальних поверхневих положень мають сильну перевагу над невеликою кількістю різних залишків (див. Padlan et al. (1991) Mol. Immunol. 28: 489-498; та Pedersen et al. (1994) J. Mol. Biol. 235: 959-973). Отже, можливо зменшити імуногенність Fv нелюдинного походження шляхом заміщення залишків, що піддані впливу у своїх каркасних регіонах, що відрізняються від тих, що звичайно знаходять в антитілах людини. Оскільки антигенність білка може корелюватися з поверхневою доступністю, заміщення поверхневих залишків може бути достатнім для надання мишачому змінному регіону "невидимості" для імунної системи людини (див. також Mark et al. (1994) in Handbook of Experimental Pharmacology Vol. 113: The pharmacology of Monoclonal Antibodies, Springer-Verlag, 105-134). Процедура гуманізації названа "облицюванням" тому, що під час її проведення змінюють тільки поверхню антитіла, а підтримуючі залишки залишають недоторканими. Додаткові альтернативні підходи охоплюють наведені у WO04/006955 та процедуру 17 UA 108227 C2 TM 5 10 15 20 25 30 35 40 45 50 55 60 Humaneering (Kalobios), де застосовують системи бактеріальної експресії та отримують антитіла, що близькі у послідовності до людської ембріональної лінії (Alfenito-M Advancing Protein Therapeutics January 2007, San Diego, California). Біспецифічний антиген - зв'язуючий білок є антиген - зв'язуючим білком, що має зв'язувальні специфічності для щонайменш двох різних епітопів. Способи отримання таких антиген зв'язуючих білків добре відомі фахівцям. Звичайно, рекомбінантне отримання біспецифічних антиген - зв'язуючих білків базується на спільній експресії двох імуноглобулінових пар типу H ланцюг- L ланцюг, де два H - ланцюга мають різні специфічності зв'язування, див. Millstein et al. (1983) Nature 305: 537-539; WO 93/08829; та Traunecker et al. (1991) EMBO 10: 3655-3659. Через випадковий асортимент H та L ланцюгів, отримують потенційну суміш десяти різних структур антитіл, з яких тільки одна має бажану специфічність зв'язування. Альтернативний підхід полягає у злитті змінних доменів з бажаними специфічностями зв'язування до сталого регіону важкого ланцюга, що містить щонайменш частину шарнірного регіону та CH2 та CH3 регіони. CH1 регіон, що містить сайт, необхідний для зв'язування легкого ланцюга може бути присутнім у щонайменш одному злитті. ДНК, що кодує ці злиття, та, якщо це бажано, L - ланцюг, вставляють у окремі вектори експресі та потім спів - трансфікують у організм хазяїна. Втім, не виключена вставка кодуючих послідовностей для двох або всіх трьох ланцюгів у один вектор експресії. У одному підході, біспецифічне антитіло складається з H - ланцюга з однією специфічністю зв'язування та з H-L ланцюгової пари, що забезпечують другу специфічність зв'язування, див. WO 94/04690. Також див. Suresh et al. (1986) Methods in Enzymology 121: 210. Фрагменти, позбавлені сталого регіону втрачають здатність до активування комплементу класичним шляхом або до опосередковування залежної від антитіла клітинної цитотоксичності. Звичайно, такі фрагменти отримують протеолітичним розщепленням інтактних антитіл, наприклад, папаїновим розщепленням (див. наприклад, WO 94/29348), але їх також можна безпосередньо отримати від рекомбінантно трансформованих клітин - хазяїв. Стосовно отримання ScFv, див. Bird et al. (1988) Science 242: 423-426. На додачу, антиген - зв'язувальні фрагменти можна отримати з застосуванням ряду інженерних способів, як-то описані нижче. Fv фрагменти, по всій видимості, мають нижчу енергію взаємодії їх двох ланцюгів, ніж Fab фрагменти. Для стабілізування асоціації доменів VH та VL, їх зв'язують з пептидами (Bird et al. (1988) Science 242: 423-426; Huston et al. (1988) PNAS 85(16): 5879-5883), дисульфідними містками (Glockshuber et al. (1990) Biochemistry 29: 1362-1367) та мутаціями типу "виступ в отворі" (Zhu et al. (1997) Protein Sci., 6: 781-788). ScFv фрагменти можна отриматиза допомогою добре відомих фахівцям способів, див. Whitlow et al. (1991) Methods Companion Methods Enzymol, 2: 97-105 and Huston et al. (1993) Int. Rev. Immunol 10: 195-217. ScFv можна отримати у бактеріальних клітинах, як-то E. coli або у еукаріотичних клітинах. Одним з недоліків ScFv є моновалентність продукту, що виключає поліпшену авидність завдяки полівалентному зв'язуванню та короткий час напівжиття. Спроби подолати ці проблеми охоплюють бівалент (ScFv')2, отриманий хімічним зчепленням від ScFv, що містить додатковий C-термінальний цистеїн (Adams et al. (1993) Can. Res 53: 4026-4034; and McCartney et al. (1995) Protein Eng. 8: 301-314) або спонтанну димеризацію ScFv, що містить неспарений Cтермінальний цистеїновий залишок (див. Kipriyanov et al. (1995) Cell. Biophys 26: 187-204). Альтернативно, ScFv може бути примушений до утворення мультимерів шляхом скорочення пептидного лінкеру до 3-12 залишків з утворенням "діатіл", див. Holliger et al. (1993) PNAS 90: 6444-6448. Скорочений лінкер також додатково може привести до отримання тримерів ScFv ("тріатіл", див. Kortt et al. (1997) Protein Eng 10: 423-433) та тетрамерів ("тетратіл", див. Le Gall et al. (1999) FEBS Lett, 453: 164-168). Конструювання бівалентних ScFv молекул також може бути досягнуто за допомогою генетичного злиття з білковими димеризуючими характерними послідовностями з утворенням "міні - антитіл" (див. Pack et al. (1992) Biochemistry 31: 1579-1584) та "мінітіл" (див. Hu et al. (1996) Cancer Res. 56: 3055-3061). Тандеми ScFv-Sc-Fv ((ScFV)2) також можна отримати за допомогою з'єднання двох ScFv одиниць третім пептидним лінкером, див. Kurucz et al. (1995) J. Immol. 154: 4576-4582. Біспецифічні діатіла можна отримати шляхом нековалентної асоціації двох одноланцюгових продуктів злиття, що складаються з VH домену від одного антитіла, приєднаних коротким лінкером до VL домену іншого антитіла, див. Kipriyanov et al. (1998) Int. J. Can 77: 763-772. Стабільність таких біспецифічних діатіл можна підсилити введенням дисульфідних містків або мутацій типу "виступ в отворі" як описано вище або утворенням діатіл з одиничним ланцюгом (ScDb), де два гібридних фрагмента ScFv зв'язані пептидним лінкером, див. Kontermann et al. (1999) J. Immunol. Methods 226:179-188. Тетравалентні біспецифічні молекули можна отримати, наприклад, злиттям фрагмента ScFv з доменом CH3 молекули IgG або з фрагментом Fab через шарнірний регіон, див. Coloma et al. (1997) Nature Biotechnol. 15: 159-163. Альтернативно, тетравалентні біспецифічні молекули 18 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 можна отримати злиттям біспецифічних одноланцюгових діатіл, див. Alt et al. (1999) FEBS Lett 454: 90-94. Менші тетравалентні біспецифічні молекули можна також отримати димеризацією або тандемів ScFv-ScFv з лінкером, що містить характерну послідовність "спіраль-петляспіраль" (DiBi міні- антитіла, див. Muller et al. (1998) FEBS Lett 432: 45-49) або одноланцюгової молекули, що містить чотири змінних домена антитіл (VH та VL) у орієнтації, що запобігає внутрішньомолекулярному паруванню (тандемне діатіло, див. Kipriyanov et al. (1999) J. Mol. Biol. 293: 41-56). Біспецифічні фрагменти F(ab')2 можна отримати хімічним з'єднанням фрагментів Fab' або гетеродимерізацією за допомогою лейцинових застібок (див. Shalaby et al. (1992) J. Exp. Med. 175: 217-225; та Kostelny et al. (1992), J. Immunol. 148: 1547-1553). Також прийнятними є виділені VH та VL домени (Domantis plc), див. US 6,248,516; US 6,291,158; та US 6,172,197. Гетерокон'югатні антитіла складаються з двох ковалентно зв'язаних антитіл, отриманих з застосуванням будь-якого прийнятного способу перехрестного з'єднання. Див., наприклад, US 4,676,980. Антиген - зв'язуючі білки заявленого винаходу можуть містити інші модифікації для посилення або змінення їх ефекторних функцій. Вважається, що взаємодія між Fc регіоном антитіла та різними Fc рецепторами (FcγR) опосередковує ефекторні функції антитіла, що охоплюють залежну від антитіла клітинну цитотоксичність (ADCC), фіксування комплементу, фагоцитоз та час напівжиття/виведення антитіла. В залежності від бажаних властивостей, можуть бути проведені різні модифікації Fc регіону антитіл. Наприклад, специфічні мутації у Fc регіоні надают антитілу іншу літичність, не-літичність, що детально описано у EP 0629240 та EP 0307434 або можна ввести у склад антитіла епітоп, що зв'язується з "рецептором порятунку" (salvage receptor) у антитілі для збільшення сироваткового часу напівжиття, див. US 5,739,277. Fcγ рецептори людини, в тому числі FcγR (I), FcγRIIa, FcγRIIb, FcγRIIIa та неонатальний FcRn. Shields et al. (2001) J. Biol. Chem 276: 6591-6604 демонструють, що загальний набор залишків IgG1 причетний до зв'язування всіх FcγR, в той час, як FcγRII та FcγRIII застосовують віддалені сайти за межами цього загального набору. Одна група залишків IgG1 знижує зв'язування до всіх FcγR, коли Pro-238, Asp-265, Asp-270, Asn-297 та Pro-239 замінюють аланіном. Всі вони знаходяться у домені IgG CH2 та кластеризовані поруч з шарнірним з'єднанням CH1 та CH2. В той час, як FcγRI застосовує тільки загальний набор залишків IgG1 для зв'язування, FcγRII та FcγRIII взаємодіють з віддаленими залишками на додачу до загального набору. Змінення деяких залишків знижує зв'язування тільки до FcγRII (наприклад Arg-292) або до FcγRIII (наприклад Glu-293). Деякі варіанти демонструють поліпшення зв'язування до FcγRII або FcγRIII але не впливають на зв'язування до іншого рецептора (наприклад, Ser-267Ala поліпшує зв'язування до FcγRII але не впливає на зв'язування до FcγRIII). Інші варіанти демонструють поліпшення зв'язування до FcγRII або FcγRIII зі зменшенням зв'язування до іншого рецептора (наприклад, Ser-298Ala поліпшує зв'язування до FcγRIII та знижує зв'язування до FcγRII). Для FcγRIIIa, найкращі варіанти зв'язування IgG1 мають об'єднані аланінові заміщення у Ser-298, Glu-333 та Lys-334. Вважається, що неонатальний рецептор FcRn бере участь у кліренсі антитіл та у трансцитозі через тканини (див. Junghans (1997) Immunol. Res 16: 29-57; та Ghetie et al. (2000) Annu. Rev. Immunol. 18: 739-766). Визначено, що залишки IgG1 людини безпосередньо взаємодіють з FcRn людини, в тому числі Ile253, Ser254, Lys288, Thr307, Gln311, Asn434 та His435. Заміщення у будь-якому з описаних у цьому розділі положень може дозволити збільшити сироватковий час напівжиття та/або змінити ефекторні властивості антитіла. Інші модифікації охоплюють варіанти глюкозилування антитіл. Глюкозилування антитіл у консервативних положення їх сталих регіонів, як відомо, сильно впливає на функцію антитіл, особливо на ефекторне функціонування, як-то описане вище, див., наприклад, Boyd et al. (1996) Mol. Immunol. 32: 1311-1318. Передбачені варіанти глюкозилування антитіл або їх антиген зв'язувальних фрагментів, де одна або декілька вуглеводних більше груп є доданою, заміщеною, вилученою або зміненою. Введення характерної послідовності аспарагін-X-серин або аспарагін-X-треонін створює потенційний сайт ензиматичного прикріплення вуглеводних груп та, отже, може бути застосованою для маніпулювання глюкозилуванням антитіла. У Raju et al. (2001) Biochemistry 40: 8868-8876 вказано про збільшення термінального сіалування TNFRIgG імуноадгезину за допомогою процесу регалактозилування та/або ресіалування з застосуванням бета-1,4- галактозилтрансферази та/або альфа, 2,3 сіалілтрансферази. Вважається, що збільшення термінального сіалування веде до збільшення часу напівжиття імуноглобуліну. Антитіла, як і більшість глікобілків, звичайно отримують у вигляді суміші глікоформ. Ця суміш є особливо наявною при продукуванні антитіл еукаріотичними клітинами, особливо клітинами ссавців. Для виробництва визначених глікоформ розроблено ряд способів, див. Zhang et al. (2004) Science 303: 371: Sears et al. (2001) Science 291: 2344; Wacker et al. (2002) Science 298: 1790; Davis et al. (2002) Chem. Rev. 102: 579; Hang et al. (2001) Acc. Chem. 19 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Res 34: 727. Описані тут антитіла (наприклад, ізотипу IgG, наприклад IgG1) можуть містити визначену кількість (наприклад, 7 або менше, наприклад, 5 або менше, наприклад, 2 або 1) глікоформ. Антитіла можна прикріпити до небілкового полімеру, як-то поліетиленгліколь (ПЕГ), pполіпропіленгліколь або поліоксиалкілен. Приєднання білків до ПЕГ є визнаним способом збільшення часу напівжиття білків, а також зменшення антигенності та імуногенності білків. Застосування ПЕГілування з різною молекулярною вагою та різного виду (лінійного або розгалуженого) досліджено на інтактних антитілах, а також на Fab' фрагментах, див. Koumenis et al. (2000) Int. J. Pharmaceut. 198: 83-95. Антиген - зв'язуючі білки можна отримати у трансгенних організмах, наприклад, кіз (див. Pollock et al. (1999) J J. Immunol. Methods 231: 147-157), курчат (див. Morrow (2000) Genet. Eng. News 20: 1-55, мишей (див. Pollock et al.) або рослин (див. Doran (2000) Curr. Opinion Biotechnol. 11: 199-204; Ma (1998) Nat. Med. 4: 601-606; Baez et al. (2000) BioPharm 13: 50-54; Stoger et al. (2000) Plant Mol. Biol. 42: 583-590). Антиген - зв'язуючі білки також можна отримати за допомогою хімічного синтезу. Проте, звичайно антиген - зв'язуючі білки отримують з застосуванням добре відомих фахівцям способів культивування рекомбінантних клітин. Полінуклеотид, що кодує антиген - зв'язуючий білок виділяють та вставляють у здатний до реплікації вектор, наприклад, у плазміду, для додаткового клонування (ампліфікації) або експресії. Однією системою експресії є система глютамат-синтази (що, наприклад, можна придбати від Lonza Biologics), особливо, де клітина хазяїн є клітиною CHO або NS0. Полінуклеотид, що кодує антиген - зв'язуючий білок легко виділяють та секвенують з застосуванням загальноприйнятних процедур (наприклад, з застосуванням олігонуклеотидних зондів). Вектори, що можна застосувати охоплюють плазміди, віруси, фаги, транспозони, міні-хромосоми, але звичайно застосовують плазміди. Головним чином, такі вектори додатково містять сигнальну послідовність, точку початку реплікації, один або більше маркерних генів, підсилюючий елемент, промотор та послідовності термінації транскрипції, функціонально пов'язані з полінуклеотидом антиген - зв'язуючого білка для сприяння експресії. Полінуклеотид, що кодує легкий та важкий ланцюги можна вставити у окремі вектори та ввести (наприклад, шляхом трансформації, трансфекції, електропорації або трансдукції) до тієї ж клітині - хазяїна одночасно або послідовно або, якщо бажано, обидва важкий та легкий ланцюги можна вставити в той же вектор перед вказаним введенням. Для того, щоб загальний рівень білка, що продукується клітиною - хазяїном був більш високим при трансфікуванні з кодон-оптимізованим геном у порівнянні з рівнем при трансфікуванні з послідовності можна застосувати кодон - оптимізування. Кілька способів опубліковано у Nakamura et al. (1996) Nucleic Acids Research 24: 214-215; W098/34640; W097/11086). Через надлишковість генетичного коду, полінуклеотиди, що альтернативні наведеним тут (особливо, кодон-оптимізовані для експресії у вибраній клітині - хазяїні) також можуть кодувати описані тут антиген - зв'язуючі білки. Отже, частота застосування кодонів антиген - зв'язуючого білка даного винаходу може бути модифікована для налаштування застосування синонімічних кодонів в геномі клітини - хазяїна для збільшення виходу транскрипту та/або продукту (наприклад, Hoekema et al Mol Cell Biol 1987 7(8): 2914-24). Вибір кодонів може бути зроблений на основі прийнятної сумісності з застосованою для експресії клітиною - хазяїном. Антиген - зв'язуючі білки можна отримати у вигляді злитого (гібридного) білка з гетерологічною сигнальною послідовністю, що має специфічний сайт розщеплення на N-кінці зрілого білка. Сигнальна послідовність повинна впізнаватися клітиною - хазяїном та піддаватися процесингу у цій клітині. Для прокаріотичних клітин - хазяїв, сигнальні послідовності можуть бути, наприклад, лідерними послідовностями алкалін-фосфотази, пеніцилінази або термостійкого ентеротоксину II. Для дріжджової секреції, сигнальні послідовності можуть бути, наприклад, лідерними послідовностями дріжджової інвертази, α - фактора або кислої фосфатази, див., наприклад, WO90/13646. У системах клітин ссавців, можуть бути прийнятними вірусні секреторні лідери, як-то сигнальна послідовність gD вірусу герпесу та нативна імуноглобулінова сигнальна послідовність. Звичайно, сигнальну послідовність лігують у рамку зчитування ДНК, що кодує антиген - зв'язуючий білок. Також можна застосувати мишачу сигнальну послідовність, як-то наведену у SEQ ID NO: 79. Фахівцям добре відома точка початку реплікації pBR322, що є прийнятною для більшості грам-негативних бактерій, точка початку реплікації плазміди 2µ для більшості дріжджів та різні вірусні точки початку реплікації, як-то точки початку реплікації вірусів SV40, поліоми, аденовірусу, VSV або BPV для більшості клітин ссавців. Головним чином, компонент точки початку реплікації є непотрібним для векторів експресії у ссавцях, але можна застосувати 20 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 компонент SV40, оскільки він містить ранній промотор. Типові маркерні гени кодують білки, що (a) наділяють стійкістю до антибіотиків або інших токсинів, наприклад, до ампіциліну, неоміцину, тетрацикліну, метотрексату або (b) додають ауксотрофні нестачі або постачання поживних речовин, відсутніх у комплексі середовища або (c) комбінації обох варіантів. Схема відбору може також полягати у затримці зростання клітина хазяїна. Клітини, успішно трансформовані генами, що кодують антиген - зв'язуючий білок, здатні до виживання завдяки, наприклад, стійкості до лікарських препаратів, яку надає селективний маркер, що спільно постачається. Одним прикладом є селективний маркер DHFR (дигідрофолатредуктази), де трансформанти культивуються у присутності метотрексату. Клітини можна культивувати у присутності збільшених кількостей метотрексату для ампліфікації кількості копій екзогенного інтересуючого гена. Особливо прийнятною клітинною лінією для DHFR-селекції є клітини CHO. Додатковим прикладом є система експресії глютамат-синтази (Lonza Biologics). Прикладом селективного гена для застосування у дріжджах є ген trp1, див. Stinchcomb et al. (1979) Nature 282: 38. Прийнятні промотори для експресування антиген - зв'язуючих білків функціонально пов'язані з ДНК / полінуклеотидом, що кодує антиген - зв'язуючий білок. Промотори для прокаріотичних хазяїв охоплюють phoA промотор, промоторні системи бета-лактамази та лактози, алкалінфосфотази, триптофановий та гібридні промотори, як-то Tac. Промотори, прийнятні для експресії у клітинах дріжджів охоплюють 3-фосфогліцерат кіназу або інші гліколітичні ферменти, наприклад, енолазу, гліцеральдегід 3 фосфатдегідрогеназу, гексокіназу, піруватдекарбоксилазу, фосфофруктокіназу, глюкозо-6 фосфат ізомеразу, 3- фосфогліцерат мутазу та глюкокіназу. Індуцибельні промотори дріжджів охоплюють алкогольдегідрогеназу 2, ізоцитохром C, кислу фосфотазу, металотіонеїн та ферменти, що відповідають за метаболізм азоту або утилізацію мальтози/галактози. Промотори для експресії у системах клітин ссавців охоплюють вірусні промотори, як-то поліоми, курячої віспи та аденовірусів (наприклад, аденовірусу 2), вірусу папіломи корів, вірусу пташиної саркоми, цитомегаловірусу (зокрема, безпосередній ранній промотор гена), ретровірусу, вірусу гепатиту B, актину, промотор вірусу саркоми Рауса (RSV) та ранній або пізній промотори вірусу SV40. Зрозуміло, що вибір промотору базується на прийнятній сумісності з застосованою для експресії клітиною - хазяїном. Одна плазміда може містити промотор RSV та/або SV40 та/або CMV, ДНК, що кодує змінний регіон легкого ланцюга (VL), κC регіон разом з селективними маркерами стійкості до неоміцину та ампіциліну та друга плазміда може містити промотор RSV або SV40, ДНК, що кодує змінний регіон важкого ланцюга (VH), ДНК, що кодує сталий регіон γ1, маркери DHFR та стійкості до ампіциліну. У разі необхідності, наприклад, для експресії у вищих еукаріотах, можна застосувати підсилюючий елемент, функціонально пов'язаний у векторі з промоторним елементом. Підсилюючі послідовності ссавців охоплюють підсилюючі елементи глобіну, еластази, альбуміну, фетопротеїну та інсуліну. Альтернативно, також можна застосувати підсилюючі елементи від вірусів еукаріотичних клітин, як-то підсилювач SV40 (у 100-270 п. о.), підсилювач раннього промотору цитомегаловірусу, поліоми, бакуловірусний підсилювач або мишачий локус IgG2a (див. WO04/009823). Підсилювач можна розмістити у векторі у сайті вище промотору. Альтернативно, підсилювач можна розмістити будь-де, у нетрансльованому регіоні або нижче сигналів поліаденілування. Вибір та розташування підсилювача може базуватися на основі прийнятної сумісності з застосованим для експресії клітиною - хазяїном. У еукаріотичних системах, сигнали поліаденілування є функціонально зв'язаними з ДНК / полінуклеотидом, що кодує антиген - зв'язуючий білок. Такі сигнали звичайно розташовані на 3" кінці відкритої рамки зчитування. У системах ссавців, необмежені приклади охоплюють сигнали, що походять від гормонів зростання, фактора елонгації-1 альфа та від вірусних (наприклад, SV40) генів або ретровірусних довгих термінальних повторів. У системах дріжджів, необмежені приклади охоплюють сигнали, що походять від генів фосфогліцераткінази (PGK) та алкогольдегідрогенази 1 (ADH). У прокаріотичних системах, сигнали поліаденілування звичайно не потребуються та замість них звичайно застосовують більш короткі та більш визначені термінаторні послідовності. Вибір послідовності поліаденілування/термінації може базуватися на основі прийнятної сумісності з застосованою для експресії клітиною - хазяїном. На додачу до вищевказаного, інші елементи, які можна застосувати для посилення виходу продукту охоплюють елементи реконструювання хроматину, інтрони та специфічну для клітинхазяїв кодон - модифікацію. Клітини - хазяї, прийнятні для векторів клонування або експресії, що кодують антигензв'язуючі білки є прокаріотичними, дріжджовими клітинами або клітинами вищих еукаріот. Прийнятні прокаріотичні клітини охоплюють еубактерії, наприклад, enterobacteriaceae, 21 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, Escherichia, наприклад, E. coli (наприклад, ATCC 31,446; 31,537; 27,325), Enterobacter, Erwinia, Klebsiella Proteus, Salmonella, наприклад, Salmonella typhimurium, Serratia, наприклад, Serratia marcescans та Shigella, а також Bacilli, як-то B. subtilis та B. licheniformis (див. DD 266 710), Pseudomonas, як-то P. aeruginosa та Streptomyces. Клітини - хазяї дріжджів охоплюють Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces (наприклад, ATCC 16,045; 12,424; 24178; 56,500), Уarrowia (EP402, 226), Pichia pastoris (EP 183 070, див. також Peng et al. (2004) J. Biotechnol. 108: 185-192). Також прийнятними є клітини - хазяї Candida, Trichoderma reesia (EP 244 234), Penicillin, Tolypocladium та Aspergillus, як-то A. nidulans та A. Niger. Вищі еукаріотичні клітини - хазяї охоплюють клітини ссавців, як-то COS-1 (ATCC No.CRL 1650) COS-7 (ATCC CRL 1651), лінію ембріональних клітин нирки людини 293, клітини нирки новонародженого хом'яка (BHK) (ATCC CRL.1632), BHK570 (ATCC NO: CRL 10314), 293 (ATCC NO.CRL 1573), клітини яєчників китайського хом'яка CHO (наприклад, CHO-K1, ATCC NO: CCL 61, клітинну лінію DHFR-CHO, наприклад, DG44 (див. Urlaub et al. (1986) Somatic Cell Mol. Genet.12: 555-556), особливо клітинні лінії CHO, що адаптовані для суспензійній культури, мишачі клітини Сертолі, клітини нирки мавпи, клітини нирки африканської зеленої мартишки (ATCC CRL-1587), клітини HELA, клітини нирки собаки (ATCC CCL 34), клітини легенів людини (ATCC CCL 75), клітини Hep G2 та клітини мієломи та лімфоми, наприклад, NS0 (див. US 5,807,715), Sp2/0, Y0. Такі клітині - хазяї також можуть бути додатково перебудовані або адаптовані до змінення якості, функції та/або виходу антиген - зв'язуючого білка. Необмежені приклади охоплюють експресію специфічних модифікуючих (наприклад, глюкозилування) ферментів та шаперонів фолдингу білка. Клітини - хазяї, трансформовані з векторами, що кодують антиген - зв'язуючі білки можна культивувати за допомогою будь-якого відомого фахівцям методу. Клітини - хазяї можна культивувати у флаконах з мішалкою, у ролерних колбах або у порожньоволоконних мікробіореакторах, але для великомасштабного виробництва, особливо для суспензійних культур звичайно застосовують реактори з мішалкою. Ці реактори можна пристосувати для аерації з застосуванням, наприклад розбризкувачів, дефлекторів або лопатевих мішалок з низькими зсувними зусиллями. Для барботажних колонок та аероліфтних реакторів можна застосувати безпосередню аерацію повітрям або кисневими бульбашками. При культивуванні клітин - хазяїв у вільному від сироватки культуральному середовищі, середовище збагачують клітинно-захисним агентом, наприклад, Рluronic F-68 для запобігання пошкодження клітин в ході процесу аерації. В залежності від характеристик клітини - хазяїна, в якості субстратів зростання для прикріплення залежних клітинних ліній можна або застосувати мікроносії або клітини можна адаптувати до суспензійної культури (що є типовим). При культивуванні клітин - хазяїв, особливо клітини - хазяїв безхребетних можуть бути застосовані різні робочі режими, як-то підживлення, періодичний режим культивування клітин, що повторюється (див. Drapeau et al. (1994) Cytotechnology 15: 103-109), подовжений режим культивування клітин або перфузійна культура. Хоча рекомбінантно трансформовані клітини - хазяї ссавців можна культивувати у сироватці, що містить середовище, як-то ембріональна теляча сироватка (FCS), подібні клітини - хазяї можна культивувати у синтетичному, вільному від сироватки середовищі, наприклад, у наведеному у Keen et al. (1995) Cytotechnology 17: 153-163; або у середовищі, що є наявним у продажу, як-то ProCHO-CDM або UltraCHO™ (Cambrex NJ, USA), доповненому у разі потреби джерелом енергії, наприклад, глюкозою та синтетичними факторами зростання, як-то рекомбінантний інсулін. Вільне від сироватки культивування клітини - хазяїв може потребувати, щоб ці клітини були адаптовані у вільних від сироватки умовах. Одним підходом такої адаптації є культивування таких клітин - хазяїв у сироватці, що містить середовище з неодноразовою зміною 80 % культуральнoго середовища до вільного від сироватки середовища таким чином, що клітини - хазяї навчаються адаптуватися у вільних від сироватки умовах (див., наприклад, Scharfenberg et al. (1995) in Animal Cell Technology: Developments towards the 21st century (Beuvery et al. eds, 619-623, Kluwer Academic publishers). Антиген - зв'язуючі білки, що вивільняються у середовище можна відновити та очистити з застосуванням ряду способів забезпечення прийнятного для призначеного застосування рівня очищення. Наприклад, застосування антиген - зв'язуючих білків для лікування людини, звичайно, вимагає принаймні 95 % чистоти, більш типово 98 % або 99 % або ще більше (порівняно до неочищеного культурального середовища). Клітинне сміття з культурального середовища, звичайно, видаляють з застосуванням центрифугування, після чого слідує стадія очищення супернатанту з застосуванням, наприклад, мікрофільтрації, ультрафільтрації та/або глибинної фільтрації. Також можна застосувати ряд інших способів, як-то діаліз, гель 22 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 електрофорез та хроматографічні способи, наприклад, хроматографію на гідроксиапатиті (HA), афінну хроматографію (що вибірково охоплює системи афінного мічення, як-то полігістидин) та/або хроматографію з гідрофобною взаємодією (HIC, див. US 5, 429,746). Наступними різними етапами очищення антитіл може бути їх захоплення з застосуванням афінної хроматографії А або G -білка. Можуть бути проведені додаткові етапи хроматографії, наприклад, іонообмінна та/або HA - хроматографія, аніонний або катіонний обмін, гель-фільтрація та осадження сульфатом амонію. Також можуть бути застосовані різні етапи видалення вірусу (наприклад, нанофільтрація з застосуванням, наприклад, фільтра DV-20). Після цих різних етапів можна отримати очищений (наприклад, моноклональний) препарат, що містить принаймні 75 мг/мл або більше або 100 мг/мл або більше антиген - зв'язуючого білка. Подібні препарати істотно вільні від агрегованих форм антиген - зв'язуючих білків. Бактеріальні системи можна застосувати для експресії антиген - зв'язувальних фрагментів. Такі фрагменти можуть бути внутрішньоклітинно локалізованими у періплазмі, або зовнішньоклітинно вивільнятися. Нерозчинні білки можна екстрагувати та піддати рефолдингу для утворення активних білків за допомогою способів, відомих фахівцям, див. Sanchez et al. (1999) J. Biotechnol. 72: 13-20; та Cupit et al. (1999) Lett Appl Microbiol 29: 273-277. Деамідування є хімічною реакцією з видаленням амідної функціональної групи. У біохімії, ця реакція є важливою у процесі деградації білків, оскільки вона пошкоджує бічні ланцюги амінокислот аспарагіну та глютаміну, що містять амід. Аспарагін перетворюється на суміш ізоаспартату та аспартату. Деамідування глютамінових залишків відбувається з набагато нижчою швидкістю. Вважається, що реакції деамідування є одними з факторів, що можуть обмежити корисний час життя білка та вони також являють собою одне з найбільш поширених пост-трансляційних змінень, що відбуваються протягом виробництва терапевтичних білків. Наприклад, для рекомбінантної ДНКази людини та рекомбінантного розчинного CD4 спостерігалося зменшення або втрата біологічної активності in vitro або in vivo, в той час, як інші рекомбінантні білки, скоріше за все, залишалися незмінними. Очищені препарати антиген зв'язуючого білка, як тут описано, можна включати до фармацевтичних композицій для застосування у лікуванні хвороб людини, розладів та описаних тут хворобливих станів. Терміни "хвороби", "розлади" та "стани" тут застосовано взаємозаміно. Фармацевтичні композиції можна застосувати у лікуванні будь-якої хвороби, де у тканинах присутні амілоїдні накопичування, що надають структурні та функціональні пошкодження, які ведуть до клінічного захворювання. SAP є завжди присутнім у всіх амілоїдних накопичуваннях in vivo та фармацевтичні композиції, що містять терапевтично ефективну кількість описаного тут антиген - зв'язуючого білка можна застосувати у лікуванні захворювань, чутливих до очищення тканин від амілоїдних накопичувань. Фармацевтичний препарат може містити антиген - зв'язуючий білок у комбінації з фармацевтично прийнятним носієм. Антиген - зв'язуючий білок може бути введений або окремо або у вигляді частини фармацевтичної композиції. Звичайно, такі композиції містять фармацевтично - прийнятний носій, як відомо та передбачено прийнятною фармацевтичною практикою, див., наприклад, Remingtons Pharmaceutical Sciences, 16th edition (1980) Mack Publishing Co. Приклади таких носіїв охоплюють стерилізовані носії, як-то фізіологічний розчин, розчин Рінгера або розчин декстрози, вибірково буферизований прийнятними буферами до pH у діапазоні 5-8. Фармацевтичні композиції можна ввести шляхом ін'єкції або безперервної інфузії (наприклад, внутрішньовенно, внутрішньоочеревинно, внутрішньошкірно, підшкірно, внутрішньом'язово або інтрапортально). Такі композицій є істотно вільними від помітних твердих частинок. Фармацевтичні композиції також можна ввести перорально, особливо ті, що містять CPHPC. Фармацевтичні композиції можуть містити 1 мг - 10 г антиген - зв'язуючого білка, наприклад, 5 мг - 1 г антиген - зв'язуючого білка. Альтернативно, композиції можуть містити 5 мг - 500 мг, наприклад, 5 мг - 50 мг. Способи отримання таких фармацевтичних композицій добре відомі фахівцям. Фармацевтичні композиції можуть містити 1 мг - 10 г антиген - зв'язуючого білка у одиничній дозованій формі, вибірково разом з інструкціями по застосуванню. Фармацевтичну композицію можна ліофілізувати (сублімаційно підсушити) для відновлення перед введенням, відповідно, добре відомими або зрозумілими фахівцям способами. Коли антитіла мають ізотип IgG1, до фармацевтичної композиції можна додати хелатор міді, як-то цитрат (наприклад, цитрат натрію) або EDTA або гістидин, для зменшення ступеню опосередкованої міддю деградації антитіла цього ізотопу, див. EP0612251. Фармацевтичні композиції також можуть містити солюбілізатор, наприклад, аргінінову основу, детергент/ агент анти -агрегування, як-то полісорбат 80 та 23 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 інертний гас, як-то азот для заміщення кисню, що знаходиться у флаконі. Ефективні дози та режими лікування для антиген - зв'язуючого білка, що вводять, головним чином визначають емпіричним шляхом та вони можуть залежати від таких факторів, як вік, вага та стан здоров'я пацієнту та від хвороби або розладу, що підлягає лікуванню. Такі фактори знаходяться в компетенції досвідченого лікаря. Керівництво по підбору відповідних доз можна знайти, наприклад, у Smith et al (1977) Antibodies in human diagnosis and therapy, Raven Press, New York. Дозування антиген - зв'язуючого білка, введеного суб'єкту, головним чином, дорівнює 1 мкг/кг - 150 мг/кг, 0.1 мг/кг - 100 мг/кг, 0.5 мг/кг - 50 мг/кг, 1-25 мг/кг або 1-10 мг/кг на масу тіла суб'єкту. Наприклад, доза може дорівнювати 10 мг/кг, 30 мг/кг або 60 мг/кг. Антиген - зв'язуючий білок може бути введено парентерально, наприклад, підшкірно, внутрішньом'язово або внутрішньовенно. Сполуку, що усуває SAP можна вводити з дозою 0.1 мг/кг - 2 мг/кг, в залежності від її активності. Сполуку, що усуває SAP можна вводити з фіксованою дозою, незалежно від співвідношення дози з вагою суб'єкта. Сполуку, що усуває SAP можна вводити у вигляді однієї або декількох окремих доз, що вводяться одночасно або послідовно парентеральним шляхом, що дорівнюють 100 мг або менше, 50 мг або менше, 25 мг або менше або 10 мг або менше. Якщо це бажано, ефективну щоденну дозу терапевтичної композиції можна ввести у вигляді 2, 3, 4, 5, 6 або більше суб - доз, що вводять окремо з відповідними інтервалами протягом доби, вибірково, у одиничних дозованих формах. Антиген - зв'язуючий білок можна ввести у вигляді одиничної великої дози або у вигляді менших доз, що повторюються. Введення дози можна уповільнити безперервною інфузією протягом періоду від 2 до 24 годин, як-то від 2 до 12 годин або від 2 до 6 годин. Це може привести до зниження токсичних побічних дій. Введення дози можна повторювати один або декілька раз при необхідності, наприклад, тричі на день, один раз на день, раз у два дні, раз на тиждень, один раз у два тижні, один раз на місяць, раз в три місяці, раз на 6 місяців, або раз на рік. Антиген - зв'язуючі білки можна вводити у вигляді підтримуючої терапії, наприклад, один раз на тиждень протягом 6 місяців або більше. Антиген - зв'язуючі білки можна вводити у вигляді преривчастої терапії, наприклад, на період від 3 до 6 місяців та потім з перервою від 3 до 6 місяців, після чого знову слідує введення антиген зв'язуючих білків протягом періоду від 3 до 6 місяців і так далі у циклі. Наприклад, дозу можна ввести підшкірним шляхом, один раз у кожні 14 або 28 днів у вигляді багатьох суб - доз на кожен день введення. Антиген - зв'язуючий білок можна ввести суб'єкту в якості цільової терапії у конкретне місце. Наприклад, антиген - зв'язуючий білок можна ввести місцевою ін'єкцією у місцево локалізовану обмежену амілоїдну масу у тканині або інфузією до кровопостачання органу з амілоїдним накопичуванням. Для лікування описаних тут хвороб, антиген - зв'язуючий білок повинно застосовувати в комбінації з одним або більше інших терапевтично активних агентів, сполук специфічного усунення SAP. Ефективне усунення SAP від циркуляції повинно бути досягнуто перед введенням SAP - зв'язуючого білка для того, щоб додати останній безпечно та ефективно. Спочатку вводять сполуку, що усуває SAP для усунення майже всього циркулюючого SAP. Оскільки залишаються істотні кількості SAP, пов'язаного з амілоїдним накопичуванням у тканинах, послідовне введення анти - SAP антиген - зв'язуючого білка робить можливим розташування та специфічне зв'язування до місць амілоїдного накопичування для сприяння їх швидкої та екстенсивної регресії. Відповідно, анти - SAP антиген - зв'язуючий білок можна вводити 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 20 або 25 або більше днів після початкового лікування(лікувань) зі сполукою, що усуває SAP. Послідовне введення може охоплювати два або більше послідовних курсів лікування зі сполукою, що усуває SAP, після чого слідує два або більше послідовних курсів лікування з анти - SAP антиген - зв'язуючим білком. Послідовне введення може охоплювати один курс лікування зі сполукою, що усуває SAP, після чого слідує один послідовний курс лікування з анти - SAP антиген - зв'язуючим білком, що є потім повторюється один або більше раз. Послідовна/наступна доза може бути кількістю, більшою, ніж стартова/попередня доза або меншою, ніж стартова/попередня доза. За введенням початкової дози білкової сполуки, що усуває SAP може слідувати введення одного або більше послідовних (наприклад, наступних) доз сполуки, що усуває SAP та/або анти - SAP антиген - зв'язуючого білка, де вказана одна або більше послідовних доз може бути у 24 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількості, яка є приблизно така саме або менша, ніж початкова доза. Після початкового усунення циркулюючого SAP, за введенням додаткових доз сполуки, що усуває SAP та першої дози анти - SAPантиген - зв'язуючого білка може слідувати введення однієї або більше послідовних (наприклад, наступних) доз, де щонайменш одна з послідовних доз є у кількості, що є більшою, ніж початкова доза. Відповідно, для введення може застосувати попередньо визначену або звичайну схему, що веде до створення попередньо визначеного періоду часу між введенням доз. Схема може містити ідентичні або різні по довжині періоди часу, що попередньо у неї визначені. Будь-яка окрема комбінація буде охоплюватися схемою введення, доки вона буде достроково визначеною, таким чином, що відповідна схема буде охоплювати введення у певний день. Фармацевтична композиція може містити набор, до складу якого входить антиген зв'язуючий білок разом з іншими лікарськими засобами, вибірково з інструкціями по застосуванню. Для зручності, набор може містити реагенти у попередньо визначених кількостях разом з інструкціями по застосуванню. Терміни "особа", "суб'єкт" та "пацієнт" застосовані тут взаємозаміно. Суб'єкт може бути приматом (наприклад, мавпою або мармозеткою). Звичайно, суб'єкт є людиною. Лікування може бути терапевтичним, профілактичним або превентивним. Суб'єкт може потребувати такого лікування. Особи, що потребують такого лікування можуть охоплювати осіб, що вже страждають від певної медичної хвороби на додачу до тих, у кого ця хвороба може розвитися у майбутньому. Отже, сполуку, що усуває SAP, після якої вводять описаний тут SAP антиген - зв'язуючий білок можна застосувати для профілактичного або превентивного лікування. У цьому разі, описані тут послідовні процедури лікування застосовують до пацієнта з метою запобігання або затримання початку одного або більше аспектів або симптомів хвороби. Суб'єкт може бути безсимптомним або може мати генетичну схильність до хвороби, оскільки відомо, що амілоїдні накопичування можуть бути присутніми у тканинах та накопичуватися впродовж певних періодів часу, перш ніж вони стануть викликати ушкодження, достатні для отримання клінічних симптомів. Такі суб - клінічні амілоїдні накопичування можна визначити за допомогою гістологічного огляду зразків тканин або за допомогою неінвазивних способів візуалізації, що охоплюють радіосцинтиграфію міченого SAP, ехокардіографію та серцеву магнітно-резонансну томографію. Після попереднього усунення циркулюючого SAP, пацієнтам вводять профілактично ефективну кількість антиген - зв'язуючого білка. Профілактично ефективна кількість є кількістю, що запобігає або затримує початок одного або декількох аспектів або симптомів описаної тут хвороби. Описаний тут антиген - зв'язуючий білок також можна застосувати у терапевтичних способах. Під терміном "терапія" мається на увазі полегшення, зменшення або запобігання щонайменш одного аспекту або симптому хвороби. Наприклад, описаний тут антиген зв'язуючий білок можна застосувати для полегшення або зменшення одного або декількох аспектів або симптомів описаної тут хвороби. Описаний тут антиген - зв'язуючий білок може бути застосованим у ефективній кількості для терапевтичного, профілактичного або превентивного лікування. Терапевтично ефективна кількість описаного тут антиген - зв'язуючого білка є кількістю, ефективною для полегшення або зменшення одного або декількох аспектів або симптомів хвороби. Описаний тут антиген зв'язуючий білок також можна застосувати для запобігання або лікування описаної тут хвороби. Описаний тут антиген - зв'язуючий білок може мати, головним чином, благотворний вплив на здоров'я суб'єкта, наприклад, він може збільшити його очікувану тривалість життя. Описаний тут антиген - зв'язуючий білок не повинен впливати на повне виліковування або на викорінення кожного симптому або проява хвороби, що містить повноцінне терапевтичне лікування. Як визнано у відповідній галузі, ліки, що застосовують у якості терапевтичних агентів, які можуть зменшити тяжкість вибраного хворобливого стану, але не усувають кожний прояв хвороби слід розглядати у якості корисних терапевтичних агентів. Крім того, профілактичне лікування не повинно бути повністю ефективним у запобіганні початку хвороби, щоб являти собою життєздатний профілактичний засіб. Достатнім буде просте зниження впливу хвороби (наприклад, шляхом зменшення кількості або тяжкості її симптомів або шляхом підвищення ефективності інших процесів лікування або отриманням іншого корисного впливу) або зменшення ймовірності того, що захворювання буде відбуватися (наприклад, затриманням початку хвороби) або погіршуватися у суб'єкті. Описані тут антиген - зв'язуючі білки можна застосувати у лікуванні або у запобіганні хвороби, пов'язаної з амілоїдним накопичуванням, тобто, амілоїдозу. "Амілоїдоз" є будь-якою хворобою, що характеризується зовнішньоклітинним амілоїдним 25 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 накопичуванням у різних органах та тканинах тіла. Термін "амілоїд" має відношення до зовнішньоклітинного накопичування у тканинах нерозчинних білкових волокон, що складаються з фібрил з характерною ультраструктурною морфологією, структурою ядра типа крос - β - лист та патогномонічною гістохімічною тинкторіальною властивістю до зв'язування барвника типу Конго червоний від алкалінового спиртового розчину з наступним отриманням червоно-зеленого дихроїзму при мікроскопічному спостереженні у сильному перехресно поляризованому світлі. Відомо, що біля 25 різних неспоріднених білків утворюють амілоїдні волокна, що накопичуються у тканинах людини та мають всі ці типові властивості. Церебральний амілоїд, амілоїдні накопичування у речовині головного мозку дещо відрізняються від амілоїдних накопичувань в інших місцях тіла, де вони є завжди фокальними та мікроскопічних розмірів та звичайно мають назву амілоїдних бляшок. Амілоїдоз, який є хворобою, безпосередньо спричиненою накопичуванням амілоїду у тканинах, охоплює локальний амілоїдоз, де накопичування обмежено одним анатомічним регіоном та/або однією тканиною або системою органів та системний амілоїдоз, де накопичування може відбуватися у будь-якому органі або тканині у тілі, в тому числі, у кровоносних судинах та у з'єднувальних тканинах. Причина амілоїдозу може бути набутою або спадковою. Придбаний амілоїдоз виникає як ускладнення попереднього захворювання, що саме по собі може бути або придбаним або спадковим. Отже, реактивний системний амілоїдоз, відомий, як амілоїдоз амілоїдного білка А (амілоїдоз - AA) є ускладненням хронічних активних запальних хвороб, як-то ревматоїдного артриту, ювенільного ревматоїдного артриту, хвороби Крона, хронічних інфекцій та хронічного сепсису та спадкових синдромів періодичної лихоманки, як-то середземноморська сімейна лихоманка, синдром Майкла - Уеллса та хронічний дитячий шкірно - артикулярно - неврологічний синдром та діалізний амілоїдоз, спричинений накопичуванням β2- мікроглобуліну в результаті термінальної стадії ниркової недостатності. Амілоїдоз легкого ланцюга моноклонального імуноглобуліну (AL) є ускладненням множинної мієломи або іншою доброякісною моноклональною гаммапатією (моноклональна гаммапатія невизначеного значення, MGUS). Набутий амілоїдоз транстиретинового типу може відбуватися без будь-якої попередньої хвороби та лише є віковим ускладненням. Спадковий амілоїдоз, спричинений мутаціями у генах різних білків, які кодують експресію варіантних білків, що мають підвищену схильність до утворення амілоїдних фібрил та охоплює хвороби, спричинені транстіретином, аполіпопротеїном AI, гельсоліном, лізоцимом, цістатіном С та β-амілоїдним білком. Докладні описи всіх різних форм амілоїдозу та причетних до нього білків можна знайти у підручниках та у науковій літературі (Pepys, M.B. (2006) Annu. Rev. Med., 57: 223-241; Pepys and Hawkins (2003) Amyloidosis. Oxford Textbook of Medicine, 4th Ed., Vol. 2, Oxford University Press, Oxford, pp. 162-173; Pepys and Hawkins (2001) Amyloidosis. Samter's Immunologic Diseases, Sixth d., Vol. 1, Lippincott Williams & Williams, Philadelphia, pp. 401-412). Місцеве амілоїдне накопичування, обмежене одним органом або тканиною, може клінічно не проявлятися або може викликати серйозне тканинне пошкодження та хворобу. Наприклад, церебральна амілоїдна ангіопатія, де судинні амілоїдні накопичування складаються з Aβ білка, є, як правило, спорадичним набутим станом, що виникає з незрозумілих причин у відсутності будь-якої іншої патології та є основною причиною крововиливу в мозок та інсульту. Існують кілька дуже важливих та загальних хвороб, особливо хвороба Альцгеймера (AD) та діабет типу 2, у яких завжди присутні амілоїдні накопичування, де докладні механізми, що спричинюють ці відповідні хвороби досі невідомі. Однак, дуже ймовірно, що місцеві накопичування амілоїду у мозку та у кровоносних мозкових судинах при хворобі Альцгеймера та у острівцях підшлункової залози при діабеті погіршують патологію та перебіг хвороби. Відповідно, заявлений винахід стосується лікування наведеними тут антиген - зв'язуючими білками хвороби Альцгеймера та діабету типу 2 та будь-якого стану, пов'язаного з наявністю амілоїдних накопичувань у тканинах. З амілоїдними накопичуваннями у мозку також пов'язано багато видів трансмісивної губчастої енцефалопатії (пріонні хвороби), отже, заявлений винахід стосується всіх цих станів, в тому числі, варіанта хвороби Крейтцфельдта-Якоба у людей, самої хвороби КрейтцфельдаЯкоба, хвороби Куру та різних інших форм пріонних хвороб людини, а також коров'ячої губчастої енцефалопатії, хронічного акобальтозу мулів, оленів та лосів та трансмісивної енцефалопатії норок. Описані тут антиген - зв'язуючі білки можна застосувати для визначення SAP у біологічних зразках in vitro або in vivo з діагностичною метою. Наприклад, анти - SAP антиген - зв'язуючі білки можна застосувати для визначення SAP у сироватці або у пов'язаних з амілоїдом утвореннях, наприклад у амілоїдних бляшках. Спочатку амілоїд можна видалити з організму людини або тварини (наприклад, шляхом біопсії). Також можна застосувати загальноприйнятні способи імуноаналізу, в тому числі ІФА, Вестерн - блот, імуногістохімію або імунопреципітацію. 26 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антиген - зв'язуючі білки можуть бути надані в діагностичному наборі, що містить один або більше антиген - зв'язуючих білків, мітку для виявлення та інструкції для застосування набору. Для зручності, набор може містити реагенти у попередньо визначених кількостях разом з інструкціями по застосуванню. Приклади Приклад 1. Секвенування змінних доменів гібридоми SAP-E та SAP-K. SAP-E та SAP-K походять від двох груп анти - SAP моноклональних антитіл, де кожну групу окремо тестували на здатність зв'язування з SAP людини in vitro. SAP-E та SAP-K у своїх групах показали більш сильне зв'язування з SAP та у інших дослідженнях їх порівняли між собою. Перша група антитіл містила антитіла з 7 гібридом, отриманих шляхом одиничної загальноприйнятної імунізації з очищеним SAP людини (SEQ ID NO:43, що показана нижче) (деталі способу очищення SAP людини наведені у Hawkins et al. (1991) Clin. Exp. Immunol. 84, 308-316) та процедури злиття, що позначені, як SAP-A-SAP-G. Два цих антитіла, SAP-E та SAPB, мають ізотип IgG2a, в той час, як всі інші мають ізотип IgG1 (див. Приклад 13, Таблиця 11). Друга груп антитіл охоплює 6 різних моноклональних антитіл ізотопу IgG2a (SAP-H-SAP-M), що отримані за допомогою стандартних способів шляхом імунізації з очищеним SAP людини (SEQ ID NO:43, що показана нижче) (Hawkins et al. (1991) Clin. Exp. Immunol. 84, 308-316) та стандартних процедур злиття для отримання гібридом, яких клонували з застосуванням загальноприйнятних способів. Зріла амінокислотна послідовність SAP homo sapiens (SEQ ID NO:43): HTDLSGKVFVFPRESVTDHVNLITPLEKPLQNFTLCFRAYSDLSRAYSLFSYNTQGRDNELLVYKE RVGEYSLYIGRHKVTSKVIEKFPAPVHICVSWESSSGIAEFWINGTPLVKKGLRQGYFVEAQPKIVLGQ EQDSYGGKFDRSQSFVGEIGDLYMWDSVLPPENILSAYQGTPLPANILDWQALNYEIRGYVIIKPLVW V З метою порівняння, нижче наведена послідовність мишачого SAP, що має 69.4 % тотожності з SAP людини. Зрілий мишачий (mus musculus) білок SAP (SEQ ID NO:44): QTDLKRKVFVFPRESETDHVKLIPHLEKPLQNFTLCFRTYSDLSRSQSLFSYSVKGRDNELLIYKE KVGEYSLYIGQSKVTVRGMEEYLSPVHLCTTWESSSGIVEFWVNGKPWVKKSLQREYTVKAPPSIVL GQEQDNYGGGFQRSQSFVGEFSDLYMWDYVLTPQDILFVYRDSPVNPNILNWQALNYEINGYVVIRP RVW 6 Загальну РНК екстрагували з гранул клітин гібридоми, що містили приблизно 10 клітин за допомогою набору RNeasy kit від Qiagen (#74106). Систему AccessQuick RT-PCR System (A1702) застосували для отримання кДНК змінного важкого та легкого регіонів за допомогою вироджених праймерів, специфічних для лідерної послідовності мишачого імуноглобулінового гена та мишачі сталі регіони IgG2a/K. Очищені за допомогою ПЛР зі зворотною транскрипцією фрагменти клонували з застосуванням набору TA cloning kit від Invitrogen (K2000-01). За допомогою вирівнювання послідовності та вирівнювання з відомими імуноглобуліновими змінними послідовностями, переліченими у KABAT (Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)) була отримана консенсусна послідовність для кожної гібридоми. Консенсусні послідовності для SAP-E та SAP-K наведені нижче. Послідовності SAP-E: SAP-E CDRH1 (SEQ ID NO:1) TYNMH SAP-E CDRH2 (SEQ ID NO:2) YIYPGDGNANYNQQFKG SAP-E CDRH3 (SEQ ID NO:3) GDFDYDGGYYFDS SAP-E CDRL1 (SEQ ID NO:4) RASENIYSYLA SAP-E CDRL2 (SEQ ID NO:5) NAKTLAE SAP-E CDRL3 (SEQ ID NO:6) QHHYGAPLT Амінокислотна послідовність SAP-E VH (SEQ ID NO:7) з підкресленими CDR: QASLQQSGTELVRSGASVKMSCKASGFTFATYNMHWIKQTPGQGLEWIGYIYPGDGNANYNQQ FKGKATLTADTSSNTAYMQISSLTSEDSAVYFCARGDFDYDGGYYFDSWGQGTTLTVSS ДНК - послідовність SAP-E VH (SEQ ID NO:8): CAGGCTTCTCTACAGCAGTCTGGGACTGAGCTGGTGAGGTCTGGGGCCTCAGTGAAGATGT 27 UA 108227 C2 5 10 15 20 25 30 35 40 45 50 55 60 CCTGCAAGGCTTCTGGCTTCACATTTGCCACTTACAATATGCACTGGATTAAGCAGACACCCGGA CAGGGCCTGGAATGGATTGGGTATATTTATCCTGGAGATGGTAATGCTAACTACAATCAGCAGTT CAAGGGCAAGGCCACATTGACTGCAGACACATCCTCCAACACAGCCTACATGCAGATCAGCAGC CTGACATCTGAAGACTCTGCGGTCTATTTCTGTGCAAGAGGGGACTTTGATTACGACGGAGGGT ACTACTTTGACTCCTGGGGCCAGGGCACCACTCTCACAGTCTCCTCA Амінокислотна послідовність SAP-E VL (SEQ ID NO:9) з підкресленими CDR: DIQMTQSPASLSASVGETVTITCRASENIYSYLAWYQQKQGRSPQLLVHNAKTLAEGVPSRVSGS GSGTHFSLKINGLQPEDFGNYYCQHHYGAPLTFGAGTKLELK ДНК - послідовність SAP-E VL (SEQ ID NO:10) GACATCCAGATGACTCAGTCTCCAGCCTCCCTATCTGCATCTGTGGGAGAAACTGTCACCAT CACATGTCGAGCAAGTGAGAATATTTACAGTTATTTAGCATGGTATCAGCAGAAACAGGGAAGAT CCCCTCAGCTCCTGGTCCATAATGCAAAAACCTTAGCAGAAGGTGTGCCATCAAGGGTCAGTGG CAGTGGATCAGGCACACACTTTTCTCTGAAGATCAACGGCCTGCAGCCTGAAGATTTTGGGAATT ATTACTGTCAACATCATTATGGTGCTCCGCTCACGTTCGGTGCTGGGACCAAGCTGGAACTGAAA Послідовності SAP-K: SAP-K CDRH1 (SEQ ID NO:11) SYWMH SAP-K CDRH2 (SEQ ID NO:12) MIHPNSVNTNYNEKFKS SAP-K CDRH3 (SEQ ID NO:13) RNDYYWYFDV SAP-K CDRL1 (SEQ ID NO:14) KASQNVNSNVA SAP-K CDRL2 (SEQ ID NO:15) SASYRYS SAP-K CDRL3 (SEQ ID NO:16) QQCNNYPFT Амінокислотна послідовність SAP-K VH (SEQ ID NO:17) з підкресленими CDR: QVQLQQPGAELIKPGASVKLSCKASGYTFTSYWMHWVKQRPGQGLEWIGMIHPNSVNTNYNEK FKSKATLTVDKSSSTAYMQLNSLTSEDSAVYYCARRNDYYWYFDVWGTGTTVTVSS ДНК - послідовність SAP-K VH (SEQ ID NO:18): CAGGTCCAACTGCAGCAGCCTGGGGCTGAGCTGATAAAGCCTGGGGCTTCAGTGAAGTTGT CCTGCAAGGCTTCTGGCTACACTTTCACCAGCTACTGGATGCACTGGGTGAAGCAGAGGCCTGG ACAAGGCCTTGAGTGGATTGGAATGATTCATCCTAATAGTGTTAATACTAACTACAATGAGAAGTT CAAGAGTAAGGCCACACTGACTGTAGACAAATCCTCCAGCACAGCCTACATGCAACTCAACAGC CTGACATCTGAGGACTCTGCGGTCTATTACTGTGCAAGACGGAATGATTACTACTGGTACTTCGA TGTCTGGGGCACAGGGACCACGGTCACCGTCTCCTCA Амінокислотна послідовність SAP-K VL (SEQ ID NO:19) з підкресленими CDR: DIVMTQSQKFMSTSVGDRVSVTCKASQNVNSNVAWYQQKPGQSPKALIYSASYRYSGVPDRFT GSGSGTDFTLTITNVQSEDLAEYFCQQCNNYPFTFGSGTKLEIK ДНК - послідовність SAP-K VL (SEQ ID NO:20): GACATTGTGATGACCCAGTCTCAAAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCGT CACCTGCAAGGCCAGTCAGAATGTGAATTCTAATGTAGCCTGGTATCAACAGAAACCAGGGCAAT CTCCTAAAGCACTGATTTACTCGGCTTCCTACCGGTACAGTGGAGTCCCTGATCGCTTCACAGGC AGTGGATCTGGGACAGATTTCACTCTCACCATCACCAATGTGCAGTCTGAAGACTTGGCAGAGTA TTTCTGTCAGCAATGTAACAACTATCCATTCACGTTCGGCTCGGGGACAAAGTTGGAAATAAAA Приклад 2. Отримання химерних антитіл. Для SAP-E та SAP-K за допомогою ПЛР-клонування, були отримані химерні антитіла, що містять батьківські мишачі змінні домени, щеплені у сталі регіони IgG1/κ людини (дикого типу). На основі коненсусної послідовності були розроблені праймери для ампліфікації мишачих змінних доменів, що містили необхідні для полегшення клонування у векторах експресії для клітин ссавців сайти рестрикції. За допомогою введення сайту рестрикції у FR4 (каркасний регіон 4 (послідовність V- регіону, що знаходиться за CDR3 та перед першим сталим доменом)) Амінокислотну послідовність VH у SAP-E змінили з TTLTVSS, як показано у SEQ ID NO:7, на TLVTVSS та амінокислотну послідовність VH у SAP-K змінили з TTVTVSS, як показано у SEQ ID NO:17, на TLVTVSS. У CDRL1, у змінному легкому ланцюзі SAP-K знаходився внутрішній сайт рестрикції EcoRI та для видалення цього небажаного сайту були створені мутагенні праймери, що змінюють одну пару основ без змінення амінокислотної послідовності. Повнорозмірні білкові послідовності важкого та легкого ланцюга химерного антитіла SAP-E (cSAP-E) наведені у SEQ ID NO:21 та, відповідно, у SEQ ID NO:22. Повнорозмірні білкові 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntigen binding proteins specific for serum amyloid p component
Автори англійськоюBhinder, Tejinder, Kaur, Ford, Sussannah, Karen, Germaschewski, Volker, Lewis, Alan, Peter, Pepys, Mark, Brian
Автори російськоюБхиндер Теджиндер Каур, Форд Сусанна Карен, Гермашевски Волкер, Люис Алан Питер, Пипис Марк Брайан
МПК / Мітки
МПК: C07K 16/18, A61P 25/28, A61K 39/395
Мітки: білок, антигензв'язуючий
Код посилання
<a href="https://ua.patents.su/100-108227-antigenzvyazuyuchijj-bilok.html" target="_blank" rel="follow" title="База патентів України">Антигензв’язуючий білок</a>
Попередній патент: Спосіб обробляння і детоксифікації матеріалу (варіанти) та пристрій для його здійснення
Наступний патент: Спосіб надання користувачу інформації з капсули для приготування напою із застосуванням коду
Випадковий патент: Пристрій для захисту трифазного асинхронного електродвигуна від аварійних режимів роботи