Біциклічні арильні аналоги сфінгозин 1-фосфату
Номер патенту: 107360
Опубліковано: 25.12.2014
Автори: Гукіан Кевін М., Чжен Го Чжу, Томас Джермейн, Колдвелл Річард Д., Лін Едвард Інь-Шиан, Таверас Артур Г., Кумаравел Гнанасамбандам, Ма Бінь, Лю Сяогао
Формула / Реферат
1. Сполука формули (IIa), (IIIa) або (IIIb):
 ,
,
де:
кожний з X1, X2, X3, X4, X5 і X6, незалежно, представляє водень, гало, гідрокси, нітро, ціано, алкіл, галоалкіл, циклоалкіл, галоциклоалкіл, алкокси, галоалкокси, циклоалкокси, галоциклоалкокси, ацил, аміноацил, -N(RfRg), -N(Rf)SO2Rg, -SO2Rf, -S(O)2N(RfRg), -CO2Rf, триалкіламіно, арил або гетероарил; W являє собою -О-;
Су має формулу:
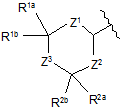 ,
,
де:
Z1 являє собою -[C(RdRe)]x-;
Z2 являє собою -[C(RdRe)]y-;
Z3 являє собою -[C(RdRe)]z-;
кожний з х, у і z, незалежно, являє собою 1, 2 або 3;
кожний Rd, незалежно, являє собою водень, гало, гідрокси, алкіл, алкеніл, алкокси або циклоалкіл;
кожний Re, незалежно, являє собою водень, гало, гідрокси, алкіл, алкеніл, алкокси або циклоалкіл;
R1a i R1b, незалежно, являють собою водень, гало, гідрокси, нітро, ціано, -NRfRg, алкіл, галоалкіл, циклоалкіл, циклоалкеніл, циклоалкілалкіл, циклоалкенілалкіл, гетероциклілалкіл, арилалкіл, гетероарилалкіл, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацил, циклоалкілацил, циклоалкенілацил, гетероциклілацил, арилацил, гетероарилацил, тіоалкіл, алкеніл, алкініл, циклоалкеніл, гетероцикліл, арил або гетероарил;
або R1a і R1b, узяті разом, являють собою С2-С5алкілен або С2-С5алкінілен;
R2a і R2b, незалежно, являють собою водень, гало, гідрокси, нітро, ціано, -NRfRg, алкіл, галоалкіл, циклоалкіл, циклоалкеніл, циклоалкілалкіл, циклоалкенілалкіл, гетероциклілалкіл, арилалкіл, гетероарилалкіл, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацил, циклоалкілацил, циклоалкенілацил, гетероциклілацил, арилацил, гетероарилацил, тіоалкіл, алкеніл, алкініл, циклоалкеніл, гетероцикліл, арил або гетероарил;
або R1a і R2a, узяті разом, являють собою C1-C5алкілен або С2-С5алкінілен;
де R1a, R1b, R2a, і R2b кожний, незалежно, заміщений 0-5 замісниками, вибраними з гало, гідрокси, нітро, ціано, -NRfRg або -CO2Rf;
R3 являє собою -L1-J-L2-T1;
L1 являє собою -С(О)-, -S(O)2-, -N(Rf)C(O)-, -N(Rf)-, -C(RfRg)-, -C(RfRg)-C(RfRg)- або зв'язок;
J являє собою -[C(RfRg)]n-, -N(Rf)- [C(RfRg)]n- або зв'язок, де кожний n, незалежно, являє собою ціле число від 0 до 5; або J являє собою
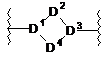 ,
,
де
кожний з D1 і D3, незалежно, являє собою
 або
або  ;
;
D2 являє собою -[C(RfRg)]k-, -[C(RfRg)]k-N(Rf)-, -[C(RfRg)]k-O-, -N(Rf)- або -N(Rf)-[(CRfRg)]k-; і
D4 являє собою -[C(RfRg)]m-;
де k являє собою 1 або 2; і m являє собою 0, 1, 2 або 3;
за умови, що не більше 2 атомів циклу D1-D4 являють собою N або О;
L2 являє собою -C(RfRg)-, -C(RfG)-, -C(G)2-, -C(RfRg)-C(RfRg)-, -C(RfRg)-C(RfG)-, -C(RfRg)-C(G)2- або зв'язок;
за умови, що як мінімум один з L1, J і L2 не є зв'язком;
Т1 являє собою -C(O)(ORf), -C(O)N(Rf)S(O)2Rf, тетразоліл, -S(O)2ORf, -C(O)NHC(O)-Rf, -Si(O)OH, -B(OH)2, -N(Rf)S(O)2Rf, -S(O)2NRf, -O-P(O)(ORf)ORf або -P(O)2(ORf);
кожний G, незалежно, являє собою водень, гідрокси, галоген або трифторметил;
кожний Rf, незалежно, являє собою водень, гідрокси, гало, алкіл, галоалкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, арил, гетероарил, гетероцикліл або NH2; де кожний з алкілу, циклоалкілу, циклоалкенілу, арилу, гетероарилу й гетероциклу необов'язково заміщений 1-5 замісниками, незалежно вибраними із групи, що складається з гало, оксо, -CN, -СНО, -CG3, -OH, -NO2, алкілу, -OCG3, алкокси, циклоалкокси, циклоалкенокси, аміно, алкіламіно, діалкіламіно, ациламіно, аміноацилу, алкілсульфонілу, алкіламіносульфонілу і діалкіламіносульфонілу;
кожний Rg, незалежно, являє собою водень, гідрокси, гало, алкіл, галоалкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, арил, гетероарил або гетероцикліл; де кожний з алкілу, циклоалкілу, циклоалкенілу, арилу, гетероарилу й гетероциклу необов'язково заміщений 1-5 замісниками, незалежно вибраними із групи, що складається з гало, оксо, -CN, -СНО, -CG3, -OH, -NO2, алкілу, -OCG3, алкокси, циклоалкокси, циклоалкенокси, аміно, алкіламіно, діалкіламіно, ациламіно, аміноацилу, алкілсульфонілу, алкіламіносульфонілу і діалкіламіносульфонілу;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що L1 являє собою -C(RfRg)- і J являє собою -NRf- або
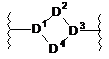 ,
,
де
кожний з D1 і D3, незалежно, являє собою
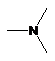 або
або 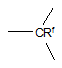 ;
;
D2 являє собою -[C(RfRg)]k-, -[C(RfRg)]k-N(Rf)-, -[C(RfRg)]k-O-, -N(Rf)- або -N(Rf)-[(CRfRg)]k-; і
D4 являє собою -[C(RfRg)]m-;
де k являє собою 1 або 2; і m являє собою 0, 1, 2 або 3;
за умови, що не більше 2 атомів циклу D1-D4 являють собою N або О; або її фармацевтично прийнятна сіль.
3. Сполука за будь-яким з пп. 1, 2, яка відрізняється тим, що Т1 являє собою -C(O)(ORf), -C(O)N(Rf)S(O2Rf), -O-P(O)(ORf)ORf, -P(O2)(ORf), тетразоліл або -S(O)2ORf; або її фармацевтично прийнятна сіль.
4. Сполука за п. 1, яка відрізняється тим, що Z1 являє собою -СН2СН2-, Z2 являє собою -СН2- і Z3 являє собою зв'язок; або її фармацевтично прийнятна сіль.
5. Сполука за п. 1, яка відрізняється тим, що кожний R1a і R2a являє собою водень, a R1b являє собою фтор, хлор, бром, йод, метил, трифторметил, етил, пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, н-пентил, ізопентил, 1,1-диметилпропіл, неопентил, циклопентил, н-гексил, циклогексил, метокси, трифторметокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, трет-бутокси, н-пентилокси, ізопентилокси, 1,1-диметилпропокси, неопентилокси, циклопентилокси, н-гексилокси або циклогексилокси; або її фармацевтично прийнятна сіль.
6. Сполука, вибрана із групи, що складається з:
3-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метиламіно)-N-(фенілсульфоніл)пропанаміду;
3-((6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталін-2-іл)метиламіно)-N-(фенілсульфоніл)пропанаміду;
2-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метиламіно)пропаноєвої кислоти;
3-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метиламіно)бутаноєвої кислоти;
2-(((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метил)(метил)аміно)оцтової кислоти;
3-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метиламіно)пропаноєвої кислоти;
3-(((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метил)(метил)аміно)пропаноєвої кислоти;
1-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метил)азетидин-3-карбонової кислоти;
1-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метил)піролідин-3-карбонової кислоти;
1-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метил)піперидин-4-карбонової кислоти;
1-((6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталін-2-іл)метил)азетидин-3-карбонової кислоти;
3-((6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталін-2-іл)метиламіно)пропаноєвої кислоти;
3-((6-(транс-4-трет-бутилциклогексилокси)нафталін-2-іл)метиламіно)-2,2-дифторпропаноєвої кислоти;
2,2-дифтор-3-((6-(спіро[5.5]ундекан-3-ілокси)нафталін-2-іл)метиламіно)пропаноєвої кислоти;
2-(((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)аміно)оцтової кислоти;
4-(((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)аміно)масляної кислоти;
4-(((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)аміно)масляної кислоти;
(R)-1-((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)піперидин-3-карбонової кислоти;
(S)-1-((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)піперидин-3-карбонової кислоти;
4-((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)масляної кислоти;
5-((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)пентанової кислоти;
6-((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)гексаноєвої кислоти;
4-(6-(транс-4-трет-бутилциклогексилокси)-3,4-дигідроізохінолін-2(1Н)-іл)бутаноєвої кислоти;
4-(6-(цис-4-трет-бутилциклогексилокси)-3,4-дигідроізохінолін-2(1H)-іл)бутаноєвої кислоти;
2-(((2-(транс-4-трет-бутилциклогексилокси)нафталін-6-іл)метил)аміно)етилфосфінової кислоти;
2-(2-(5-(транс-4-трет-бутилциклогексилокси)індолін-1-іл)-2-оксоетиламіно)етилфосфінової кислоти;
3-аміно-4-(5-(транс-4-трет-бутилциклогексилокси)індолін-1-іл)-4-оксобутаноєвої кислоти;
3-{[6-(4-трет-бутилциклогексилокси)-8-метилнафталін-2-ілметил]аміно}пропіонової кислоти;
{[6-(4-трет-бутилциклогексилокси)-8-метилнафталін-2-ілметил]аміно}оцтової кислоти;
4-{[6-(4-трет-бутилциклогексилокси)-8-метилнафталін-2-ілметил]аміно}масляної кислоти;
1-[6-(4-трет-бутилциклогексилокси)-8-метилнафталін-2-ілметил]азетидин-3-карбонової кислоти і
1-[6-(4-трет-бутилциклогексилокси)-8-метилнафталін-2-ілметил]піролідин-3-карбоксилату;
або її фармацевтично прийнятна сіль.
7. Фармацевтична композиція, що містить фармацевтично прийнятний носій і сполуку за пп. 1-6 або її фармацевтично прийнятну сіль.
8. Сполука за будь-яким з пп. 1-6 або її фармацевтично прийнятна сіль для застосування при лікуванні або профілактиці розсіяного склерозу, аутоімунного захворювання, хронічного запального розладу, астми, запальної нейропатії, артриту, відторгнення при трансплантації, хвороби Крона, виразкового коліту, червоного вовчака, псоріазу, ішемічно-реперфузійного ушкодження, солідної пухлини, метастазів пухлин, захворювань, пов'язаних з ангіогенезом, судинного захворювання, больового стану, гострого вірусного захворювання, запального захворювання кишечнику, інсулінозалежного або інсулінонезалежного діабету.
9. Сполука за п. 8 або її фармацевтично прийнятна сіль, де патологічний стан являє собою нейропатичний біль або аутоімунне захворювання.
10. Сполука за п. 8 або її фармацевтично прийнятна сіль, де аутоімунне захворювання являє собою увеїт, діабет І типу, ревматоїдний артрит, запальне захворювання кишечнику або розсіяний склероз.
11. Сполука за п. 8 або її фармацевтично прийнятна сіль, де застосування додатково включає використання лікарського засобу, вибраного із групи, що складається з: кортикостероїду, бронходилататора, протиастматичного засобу, протизапального засобу, протиревматичного засобу, імуносупресора, антиметаболіту, імуномодулятора, протипсоріатичного засобу і протидіабетичного засобу.
12. Сполука за п. 8 або її фармацевтично прийнятна сіль, де аутоімунне захворювання являє собою розсіяний склероз.
Текст
Реферат: Представлено сполуки, які мають агоністичну активність при одному або більше S1Pрецепторах. Сполуки є аналогами сфінгозину, які, після фосфорилування, можуть поводитися як агоністи на S1P-рецепторах. UA 107360 C2 (12) UA 107360 C2 UA 107360 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівень техніки Сфінгозин 1-фосфат (S1P) є лізофосфоліпідним медіатором, що викликає безліч клітинних відповідей шляхом стимулювання п'яти членів сімейства рецепторів гена ендотеліальної клітинної диференціації (EDG). Рецептори EDG є G-білок сполученими рецепторами (GPCRs) і після стимуляції поширюють сигнали вторинного месенджеру за допомогою активації гетеротримірних субодиниць G-білку альфа (Gα) і бета-гама (Gβγ) димерів. В остаточному підсумку, така S1P-індукована сигналізація приводить до виживання клітин, підвищеної клітинної міграції й, часто, до мутагенезу. Останні розробки агоністів, спрямованих на S1P рецептори, забезпечили розуміння ролі такої сигнальної системи у фізіологічному гомеостазі. Наприклад, імуномодулятор, FTY720 (аміно-2-[2- (4-октілфеніл)етил]пропан-1,3-діол), що наступний за фосфорилюванням, є агоністом при 4 з 5 S1P рецепторів, що, як було виявлено, впливає на S1P рецепторну активність, що впливає на рух лімфоцитів. Додатково, антагоністи рецептора S1P типу 1 (S1P1) приводять до протікання легеневого капілярного ендотелію, що припускає, що S1P може бути залучений у підтримці цілісності ендотеліального бар'єра в деяких шарах тканин. Рецептори S1P типу 4 (S1P4) експресуються, головним чином, у лейкоцитах, і конкретно S1P4 опосередковує імуносупресорний вплив S1P шляхом інгібування проліферації й секреції ефекторних цитокінів, при посиленні секреції супресорного цитокіну IL10. Див., наприклад, Wang, W. et. al., (2005) FASEB J. 19(12): 1731-3, що повністю включений у дану заявку шляхом посілання. Рецептори S1P типу 5 (S1P5) експресуються винятково в олігодендроцитах і олігодендроцитних клітинах-попередниках (ОКП) і є життєво важливими для клітинної міграції. Стимулювання S1P5 інгібує міграцію олігодендроцитних клітин-попередників, які звичайно мігрують на значні відстані під час розвитку мозку. Див., наприклад, Novgorodov, A. et al., (2007) FASEB J, 21: 1503-1514, що повністю включений у дану заявку шляхом посілання. S1P, як було продемонстровано, викликає багато клітинних процесів, включаючи ті з них, які приводять до агрегації тромбоцитів, клітинної проліферації, клітинної морфології, пухлиноклітинної інвазії, хемотаксісу ендотеліальних клітин і ангіогенезу. Через це, S1P рецептори є гарними мішенями для терапевтичного застосування, такого, як загоєння ран, інгібування росту пухлин і аутоімунні захворювання. Сфінгозин- 1- фосфат передає сигнал клітинам частково за допомогою набору G-білок сполучених рецепторів за назвою S1P1, S1P2, S1P3, S1P4, і S1P5 (раніше EDG1, EDG5, EDG3, EDG6 і EDG8). EDG рецептори є G-білок сполученими рецепторами (GPCRs) і після стимуляції поширюють сигнали вторинного месенджеру за допомогою активації гетеротримірних субодиниць G-білка альфа (Gα) і бета-гама (Gβγ) димерів. Дані рецептори мають 50-55 % ідентичність амінокислотних послідовностей і кластер із трьома іншими рецепторами (LPA 1, LPA2, і LPA3 (раніше EDG2, EDG4 і EDG7) для структурно родинної лізофосфатидної кислоти (LPA). Конформаційні зрушення викликаються G- білок сполученим рецептором (GPCR), якщо ліганд зв'язує даний рецептор, приводячи до заміщення GDP на GTP на α-субодиниці зв'язаних G- білків і наступному вивільненню G- білків у цитоплазму. α-субодиниця потім дисоціює з βγ-субодиниці й кожна субодиниця може потім зв'язуватися з ефекторними білками, що активує вторинні месенджери, приводячи до клітинної відповіді. В остаточному підсумку, GTP на Gбілках гідролізує в GDP і субодиниці G-білків повторно асоціюють один з одним і потім з рецептором. Ампліфікація відіграє головну роль у загальному маршруті GPCR. Зв'язування одного з лігандів з одним рецептором приводить до активації багатьох G-білків, кожний з яких здатний до асоціації з багатьма ефекторними білками, що приводить до посиленої клітинної відповіді. Загалом, сполуки можуть перемикатися від антагоністів до агоністам залежно від того, який з G-білків перебуває нижче рецептора. Якщо Gq перебуває нижче, то сполука, спрямована на рецептор S1P4, може діяти як антагоніст. Можливо, що з іншим G-білком (Gi) нижче, сполукаагоніст може бути агоністом. S1P рецептори являють собою гарні лікарські мішені, оскільки індивідуальні рецептори є як тканино-, так і відповід-специфічними. Тканиноспецифічність S1P рецепторів є бажаної, оскільки розвиток агоністу або антагоністу, селективних для одного рецептора, локалізує клітинну відповідь у тканинах, що містять даний рецептор, обмежуючи небажані побічні ефекти. Відповідь-специфічність S1P рецепторів також є важливою, оскільки дозволяє розвиток агоністів або антагоністів, які ініціюють або придушують певні клітинні відповіді, не впливаючи на інші відповіді. Наприклад, відповідь-специфічність S1P рецепторів може дозволити певну S1P мімікрію, що ініціює агрегацію тромбоцитів, не роблячи впливу на клітинну морфологію. Сфінгозин-1- фосфат утвориться як метаболіт сфінгозину в реакції зі сфінгозин кіназою і зберігається в надлишку в агрегатах тромбоцитів, де присутні високі рівні сфінгозин кінази й відсутня сфінгозин ліаза. S1P вивільняється під час агрегації тромбоцитів, накопичується в 1 UA 107360 C2 5 10 сироватці, і також виявлений у злоякісних асцитах. Оборотний біорозпад S1P, найбільше імовірно, відбувається за допомогою гідролізу за допомогою ектофосфогідролаз, конкретно сфінгозин 1-фосфат фосфогідролази. Необоротний розпад S1P каталізує S1P ліазою, приводячи до одержання етанoламін фосфату й гексадеканалю. Суть винаходу У цей час, існує необхідність у нових, потужних і селективних агентах, які є агоністами S1P рецептору, які мають підвищену ефективність, селективність і пероральну біодоступність. Додатково, у даній області існує необхідність в ідентифікації, а також синтезі й застосуванні таких сполук. В одному аспекті, сполука може мати формулу (I): A2 A3 A1 B1 A7 A8 B2 6 A A (I). 1 2 У формулі (I), A може бути -CX =, -C(X )2-, -N=, -NX -, -O-, -S- або зв'язком; A може бути 2 2 2 3 3 3 3 -CX =, -C(X )2-, -N=, -NX -, -O- або -S-; A може бути -CX =, -C(X )2-, -N=, -NX -, -O-, -S- або 4 4 4 4 5 5 зв'язком; A може бути -CX =, -C(X )2-, -N=, -NX -, -O-, -S- або зв'язком; A може бути -CX =, 5 5 6 6 6 6 7 C(X )2-, -N=, -NX -, -O- або -S-; A може бути -CX =, -C(X )2-, -N=, -NX -, -O-, -S- або зв'язком; A 3 3 f 3 8 f може бути -C(R )=, -C(R R )- або -NR -; і A може бути -C(-W-Cy)=, -C(-W-Cy)(R )- або -N(-W-Cy)-. 1 15 A4 5 CH 1 C 1 N 1 CH 2 C N B може бути , або ; і В може бути , або . 1 3 4 6 1 2 У формулі (I), не більше 1 з A , A , A , і А являє собою зв'язок; B і В обидва не є одночасно N 20 25 30 35 1 8 1 2 ; і не більше 4 атомів циклу A -A і В -B являють собою N, O або S. 1 2 3 4 5 6 Кожний з X , X , X , X , X , і Х , незалежно, може бути воднем, гало, гідрокси, нітро, ціано, алкілом, галоалкілом, циклоалкілом, галоциклоалкілом, алкокси, галоалкокси, циклоалкокси, f g f g, f f g f галоциклоалкокси, ацилом, аміноацилом, -N(R R ), -N(R )SO2R -SO2R , -S(O)2N(R R ), -CO2R , триалкіламіно, арилом або гетероарилом. f g f W може бути -C(R R )-, -N(R )-, -O-, -S-, -S(O)- або -S(O)2-. Cy може бути циклоалкілом, спіроциклоалкілом, циклоалкенілом, спіроциклоалкенілом, гетероциклілом, спірогетероциклілом, арилом або гетероарилом. Cy може бути необов'язково заміщений 1-6 замісниками, вибраними із групи, що складається з гало, гідрокси, нітро, ціано, f g -N(R R ), алкілу, галоалкілу, циклоалкілу, циклоалкенілу, циклоалкілалкілу, циклоалкенілалкілу, гетероциклілалкілу, арилалкілу, гетероарилалкілу, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацилу, циклоалкілацилу, циклоалкенілацилу, гетероциклілацилу, арилацилу, гетероарилацилу, тіоалкілу, алкенілу, алкінілу, циклоалкенілу, гетероциклілу, арилу або гетероарилу. 3 1 2 1, R може бути -L -J-L -T 1 f f f g f g f g L може бути -C(O)-, -S(O)2-, -N(R )C(O)-, -N(R )-, -C(R R )-, -C(R R )-C(R R )- або зв'язком. f g f f g J може бути -[C(R R )]n-, -N(R )-[C(R R )]n- або зв'язком, де кожний n, незалежно, може бути цілим числом від 0 до 5; або J може бути D2 D1 D3 D4 40 45 CRf N 1 3 де кожний з D і D , незалежно, може бути або . 2 f g f g f f g f f f g 4 D може -[C(R R )]k-, -[C(R R )]k-N(R )-, -[C(R R )]k-O-, -N(R )- або -N(R )-[(CR R )]k-. D може f g 1 бути -[C(R R )]m-. k може бути 1 або 2; і m може бути 0, 1, 2 або 3. Не більше 2 атомів циклу D 4 D можуть бути N або O. 2 f g f f g f g f g f f g L може бути -C(R R )-, -C(R G)-, -C(G)2-, -C(R R )-C(R R )-, -C(R R )-C(R G)-, -C(R R )-C(G)2або зв'язком. 1 2 Як мінімум один з L , J, і L може бути іншим, чим зв'язок. 1 f f f f f T може бути -C(O)(OR ), -C(O)N(R )S(O)2R , тетразолілом, -S(O)2OR , -C(O)NHC(O)-R , f f f f f f -Si(O)OH, -B(OH)2, -N(R )S(O)2R , -S(O)2NR , -O-P(O)(OR )OR або -P(O)2(OR ). 2 UA 107360 C2 5 10 15 Кожний G, незалежно, може бути воднем, гідрокси, галогеном або трифторметилом. f Кожний R , незалежно, може бути воднем, гідрокси, гало, алкілом, галоалкілом, алкенілом, алкінілом, циклоалкілом, циклоалкенілом, арилом, гетероарилом, гетероциклілом або NH 2. Кожний з алкілу, циклоалкілу, циклоалкенілу, арилу, гетероарилу й гетероциклу може бути необов'язково заміщений 1-5 замісниками, незалежно вибраними із групи, що складається з гало, оксо, -CN, -CHO, -CG3, -OH, -NO2, алкілу, -OCG3, алкокси, циклоалкокси, циклоалкеноксі, аміно, алкіламіно, діалкіламіно, ациламіно, аміноацилу, алкілсульфонілу, алкіламіносульфонілу або діалкіламіносульфонілу. g Кожний R , незалежно, може бути воднем, гідрокси, гало, алкілом, галоалкілом, алкенілом, алкінілом, циклоалкілом, циклоалкенілом, арилом, гетероарилом або гетероциклілом. Кожний з алкілу, циклоалкілу, циклоалкенілу, арилу, гетероарилу й гетероциклу може бути необов'язково заміщений 1-5 замісниками, незалежно вибраними із групи, що складається з гало, оксо, -CN, -CHO, -CG3, -OH, -NO2, алкілу, -OCG3, алкокси, циклоалкокси, циклоалкеноксі, аміно, алкіламіно, діалкіламіно, ациламіно, аміноацилу, алкілсульфонілу, алкіламіносульфонілу, може бути діалкіламіносульфонілу. Сполука може бути у формі фармацевтично прийнятної солі. C 7 3 8 1 У деяких умовах, A може бути -CR =, A може бути -C(- W- Cy)=, B може бути 6 1 C 1 25 6 C 2 3 7 4 5 -C(- W- Cy)=, B являє собою , B може бути , і А , A , A , і А , може бути, відповідно: 3 3 f 5 3 3 4 5 3 3 f 4 -NX -, -C(R R )-, зв'язком і -C(X )2-; -C(X )2-, -NR -, -C(X )2-, і -C(X )2-; -C(X )2-, -C(R R )-, -NX -, і 5 3 4 5 3 5 3 3 5 3 C(X )2-; -N=, -CR =, -CX =, і -CX =; -N=, -CR =, -N=, і -CX =; -CX =, -CR =, -N=, і -CX =; -N=, -CR =, 4 3 3 4 3 3 3 3 5 -CX =, і -N=; -CX =, -CR =, -CX =, і -N=; -CX =, -CR =, -N=, і -N=; -NX -, -CR =, зв'язком, і -CX =; 3 3 5 или -CX =, -CR =, зв'язком, і -NX -. 3 3 4 4 5 5 7 У деяких умовах, A може бути -CX =, A може бути -CX =, A може бути -CX =, A може бути C 3 30 2 може бути C . З A -A , 0, 1 або 2 атомів циклу A -A може бути N. З атомів, що залишилися, 1 6 1 1 2 2 6 6 циклу A -A кожний може бути C. A може бути -CX =, A може бути -CX =, і А може бути -CX =. 3 3 4 4 5 5 A може бути -CX =, A може бути -CX =, і А може бути -CX =. 1 1 2 2 6 6 8 У деяких умовах, A може бути -CX =, A може бути -CX =, A може бути -CX =, A може бути 1 20 ,іВ 1 2 C 2 1 8 6 2 -CR =, B може бути , B може бути , і А , A , A , і А , може бути, відповідно: -CX =, 1 2 2 1 2 -CX =, -C(-W-Cy), і -N=; -CX =, -N=, -C(-W-Cy), і -N=; -NX -, -CX =, -C(-W-Cy)=, і зв'язком; -NX -, 6 2 6 зв'язком, -C(-W-Cy)=, і -CX =; або -CX =, зв'язком, -C(-W-Cy)=, і -NX -. 1 2 5 8 1 2 3 4 У деяких умовах, кожний атом циклу A , A , A -A і В -B являє собою C, і кожний з A і А 1 f g f являє собою, незалежно, C або N. L може бути -C(R R )- і J може бути -NR - або D2 D1 D3 D4 де 35 40 1 3 N CRf кожний з D і D , незалежно, являє собою або ; 2 f g f g f f g f f f g D являє собою -[C(R R )]k-, -[C(R R )]k-N(R )-, -[C(R R )]k-O-, -N(R )- або -N(R )-[(CR R )]k-; і 4 f g D являє собою -[C(R R )]m-; де k являє собою 1 або 2; і m являє собою 0, 1, 2 або 3; 1 4 f g за умови, що не більше 2 атомів циклу D -D являють собою N або O. Кожний R і R , 1 незалежно, може бути воднем або алкілом. T може бути f 1 f f f f f -C(O)(OR ). T може бути -C(O)N(R )S(O2R ), -O-P(O)(OR )OR , -P(O2)(OR ), тетразолілом або – f 6 6 S(O)2OR . X може бути електроноакцепторною групою. X може бути гало, алкілом або галоалкілом. Кожний G, незалежно, може бути фтором або гідроксі. У деяких умовах, Cy може мати формулу: 3 UA 107360 C2 R1a 1b R Z1 Z3 5 10 15 20 25 30 35 40 2a R2b R . 1 d e d e f Z може бути зв'язком, -[C(R R )]x-, -CR =CR -, -O- або -NR -. 2 d e d e f Z може бути зв'язком, -[C(R R )]y-, -CR =CR -, -O- або -NR -. 3 d e d e f Z може бути зв'язком, -[C(R R )]z-, -CR =CR -, -O- або -NR -. Кожний з x, y, і z, незалежно, може бути 1, 2 або 3. d e Кожний R , і кожний R , незалежно, може бути воднем, гало, гідрокси, алкілом, алкенілом, алкоксі або циклоалкілом. 1a 1b f g R і R , незалежно, може бути воднем, гало, гідрокси, нітро, ціано, -NR R , алкілом, галоалкілом, циклоалкілом, циклоалкенілом, циклоалкілалкілом, циклоалкенілалкілом, гетероциклілалкілом, арилалкілом, гетероарилалкілом, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацилом, циклоалкілацилом, циклоалкенілацилом, гетероциклілацилом, арилацилом, гетероарилацилом, тіоалкілом, алкенілом, алкінілом, циклоалкенілом, гетероциклілом, арилом або гетероарилом. 1a 1b R і R , узяті разом, можуть бути C2-C5 алкіленом або C2-C5 алкеніленом. 2a 2b f g R і R , незалежно, можуть бути воднем, гало, гідрокси, нітро, ціано, -NR R , алкілом, галоалкілом, циклоалкілом, циклоалкенілом, циклоалкілалкілом, циклоалкенілалкілом, гетероциклілалкілом, арилалкілом, гетероарилалкілом, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацилом, циклоалкілацилом, циклоалкенілацилом, гетероциклілацилом, арилацилом, гетероарилацилом, тіоалкілом, алкенілом, алкінілом, циклоалкенілом, гетероциклілом, арилом або гетероарилом. 1a 2a R і R , узяті разом, можуть бути C1-C5 алкіленом або C2-C5 алкеніленом. 1a 1b 2a 2b R , R , R , і R може бути кожний, незалежно, заміщений 0-5 замісниками, вибраними з f g f гало, гідрокси, нітро, ціано, -NR R або -CO2R . 1a 2a 1 2 3 R і R можуть бути обидва воднем. Z може бути -CH2CH2-. Z може бути -CH2-. Z може бути зв'язком. 1b R може бути фтором, хлором, бромом, йодом, метилом, трифторметилом, етилом, пропілом, ізопропілом, н-бутилом, ізо-бутилом, т-бутилом, н-пентилом, ізопентилом, 1,1диметилпропілом, неопентилом, циклопентилом, н-гексилом, циклогексилом, метоксі, трифторметоксі, етоксі, н-пропоксі, ізо-пропоксі, н-бутоксі, ізо-бутоксі, т-бутоксі, н-пентилоксі, ізо-пентилоксі, 1,1-диметилпропоксі, неопентилоксі, циклопентилоксі, н-гексилоксі або циклогексилоксі. 1 d e 2 d e У деяких умовах, W являє собою O, Z являє собою -[C(R R )]x-, Z являє собою -[C(R R )]y-, і 3 d e 2 Z являє собою -[C(R R )]z-. У деяких умовах, X являє собою метил. У деяких умовах, W являє 1 8 1 2 собою -O-. У деяких умовах, кожний атом циклу A -A і В -B являє собою C. У деяких умовах, 1 3 5 8 1 2 4 кожний атом циклу A -A , A -A і В -B являє собою C, і А являє собою N. У деяких умовах, 1 2 4 8 1 2 3 кожний атом циклу A -A , A -A і В -B являє собою C, і А являє собою N. Сполука може бути у вигляді фармацевтично прийнятної солі. 2 2 2 У деяких умовах, A може бути -CX =, і Х являє собою фтор, хлор, бром, метил, дифторметил, трифторметил, етил, пропіл, ізопропіл або бутил. 1 2 2 2 У деяких умовах, A може бути CH; A може бути -CX =, і Х являє собою фтор, хлор, бром, 3 4 метил, дифторметил, трифторметил, етил, пропіл, ізопропіл або бутил. A може бути CH; A 5 6 7 3 8 може бути CH; A може бути CH; A може бути CH; A може бути C(R ); A може бути C(-W-Cy); C 1 45 Z2 2 C B може бути ; і В може бути . 1 2 5 8 1 2 3 4 Кожний атом циклу A , A , A -A і В -B являє собою C, і кожний з A і А являє собою, 1 f g f незалежно, C або N. L може бути -C(R R )- і J може бути -NR - або D2 D1 D3 D4 де 4 UA 107360 C2 5 10 CRf N 1 3 кожний з D і D , незалежно, являє собою або ; 2 f g f g f f g f f f g D являє собою -[C(R R )]k-, -[C(R R )]k-N(R )-, -[C(R R )]k-O-, -N(R )- або -N(R )- [(CR R )]k-; і 4 f g D являє собою -[C(R R )]m-; Що відрізняються тим, що k являє собою 1 або 2; і m являє собою 0, 1, 2 або 3; 1 4 f g за умови, що не більше 2 атомів циклу D -D являють собою N або O. Кожний R і R , 1 f 1 незалежно, може бути воднем або алкілом. T може бути -C(O)(OR ). T може бути f f f f f f 6 -C(O)N(R )S(O2R ), -O-P(O)(OR )OR , -P(O2)(OR ), тетразолілом або –S(O)2OR . X може бути 6 електроноакцепторною групою. X може бути гало, алкілом або галоалкілом. Кожний G, незалежно, може бути фтором або гідроксі. У деяких умовах, Cy може мати формулу: R1a Z1 R1b Z3 15 20 25 30 35 40 45 50 Z2 2a R2b R . 1 d e d e f Z може бути зв'язком, -[C(R R )]x-, -CR =CR -, -O- або -NR -. 2 d e d e f Z може бути зв'язком, -[C(R R )]y-, -CR =CR -, -O- або -NR -. 3 d e d e f Z може бути зв'язком, -[C(R R )]z-, -CR =CR -, -O- або -NR -. Кожний з x, y і z, незалежно, може бути 1, 2 або 3. d e Кожний R і кожний R , незалежно, можуть бути воднем, гало, гідрокси, алкілом, алкенілом, алкоксі або циклоалкілом. 1a 1b f g R і R , незалежно, можуть бути воднем, гало, гідрокси, нітро, ціано, -NR R , алкілом, галоалкілом, циклоалкілом, циклоалкенілом, циклоалкілалкілом, циклоалкенілалкілом, гетероциклілалкілом, арилалкілом, гетероарилалкілом, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацилом, циклоалкілацилом, циклоалкенілацилом, гетероциклілацилом, арилацилом, гетероарилацилом, тіоалкілом, алкенілом, алкінілом, циклоалкенілом, гетероциклілом, арилом або гетероарилом. 1a 1b R і R , узяті разом, можуть бути C2-C5 алкіленом або C2-C5 алкеніленом. 2a 2b f g R і R , незалежно, можуть бути воднем, гало, гідрокси, нітро, ціано, -NR R , алкілом, галоалкілом, циклоалкілом, циклоалкенілом, циклоалкілалкілом, циклоалкенілалкілом, гетероциклілалкілом, арилалкілом, гетероарилалкілом, алкокси, циклоалкілалкокси, циклоалкенілалкокси, гетероциклілалкокси, арилалкокси, гетероарилалкокси, ацилом, циклоалкілацилом, циклоалкенілацилом, гетероциклілацилом, арилацилом, гетероарилацилом, тіоалкілом, алкенілом, алкінілом, циклоалкенілом, гетероциклілом, арилом або гетероарилом. 1a 2a R і R , узяті разом, можуть бути C1-C5 алкіленом або C2-C5 алкеніленом. 1a 1b 2a 2b R , R , R , і R можуть бути кожний, незалежно, заміщений 0-5 замісниками, вибраними з f g f гало, гідрокси, нітро, ціано, -NR R або -CO2R . 1a 2a 1 2 3 R і R можуть бути обидва воднем. Z може бути -CH2CH2-. Z може бути -CH2-. Z може бути зв'язком. 1b R може бути фтором, хлором, бромом, йодом, метилом, трифторметилом, етилом, пропілом, ізопропілом, н-бутилом, ізо-бутилом, т-бутилом, н-пентилом, ізопентилом, 1,1диметилпропілом, неопентилом, циклопентилом, н-гексилом, циклогексилом, метоксі, трифторметоксі, етоксі, н-пропоксі, ізо-пропоксі, н-бутоксі, ізо-бутоксі, т-бутоксі, н-пентилоксі, ізо-пентилоксі, 1,1-диметилпропоксі, неопентилоксі, циклопентилоксі, н-гексилоксі або циклогексилоксі. 1 d e 2 d e У деяких умовах, W являє собою O, Z являє собою -[C(R R )]x-, Z являє собою -[C(R R )]y-, і 3 d e 2 Z являє собою -[C(R R )]z-. У деяких умовах, X являє собою метил. У деяких умовах, W являє собою -O-. В іншому аспекті, фармацевтична композиція містить фармацевтично прийнятний носій і сполуку формули (I), як визначено вище. В іншому аспекті, спосіб профілактики або лікування патологічного стану або симптому в ссавця, де задіяна активність рецепторів сфінгозин 1-фосфату й агонізм такої активності є бажаним, включає введення зазначеному ссавцеві ефективної кількості сполуки формули (I). В іншому аспекті, спосіб профілактики або лікування патологічного стану або симптому в ссавця, де задіяна активність S1P ліази й бажаним є інгібування S1P ліази, включає введення зазначеному ссавцеві ефективної кількості сполуки формули (I). В іншому аспекті, спосіб профілактики або лікування патологічного стану або симптому в 5 UA 107360 C2 5 10 15 20 ссавця, де задіяна активність рецепторів сфінгозин 1-фосфату й бажаним є антагонізм такої активності, включає введення зазначеному ссавцеві ефективної кількості сполуки формули (I). В іншому аспекті, патологічним станом може бути розсіяний склероз, аутоімунні захворювання, хронічні запальні розлади, астма, запальні нейропатії, артрит, трансплантація, хвороба Крона, виразковий коліт, червоний вовчак, псоріаз, ішемічно-реперфузійне ушкодження, солідні пухлини, метастази пухлин, захворювання, пов'язані з ангіогенезом, судинні захворювання, больові стани, гострі вірусні захворювання, запальні захворювання кишечника, інсулінозалежний або інсуліннезалежний діабет, інгібована клітинна міграція, надмірна проліферація й секреція ефекторних цитокінів або відсутність секреції супресорного цитокіну IL-10. В іншому аспекті, сполука проявляє S1P1 агоністичну дію. В іншому аспекті, сполука проявляє S1P1 агоністичну дію й в істотному ступені не має S1P3 агоністичної й антагоністичної дії. В іншому аспекті, сполука проявляє S1P5 антагоністичну дію. В іншому аспекті, сполука проявляє S1P5 агоністичну дію. В іншому аспекті, сполука проявляє S1P4 антагоністичну дію. В іншому аспекті, сполука проявляє S1P4 агоністичну дію. В іншому варіанті виконання, дане винахід спрямований на приклади, що мають формулу (I), їх фармацевтично прийнятні солі або якщо приклад, що має формулу (I), є сіллю, вільною основою даної солі. Сполука формули (I) може бути сполукою формули (IIa)-(IId): X2 (X3)2 X2 X3 1 1 3 X R3 X R Rf X4 Cy-W X6 X4 Cy-W X6 X5 (IIb) (IIa) X2 X2 X3 X1 (X4)2 Cy-W (X3)2 X1 R3 X6 X5 R3 Rf (X4)2 Cy-W 6 (X5)2 X 5 (X )2 (IId) (IIc) ; сполукою формули (IIIa)-(IIIg): X2 X1 X2 Cy-W X6 R3 X1 X4 N Cy-W X5 N N Cy-W 6 X X5 X2 X1 R3 Cy-W N N X6 (IIIe) N X1 N R3 (X4)2 Cy-W 6 5 X (X )2 (IIIf) сполукою формули (IVa)-(IVc): 6 X4 6 X X (IIId) X2 (X3)2 R3 N Cy-W 5 (IIIc) X2 X3 X1 R3 N (IIIb) (IIIa) 25 X1 R3 X6 X2 X2 X3 (X3)2 1 R3 Rf X N Cy-W 6 X X4 5 (X )2 (IIIg) ; UA 107360 C2 X2 X2 X3 N 1 X 1 X R3 X X N X5 Cy-W 5 6 X3 N 1 X R3 Cy-W X2 X3 6 X R3 Rf Cy-W (IVb) (IVa) (X5)2 X6 (IVc) ; сполукою формули (Va)-(Vc): X2 X2 X3 X1 Cy-W X4 X3 R3 3 R3 N X2 X3 R N Cy-W X4 N N 6 X X5 X5 X 5 (Vc) (Vb) (Va) X4 Cy-W ; або сполукою формули (VIa)-(VIc): X2 N X3 X3 X2 N R3 5 10 15 20 25 30 35 X X (VIa) R3 Cy-W 4 4 X5 X3 R3 X1 Cy-W X6 X2 Cy-W X5 (VIb) N X6 X4 X5 (VIc) . У деяких умовах, сполука має формулу (IIa), (IIIa) або (IIIb). Докладний опис одного або більше варіантів виконання винаходу викладено в описі, що додається, наведеному нижче. Інші ознаки, об'єкти й переваги будуть очевидні з опису й формули винаходу. Докладний опис винаходу У даній заявці використовують наступні скорочення: S1P, сфінгозин-1-фосфат; S1P1- 5, S1P рецептор типів 1-5; GPCR, G-білок сполучений рецептор; ССА, співвідношення структураактивність; ГДЕ, ген диференціації ендотеліальних клітин; ЕАЕ, експериментальний аутоімунний енцефаломієліт; ДНО, діабет, не пов'язаний з ожирінням; TNFα, фактор некрозу пухлин альфа; ЛПВ, ліпопротеїн високої щільності; і RТ-ПЦР, ревертазна полімеразна ланцюгова реакція. Значення, перераховані нижче, для радикалів, замісників і діапазонів, наведені тільки для ілюстрації; вони не виключають інші певні значення або інші значення, які перебувають у певних діапазонах для радикалів і замісників. Описані сполуки включають сполуки формули I, що мають будь-яку комбінацію значень, конкретних значень, більше конкретних значень і переважних значень, описаних у даній заявці. Термін "галоген" або "гало" включає бром, хлор, фтор, і йод. Термін "галоалкіл" відноситься до алкільного радикала, що містить принаймні один галогеновий замісник, що не обмежують приклади включають, не обмежуючись наведеним, хлорметил, фторетил, трихлорметил або трифторметил і т.п. Термін "C1-C20 алкіл" відноситься до розгалуженої або лінійної алкільної групи, що має від одного до двадцяти атомів вуглецю. Необмежуючі приклади включають, не обмежуючись наведеним метил, етил, н-пропіл, ізо-пропіл, бутил, ізо-бутил, втор-бутил, трет-бутил, пентил, гексил, гептил, ороктил й т.п. Термін "C2-C20 алкеніл", відноситься до олефіно ненасиченої розгалуженої або лінійної групи, що має від одного до двадцяти атомів вуглецю і принаймні один подвійний зв'язок. Типово, C2-C20 алкенільні групи включають, не обмежуючись наведеним, 1-пропеніл, 2-пропеніл, 1, 3-бутадієніл, 1-бутеніл, гексеніл, пентeніл, гексеніл, гептеніл або октеніл і т.п. Терміном (C2-C20)алкініл може бути етиніл, 1-пропиніл, 2-пропиніл, 1-бутиніл, 2-бутиніл, 3бутиніл, 1-пентиніл, 2-пентиніл, 3-пентиніл, 4-пентиніл, 1- гексиніл, 2-гексиніл, 3-гексиніл, 4гексиніл або 5-гексиніл і т.п. Термін “(C1-C10)алкоксі" відноситься до алкільної групи, приєднаної через атом кисню. Прикладуми (C1-C10)алкоксі можуть бути метоксі, етоксі, пропоксі, ізопропоксі, бутоксі, ізобутоксі, втор-бутоксі, пентоксі, 3-пентоксі або гексилоксі й т.п. 7 UA 107360 C2 5 10 15 20 25 30 35 40 45 50 55 Термін “(C3-C12)циклоалкіл" відноситься до циклічної алкільної групи, такої, як, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил або циклооктіл і т.п. Циклоалкільні групи включають біциклічні групи, такі, як декалиніл, місткові біциклічні групи, такі, як норборнил або біцикло[2,2,2]октіл, трициклічні, місткові трициклічні, такі, як адамантил або спіро-зв'язані біциклічні або трициклічні групи. Термін “(C6-C14)арил" відноситься до моноциклічної, біциклічної або трициклічної карбоциклічної системи, що має один або два ароматичних цикли, включаючи, але не обмежуючись наведеним, феніл, бензил, нафтил, тетрагідронафтил, інданил, інденіл або антрацил і т.п. Термін "арил(C1-C20)алкіл" або "арилалкіл" або "аралкіл" відноситься до алкільної групи, заміщеної моно- або біциклічною карбоциклічною системою циклу, що містить один або два ароматичних цикли, включаючи таку групу, як феніл, нафтил, тетрагідронафтил, інданил або інденіл і т.п. Необмежуючі приклади арилалкілів включають бензил або фенілетил і т.п. Термін “(C1-C14)гетероциклічна група" відноситься до необов'язково заміщеної моно- або біциклічної карбоциклічної системи циклу, що містить один, два, три або чотири гетероатоми (необов'язково в кожному циклі), де гетероатомами є кисень, сірка й азот. Термін “(C4-C14)гетероарил" відноситься до необов'язково заміщеної моно- або біциклічної циклічної системи, що містить один, два або три гетероатома (необов'язково в кожному циклі), де гетероатомами є кисень, сірка або азот. Необмежуючі приклади гетероарильних груп включають фурил, тієніл або піридил і т.п. Термін "фосфатний аналог" і "фосфонатний аналог" включають аналоги фосфату й фосфонату, де атом фосфору має ступінь окислювання +5 і один або більше атомів кисню заміщені не-кисневмісним фрагментом, включаючи, наприклад, фосфатні аналоги фосфоротіоат, фосфородитіоат, фосфороселеноат, фосфородиселеноат, фосфороанілотіоат, фосфоранілідат, фосфорамідат або боронофосфати й т.п., включаючи зв'язані протиіони, + + + + наприклад, H , NH4 , Na або K і т.п., якщо такі протиіони присутні. Термін "альфа-заміщений фосфонат" включає фосфонатні (-CH2PO3H2) групи, заміщені на альфа-атомі вуглецю, наприклад -CHFPO3H2, -CF2PO3H2, -CHOHPO3H2 або -C=OPO3H2) і т.п. Термін "фармацевтично прийнятний носій" включає кожний зі стандартних фармацевтичних носіїв, наприклад, фосфатний буферний сольовий розчин, гідроксіпропіл бета-циклодекстрини (HO-пропіл бета циклодекстрини), воду, емульсії, такі, як емульсії типу масло/вода або вода/масло, і різні типи змочувальних агентів. Термін також охоплює кожні з агентів, затверджених регуляторним органом Федерального уряду США або перерахованих у Фармакопеї США для застосування у тварин, включаючи людей. Термін "фармацевтично прийнятна сіль" відноситься до солей, які зберігають біологічну ефективність і властивості описаних сполук, і які не є біологічно або іншим способом небажаними. У багатьох випадках, описані сполуки здатні утворювати кислотні або основні солі в силу присутності аміно або карбоксильних груп або груп, аналогічних їм. Термін "проліки" відноситься до сполуки, що перетворюється у фізіологічних умовах, наприклад, шляхом сольволізу або метаболічно, у сполуку, що є фармацевтично активну, наприклад, сполуку формули (I). Проліки можуть бути похідними сполуки формули (I), що містить ефір карбонової або фосфорної кислоти або амідний фрагмент, що може бути розщеплене у фізіологічних умовах. Проліки, що містять такий фрагмент, можуть бути отримані відповідно до традиційних процедур, наприклад, шляхом обробки сполуки відповідно до даного винаходу, що містить аміно, амідо або гідроксильний фрагмент, прийнятним агентом, що дериватизує, наприклад, галідом карбонової або фосфорної кислоти або ангідридом або шляхом перетворення карбоксильного фрагмента в складний ефір або амід. Метаболіти сполук формули (I) можуть бути також фармацевтично активними. "Ефективна кількість" означає кількість, достатню для одержання вибраного ефекту. Наприклад, ефективна кількість агоністу S1P рецептора являє собою кількість, що знижує клітинну сигнальну активність S1P рецептора. Описані сполуки можуть містити один або більше асиметричних центрів у молекулі. Відповідно до даного винаходу будь-яка структура, що не позначає стереохімію, повинна матися на увазі як та, що охоплює всі різні оптичні ізомери (наприклад, діастереоміри й енантіоміри), а також їхні суміші (такі, як рацемічна суміш). Сполуки можуть бути ізотопноміченими сполуками, наприклад, сполуками, що містять різні ізотопи водню, вуглецю, азоту, кисню, фосфору, фтору, йоду або хлору. Описані сполуки можуть існувати в таутомірних формах, і даний винахід включає як суміші, так і окремі індивідуальні таутоміри. Наприклад, наступна структура: 8 UA 107360 C2 HN N мається на увазі як суміш структур: HN 5 10 15 20 25 30 35 40 45 50 N N NH , а також . "S1P агент, що модулює, ” відноситься до сполуки або композиції, здатним викликати зміни, що детектують активності S1P рецептора in vivo або in vitro (наприклад, принаймні 10 % зростання або зменшення S1P активності відповідно до вимірів у даному аналізі, такому, як біоаналіз, описаний у прикладух, і відомим у даній області. "S1P рецептор" відноситься до всіх підтипів S1P рецепторів (наприклад, S1P рецептори S1P1, S1P2, S1P3, S1P4 або S1P5), якщо не зазначений конкретний підтип. Фахівець у даній області оцінить, що описані сполуки, що мають хіральні центри, можуть існувати й бути виділені в необов'язково активних й рацемічних формах. Повинне бути зрозуміло, що описані сполуки охоплюють будь-яку рацемічну, необов'язково активну або стереоізомерну форму або їхнії суміші. З рівня техніки відомо, яким чином одержувати такі необов'язково активні форми (наприклад, розділення рацемічної форми за допомогою методів рекристалізації, синтез із необов'язково-активних вихідних матеріалів, за допомогою хірального синтезу або хроматографічного поділу з використанням хіральної нерухливої фази) і як визначати активність у якості S1P агоніста за допомогою стандартних тестів, описаних у даній заявці або за допомогою інших аналогічних тестів, добре відомих у даній області. Додатково, деякі сполуки можуть проявляти поліморфізм. Можливе застосування агоніста S1P рецептора, і селективних агоністів рецепторів типу S1P1 зокрема, включає, не обмежуючись наведеним, профілактику або лікування патологічного стану або симптому в ссавця. Наприклад, стан може включати астму, запальні нейропатії, артрит, червоний вовчак, псоріаз, ішемічно-реперфузійне ушкодження, солідні пухлини, метастази пухлин, захворювання, пов'язані з ангіогенезом, судинні захворювання, больові стани, гострі вірусні захворювання або інсулінозалежний або інсулінонезалежний діабет. Стан може змінювати рух лімфоцитів як спосіб лікування нейропатичного болю, болю, викликаного запаленням (наприклад, якщо задіяні простагландіни) або лікування аутоімунних патологій, таких, як увеїт, діабет I типу, ревматоїдний артрит, хронічні запальні розлади, запальні захворювання кишечника (наприклад, хвороба Крона й виразковий коліт), розсіяний склероз, і стенти з лікарським покриттям. Додаткове застосування може включати лікування дегенеративних захворювань мозку, захворювань серця, ракових захворювань або гепатиту C. Див., наприклад, WO 2005/085295, WO 2004/010987, WO 03/097028, і WO 2006/072562, кожна з яких повністю включена шляхом посілання. Клас сполук - агоністів S1P - описаний у попередній заявці США № 60/956,111, поданої 15 серпня 2007 р., і в заявці PCT/US2008/073378, поданої 15 серпня 2008 р., кожна з яких повністю включена шляхом посілання. Можливе застосування антагоніста S1P рецептора, і зокрема селективних антагоністів рецепторів типу S1P5, включає, не обмежуючись наведеним, профілактику або лікування патологічного стану або симптому в ссавця. Наприклад, стан може включати інгібовану клітинну міграцію олігодендроцитних клітин-попередників (ОКП). В іншому прикладі, селективний антагоніст рецептора типу S1P5 може не викликати лімфопенію, таким чином, досягаючи часткової ефективності без імуносупрессії. Можливе застосування антагоніста S1P рецептора, і зокрема селективних антагоністів рецепторів типу S1P4 включає, не обмежуючись наведеним, профілактику або лікування патологічного стану або симптому в ссавця. "Лікування" розсіяного склерозу включає лікування різних форм захворювання, включаючи зворотньо-ремітуючу, хронічно прогресуючу, і агоністи/антагоністи S1P рецептора можуть бути застосовані окремо або в сполученні з іншими агентами для полегшення ознак і симптомів захворювання, а також як профілактика. Додатково, описані сполуки можуть бути застосовані для зміни руху лімфоцитів як спосіб пролонгування аллотрансплантатної виживаності, наприклад трансплантації, включаючи трансплантати твердих органів, лікування захворювання "трансплантат проти хазяїна", трансплантації кісткового мозку й т.п. Додатково, описані сполуки можуть бути застосовані для інгібування аутотаксину. Аутотаксин, фосфодієстераза плазми, як було продемонстровано, перетерплюють інгібування кінцевого продукту. Аутотаксин гідролізує кілька субстратів з одержанням лізофосфатидінової 9 UA 107360 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоти й сфінгозин 1-фосфат, і був задіяний у розвитку раку й ангіогенезу. Тому, проліки описаних сполук - агоністи S1P рецептора - можуть бути застосовані для інгібування аутотаксину. Дана активність може сполучатися з агонізмом при S1P рецепторах або може бути незалежною від такої активності. Описані сполуки можуть бути корисними для інгібування сфінгозин кінази (тобто, сфінгозин кінази I, сфінгозин кінази II або обох). Сфінгозин кіназа являє собою внутрішньоклітинний фермент, що каталізує утворення S1P зі сфінгозину й нуклеотидтрифосфату (наприклад, ATФ). Інгібування сфінгозин кінази може зменшувати утворення S1P і в такий спосіб зменшувати поставку S1P, доступного для активування сигналізації при S1P рецепторах. Відповідно, інгібітори сфінгозин кінази можуть бути корисними при модулюванні функції імунної системи. Тому, описані сполуки можуть бути застосовані для інгібування сфінгозин кінази. Таке інгібування може бути спільним з S1P рецепторною активністю або бути незалежним від активності при будь-якому S1P рецепторі. Додатково, описані сполуки можуть бути корисними для інгібування S1P ліази. S1P ліаза є внутрішньоклітинним ферментом, що необоротно розкладає S1P. Інгібування S1P ліази руйнує рух лімфоцитів із супутньою лімфопенією. Відповідно, інгібітори S1P ліази можуть бути корисними при модулюванні функції імунної системи. Тому, описані сполуки можуть бути застосовані для інгібування S1P ліази. Таке інгібування може бути спільним з S1P рецепторною активністю або бути незалежним від активності при будь-якому S1P рецепторі. Додатково, описані сполуки можуть бути корисними у якості антагоністів каннабіноїдного CB1 рецептора. CB1 антагонізм пов'язаний зі зменшенням маси тіла й поліпшенням ліпідних профілів крові. CB1 антагонізм може бути спільним з S1P рецепторною активністю або бути незалежним від активності при будь-якому S1P рецепторі. Додатково, описані сполуки можуть бути корисними для інгібування групи IVA цитозольних PLA2 (cPLA2). cPLA2 каталізує вивільнення ейкозанових кислот (наприклад, арахідонової кислоти). Ейкозанові кислоти перетворюються в прозапальні ейкозаноїди, такі, як простагландіни й лейкотрієни. Таким чином, описані сполуки можуть бути корисними в якості протизапальних агентів. Таке інгібування може бути спільним з S1P рецепторною активністю або бути незалежним від активності при будь-якому S1P рецепторі. Додатково, описані сполуки можуть бути корисними для інгібування багатосубстратної ліпідної кінази (MuLK). MuLK у високому ступені експресуються в багатьох людських пухлинних клітинах і тому її інгібування може сповільнювати рост або розподіл пухлин. Фармацевтичні композиції можуть містити сполуки формули I. Більш конкретно, такі сполуки можуть бути складені як фармацевтичні композиції за допомогою стандартних фармацевтично прийнятних носіїв, наповнювачів, солюбілізуючих агентів і стабілізаторів, відомих фахівцям у даній області. Наприклад, фармацевтичну композицію, що містить сполуки формули I або його сіль, аналог, похідні або модифікацію, як описано в даній заявці, використовують для введення відповідної сполуки суб'єктові. Сполуки формули I є корисними для лікування захворювання або розладу, включаючи введення суб'єктові, що потребує в цьому, терапевтично прийнятної кількості сполуки формули I або фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули I, і фармацевтично прийнятний носій. Описані сполуки й спосіб спрямовані на аналоги сфінгозин 1-фосфату (S1P), які мають активність у якості агоністів рецепторів або антагоністів рецепторів на одному або більше S1P рецепторах, конкретно S1P1, S1P4 або S1P5 типах рецепторів. Описані сполуки й спосіб включають обидву сполуки, що містять фосфатний фрагмент, а також сполуки з резистентними до гідролізу фосфатними сурогатами, такі, як фосфонати, альфа-заміщені фосфонати (особливо, де альфа заміщення є галогеном) або фосфотіонати. У випадках, коли сполуки формули I є досить основними або кислотними, утворюючи стабільні нетоксічні кислі або основні солі, одержання й введення сполук у вигляді фармацевтично прийнятних солей може бути прийнятним. Приклади фармацевтично прийнятних солей являють собою органічні сол, і приєднання кислот, утворені з кислотами, що утворюють фізіологічно прийнятний аніон, наприклад, тозілат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α -кетоглутарат або α -гліцерофосфат. Можуть бути також утворені неорганічні солі, включаючи гідрохлоридні, сульфатні, нітратні, бікарбонатні і карбонатні солі. Фармацевтично прийнятні солі можуть бути отримані за допомогою стандартних процедур, добре відомих у даній області, наприклад, шляхом реакції досить основної сполуки, такої, як амін, із прийнятною кислотою, з одержанням фізіологічно прийнятного аніона. Також можуть бути отримані солі карбонових кислот лужних металів (наприклад, натрію, калію або літію) або 10 UA 107360 C2 5 10 15 20 25 30 35 40 45 50 55 60 лужноземельних металів (наприклад, кальцію). Фармацевтично прийнятні основні солі приєднання можуть бути отримані з неорганічних і органічних основ. Солі з неорганічних солей, включають, не обмежуючись наведеним, солі натрію, калію, літію, амонію, кальцію або магнію. Солі, отримані з органічних основ, включають, не обмежуючись наведеним, солі первинних, вторинних або третинних амінів, наприклад, алкіламінів, діалкіламінів, триалкіламінів, заміщених алкіламінів, ди(заміщених алкіл)амінів, три(заміщених алкіли)амінів, алкеніламінів, диалкеніламінів, триалкеніламінів, заміщених алкеніламінів, ди(заміщених алкеніл)амінів, три(заміщених алкеніл)амінів, циклоалкіламінів, ди(циклоалкіл)амінів, три(циклоалкіл)амінів, заміщених циклоалкіламінів, дизаміщених циклоалкіламінів, тризаміщених циклоалкіламінів, циклоалкеніламінів, ди(циклоалкеніл)амінів, три(циклоалкеніл)амінів, заміщених циклоалкеніламінів, дизаміщених циклоалкеніламінів, тризаміщених циклоалкеніламінів, ариламінів, диариламінів, триариламінів, гетероариламінів, дигетероариламінів, тригетероариламінів, гетероциклічних амінів, дигетероциклічних амінів, тригетероциклічних амінів або змішаних ди- і три-амінів, де принаймні обидва із замісників на аміни є різними і є алкілом, заміщеним алкілом, алкенілом, заміщеним алкенілом, циклоалкілом, заміщеним циклоалкілом, циклоалкенілом, заміщеним циклоалкенілом, арилом, гетероарилом або гетероциклом і т.п. Також включені аміни, у яких два або три замісники, разом з азотом аміногрупи, утворюють гетероциклічну або гетероарильну групу. Необмежуючі приклади амінів включають ізопропіламін, триметил амін, диетиламін, три(ізо-пропіл)амін, три (н-пропіл)амін, етанoламін, 2-диметиламіноетанoл, трометамін, лізин, аргінін, гістидин, кофеїн, прокаїн, гідрабамін, холін, бетаїн, етилeндиамін, глюкозамін, N-алкілглюкаміни, теобромін, пурини, піперазин, піперидин, морфолін або N-етилпіперидин і т.п. Також повинне бути зрозуміло, що корисними можуть бути інші похідні карбонових кислот, наприклад, аміди карбонових кислот, включаючи карбоксаміди, нижні алкіл карбоксаміди або діалкіл карбоксаміди й т.п. Сполуки формули I можуть бути складені як фармацевтичні композиції й уведені хазяїновіссавцеві, такому, як людський пацієнт, у вигляді безлічі форм, адаптованих для вибраного маршруту введення, наприклад, перорально або парентерально, у вигляді очних крапель, внутрішньовенними, внутрім'язовими, місцевими або підшкірними маршрутами. Тому дані сполуки можуть бути уведені системно, наприклад, перорально, у комбінації з фармацевтично прийнятним носієм, таким, як інертний розріджувач або засвоюваний їстівний носій. Вони можуть бути укладені у тверді або м'які желатинові капсули, можуть бути спресовані в таблетки або включені в їжу дієти пацієнта. Для перорального терапевтичного введення, активна сполука може бути скомбінована з одним або більше ексципієнтів і застосовано у вигляді проковтуваних таблеток, буккальних таблеток, коржів, капсул, еліксирів, суспензій, сиропів або пластинок і т.п. Такі композиції й препарати повинні містити принаймні приблизно 0,1 % активної сполуки. Процентний вміст композицій і препаратів може, звичайно, варіюватися, і може традиційно становити від приблизно 2 до приблизно 60 % маси даної стандартної лікарської форми. Кількість активної сполуки в таких терапевтично корисних композиціях є такою, що буде отриманий ефективний рівень дозувань. Таблетки, пастилки, пігулки, капсули й т.п., можуть також містити наступне: агенти зв'язування, такі, як трагакантова камедь, гумміарабік, кукурудзяний крохмаль або желатин; ексципієнти, такі, як дикальцій фосфат; агент розпаду, такий, як кукурудзяний крохмаль, картопляний крохмаль, альгінова кислота й т.п.; речовина, що змазує, така, як стеарат магнію; і підсолоджувач, наприклад, сахароза, фруктоза, лактоза або аспартам або може бути доданий ароматизатор, наприклад, перцева м'ята, масло вінтергрена або вишневий ароматизатор. Якщо стандартною лікарською формою є капсула, вона може містити, додатково до речовин зазначеного вище типу, рідкий носій, такий, як рослинне масло або поліетиленгліколь. Різні інші матеріали можуть бути присутнім у вигляді покриттів або для іншої модифікації фізичної форми твердої стандартної лікарської форми. Наприклад, таблетки, пігулки або капсули можуть бути покриті желатином, воском, шелаком або цукром і т.п. Сироп або еліксир можуть містити активні сполуки, сахарозу або фруктозу в якості підсолоджувача, метил або пропілпарабени як консерванти, барвник і ароматизатор, такого, як вишневий або апельсиновий ароматизатор. Звичайно, будь-яка речовина, використовувана при одержанні стандартної лікарської форми, повинна бути фармацевтично прийнятною і істотно нетоксічною у застосованих кількостях. Додатково, активна сполуки може бути включена в препарати й пристрої з уповільненим вивільненням. Активна сполука може бути також уведена внутришньовенно або інтраперітонеально шляхом інфузії або ін'єкції. Розчини активної сполуки чи її солі можуть бути отримані у воді, необов'язково змішані з нетоксічною поверхнево-активною речовиною. Дисперсії можуть бути також отримані в гліцерині, рідких поліетиленгліколях, триацетині, і їхніх сумішах і в маслах. У 11 UA 107360 C2 5 10 15 20 25 30 35 40 45 50 55 60 звичайних умовах зберігання й застосування, такі препарати містять консервант для попередження росту мікроорганізмів. Ілюстративні фармацевтичні лікарські форми для ін'єкцій або інфузій можуть містити стерильні водяні розчини або дисперсії або стерильні порошки, що містять активний інгредієнт, адаптований для препаратів негайного прийому стерильних розчинів або дисперсій для ін'єкцій або інфузій, необов'язково інкапсульованих у ліпосомах. У всіх випадках, підсумкова лікарська форма повинна бути стерильною, текучою і стабільною в умовах виробництва й зберігання. Рідкий носій або основа можуть бути розчинником або рідким дисперсійним середовищем, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь, рідкі поліетиленгліколі й т.п.), рослинні масла або нетоксічні гліцеринові ефіри і їхні суміші. Належна плинність може бути підтримана, наприклад, шляхом утворення ліпосом, шляхом підтримкMи необхідного розміру часток у випадку дисперсій або шляхом використання поверхнево-активних речовин. Запобігання дії мікроорганізмів може бути зроблені за допомогою різних антибактеріальних і протигрибкових агентів, наприклад, парабенів, хлорбутанoлу, фенолу, сорбінової кислоти або тімеросала й т.п. У багатьох випадках буде переважним включити ізотонічні агенти, наприклад, цукри, буфери або хлорид натрію. Пролонговане поглинання композицій для ін'єкцій може бути здійснене шляхом застосування композицій агентів, що сповільнюють поглинання, наприклад, моностеарату алюмінію або желатину. Стерильні розчини для ін'єкцій одержують шляхом включення активної сполуки в необхідній кількості у відповідний розчинник з різними іншими інгредієнтами, перерахованими вище, у міру необхідності, з наступною стерилізацією фільтруванням. У випадку стерильних порошків для одержання стерильних розчинів для ін'єкцій, переважними способами одержання є методи сушіння у вакуумі й ліофільному очищенні, у результаті яких одержують порошок активного інгредієнта плюс будь-який додатковий бажаний інгредієнт, що є присутнім у попередньо стерильно-відфільтрованих розчинах. Для місцевого введення, дані сполуки можуть бути нанесені в чистих формах, наприклад, якщо вони є рідинами. Однак, у загальному буде бажаним уводити їх у шкіру у вигляді композицій або складів з дерматологічно прийнятним носієм, що може бути твердим або рідким. Ілюстративні тверді носії включають тонкодисперсні тверді речовини, такі, як тальк, глина, мікрокристалічна целюлоза, кремнезем, диоксид алюмінію й т.п. Корисні рідкі носії включають воду, спирти або гліколи або суміші вода-спирт/гліколь, у яких дані сполуки можуть бути розчинені або дисперговані на ефективних рівнях, необов'язково за допомогою нетоксічних поверхнево-активних речовин. Для оптимізації властивостей для даного застосування можуть бути додані ад'юванти, такі, як віддушки, і додаткові антимікробні агенти. Отримані в результаті рідкі композиції можуть бути нанесені з гігроскопічних прокладок, використані для просочування бандажів і інших пов'язок або розпилені на уражену ділянку за допомогою помпових або аерозольних спреїв. Також можуть бути використані загусники, такі, як синтетичні полімери, жирні кислоти, солі або ефіри жирних кислот, жирні спирти, модифіковані целюлози або модифіковані мінеральні речовини з рідкими носіями з утворенням паст, що розпорошуються, гелів, мазей, мил і т.п., для нанесення безпосередньо на шкіру користувача. Приклади корисних дерматологічних композицій, які можуть бути застосовані для доставки сполук формули I у шкіру відомі з рівня техніки; наприклад, див. Jacquet et al. (патент США № 4608392), Geria (патент США № 4992478), Smith et al. (патент США № 4559157) і Wortzman (патент США № 4820508), кожний з яких повністю включений шляхом посілання. Корисні дозування сполук формули I можуть бути визначені шляхом порівняння їхньої активності in vitro, і активності in vivo у тваринних моделях. Способи екстраполювання ефективних дозувань у мишей, і інших тварин, для людей, відомі в даній області; наприклад, див. патент США № 4938949, що повністю включений шляхом посілання. Загалом, концентрація сполуки(к) формули I у рідкій композиції, наприклад, лосьйоні, буде становити від приблизно 0,1 до приблизно 25 масових відсотків, переважно від приблизно 0,510 масових відсотків. Концентрація в напівтвердій або твердій композиції, таких, як гель або порошок, складає приблизно 0,1-5 мас. %, переважно приблизно 0,5-2,5 масових відсотків, виходячи із загальної маси композиції. Кількість сполуки або його активної солі або похідного, необхідного для використання при лікуванні, буде варіюватися не тільки залежно від конкретної вибраної солі, але також залежно від маршруту введення, характеру стану, що лікують і віку й стану пацієнта, і буде, в остаточному підсумку, прийнято по розсуду лікаря або клініциста. Загалом, однак, доза буде перебувати в діапазоні від приблизно 0,1 до приблизно 10 мг/кг маси тіла в день. Сполуки традиційно вводять у стандартній лікарській формі; наприклад, що містить 0,01-10 12 UA 107360 C2 5 10 15 20 25 30 35 40 45 мг або 0,05-1 мг, активного інгредієнта на стандартну лікарську форму. У деяких варіантах виконання, прийнятної є доза 5 мг/кг або менш. Ідеально, активний інгредієнт повинен бути уведений для досягнення пікових концентрацій у плазмі активного інгредієнта від приблизно 0,5 до приблизно 75 мкM, переважно, приблизно 150 мкM, найбільше переважно, від приблизно 2 до приблизно 30 мкM. Цього можна досягти, наприклад, шляхом внутрішньовенної ін'єкції 0,05-5 % розчину активного інгредієнта, необов'язково в сольовому розчині або перорального введення у вигляді болюсу, що містить приблизно 1-100 мг активного інгредієнта. Бажані рівні в крові можуть підтримуватися за допомогою безперервної інфузії із забезпеченням приблизно 0,01-5,0 мг/кг/година або за допомогою періодичних інфузій, що містять приблизно 0,4-15 мг/кг активного інгредієнта(ів). Бажана доза може бути традиційно представлена у вигляді одинарної дози або у вигляді розділених доз, що вводяться через відповідні інтервали, наприклад, як дві, три, чотири або більше суб-доз в день.Суб-доза сама по собі може бути додатково розділена, наприклад, на ряд дискретних вільним образом розділених введень; у вигляді безлічі інгаляцій з інсуффлятору або шляхом нанесення безлічі крапель в око. Описаний спосіб включає набір, що містить сполуки формули I і матеріал інструкцій, що описує введення сполуки або композиції, що містить сполуки, у клітину або суб'єктові. Це повинне бути витлумачено як те, що включає інші варіанти виконання наборів, відомих фахівцям у даній області, наприклад, набір, що містить (переважно стерильний) розчинник для розчинення або супендування сполуки або композиції перед введенням сполуки або композиції в клітину або суб'єктові. Переважно, суб'єктом є людина. Сполуки можуть мати значення EC50 від 5 нМ до 3 мкM при дії в якості агоністів для S1P1 рецепторів. У той час як EC50 певних сполук, що діють у якості агоністів S1P1 і S1P3 рецепторів може перевищувати 5000 нМ, такого ж сполуки можуть мати значення EC 50 0,2 нМ - 700 нМ при дії як селективних антагоністів для S1P5 рецепторів і 50 нМ – 3 мкM при дії як селективних антагоністів для S1P4 рецепторів. Відповідно до описаних сполук і способами, як описано вище або як обговорено в Прикладух нижче, можуть бути застосовані традиційні хімічні, клітинні, гістохімічні, біохімічні, молекулярнобіологічні, мікробіологічні й in vivo методи, відомі фахівцеві в даній області. Такі способи повністю пояснені в літературі. Наступні робочі приклади забезпечені винятково з метою ілюстрації, і не повинні бути витлумачені як яким-небудь чином обмежуючу частину, що залишилася, опису. Тому, приклади повинні бути витлумачені як ті, що охоплюють будь-які й всі варіації, які стануть очевидними в результаті доктрин, представлених у даній заявці. Приклади Приклад 1: цис-4-трет-бутилциклогексил метансульфонат Цис-4-трет-бутилциклогексанол (6,0 г, 38,5 ммоль, 1,0 екв.) розчиняли в дихлорметані (10 мл). До суміші повільно додавали метансульфоновий ангідрид (8,03 г, 46,2 ммоль, 1,1 екв.) при 0 °C. Потім до суміші додавали триетиламін (6,4 мл, 46,2 ммоль, 1,5 екв.) і суміш перемішували при кімнатній температурі протягом 3 годин. Суміш екстрагували дихлорметаном і органічний шар концентрували з одержанням продукту у вигляді білого порошку (8,0 г, вихід: 90 %). 1 Продукт використовували на наступній стадії без подальшого очищення. H ЯМР (400 МГц, CDCl3) δ 4,99-4,98 (m, 1H), 3,02 (s, 3H), 2,14-2,12 (m, 2H), 1,65-1,28 (m, 7H), 0,84 (s, 9H). Приклад 2: 2-бром-6-(транс-4-трет-бутилциклогексилоксі)нафталін 50 13 UA 107360 C2 5 10 15 20 25 6-бромнафталін-2-ол (CAS №15231-91-1) (3,0 г, 14,8 ммоль, 1,0 екв.) розчиняли в суміші трет-бутанола/2-бутанона (4 мл/2 мл). Потім до суміші додавали карбонат цезію (12 г, 37,2 ммоль, 2,5 екв.) і суміш перемішували при 110 °C протягом 10 хвилин. Потім до суміші додавали транс-4-трет-бутилциклогексил метансульфонат (3,48 г, 16,2 ммоль, 1,1 екв.). Суспензію перемішували при 110 °C в атмосфері азоту протягом 15 годин. Реакційну суміш екстрагували етилацетатом і органічний шар очищали за допомогою хроматографії на колонку із силікагелем з використанням петролейного ефіру в якості елюента з одержанням 2-бром-6-(транс-4-третбутилциклогексилоксі)нафталіну у вигляді ясно-жовтої твердої речовини (1,7 г, вихід: 32 %).ESI+ 1 МС: 361,0 (M+H) . H ЯМР (400 МГц, CDCl3) δ 7,89 (s, 1H), 7,63 (d, 1H), 7,56 (d, 1H), 7,47 (d, 1H), 7,15-7,11 (m, 2H), 4,26-4,24 (m, 1H), 2,27-2,25 (m, 2H), 1,89-1,87 (m, 2H), 1,45-1,09 (m, 5H), 0,89 (s, 9H). Приклад 3: 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтальдегід 2-бром-6-(транс-4-трет-бутилциклогексилоксі)нафталін (2,249 г, 6,25 ммоль, 1,0 екв.) розчиняли в ТГФ (10 мл) в атмосфері азоту. Потім суміш прохолоджували до -78 °C і розчин нBuLi у ТГФ (2,5 M, 7,5 мл, 18,8 ммоль, 3,0 екв.) додавали до суміші по краплях. Суміш перемішували при -78 °C протягом 15 хвилин. Потім до суміші додавали ДМФ (2,4 мл, 31,2 ммоль, 5,0 екв.) і перемішували при -78 °C протягом 1 години. Після завершення реакції, додавали 1 M HCl для регулювання pH до 6. Суміш екстрагували EtOAc і органічний шар концентрували й очищали за допомогою хроматографії на силікагелі з використанням петролейного ефіру/етилацетату (10/1) у якості елюента з одержанням 6-(транс-4-третбутилциклогексилоксі)-2-нафтальдегіду у вигляді білої твердої речовини (1,16 г, 60 %).EDI-МС: + 1 311,1 (M+H) . H ЯМР (400 МГц, CDCl3) δ 10,08 (s, 1H), 8,24 (s, 1H), 7,92-7,87 (m, 2H), 7,77 (d, 1H), 7,22-7,19 (m, 2H), 4,42-4,30 (m, 1H), 2,30-2,28 (m, 2H), 1,93-1,90 (m, 2H), 1,48-1,11 (m, 5H), 0,82 (s, 9H). Приклад 4: 2-бром-6-(транс-4-трет-бутилциклогексилоксі)нафталін (альтернативний синтез) ДІАД, 30 35 40 До розчину 6-бромнафталін-2-олу (100,0 г, 450,1 ммоль), трифенілфосфіну (230 г, 877,8 ммоль, 2,0 екв.) й цис-4-трет-бутилциклогексанолу (105,4 г, 675,7 ммоль; 1,5 екв.) у толуолі (1,5 л), по краплях додавали диізопропіл азодікарбоксилат (170 г, 850,0 ммоль, 2,0 екв.) при 0 °C. Додавання зайняло ~2 години й отриману в результаті суміш нагрівали до 26-30 °C. Через 24 години, тонкошарова хроматографія показала практично повне витрату 6-бромнафталін-2-олу. Суміш потім прохолоджували до 5 °C і перемішували при даній температурі протягом 2 годин, після чого тверді речовини осаджували й фільтрували. Фільтрат концентрували практично до сухого залишку з одержанням масла, що розчиняли в 200 мл метиленхлориду й очищали за допомогою хроматографії на силікагелі з 100 % петролейним ефіром. Після концентрування, 127 грам продукту одержували у вигляді білої твердої речовини (вихід: 79,1 %).EDI-МС: 361,1 + (M+H) . Приклад 5: 5: 6-бром-2-(транс-4-трет-бутилциклогексилоксі)-1-йоднафталін Br Br NIS, ZrCl4, CH 2Cl2 O O I 45 50 Розчин 2-бром-6-(транс-4-трет-бутилциклогексилоксі)нафталіну (160,0 г, 444,4 ммоль) у метиленхлориді (2,5 л) продували в атмосфері аргону. N-йодсукцинимід (202,1 г, 888,8 ммоль) і тетрахлорид цирконію (20,4 г, 88,9 ммоль) додавали й реакційну суміш перемішували при 1 кімнатній температурі в атмосфері аргону. Реакцію контролювали за допомогою H ЯМР, що показував повне перетворення в продукт через 30 хвилин. Суміш потім концентрували при зниженому тиску з одержанням ~250 грам неочищеного продукту у вигляді коричневої твердої 14 UA 107360 C2 речовини. Неочищену речовину очищали за допомогою хроматографії на силікагелі з гексаном з одержанням 200 грам цільового продукту у вигляді коричневої твердої речовини (вихід: + 92,6 %).EDI-МС: 487,1 (M+H) . Приклад 6: 6-бром-2-(транс-4-трет-бутилциклогексилоксі)-1-(трифторметил)нафталін 5 ГМФТА, ДМФ 10 15 20 25 30 35 40 45 Розчин 6-бром-2-(транс-4-трет-бутилциклогексилоксі)-1-йоднафталіну (210,0 г, 433 ммоль), гекcаметилфосфораміду (386,4 г, 2,16 моль, 5 екв.) в N, Nдиметилформаміді (2,0 л) дегазували шляхом перемішування у вакуумі й заміщення вакууму аргоном (4 рази). До даної суміші додавали йодид міді(I) (140,0 г, 735 ммоль; 1,7 екв.) і метил фторсульфонілдифторацетат (415 г, 2,16 моль, 5 екв.). Реакційну суміш нагрівали до 80 °C в атмосфері аргону. Після перемішування протягом 6 годин, тонкошарова хроматографія показала повне перетворення в продукт. Насичений розчин NaHCO 3 додавали для регулювання кінцевого значення pH до 9~10 з наступним додаванням EtOAc (3,5 л). Суміш екстрагували EtOAc (2,5 л x 3), і промивали сольовим розчином (1,0 л x 4), потім висушували над Na2SO4 (500 грам). Розчинник видаляли при зниженому тиску з одержанням 195 грам неочищеного продукту у вигляді клейкого практично білої твердої речовини із чистотою >90 %, що очищали за допомогою хроматографії на силікагелі 0-30 % EtOAc у гексані з одержанням цільового продукту + (156 г, 84,3 %).EDI-МС: 430,0 (M+H) . Приклад 7: трет-бутил 3-оксо-3-(фенілсульфонамідо)пропілкарбамат 3-(Трет-бутоксікарбониламіно)пропаноєву кислоту (4 г, 21,2 ммоль, 1,0 еквів.) розчиняли в ДХМ (100 мл). Потім до суміші додавали фенілсульфонамід (15,1 ммоль, 0,7 еквів.), EDCI (3,45 г, 18,2 ммоль, 0,85 еквів.) і диметиламінопіридин (0,37 г, 3 ммоль, 0,15 еквів.) і перемішували протягом 2 годин при кімнатній температурі. Реакційну суміш прохолоджували до 0 °C, додавали крижану воду (100 мл). Суміш перемішували протягом 15 хвилин, розділяли й водний шар екстрагували двічі дихлорметаном. З'єднаний органічний шар промивали 5 % HCl, сольовим розчином, висушували над Na2SO4, концентрували з одержанням трет-бутил 3-оксо-3+ 1 (фенілсульфонамідо)пропілкарбамату, 5,3 г, сіре масло, 100 %.EDI-МС: 329,0 (M+H) . H ЯМР (400 МГц, CDCl3) δ: 9,52~9,43 (brs, 1H), 8,02~7,96 (m, 2H), 7,61~7,55 (m, 1H), 7,50~7,45 (m, 2H), 5,02~4,93 (m, 1H), 3,30~3,24 (m, 2H), 2,48~2,41 (m, 2H), 1,34 (s, 9H). Приклад 8: 3-аміно-N-(фенілсульфоніл)пропанамід Трет-бутил 3-оксо-3-(фенілсульфонамідо)пропілкарбамат (3,6 г, 15,1 ммоль) розчиняли в дихлорметані (60 мл). Потім до суміші додавали CF 3COOH (1,1 мл, 0,3 ммоль, 20 еквів.) при 0 °C і перемішували протягом 2 годин при 0 °C Реакційну суміш концентрували й очищали за допомогою флеш-хроматографії з одержанням 3-аміно-N-(фенілсульфоніл)пропанаміду у + 1 вигляді білої твердої речовини (1,4 г, 40 %).EDI-МС: 229,0 (M+H) . H ЯМР (400 МГц, ДМСО-d6) δ: 7,79~7,71 (m, 2H), 7,70~7,43 (brs, 3H), 7,42~7,34 (m, 3H), 2,83 (t, 2H), 2,24 (t, 2H). Приклад 9: 3-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метиламіно)-N(фенілсульфоніл)пропанамід 15 UA 107360 C2 5 10 15 20 25 30 6-(Транс-4-трет-бутилциклогексилоксі)-2-нафтальдегід (300 мг, 0,96 ммоль, 1 еквів.) і 3аміно-N-(фенілсульфоніл)пропанамід (1,19 ммоль, 1,5 еквів.) розчиняли в безводному етанолі. Суміш перемішували при 80 °C протягом 1 години. Потім NaBH3CN (110 мг, 1,74 ммоль, 2 еквів.) додавали до суміші й перемішували при 80 °C протягом 16 годин. Органічний шар концентрували й очищали за допомогою препаративної тонкошарової хроматографії (рухливою фазою був метанол:дихлорметан 1:10) з одержанням 3-((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метиламіно)-N-(фенілсульфоніл)пропанаміду у вигляді + білої твердої речовини, 284 мг, біла тверда речовина, 62 %.ESI-МС: 523,0 (M+H) . ВЕЖХ: 1 99,42 %. H ЯМР (400 МГц, ДМСО-d6) δ: 7,91 (s, 1H), 7,85~7,82 (m, 2H), 7,74~7,72 (m, 2H), 7,53~7,51(m, 1H), 7,41~7,35(m, 4H), 7,20~7,15 (m, 1H), 4,45~4,40 (m, 1H), 4,23 (s, 2H), 2,99 (t, 2H), 2,33 (t, 2H), 2,28~2,16 (m, 2H), 1,89~1,78 (m, 2H), 1,41~1,31 (m, 2H), 1,27~1,17 (m, 2H), 1,13~1,06 (m, 1H), 0,89 (s, 9H). Приклад 10: 3-((6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)нафталін-2іл)метиламіно)-N-(фенілсульфоніл)пропан амід 6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)-2-нафтальдегід (300 мг, 0,96 ммоль, 1 еквів.) і 3-аміно-N-(фенілсульфоніл)пропанамід (1,19 ммоль, 1,5 еквів.) розчиняли в безводному етанолі. Суміш перемішували при 80 °C протягом 1 години. Потім NaBH3CN (110 мг, 1,74 ммоль, 2 еквів.) додавали до суміші й перемішували при 80 °C протягом 16 годин. Органічний шар концентрували й очищали за допомогою препаративної тонкошарової хроматографії (рухливою фазою був метанол:дихлорметан 1:10) з одержанням 3-((6-(транс-4трет-бутилциклогексилоксі)-5-(трифторметил)нафталін-2-іл)метиламіно)-N(фенілсульфоніл)пропанаміду у вигляді білої твердої речовини. 120 мг, біла тверда речовина, + 1 53 %.ESI-МС: 591,0 (M+H) … ВЕЖХ: 98,05 %. H ЯМР (400 МГц, ДМСО-d6) δ: 8,22~8,13 (m, 1H), 8,11~8,04 (m, 2H), 7,79~7,63 (m, 4H), 7,45~7,30(m, 3H), 4,63~4,49(m, 1H), 4,27 (s, 2H), 2,99 (t, 2H), 2,32 (t, 2H), 2,19~2,07 (m, 2H), 1,85~1,74 (m, 2H), 1,45~1,30 (m, 2H), 125~1,12 (m, 2H), 1,10~0,97 (m, 1H), 0,86 (s, 9H). Приклад 11: метил 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метиламіно)пропаноат 35 40 45 Суміш 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтальдегіду (155 мг, 0,5 ммоль), метил 2амінопропаноату (103 мг, 1,0 ммоль, 2,0 еквів.) і АcOH (59 мг, 1,0 ммоль, 2,0 еквів.) у безводному дихлоретані (20 мл) кип'ятили зі зворотним холодильником протягом 30 хвилин, прохолоджували до 23 °C, додавали NaBH3CN (60 мг, 1,0 ммоль, 2,0 еквів.), отриману в результаті суміш кип'ятили зі зворотним холодильником протягом 1 години. Реакційну суміш концентрували у вакуумі й залишок очищали за допомогою хроматографії на силікагелі (дихлорметан:метанол 20:1) з одержанням метил 2-((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метиламіно)пропаноату у вигляді білої твердої речовини + 1 (277 мг, вихід: 70 %).ESI-МС: 398,1 (M+H) . ВЕЖХ: 96,09 %. H ЯМР (400 МГц, CD3OD) δ: 7,83 (s, 16 UA 107360 C2 5 10 15 20 25 30 35 1H), 7,79 (d, 1H), 7,74 (d, 1H), 7,43 (dd, 1H), 7,22 (d, 1H), 7,10 (dd, 1H), 4,28-4,33 (m, 3H), 4,13 (q, 1H), 3,80 (s, 3H), 2,21 (d, 2H), 1,85 (d, 2H), 1,56 (d, 3H), 1,31-1,37 (m, 2H), 1,17-1,24 (m, 2H), 1,051,11 (m, 1H), 0,85 (s, 9H). Приклад 12: 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метиламіно)пропаноєва кислота До розчину метил 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метиламіно)пропаноат (100 мг, 0,25 ммоль) в етанолі (10 мл) додавали водний NaOH (3 мл, 20 %, 5,0 екв.) і кип'ятили зі зворотним холодильником протягом 1 години. Потім реакційну суміш прохолоджували до 0 °C, pH розчину доводили до 6 за допомогою 1 M HCl, концентрували й залишок розчиняли в дихлорметані, промивали водою, висушували й концентрували з одержанням 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метиламіно)пропаноєвої кислоти у вигляді білої твердої речовини (70 мг, вихід: 75 %).ESI-МС: + 1 384,1 (M+H) . ВЕЖХ: 97,18 %. H ЯМР (400 МГц, CD3OD) δ: 7,88 (s, 1H), 7,83 (d, 1H), 7,73 (d, 1H), 7,49 (dd, 1H), 7,26 (d, 1H), 7,15 (dd, 1H), 4,29-4,38 (m, 3H), 4,04 (q, 1H), 2,25 (d, 2H), 1,90 (d, 2H), 1,60 (d, 3H), 1,36-1,44 (m, 2H), 1,21-1,31 (m, 2H),1,09-1,15 (m, 1H), 0,89 (s, 9H). Приклад 13: етил 3-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метиламіно)бутаноат 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтальдегід (30 мг, 0,097 ммоль), етил 3амінобутаноат (CAS № 5303-65-1)(19 мг, 0,145 ммоль), і оцтову кислоту (17 мг, 0,291 ммоль) розчиняли в дихлоретані (2 мл). Суміш перемішували при кімнатній температурі протягом 10 хвилин в атмосфері азоту. Потім NaBH(OAc)3 (41 мг, 0,194 ммоль) додавали до суміші й суміш перемішували при кімнатній температурі протягом 15 годин. Потім насичений розчин NaHCO 3 додавали до суміші для регулювання значення pH до 8. Суміш екстрагували етилацетатом і органічний шар очищали за допомогою хроматографії на колонку із силікагелем з використанням дихлорметан:метанол 10:1 з одержанням продукту етил 3-((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метиламіно)бутаноату (40 мг, 88 %) у вигляді ясно-жовтої + 1 твердої речовини.ESI-МС: 426,1 (M+H) . H ЯМР (400 МГц, CDCl3) δ 7,70-7,65 (m, 3H), 7,41 (d, 1H), 7,13-7,09 (m, 2H), 4,28-4,23 (m, 1H), 4,12 (q, 2H), 3,98-3,88 (m, 2H), 3,22-3,18 (m, 1H), 2,532,42 (m, 2H), 2,28-2,25 (m, 2H), 1,90-1,87 (m, 2H), 1,45-1,42 (m, 2H), 1,26-1,09 (m, 9H), 0,90 (s, 9H). Приклад 14: 3-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метиламіно)бутаноєва кислота 40 45 Синтез здійснювали так, як описано для 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін2-іл)метиламіно)пропаноєвої кислоти. + 1 9 мг, ясно-жовте масло, вихід: 27 %.ESI-МС: 398,1 (M+H) . ВЕЖХ: 91,26 %. H ЯМР (400 МГц, CDCl3) δ 7,70-7,61 (m, 3H), 7,45 (d, 1H), 7,07 (t, 2H), 4,20-4,17 (m, 2H), 3,98-3,95 (m, 1H), 3,18-3,16 (m, 1H), 2,43-2,42 (m, 2H), 2,24-2,18 (m, 2H), 1,87-1,84 (m, 2H), 1,34-1,17 (m, 8H), 0,91 (s, 9H). 17 UA 107360 C2 Приклад 15: етил іл)метил)(метил)аміно)ацетат 2-(((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2 5 10 15 20 25 30 35 40 Суміш 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтальдегіду (155 мг, 0,5 ммоль) і етил 2(метиламіно)ацетату (117 мг, 1,0 ммоль, 2,0 еквів.) у безводному етанолі (20 мл) кип'ятили зі зворотним холодильником протягом 2 годин і випаровували у вакуумі до сухого залишку. Додавали безводний EtOH і кип'ятили зі зворотним холодильником протягом 1 години, і потім суміш прохолоджували до 23 °C. Додавали NaBH3CN (60 мг, 1,0 ммоль, 2,0 еквів.). Отриману в результаті суміш кип'ятили зі зворотним холодильником протягом 1 години. Реакційну суміш концентрували у вакуумі й залишок очищали за допомогою хроматографії на силікагелі (дихлорметан:метанол 20:1) з одержанням продукту етил 2-(((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метил)(метил)аміно)ацетату у вигляді білої твердої + 1 речовини (82 мг, вихід: 40 %).ESI-МС: 411,3 (M+H) . ВЕЖХ: 98,93 %. H ЯМР (400 МГц, CDCl3) δ 7,71-7,67 (m, 3H), 7,00 (d, 1H), 7,14-7,13 (m, 2H), 4,30-4,28 (m, 1H), 4,18 (q, 2H), 3,82 (s, 3H), 3,30 (s, 2H), 2,45 (s, 3H), 2,29-2,27 (m, 2H), 1,91-1,88 (m, 2H), 1,46-1,42 (m, 2H), 1,29-1,22 (m, 3H), 0,90 (s, 9H). Приклад 16: 2-(((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)(метил)аміно) оцтова кислота Синтез здійснювали так, як описано для 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін2-іл)метиламіно)пропаноєвої кислоти. + 1 14 мг, сіра тверда речовина, вихід: 75 %.ESI-МС: 383,3 (M+H) . ВЕЖХ: 95,11 %. H ЯМР (400 МГц, CD3OD) δ 7,98 (s, 1H), 7,91-7,85 (m, 2H), 7,59-7,57 (m, 1H), 7,33 (s, 1H), 7,22 (d, 1H), 4,55 (s, 2H), 4,42-4,40 (m, 1H), 4,10 (s, 2H), 2,95 (s, 3H), 2,32-2,29 (m, 2H), 1,96-1,93 (m, 2H), 1,47-1,41 (m, 2H), 1,35-1,25 (m, 3H), 0,95 (s, 9H). Приклад 17: етил 3-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метиламіно)пропаноат Титульну сполуку синтезували так, як описано для етил 3-((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метиламіно) бутаноату. 730 мг, біла тверда речовина, + 1 40,9 %.ESI-МС: 412,3 (M+H) . H ЯМР (400 МГц, CDCl3) δ: 7,75 (s, 1H), 7,72-7,67 (m, 2H), 7,50 (dd, 1H), 7,12-7,10 (m, 1H), 7,07 (d, 1H), 4,20 (m, 1H), 4,11 (q, 2H), 4,01 (s, 2H), 3,05 (t, 2H), 2,81 (t, 2H), 2,22-2,20 (m, 2H), 1,87-1,84 (m, 2H), 1,41-1,38 (m, 2H), 1,22 (t, 3H), 1,17-1,07 (m, 3H), 0,89 (s, 9H). Приклад 18: 3-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метиламіно)пропаноєва кислота 18 UA 107360 C2 5 Синтез здійснювали так, як описано для 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін2-іл)метиламіно)пропаноєвої кислоти. + 1 593 мг, бежева тверда речовина, вихід: 87,2 %.ESI-МС: 384,1 (M+H) . ВЕЖХ: 100 %. H ЯМР (400 МГц, CD3OD) δ: 7,84 (s, 1H), 7,81-7,75 (m, 2H), 7,45 (dd, 1H), 7,22 (d, 1H), 7,14 (dd, 1H), 4,344,32 (m, 1H), 4,28 (s, 2H), 3,17 (t, 2H), 2,49 (t, 2H), 2,28-2,25 (m, 2H), 1,92-1,88 (m, 2H), 1,43-1,40 (m, 2H), 1,25-1,22 (m, 2H), 1,13-1,10 (m, 1H), 0,90 (s, 9H). Приклад 19: етил 3-(((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метил)(метил)аміно)пропаноат 10 15 Титульну сполукусинтезували так, як описано для 2-((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метиламіно)пропаноату. + 1 100 мг, біла тверда речовина, вихід: 70 %.ESI-МС: 426,3 (M+H) . ВЕЖХ: 90,71 %. H ЯМР (400 Мгц, CD3OD) δ: 7,73-7,76 (m, 3H), 7,43 (dd, 1H), 7,24 (d, 1H), 7,12 (dd, 1H), 4,31-4,37(m, 1H), 4,12-4,17 (m, 2H), 3,87 (s, 2H), 2,96 (t, 2H), 2,66 (t, 2H), 2,40 (s, 3H), 2,28 (d, 2H), 1,91 (d, 2H), 1,391,46 (m, 2H), 1,22-1,31 (m, 5H), 1,10-1,17 (m, 1H), 0,93 (s, 9H). Приклад 20: 3-(((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)(метил)аміно) пропаноєва кислота 20 25 30 35 40 Синтез здійснювали так, як описано для 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін2-іл)метиламіно)пропаноєвої кислоти. + 1 70 мг, біла тверда речовина, вихід: 75 %.ESI-МС: 398,3 (M+H) . ВЕЖХ: 94,61 %. H ЯМР (400 МГц, ДМСО-d6) δ: 7,97 (s, 1H), 7,87 (d, 1H), 7,83 (d, 1H), 7,62 (d, 1H), 7,43 (d, 1H), 7,19 (dd, 1H), 4,39-4,44 (m, 3H), 3,27 (br, 2H), 2,85 (t, 2H), 2,67 (s, 3H), 2,21 (d, 2H), 1,82 (d, 2H), 1,32-1,38 (m, 2H), 1,18-1,27 (m, 2H), 1,03-1,08 (m, 1H), 0,88 (s, 9H). Приклад 20: метил 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)азетидин3-карбоксилат Титульну сполуку синтезували так, як описано для метил 2-((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метиламіно)пропаноату. 150 мг, біла тверда речовина, + 1 вихід: 61 %.ESI-МС: 410,3 (M+H) … ВЕЖХ: 92,03 %. H ЯМР (400 МГц, CD3OD) δ: 7,88 (s, 1H), 7,84 (d, 1H), 7,82 (d, 1H), 7,44 (dd, 1H), 7,28 (d, 1H), 7,17 (dd, 1H), 4,51 (s, 2H), 4,32-4,39 (m, 5H), 3,72-3,77 (m, 4H), 2,26 (d, 2H), 1,90 (d, 2H), 1,36-1,47 (m, 2H), 1,24-1,31 (m, 2H), 1,11-1,17 (m, 1H), 0,91 (s, 9H). Приклад 21: 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)азетидин-3карбонова кислота екв год 19 UA 107360 C2 5 Синтез здійснювали так, як описано для 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін2-іл)метиламіно)пропаноєвої кислоти. + 1 70 мг, біла тверда речовина, вихід: 70 %.ESI-МС: 396,3 (M+H) . ВЕЖХ: 90,04 %. H ЯМР (400 МГц, CD3OD) δ: 7,91 (s, 1H), 7,86 (d, 1H), 7,83 (d, 1H), 7,47 (dd, 1H), 7,30 (s, 1H), 7,19 (dd, 1H), 4,53 (s, 2H), 4,30-4,51 (m, 5H), 3,66-3,70 (m, 1H), 2,29 (d, 2H), 1,93 (d, 2H), 1,39-1,48 (m, 2H), 1,241,33 (m, 2H),1,14-1,17 (m, 1H), 0,93 (s, 9H). Приклад 22: метил 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)піролідин3-карбоксилат 10 екв год екв 15 20 Титульну сполукусинтезували так, як описано для етил 2-(((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метил)(метил)аміно)ацетату. + 1 150 мг, біла тверда речовина, вихід: 55 %.ESI-МС: 423,3 (M+H) . ВЕЖХ: 98,59 %. H ЯМР (400 МГц, CDCl3) δ 7,69-7,67 (m, 3H), 7,42 (d, 1H), 7,12 (t, 2H), 4,27-4,25 (m, 1H), 3,87 (s, 2H), 3,69 (s, 3H), 3,12-3,06 (m, 2H), 2,88-2,84 (m, 2H), 2,73-2,70 (m, 1H), 2,28-2,25 (m, 2H), 2,18-2,16 (m, 2H), 1,90-1,87 (m, 2H), 1,45-1,42 (m, 2H), 1,25-1,12 (m, 3H), 0,89 (s, 9H). Приклад 23: 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)піролідин-3карбонова кислота екв год 25 30 Синтез здійснювали так, як описано для 2-((6-(транс-4-трет-бутилциклогексилоксі)нафталін2-іл)метиламіно)пропаноєвої кислоти. + 1 80 мг, біла тверда речовина, вихід: 55 %.ESI-МС: 409,3 (M+H) . ВЕЖХ: 93,50 %. H ЯМР (400 МГц, CD3OD) δ 7,95 (s, 1H), 7,83 (dd, 2H), 7,55 (d, 1H), 7,28 (s, 1H), 7,18 (d, 1H), 4,55-4,47 (m, 2H), 4,41-4,34 (m, 1H) 3,63-3,37 (m, 2H), 3,32 (s, 2H), 3,28-3,20 (m, 1H), 2,42-2,27 (m, 4H), 1,94-1,90 (m, 2H), 1,48-1,38 (m, 2H), 1,33-1,23 (m, 2H), 1,23-1,14 (m, 1H), 0,89 (s, 9H). Приклад 24: етил 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)піперидин4-карбоксилат екв хв екв 35 40 Титульну сполуку синтезували так, як описано для 2-(((6-(транс-4-третбутилциклогексилоксі)нафталін-2-іл)метил)(метил)аміно)ацетату. 100 мг, біла тверда речовина, + 1 вихід: 46 %.ESI-МС: 451,3 (M+H) … ВЕЖХ: 92,64 %. H ЯМР (400 МГц, CDCl3) δ 7,75-7,72 (m, 3H), 7,48 (dd, 1H), 7,17 (d, 2H), 4,30-4,28 (m, 1H), 4,16 (q, 2H), 3,96 (s, 2H), 3,09-3,08 (m, 2H), 2,532,51 (m, 3H), 2,29-2,26 (m, 2H), 2,10-2,03 (m, 4H), 1,91-1,88 (m, 2H), 1,43-1,43 (m, 2H), 1,18-1,13 (m, 6H), 0,88 (s, 9H). Приклад 25: 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)піперидин-4карбонова кислота екв год 45 Синтез здійснювали так, як описано для -((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метиламіно)пропаноєвої кислоти. + 1 70 мг, біла тверда речовина, вихід: 87 %.ESI-МС: 423,3 (M+H) . ВЕЖХ: 94,25 %. H ЯМР (400 МГц, CD3OD) δ 7,90 (s, 1H), 7,86 (dd, 2H), 7,56 (d, 1H), 7,32 (s, 1H), 7,20 (dd, 1H), 4,46 (s, 2H), 20 UA 107360 C2 4,42-4,39 (m, 1H), 3,61-3,59 (m, 2H), 3,19-3,15 (m, 2H), 2,72-2,60 (m, 1H), 2,31-2,27 (m, 4H), 1,951,92 (m, 4H), 1,46-1,42 (m, 2H), 1,34-1,27 (m, 3H), 0,93 (s, 9H). Приклад 26: 6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)-2-нафтальдегід екв ДМФ екв год ТГФ 5 10 15 До розчину 6-бром-2-(транс-4-трет-бутилциклогексилоксі)-1-(трифторметил)нафталіну (1 г, 2,3 ммоль) у ТГФ (30 мл) додавали н-BuLi (2,8 мл, 2,5M у ТГФ, 3,0 еквів.) по краплях при -78 °C протягом 30 хвилин, потім повільно додавали ДМФ (840 мг, 11,5 ммоль, 5,0 еквів.) при -78 °C. Реакційну суміш перемішували при -78 °C протягом 1,5 годин. Потім насичений розчин NH 4Cl додавали до суміші для того, щоб погасити реакцію. Суміш екстрагували EtOAc і очищали за допомогою хроматографії на силікагелі (петролейний ефір:етилацетат 10:1) з одержанням продукту 6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)-2-нафтальдегіду у вигляді + 1 жовтої твердої речовини (608 мг, 70 %) ESI-МС: 379,2 (M+H) . H ЯМР (400 МГц, CDCl3) δ: 10,13 (s, 1H), 8,28 (d, 2H), 8,08 (d, 1H), 7,98-8,01 (dd, 1H), 7,41 (d, 1H), 4,39 (m, 1H), 2,21 (d, 2H), 1,90 (d, 2H), 1,49-1,58 (q, 2H), 1,10-1,17 (m, 3H), 0,86 (s, 9H). Приклад 27: метил 1-((6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)нафталін-2іл)метил)азетидин-3-карбоксилат год екв год екв 20 25 30 35 Суміш 6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)-2-нафтальдегіду (300 мг, 0,8 ммоль) і метил азетидин-3-карбоксилату (184 мг, 1,6 ммоль, 2,0 еквів.) у безводному етанолі (20 мл) кип'ятили зі зворотним холодильником протягом 2 годин. Потім розчинник видаляли у вакуумі, додавали свіжий етанол і NaBH3CN (150 мг, 2,4 ммоль, 3,0 еквів.), отриману в результаті суміш кип'ятили зі зворотним холодильником протягом 1 години. Реакційну суміш концентрували й залишок очищали за допомогою хроматографії на силікагелі (дихлорметан:метанол 20:1) з одержанням продукту метил 1-((6-(транс-4-третбутилциклогексилоксі)-5-(трифторметил)нафталін-2-іл)метил)азетидин-3-карбоксилату у вигляді + 1 білої твердої речовини (150 мг, вихід: 40 %).ESI-МС: 477,3 (M+H) . ВЕЖХ: 85,67 % H ЯМР (400 МГц, CD3OD) δ: 8,09 (dd, 1H), 8,01 (d, 1H), 7,56 (s, 1H), 7,46-7,51 (m, 2H), 4,42 (m, 1H), 3,77 (s, 2H), 3,71 (s, 3H),3,57 (t, 2H), 3,45 (t, 2H), 3,35-3,39 (m, 1H), 2,18 (d, 2H), 1,88 (d, 2H), 1,43-1,52 (q, 2H), 1,09-1,22 (m, 3H), 0,89 (s, 9H). Приклад 28: 1-((6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)нафталін-2іл)метил)азетидин-3-карбонова кислота екв год 40 До розчину метил метил 1-((6-(транс-4-трет-бутилциклогексилоксі)-5(трифторметил)нафталін-2-іл)метил)азетидин-3-карбоксилату (100 мг, 0,25 ммоль) в етанолі (10 мл) додавали водний NaOH (3 мл, 20 %) і кип'ятили зі зворотним холодильником протягом 1 години. Потім реакційну суміш прохолоджували до 0 °C, pH розчину доводили до 6 за допомогою 1 M HCl, і концентрували. Залишок розчиняли в дихлорметані, промивали водою, висушували й концентрували з одержанням 1-((6-(транс-4-трет-бутилциклогексилоксі)-5(трифторметил)нафталін-2-іл)метил)азетидин-3-карбонової кислоти у вигляді білої твердої 21 UA 107360 C2 + 5 1 речовини (70 мг, вихід: 70 %).ESI-МС: 464,2 (M+H) . ВЕЖХ: 98,64 % H ЯМР (400 МГц, ДМСО-d6) δ: 8,19 (d, 2H), 8,08 (d, 2H), 7,72 (d, 1H), 7,67 (d, 1H), 4,60-4,58 (m, 1H), 4,51 (s, 2H), 4,21 (d, 4H), 3,55-3,67 (m, 1H), 2,13 (d, 2H), 1,80 (d, 2H), 1,35-1,43 (q, 2H), 1,03-1,22 (m, 3H), 0,86 (s, 9H). Приклад 29: етил 3-((6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)нафталін-2іл)метиламіно)пропаноат год екв год екв 10 15 Синтез здійснювали так, як описано для метил 1-((6-(транс-4-трет-бутилциклогексилоксі)-5(трифторметил)нафталін-2-іл)метил)азетидин-3-карбоксилату. 50 мг, біла тверда речовина + 1 (вихід: 20 %).ESI-МС: 480,3 (M+H) . ВЕЖХ: 89,20 % H ЯМР (400 МГц, ДМСО-d6) δ: 8,22 (d, 1H), 8,97 (d, 1H), 7,90 (s, 1H), 7,52 (d, 1H), 7,33 (d, 1H), 4,30-4,28 (m, 1H), 4,14-4,20 (m, 4H), 3,17 (s, 2H), 2,77 (s, 2H), 2,16 (d, 2H), 1,86 (d, 2H), 1,47-1,55 (q, 2H), 1,25 (t, 3H), 1,09-1,13 (m, 3H), 0,87 (s, 9H). Приклад 30: 3-((6-(транс-4-трет-бутилциклогексилоксі)-5-(трифторметил)нафталін-2іл)метиламіно)пропаноєва кислота екв год 20 25 Синтез здійснювали так, як описано для 1-((6-(транс-4-трет-бутилциклогексилоксі)-5(трифторметил)нафталін-2-іл)метил)азетидин-3-карбонової кислоти. 30 мг, біла тверда + 1 речовина (вихід: 70 %).ESI-МС: 452,2 (M+H) . ВЕЖХ: 94,35 % H ЯМР (400 МГц, ДМСО-d6) δ: 8,12 (d, 1H), 8,01 (d, 1H), 7,91 (s, 1H), 7,62 (d, 2H), 4,54-4,52 (m, 1H), 3,93 (s, 2H), 2,79 (t, 2H), 2,36 (t, 2H), 2,12 (d, 2H), 1,79 (d, 2H), 1,35-1,41 (q, 2H), 1,03-1,22 (m, 3H), 0,86 (s, 9H). Приклад 31: метил 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтоат ДІАД 30 35 Суміш цис-4-трет-бутилциклогексанолу (927 мг, 0,00593 моль), метилового ефіру 6-гідроксінафталін-2-карбонової кислоти (1,00 г, 0,00494 моль) і трифенілфосфіну (1560 мг, 0,00593 моль) у толуолі (10 мл, 0,1 моль) нагрівали до повернення флегми, і по краплях додавали диізопропіл азодікарбоксилат (1,17 мл, 0,00593 моль) і перемішували й кип'ятили зі зворотним холодильником протягом 6 годин. Суміш розчиняли в дихлорметані й очищали за допомогою колоночної хроматографії етилацетатом:гексаном (0:100 до 40:60) з одержанням метил 6(транс-4-трет-бутилциклогексилоксі)-2-нафтоату у вигляді білої твердої речовини (0,95г, 56 %). 1 H ЯМР (400 МГц, CDCl3) δ 8,52 (s, 1H), 8,01 (dd, J=8,7, 1,7 Гц, 1H), 7,84 (d, J=9,6 Гц, 1H), 7,73 (d, J=8,7 Гц, 1H), 7,17 (m, 2H), 4,34 (m, 1H), 3,97 (s, 3H), 2,30 (m, 2H), 1,92 (m, 2H), 1,52-1,14 (m, 5H), 0,91 (s, 9H). Приклад 32: (6-транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метанол 40 ТГФ Метил 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтоат (950 мг, 0,0028 моль) розчиняли в 22 UA 107360 C2 5 тетрагідрофурані (20 мл, 0,2 моль) і потім додавали 1,0 M тетрагідроалюмінат літію в тетрагідрофурані (8,4 мл, 0,0084 моль) при 0 °C. Після перемішування при кімнатній температурі протягом 2 годин, додавали етилацетат і сегнетову сіль і суміш потім перемішували при кімнатній температурі протягом 1 години. Після екстракції етилацетатом з наступним концентруванням при зниженому тиску, одержували продукт (6-транс-4-трет1 бутилциклогексилоксі)нафталін-2-іл)метанол у вигляді білої твердої речовини (770 мг, 88 %). H ЯМР (400 МГц, CDCl3) δ 7,71 (m, 2H), 7,45 (d, J=10,1 Гц, 1H), 7,15 (m, 3H), 4,82 (AB, J=16,1, 16,1Гц, 2H), 4,28 (m, 1H), 2,27-2,31 (m, 2H), 1,89-1,92 (m, 2H), 1,11-1,50 (m, 5H), 0,91 (s, 9H). Приклад 33: 6-(транс-4-трет-бутилциклогексилоксі)-2-нафтальдегід 10 Десс-Мартин Періодінат, ДХМ 15 20 До (6-транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метанолу (150 мг, 0,480 ммоль) у метиленхлориді (5 мл, 80 ммоль) додавали періодінан Десс-Мартіна (0,285 г, 0,672 ммоль) і суміш перемішували при кімнатній температурі протягом 1 години. Неочищену реакційну суміш потім пропускали через шар силікагелю, і фільтрат потім концентрували при зниженому тиску з 1 одержанням продукту у вигляді білої твердої речовини (0,150 г, 100 %). H ЯМР (400 МГц, CDCl3) δ 10,10 (s, 1H), 8,25 (s, 1H), 7,92-7,87 (m, 2H), 7,78 (d, J=8,5Гц, 1H), 7,23-7,19 (m, 2H), 4,38-4,30 (m, 1H), 2,31-2,29 (m, 2H), 1,94-1,91 (m, 2H), 1,54-1,11 (m, 5H), 0,92 (s, 9H). Приклад 34: 3-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метиламіно)-2,2дифторпропаноєва кислота O F F H2N OH + O 25 30 35 O NaBH3CN, EtOH 41% O O N OH H F F Розчин 6-(4-трет-Бутил-циклогексилоксі)-нафталін-2-карбальдегіду (150 мг, 0,483 ммоль) і 3аміно-2,2-дифтор-пропіонової кислоти (60,4 мг, 0,483 ммоль) в етанолі (0,7 мл, 10 ммоль) нагрівали до повернення флегми протягом 2 годин. Жовтий розчин потім прохолоджували до кімнатної температури й до розчину, що перемішується, додавали натрій цианоборогідрид (36,4 мг, 0,580 ммоль). Отриману в результаті суміш нагрівали до повернення флегми протягом 1 години. Після охолодження до кімнатної температури, додавали лимонну кислоту, і розчинник видаляли у вакуумі. Отриману в результаті тверду речовину суспендували у воді й збирали за допомогою фільтрування. Фільтрат ретельно промивали водою (4x), простим ефіром (3x), і гексаном (3x). Отриману в результаті тверду речовину висушували на фільтрі з одержанням 1 титульної сполуки у вигляді білої твердої речовини (128,8 мг, 64 %). H ЯМР (400 МГц, CDCl3) δ: 7,92 (s, 1H), 7,87 (d, J=8,5Гц, 1H), 7,82 (d, J=9,1 Гц, 1H), 7,52 (dd, J=8,4, 1,8 Гц, 1H), 7,30 (d, J=2,2 Гц, 1H), 7,19 (dd, J=9,0, 2,4Гц, 1H), 4,45 (s, 2H), 4,40 (m, 1H), 3,61 (t, J=13,8 Гц, 2H), 2,28~2,31 (m, 2H), 1,92-1,95 (m, 2H), 1,49-1,14 (m, 5H), 0,94 (s, 9H). Приклад 35: метил 6-(спіро[5.5]ундекан-3-ілоксі)-2-нафтоат ДIАД, 40 45 50 Суміш спіро[5.5]ундекан-3-олу (0,999 г, 0,00593 моль), метилового ефіра 6-гідроксінафталін-2-карбонової кислоти (1,00 г, 0,00494 моль) й трифенілфосфіну (1,56 г, 0,00593 моль) у толуолі (10 мл, 0,1 моль) нагрівали до повернення флегми. Диізопропіл азодікарбоксилат (1,17 мл, 0,00593 моль) потім додавали по краплях і отриману в результаті суміш кип'ятили зі зворотним холодильником протягом 6 годин. Суміш потім розбавляли дихлорметаном і піддавали хроматографічному очищенню етилацетатом:гексаном (0:100 до 40:60) з одержанням метил 6-(спіро[5.5]ундекан-3-ілоксі)-2-нафтоату у вигляді білої 1 твердої речовини. (1,09 г, 62 %). H ЯМР (400 МГц, CDCl3) δ 8,52 (s, 1H), 8,01 (dd, J=8,7, 1,7 Гц, 1H), 7,84 (d, J=9,6 Гц, 1H), 7,72 (d, J=8,7 Гц, 1H), 7,17 (m, 2H), 4,45 (m, 1H), 3,97 (s, 3H), 1,93-1,28 23 UA 107360 C2 (m, 18H). Приклад 36: (6-(спіро[5.5]ундекан-3-ілоксі)нафталін-2-іл)метанол ТГФ 5 10 15 До розчину метилового ефіру 6-(спіро[5.5]ундек-3-ілоксі)-нафталін-2-карбонової кислоти (0,374 г, 0,00106 моль) у тетрагідрофурані (10 мл, 0,1 моль) додавали 1,0 M літій тетрагідроалюмінат у тетрагідрофурані (3,18 мл, 0,00318 моль) при 0 °C. Реакційної суміші потім дозволяли нагріватися до кімнатної температури при перемішуванні протягом 2 годин, потім додавали сегнетову сіль і перемішували отриману в результаті суміш при кімнатній температурі протягом 1 години. Після екстракції етилацетатом, і видалення розчинника у вакуумі, (6-(спіро[5.5]ундекан-3-ілоксі)нафталін-2-іл)метанол одержували у вигляді білої твердої + 1 речовини (0,28 г, 83 %).ESI-МС: 307,5 (M+H) . 100 %). H ЯМР (400 МГц, CDCl3) δ 7,74-7,70 (m, 3H), 7,44 (d, J=10,0 Гц, 1H), 7,16 (m, 2H), 4,81 (s, 2H), 4,40 (m, 1H), 1,94-1,26 (m, 18H). Приклад 37: 6-(спіро[5.5]ундекан-3-ілоксі)-2-нафтальдегід Десс-Мартин Періодінат, ДХМ 20 25 ДО [6-(спіро[5.5]ундек-3-ілоксі)-нафталін-2-іл]-метанолу (150 мг, 0,46 ммоль) у метиленхлориді (5 мл, 80 ммоль) додавали періодінан Десса-Мартіна (0,274 г, 0,647 ммоль) і отриманий у результаті розчин перемішували при кімнатній температурі протягом 1 години. Неочищену реакційну суміш потім пропускали через шар силікагелю, фільтрат видаляли у вакуумі з одержанням 6-(спіро[5.5]ундекан-3-ілоксі)-2-нафтальдегіду у вигляді безбарвної 1 твердої речовини. (0,150 г, 100 %). H ЯМР (400 МГц, CDCl3) δ 10,09 (s, 1H), 8,25 (s, 1H), 7,927,89 (m, 2H), 7,78 (d, J=8,7Гц, 1H), 7,24-7,19 (m, 2H), 4,48 (m, 1H), 1,96-1,29 (m, 18H). Приклад 38: 2,2-дифтор-3-((6-(спіро[5.5]ундекан-3-ілоксі)нафталін-2іл)метиламіно)пропаноєва кислота F O F H2N OH O + O NaBH 3CN, EtOH N H 41% O O OH F F 30 35 40 45 Розчин 6-(спіро[5.5]ундек-3-ілоксі)-нафталін-2-карбальдегіду (150 мг, 0,46 ммоль) й 3-аміно2,2-дифтор-пропіонової кислоти (58,2 мг, 0,465 ммоль) в етанолі (0,7 мл, 10 ммоль) нагрівали до повернення флегми протягом 2 годин. Жовтий розчин потім прохолоджували до кімнатної температури й порціями додавали натрій цианоборогідрид (35,1 мг, 0,558 ммоль). Отриману в результаті суміш нагрівали до повернення флегми протягом 1 години. Реакційну суміш потім прохолоджували до кімнатної температури, і додавали лимонну кислоту. Розчин перемішували протягом декількох хвилин і розчинник видаляли у вакуумі. Отриману в результаті тверду речовину суспендували у воді й фільтрували, і зібрану тверду речовину ретельно промивали водою (4x), простим ефіром (5x), і гексаном (5x) з одержанням (82,1 мг, 41 %) 2,2-дифтор-3-((61 (спіро[5.5]ундекан-3-ілоксі)нафталін-2-іл)метиламіно)пропаноєвої кислоти. H ЯМР (400 МГц, CDCl3) δ: 7,93 (s, 1H), 7,86 (d, J=8,5Гц, 1H), 7,83 (d, J=9,1 Гц, 1H), 7,52 (dd, J=8,4, 1,8 Гц, 1H), 7,30 (d, J=2,2 Гц, 1H), 7,22 (dd, J=9,0, 2,4Гц, 1H), 4,52 (m, 1H), 4,45 (s, 2H), 3,60 (t, J=15,9 Гц, 2H), 1,76-1,35 (m, 18H). Приклад 39: (R)-етил 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метил)піперидин-3-карбоксилат O O O + O O NaCNBH3 N N H MeOH/AcOH O 24 O UA 107360 C2 5 10 6-(4-Трет-бутил-циклогексилоксі)-нафталін-2-карбальдегід (500 мг, 2 ммоль) з'єднували з етиловим ефіром (R)-піперидин-3-карбонової кислоти (0,51 г, 3,2 ммоль) у метанолі (10 мл, 200 ммоль) і оцтовій кислоті (9,2 мкMл, 0,16 ммоль). Потім додавали натрій цианоборогідрид (0,25 г, 4,0 ммоль) і реакційну суміш перемішували всю ніч при кімнатній температурі. Реакцію потім гасили водою й тричі екстрагували етилацетатом. Органічні шари з'єднували й висушували над MgSO4. Тверді речовини видаляли за допомогою фільтрування й додавали 10 грам силікагелю. Потім видаляли весь розчинник і отриманий у результаті силікагель завантажували в стовпчик на 24 грама й продукт елюювали з використанням градієнта 0-60 % етилацетат/гексан і потім висушували у вакуумі з одержанням титульної сполуки у вигляді безбарвного масла.EDI-МС: + 438,1 (M+H) . Приклад 40: (R)-1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)піперидин-3карбонова кислота O O 1N NaOH N O N OH EtOH O O 15 20 25 30 Етиловий ефір ((R)-1-[6-(4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]-піперидин-3карбонової кислоти (363,4 мг, 0,8046 ммоль) розчиняли в етанолі (5 мл, 80 ммоль), потім обробляли 1 M водним гідроксидом натрію (5 мл, 5 ммоль). Суміш енергійно перемішували протягом 18 годин. Значення pH доводили до 3-4 за допомогою 3N HCl і реакційну суміш потім тричі екстрагували етилацетатом. Органічні шари з'єднували й потім висушували над MgSO 4, фільтрували й концентрували до сухого залишку при зниженому тиску. Потім додавали етиловий ефір і білий осад, утворений на ньому, видаляли за допомогою фільтрування з одержанням білої твердої речовини, що має чистоту 86 % по даним ВЕЖХ. Процес повторювали ще два рази з одержанням титульної сполуки у вигляді білої твердої речовини + 1 (156 мг, 44 %).EDI-МС: 424,2 (M+H) . H ЯМР (400МГц, MeOD) δ = 7,82 (s, 1 H), 7,74-7,62 (m, 2 H), 7,42 (d, J=2,3, 1 H), 7,19 (d, J=2,3 Гц, 1 H), 7,08 (d, J=2,5, 1 H), 4,43-4,34 (m, 1 H), 4,33-4,22 (m, 2 H), 2,71 (br. s., 1 H), 2,16 (d, J=2,0 Гц, 2 H), 1,88-167 (m, 4 H), 1,40-1,25 (m, 3 H), 1,24-1,11 (m, 4 H), 1,10-0,95 (m, 5 H), 0,79 (s, 9 H) Приклад 41: (S)-метил 1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2іл)метил)піперидин-3-карбоксилат O O O + N H O 35 40 O NaCNBH3 N MeOH/AcOH O O 6-(4-трет-бутил-циклогексилоксі)-нафталін-2-карбальдегід (503,27 мг, 1,6212 ммоль) з'єднували в метанолі (10 мл, 200 ммоль) з оцтовою кислотою (9,2 мкMл, 0,16 ммоль). Потім додавали натрій цианоборогідрид (252,76 мг, 4,0221 ммоль) і реакційну суміш перемішували всю ніч при кімнатній температурі. Потім реакцію гасили водою й тричі екстрагували етилацетатом. Органічні шари з'єднували й висушували над MgSO4. Тверді речовини видаляли за допомогою фільтрування й додавали 7 грам силікагелю. Весь розчинник потім видаляли й отриманий у результаті кремнезем завантажували в стовпчик на 24 г і продукт елюювали з використанням градієнта 0-60 % етилацетат/гексан і потім висушували у вакуумі з одержанням + титульної сполуки у вигляді безбарвного масла (366 мг, 45 %).EDI-МС: 438,3 (M+H) . Приклад 42: (S)-1-((6-(транс-4-трет-бутилциклогексилоксі)нафталін-2-іл)метил)піперидин-3карбонова кислота 45 O N O 50 O 1N NaOH O N OH EtOH O Етиловий ефір (S)-1-[6-(4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]-піперидин-3карбонової кислоти (151,23 мг, 0,33484 ммоль) розчиняли в етанолі (5 мл, 80 ммоль) і потім обробляли 1 M гідроксидом натрію у воді (5 мл, 5 ммоль). Суміш енергійно перемішували протягом 18 часов. pH доводили до 3-4 за допомогою 3 N HCl і реакційну суміш потім тричі 25 UA 107360 C2 5 10 15 20 25 30 35 екстрагували етилацетатом. Органічні шари з'єднували й потім висушували над MgSO 4, фільтрували й концентрували до сухого залишку при зниженому тиску. Потім додавали диетиловий ефір і білий осад, утворений на ньому, видаляли за допомогою фільтрування з одержанням титульної сполуки у вигляді білої твердої речовини (21 мг, 13 %).EDI-МС: 424,1 + 1 (M+H) . H ЯМР (400МГц, MeOD) δ = 7,82 (s, 1 H), 7,74-7,62 (m, 2 H), 7,44 (d, J=2,3, 1 H), 7,19 (d, J=2,3 Гц, 1 H), 7,08 (d, J=2,5, 1 H), 4,43-4,34 (m, 1 H), 4,33-4,22 (m, 2 H), 2,71 (br. s., 1 H), 2,16 (d, J=2,0 Гц, 2 H), 1,88-167 (m, 4 H), 1,40-1,25 (m, 3 H), 1,24-1,11 (m, 4 H), 1,11-0,94 (m, 5 H), 0,80 (s, 9 H). Приклад 43: трет-бутиловий ефір 4-{[6-(транс-4-трет-бутил-циклогексилоксі)-нафталін-2ілметил]-аміно}-масляної кислоти Розчин 6-(4-трет-бутил-циклогексилоксі)-нафталін-2-карбальдегіду (45 мг, 0,15 ммоль, HCl солі трет-бутилового ефіра 4-аміно-масляної кислоти (115 мг, 0,59 ммоль), і триетиламіну (81 мкMл, 0,58 ммоль) в 1, 2-дихлоретані (1,5 мл) обробляли натрій триацетоксіборогідридом (65 мг, 0,29 ммоль). Після перемішування при кімнатній температурі протягом ночі, суміш розбавляли дихлорметаном і промивали водним бікарбонатом натрію. Органічну фазу висушували над MgSO4, фільтрували й концентрували й залишок очищали на колонку із силікагелем з елююванням етилацетатом у гексані від 0 до 100 % з одержанням безбарвного + 1 масла (33 мг, вихід: 50 %).ESI-МС: 454,4 (M+H) ; H ЯМР (400 МГц, CDCl3) δ = 7,65-7,70 (m, 3H), 7,38-7,40 (dd, 1H), 7,10-7,14 (m, 2H), 4,22-4,28 (m, 1H), 3,90 (s, 2H), 2,67 (t, 2H), 2,28 (t, 4H), 1,89 (d, 2H), 1,81 (t, 2H), 1,40 (m, 1H), 1,42 (s, 9H), 1,30 (m, 4H), 0,9 (s, 9H). Приклад 44: 4-{[6-(транс-4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]-аміно}-масляна кислота Розчин трет-бутилового ефіра 4-{[6-(4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]аміно}-масляної кислоти (33 мг, 0,073 ммоль) в 4 M HCl у диоксані (1,50 мл) перемішували при кімнатній температурі всю ніч із утворенням білого осаду. Осад фільтрували й промивали простим ефіром з одержанням продукту у вигляді HCl солі (20 мг, вихід: 63 %).ESI-МС: 398,1 + (M+H) ; (400 МГц, CD3OD) δ = 7,90 (s, 1H), 7,84 (d, 1H), 7,81 (d, 1H), 7,49 (dd, 1H), 7,28 (d, 1H), 7,17 (dd, 1H), (m, 2H), 4,37 (m, 1H), 4,33 (s, 2H), 3,15 (t, 2H), 2,47 (t, 2H), 2,28 (t, 2H), 2,0 (m, 2H), 1,92 (d, 2H), 1,43 (q, 2H), 1,27 (q, 2H), 1,13 (m, 1H), 0,92 (s, 9H). Приклад 45: етиловий ефір {[6-(транс-4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]аміно}-оцтової кислоти 40 45 Розчин 6-(4-трет-бутил-циклогексилоксі)-нафталін-2-карбальдегіду (90 мг, 0,29 ммоль), гідрохлориду гліцинового етилового ефіру (162 мг, 1,16 ммоль), і триетиламіну (0,16 мл, 1,16 ммоль) в 1, 2-дихлоретані (2 мл) обробляли натрій триацетоксіборогідридом (129 мг, 0,58 ммоль). Суміш перемішували при кімнатній температурі всю ніч. Розчин розбавляли дихлорметаном і промивали водним бікарбонатом натрію. Органічну фазу висушували над MgSO4 і концентрували. Залишок очищали на колонку із силікагелем з елююванням етилацетатом у гексані від 0 до 100 % з одержанням продукту (64 мг, вихід: 55 %).ESI-МС: + 1 420,30 (M+23) ; H ЯМР (400 МГц, CDCl3) δ = 7,66-7,70 (m, 3H), 7,41 (dd, 1H), 7,11-7,14 (m, 2H), 4,26 (m, 1H), 4,19 (q, 2H), 3,93 (s, 2H), 3,43 (s, 2H), 2,28 (d, 4H), 1,89 (d, 2H), 1,44 (q, 2H), 1,27 (t, 26 UA 107360 C2 3H), 1,09-1,20 (m, 3H), 0,89 (s, 9H). Приклад 46: {[6-(транс-4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]-аміно}-оцтова кислота 5 10 15 20 25 30 35 40 До розчину етилового ефіру {[6-(4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]-аміно}оцтової кислоти (60 мг, 0,15 ммоль) у метанолі (1 мл) додавали водний гідроксид літію (4,2 M, 0,5 мл, 2 ммоль) з утворенням білого осаду. Суміш у вигляді суспензії перемішували при кімнатній температурі протягом 3 годин і потім при 50 °C протягом 2 годин. Суспензію нейтралізували 1 N HCl до pH 6 і білий осад фільтрували й висушували у вакуумі з одержанням + 1 білого осаду (48 мг, вихід: 86 %).ESI-МС: 392,3 (M+23) ; H ЯМР (400 МГц, ДМСО) δ = 7,77-7,82 (m, 3H), 7,48 (dd, 1H), 7,37 (d, 1H), 7,15 (dd, 1H), 4,38 (m, 1H), 4,07 (s, 2H), 3,16 (s, 2H), 2,20 (d, 2H), 1,82 (d, 2H), 1,35 (m, 2H), 1,10-1,25 (m, 3H), 0,89 (s, 9H). Приклад 47: диетиловий ефір (2-{[6-(транс-4-трет-бутил-циклогексилоксі)-нафталін-2ілметил]-аміно}-етил)-фосфінової кислоти До розчину оксалатної солі диетилового ефіру (2-аміно-етил)-фосфінової кислоти (200 мг, 0,74 ммоль) в 1, 2-дихлоретані (3 мл) додавали (2-аміно-етил)-фосфінової (343 мг, 1,1 ммоль). Суміш перемішували при кімнатній температурі протягом 1 години, потім додавали натрій триацетоксіборогідрид (329 мг, 1,5 ммоль). Після перемішування при кімнатній температурі всю ніч, реакцію гасили водою, перемішували при кімнатній температурі протягом 30 хвилин, потім розбавляли етилацетатом, і промивали водним NaHCO3. Органічний шар висушували над MgSO4 і очищали на колонку із силікагелем з елююванням етилацетатом (100 %), з наступним елююванням метанолом у дихлорметані від 0 до 15 % з одержанням грузлого масла (130 мг, + вихід: 25 %).ESI-МС: 476,3 (M+H) . Приклад 48: (2-{[6-(транс-4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]-аміно}етил)фосфінова кислота До розчину диетилового ефіру (2-{[6-(4-трет-бутил-циклогексилоксі)-нафталін-2-ілметил]аміно}-етил)-фосфінової кислоти (65,00 мг, 0,14 ммоль) в ацетонітрилі (1 мл) додавали бромтриметилсілан (1 мл, 7,58 ммоль). Реакційну суміш потім перемішували при 50 °C всю ніч. Після того, як розчинник концентрували, залишок очищали за допомогою ВЕЖХ (ацетонітрил+ 1 вода, 15-85 %) з одержанням білого осаду (33 мг, вихід: 58).ESI-МС: 420,2 (M+H) ; H ЯМР (400 МГц, ДМСО) δ = 7,81-7,91 (m, 3H), 7,51 (dd, 1H), 7,41 (d, 1H), 7,19 (dd, 1H), 4,40 (m, 1H), 4,31 (s, 2H), 3,12 (m, 2H), 2,21 (d, 2H), 1,97 (m, 2H), 1,82 (d, 2H), 1,36 (q, 2H), 1,22 (q, 2H), 1,08 (m, 1H), 0,88 (s, 9H). Приклад 49: трет-бутиловий ефір 5-гідроксі-2,3-дигідро-індол-1-карбонової кислоти H N Boc2O, CHCl3, Na2CO3(aq) Boc N HO HO 27 UA 107360 C2 5 10 Суміш 2,3-дигідро-1H-індол-5-олу (1,0 г, 7,8 ммоль), ди-трет-бутилдикарбонату (4,0 г, 18 ммоль), хлороформу (20 мл) і насиченого водяного розчину бікарбонату натрію (8 мл) перемішували при кімнатній температурі протягом ночі. Органічну фазу відокремлювали й двічі промивали водою, висушували над MgSO4, фільтрували й концентрували з одержанням неочищеного продукту. Неочищену речовину обробляли простим ефіром і фільтрували з + 1 одержанням продукту (1,1 г, вихід: 60 %).ESI-МС: 258,10 (M+23) , H ЯМР (400 МГц, ДМСО) δ 9,00 (s, 1H), 7,48 (ws, 1H), 6,61 (d, 1H), 6,51 (dd, 1H), 3,84 (t, 2H), 2,96 (t, 2H), 1,48 (s, 9H). Приклад 50: трет-бутиловий ефір 5-(транс-4-трет-бутил-циклогексилоксі)-2,3-дигідро-індол1-карбонової кислоти 2-бутанон 15 20 До суміші трет-бутилового ефіра 5-гідроксі-2,3-дигідро-індол-1-карбонової кислоти (0,6 г, 2,6 ммоль) у трет-бутиловом спирті (8 мл) і 2-бутаноні (4 мл) додавали карбонат цезію (2,5 г, 7,7 ммоль) з наступним додаванням бутил-циклогексилового ефіру метансульфонової кислоти (1,9 г, 7,7 ммоль). Суміш нагрівали в герметично закритої віалі при 100 °C протягом ночі з утворенням осаду. Суміш обробляли дихлорметаном і осад відфільтровували й розчинник концентрували. Залишок очищали на колонку із силікагелем з елююванням етилацетатом у + гексані від 0 до 30 % з одержанням осаду (0,96 г, вихід: 100 %).ESI-МС: 373,30 (M) . Приклад 51: 5-(транс-4-трет-бутил-циклогексилоксі)-2,3-дигідро-1H-індол 2 дні 25 30 До розчину трет-бутилового ефіра 5-(4-трет-бутил-циклогексилоксі)-2,3-дигідро-індол-1карбонової кислоти (0,92 г, 2,5 ммоль) у ТГФ (10 мл) додавали 4 M HCl у диоксані (6 мл, 25 ммоль). Суміш перемішували при кімнатній температурі протягом 48 годин з утворенням білого осаду. Дану суміш розділяли на фракції між дихлорметаном і водяним розчином бікарбонату натрію, і органічну фазу висушували над MgSO4, фільтрували й концентрували. Неочищений продукт очищали на колонку із силікагелем з елююванням метанолом у дихлорметані від 0 до + 8 % з одержанням осаду (0,67 г, вихід: 99 %).ESI-МС: 274,2 (M+H) . Приклад 52: трет-бутиловий ефір 3-трет-бутоксікарбониламіно-4-[5-(транс-4-трет-бутилциклогексилоксі)-2,3-дигідро-індол-1-іл]-4-оксо-масляної кислоти ДМФ 35 40 До розчину 5-(4-трет-бутил-циклогексилоксі)-2,3-дигідро-1H-індолу (110 мг, 0,4 ммоль) у диметилформаміді (2 мл) додавали HOBT моногідрат (10 мг, 0,1 ммоль), 4-трет-бутиловий ефір 2-трет-бутоксікарбониламіно-янтарної кислоти (230 мг, 0,8 ммоль) й N-(3-диметиламінопропіл)N'-етилкарбодіїмід гідрохлорид (92 мг, 0,48 ммоль). Реакційну суміш нагрівали при 50 °C всю ніч. Розчин розбавляли простим ефіром і двічі промивали водою. Органічну фазу висушували над MgSO4, фільтрували й концентрували з одержанням неочищеного продукту (220 мг, вихід: 100 %). Неочищений продукт безпосередньо використовували в Прикладі 53, ESI-МС: 545,4 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBicyclic aryl sphingosine 1-phosphate analogs
Автори англійськоюThomas, Jermaine, Liu, Xiaogao, Lin, Edward, Yin-Shiang, Zheng, Guo, Zhu, Ma, Bin, Caldwell, Richard, D., Guckian, Kevin, M., Kumaravel, Gnanasambandam, Taveras, Arthur, G.
Автори російськоюТомас Джермейн, Лю Сяогао, Лин Эдвард Инь-Шиан, Чжен Го Чжу, Ма Бинь, Колдвелл Ричард Д., Гукиан Кевин М., Кумаравел Гнанасамбандам, Таверас Артур Г.
МПК / Мітки
МПК: A01N 43/42
Мітки: сфінгозин, аналоги, арильні, 1-фосфату, біциклічні
Код посилання
<a href="https://ua.patents.su/102-107360-biciklichni-arilni-analogi-sfingozin-1-fosfatu.html" target="_blank" rel="follow" title="База патентів України">Біциклічні арильні аналоги сфінгозин 1-фосфату</a>
Попередній патент: Спосіб і пристрій для використання кисню в паровому риформінгу біомаси
Наступний патент: Мікрогранули
Випадковий патент: Спосіб очищення пляжних пісків












