Композиції, які містять бензодіазепіни короткої дії
Номер патенту: 115063
Опубліковано: 11.09.2017
Автори: Бейллі Алан Джеймс, Пікок Томас, Грехем Джон Ейткен, Уорд Кевін Річард
Формула / Реферат
1. Ліофілізована або висушена розпиленням композиція, яка містить щонайменше один бензодіазепін формули (І):
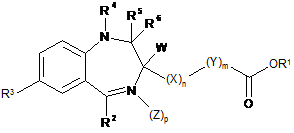 , (І)
, (І)
де
W являє Н;
X являє СН2; n дорівнює 1;
Υ являє СН2; m дорівнює 1;
Ζ являє О;
R1 являє СН3, СН2СН3, СН2СН2СН3, СН(СН3)2 або СН2СН(СН3)2;
R2 являє 2-фторфеніл, 2-хлорфеніл або 2-піридил;
R3 являє Сl або Br;
R4, R5 і R6 утворюють групу -CR8=U-V=, де R8 являє водень, С1-С4алкіл або С1-С3гідроксіалкіл, U являє N або CR9, де R9 являє Н, С1-С4алкіл, С1-С3гідроксіалкіл або С1-С4алкокси, V являє N або СН, і p дорівнює 0,
або його фармацевтично прийнятну сіль, де композиція містить щонайменше один фармацевтично прийнятний гігроскопічний ексципієнт, де гігроскопічний ексципієнт представляє вуглевод, вибраний із групи, яка складається із дисахаридів і декстрану, і композиція необов'язково є щонайменше частково аморфною.
2. Композиція за п. 1, де бензодіазепін формули (І) представляє метил 3-[(4S)-8-бром-1-метил-6-(піридин-2-іл)-4Н-імідазо[1,2-а]бензодіазепін-4-іл]пропаноат (ремімазолам).
3. Композиція за п. 2, де фармацевтично прийнятна сіль бензодіазепіну у даній композиції формулюється в катіонній формі, і протиіон представляє бензолсульфонат (безилат).
4. Композиція за одним з пп. 1-3, де декстран має молекулярну масу, нижчу ніж 150 кДа.
5. Композиція за одним з пп. 1-3, де дисахарид вибраний із групи, яка складається із лактози, мальтози, сахарози і трегалози.
6. Композиція за одним з пп. 1-3, де композиція містить суміш першого гігроскопічного ексципієнта і другого гігроскопічного ексципієнта.
7. Композиція за п. 6, де композиція містить суміш дисахариду і декстрану, переважно суміш лактози і декстрану.
8. Композиція за п. 7, де співвідношення в мас. % лактози і декстрану знаходиться в межах від 1:1,0 до 1:10, переважно від 1:1,2 до 1:5 і переважніше 1:1,5 або 1:4.
9. Композиція за одним з пп. 1-3, де співвідношення в мас. % загальної кількості гігроскопічних ексципієнтів і загальної кількості бензодіазепінів або їх солей у перерахунку на основу в композиції становить від 20:1 до 1:1, переважно від 12:1 до 3:1, найбільш переважно від 9:1 до 3:1.
10. Композиція за одним з пп. 1-3, яка є фармацевтичним складом.
11. Застосування суміші щонайменше одного дисахариду і щонайменше одного декстрану для отримання фармацевтичної композиції, яка містить бензодіазепін із складноефірною групою карбонової кислоти, визначений у п. 1, або його фармацевтично прийнятну сіль, зокрема ремімазолам.
12. Спосіб отримання фармацевтичної композиції, який включає стадії:
a) підготовки розчину, який містить бензодіазепін за п. 1 або його фармацевтично прийнятну сіль, зокрема ремімазолам;
b) додавання щонайменше одного гігроскопічного ексципієнта, який представляє вуглевод, вибраний із групи, яка складається із дисахаридів і декстрану, або їх суміші, щонайменше із іншим гігроскопічним ексципієнтом;
c) висушування розчину із стадії b) ліофілізацією або розпилювальним сушінням.
Текст
Реферат: Винахід стосується ліофілізованої або висушеної розпиленням композиції, яка містить щонайменше один бензодіазепін та щонайменше один фармацевтично прийнятний гігроскопічний ексципієнт, де гігроскопічний ексципієнт представляє вуглевод, вибраний із групи, яка складається із дисахаридів і декстрану, і композиція необов'язково є щонайменше частково аморфною. UA 115063 C2 (12) UA 115063 C2 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується композицій, які містять бензодіазепіни або їх фармацевтично прийнятних солей, і їх застосувань. Сполуки бензодіазепіну відомі за рахунок їх здатності зв'язуватися із сайтом у комплексі специфічний ГАМК-рецептор/хлоридний іонний канал, який відомий як рецептор ГАМК А. Зв'язування сполуки бензодіазепіну потенціює зв'язування інгібуючого нейромедіатора 7аміномасляної кислоти (ГАМК) із комплексом, приводячи тим самим до інгібування нормальної функції нейронів. Терапевтичні цілі лікування сполуками бензодіазепіну полягають, зокрема, у забезпеченні седативного або гіпнотичного ефекту, індукції анксіолізису, індукції міорелаксації, лікування судом або індукції і/або підтримці анестезії у ссавця. Загальну інформацію див. в Goodman and Gilman's "The Pharmacological Basis of Therapeutics", Eighth Edition; Gilman A.G., Rall T.W., Nies A.S., Taylor P., Eds.; Pergamon Press: New York, 1990, pp. 303-304, 346-358. Безодіазепіни короткої дії, які забезпечують швидше відновлення, були предметом клінічних випробувань (W. Hering et al., Anesthesiology, 1996, 189, 85 (Suppl.); J. Dingemanse et al., Br. J. Anaesth., 1997, 79, 567-574). Додаткові сполуки розкриті в WO 96/23790, WO 96/20941 і патенті США № 5665718. Інші публікації, у яких описані бензодіазепінони, включають E. Manghisi and A. Salimbemi, Boll. Chim. Farm., 1974, 113, 642-644; W.A. Khan and P. Singh, Org. Prep. Proc. Int., 1978, 10, 105-111 і J.B. Hester Jr. et al., J. Med. Chem., 1980, 23, 643-647. Бензодіазепіни, такі як діазепам, лоразепам і мідазолам, усі зазнають метаболізму в результаті залежних від печінки процесів. Активні метаболіти, які часто метаболізуються значно повільніше, ніж вихідний лікарський засіб, можуть утворюватися в результаті цих печінкових механізмів і фактично пролонгувати дію багатьох бензодіазепінів (T.M. Bauer et al., Lancet, 1995, 346, 145-147). Ненавмисна підвищена седація пов'язана із застосуванням бензодіазепінів (A. Shafer, Crit. Care Med., 1998, 26, 947-956), зокрема, у відділеннях інтенсивної терапії, де часто застосовуються бензодіазепіни, такі як мідазолам. Бензодіазепіни короткої дії додатково розкриваються в WO 2000/69836 A1. Бензодіазепіни, розкриті у даній заявці, містять складноефірну групу карбонової кислоти, і інактивуються неспецифічними тканинними естеразами. В WO 2008/007071 А1 розкривається висококристалічна безилатна сіль бензодіазепіну із складноефірною групою карбонової кислоти, як описано в WO 2000/69836 A1. В WO 2008/007081 А1 розкривається езилатна сіль бензодіазепіну. Продукти, які застосовуються як седативних засобів або анестетики звичайно зберігаються при кімнатній температурі. Отже, є потреба у забезпеченні композицій бензодіазепінів короткої дії, які мають достатню стабільність при кімнатній температурі. Крім того, для продуктів, які повинні бути стерильними, наприклад, для ін'єкційного введення різними шляхами, спосіб, використовуваний для виробництва таких композицій, повинен гарантувати стерильність, наприклад, із використанням фільтрації в асептичних умовах. Метою даного винаходу, зокрема, є забезпечення фармацевтично прийнятних композицій із достатньою стабільністю при кімнатній температурі для бензодіазепінів короткої дії, як розкрито в WO 2000/69836 A1, WO 2008/007071 A1 і WO 2008/007081 А1. Результати тестів, які проводилися із цими сполуками, показали, що водні розчини сполук не мають достатньої стабільності при кімнатній температурі і демонструють сильну деградацію протягом короткого періоду часу. Отже, альтернативні підходи не були знайдені. Відомим методом стабілізації нестійких у воді сполук є метод ліофілізації. Однак одна ліофілізація бензодіазепінів, описана в WO 2008/007071 A1, не приводила до забезпечення задовільної стабільності даного бензодіазепіну. У наш час заявники даного винаходу встановили, що можуть бути отримані стабільні ліофілізовані композиції, коли формулюються суміші бензодіазепіну із гігроскопічними ексципієнтами, і/або, коли ліофілізована композиція є щонайменше частково аморфною. Крім того, було показано, що можна використовувати альтернативний процес сушіння, а саме розпилювальне сушіння, для досягнення того ж ефекту. Отже, перший аспект винаходу являє композицію, яка містить суміш щонайменше одного бензодіазепіну або його фармацевтично прийнятної солі і щонайменше одного фармацевтично прийнятного гігроскопічного ексципієнта, де бензодіазепін містить щонайменше одну складноефірну групу карбонової кислоти. Згідно із винаходом бензодіазепін переважно представляє сполуку формули (I): 1 UA 115063 C2 5 10 15 20 25 30 35 40 45 , де W являє Н, С1-С4алкіл із розгалуженим або прямим ланцюгом; X являє CH2, NH або NCH3; n дорівнює 1 або 2; Y являє O або CH2; m дорівнює 0 або 1; Z являє O; p дорівнює 0 або 1; 1 R являє С1-С7алкіл із прямим ланцюгом, С3-С7алкіл із розгалуженим ланцюгом, С1С4галогеналкіл, С3-С7циклоалкіл, арил, гетероарил, аралкіл або гетероаралкіл; 2 R являє феніл, 2-галогенфеніл або 2-піридил; 3 R являє H, Cl, Br, F, I, CF3 або NO2; 4 5 6 (1) R являє Н, С1-С4алкіл або діалкіламіноалкіл, і R і R разом представляють один атом кисню або S, який зв'язаний із діазепіновим кільцем подвійним зв'язком, і р дорівнює 0 або 1; 4 5 6 7 або (2) R і R разом утворюють подвійний зв'язок у діазепіновому кільці, і R являє групу NHR , 7 де R являє Н, С1-С4алкіл, С1-С4гідроксіалкіл, бензил або бензил, незалежно моно- або дизаміщений замісниками - атомами галогену, С1-С4алкілпіридил або С1-С4алкілімідазоліл, і р 4 5 6 8 8 дорівнює 0; або (3) R , R і R утворюють групу -CR =U-V=, де R являє водень, С1-С4алкіл, або 9 9 С1-С3гідроксіалкіл, U являє N або CR , де R являє Н, С1-С4алкіл, С1-С3гідроксіалкіл або С1С4алкокси, V являє N або СН, і р дорівнює 0. У тому розумінні, у якому тут використовується термін "арил", самостійно або в комбінації, він визначається, як моноциклічна або поліциклічна група, переважно моноциклічна або біциклічна група, наприклад, феніл або нафтил, яка може бути незаміщена або заміщена, наприклад, одним або більше, і зокрема, одним-трьома замісниками, вибраними із атома галогену, С1-С4алкілу із розгалуженим або прямим ланцюгом, С1-С4алкокси, С1-С4галогеналкілу, гідрокси, нітро, аміно і таке інше. У тому розумінні, у якому тут використовується термін "гетероарил", він визначається як 5-членна або 6-членна гетероциклічна ароматична група, яка може необов'язково містити конденсоване бензольне кільце і де зазначена 5-членна або 6членна гетероциклічна ароматична група може бути незаміщеною або заміщеною, наприклад, одним або більше, зокрема, одним-трьома замісниками, вибраними із атома галогену, С1С4алкілу із розгалуженим або прямим ланцюгом, С1-С4алкокси, С1-С4галогеналкілу, гідрокси, нітро, аміно і таке інше. У тому розумінні, у якому тут використовується термін "алкокси", він включає алкільну групу, яка з'єднана через атом кисню із вихідною молекулярною субодиницею. Зразкові алкоксигрупи включають, необов'язково обмежуючись цим, метокси, етокси і ізопропокси. У тому розумінні, у якому тут використовується термін "аралкіл", він визначається, як алкільна група, у якій один із атомів водню заміщений арильною групою. У тому розумінні, у якому тут використовується термін "гетероаралкіл", він визначається, як алкільна група, у якій один із атомів водню заміщений гетероарильною групою. Зразкові С1-С4алкільні групи із розгалуженим або прямим ланцюгом включають, необов'язково обмежуючись цим, метил, етил, пропіл, ізопропіл, ізобутил і н-бутил. Зразкові С1С7алкільні групи із прямим ланцюгом включають, необов'язково обмежуючись цим, метил, етил, пропіл, н-бутил, н-гексил і н-гептил. Зразкові С3-С7алкільні групи із розгалуженим ланцюгом включають, необов'язково обмежуючись цим, ізопропіл, ізобутил, втор-бутил, трет-бутил, ізопентил, неопентил, трет-пентил і ізогексил. Зразкові С3-С7циклоалкільні групи включають, необов'язково обмежуючись цим, циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Зразкові С1-С4галогеналкільні групи включають, необов'язково обмежуючись цим, метил, етил, пропіл, ізопропіл, ізобутил і н-бутил, незалежно заміщені одним або більше атомами галогену, наприклад, атомом фтору, хлору, брому і йоду. 4 5 6 8 Сполуки формули (I), де R , R і R разом утворюють групу -CR =U-V=, і р дорівнює 0, представляють кращий варіант здійснення винаходу, і можуть бути, відповідно, представлені сполукою формули (II): 2 UA 115063 C2 , 1 2 3 8 де R , R , R , R , U, V, W, X, Y, n і m мають значення, певні для формули (I). Також кращими є сполуки формули (I): 5 10 15 20 25 , де W являє Н; X являє CH2; n дорівнює 1; Y являє CH2; m дорівнює 1; Z являє O; p дорівнює 0 або 1; 1 R являє СН3, СН2СН3, СН2СН2СН3, СН(СН3)2 або СН2СН(СН3)2; 2 R являє 2-фторфеніл, 2-хлорфеніл або 2-піридил; 3 R являє Cl або Br; 4 5 6 (1) R являє Н, С1-С4алкіл або діалкіламіноалкіл, і R і R разом представляють один атом кисню або S, який зв'язаний із діазепіновим кільцем подвійним зв'язком, і р дорівнює 0 або 1; 4 5 6 7 або (2) R і R разом являють подвійний зв'язок у діазепіновому кільці, і R являє групу NHR , де 7 R являє Н, С1-С4алкіл, С1-С4гідроксіалкіл, бензил або бензил, незалежно моно- або дизаміщений замісниками - атомами галогену, С1-С4алкілпіридил або С1-С4алкілімідазоліл, і р 4 5 6 8 8 дорівнює 0; або (3) R , R і R утворюють групу -CR =U-V=, де R являє водень, С1-С4алкіл або 9 9 С1-С3гідроксіалкіл, U являє N або CR , де R являє Н, С1-С4алкіл, С1-С3гідроксіалкіл або С1С4алкокси, V являє N або СН, і р дорівнює 0. Переважно, зокрема, у сполуках формули (II) W являє Н, Х являє СН 2, n дорівнює 1; Y являє 1 2 СН2; m дорівнює 1; R являє СН3, СН2СН3, СН2СН2СН3, СН(СН3)2 або СН2СН(СН3)2; R являє 23 8 9 фторфеніл, 2-хлорфеніл або 2-піридил; R являє Cl або Br; R являє Н, СН3 або СН2ОН; R 9 являє Н, СН3, СН2ОН або СН2О-трет-бутил; U являє CR або N; і V являє N або СН. Серед даних сполук особливо кращими є сполуки формули (II), де в будь-якій сполуці W 1 2 3 8 являє Н, Х являє СН2, n дорівнює 1; Y являє СН2; m дорівнює 1; і де R , R , R , R , U і V для будь-якої сполуки є наступними: 3 UA 115063 C2 5 10 15 20 25 30 35 Серед даних сполук найбільш кращим є ремімазолам (INN), де W являє H, Х являє СН 2, n 1 2 3 8 дорівнює 1, Y являє СН2, m дорівнює 1, R являє СН3, R являє 2-піридил, R являє Br, R являє СН3, U являє СН і V являє N. Згідно із системою ІЮПАК ремімазолам представляє метил 3[(4S)-8-бром-1-метил-6-(піридин-2-іл)-4Н-імідазо[1,2-a][1,4]бензодіазепін-4-іл]пропаноат. Він був розроблений для клінічного застосування PAION AG, Aachen під міжнародним кодом "CNS7056". У формі безилатної солі він також позначається як "CNS7056B" (див. експериментальні дані нижче). Сполуки формули (I) і (II) містять стереоцентр. Згідно із винаходом можна використовувати енантіомерно чисті форми, які, по суті, не містять іншого енантіомера, але також можуть використовувати рацемічні суміші. Композиція за винаходом може містити вільну форму бензодіазепіну, але в кращому варіанті здійснення бензодіапін використовується у формі солі, зокрема, у формі неорганічної або органічної солі. У найкращому варіанті здійснення бензодіазепін використовується у вигляді солі в катіонній формі. Протиіон катіонного бензодіапіну переважно вибраний із галогенідів, зокрема, фториду, хлориду або броміду, сульфату, органічних сульфатів, сульфонату, органічних сульфонатів, нітрату, фосфату, саліцилату, тартрату, цитрату, малеату, форміату, малонату, сукцинату, ізетіонату, лактобіонату і сульфамату. Солі за винаходом отримують взаємодією бензодіазепіну із придатними кислотами, зокрема, взаємодією із наступними кислотами: соляною, бромистоводневою, сірчаною, азотною, фосфорною, саліциловою, п-толуолсульфоновою, винною, лимонною, метансульфоновою, малеїновою, мурашиною, малоновою, бурштиновою, ізетіоновою, лактобіоновою, нафталін-2-сульфоновою, сульфаміновою, етансульфоновою і бензолсульфоновою. У кращому варіанті здійснення протиіон вибраний із органічних сульфатів і органічних сульфонатів, зокрема, із ароматичних сульфатів і ароматичних сульфонатів. У найкращому варіанті здійснення органічний сульфонат використовується як протиіон, переважно ароматичного сульфонату, зокрема, п-толуолсульфонової кислоти (тозилату), нафталін-2сульфонової кислоти, етансульфонової кислоти (езилату) або бензолсульфонової кислоти, де бензолсульфонова кислота (безилат) є найкращим протиіоном. Найкращими солями за даним винаходом є безилатна сіль (розкрита в WO 2008/007071 А1) або езилатна сіль (розкрита в WO 2008/007081 А1) ремімазоламу. Тозилатна сіль ремімазоламу також є кращою і предметом WO 2013029431 А1. 4 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиції за одним аспектом винаходу містять щонайменше один фармацевтично прийнятний гігроскопічний ексципієнт. Гігроскопічний ексципієнт може представляти органічну або неорганічну речовину, але переважно є органічною речовиною. Гігроскопічний ексципієнт не включає воду, оскільки вода може бути присутньою на додаток до гігроскопічного ексципієнту. Гігроскопічний ексципієнт переважно представляє сполуку, яка здатна утворювати стабільні гідрати. Гігроскопічний ексципієнт переважно представляє сполуку, яка в нормальних умовах (25 °C, 1013,25 гПа) зв'язує молекули води зворотно і переважно також здатна вивільняти молекули води, коли прикладається достатній вакуум і/або тепло. Навпаки гігроскопічний ексципієнт, отриманий застосуванням вакууму і/або тепла після дегідратації, знову здатний зв'язувати молекули води. В умовах нормальної температури (25 °C) тиск парів води гідратованих гігроскопічних ексципієнтів переважно нижче 23 гПа, переважніше 20 гПа, переважно нижче 15 гПа, зокрема, нижче 10 гПа. В особливо кращому варіанті здійснення тиск водної пари гідратованого гігроскопічного ексципієнта перебуває в межах від 2 до 20 гПа, переважніше від 5 до 15 гПа. Дегідратований гігроскопічний ексципієнт переважно має здатність зв'язувати щонайменше 0,01 г, переважніше щонайменше 0,03 г, зокрема щонайменше 0,05 г або щонайменше 1 г води на г гігроскопічної сполуки. У кращому варіанті здійснення дегідратований гігроскопічний ексципієнт переважно може зв'язувати до 5 г, переважніше до 10 г, зокрема, до 20 г води на г гігроскопічної сполуки. Органічні гігроскопічні ексципієнти за винаходом переважно мають молекулярну масу нижче, ніж 400 кДа, переважно нижче, ніж 350 кДа, переважніше нижче, ніж 100 кДа, найбільш переважно нижче, ніж 20 кДа і ще переважніше нижче, ніж 1 кДа. У найкращому варіанті здійснення гігроскопічний ексципієнт має молекулярну масу нижче, ніж 0,1 кДа. Згідно із винаходом термін "ексципієнт" визначається, як інгредієнт, навмисно доданий до субстанції лікарського препарату, який не має фармакологічних властивостей у використовуваній кількості. Такі ексципієнти служать деяким іншим корисним цілям, наприклад, полегшують обробку, підвищують розчинність або розчинення, доставку лікарського препарату через необхідний шлях введення або сприяють забезпеченню стабільності. У контексті даного винаходу визначення "фармацевтично прийнятний" призначає для включення будь-якої сполуки, яка не виявляє негативного впливу на ефективність біологічної активності активного інгредієнта і яка не є токсичною для хазяїна, якому її вводять. У кращому варіанті здійснення органічний гігроскопічний ексципієнт вибраний із вуглеводів і/або органічних полімерів. Згідно із винаходом "вуглевод" являє органічну сполуку емпіричної формули Cm(H 2O)n (де m може відрізнятися від n). У структурному відношенні вуглеводні можуть бути описані, як полігідроксіальдегіди і кетони. У тому розумінні, у якому тут використовується термін "сахарид" або "цукор", він представляє синонім терміна "вуглевод". Вуглеводи діляться на чотири хімічні групи: моносахариди, дисахариди, олігосахариди і полісахариди. У тому розумінні, у якому тут використовується термін "вуглеводи", він включає всі модифікації, похідні і аналоги вуглеводів, такі як кислі сахариди, які містять карбоксильні групи, фосфатні групи і/або групи складних ефірів сірчаної кислоти. У найкращому варіанті здійснення органічний гігроскопічний ексципієнт являє вуглевод або суміш різних щонайменше двох типів вуглеводів. Придатними вуглеводами є, наприклад, амілоза, амілопектин, альгінат, декстрани, крохмалі, а також моно-, ди- і олігосахариди. Заявники даного винаходу встановили, що застосування гігроскопічних вуглеводів або їх сумішей особливо придатні для отримання стабільних твердих лікарських складів/композицій наприклад, ліофілізованих або висушених розпиленням композицій, бензодіазепінів, зокрема, солей ремімазоламу, які мають придатний час відновлення. У кращому варіанті здійснення вуглевод має молекулярну масу нижче, ніж 150 кДа, переважно нижче, ніж 100 кДа, зокрема, нижче, ніж 80 кДа, особливо переважно нижче, ніж 20 кДа і додатково переважно нижче, ніж 1 кДа (наприклад, нижче, ніж 0,5 кДа). У кращому варіанті здійснення оліго- або полісахаридні ланцюги не є циклічними, тобто вони не представляють циклічні геміацетали або гемікетали. В особливо кращому варіанті здійснення декстрани із молекулярною масою нижче, ніж 150 кДа, переважно нижче, ніж 100 кДа, зокрема, нижче, ніж 80 кДа, використовуються як гігроскопічний ексципієнт. Найкращі декстрани мають молекулярну масу в межах від 5 до 80 кДа, зокрема, у межах від 10 до 40 кДа. У ще одному особливо кращому варіанті здійснення моно- або олігосахариди використовуються як гігроскопічні ексципієнти, або як один гігроскопічний ексципієнт або в суміші щонайменше із ще одним додатковим гігроскопічним ексципієнтом, таким як декстран 5 UA 115063 C2 5 10 15 20 25 30 де олігосахариди переважно не є циклічними. У даному варіанті здійснення вуглевод переважно вибраний із моносахаридів і С2-6-олігосахаридів, зокрема, із дисахаридів. Дисахарид переважно вибраний із лактози, мальтози, сахарози і трегалози, і найкращою є лактоза. У ще одному варіанті здійснення можуть використовуватися два або більше дисахаридів, зокрема, включаючи лактозу. Дані дисахариди можна об'єднати із додатковими ексципієнтами, наприклад, декстраном. У ще одному найбільш кращому варіанті здійснення органічний гігроскопічний ексципієнт є полімером, переважно поліакрилатом або вініловим полімером, переважніше полівінілпіролідоном. У кращому варіанті здійснення полівінілпіролідон має молекулярну масу нижче, ніж 150 кДа, переважно нижче, ніж 100 кДа, зокрема, нижче, ніж 50 кДа. Особливо кращі полівінілпіролідони мають молекулярну масу в межах від 5 до 40 кДа, зокрема, у межах від 10 до 30 кДа. У додатковому варіанті здійснення винаходу гігроскопічний ексципієнт являє суміш щонайменше двох різні гігроскопічних ексципієнтів, зокрема, конкретніше двох, трьох, чотирьох, п'яти або більше ексципієнтів. Дані щонайменше два різні ексципієнти можуть бути однієї і тієї ж хімічної природи, наприклад, обидва можуть являти вуглеводи або обидва можуть являти органічні полімери. Альтернативно вони можуть бути різної хімічної природи, наприклад, один або більше являють вуглеводи і один або більше являють органічні полімери. У кращому варіанті здійснення винаходу композиція містить суміш щонайменше двох вуглеводів. Такі щонайменше два вуглеводи можуть бути одного і того ж типу вуглеводів, наприклад, вони можуть являти, відповідно, моносахариди, дисахариди, олігосахариди або полісахариди. Вуглеводи можуть альтернативно являти різні типи вуглеводів, наприклад, один або більше моносахаридів, об'єднаних із одним або більше дисахаридом і т. п. Кращою є комбінація щонайменше одного дисахариду щонайменше із одним або більше полісахаридом. Особливо кращою є комбінація одного дисахариду і одного полісахариду. Дисахарид переважно являє лактозу, і полісахарид переважно являє декстран, зокрема, із молекулярною масою 80 кДа або нижче. Композиція переважно містить ремімазолам, переважно у вигляді безилатної, езилатної або тозилатної солі. Особливо кращою є безилатна сіль. Особливо кращі суміші вуглеводів за винаходом містять або складаються із комбінацій, представлених у таблиці: Дисахарид 1 Лактоза Трегалоза Сахароза Лактоза Трегалоза Сахароза Лактоза Лактоза Лактоза Лактоза Трегалоза Трегалоза 35 40 45 Дисахарид 2 Трегалоза Сахароза Трегалоза Сахароза Сахароза Сахароза Полісахарид Декстран 40 Декстран 40 Декстран 40 Декстран 70 Декстран 70 Декстран 70 Декстран 40 Декстран 40 Декстран 70 Декстран 70 Декстран 40 Декстран 70 Композиція із вищевказаними сумішами дисахариду/декстрану переважно містить ремімазолам, у вигляді безилатної, езилатної або тозилатної солі. Особливо кращою є безплатна сіль. Як вказувалося вище, заявники за даним винаходом встановили, що композиція за винаходом, зокрема, композиція із сумішшю, яка містить щонайменше один дисахарид, такий як лактоза, і щонайменше один декстран, можуть утворювати стабільну тверду речовину, зокрема, ліофілізовану або висушену розпиленням, композиції із прийнятною ліофілізацією (яка також називається "загальною тривалістю циклу") і/або часом відновлення. Згідно із винаходом придатний час відновлення становить 5 хв. або менше, переважно 3 хв. або менше, переважніше 2 хв. або навіть 1 хв. Час відновлення, який становить 1 хв., також є кращим і час відновлення, який становить менше 1 хв., є найкращим. Час ліофілізації композиції за винаходом переважно дорівнює менше 120 год., переважно менше 100 год., переважніше менше 80 год. і ще переважніше менше 70 год. і, зокрема, 66 год. 6 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 Таке зниження часу ліофілізації, зокрема, має місце, коли стадія сушіння проводиться при 25 °C і нижче 100 мторр (наприклад між 90 і 100 мторр), або при -15 °C або вище і 350-750 мторр. Заявники даного винаходу встановили кореляцію між кількістю полімеру, зокрема, полісахариду, конкретніше декстрану, і часом, необхідним для ліофілізації: із підвищенням кількості полісахариду в суміші вуглеводних ексципієнтів підвищується температура колапсу композиції, і знижується час, необхідний для ліофілізації. Наприклад, композиція із сіллю ремімазоламу, яка додатково містить лактозу і декстран, у масовому співвідношенні 1:1, показує час ліофілізації, який становить 99 год., у той час як для такої ж композиції із лактозою і декстраном, які знаходяться у масовому співвідношенні 1:4, потрібен час ліофілізації, який становить тільки 66 год. або менше. У сумішах ексципієнтів (ексципієнтів різної хімічної природи або різних типів, див. вище) співвідношення в мас. % першого ексципієнта (наприклад, дисахариду) і другого ексципієнта (наприклад, декстрану) може знаходитися в межах від 1:1 до 1:10, переважніше від 1:1 до 1:6, ще переважніше від 1:1 до 1:5 і ще переважніше від 1:1,0 до 1:4,5. У конкретному варіанті здійснення зазначене співвідношення в мас. % становить 1:1,5 або 1:4. Перший ексципієнт являє, зокрема, лактозу, і другий ексципієнт переважно є декстраном, зокрема, декстраном 70 або декстраном 40. Лактозу можна використовувати у вигляді гідрату. Однак, якщо не зазначено інакше, то зазначені точні масові співвідношення і концентрації, наведені тут, стосуються лактози. Теж саме стосується інших ексципієнтів, які придатні для застосування в даному винаході. Особливо переважно, коли відносна кількість полісахариду у суміші перевищує відносну кількість дисахаридів у ній. Отже, 50 мас. % або вище суміші вуглеводів може становити полісахарид, переважніше 60 мас. % або вище, ще переважніше 80 мас. % або вище. У бінарній суміші інша частина переважно являє дисахарид. У даних варіантах здійснення винаходу можливо збільшити час ліофілізації, тобто забезпечити вищі температури колапсу. Переважно полісахарид являє декстран. Композиція за винаходом може містити бензодіазепін або його сіль, переважно безилатну сіль або тозилатну сіль ремімазоламу, у відносній кількості від 5 до 50 мас. %, переважніше у відносній кількості від 8 до 25 мас. %, ще переважніше у відносній кількості від 10 до 20 мас. % і, зокрема, у відносних кількостях 10 або 19 мас. %. Необхідно відзначити, що всі відносні кількості, масові співвідношення і т. д. бензодіазепіну, зокрема, ремімазоламу, у композиціях за винаходом розраховані в перерахунку на вільну основу, якщо не зазначено інакше. Композиція за винаходом може містити загальну кількість гігроскопічних ексципієнтів, переважно вуглеводу або суміші вуглеводів, у відносній кількості від 50 до 95 мас. %, переважніше у відносній кількості від 75 до 92 мас. %, ще переважніше у відносній кількості від 80 до 90 мас. % і, зокрема, у відносних кількостях 81 або 90 мас. %. Співвідношення в мас. % загальної кількості гігроскопічних ексципієнтів до загальної кількості бензодіазепінів або її солей у композиції - розраховано у перерахунку на вільну основу - переважно становить щонайменше 1:1, переважніше щонайменше 2:1, 3:1 або 4:1, зокрема, щонайменше 5:1, 6:1, 7:1 або 9:1. В особливо кращих варіантах здійснення співвідношення в мас. % загальної кількості гігроскопічних ексципієнтів до загальної кількості бензодіазепінів або її солей у композиції, розраховано в перерахунку на вільну основу, переважно становить щонайменше від 1:1 до 100:1, зокрема, у межах від 3:1 до 50:1, переважніше в межах від 5:1 до 25:1, найбільш переважно в межах від 7:1 до 15:1, і в найкращому варіанті здійснення становить 13:1. В одному варіанті здійснення винаходу композиція містить тільки гігроскопічні ексципієнти. В одному аспекті композиція за винаходом має температуру колапсу вище -20,5 °C, переважно вище -18 °C і переважніше вище -15,5 °C. У додатковому аспекті композиції за винаходом температура колапсу композиції підвищується при додаванні щонайменше однієї сполуки із температурою колапсу вище -20 °C (модифікатор температури колапсу). У додатковому аспекті композиція за винаходом також містить щонайменше одну сполуку із температурою колапсу вище -20 °C (далі по тексту називається "модифікатором температури колапсу"). Даний компонент додається до композиції, яка потім висушується (зокрема, ліофілізацією) із отриманням твердої композиції. Модифікатор температури колапсу за даним винаходом може бути вибраний із групи, яка складається із співполімеру сахарози і епіхлоргідрину (такого як Ficoll ), желатину і гідроксіетилкрохмалю (HES) або декстрану. У кращому варіанті здійснення винаходу 7 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 60 модифікатор температури колапсу являє HES. У ще одному кращому варіанті здійснення винаходу модифікатор температури колапсу являє декстран. Модифікатор температури колапсу може бути присутнім у композиції за винаходом у відносній кількості від 1 до 75 мас. %, переважніше у відносній кількості від 5 до 50 мас. %, ще переважніше у відносній кількості від 10 до 40 мас. %. Модифікатор температури колапсу може бути ідентичний гігроскопічному ексципієнту. У тому розумінні, у якому тут використовується термін "температура колапсу", він стосується температури, при якій розм'якшення твердої композиції ("таблетка") прогресує до структурного "колапсу", явище, яке можна спостерігати із використанням мікроскопії із висушуванням заморожуванням (FDM). У кристалізаційній системі колапс відбувається, якщо перевищується найменша температура евтектичного плавлення (Teu). У некристалізаційній системі температура колапсу визначається температурою склування (Tg), яку можна визначити із використанням диференціальної скануючої калориметрії (ДСК). Температуру колапсу може визначити фахівець у даній галузі. Отже, для аморфної речовини температура колапсу дається у вигляді температури склування. Отже, термін "колапс", зокрема, стосується втрати інтегральної структури твердої композиції (грудки) і/або до зменшення її об'єму щонайменше приблизно на 10 %, 25 %, 50 %, 75 %, 85 %, 95 % або 100 %. Зменшення об'єму і втрату структурної цілісності можна визначити із використань методологій, які включають, не обмежуючись цим, візуальний огляд або аналіз площі поверхні Брунауера-Еммета-Теллера (BET). В одному аспекті винаходу протиіон може надавати солі гігроскопічності. Отже, у даному варіанті здійснення сіль бензодіазепіну також являє ексципієнт. У ще одному варіанті здійснення композиції за винаходом можуть додатково містити, крім щонайменше одного гігроскопічного ексципієнта, фармацевтично прийнятні носії і/або ексципієнти. Додаткові носії і/або ексципієнти, якщо вони використовуються, звичайно, повинні бути прийнятними відносно сумісності із іншими інгредієнтами композиції і не повинні бути токсичними для пацієнта. Отже, даний винахід у додатковому варіанті здійснення стосується композиції, як тут визначено вище, і додаткових фармацевтично прийнятних носіїв і/або ексципієнтів. Додатковий носій і/або ексципієнт може бути вибраний, наприклад, із аскорбінової кислоти, гліцину, гліцину гідрохлориду, хлориду натрію, цукрових спиртів і їх сумішей. У кращому варіанті здійснення додатковий ексципієнт вибраний із цукрових спиртів, зокрема, С 3-6 цукрових спиртів, переважніше С6 цукрових спиртів. У тому розумінні, у якому тут використовується термін "цукровий спирт" (також відомий як поліол, багатоатомний спирт або поліспирт), він визначається як гідрогенізована форма вуглеводу, карбонільна група якого (альдегід або кетон редукуючий цукор) відновлена до первинної або вторинної гідроксильної групи. Другим аспектом винаходу є композиція, яка містить щонайменше один бензодіазепін або його фармацевтично прийнятну сіль, де щонайменше частині композиції є аморфними, і де бензодіазепін містить щонайменше одну складноефірну групу карбонової кислоти. Композиція також може містити кристалічні частини/сполуки. У ще одному аспекті винаходу композиція містить суміш зазначеного бензодіазепіну щонайменше із одним гігроскопічним ексципієнтом, де зазначена композиція є щонайменше частково аморфною, але може містити кристалічні частини. Композиція за винаходом в кращому варіанті здійснення є твердою композицією, зокрема, отриманою ліофілізацією або розпилювальним сушінням. Висушена композиція містить щонайменше одну сполуку (наприклад, ексципієнт) у аморфній формі. У кращому варіанті здійснення ліофілізована композиція складається із суміші аморфних і кристалічних, зокрема, мікрокристалічних частин/сполук. У кращому варіанті здійснення кристалічна частина ліофілізованих твердих речовин містить або переважно, по суті, складається із похідних бензодіазепіну або їх солей. У додатковому варіанті здійснення винаходу щонайменше 50 % (мас./мас.), переважно щонайменше 75 % (мас./мас.), переважно щонайменше 90 % (мас./мас.) і найбільш переважно щонайменше 95 % (мас./мас.) бензодіазепіну в композиції перебуває в аморфному стані. У кращому варіанті здійснення щонайменше 96 %, 97 %, 88 % або 99 % (мас./мас.) перебуває в аморфному стані. У кращому варіанті здійснення композиція є аморфною щонайменше на 96 %, 97 %, 88 % або 99 %. В одному варіанті здійснення винаходу композиція містить суміш кристалічного і аморфного бензодіазепіну або солі бензодіазепіну. В одному варіанті здійснення щонайменше 25 %, 5075 % або більше ніж 90 % (мас./мас.) загальної кількості бензодіазепіну або солі бензодіазепіну композиції є кристалічними. 8 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 У найкращому варіанті здійснення винаходу сіль бензодіазепіну являє безилатну сіль ремімазоламу. Коли композиція містить кристалічну безилатну сіль ремімазоламу, в одному варіанті здійснення кристалічний поліморф (позначений безилатною формою 1) має спектр порошкової дифракції рентгенівських променів (XRPD), який має характерні піки приблизно при 7,3; 7,8; 9,4; 12,1; 14,1; 14,4; 14,7 або 15,6 градусів два-тета. Переважно безилатна форма 1 кристалічного поліморфа ремімазоламу має спектр XRPD, який має характерні піки приблизно при 7,3; 7,8; 9,4; 12,1; 14,1; 14,4; 14,7 і 15,6 градусів дватета. Переважніше безилатна форма 1 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 7,25 (10,60); 7,84 (72,60); 9,36 (12,10); 12,13 (32,50); 14,06 (48,50); 14,41 (74,30); 14,70 (50,70); 15,60 (26,90) [кут градусів два-тета (процентна відносна інтенсивність)]. Переважно безилатна форма 1 кристалічного поліморфа має початкову температуру плавлення при диференціальній скануючій калориметрії (ДСК) у межах 187-204 °C, переважно приблизно при 191-192 °C. Структура кристалізованих із суміші 2-метоксіетанол:пентилацетат голчастих кристалів форми 1 руйнувалася при 190К (R-Фактор 6,3, приклад 9 в WO2008/007071 A1). Форма 1 має стехіометрію 1:1 сполука:безилат. Її кристалографічна асиметична одиниця містить дві незалежні молекули сполуки і дві молекули безилату. Дві незалежні молекули сполуки одноразово протоновані в імідазольному кільці. Кристалічна структура має розміри елементарної комірки кристала, які дорівнюють а=7,6868 Å, b=29,2607 Å, с=12,3756 Å, α=90С, β=97,7880, γ=90, і просторову групу Р21. Кристалічна структура додатково має наступні -3 параметри: моноклінна, об'єм: 2757,86 Å, щільність: 1,439 г/см , поглинання: 1,610 мкм [MoKα] -1 (мм ), F(000): 1224. Параметр Flack "Enantiopole" був визначений, як такий, що дорівнює 0,03. Кристалічна структура також описана більш докладно в прикладі 9 WOO2008/007071 A1, і кристалографічні координати представлено на фігурі 5А-5D (відповідають таблиці 17 в WO2008/007071 A1). Довжина і кути зв'язку форми 1 представлено на фігурах 7А-В і 8А-С (відповідають таблицям 19 і 20 в WO2008/007071 A1). Згідно із винаходом композиція може містити безилатну сіль ремімазоламу, яка являє кристалічний поліморф, який містить кристал із розмірами елементарної комірки кристала, які дорівнюють а=7,6868 Å, b=29,2607 Å, с=12,3756 Å, α=90 °C, β=97,7880, γ=90. Також даний винахід стосується композиції із безилатною сіллю ремімазоламу, яка являє кристалічний поліморф, який має кристалічну структуру, певну структурними координатами, як показано на фігурі 5А-D. Кристалічна форма переважно має довжини і кути зв'язків, показано відповідно на фігурах 7А-В і 8А-С. У додатковому варіанті здійснення композиція за винаходом містить поліморф безилатної солі ремімазоламу (позначений безилатною формою 2), який має спектр порошкової дифракції рентгенівських променів (XRPD), який має характерні піки приблизно при 8,6; 10,5; 12,0; 13,1; 14,4; або 15,9 градусів два-тета. Переважно безилатна форма 2 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 8,6; 10,5; 12,0; 13,1; 14,4; або 15,9 градусів два-тета. Переважніше безилатна форма 2 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 8,64 (17,60); 10,46 (21,00); 12,03 (22,80); 13,14 (27,70); 14,42 (11,20); 15,91 (100,00) [кут два-тета градусів (процентна відносна інтенсивність)]. Переважно безилатна форма 2 кристалічного поліморфа має початкову температуру плавлення при диференціальній скануючій калориметрії (ДСК) у межах 170-200 °C, переважно приблизно при 180 °C. Структура етанол:етилацетат голчастих кристалів форми 2 руйнувалася при 190К (R-Фактор 3,8, приклад 10 в WO2008/007071 A1). Форма 2 має стехіометрію 1:1 сполука:безилат. Її кристалографічна асиметична одиниця містить одну молекулу сполуки і одну молекулу безилату. Молекула сполуки одноразово протонована в імідазольному кільці. Кристалічна структура має розміри елементарної комірки, які дорівнюють а=8,92130 Å, b=11,536 Å, с=25,8345 Å, α=90С, β=90, γ=90, і просторову групу Р212121. Кристалічна структура додатково -3 має наступні параметри: орторомбічна, об'єм: 2570,65 Å, щільність: 1,544 г/см , поглинання: -1 1,727 мк [MoKα] (мм ), F(000): 1224. Параметр Flack "Enantiopole" був визначений, як такий, що дорівнює 0,011. Кристалічна структура також описана більш докладно в прикладі 10 WO2008/007071 A1, і кристалографічні координати представлено на фігурі 6А-С (відповідає таблиці 18 в WO2008/007071 A1). Довжина і кути зв'язку форми 2 представлено на фігурах 9 і 10, відповідно, (відповідають таблицям 21 і 22 в WO2008/007071 A1). 9 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 Згідно із винаходом забезпечується композиція із безилатною сіллю ремімазоламу, яка являє кристалічний поліморф, який містить кристал із розмірами елементарної комірки, які дорівнюють а=8,92130 Å, b=11,1536 Å, с=25,8345 Å, α=90 °C, β=90, γ=90°. Також даний винахід стосується композиції із безилатною сіллю ремімазоламу, яка являє кристалічний поліморф, який має кристалічну структуру, певну структурними координатами, як показано на фігурі 6А-С. Композиція безилатної солі ремімазоламу згідно із винаходом має довжини і кути зв'язків, як показано, відповідно, на фігурах 9 і 10. У додатковому варіанті здійснення винаходу забезпечується композиція із кристалічним поліморфом безилатної солі ремімазоламу (позначений безилатною формою 3), який має спектр порошкової дифракції рентгенівських променів (XRPD), який має характерні піки приблизно при 7,6; 11,2; 12,4; 14,6; 15,2; 16,4 і 17,7 градусів два-тета. Переважно безилатна форма 3 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 7,6; 11,2; 12,4; 14,6; 15,2; 16,4 або 17,7 градусів два-тета. Переважніше безилатна форма 3 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 7,61 (65,70); 11,19 (33,20); 12,38 (48,70); 14,63 (30,60); 15,18 (33,20); 16,40 (29,60); 17,68 (51,30) [кут два-тета градусів (процентна відносна інтенсивність)]. Переважно безилатна форма 3 кристалічного поліморфа має початкову температуру плавлення при диференціальній скануючій калориметрії (ДСК) у межах 195-205 °C, переважно приблизно при 200-201 °C. У додатковому варіанті здійснення винаходу забезпечується композиція із кристалічним поліморфом безилатної солі ремімазоламу (позначеним безилатною формою 4), який має спектр XRPD, який має характерні піки приблизно при 7,6; 10,8; 15,2; 15,9 або 22,0 градусів дватета. Переважно безилатна форма 4 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 7,6; 10,8; 15,2; 15,9 або 22,0 градусів два-тета. Переважно безилатна форма 4 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 7,62 (83,50); 10,75 (14,70); 15,17 (37,80); 15,85 (28,70); 22,03 (100) [кут два-тета градусів (процентна відносна інтенсивність)]. Переважно безилатна форма 4 кристалічного поліморфа має початкову температуру плавлення при диференціальній скануючій калориметрії (ДСК) у межах 180-185 °C, переважно приблизно при 182 °C. Безилатні форми 1-4 можуть бути отримані і кристалізовані із використанням способів і розчинників, розкритих в WO2008/007071 A1. Кращою сіллю є безилатна форма 1, яка основана на надійності утворення, виході, чистоті, хімічній стабільності і стабільності твердої форми. В одному варіанті здійснення композиція містить суміш форм 1, 2, 3 і 4. Однак можливі композиції тільки із однією із форм 1-4. У ще одному кращому варіанті здійснення сіль бензодіазепіну являє езилатну сіль ремімазоламу. Коли композиція містить кристалічну езилатну сіль ремімазоламу в одному варіанті здійснення, то кристалічний поліморф (позначений тут як "езилатна форма 1") має спектр порошкової дифракції рентгенівських променів (XRPD), який має характерні піки приблизно при 6,2; 9,2; 12,3; 15,0; 17,2 або 20,6 градусів два-тета. Переважно езилатна форма 1 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 6,2; 9,2; 12,3; 15,0; 17,2 або 20,6 градусів два-тета. Переважніше езилатна форма 1 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 6,7 (19,30); 9,21 (20,50); 12,28 (16,40); 14,97 (23,40); 17,18 (52,80); 20,63 (100,00) [кут градусів два-тета (процентна відносна інтенсивність)]. Переважно езилатна форма 1 кристалічного поліморфа має початкову температуру плавлення при диференціальній скануючій калориметрії (ДСК) у межах 195-205 °C, переважно приблизно при 201-202 °C. У додатковому варіанті здійснення винаходу забезпечується кристалічний поліморф езилатної солі сполуки формули (I) (позначений езилатною формою 2), який має спектр порошкової дифракції рентгенівських променів (XRPD), який має характерні піки приблизно при 3,6; 6,4; 7,1; 12,3; 14,1 і 17,1 градусів два-тета. Переважно езилатна форма 2 кристалічного поліморфа має спектр XRPD, який має характерні піки приблизно при 3,6; 6,4; 7,1; 12,3; 14,1 або 17,1 градусів два-тета. Переважніше кристалічний поліморф має спектр XRPD, який має характерні піки приблизно при 3,57 (15,60); 6,42 (21,10); 7,13 (58,30); 12,29 (51,50); 14,10 (58,90); 17,13 (68,00) [кут два-тета градусів (процентна відносна інтенсивність)]. 10 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважно езилатна форма 2 кристалічного поліморфа має початкову температуру плавлення при диференціальній скануючій калориметрії (ДСК) у межах 185-195 °C, переважно приблизно при 190-191 °C. Езилатні форми 1 і 2 можуть бути отримані і кристалізовані із використанням способів і розчинників, розкритих в WO2008/007081 A1. Кращою сіллю є езилатна форма 1, яка ґрунтується на надійності утворення, виході, чистоті, хімічній стабільності і стабільності твердої форми. В одному варіанті здійснення винаходу композиція містить суміш форм 1 і 2. Однак можливі композиції тільки із однією із форм 1 або 2. Ліофілізована форма композиції за винаходом переважно використовується для зберігання композицій. Тверда форма композицій, зокрема, ліофілізованих або висушених розпиленням твердих речовин, переважно демонструє дуже високу стабільність при зберіганні. У кращому варіанті здійснення вони показують деградацію бензодіазепіну, зокрема, гідроліз складноефірної групи карбонової кислоти на рівні менше 1 % при зберіганні протягом 13 тижнів, зокрема, при зберіганні в умовах 40 °C/75 % відносної вологості. Тверді, зокрема ліофілізовані або висушені розпиленням, композиції за винаходом у кращому варіанті здійснення мають строк зберігання при кімнатній температурі щонайменше протягом 1 року, переважніше щонайменше протягом 2 років, зокрема щонайменше протягом 3 років. Вони додатково містять у кращому варіанті здійснення менше ніж 5 мас. % води, переважно менше ніж 2 мас. % води, переважніше менше ніж 1 мас. % води. У твердій формі, зокрема ліофілізованій або висушеній розпиленням, у композиціях за винаходом загальна кількість бензодіазепінів або їх солей і гігроскопічних ексципієнтів переважно доходить щонайменше до 50 % мас. %, переважніше щонайменше до 70 % мас. %, зокрема щонайменше до 90 % мас. %. У ще одному кращому варіанті здійснення композиції за винаходом знаходяться у рідкій формі, переважніше у вигляді водних розчинів. Із одного боку, рідка форма використовується для отримання ліофілізованих або висушених розпиленням твердих речовин, а із іншого - для отримання солюбілізацією ліофілізованих або висушених розпиленням твердих речовин, коли ліофілізована композиція переводиться у придатний фармацевтично прийнятний розчин. Рідина містить відновлений твердий бензодіазепін у вигляді вільної основи переважно в концентрації в межах від 0,5 до 30 мг/мл, переважніше в концентрації в межах від 1 до 20 мг/мл, зокрема, у концентрації в межах від 2 до 10 мг/мл. Додатковим предметом даного винаходу є фармацевтичний препарат, який містить композицію за винаходом. Отже, предметом винаходу також є спосіб виробництва композиції або фармацевтичної композиції за винаходом, де композиція або фармацевтична композиція перебуває у твердому стані, яка включає наступні стадії: а) підготовки розчину, який містить щонайменше один бензодіазепін щонайменше із однією складноефірною групою карбонової кислоти або його фармацевтично прийнятну сіль (зокрема, сіль ремімазоламу), як тут описано вище, і щонайменше один фармацевтично прийнятний гігроскопічний ексципієнт або суміш щонайменше двох гігроскопічних ексципієнтів, як тут описано вище, де розчин переважно являє водний розчин і де розчин переважно має рН в межах від 2 до 7, переважно від 2 до 5 і переважніше від 2 до 4; b) ліофілізації розчину за п. (а). У кращому варіанті здійснення час ліофілізації на стадії (b) становить менше ніж 120 год., переважно менше ніж 100 год., переважніше менше ніж 80 год., ще переважніше менше ніж 70 год., і конкретно 66 год. або навіть менше. Переважно тверда композиція, отримана на стадії b) відновлюється рідкою фармацевтичною композицією на додатковій стадії с). Відновлення твердої композиції, отриманої на стадії b), переважно можливо протягом менше ніж 5 хв., менше ніж 3 хв., найбільш переважно протягом менше ніж 1 хв. Для відновлення може використовуватися фізіологічний розчин (0,9 % мас. % хлориду натрію). У ще одному варіанті здійснення винаходу ліофілізація на стадії b) може бути замінена розпилювальним сушінням. Отже, предметом винаходу також є спосіб отримання композиції або фармацевтичної композиції за винаходом, де композиція або фармацевтична композиція перебуває в рідкому стані, який включає стадію солюбілізації композиції за винаходом, де вихідна композиція перебуває у твердому стані, переважно ліофілізована або висушена розпиленням, і де вихідна композиція переважно щонайменше частково є аморфною. Солюбілізація твердої, переважно 11 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 60 ліофілізованої або висушеної розпиленням композиції переважно проводиться водою, водним розчином декстрози або фізіологічними розчинами. Композиція за винаходом, зокрема, фармацевтична, переважно представлена в разових лікарських формах, таких як ампули або одноразові обладнання для ін'єкцій, такі як шприци. Вона також може знаходитися в мультидозових формах, таких як сулія або флакон, із яких може бути відібрана відповідна доза. Усі такі композиції повинні бути стерильними. У кращому варіанті здійснення винаходу ампули, обладнання для ін'єкцій і мультидозові форми містять композицію за винаходом, зокрема, фармацевтичний препарат у твердій формі, переважно ліофілізований або висушений розпиленням, і композиція переводиться в готові для застосування фармацевтичні препарати солюбілізацією композицій тільки незадовго до їх застосування. Композиції за винаходом включають придатні для перорального, ректального, місцевого, букального (наприклад, сублінгвального) і парентерального (наприклад, підшкірного, внутрішньом'язового, внутрішньошкірного або внутрішньовенного) введення. Переважно представити композиції за даним винаходом у формі фармацевтичної композиції для парентерального введення, найбільш переважно для будь-якого типу ін'єкцій, зокрема, для внутрішньовенної, внутрішньоартеріальної, внутрішньолюмбальної, внутрішньоочеревинної, внутрішньом'язової, внутрішньошкірної, підшкірної або внутрішньокісткової ін'єкції. У тих випадках, коли фармацевтична композиція призначена для парентерального введення, композиція може представляти водний або неводний розчин або суміш рідин, які можуть містити бактеріостатичні агенти, антиоксиданти, буфери або інші фармацевтично прийнятні добавки. Краща формуляція композицій за даним винаходом, являє водне кисле середовище із рН 2-7, переважно 2-5 і переважно 2-4, або водний розчин циклодекстрину. Циклодекстрини, які можна використовувати для даних формуляцій, представляють похідні негативно зарядженого сульфобутилового ефіру (SBE) β-CD, зокрема, SBE7-β-CD, промислово доступного на ринку під торговельною назвою Captisol виробництва CyDex, Inc. (Critical Reviews in Therapeutic Drug Carrier Systems, 14(1), 1-104, 1997)) або гідроксипропіл-CD. Кращий спосіб формуляції (тобто кислий буфер або на основі CD) може залежати від фізико-хімічних властивостей (наприклад, розчинності у воді, рКа і т. д.) конкретної композиції. Коли композиція перебуває у твердій формі, зокрема, у ліофілізованому стані, то тверду форму відповідним чином переважно солюбілізують перед застосуванням як водного кислого середовища, переважно із отриманням рН у межах 2-4 розчину або водного розчину циклодекстрину. Відповідно одному аспекту винаходу забезпечується тверда фармацевтична композиція. Дана композиція містить 5-25 мас. % солі ремімазоламу, переважно безилатної солі, переважно 8-23 мас. %, ще переважніше 10-19 мас. %. Дана композиція може додатково містити від 75 до 95 мас. % одного або більше гігроскопічних ексципієнтів, переважно від 77 до 92 мас. % і переважніше від 81 до 90 мас. %. Переважно гігроскопічні ексципієнти представляють суміш вуглеводів, яка містить до 40 мас. % лактози, 38 мас. %, переважніше до 33 мас. % дисахариду, переважно лактози. Інша частина суміші може бути декстраном. В одному варіанті здійснення тверда композиція, описана вище, не містить додаткових ексципієнтів. У ще одному варіанті здійснення тверда композиція складається тільки із солі ремімазоламу, декстрану і дисахариду (наприклад, лактози). У ще одному варіанті здійснення композиція складається тільки із солі ремімазоламу і лактози (може бути представлена як гідрат). У ще одному варіанті здійснення композиція являє рідку композицію, яка складається із ремімазоламу, декстрану, дисахариду і розчинника, який переважно являє фізіологічний розчин (0,9 мас. % хлориду натрію). Значення рН такої рідкої (водної) композиції, переважно відновленої із твердої композиції, може знаходитися в межах приблизно від 3 до приблизно 4, переважно приблизно від 3,2 до приблизно 3,3, і переважніше від 3,21 до 3,28. Отже, даний винахід також стосується способу отримання седативного або гіпнотичного ефекту у ссавця, який включає введення ссавцеві ефективної седативної або гіпнотичної кількості фармацевтичного препарату за даним винаходом, як було визначено раніше. Даний винахід також стосується способу індукції анксіолітичного ефекту у ссавця, який включає введення ссавцеві ефективної анксіолітичної кількості фармацевтичного препарату за даним винаходом, як було визначено раніше. Даний винахід також стосується способу індукції міорелаксації у ссавця, який включає введення ссавцеві ефективної міорелаксантної кількості фармацевтичного препарату за даним винаходом, як було визначено раніше. Даний винахід також стосується способу лікування судом у ссавця, який включає введення ссавцеві ефективної протисудомної кількості фармацевтичного препарату за даним винаходом, як було 12 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 визначено раніше. Даний винахід також стосується способу індукції або підтримки анестезії у ссавця, який включає введення ссавцеві ефективної анестетичної кількості фармацевтичного препарату за даним винаходом, як було визначено раніше. Даний винахід також стосується застосування седативної або гіпнотичної кількості композиції у ссавця, як було визначено раніше, у виробництві лікарського препарату для отримання седативного або гіпнотичного ефекту у ссавця, включаючи людину. Даний винахід також стосується застосування анксіолітичної кількості композиції згідно із даним винаходом у ссавця, як було визначено раніше, у виробництві лікарського препарату для отримання анксіолітичного ефекту у ссавця, включаючи людину. Даний винахід також стосується застосування міорелаксантної кількості композиції згідно із даним винаходом у ссавця, як було визначено раніше, у виробництві лікарського препарату для отримання міорелаксації у ссавця, включаючи людину. Даний винахід також стосується застосування протисудомної кількості композиції згідно із даним винаходом у ссавця, як було визначено раніше, у виробництві лікарського препарату для лікування судом у ссавця, включаючи людину. Даний винахід також стосується застосування анестетичної кількості композиції згідно із даним винаходом у ссавця, як було визначено раніше, у виробництві лікарського препарату для індукції або підтримки анестезії у ссавця, включаючи людину. Даний винахід також стосується застосування фармацевтичного препарату за винаходом для отримання седативного або гіпнотичного ефекту, і/або індукції анксіолітичного ефекту, і/або індукції міорелаксації, і/або лікування судом, і/або індукції або підтримки анестезії у ссавця. Внутрішньовенне введення може проводитися у формі болюс-ін'єкції або, переважніше, тривалої інфузії. Лікарська форма для будь-якого суб'єкта може варіювати, однак, придатна кількість для внутрішньовенного введення або доза для сполук за даним винаходом для отримання седативного або гіпнотичного ефекту у ссавців буде становити від 0,01 до 5,0 мг/кг маси тіла, і конкретніше від 0,02 до 0,5 мг/кг маси тіла, вищевказані дози виражені на основі маси сполуки, яка представляє активний інгредієнт (тобто маси бензодіазепіану). Придатна кількість для внутрішньовенного введення або доза сполук за даним винаходом для отримання анксіолітичного ефекту у ссавців буде становити від 0,01 до 5,0 мг/кг маси тіла, і конкретніше від 0,02 до 0,5 мг/кг маси тіла, вищевказані дози виражені на основі маси сполуки, яка представляє активний інгредієнт. Придатна кількість для внутрішньовенного введення або доза для сполук за даним винаходом для отримання міорелаксації у ссавців буде становити від 0,01 до 5,0 мг/кг маси тіла, і конкретніше від 0,02 до 0,5 мг/кг маси тіла, вищевказані дози виражені на основі маси сполуки, яка представляє активний інгредієнт. Придатна кількість для внутрішньовенного введення або доза для сполук за даним винаходом для лікування судом у ссавців буде становити від 0,01 до 5,0 мг/кг маси тіла, і конкретніше від 0,02 до 0,5 мг/кг маси тіла, вищевказані дози виражені на основі маси сполуки, яка представляє активний інгредієнт. Таким чином, придатний фармацевтичний препарат для парентерального введення людям переважно буде містити від 0,1 до 20 мг/мл сполуки за даним винаходом в розчині або його помножена кількість для мультидозових флаконів. У ще одному аспекті винахід стосується застосування суміші щонайменше одного дисахариду і щонайменше декстрану для отримання твердої композиції, яка містить щонайменше один бензодіазепін, який містить щонайменше одну складноефірну групу карбонової кислоти, або його фармацевтично прийнятну сіль, яка переважно є сіллю ремімазоламу (зокрема, його безилатною або тозилатною сіллю). Переважно суміш містить або складається із лактози і декстрану, переважно декстрану із молекулярною масою 80 кДа або нижче (наприклад, декстрану 40 або декстрану 70). Тверда композиція має придатний час відновлення. Зокрема, винахід стосується наступних варіантів здійснення. У варіанті здійснення 1 винахід стосується композиції, яка містить щонайменше один бензодіазепін, який містить щонайменше одну складноефірну групу карбонової кислоти, або його фармацевтично прийнятну сіль, де композиція: а) містить щонайменше один фармацевтично прийнятний гігроскопічний ексципієнт і/або; b) композиція щонайменше частково є аморфною. Варіант здійснення 2 стосується композиції за варіантом здійснення 1, де бензодіазепін представляє сполуку формули (I): 13 UA 115063 C2 5 10 15 20 25 30 35 40 45 , де W являє Н, С1-С4алкіл із прямим або розгалуженим ланцюгом; X являє CH2, NH або NCH3; n дорівнює 1 або 2; Y являє O або CH2; m дорівнює 0 або 1; Z являє O; p дорівнює 0 або 1; 1 R являє С1-С7алкіл із прямим ланцюгом, С3-С7алкіл із розгалуженим ланцюгом, С1С4галогеналкіл, С3-С7циклоалкіл, арил, гетероарил, аралкіл або гетероаралкіл; 2 R являє феніл, 2-галогенфеніл або 2-піридил; 3 R являє H, Cl, Br, F, I, CF3 або NO2; 4 5 6 (1) R являє Н, С1-С4алкіл або діалкіламіноалкіл, і R і R разом представляють один атом кисню або S, який зв'язаний із діазепіновим кільцем подвійним зв'язком, і р дорівнює 0 або 1; 4 5 6 7 або (2) R і R разом утворюють подвійний зв'язок у діазепіновому кільці, і R являє групу NHR , 7 де R являє Н, С1-С4алкіл, С1-С4гідроксіалкіл, бензил або бензил, незалежно моно- або дизаміщений замісниками - атомами галогену, С1-С4алкілпіридил або С1-С4алкілімідазоліл, і р 4 5 6 8 8 дорівнює 0; або (3) R , R і R утворюють групу -CR =U-V=, де R являє водень, С1-С4алкіл або 9 9 С1-С3гідроксіалкіл, U являє N або CR , де R являє Н, С1-С4алкіл, С1-С3гідроксіалкіл або С1С4алкокси, V являє N або СН, і р дорівнює 0. 4Варіант здійснення 3 стосується композиції за варіантом здійснення 2, де р дорівнює 0, і R , 5 6 8 8 R і R утворюють групу -CR =U-V=, де R являє водень, С1-С4алкіл або С1-С3гідроксіалкіл, U 9 9 являє N або CR , де R являє Н, С1-С4алкіл, С1-С3гідроксіалкіл або С1-С4алкокси, V являє N або СН. Варіант здійснення 4 стосується композиції за варіантом здійснення 2 або 3, де W являє Н; X являє CH2; n дорівнює 1; Y являє CH2; m дорівнює 1; 1 R являє СН3, СН2СН3, СН2СН2СН3, СН(СН3)2 або СН2СН(СН3)2; 2 R являє 2-фторфеніл, 2-хлорфеніл або 2-піридил; 3 R являє Cl або Br. Варіант здійснення 5 стосується композиції за одним із варіантів здійснення 2-4, де р 4 5 6 8 8 дорівнює 0, і R , R і R утворюють групу -CR =U-V=, де R являє метил, U являє СН2, V являє N; W являє Н; X являє CH2; n дорівнює 1; Y являє CH2; m дорівнює 1; 1 2 3 R являє CH3; R являє 2-піридил; R являє Br. Варіант здійснення 6 стосується композиції за одним із варіантів здійснення 1-5, де бензодіазепін перебуває у формі фармацевтично прийнятної солі. Варіант здійснення 7 стосується композиції за одним із варіантів здійснення 1-6, де фармацевтично прийнятна сіль бензодіазепіну формулюється в катіонній формі, і протиіон вибраний із галогенідів, зокрема, фториду, хлориду або броміду, сульфату, органічних сульфатів, сульфонату, органічних сульфонатів, нітрату, фосфату, салицилату, тартрату, цитрату, малеату, форміату, малонату, сукцинату, ізетіонату, лактобіонату і сульфамату. Варіант здійснення 8 стосується композиції за варіантом здійснення 7, де протиіон вибраний із органічних сульфатів і сульфонатів, зокрема, ароматичних сульфатів і сульфонатів. Варіант здійснення 9 стосується композиції за варіантом здійснення 8, де протиіон представляє бензолсульфонат (безилат). Варіант здійснення 10 стосується композиції за варіантом здійснення 9, де сіль бензодіазепіну представляє кристалічну безилатну сіль ремімазоламу. Варіант здійснення 11 стосується композиції за одним із варіантів здійснення 1-10, де гігроскопічний ексципієнт представляє сполуку, здатну утворювати стабільні гідрати. Варіант здійснення 12 стосується композиції за одним із варіантів здійснення 1-11, де гігроскопічний ексципієнт представляє органічну сполуку, переважно вибрану із вуглеводів і/або органічних полімерів. 14 UA 115063 C2 5 10 15 20 25 30 35 40 Варіант здійснення 13 стосується композиції за варіантом здійснення 12, де гігроскопічний ексципієнт має молекулярну масу нижче ніж 150 кДа. Варіант здійснення 14 стосується композиції за варіантом здійснення 12 або 13, де вуглевод представляє молекулу декстрану. Варіант здійснення 15 стосується композиції за варіантом здійснення 12 або 13, де вуглевод вибраний із моносахаридів і С2-6-олігосахаридів. Варіант здійснення 16 стосується варіанта здійснення 15, де вуглевод представляє дисахарид, переважно вибраний із групи, яка складається із лактози, мальтози, сахарози і трегалози. Варіант здійснення 17 стосується композиції за варіантом здійснення 12, де органічний полімер являє полівінілпіролідон і переважно має молекулярну масу в межах від 5 до 40 кДа. Варіант здійснення 18 стосується композиції за одним із варіантів здійснення 1-17, де співвідношення в мас. % загальної кількості гігроскопічних ексципієнтів до загальної кількості бензодіазепінів або їх солей у композиції становить щонайменше 1:1, переважно щонайменше 2:1, найбільше переважно щонайменше 5:1. Варіант здійснення 19 стосується композиції за одним із варіантів здійснення 1-18, де композиція перебуває у твердому стані і переважно представляє ліофілізовану тверду речовину. I. СТАБІЛЬНІСТЬ CNS7056; КОМПОЗИЦІЇ ІЗ ВИБРАНИМИ ЕКСЦИПІЄНТАМИ 1. Композиції Загалом, було ліофілізовано 11 композицій безилатної солі ремімазоламу із вибором придатних ексципієнтів, як докладно показано на фігурі 1 і 2. Крім того, також приготували композицію, яка містить тільки безилатну сіль ремімазоламу і відповідні плацебо для кожної композиції (див. фігуру 3). Далі по тексту скорочене позначення "REM" використовується для безилатної солі ремімазоламу. Кожну композицію готували, як описано нижче, і розливали у флакони для сублімаційного сушіння: ексципієнт розчиняли приблизно в 50 мл води. Додавали REM і перемішували до розчинення. Після розчинення значення рН розчинів доводили до 3,10±0,05 сумішшю 0,5 М соляна кислота/2М гідроксид натрію. Аналогічно готували розчини плацебо і розчин, який містить тільки один REM. Кожний розчин доводили до 100 мл і по 1,2 мл кожного розчину відбирали і вносили у флакони місткістю 2 мл. Композиції ліофілізували із використанням сублімаційної сушарки Virtis Genesis 25 EL згідно із наступним циклом: Після сублімаційного сушіння зразки зберігали в шафах для зберігання при 25 °C/60 % відносної вологості і 40 °C/75 % відносної вологості протягом відповідно 13 тижнів ("RH" означає відносну вологість). Аналіз а) Час відновлення Через 13 тижнів зберігання вміст флаконів відновлювали у двох повторюваностях 1,2 мл води для зрошення/ін'єкції і м'яко перемішували для змішування. Реєстрували час, необхідний для повного розчинення. 15 UA 115063 C2 5 10 15 20 25 30 35 b) ВЕРХ Для проведення ВЕРХ вміст кожного флакона відновлювали розчинником для зразків (суміш 50/50 % ацетонітрил/вода об./об.) і вміст переносили в мірну колбу місткістю 25 мл (за винятком флакона тільки із REM, вміст якого переносили в мірну колбу місткістю 50 мл) декількома промиваннями. Композиція із декстраном не розчинна в розчиннику для зразків і її розчиняли 100 % водою. Для кожного зразка також аналізували плацебо таким же чином. Аналізи проводили у двох повторюваностях, якщо не зазначено інакше. Результати а) Час відновлення Час відновлення був прийнятним для всіх зразків. b) ВЕРХ Дослідження появи продукту гідролізу REM (результати наведено на фігурі 4), який утворюється в результаті гідролізу складноефірного зв'язку, виявило, що тільки зразок із REM, а також зразок, який містить маніт, який представляє широко використовуваний ексципієнт для ліофілізації фармацевтичних препаратів, показували низьку стабільність REM, що свідчить про деградацію через 13 тижнів зберігання в умовах 40 °C/75 % відносної вологості більше ніж на 8 %. Зразки, які містять гліцин, показували помірну деградацію, у той час як усі зразки, які містять гігроскопічні ексципієнти (вуглеводи або полівінілпіролідон) показували гарну або дуже гарну стабільність. Зокрема, зразки, які містять вуглеводи (дисахариди або декстран) показували високу стабільність, тобто деградація через 13 тижнів зберігання в умовах 40 °C/75 % відносної вологості була нижче 1 %. На зразках із різними кількостями лактози було встановлено, що чим більше була кількість вуглеводу у порівнянні із кількістю REM, тим вище була стабільність REM. Крім того, при включенні вуглеводу (наприклад, лактози) як компонента лікарської форми CNS 7056, яка спочатку є нестабільною, наприклад, маніт, було можливо підвищити стабільність даної лікарської форми. 2. Дані по стабільності CNS 7056: партії композицій на основі лактози після зберігання строком до 36 місяців 2.1. Введення CNS 7056 представлений для клінічного застосування у вигляді стерильного ліофілізованого порошку для відновлення у флаконах місткістю 20 мл із бромбутилкаучуковою пробкою, які придатні для внутрішньовенної ін'єкції. Кожний флакон містить 26 мг CNS 7056. Під час розробки були приготовлені додаткові партії із 25, 23 і 26 мг CNS 7056. При відновленні певними об'ємом води для ін'єкцій, концентрація CNS 7056 у розчині для введення становить 5 мг/мл. Усі дані продукти мали однакове співвідношення CNS 7056 до лактози в ліофілізованому продукті (тобто співвідношення CNS 7056:лактоза моногідрат становило 1:13). Для всіх інтервалів часу збирали дані по стабільності протягом місяця, і вони показані в наступній таблиці 1. 16 UA 115063 C2 Таблиця 1 Узагальнені дані дослідів по оцінці стабільності партій CNS 7056 Партія А01Р310 Р310-01 (В) 025CNS27 026CNS27 G384 Р02308 Узагальнені дані для CNS 7056 для ін'єкцій по оцінці стабільності Умови зберігання Тип партії Інтервал тестування (місяці) 25С/60 % відносна Партія для клініки по GMP, 0, 1, 3, 6, 9, 12, 18, с с стабільність 24, 36 , 48 вологість 0, 1, 3, 6, 9, 12 30С/65 % відносна вологість 0, 1, 3, 6 40С/75 % відносна вологість 25С/60 % відносна Дослідна лабораторна партія, 0, 1, 3, 6, 9, 12, 18 стабільність вологість 0, 6, 9, 12 30С/65 % відносна вологість 0, 1, 3, 6, 9, 12 40С/75 % відносна вологість 25С/60 % відносна Дослідна лабораторна партія, 0, 1, 2, 3, 6, 9, 12, аb стабільність 18 вологість b 0, 1, 2, 3, 6, 9, 12 40С/75 % відносна вологість 25С/60 % відносна Дослідна лабораторна партія, 0, 1, 2, 3, 6, 9, 12, аb стабільність 18 вологість b 0, 1, 2, 3, 6 40С/75 % відносна вологість 25С/60 % відносна Дослідна лабораторна партія, 0, 1, 2, 3, 6, 9, 12, аb стабільність 18 вологість b 0, 1, 2, 3, 6 40С/75 % відносна вологість 25С/60 % відносна Партія для клініки по GMP, 0, 1, 2, 3, 6, 9, 12, с с стабільність 18, 24, 36 , 48 вологість а 0, 1, 2, 3, 6, 9 , 12 40С/75 % відносна вологість а = доданий інтервал тестування на стабільність. Випробувані флакони із інших резервних флаконів при зазначеній температурі. b = дослідження із стабільності на 025CNSS27, 026CONS27 і G384 завершені. с = необов'язкові тимчасові точки. 2.1.1 Склад партій CNS 7056 5 17 UA 115063 C2 Таблиця 2 Склад різних партій CNS 7056 Сполука Номер партії G384 P02308 025CNS27 CNS7056 основа Лактоза моногідрат 0,12 М Naoh/0,12 M Hcl 026CNS27 23 мг P31001(B) 26 мг A01P310 26 мг 25 мг 25 мг 25 мг 433 мг 433 мг 433мг 398 мг 450,3 мг 450,3 мг до рН 3,1 до рН 3,1 до рН 3,1 до рН 3,1 до рН 3,1 до рН 3,1 qs = додати достатню кількість до 2.1.2 Умови сублімаційного сушіння Умови сублімаційного сушіння партій представлені в наступних таблицях 3-7: 5 Таблиця 3 Цикл сублімаційного сушіння партії 025CNS27 Стадія Процес 1 Завантаження 2 Заморожування 3 4 5 Первинне сушіння Вторинне сушіння Закінчення Температура зберігання (С) 4 Лінійна зміна (С/хв.) 0 Час утримання (хв.) 30 Тиск (мторр) Немає даних -45 0,1 180 Немає даних -25 0,1 1700 100 30 0,2 1300 75 Флакони закривали пробками в атмосфері 95 % чистого азоту Таблиця 4 Цикл сублімаційного сушіння партії 026CNS27 Стадія Процес 1 Завантаження 2 Заморожування 3 4 4 5 Первинне сушіння Первинне сушіння Вторинне сушіння Закінчення Температура зберігання (С) 4 Тиск (мторр) Немає даних -45 0,1 300 Немає даних -25 0,1 2885 100 30 0,2 4100 100 30 0,2 1580 75 Флакони закривали пробками в атмосфері 95 % чистого азоту 18 Лінійна зміна (С/хв.) 0 Час утримання (хв.) 120 UA 115063 C2 Таблиця 5 Цикл сублімаційного сушіння партії G384 Стадія Процес Температура зберігання (С) 4 1 Завантаження 2 Заморожування 3 4 5 Первинне сушіння Вторинне сушіння Закінчення Лінійна зміна (С/хв.) 0 Час утримання (хв.) 10 Тиск (мторр) Немає даних -45 0,1 300 Немає даних -25 0,1 3640 100 30 0,2 1125 70 Флакони закривали пробками в атмосфері 95 % чистого азоту Таблиця 6 Цикл сублімаційного сушіння партії P02308 Стадія Процес 1 Завантаження 2 Заморожування 3 4 5 Первинне сушіння Вторинне сушіння Закінчення Температура зберігання (С) 4 Лінійна зміна (С/хв.) 0 Час утримання (хв.) 60 Тиск (мторр) Немає даних -45 0,1 180 Немає даних -25 0,1 3640 100 30 0,2 1300 75 Флакони закривали пробками в атмосфері 95 % чистого азоту Таблиця 7 Цикл сублімаційного сушіння партії A01P310 Стадія Тиск (мторр) 1 Завантаження Немає даних а 2 Заморожування -45 0,1 210 Немає даних 3 Первинне сушіння -25 0,1 3640 100 4 Вторинне сушіння 30 0,2 1300 75 5 Закінчення Флакони закривали пробками в атмосфері 95 % чистого азоту а = включає 30 хв. для конденсації сполуки. 5 10 15 Процес Температура зберігання (С) 4 Лінійна зміна (С/хв.) 0 Час утримання (хв.) 60 2.2. Методи аналізу 2.2.1. Зовнішній вигляд ліофілізованого продукту Ті самі флакони із CNS7056 (6 для кожної умови зберігання) оглядали візуально, описували зовнішній вигляд і флакони повертали назад на зберігання. Також проводили порівняння із рядом флаконів, які зберігалися в однаковому вторинному упакуванні при 2-8 °C, для оцінки того, наскільки вони різнилися (зокрема, по кольору) із даними контролями і із зразками, які зберігалися при підвищеній температурі. 2.2.2. Вміст CNS7056 у флаконі, концентрація при відновленні і близькі сполуки Аналіз CNS7056 і визначення близьких сполук проводили із використанням ВЕРХ. Для даної мети в будь-який флакон додавали відповідний об'єм WFI і перемішували до повного розчинення. Герметичну прокладку і пробку обережно витягали і пробку ретельно ополіскували і промивні фракції зливали в мірну колбу місткістю 100 мл. Вміст флакона із промивними фракціями розріджувача переносили в мірну колбу. Додавали розріджувач до досягнення об'єму 100 мл (дорівнює концентрації 0,23; 0,25 або 0,26 мг/мл, відповідно). Зразки аналізували ВЕРХ із використанням наступних умов: 19 UA 115063 C2 5 10 15 20 25 30 35 40 Колонка: YMC ODS-AQ, 250×4,6 мм, розмір частинок 3 мкм. Рухома фаза: Res A: 0,01 % трифтороцтова кислота у воді, Res B: 0,01 % трифтороцтова кислота в ацетонітрилі. Градієнт: Швидкість потоку: 1,0 мл/хв. Температура колонки: 40 °C. Автосамплер: кімнатна температура. Детектування: УФ-детектор при 230 нм. Об'єм інжектування: 10 мкл. Час аналізу: 40 хв. Час утримання CNS7056 становить приблизно 15 хв. Вміст CNS7056 визначали в порівнянні із стандартними розчинами, які хроматографували в аналогічних умовах. Близькі сполуки визначали по % нормалізованій площі. Концентрацію відновленого розчину розраховували по наступній формулі: де W t std1 представляє масу стандарту CNS7056B, використаного для приготування стандарту I (мг); MW t CNS7056 основи представляє молекулярну масу вільної основи CNS7056=439,3; MW t CNS7056В представляє молекулярну масу безилатної солі CNS7056=597,5; Р представляє зазначений аналіз у вигляді С на А для стандарту; DF представляє коефіцієнт розведення. Вміст у флаконі розраховували за наступною формулою: де W t std1 представляє масу стандарту CNS7056B, використаного для приготування стандарту I (мг); MW t CNS7056 основи представляє молекулярну масу вільної основи CNS7056=439,3; MW t CNS7056В представляє молекулярну масу безилатної солі CNS7056=597,5; Р представляє зазначений аналіз у вигляді С на А для стандарту; DF представляє коефіцієнт розведення. Для визначення близьких сполук CNS7056, ідентифікували порівняння часу утримання з часом утримання CNS7056 на хроматограмах стандарту. Кількість кожної окремої детектованої близької сполуки розраховували у вигляді відсотка площі для введення будь-якого зразка за наступною формулою: де А = площа піка близької сполуки; Т = загальна площа всіх піків на хроматограмі. 2.2.3. Хіральна чистота Хіральну чистоту CNS 7056 визначали ВЕРХ із використанням наступних умов: Колонка: Chiralpak Ic, 250×4,6 мм, розмір частинок 5 мкм. 20 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 Рухома фаза: фосфатний буфер рН 7,0/вода/ацетонітрил 10/40/50, об./об./об. Розчинник для зразків: суміш вода/ацетонітрил 50/50, об./об. Швидкість потоку: 0,7 мл/хв. Температура колонки: 40 °C. Автосамплер: кімнатна температура. Детектування: УФ-детектор при 250 нм. Об'єм інжектування: 10 мкл. Час аналізу: 35 хв. Час утримання S-енантіомера CNS7056 становить приблизно 21,3 хв. і для R-енантіомера CNS7056 становить приблизно 17,8 хв. (RRT=0,84). Хіральну чистоту розраховували за наступною формулою: де А = площа піка R-енантіомера CNS7056; Т = загальна площа піків CNS7056 і R-енантіомера CNS7056. 2.2.4. Об'єм розчину у флаконі після відновлення (Європейська Фармакопея 2.9.17) Кожний окремий флакон відновлювали 5,0 мл води для ін'єкцій (WFI), Європейська Фармакопея, із використанням шприца BD об'ємом 5 мл із придатною голкою. Після повного відновлення вміст витягали із використанням шприца і голки 21g, і переносили у відкалібрований мірний циліндр місткістю 10 мл. 2.2.5. Зовнішній вигляд відновленого розчину Описували зовнішній вигляд розчину після відновлення. 2.2.6. Час відновлення Два флакони відновлювали 5,0 мл води для ін'єкцій (WFI), Європейська Фармакопея, із використанням шприца BD об'ємом 5 мл і придатної голки, і реєстрували час, необхідне для повного розчинення. 2.2.7. Значення рН Значення рН визначали на двох відновлених розчинах після додавання 5,0 мл води для ін'єкцій (WFI), Європейська Фармакопея, із використанням шприца BD об'ємом 5 мл із придатною голкою. рН визначали на одній аліквотній порції із кожного із двох флаконів. 2.2.8. Осмолярність Осмолярність визначали на двох відновлених розчинах після додавання 5,0 мл води для ін'єкцій (WFI), Європейська Фармакопея, із використанням шприца BD об'ємом 5 мл із придатною голкою. Осмолярність визначали на одній аліквотній порції із кожного із двох флаконів по зниженню точки замерзання у порівнянні із розчином із відомою осмолярністю. Для даної мети 100 мкл відновленого розчину CNS 7056 аналізували на осмометрі, принципом роботи якого є визначення зниження точки замерзання. 2.2.9. Вміст води Вміст води визначали із використанням колориметричного титрування за Карлом-Фішером. Вміст вологи у флаконах із лікарським продуктом CNS 7056 визначали розчиненням усього вмісту флакона із ліофілізованим порошком CNS 7056 у безводному диметилформаміді (ДМФА) і введенням відомої кількості розчину в аноліт калориметричного апарата Карла-Фішера. У реакції Карла-Фішера вода взаємодіє у співвідношенні 1:1 із йодом. Кількість води визначають вимірюванням кількості кулон електрики, необхідної для окиснення іонів йодиду в йод, необхідної для реакції Карла-Фішера. Кількість кулон використовується для розрахунку кількості води, титрованої у мкг, яка показується апаратом. Використовували наступне устаткування і реагенти: Апарат для титрування Карла-Фішера: Mitsubishi CA-100. Аноліт: Hydranal Coulomat AG. Католіт: Hydranal Coulomat CG. Вміст води у ліофілізованому порошку CNS 7056 розраховували за формулою: 21 UA 115063 C2 5 10 15 20 25 30 35 40 45 50 55 де Мзразка = кількість води у розчині зразка, доданого в посудину для титрування (мкг); Мрозчинника = середня кількість води у розчині контролю, доданого в посудину для титрування (мкг); Мрозчинника = маса ДМФА, доданого у флакон (г); Прозчинника = густина розчинника (г/мл); st Для ДМФА d=0,944 г/мл, джерело CRC, handbook 81 видання; Відтитрування = об'єм розчину, доданий у посудину для титрування (мл); Мтв. реч. у флаконі = розрахована загальна маса твердої речовини на флакон, включаючи воду (мг). 2.2.10. Справжність по УФ-спектру Аналіз проводили на одному флаконі в паралелях. Справжність по УФ-спектру підтверджували порівнянням спектра лікарського продукту із спектром стандарту. 2.2.11. Невидимі частинки (ЕР 2.9.19) 10 флаконів відновлювали 5 мл WFI із використанням відповідного стерильного шприца і голки. Вміст флаконів поєднували разом в асептичних умовах і аналізували відповідно Європейської Фармакопеї 2.9.19. 2.2.12. Невидимі частинки (ЕР 2.9.19) 10 флаконів відновлювали 5 мл WFI із використанням відповідного стерильного шприца і голки. Вміст флаконів поєднували разом в асептичних умовах і аналізували відповідно Європейської Фармакопеї 2.9.19. 2.2.13. Бактеріальний ендотоксин Бактеріальний ендотоксин визначали гель-тромб тестом із лізатом Limulus amebocyte (LaLтест) як обмежуючий тест із межею
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions comprising short-acting benzodiazepines
Автори англійськоюGraham, John Aitken, Baillie, Alan James, Ward, Kevin Richard, Peacock, Thomas
Автори російськоюГрэхэм Джон Эйткен, Бэйлли Алан Джэймс, Уорд Кэвин Ричард, Пикок Томас
МПК / Мітки
МПК: A61K 47/26, A61K 9/19, A61K 31/5517
Мітки: короткої, бензодіазепіни, композиції, містять, дії
Код посилання
<a href="https://ua.patents.su/102-115063-kompozici-yaki-mistyat-benzodiazepini-korotko-di.html" target="_blank" rel="follow" title="База патентів України">Композиції, які містять бензодіазепіни короткої дії</a>
Попередній патент: Здатний до розкладання фільтр для курильних виробів
Наступний патент: Контейнер для транспортування продуктів, переважно у вигляді бухт
Випадковий патент: Пристрій передачі зусилля для вікна, дверей або тому подібного












