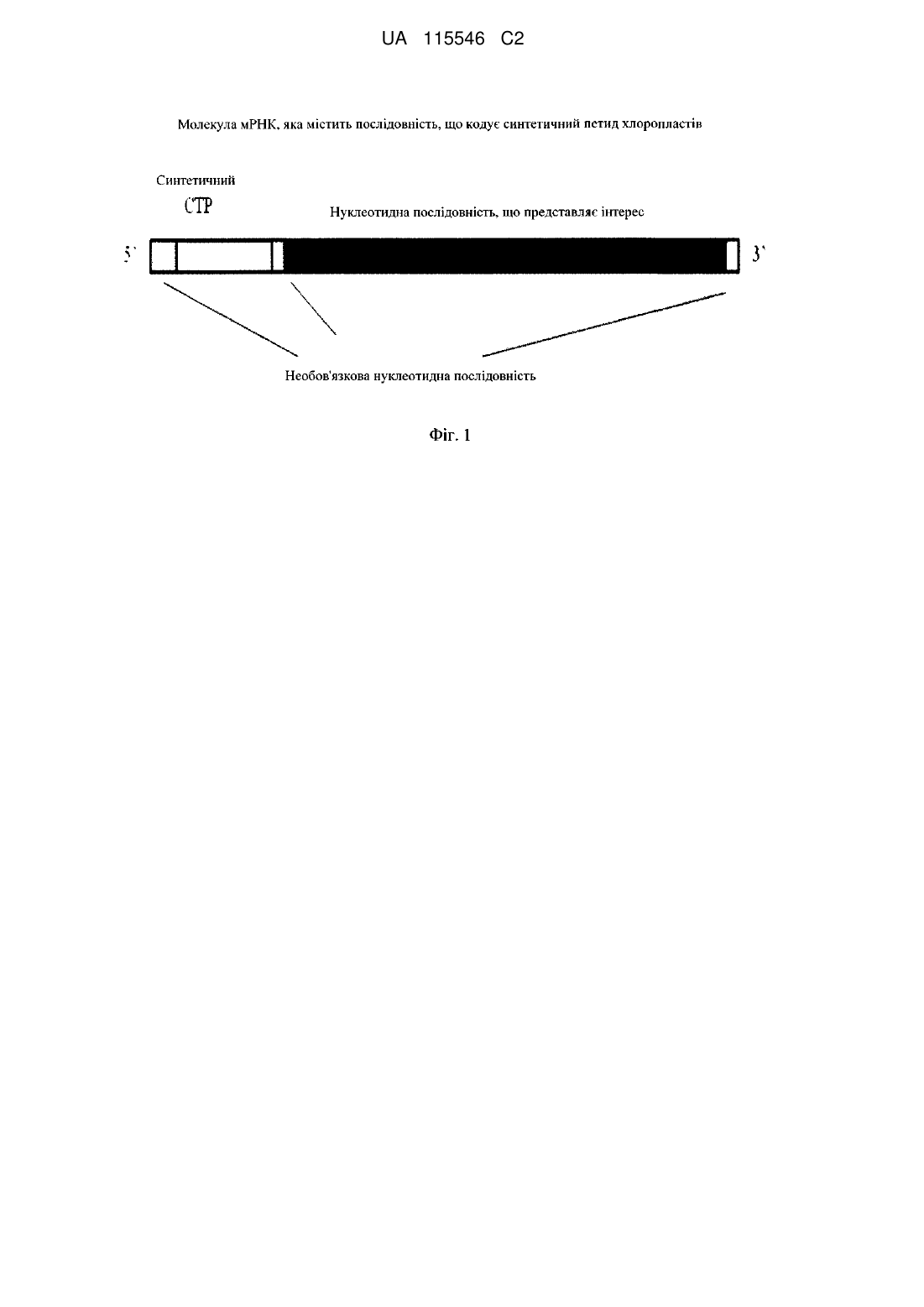
Синтетичний транзитний пептид хлоропластів та спосіб його одержання
Номер патенту: 115546
Опубліковано: 27.11.2017
Автори: Йєркс Карла, Чіккілло Роберт М., Робінсон Ендрю Е., Ліра Джастін М.
Формула / Реферат
1. Конструкція нуклеїнової кислоти для локалізації поліпептиду у хлоропласті, яка характеризується нуклеотидною послідовністю, яка кодує синтетичний транзитний пептид хлоропласта (CTP) із SEQ ID NO: 11, пов'язаною суміжно у рамці зчитування з нуклеотидною послідовністю, що кодує поліпептид, так що конструкція кодує химерний білок, який складається з CTP із SEQ ID NO: 11 і поліпептиду.
2. Конструкція для експресії націленого на хлоропласти поліпептиду в рослинній клітині, яка характеризується геном, що складається із нуклеотидної послідовності SEQ ID NO: 12, пов'язаної суміжно у рамці зчитування з нуклеотидною послідовністю, яка кодує поліпептид.
3. Конструкція за п. 2, в якій нуклеотидна послідовність SEQ ID NO: 12 і нуклеотидна послідовність, що кодує поліпептид, функціонально зв'язані з однією або декількома регуляторними послідовностями.
4. Химерний білок для локалізації поліпептиду у хлоропласті клітини, де химерний білок складається із послідовності транзитного пептиду хлоропластів (CTP) з SEQ ID NO: 11, що пов'язаний суміжно з поліпептидом.
5. Химерний білок за п. 4, який відрізняється тим, що поліпептид бере участь у толерантності рослин до гербіцидів або стійкості до комах.
6. Химерний білок за п. 4, в якому поліпептид являє собою флуоресцентний маркер.
7. Химерний білок за п. 5, в якому поліпептид вибирають з групи, що складається з: ацетолактатсинтази (АЛС), мутантної АЛС, попередників АЛС, 3-енолпірувілшикімат-5-фосфатсинтетази (EPSPS), DGT-28 і Cry2Aa.
8. Клітина трансгенної рослини, яка містить химерний білок за п. 4, де хлоропласти рослинної клітини містять поліпептид.
9. Клітина трансгенної рослини за п. 8, в якій поліпептид являє собою флуоресцентний маркер.
10. Клітина трансгенної рослини за п. 8, в якій поліпептид бере участь в толерантності рослин до гербіцидів або у стійкості до комах.
11. Клітина трансгенної рослини за п. 10, в якій поліпептид вибраний із групи що складається з: ацетолактатсинтази (АЛС), мутантної АЛС, попередників АЛС, 3-енолпірувілшикімат-5-фосфатсинтетази (EPSPS), DGT-28 і Cry2Aa.
12. Трансгенний рослинний матеріал, що експресує поліпептид в хлоропластах, який відрізняється тим, що трансгенний рослинний матеріал містить клітину рослини за п. 8, де рослинний матеріал вибирають з групи, що складається з рослинної тканини, культури рослинних тканин, калюсної культури, частини рослини і цілої рослини.
13. Трансгенний рослинний матеріал за п. 12, який відрізняється тим, що рослинним матеріалом є ціла рослина.
14. Трансгенний рослинний матеріал за п. 13, який відрізняється тим, що поліпептидом є флуоресцентний маркер.
15. Трансгенний рослинний матеріал за п. 13, який відрізняється тим, що поліпептид бере участь у толерантності рослин до гербіцидів або у стійкості до комах.
16. Трансгенний рослинний матеріал за п. 15, який відрізняється тим, що поліпептид вибраний з групи, що складається з: ацетолактатсинтази (АЛС), мутантної АЛС, попередників АЛС, 3-енолпірувілшикімат-5-фосфатсинтетази (EPSPS), DGT-28 і Cry2Aa.
17. Трансгенний рослинний матеріал за п. 13, який відрізняється тим, що рослина вибрана з групи, яка складається з Arabidopsis, люцерни, Brassica, бобів, броколі, капусти, моркви, цвітної капусти, селери, китайської капусти, бавовни, огірка, баклажана, салату, дині, гороху, перцю, арахісу, картоплі, гарбуза, редиски, рапсу, шпинату, соєвих бобів, кабачків, цукрового буряку, соняшнику, тютюну, томата, гарбуза, кукурудзи, цибулі, рису, сорго, пшениці, жита, проса, цукрової тростини, вівса, тритикале, проса і газонної трави.
18. Частина трансгенної рослини, яка експресує поліпептид у хлоропластах, де частина трансгенної рослини містить клітину рослини за п. 8.
19. Насіння трансгенної рослини для вирощування рослини, яка експресує поліпептид у хлоропластах, де насіння трансгенної рослини містить клітину рослини за п. 8.
20. Культура тканини клітин трансгенної рослини за п. 8 для регенерації рослини, яка експресує поліпептид у хлоропластах.
21. Спосіб одержання трансгенного рослинного матеріалу, який експресує поліпептид у хлоропласти, де вказаний спосіб включає:
трансформацію рослинного матеріалу за допомогою конструкції нуклеїнової кислоти за п. 1, отримуючи таким чином трансгенний рослинний матеріал, який експресує химерний білок, що складається із транзитного пептиду хлоропласта з SEQ ID NO: 11, пов'язаний суміжно з поліпептидом, де хлоропласти рослинного матеріалу містять поліпептид.
22. Спосіб за п. 21, в якому рослинний матеріал вибирають з групи, що складається з рослинної клітини, рослинної тканини, культури рослинних тканин, калюсної культури, частини рослини і цілої рослини.
23. Спосіб за п. 21, в якому поліпептид являє собою флуоресцентний маркер.
24. Спосіб за п. 21, в якому поліпептид бере участь у толерантності рослин до гербіцидів або у стійкості до комах.
25. Спосіб за п. 24, в якому поліпептид вибраний з групи що складається з: ацетолактатсинтази (АЛС), мутантної АЛС, попередників АЛС, 3-енолпірувілшикімат-5-фосфатсинтетази (EPSPS), DGT-28 і Cry2Aa.
26. Спосіб за п. 24, в якому рослина вибрана з групи, яка складається з Arabidopsis, люцерни, Brassica, бобів, броколі, капусти, моркви, цвітної капусти, селери, китайської капусти, бавовни, огірка, баклажана, салату, дині, гороху, перцю, арахісу, картоплі, гарбуза, редиски, рапсу, шпинату, соєвих бобів, кабачків, цукрового буряку, соняшнику, тютюну, томата, гарбуза, кукурудзи, цибулі, рису, сорго, пшениці, жита, проса, цукрової тростини, вівса, тритикале, проса і газонної трави.
Текст
Реферат: Винахід стосується конструкції нуклеїнової кислоти для локалізації поліпептиду в хролопласт, яка характеризується: нуклеотидною послідовністю, яка кодує синтетичний транзитний пептид хлоропласта (CTP) із SEQ ID NO: 11, пов'язаною суміжно у рамці зчитування з нуклеотидною послідовністю, що кодує поліпептид, так що конструкція кодує химерний білок, який складається з CTP із SEQ ID NO: 11 і поліпептиду. Винахід також стосується химерного білка, кодованого зазначеною послідовністю, клітини трансгенної рослини, яка містить зазначений химерний білок, трансгенної рослини, частини трансгенної рослини, насіння трансгенної рослини, культури клітин та способу одержання трансгенного рослинного матеріалу. UA 115546 C2 (12) UA 115546 C2 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявка на пріоритет Дана заявка претендує на пріоритет попередньої патентної заявки США, серійний номер 61/593555, поданої 1 лютого 2012 року, а також попередньої патентної заявки США, серійний номер 61/625222, поданої 17 квітня 2012 року. ЗАЯВА ВІДПОВІДНО ДО 37 CFR § 1,821 (с) або (е) - перелік послідовностей представлений у вигляді текстового файлу ASCII. Згідно з 37 CFR § 1,821 (с) або (е), файл, що містить список послідовностей в текстовій версії ASCII, представлений одночасно з даною заявкою і його зміст включений в даний опис за допомогою посилання. Галузь техніки Даний винахід стосується композицій і способів для генетичного кодування і експресії поліпептидів, які націлені на пластиди з пластидовмісних клітин. У деяких варіантах здійснення винахід стосується амінокислотних послідовностей, які націлюють поліпептиди на хлоропласти (наприклад, у вищих рослин), і/або молекул нуклеїнових кислот, що кодують ці поліпептиди. У деяких варіантах здійснення винахід стосується химерних поліпептидів, що містять амінокислотну послідовність, яка регулює перенесення химерних поліпептидів в пластиди, і/або молекул нуклеїнових кислот, що кодують ці поліпептиди. Рівень винаходу Рослинні клітини містять різні субклітинні органели, в сукупності називані "пластидами", які відділені одна від одної за допомогою характерних мембранних систем і виконують спеціалізовані функції в клітині. Конкретні пластиди відповідають за фотосинтез, а також за синтез і зберігання певних хімічних сполук. Всі пластиди походять з пропластид, які присутні в меристемних зонах рослини. Пропластиди можуть розвиватися, наприклад, в хлоропласти, етіопласти, хромопласти, геронтопласти, лейкопласти, амілопласти, елайопласти і протеїнопласти. Пластиди мають самостійну генетичну систему і механізм синтезу білка і існують всередині клітини в напівавтономному режимі, але в основі їх розвитку лежить тісна взаємодія з ядерно-цитоплазматичною системою і процесами біосинтезу. У фотосинтезуючих клітинах листів вищих рослин найбільш вираженими пластидами є хлоропласти. Найбільш важливою функцією хлоропластів є здійснення світлокерованих реакцій фотосинтезу. При цьому хлоропласти також виконують багато які інші процеси біосинтезу, важливі для рослинної клітини. Наприклад, всі жирні кислоти в клітині виробляються за допомогою ферментів, розташованих в стромі хлоропласта, з використанням АТФ, NAOPH і вуглеводів, які в ній легкодоступні. Крім того, зменшення сили активованих світлом електронів в хлоропласті приводить до відновлення нітриту (NО2 ) до аміаку (NH3), і цей аміак забезпечує рослину азотом, необхідним для синтезу амінокислот і нуклеотидів. Хлоропласт також залучений до явищ, що мають особливе значення в агрохімічній промисловості. Наприклад, відомо, що багато які гербіциди діють шляхом блокування функцій, які здійснюються в хлоропласті. У нещодавніх дослідженнях була встановлена конкретна мішень деяких гербіцидів. Наприклад, гербіциди - похідні триазину - інгібують фотосинтез шляхом заміщення молекули пластохінону з її сайта зв’язування в поліпептиді масою 32 кДа з фотосистеми II. Цей поліпептид масою 32 кДа кодується в геномі хлоропласта і синтезується за допомогою механізмів органел. Були одержані мутантні рослини, що мають стійкість до триазинових гербіцидів. Ці рослини містять мутантний поліпептид масою 32 кДа, в якому пластохінон більше не може замінятися триазиновими гербіцидами. Сульфонілсечовини інгібують ацетолактатсинтазу в хлоропластах. Ацетолактатсинтаза бере участь в синтезі ізолейцину і валіну. Гліфосат інгібує функцію 5-енолпірувіл-3-фосфошикіматсинтази (EPSPS), яка являє собою фермент, що бере участь в синтезі ароматичних амінокислот. Всі ці ферменти кодуються ядерним геномом, при цьому вони переносяться в хлоропласт, де фактично відбувається синтез амінокислот. Більшість білків хлоропласта кодується в ядрі рослинної клітини, синтезується у вигляді великих білків-попередників в цитозолі і після трансляції надходить в хлоропласт. Введення в строму через зовнішню і внутрішню мембрани оболонок є основним способом надходження білків, призначених для строми, тилакоїдної мембрани і просвіту тилакоїду. Розміщення білківпопередників, що надходять, в тилакоїдній мембрані і тилакоїдному просвіті здійснюється чотирма різними механізмами, що включають в себе два механізми, які гомологічні системам транспорту бактеріальних білків. Таким чином, механізми локалізації білка в хлоропласті, зокрема, походять з прокаріотичного ендосимбіонта. Cline and Henry (1996), Annu. Rev. Cell. Dev. Biol. 12:1-26. Білки-попередники, призначені для хлоропластної експресії, містять подовжувальні сегменти на N-кінці, називані транзитними пептидами хлоропластів (СТР). Транзитний пептид є 1 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 інструментом для специфічного розпізнавання на поверхні хлоропластів і опосередковування посттрансляцйної транслокації білків-попередників через оболонку хлоропласта і, отже, в різні підвідділи в самому хлоропласті (наприклад, в строму, тилакоїд і тилакоїдну мембрану). Ці послідовності N-кінцевого транзитного пептиду містять всю інформацію, необхідну для надходження білка хлоропласта в пластиди, ці послідовності транзитного пептиду є необхідними і достатніми для введення пластид. Гени рослин з відомою наявністю природно кодованих послідовностей транзитних пептидів на N-кінці включають в себе хлоропластну малу субодиницю з рибулозо-1,5бісфосфаткароксилази (RuBisCo) (de Castro Silva-Filho et al. (1996), Plant Mol. Biol. 30:769-80; Schnell et al. (1991), J. Biol. Chem. 266:3335-42), EPSPS (див., наприклад, Archer et al. (1990), J. Bioenerg. and Biomemb. 22:789-810; і патенти США №№ 6867293, 7045684 і Re 36449), триптофансинтазу (Zhao et al. (1995), J. Biol. Chem. 270:6081-7), пластоціанін (Lawrence et al. (1997), J. Biol. Chem. 272:20357-63), хоризматсинтазу (Schmidt et al. (1993), J. Biol. Chem. 268:27447-57), білок, який зв'язує утворюваний на світлі хлорофіл а/b (LHBP), (Lamppa et al. (1988), J. Biol. Chem. 263:14996-14999), і хлоропластний білок Arabidopsis thaliana (Lee et al. (2008), Plant Cell, 20:1603-22). В американській патентній публікації US 2010/0071090 представлені деякі націлені на хлоропласти пептиди з Chlamydomonas sp. Разом з тим, залишаються неясними структурні умови відносно інформації, кодованої націленими на хлоропласти пептидами, в зв'язку з високим рівнем варіабельності послідовностей і відсутністю загальних або консенсусних мотивів послідовностей, хоч цілком можливе існування окремих підгруп націлених на хлоропласти пептидів з незалежними структурними мотивами. Lee et al. (2008), див. вище. Додатково, не всі з цих послідовностей грають роль в гетерологічній експресії націлених на хлоропласти білків у вищих рослин. Розкриття винаходу У винаході описані композиції і способи для націлювання поліпептидів на пластиди в рослині. У деяких варіантах здійснення композиція містить молекулу нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний транзитний пептид хлоропластів (наприклад, пептид TraP23), який функціонально зв’язаний з нуклеотидною послідовністю, що представляє інтерес. У конкретних варіантах здійснення такі молекули нуклеїнових кислот можуть бути корисні для експресії і націлювання поліпептиду, кодованого нуклеотидною послідовністю, що представляє інтерес, в однодольних або дводольних рослинах. Додатково описані вектори, що містять молекулу нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний транзитний пептид хлоропластів, функціонально зв’язану з нуклеотидною послідовністю, що представляє інтерес. У деяких варіантах здійснення нуклеотидна послідовність, яка кодує синтетичний СТР, може являти собою нуклеотидну послідовність, що походить з еталонної нуклеотидної послідовності, одержаної при вирівнюванні ферментів 5-енолпірувілшикімат-3-фосфатсинтази (EPSPS) або її функціонального варіанта. У деяких варіантах здійснення нуклеотидна послідовність, що кодує синтетичний СТР, може являти собою нуклеотидну послідовність, яка містить частину СТРкодуючої нуклеотидної послідовності з різних організмів, або її функціональний варіант. У конкретних варіантах здійснення нуклеотидна послідовність, що кодує синтетичний СТР, може містити суміжні нуклеотидні послідовності, одержані з кожної з еталонної EPSPS CTP або з функціональних варіантів будь-якої з вищеперерахованих послідовностей. У цих і інших варіантах здійснення нуклеотидна послідовність, що кодує синтетичний СТР, може являти собою нуклеотидну послідовність, яка містить більше однієї СТР-кодуючої нуклеотидної послідовності. У деяких прикладах нуклеотидна послідовність, що кодує синтетичний СТР, може являти собою нуклеотидну послідовність, яка містить частину нуклеотидної послідовності СТР з ферменту EPSPS, або її функціональні варіанти. У конкретних прикладах нуклеотидна послідовність, що кодує синтетичний СТР, може містити суміжні нуклеотидні послідовності, одержані з ферменту EPSPS, або їх функціональні варіанти. У деяких варіантах здійснення композиція містить молекулу нуклеїнової кислоти, що містить щонайменше один одержаний з EPSPS агент для націлювання поліпептиду на хлоропласти. Додатково описані молекули нуклеїнових кислот, що містять молекулу нуклеїнової кислоти, яка містить щонайменше один одержаний з EPSPS агент для націлювання поліпептиду на хлоропласти, функціонально зв’язаний з нуклеотидною послідовністю, що представляє інтерес. У конкретних варіантах здійснення такі молекули нуклеїнових кислот можуть бути корисні для експресії і націлювання поліпептиду, кодованого нуклеотидною послідовністю, що представляє інтерес, в однодольних або дводольних рослинах. Для цілей даного винаходу, одержаний з EPSPS агент для націлювання поліпептиду на хлоропласт належить до конкретних синтетичних 2 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 нуклеотидних послідовностей. У конкретних варіантах здійснення одержаний з EPSPS агент для націлювання поліпептиду на хлоропласт вибирають з групи, що складається з нуклеотидних послідовностей, вказаних в даному винаході як TraP23. Також у винаході описані рослинні матеріали (наприклад, і без обмеження, рослини, тканини рослин і клітини рослин), що містять молекулу нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний СТР, функціонально зв’язану з нуклеотидною послідовністю, що представляє інтерес. У деяких варіантах здійснення рослинний матеріал може мати таку молекулу нуклеїнової кислоти, стабільно інтегровану в свій геном. У деяких варіантах здійснення рослинний матеріал може транзиторно експресувати продукт молекули нуклеїнової кислоти, який містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний СТР, функціонально зв’язану з нуклеотидною послідовністю, що представляє інтерес. У деяких варіантах здійснення рослинний матеріал являє собою рослинну клітину, яка нездатна до регенерації для одержання рослини. У винаході також описані способи для експресії нуклеотидної послідовності в пластидовмісній клітині (наприклад, в рослині) в пластиді (наприклад, в хлоропласті) з пластидовмісної клітини. У конкретних варіантах здійснення молекула нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний СТР, яка функціонально зв’язана з нуклеотидною послідовністю, що представляє інтерес, може бути використана для трансформації рослинної клітини, таким чином, що синтез поліпептидупопередника злиття, що містить синтетичний CTP, злитий з продуктом експресії з нуклеотидної послідовності, що представляє інтерес, відбувається в цитоплазмі рослинної клітини, і потім злитий поліпептид транспортується in vivo в хлоропласт рослинної клітини. У деяких варіантах здійснення таких способів рослинну клітину неможливо регенерувати для одержання рослини. Додатково у винаході описані способи виробництва трансгенної рослини, що містить молекулу нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний СТР, функціонально зв’язану з нуклеотидною послідовністю, що представляє інтерес. Також у винаході описані товарні рослинні продукти (наприклад, насіння), одержані з таких трансгенних рослин. Вищезгадані і інші ознаки стануть більш очевидними з подальшого докладного опису декількох варіантів здійснення, які виконані з посиланням на прикладені креслення. Короткий опис креслень Фігура 1 показує молекули мРНК, які представляють конкретні приклади нуклеотидної послідовності, що кодує синтетичний CTP (наприклад, TraP23), функціонально зв’язаної з нуклеотидною послідовністю, що представляє інтерес. У деяких варіантах здійснення молекули мРНК (такі, як показані в фігурі) можуть транскрибуватися з молекули ДНК, яка містить відкриту рамку зчитування, що включає в себе послідовність, яка кодує синтетичний CTP, функціонально зв’язану з нуклеотидною послідовністю, що представляє інтерес. У деяких варіантахздійснення нуклеотидна послідовність, що представляє інтерес, може бути послідовністю, яка кодує пептид, що розглядається, наприклад, і без обмеження, маркерний генний продукт або пептид для націлювання на пластиди. Фігура 2 показує вирівнювання декількох послідовностей транзитних пептидів хлоропластів EPSPS. Заштриховані амінокислотні залишки показують амінокислотні послідовності, які були вибрані для TraP23. Фігура 3 показує карту плазміди pDAB107640. Фігура 4 являє собою зображення мікроскопії інфільтрації TraP23-GFP в листовій тканині тютюну. Фігура 5 показує карту плазміди pDAB106598. Фігура 6 являє собою зображення мікроскопії TraP23-GFP, трансформованого в протопласти кукурудзи, що показує транслокацію в хлоропласти з протопласта кукурудзи. Фігура 7 показує карту плазміди pDAB109808. Фігура 8 показує карту плазміди pDAB107687. Спосіб (способи) здійснення винаходу I. Огляд деяких варіантів Транзитний пептид хлоропласта (CTP) (або пластидний транзитний пептид) діє котрансляційно або посттрансляційно, націлюючи поліпептид, що містить CTP, на пластиди (наприклад, хлоропласт). У деяких варіантах здійснення даного винаходу на хлоропласт можуть бути націлені як ендогенні білки хлоропластів, так і гетерологічні білки, шляхом експресії такого білка у вигляді більш великого поліпептиду-попередника, що містить CTP. У конкретних варіантах здійснення CTP може бути одержаний з нуклеотидної послідовності, одержаної при вирівнюванні ферментів 5-енолпірувілшикімат-3-фосфатсинтази (EPSPS), наприклад, і без 3 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмеження, шляхом включення щонайменше однієї суміжної послідовності з ортологічного гена, одержаної з іншого організму, або її функціонального варіанта. У прикладі варіанта здійснення були одержані послідовності нуклеїнових кислот, кожна з яких кодує CTP, при вирівнюванні білкових послідовностей EPSPS (фіг. 2). СТР-кодуючі послідовності були виділені шляхом аналізу послідовності генів EPSPS за допомогою прогностичного сервера ChloroP (ChloroP prediction server, Emanuelsson et al. (1999), Protein Science, 8:978-84 (доступний ресурс: cbs.dtu.dk/services/ChloroP)). Передбачені білкові продукти виділених СТР-кодуючих послідовностей являють собою транзитні пептиди довжиною приблизно 60-70 амінокислот. У цьому прикладі для одержання нового синтетичного СТР використовували вирівнювання послідовностей CTP EPSPS як еталонну послідовність для створення зразка синтетичного CTP шляхом випадкового вибору амінокислот. Цей спосіб конструювання демонструє властивості одержання синтетичного CTP. Зразок синтетичного CTP в даному розкритті називається TraP23. Зразок синтетичного TraP23 тестували на функції націлювання на пластиду і було показано, що він виявляє націлювання на пластиди щонайменше з тією ж перевагою, яка спостерігається безпосередньо у нативних СТРпослідовностей. Ще в одному прикладі варіанта здійснення були незалежно синтезовані послідовності нуклеїнових кислот, кожна з яких кодує синтетичний пептид TraP за винаходом і функціонально зв’язана з послідовністю нуклеїнової кислоти, що кодує зелений флуоресцентний білок (GFP), з метою одержання молекул синтетичних нуклеїнових кислот, кожна з яких кодує химерний злитий поліпептид TraP:GFP. Кожну з таких молекул нуклеїнових кислот, що кодують химерний поліпептид TraP:GFP, вставляли в бінарний вектор таким чином, що кожна послідовність нуклеїнової кислоти, яка кодує TraP:GFP, була функціонально зв’язана з промотором AtUbi10. Ще в одному прикладі варіанта здійснення кожний з бінарних векторів, які містять послідовність нуклеїнової кислоти, яка кодує TraP:GFP, функціонально зв’язану з промотором AtUbi10, незалежно один від одного і транзиторно трансформували в тютюн (Nicotiana benthamiana) за допомогою опосередкованої Agrobacterium трансформації. За допомогою конфокальної мікроскопії і вестерн-блотингу було підтверджено, що кожний TraP успішно націлював GFP на хлоропласти тютюну. Ще в одному прикладі варіанта здійснення була незалежно синтезована послідовність нуклеїнової кислоти, яка кодує синтетичний пептид TraP за винаходом і функціонально зв’язана з послідовністю нуклеїнової кислоти, що кодує агрономічно важливу послідовність генів. Послідовність TraP була злита з ознакою переносимості гербіцидів (наприклад, dgt-28) для одержання молекули синтетичної нуклеїнової кислоти, що кодує химерний злитий поліпептид TraP:dgt-28. Таку молекулу нуклеїнової кислоти, що кодує химерний поліпептид TraP:dgt-28, вставляли в бінарний вектор, таким чином, що кожна послідовність нуклеїнової кислоти, яка кодує TraP:dgt-28, була функціонально зв’язана з промотором і іншими регуляторними елементами гена. Бінарний вектор, що містить послідовність нуклеїнової кислоти, яка кодує TraP:dgt-28, використовували для трансформації різних видів рослин. Трансгенні рослини аналізували на толерантність до гербіцидів, зумовлену експресією і транслокацією ферменту dgt-28 в хлоропласті. Ще в одному прикладі варіанта здійснення була незалежно синтезована послідовність нуклеїнової кислоти, яка кодує синтетичний пептид TraP згідно з винаходом і функціонально зв’язана з послідовністю нуклеїнової кислоти, що кодує агрономічно важливі послідовності генів. Послідовність TraP була злита з ознакою стійкості до комах (наприклад, cry2Ad) для одержання молекули синтетичної нуклеїнової кислоти, що кодує химерний злитий поліпептид TraP:Cry2Aa. Таку молекулу нуклеїнової кислоти, що кодує химерний поліпептид TraP:Cry2Aa, вставляли в бінарний вектор, таким чином, що кожна послідовність нуклеїнової кислоти, яка кодує TraP:cry2Аa, була функціонально зв’язана з промотором і іншими регуляторними елементами гена. Бінарний вектор, що містить послідовність нуклеїнової кислоти, яка кодує TraP:cry2Аa, використовували для трансформації різних видів рослин. З трансгенними рослинами проводили біологічні дослідження на стійкість до комах, зумовлену експресією і транслокацією ферменту Cry2Aa в хлоропласті. У світлі вищезазначених докладних практичних прикладів, можна використовувати послідовності синтетичного CTP за винаходом і кодуючі їх нуклеїнові кислоти для націлювання будь-якого поліпептиду на пластиди в широкому діапазоні пластидовмісних клітин. Наприклад, способами, доступними фахівцям в даній галузі техніки за допомогою даного винаходу, в пластидовмісну клітину-хазяїна можна вставляти (або експресувати) химерний поліпептид, що містить послідовність синтетичного CTP, злиту з N-кінцем будь-якої другої пептидної послідовності, для націлювання на пластиди другої пептидної послідовності. Таким чином, в 4 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 конкретних варіантах здійснення, в порівнянні з нативним CTP, пептид TraP за винаходом може забезпечити підвищену ефективність введення і процесування пептиду, для якого бажана експресія пластид. II. Скорочення СТР - транзитний пептид хлоропласта; EPSPS - 3-енолпірувілшикімат-5-фосфатсинтетаза; YFP - жовтий флуоресцентний білок; Ti - індукуючі пухлину (плазміди, що походять з А. tumefaciens); Т-ДНК - трансферна ДНК. III. Термінологія Для полегшення розуміння різних варіантів здійснення даного розкриття наведені наступні пояснення спеціальних термінів. Транзитний пептид хлоропласта. Використовуваний у винаході термін "транзитний пептид хлоропласта" (СТР) (або "транзитний пептид пластид") може стосуватися амінокислотної послідовності, яка, у випадку її присутності на N-кінці поліпептиду, спрямовує надходження поліпептиду в пластиду з пластидовмісної клітини (наприклад, клітини рослини, наприклад, в цільній рослині або в культурі рослинних клітин). Звичайно CTP необхідний і достатній для спрямування надходження білка в пластиду клітини-хазяїна (наприклад, в первинну, вторинну або третинну пластиду, таку як хлоропласт). Передбачуваний транзитний пептид хлоропласта може бути ідентифікований за допомогою одного з декількох доступних алгоритмів (наприклад, PSORT і ChloroP (доступний в cbs.dtu.dk/services/ChloroP)). Алгоритм ChloroP може давати особливо добре передбачення СТР. Emanuelsson et al. (1999), Protein Science, 8:978-84. Проте, за допомогою будь-якого існуючого алгоритму не досягається 100% ефективності передбачення функціонального СТР. Тому, важливо пересвідчитися, що ідентифіковані передбачувані CTP дійсно мають намічену функцію, наприклад, за допомогою методик in vitro або in vivo. Транзитні пептиди хлоропласта можуть бути розташовані на N-кінці поліпептиду, який надходить в пластиди. CTP може сприяти котрансляційному або посттрансляційному транспорту поліпептиду, що містить CTP, в пластиди. Звичайно транзитні пептиди хлоропласта містять приблизно від 40 приблизно до 100 амінокислот, і у таких CTP виявляють наявність певних загальних характеристик. Наприклад: CTP майже не містять негативно заряджених амінокислот (наприклад, аспарагінової кислоти, глутамінової кислоти, аспарагіну або глутаміну); на N-кінцевих ділянках СТР відсутні заряджені амінокислоти гліцин і пролін; передбачається, що центральна область CTP має дуже високий вміст основних або гідроксильованих амінокислот (таких як серин і треонін); і передбачається, що С-кінцева область CTP багата аргініном і має можливість містити амфіпатичну бета-пластинчату структуру. Протеази пластид можуть розщеплювати CTP з іншої частини поліпептиду, що містить CTP, після надходження поліпептиду в пластиди. Контакт. Використовуваний у винаході термін "контакт з" клітиною, тканиною або організмом або "захоплення за допомогою" клітини, тканини або організму (наприклад, клітин рослини, тканини рослини і рослини), відносно молекули нуклеїнової кислоти, включає в себе інтерналізацію молекули нуклеїнової кислоти в організмі, наприклад, і без обмеження: контактування організму з композицією, що містить молекулу нуклеїнової кислоти, і витягання з організмів з розчином, що містить молекулу нуклеїнової кислоти. Ендогенний. Використовуваний у винаході термін "ендогенний" стосується речовин (наприклад, молекул нуклеїнових кислот і поліпептидів), які походять з конкретного організму, тканини або клітини. Наприклад, "ендогенний" поліпептид, експресований в клітині рослини, може належати до поліпептиду, який звичайно експресується в клітинах того ж типу з негенноінженерних рослин того ж виду. У деяких прикладах можна використовувати ендогенний ген (наприклад, ген EPSPS) для одержання еталонної послідовності CTP. Експресія. Використовуваний у винаході термін "експресія" кодуючої послідовності (наприклад, гена або трансгена) стосується способу, за допомогою якого кодована інформація про транскрипційну одиницю нуклеїнової кислоти (що включає в себе, наприклад, геномну ДНК або кДНК) перетворюється в функціональну, нефункціональну або структурну частини клітини, часто включаючи в себе синтез білка. Експресія генів може залежати від зовнішніх сигналів, наприклад від впливу на клітини, тканини або організм якого-небудь агента, який збільшує або зменшує експресію генів. Експресія гена також може регулюватися в будь-якій частині шляху від ДНК до РНК в білок. Регуляція експресії генів відбувається, наприклад, за допомогою елементів контролю, діючих в ході транскрипції, трансляції, транспорту РНК і процесування, деградації проміжних молекул, таких як мРНК, або за допомогою активації, інактивації, компартменталізації або деградації специфічних білкових молекул після їх утворення, або за 5 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 допомогою комбінації цих явищ. Експресію гена можна вимірювати на рівні РНК або на рівні білка будь-яким способом, відомим в даній галузі, наприклад, і без обмеження: за допомогою нозерн-блотингу, ПЛР в реальному часі (RT-PCR), вестерн-блотингу або шляхом аналізу активності білка (білків) in vitro, in situ і in vivo. Генетичний матеріал. Використовуваний у винаході термін "генетичний матеріал" включає в себе всі гени і молекули нуклеїнових кислот, такі як ДНК і РНК. Гетерологічний. Використовуваний у винаході термін "гетерологічний" стосується речовин (наприклад, молекул нуклеїнових кислот і поліпептидів), які не походять з конкретного організму, тканини або клітини. Наприклад, "гетерологічний" поліпептид, експресований в рослинній клітині, може означати поліпептид, який звичайно не експресується в клітинах того ж типу з негенно-інженерних рослин того ж виду (наприклад, поліпептид, який експресується в різних клітинах одного і того ж організму або клітинах іншого організму). Виділений. Використовуваний у винаході термін "виділений" стосується молекул (наприклад, молекул нуклеїнових кислот і поліпептидів), які, по суті, відділені або очищені від інших молекул того ж типу (наприклад, від інших молекул нуклеїнових кислот і інших поліпептидів), з якими ці молекули звичайно асоційовані в клітині організму, в якому ця молекула зустрічається в природі. Наприклад, виділена молекула нуклеїнової кислоти може бути, по суті, відділена або очищена від хромосомної ДНК або позахромосомної ДНК в клітині організму, в якому молекула нуклеїнової кислоти зустрічається в природі. Таким чином, цей термін включає в себе рекомбінантні молекули нуклеїнових кислот і поліпептиди, які очищені біохімічно таким чином, що видалені інші молекули нуклеїнової кислоти, поліпептиди і клітинні компоненти. Цей термін також включає в себе рекомбінантні молекули нуклеїнових кислот, хімічно синтезовані молекули нуклеїнових кислот і поліпептиди, одержані рекомбінантним способом. Термін "по суті очищений", використовуваний у винаході, стосується молекули, яка відділена від інших молекул, звичайно асоційованих з нею в її нативному стані. По суті очищена молекула може бути переважним видом, присутнім в композиції. По суті очищена молекула може не містити, наприклад щонайменше на 60%, щонайменше на 75% або щонайменше на 90% не містити, інших молекул, крім розчинника, присутнього в природній суміші. Термін "по суті очищений" не стосується молекул, що знаходяться в їх нативному стані. Молекула нуклеїнової кислоти. Використовуваний у винаході термін "молекула нуклеїнової кислоти" стосується полімерної форми нуклеотидів, які можуть включати в себе як смислові, так і антисмислові ланцюжки РНК, кДНК, геномної ДНК і їх синтетичні і змішані форми і полімери. Нуклеотид може належати до рибонуклеотиду, дезоксирибонуклеотиду або до модифікованої форми нуклеотиду будь-якого типу. Термін "молекула нуклеїнової кислоти", використовуваний у винаході, є синонімом термінів "нуклеїнова кислота" і "полінуклеотид". Молекула нуклеїнової кислоти звичайно має довжину щонайменше 10 основ, якщо не вказане інше. Цей термін включає в себе одно- і дволанцюжкові форми ДНК. Молекули нуклеїнових кислот включають в себе димерні (так звані тандемні) форми і продукти транскрипції молекул нуклеїнових кислот. Молекула нуклеїнової кислоти може включати в себе природні і модифіковані нуклеотиди, або один з них, або обидва, які зв'язані один з одним за допомогою природних і/або неприродних нуклеотидних зв'язків. Молекули нуклеїнових кислот можуть бути модифіковані хімічно або біохімічно або можуть містити неприродні або дериватизовані нуклеотидні основи, що буде легко зрозуміти фахівцям в даній галузі. Такі модифікації включають в себе, наприклад, мітки, метилування, заміну одного або декількох природних нуклеотидів на аналог, міжнуклеотидні модифікації (наприклад, незаряджені зв'язки, наприклад метилфосфонати, фосфотриефіри, фосфорамідати, карбамати і т. д.; заряджені зв'язки, наприклад фосфоротіоати, фосфородитіоати і т. д.; бічні групи, наприклад пептиди; інтеркалятори, наприклад акридин, псорален і т. д.; ентеросорбенти; алкілувальні і модифіковані зв'язки, наприклад альфа-аномерні нуклеїнові кислоти і т. д.). Термін "молекула нуклеїнової кислоти" також включає в себе будь-яку топологічну конформацію, в тому числі одноланцюжкові, дволанцюжкові, частково дуплексні, триплексні, шпилькові, кругові конформації і конформації типу висячий замок. Використовувані у винаході відносно ДНК терміни "кодуюча послідовність", "структурна нуклеотидна послідовність" або "структурна молекула нуклеїнової кислоти" стосуються нуклеотидної послідовності, яка, зрештою, транслюється в поліпептид за допомогою транскрипції і мРНК, що знаходиться під контролем придатних регуляторних послідовностей. Відносно РНК, термін "кодуюча послідовність" стосується нуклеотидної послідовності, яка транслюється в пептид, поліпептид або білок. Границі кодуючої послідовності визначаються стартовим кодоном трансляції на 5'-кінці і стопах-кодоном трансляції на 3'-кінці. Кодуючі 6 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності включають в себе без обмеження геномну ДНК, кДНК, маркерні послідовності, що експресуються (EST), і рекомбінантні нуклеотидні послідовності. У деяких варіантах здійснення даний винахід включає в себе нуклеотидні послідовності, які можуть бути виділені, очищені або частково очищені, наприклад, способами розділення, такими як, наприклад, іонообмінна хроматографія, ексклюзійним способом на основі молекулярних розмірів або на основі афінності, за допомогою методик фракціонування на основі розчинності в різних розчинниках і способів генної інженерії, таких як ампліфікація, клонування і субклонування. Ідентичність послідовності. Термін "ідентичність послідовності" або "ідентичність", використовуваний у винаході відносно двох послідовностей нуклеїнових кислот або поліпептидів, може стосуватися залишків в двох послідовностях, які є однаковими при їх вирівнюванні на максимальну відповідність на протязі визначеного вікна порівняння. Використовуваний у винаході термін "процент ідентичності послідовностей" може стосуватися значення, визначеного шляхом порівняння двох оптимально вирівняних послідовностей (наприклад, послідовностей нуклеїнових кислот і амінокислотних послідовностей) у вікні порівняння, при цьому для оптимального вирівнювання двох послідовностей частина послідовності у вікні порівняння може містити вставки або делеції (тобто пропуски) в порівнянні з еталонною послідовністю (яка не містить вставок або делецій). Процент розраховують шляхом визначення числа положень, в яких ідентичний нуклеотид або амінокислотний залишок зустрічається в обох послідовностях, з одержанням числа співпадаючих положень, ділення числа співпадаючих положень на загальне число положень у вікні порівняння і множення результату на 100 з одержанням процента ідентичності послідовностей. Способи вирівнювання послідовностей для порівняння добре відомі в даній галузі. Описані різні програми і алгоритми вирівнювання, наприклад, Smith and Waterman (1981), Adv. Appl. Math. 2:482; Needleman and Wunsch (1970), J. Mol. Biol. 48:443; Pearson and Lipman (1988), Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988), Gene, 73:237-44; Higgins and Sharp (1989), CABIOS, 5:151-3; Corpet et al. (1988), Nucleic Acids Res. 16:10881-90; Huang et al. (1992), Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994), Methods Mol. Biol. 24:307-31; Tatiana et al. (1999), FEMS Microbiol. Lett. 174:247-50. Докладний розгляд способів вирівнювання послідовностей і розрахунків гомології можна знайти, наприклад, в публікації Altschul et al. (1990), J. Mol. Biol. 215:403-10. Продукт Національного центра біотехнологічної інформації (NCBI) - програму Basic Local Alignment Search Tool (BLAST™, Altschul et al. (1990)), можна одержати з декількох джерел, в тому числі в Національному центрі біотехнологічної інформації (Bethesda, MD), і з Інтернету, для використання як програми аналізу декількох послідовностей. Опис алгоритму визначення ідентичності послідовності за допомогою цієї програми доступний в Інтернеті в розділі "допомога" для програми BLAST™. Для порівняння послідовностей нуклеїнових кислот можна використовувати функцію "Blast 2 послідовності" програми BLAST™ (BLASTN), задіюючи установки матриці BLOSUM62 за замовчуванням з параметрами за замовчуванням. При оцінці цим способом послідовності нуклеїнових кислот з більш високою схожістю з еталонними послідовностями будуть показувати зростаючий процент ідентичності. Специфічно гібридизований/специфічно комплементарний. Використовувані у винаході терміни "специфічно гібридизований" і "специфічно комплементарний" вказують на достатній ступінь комплементарності, при якій виникає стабільне і специфічне зв’язування між молекулою нуклеїнової кислоти і цільовою молекулою нуклеїнової кислоти. Гібридизація між двома молекулами нуклеїнових кислот охоплює утворення антипаралельного вирівнювання між нуклеїновокислотними послідовностями двох молекул нуклеїнових кислот. Ці дві молекули потім здатні створювати водневі зв'язки з відповідними основами на протилежному ланцюзі з утворенням дуплексної молекули, яка при достатній стабільності піддається виявленню за допомогою способів, добре відомих в даній галузі. Щоб бути специфічно гібридизованою, молекула нуклеїнової кислоти не обов'язково повинна бути на 100% комплементарною своїй цільовій послідовності. Проте, кількісні показники комплементарності послідовностей, які необхідні для специфічності гібридизації, залежать від застосовуваних умов гібридизації. Умови гібридизації, що дають конкретні ступені жорсткості, будуть варіюватися залежно від природи вибраного способу гібридизації і композиції і довжин гібридизованих послідовностей нуклеїнових кислот. Загалом, жорсткість гібридизації буде визначатися температурою + ++ гібридизації і іонною силою (особливо концентрацією Na і/або Mg ) в буфері для гібридизації, при цьому на жорсткість також впливає кількість промивань. Розрахунки відносно умов гібридизації, необхідних для досягнення конкретних ступенів жорсткості, відомі рядовим 7 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 фахівцям в даній галузі і описані, наприклад, авторами Sambrook et al. (ed.), Molecular Cloning: А Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, розділи 9 і 11; і Hames and Higgins (eds.), Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Додаткові докладні інструкції і керівництво по гібридизації нуклеїнових кислот можна знайти, наприклад, в публікації Tijssen, "Overview of principles of hybridization and the strategy of nucleic acid probe assays" у виданні Laboratory Techniques in Biochemistry and Molecular Biology Hybridization with Nucleic Acid Probes, частина I, розділ 2, Elsevier, NY, 1993; і Ausubel et al., Eds., Current Protocols in Molecular Biology, розділ 2, Greene Publishing and Wiley-Interscience, NY, 1995. Використовуване у винаході поняття "жорсткі умови" охоплюють умови, при яких гібридизація буде відбуватися тільки у випадку, якщо є менше 20% неспівпадань між гібридизованою молекулою і гомологічною послідовністю в цільовій молекулі нуклеїнової кислоти. "Жорсткі умови" включають в себе додаткові конкретні рівні жорсткості. Таким чином, використовуване у винаході поняття "умови помірної жорсткості" означає умови, при яких з неспівпаданням більше ніж 20% послідовностей не буде відбуватися гібридизація молекул; умови "високої жорсткості" являють собою умови, при яких не буде відбуватися гібридизація послідовностей з неспівпаданням більше ніж 10%; і умови "дуже високої жорсткості" являють собою умови, при яких не буде відбуватися гібридизація послідовностей з неспівпаданням більше ніж 5%. Нижче представлені типові необмежувальні умови гібридизації. Умови високої жорсткості (визначають послідовності, що мають щонайменше 90% ідентичності послідовностей): гібридизація в 5× SSC-буфері при 65 °C протягом 16 годин, промивання два рази в 2× SSC-буфері при кімнатній температурі протягом 15 хвилин кожне, і промивання двічі в 0,5× SSC-буфері при 65 °C протягом 20 хвилин кожне. Умови помірної жорсткості (визначають послідовності, що мають щонайменше 80% ідентичності послідовностей): гібридизація в 5× SSC-буфері при 65-70 °C протягом 16-20 годин, промивання два рази в 2× SSC-буфері при кімнатній температурі протягом 5-20 хвилин кожне, і промивання двічі в 1× SSC-буфері при 55-70 °C протягом 30 хвилин кожне. Нежорсткі контрольні умови (гібридизуються послідовності, які мають ідентичність послідовностей щонайменше 50%): гібридизація в 6× SSC-буфері до 55 °C протягом 16-20 годин, промивання щонайменше два рази в 2×-3× SSC-буфері при температурі від кімнатної до 55 °C протягом 20-30 хвилин кожне. Використовуваний у винаході термін "по суті гомологічний" або "по суті гомологія", відносно суміжної послідовності нуклеїнової кислоти, стосується суміжних нуклеотидних послідовностей, які гібридизуються в жорстких умовах з еталонною послідовністю нуклеїнової кислоти. Наприклад, послідовності нуклеїнових кислот, які по суті гомологічні еталонній послідовності нуклеїнової кислоти (наприклад, SEQ ID NO: 12), являють собою такі послідовності нуклеїнових кислот, які гібридизуються з еталонною послідовністю нуклеїнової кислоти в жорстких умовах (наприклад, в помірно жорстких умовах, вказаних вище). По суті гомологічні послідовності можуть мати ідентичність послідовностей щонайменше 80%. Наприклад, по суті гомологічні послідовності можуть мати ідентичність послідовностей приблизно від 80% до 100%, наприклад приблизно 81%, приблизно 82%, приблизно 83%, приблизно 84%, приблизно 85%, приблизно 86%, приблизно 87%, приблизно 88%, приблизно 89%, приблизно 90%, приблизно 91%, приблизно 92%, приблизно 93%, приблизно 94%, приблизно 95%, приблизно 96%, приблизно 97%, приблизно 98%, приблизно 98,5%, приблизно 99%, приблизно 99,5% і приблизно 100%. Властивість суттєвої гомології тісно пов'язана зі специфічністю гібридизації. Наприклад, молекула нуклеїнової кислоти є специфічно гібридизованою, якщо є достатній ступінь комплементарності, щоб уникнути неспецифічного зв’язування нуклеїнової кислоти з нецільовими послідовностями в умовах, коли бажане специфічне зв’язування, наприклад в жорстких умовах гібридизації. Використовуваний у винаході термін "ортолог" (або "ортологічний") стосується гена в двох або декількох видах, який виник із загальної предкової нуклеотидної послідовності і може зберігати однакову функцію в двох або декількох видах. Згідно з винаходом, дві молекули нуклеїнової кислоти вважаються такими, що виявляють "повну комплементарність", якщо кожний нуклеотид в послідовності, що зчитується в напрямку від 5' до 3', комплементарний кожному нуклеотиду іншої послідовності при зчитуванні в напрямку від 3' до 5'. Нуклеотидна послідовність, яка є комплементарною еталонній нуклеотидній послідовності, буде показувати послідовність, ідентичну послідовності, зворотно комплементарній еталонній нуклеотидній послідовності. Ці терміни і описи чітко визначені в даній галузі техніки і легко зрозумілі рядовим фахівцям в даній галузі. 8 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фахівцям в даній галузі техніки добре відомо, що при визначенні процента ідентичності послідовностей між амінокислотними послідовностями в заданому положенні може відрізнятися ідентичність амінокислоти, яка була досягнута за допомогою вирівнювання, що не впливає на бажані властивості поліпептидів, які містять вирівняні послідовності. У цих випадках процент ідентичності послідовності може бути підібраний з урахуванням схожості між консервативно заміщеними амінокислотами. Такий підбір добре відомий і широко використовується фахівцями в даній галузі техніки. Див., наприклад, Myers and Miller (1988), Computer Applications in Biosciences, 4:11-7. Варіанти здійснення даного винаходу включають в себе функціональні варіанти ілюстративних амінокислотних послідовностей транзитного пептиду пластид і послідовностей нуклеїнових кислот, які їх кодують. Функціональний варіант ілюстративної послідовності транзитного пептиду може являти собою, наприклад, фрагмент ілюстративної амінокислотної послідовності транзитного пептиду (наприклад, N-кінцевий або С-кінцевий фрагмент) або модифіковану послідовність з ілюстративної амінокислотної послідовності повнорозмірного транзитного пептиду, або фрагмент ілюстративної амінокислотної послідовності транзитного пептиду. Ілюстративну амінокислотну послідовність транзитного пептиду можна модифікувати в деяких варіантах здійснення шляхом введення однієї або декількох консервативних амінокислотних замін. "Консервативна" амінокислотна заміна являє собою заміну, при якій амінокислотний залишок заміщується амінокислотним залишком, що має схожий функціональний бічний ланцюг, аналогічний розмір і/або аналогічну гідрофобність. У даній галузі відомі сімейства амінокислот, які можна використовувати для заміни іншої амінокислоти того ж сімейства з метою введення консервативної заміни. Наприклад, ці сімейства амінокислот включають в себе: основні амінокислоти (наприклад, лізин, аргінін, гістидин), кислі амінокислоти (наприклад, аспарагінову кислоту і глутамінову кислоту), незаряджені (при фізіологічному рівні рН) полярні амінокислоти (наприклад, гліцин, аспарагіни, глутамін, серин, треонін, тирозин і цитозин), неполярні амінокислоти (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін і триптофан), бета-розгалужені амінокислоти (наприклад, треонін, валін і ізолейцин) і ароматичні амінокислоти (наприклад, тирозин, фенілаланін, триптофан і гістидин). Див., наприклад, Sambrook et al. (Eds.), вище; і Innis et al., PCR Protocols: А Guide to Methods and Applications, 1990, Academic Press, NY, USA. Функціонально зв'язаний. Перша нуклеотидна послідовність є "функціонально зв’язаною" з другою нуклеотидною послідовністю, якщо перша нуклеотидна послідовність знаходиться в функціональному зв'язку з другою нуклеотидною послідовністю. Наприклад, промотор функціонально зв’язаний з кодуючою послідовністю, якщо промотор діє на транскрипцію або експресію кодуючої послідовності. Якщо послідовності створені рекомбінантним шляхом, функціонально зв’язані нуклеотидні послідовності звичайно є суміжними і знаходяться в тій же рамці зчитування, при необхідності з'єднання двох ділянок, що кодують білок. Проте, щоб бути функціонально зв’язаними, нуклеотидні послідовності не обов'язково повинні бути суміжними. Термін "функціонально зв’язаний", використовуваний відносно регуляторної послідовності і кодуючої послідовності, означає, що регуляторна послідовність впливає на експресію зв'язаної з нею кодуючої послідовності. "Регуляторні послідовності", або "елементи контролю", стосуються нуклеотидних послідовностей, які впливають на часовий режим і рівень/кількість транскрипції, процесинг РНК або стабільність, або на трансляцію асоційованої з ними кодуючої послідовності. Регуляторні послідовності можуть включати в себе промотори, трансляційний лідерні послідовності, інтрони, енхансери, структури типу петля-на-стеблі, репресорні зв'язувальні послідовності, послідовності термінації, послідовності розпізнавання поліаденілювання і т. д. Конкретні регуляторні послідовності можуть бути розташовані в 3'-5'-напрямку і/або в 5'-3'напрямку від кодуючої послідовності, яка функціонально зв’язана з ними. Також окремі регуляторні послідовності, функціонально зв’язані з кодуючою послідовністю, можуть бути розташовані на відповідному комплементарному ланцюзі молекули дволанцюжкової нуклеїнової кислоти. Використовуваний відносно двох або декількох амінокислотних послідовностей термін "функціонально зв’язаний" означає, що перша амінокислотна послідовність знаходиться в функціональному зв'язку щонайменше з однією з додаткових амінокислотних послідовностей. Наприклад, транзитний пептид (наприклад, CTP) є функціонально зв’язаним з другою амінокислотною послідовністю в поліпептиді, що містить обидві послідовності, якщо цей транзитний пептид впливає на експресію або направлену міграцію поліпептиду або другої амінокислотної послідовності. Промотор. Використовуваний у винаході термін "промотор" стосується ділянки ДНК, яка може знаходитися в 3'-5'-напрямку від початку транскрипції і може бути залучена у 9 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 розпізнавання і зв’язування РНК-полімерази і інших білків для ініціації транскрипції. Промотор може бути функціонально зв’язаним з кодуючою послідовністю для експресії в клітині або промотор може бути функціонально зв’язаним з нуклеотидною послідовністю, що кодує сигнальну послідовність, яка може бути функціонально зв’язана з кодуючою послідовністю, для експресії в клітині. "Рослинним промотором" може бути промотор, який здатний запускати транскрипцію в клітинах рослин. Приклади промоторів під контролем розвитку включають в себе промотори, які переважно запускають транскрипцію в деяких тканинах, наприклад в листі, корінні, насінні, волокнах, судинах ксилеми, трахеїдах або в склеренхімі. Такі промотори називають "переважними для тканини". Промотори, які запускають транскрипцію тільки в певних тканинах, називаються "тканиноспецифічними". Промотор, "специфічний для типу клітин", переважно запускає експресію в деяких типах клітин в одному або декількох органах, наприклад в судинних клітинах в корінні і листі. "Індукований" промотор являє собою промотор, який може регулюватися навколишнім середовищем. Приклади умов навколишнього середовища, при яких індуковані промотори можуть запускати транскрипцію, включають в себе анаеробні умови і наявність світла. Тканиноспецифічні, переважні для тканини, специфічні для типу клітин і індуковані промотори складають клас "неконститутивних" промоторів. "Конститутивний" промотор являє собою промотор, який може бути активним в більшості умов навколишнього середовища. У деяких варіантах здійснення даного винаходу може бути використаний будь-який індукований промотор. Див. Ward et al. (1993), Plant Mol. Biol. 22:361-366. При наявності індукованого промотору швидкість транскрипції зростає у відповідь на індукуючий агент. Приклади індукованих промоторів включають в себе без обмеження: промотори з системи ACEI, які реагують на мідь, ген In2 з кукурудзи, який реагує на антидоти до бензолсульфонамідних гербіцидів, репресор Tet з Tn10 і індукований промотор з гена стероїдного гормону, транскрипційна активність якого може індукуватися глюкокортикостероїдним гормоном (Schena et al. (1991), Proc. Natl. Acad. Sci. USA, 88:0421). Приклади конститутивних промоторів включають в себе без обмеження: промотори з вірусів рослин, такі як промотор 35S з CaMV, промотори з генів актину в рисі, убіквітинові промотори, pEMU, MAS, промотор Н3 гістону в кукурудзі і промотор ALS, XbaІ/NcoІ-фрагмент 5' до структурного гена ALS3 Brassica napus (або подібна до вказаного фрагмента XbaІ/NcoІ нуклеотидна послідовність) (міжнародна публікація РСТ WO 96/30530). Додатково, в деяких варіантах здійснення даного винаходу можна використовувати будьякий тканиноспецифічний або переважний для тканини промотор. Рослини, трансформовані молекулою нуклеїнової кислоти, що містить кодуючу послідовність, яка функціонально зв’язана з тканиноспецифічним промотором, можуть виробляти продукт кодуючої послідовності виключно в певній тканині або переважно в певній тканині. Ілюстративні тканиноспецифічні або переважні для тканини промотори включають в себе без обмеження переважний для коренів промотор, наприклад з гена фазеоліну; специфічний для листів і світлоіндукований промотор, наприклад з cab або rubisco; специфічний для пиляка промотор, наприклад з LAT52; специфічний для пилка промотор, наприклад з Zm13; і переважний для мікроспор промотор, наприклад з apg. Трансформація. Використовуваний у винаході термін "трансформація" або "трансдукція" стосується перенесення однієї молекули або декількох молекул нуклеїнової кислоти в клітину. Клітина є "трансформованою" за допомогою молекули нуклеїнової кислоти, трансдукованої в клітину, якщо молекула нуклеїнової кислоти починає стабільно реплікуватися в клітині, як шляхом включення цієї молекули нуклеїнової кислоти в клітинний геном, так і шляхом епісомальної реплікації. Використовуваний у винаході термін "трансформація" охоплює всі способи, за допомогою яких в таку клітину можна вводити молекулу нуклеїнової кислоти. Приклади включають в себе, без обмеження, трансфекцію з вірусними векторами, трансформацію з плазмідними векторами, електропорацію (Fromm et al. (1986), Nature, 319:7913), ліпофекцію (Feigner et al. (1987), Proc. Natl. Acad. Sci. USA, 84:7413-7), мікроін’єкцію (Mueller et al. (1978), Cell, 15:579-85), опосередковане Agrobacterium перенесення (Fraley et al. (1983), Proc. Natl. Acad. Sci. USA, 80:4803-7), пряме захоплення ДНК і бомбардування мікрочастинками (Klein et al. (1987), Nature, 327:70). Трансген: екзогенна послідовність нуклеїнової кислоти. У деяких прикладах трансген може являти собою послідовність, яка кодує поліпептид, що містить щонайменше один синтетичний СТР. У конкретних прикладах трансген може кодувати поліпептид, що містить щонайменше один синтетичний СТР і щонайменше одну додаткову пептидну послідовність (наприклад, пептидну послідовність, яка надає толерантність до гербіцидів), для яких бажана експресія пластид. У цих і інших прикладах трансген може містити регуляторні послідовності, 10 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 функціонально зв’язані з кодуючою послідовністю трансгена (наприклад, з промотором). Для цілей даного опису термін "трансген", використовуваний для позначення організму (наприклад, рослини), стосується організму, який містить послідовність екзогенної нуклеїнової кислоти. У деяких прикладах організм, що містить екзогенну послідовність нуклеїнової кислоти, може являти собою організм, в який ця послідовність нуклеїнової кислоти була введена за допомогою технологій молекулярної трансформації. У інших прикладах організм, що містить екзогенну послідовність нуклеїнової кислоти, може являти собою організм, в який ця послідовність нуклеїнової кислоти була введена, наприклад, шляхом інтрогресії або перехресного запилення рослини. Транспорт. Використовувані у винаході терміни "транспорт(и)", "мішень(і)" і "перенесення" стосуються властивості конкретних амінокислотних послідовностей за винаходом, яка полегшує переміщення поліпептиду, що містить амінокислотну послідовність, з ядра клітини-хазяїна в пластиди клітини-хазяїна. У конкретних варіантах здійснення така амінокислотна послідовність (тобто послідовність синтетичного СТР) може мати здатність до перенесення в пластиди клітини-хазяїна приблизно 100% поліпептиду, що містить амінокислотну послідовність, щонайменше приблизно 95%, щонайменше приблизно 90%, щонайменше приблизно 85%, щонайменше приблизно 80%, щонайменше приблизно 70%, щонайменше приблизно 60% і/або щонайменше приблизно 50% поліпептиду, що містить амінокислотну послідовність. Вектор: молекула нуклеїнової кислоти, яку вводять в клітину, наприклад, для створення трансформованої клітини. Вектор може включати в себе послідовності нуклеїнових кислот, які дозволяють йому реплікуватися в клітині-хазяїні, такі як сайт ініціації реплікації. Приклади векторів включають в себе, без обмеження, плазміду, косміду, бактеріофаг або вірус, який несе екзогенну ДНК в клітину. Вектор може також включати в себе один або декілька генів, антисмислові молекули і/або селектовані маркерні гени і інші генетичні елементи, відомі в даній галузі. Вектор може трансдукувати, трансформувати або інфікувати клітину, внаслідок чого клітина починає експресувати молекули нуклеїнових кислот і/або білки, кодовані цим вектором. Вектор необов'язково включає в себе матеріали, сприяючі досягненню впровадження молекули нуклеїнової кислоти в клітину (наприклад, ліпосоми, покриття білка і т. д.). Якщо це не вказано або мається на увазі, використовувані у винаході терміни в однині означають "щонайменше один". Якщо не наведені конкретні пояснення, всі використовувані у винаході технічні і наукові терміни мають значення, яке звичайно зрозуміле рядовому фахівцю в галузі, до якої належить дане розкриття. Визначення загальних термінів з молекулярної біології можна знайти, наприклад, в наступних джерелах: Lewin В., Genes V, Oxford University Press, 1994 (ISBN 0-19854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9), і Meyers R.A. (ed.), Molecular Biology and Biotechnology: А Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Якщо не вказане інше, всі процентні значення наведені по масі і всі пропорції суміші розчинників наведені по об'єму. Всі значення температури наведені в градусах Цельсія. IV. Молекули нуклеїнових кислот, які містять послідовність, що кодує синтетичний CTP У деяких варіантах здійснення даний винахід стосується молекули нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний СТР, яка функціонально зв’язана з нуклеотидною послідовністю, що представляє інтерес. У конкретних варіантах здійснення нуклеотидною послідовністю, що представляє інтерес, може бути нуклеотидна послідовність, яка кодує поліпептид, що розглядається. Конкретні приклади стосуються єдиної молекули нуклеїнової кислоти, що кодує поліпептид, в якому послідовність TraP23 злита з N-кінцем поліпептиду, що представляє інтерес. У деяких варіантах здійснення синтетичний транзитний пептид хлоропласта може являти собою химерний CTP. Синтетичний CTP може бути одержаний шляхом рандомізованої селекції амінокислот з вирівнювання ферментів EPSPS. Фігура 2 показує вирівнювання послідовностей CTP, які були виділені з ферментів EPSPS у рослин. Таким чином, можна одержувати амінокислотну послідовність, що кодує синтетичний СТР, шляхом рандомізованої селекції амінокислотних послідовностей з вирівнювання послідовностей нативного транзитного пептиду хлоропласта. У цих і інших прикладах суміжна амінокислотна послідовність з еталонних послідовностей CTP, використовуваних для створення вирівнювання, може містити синтетичний СТР. Фахівцю в даній галузі буде очевидно, що після селекції першої суміжної амінокислотної послідовності в синтетичній послідовності CTP ідентифікація і відбір послідовності суміжних амінокислот з іншої частини гомологічної послідовності CTP відповідно до вищевикладеного способу одержання стають однозначними і автоматичними. У деяких прикладах довжина 11 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 першої послідовності суміжних амінокислот може складати приблизно від 25 приблизно до 41 амінокислоти (наприклад, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 і 42 амінокислоти в довжину). Приклади білкових послідовностей синтетичного СТР згідно з вищезгаданим способом представлені послідовністю SEQ ID NO: 11. Фахівець в даній галузі техніки зможе безпосередньо передбачати рід нуклеотидних послідовностей, що кодують ці пептиди, враховуючи виродженість генетичного коду. Ці конкретні приклади ілюструють структурні ознаки синтетичних СТР шляхом включення суміжних послідовностей з вирівнювання гомологічних CTP з одного з декількох ортологів ESPSP у різних видів рослин. Деякі варіанти здійснення включають в себе функціональні варіанти синтетичного транзитного пептиду хлоропласта і/або кодуючі їх нуклеїнові кислоти. Такі функціональні варіанти включають в себе, наприклад, і без обмеження: послідовність, що кодує синтетичний CTP, показану в SEQ ID NO: 11, і/або CTP, кодований цією послідовністю; нуклеїнову кислоту, яка кодує синтетичний СТР, що містить суміжну амінокислотну послідовність в межах SEQ ID NO: 11, і/або CTP, кодований цією послідовністю; усічену послідовність, яка кодує синтетичний СТР, що містить суміжну послідовність нуклеїнової кислоти SEQ ID NO: 12; усічену послідовність, яка кодує синтетичний СТР, що містить суміжну послідовність нуклеїнових кислот, по суті гомологічну послідовності SEQ ID NO: 12; усічений синтетичний СТР, який містить суміжну амінокислотну послідовність SEQ ID NO: 11; нуклеїнову кислоту, яка кодує синтетичний СТР, що містить суміжну амінокислотну послідовність SEQ ID NO: 11, і/або CTP, кодований цією послідовністю; нуклеїнову кислоту, яка кодує синтетичний СТР, що містить суміжну амінокислотну послідовність в межах SEQ ID NO: 11, що має одну або декілька консервативних амінокислотних замін, і/або CTP, кодований цією послідовністю; і нуклеїнову кислоту, яка кодує синтетичний СТР, що містить суміжну амінокислотну послідовність в межах SEQ ID NO: 11, що має одну або декілька неконсервативних амінокислотних замін, які показують націлювання функціонально зв’язаного пептиду на пластиди в пластидовмісній клітині і/або CTP, кодований цією послідовністю. Таким чином, деякі варіанти здійснення даного винаходу включають в себе молекулу нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує синтетичний СТР, що містить одну або декілька консервативних амінокислотних замін. Така молекула нуклеїнової кислоти може бути корисною, наприклад, в молекулярно-біологічних технологіях для полегшення маніпуляцій з послідовністю за винаходом, що кодує CTP. Наприклад, в деяких варіантах здійснення послідовність за винаходом, що кодує CTP, можна вставляти у відповідний вектор для субклонування послідовності в експресуючий вектор, або послідовність за винаходом, що кодує CTP, можна вводити в молекулу нуклеїнової кислоти, що полегшує одержання додаткової молекули нуклеїнової кислоти, яка містить послідовність, що кодує СТР, яка функціонально зв’язана з нуклеотидною послідовністю, що представляє інтерес. У цих і інших варіантах здійснення можна видаляти одну або декілька амінокислотних позицій в послідовності синтетичного CTP. Наприклад, послідовність синтетичного CTP можна модифікувати з видаленням амінокислоти (амінокислот) в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 або 20 позиції в послідовності. Вирівнювання гомологічних послідовностей CTP можна використовувати як керівництво відносно того, які амінокислоти можуть бути видалені без впливу на функцію синтетичного CTP. У конкретних прикладах синтетичний транзитний пептид хлоропласта має довжину менше 80 амінокислот. Наприклад, синтетичний СТР може мати 79, 78, 77, 76, 75, 74, 73, 72, 71, 70, 69, 68, 67, 66, 65, 64, 63, 62, 61, 60 або менше амінокислот в довжину. У деяких прикладах синтетичний СТР може мати довжину приблизно в 65 амінокислот, приблизно в 68, приблизно в 72 або приблизно в 74 амінокислоти. У цих і подальших прикладах синтетичний СТР може містити амінокислотну послідовність, представлену в SEQ ID NO: 11, або функціональний варіант вищезгаданої послідовності. Таким чином, синтетичний СТР може містити амінокислотну послідовність SEQ ID NO: 11, або її функціональний варіант, при цьому довжина синтетичного CTP складає менше 80 амінокислот. У деяких прикладах синтетичний СТР може містити амінокислотну послідовність, яка, наприклад, ідентична послідовності з SEQ ID NO: 11 щонайменше на 80%, щонайменше на 85%, щонайменше на 90%, щонайменше на 92%, щонайменше на 94%, щонайменше на 95%, щонайменше на 96%, щонайменше на 97%, щонайменше на 98%, щонайменше на 99% або 100%. Фахівці в даній галузі техніки в світлі даного опису зможуть розпізнати всі нуклеотидні послідовності, які кодують конкретний синтетичний білок CTP, наприклад пептид TraP23 з SEQ ID NO: 11, або функціональні варіанти будь-якої з вищезгаданих послідовностей, що включають в себе будь-які конкретні делеції і/або консервативні амінокислотні заміни. Виродженість 12 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 генетичного коду дає кінцеве число кодуючих послідовностей для конкретної амінокислотної послідовності. Вибір конкретної послідовності для кодування синтетичного СТР здійснюється за розсудом фахівця. Для різних застосувань можуть бути бажаними різні кодуючі послідовності. Наприклад, для збільшення експресії синтетичного CTP в певному хазяїні можна вибирати кодуючу послідовність, яка відображає систематичну помилку при використанні кодонів хазяїна. Як приклад, синтетичний СТР може бути кодований нуклеотидною послідовністю, показаною в SEQ ID NO: 12. У молекулах нуклеїнових кислот, представлених в деяких варіантах здійснення даного винаходу, останній кодон з нуклеотидної послідовності, що кодує синтетичний СТР, і перший кодон нуклеотидної послідовності, що представляє інтерес, можуть бути розділені за допомогою будь-якої кількості нуклеотидних триплетів, наприклад, без кодування інтрона або стоп-кодону. У деяких прикладах, послідовність, що кодує перші амінокислоти зрілого білка, звичайно асоційованого з транзитним пептидом хлоропласта в природному поліпептиді-попереднику, може знаходитися між останнім кодоном нуклеотидної послідовності, що кодує синтетичний СТР, і першим кодоном нуклеотидної послідовності, що представляє інтерес. Послідовність, яка відділяє нуклеотидну послідовність, що кодує синтетичний СТР, і перший кодон нуклеотидної послідовності, що представляє інтерес, наприклад, може складатися з будь-якої послідовності, і передбачається, що таким чином кодована амінокислотна послідовність не може значно змінювати трансляцію химерного поліпептиду і його переміщення до пластиди. У цих і інших варіантах здійснення останній кодон в нуклеотидній послідовності, що кодує синтетичний транзитний пептид хлоропласта, може бути злитий в регістр-фазі з першим кодоном нуклеотидної послідовності, що представляє інтерес, безпосередньо суміжної з нею, або відділений від нього не більше ніж короткою пептидною послідовністю, яка кодується, наприклад, нуклеотидним синтетичним лінкером (наприклад, нуклеотидним лінкером, який можна використовувати для досягнення злиття). У деяких варіантах здійснення може бути бажаною модифікація нуклеотидів в нуклеотидній послідовності, що представляє інтерес, і/або в послідовності, що кодує синтетичний CTP, злитій з нею в єдину кодуючу послідовність, наприклад, для посилення експресії кодуючої послідовності в певному хазяїні. 64 можливих кодони являють собою надмірний генетичний код, але більшість організмів переважно задіює підмножину цих кодонів. Найчастіше використовувані у видах організмів кодони називаються оптимальними кодонами, і кодони, які використовуються не дуже часто, вважаються рідкими або слабовикористовуваними кодонами. Zhang et al. (1991), Gene, 105:61-72. Кодони можуть бути заміщені, щоб відображати використання переважного кодону у конкретного хазяїна, і це явище іноді називають "оптимізацією кодону". Можна одержувати оптимізовані кодуючі послідовності, що містять кодони, які переважні для конкретного прокаріотичного або еукаріотичного хазяїна, наприклад, для збільшення швидкості трансляції або для одержання рекомбінантних РНК-транскриптів, що мають бажані властивості (наприклад, більш тривалий період напівжиття в порівнянні з транскриптами, одержаними з неоптимізованої послідовності). Будь-який поліпептид можна націлювати на пластиду в пластидовмісній клітині шляхом впровадження послідовності синтетичного CTP. Наприклад, в деяких варіантах здійснення поліпептид може бути зв'язаний з послідовністю синтетичного CTP, щоб направляти поліпептид на пластиду в клітині, в якій експресується молекула зв'язаного поліпептиду-СТР. У конкретних варіантах здійснення поліпептид, націлений на пластиди шляхом впровадження послідовності синтетичного CTP, може являти собою, наприклад, поліпептид, який звичайно експресується в пластидах в клітині, де існує нативна експресія цього поліпептиду. Наприклад, і без обмеження, поліпептид, націлений на пластиди шляхом впровадження послідовності синтетичного CTP, може являти собою поліпептид, залучений у толерантність до гербіцидів, стійкість до вірусів, стійкість до бактеріальних патогенів, стійкість до комах, стійкість до нематод або стійкість до грибків. Див., наприклад, патенти США №№ 5569823, 5304730, 5495071, 6329504 і 6337431. Поліпептид, націлений на пластиду шляхом впровадження послідовності синтетичного CTP, альтернативно може являти собою, наприклад, і без обмеження, поліпептид, залучений у врожайність або силу росту рослин (включаючи в себе поліпептиди, залучені у толерантність до екстремальних температур, стану ґрунту, рівня освітленості, кількості води і хімічного складу навколишнього середовища), або поліпептид, який можна використовувати як маркер для ідентифікації рослин, які містять ознаку, що представляє інтерес (наприклад, селектований маркерний генний продукт, поліпептид, що бере участь в забарвленні насіння і т. д.). Необмежувальні приклади поліпептидів, залучених у толерантність до гербіцидів, які можуть бути зв'язані з послідовністю синтетичного CTP, в деяких варіантах здійснення даного винаходу включають в себе ацетолактатсинтазу (АЛС), мутантну АЛС і попередники АЛС (див., 13 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, патент США № 5013659), EPSPS (див., наприклад, патенти США №№ 4971908 і 6225114), такі як CP4 EPSPS або EPSPS класу III, ферменти, що модифікують фізіологічні процеси, які відбуваються в пластидах, що включають в себе фотосинтез і синтез жирних кислот, амінокислот, олій, аротеноїдів, терпеноїдів, крохмалю і т. д. Інші необмежувальні приклади поліпептидів, які можуть бути зв'язані з синтетичним транзитним пептидом хлоропласта в конкретних варіантах здійснення, включають в себе зеаксантинепоксидазу, холінмонооксигеназу, ферохелатазу, десатуразу омега-3 жирних кислот, глутамінсинтетазу, модифікуючі крохмаль ферменти, поліпептиди, що беруть участь в синтезі незамінних амінокислот, провітаміну А, гормонів, білків Bt-токсинів і т. д. Нуклеотідні послідовності, що кодують вказані вище пептиди, відомі в даній галузі техніки, і такі нуклеотидні послідовності можуть бути функціонально зв’язані з нуклеотидною послідовністю, яка кодує синтетичний СТР, що повинен експресуватися в поліпептиді, який містить поліпептид, що розглядається, зв'язаний з синтетичним CTP. Крім того, фахівці в даній галузі можуть ідентифікувати додаткові нуклеотидні послідовності, що кодують будь-який з вищезгаданих поліпептидів (наприклад, шляхом клонування генів з високим рівнем гомології з іншими генами, що кодують конкретний поліпептид). Після ідентифікації такої нуклеотидної послідовності не викликає труднощів спосіб створення нуклеотидної послідовності, яка містить послідовність, що кодує синтетичний СТР, яка функціонально зв’язана з ідентифікованою нуклеотидною послідовністю або з послідовністю, що кодує еквівалентний поліпептид. V. Експресія поліпептидів, що містять синтетичний транзитний пептид хлоропласта У деяких варіантах здійснення в клітини, тканини або організм можна вводити щонайменше одну молекулу нуклеїнової кислоти, яка містить нуклеотидну послідовність, що кодує поліпептид, який містить щонайменше один синтетичний СТР, або її функціональний еквівалент, для експресії поліпептиду в клітині, тканині або організмі. У конкретних варіантах здійснення молекула нуклеїнової кислоти може містити нуклеотидну послідовність, що представляє інтерес, функціонально зв’язану з нуклеотидною послідовністю, що кодує синтетичний СТР. Наприклад, молекула нуклеїнової кислоти може містити кодуючу послідовність, яка кодує поліпептид, що містить щонайменше один синтетичний СТР, і щонайменше одну додаткову пептидну послідовність, кодовану нуклеотидною послідовністю, що представляє інтерес. У деяких варіантах здійснення молекула нуклеїнової кислоти за винаходом може бути введена в пластидовмісну клітину-хазяїна, тканину або організм (наприклад, в клітину рослини, рослинну тканину і рослину), таким чином, що може відбуватися експресія поліпептиду з молекули нуклеїнової кислоти в пластидовмісній клітині-хазяїні, тканині або організмі, при цьому експресований поліпептид містить щонайменше один синтетичний СТР і щонайменше одну додаткову пептидну послідовність, кодовану нуклеотидною послідовністю, що представляє інтерес. У деяких прикладах синтетичний СТР такого експресованого поліпептиду може сприяти націлюванню частини поліпептиду, що містить щонайменше додаткову пептидну послідовність, на пластиду з клітини-хазяїна, тканини або організму. У деяких варіантах здійснення молекула нуклеїнової кислоти за винаходом може бути введена в пластидовмісні клітини за допомогою однією з яких-небудь методик, відомих фахівцям в даній галузі. У конкретних варіантах здійснення клітина-хазяїн, тканина або організм може контактувати з молекулою нуклеїнової кислоти згідно з винаходом з метою впровадження молекули нуклеїнової кислоти в клітину, тканину або організм. У конкретних варіантах здійснення клітини можуть бути трансформовані з молекулою нуклеїнової кислоти згідно з винаходом таким чином, що ця молекула нуклеїнової кислоти вводиться в клітину, і ця молекула нуклеїнової кислоти стабільно інтегрується в геном клітини. У деяких варіантах здійснення молекулу нуклеїнової кислоти, яка містить щонайменше одну нуклеотидну послідовність, що кодує синтетичний СТР, функціонально зв’язану з нуклеотидною послідовністю, що представляє інтерес, можна використовувати для трансформації клітини, наприклад, пластидовмісної клітини (наприклад, клітини рослини). Для ініціації або посилення експресії молекула нуклеїнової кислоти може містити одну або декілька регуляторних послідовностей, і ці регуляторні послідовності можуть бути функціонально зв’язані з нуклеотидною послідовністю, що кодує поліпептид, який містить щонайменше один синтетичний СТР. Молекула нуклеїнової кислоти може являти собою, наприклад, векторну систему, що включає в себе, наприклад, лінійну або замкнену кільцеву плазміду. У конкретних варіантах здійснення вектор може являти собою вектор експресії. Послідовності нуклеїнових кислот згідно з винаходом можуть, наприклад, бути вбудовані у вектор так, що послідовність нуклеїнової кислоти буде функціонально зв’язана з однією або декількома регуляторними послідовностями. Для цієї мети доступна множина векторів, і вибір конкретного вектора може залежати, 14 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, від розміру нуклеїнової кислоти, що вставляється у вектор, і від конкретної клітинихазяїна, яку трансформують цим вектором. Вектор звичайно містить різні компоненти, ідентичність яких залежить від функції вектора (наприклад, ампліфікація ДНК і експресія ДНК) і від конкретної клітини-хазяїна (клітин-хазяїнів), з якою вектор є сумісним. Деякі варіанти здійснення можуть включати в себе вектор для трансформації рослин, який містить нуклеотидну послідовність, що містить щонайменше одну з описаних вище регуляторних послідовностей, функціонально зв’язаних з однією або декількома нуклеотидними послідовностями, що кодують поліпептид, який містить щонайменше один синтетичний СТР. У рослинній клітині, тканині або організмі може експресуватися одна або декілька нуклеотидних послідовностей під контролем регуляторної послідовності (послідовностей) для створення поліпептиду, що містить синтетичний СТР, який націлений щонайменше на ділянку поліпептиду в пластиді в рослинній клітині, тканині або в організмі. У деяких варіантах здійснення регуляторна послідовність, функціонально зв’язана з нуклеотидною послідовністю, що кодує поліпептид, який містить щонайменше один синтетичний СТР, може являти собою промоторну послідовність, яка діє в клітині-хазяїні, наприклад в бактеріальній клітині, яка призначена для ампліфікації молекули нуклеїнової кислоти, або в рослинній клітині, яка призначена для експресії молекули нуклеїнової кислоти. Промотори, придатні для використання в молекулах нуклеїнових кислот за винаходом, включають в себе індуковані, вірусні, синтетичні або конститутивні промотори, всі з яких добре відомі в даній галузі техніки. Необмежувальні приклади промоторів, які можуть бути корисні у варіантах здійснення даного винаходу, розглянуті в наступних патентах: патенти США №№ 6437217 (промотор кукурудзи RS81), 5641876 (промотор актину рису), 6426446 (промотор кукурудзи RS324), 6429362 (промотор кукурудзи PR-1), 6232526 (промотор кукурудзи A3), 6177611 (конститутивні промотори кукурудзи), 5322938, 5352605, 5359142 і 5530196 (промотор 35S), 6433252 (промотор олеозину кукурудзи L3), 6429357 (промотор актину рису 2 і інтрон актину рису 2), 6294714 (індуковані світлом промотори), 6140078 (індуковані сіллю промотори), 6252138 (індуковані патогеном промотори), 6175060 (промотори, індуковані дефіцитом фосфору), 6388170 (двонаправлені промотори), 6635806 (промотор гамма-коїксину), і в патентній заявці США серійний номер 09/757089 (промотор альдолази хлоропластів кукурудзи). Додаткові ілюстративні промотори включають в себе промотор нопалінсинтази (NOS) (Ebert et al. (1987), Proc. Natl. Acad. Sci. USA, 84 (16):5745-9), промотор октопінсинтази (OCS), (який міститься в індукуючих пухлину плазмідах з Agrobacterium tumefaciens), колімовірусні промотори, такі як промотор 19S вірусу мозаїки цвітної капусти (CaMV) (Lawton et al. (1987), Plant Mol. Biol. 9:315-24), промотор 35S CaMV (Odell et al. (1985), Nature, 313:810-2), промотор 35S вірус мозаїки ранника (Walker et al. (1987), Proc. Natl. Acad. Sci. USA, 84(19):6624-8), промотор сахарозосинтази (Yang and Russell (1990), Proc. Natl. Acad. Sci. USA, 87:4144-8), промотор генного комплексу R (Chandler et al. (1989), Plant Cell, 1:1175-83), промотор гена а/b білка, що зв'язує хлорофіл, CaMV35S (патенти США №№ 5322938, 5352605, 5359142 і 5530196), FMV35S (патенти США №№ 6051753 і 5378619), промотор PC1 SV (патент США № 5850019), промотор SCPL (патент США № 6677503), і промотори AGRtu.nos (GenBank реєстраційний номер No. V00087, Depicker et al. (1982), J. Mol. Appl. Genet. 1:561-73, Bevan et al. (1983), Nature, 304:184-7). У конкретних варіантах здійснення молекули нуклеїнової кислоти згідно з винаходом можуть включати в себе тканиноспецифічний промотор. Тканиноспецифічний промотор являє собою нуклеотидну послідовність, яка визначає більш високий рівень транскрипції функціонально зв’язаної нуклеотидної послідовності в тканині, для якої цей промотор є специфічним, в порівнянні з іншими тканинами організму. Приклади тканиноспецифічних промоторів включають в себе без обмеження специфічні для тапетуму промотори, специфічні для пиляка промотори, специфічні для пилка промотори (див., наприклад, патент US № 7141424 і міжнародну РСТ публікацію WO 99/042587), специфічні для насінного зачатка промотори (див., наприклад, заявку на патент US 2001/047525 A1), специфічні для плодів промотори (див., наприклад, патенти США №№ 4943674 і 5753475) і специфічні для насіння промотори (див., наприклад, патенти США №№ 5420034 і 5608152). У деяких варіантах здійснення в композиції або способі за винаходом можна використовувати промотор, специфічний для стадії розвитку (наприклад, промотор, діючий на більш пізній стадії розвитку). Додаткові регуляторні послідовності, які в деяких варіантах здійснення можуть бути функціонально зв’язані з молекулою нуклеїнової кислоти, включають в себе 5'-UTR (нетрансльовані області), розташовані між промоторною послідовністю і кодуючою послідовністю, які функціонують як трансляційна лідерна послідовність. Трансляційна лідерна послідовність присутня в повністю процесованій мРНК, і вона може впливати на процесування 15 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 первинного транскрипту і/або на стабільність РНК. Приклади трансляційний лідерних послідовностей включають в себе лідерні послідовності білків теплового шоку кукурудзи і петунії (патент США № 5362865), лідерні послідовності оболонкових білків вірусів рослин, лідерні послідовності rubisco (рибулозо-1,5-біфосфаткарбоксилази/оксигенази) і інші. Див., наприклад, Turner and Foster (1995), Molecular Biotech. 3(3):225-36. Необмежувальні приклади 5'-UTR представлені наступними послідовностями: GmHsp (патент США № 5659122), PhDnaK (патент США № 5362865), AtAnt1, TEV (Carrington and Freed (1990), J. Virol. 64:1590-7), і AGRtunos (GenBank реєстраційний номер V00087, і Bevan et al. (1983), Nature, 304:184-7). Додаткові регуляторні послідовності, які в деяких варіантах здійснення можуть бути функціонально зв’язані з молекулою нуклеїнової кислоти, також включають в себе 3'нетрансльовані послідовності, 3'-області термінації транскрипції або області поліаденілювання. Вони являють собою генетичні елементи, розташовані в 5'-3'-напрямку від нуклеотидної послідовності, і включають в себе полінуклеотиди, які створюють сигнал поліаденілювання і/або інші регуляторні сигнали, здатні впливати на транскрипцію або процесування мРНК. Функція сигналу поліаденілювання у рослин полягає в індукції приєднання поліаденілатнуклеотидів до 3'-кінця попередника мРНК. Послідовність поліаденілювання може бути одержана з різних рослинних генів або з генів Т-ДНК. Необмежувальним прикладом області 3'-термінації транскрипції є 3'-область нопалінсинтази (nos-3', Fraley et al. (1983), Proc. Natl. Acad. Sci. USA, 80:4803-7). Приклад використання різних 3'-нетрансльованих областей представлений в публікації Ingelbrecht et al. (1989), Plant Cell, 1:671-80. Необмежувальні приклади сигналів поліаденілювання включають в себе сигнал з гена Pisum sativum RbcS2 (Ps.RbcS2-E9, Coruzzi et al. (1984), EMBO J. 3:1671-9.) і AGRtu.nos (Genbank, реєстраційний номер E01312). Рекомбіантна молекула нуклеїнової кислоти або вектор за даним винаходом може містити селектований маркер, який надає селектований фенотип трансформованій клітині, наприклад рослинній клітині. Селектовані маркери також можна використовувати для вибору рослин або рослинних клітин, які містять рекомбінантну молекулу нуклеїнової кислоти за винаходом. Маркер може кодувати стійкість до біоцидів, стійкість до антибіотиків (наприклад, до канаміцину, генетицину (G418), блеоміцину, гігроміцину і т. д.) або толерантність до гербіцидів (наприклад, до гліфосату і т. д.). Приклади селектованих маркерів включають в себе без обмеження: ген neo, що кодує стійкість до канаміцину, який можна вибирати для застосування канаміцину, G418 і т.д.; ген bar, який кодує стійкість до біалафосу; мутантний ген EPSPS-синтази, який кодує стійкість до гліфосату; ген нітрилази, який надає стійкість до бромоксинілу; мутантний ген ацетолактатсинтази (АЛС), який надає стійкість до імідазолінону або сульфонілсечовини; і ген DHFR стійкості до метотрексату. Доступний ряд селектованих маркерів, які надають стійкість до ампіциліну, блеоміцину, хлорамфеніколу, гентаміцину, канаміцину, гігроміцину, лінкоміцину, метотрексату, фосфінотрицину, пуроміцину, спектиноміцину, рифампіцину, стрептоміцину і тетрацикліну і т. п. Приклади таких селектованих маркерів показані, наприклад, в патентах США №№ 5550318, 5633435, 5780708 і 6118047. Рекомбіантна молекула нуклеїнової кислоти або вектор за даним винаходом може аналогічно або альтернативно містити маркер для скринінгу. Маркери для скринінгу можуть бути використані для контролю експресії. Приклади маркерів для скринінгу включають в себе ген β-глюкуронідази або uidA (GUS), що кодує фермент, для якого відомі різні хромогенні субстрати (Jefferson et al. (1987), Plant Mol. Biol. Rep. 5:387-405), ген R-локусу, що кодує продукт, який регулює вироблення пігментів антоціанів (червоного кольору) в тканинах рослин (Dellaporta et al. (1988), "Molecular cloning of the maize R-nj allele by transposon tagging with Ac" в матеріалах 18-го симпозіуму генетиків Stadler Genetics Symposium, P. Gustafson and R. Appels, eds. (New York: Plenum), СТР. 263-82), ген β-лактамази (Sutcliffe et al. (1978), Proc. Natl. Acad. Sci. USA, 75:3737-41), ген, що кодує фермент, для якого відомі різні хромогенні субстрати (наприклад, PADAC, хромогенний цефалоспорин), ген люциферази (Ow et al. (1986), Science, 234:856-9.), ген xylE, що кодує катехіндіоксигеназу, яка може перетворювати хромогенні катехіни (Zukowski et al. (1983), Gene, 46(2-3):247-55.), ген амілази (Ikatu et al. (1990), Bio/Technol. 8:241-2), ген тирозинази, що кодує фермент, який здатний окисляти тирозин в ДОФА і допахінон, який, в свою чергу, конденсується до меланіну (Katz et al. (1983), J. Gen. 129:2703-14) і αгалактозидази. Придатні способи трансформації клітин-хазяїнів включають в себе будь-який спосіб, за допомогою якого в клітину можна вводити ДНК, наприклад, і без обмеження: шляхом трансформації протопластів (див., наприклад, патент США № 5508184), шляхом опосередковуваного висушуванням/інгібуванням захоплення ДНК (див., наприклад, Potrykus et al. (1985), Mol. Gen. Genet. 199:183-8), шляхом електропорації (див., наприклад, патент США № 5384253), шляхом збовтування з волокнами карбіду кремнію (див., наприклад, патенти США 16 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 №№ 5302523 і 5464765), шляхом опосередковуваної Agrobacterium трансформації (див., наприклад, патенти США №№ 5563055, 5591616, 5693512, 5824877, 5981840 і 6384301) і шляхом акселерації частинок, покритих ДНК (див., наприклад, патенти США №№ 5015580, 5550318, 5538880, 6160208, 6399861 і 6403865) і т. д. Шляхом застосування згаданих способів можна стабільно трансформувати клітини практично будь-якого виду. У деяких варіантах здійснення трансформуюча ДНК інтегрована в геном клітини-хазяїна. У багатоклітинних видів трансгенні клітини можна регенерувати в трансгенний організм. Можна використовувати будьякий із згаданих способів для одержання трансгенної рослини, наприклад з вмістом в геномі трансгенної рослини однієї або декількох послідовностей нуклеїнових кислот за винаходом. Найбільш широко використовуваний спосіб введення вектора експресії в рослини оснований на природній системі трансформації Agrobacterium. Бактерії A. tumefaciens і А. rhizogenes являють собою рослинні патогенні ґрунтові бактерії, які генетично трансформують рослинні клітини. Плазміди Ti і Ri з А. tumefaciens і А. rhizogenes, відповідно, несуть гени, відповідальні за генетичну трансформацію рослин. Плазміди Ti (індукуючі пухлину) містять великий сегмент, називаний Т-ДНК, який переноситься в трансформовані рослини. Інший сегмент плазміди Ti, ділянка vir, відповідає за перенесення Т-ДНК. Область Т-ДНК обмежена кінцевими повторами. У деяких модифікованих бінарних векторах видаляли індукуючі пухлину гени, і функції ділянки vir задіювали для перенесення чужорідної ДНК, обмеженої прикордонними послідовностями ТДНК. Т-область також може містити, наприклад, селектований маркер для ефективного відновлення трансгенних рослин і клітин і сайт множинного клонування для вставки послідовностей з метою перенесення, наприклад, нуклеїнової кислоти, що кодує синтетичний СТР. Таким чином, в деяких варіантах здійснення вектор трансформації рослин можна одержувати з плазміди Ti А. tumefaciens (див., наприклад, патенти США №№ 4536475, 4693977, 4886937 і 5501967, і європейський патент EP 0122791) або з плазміди Ri А. rhizogenes. Додаткові вектори трансформації рослин включають в себе, як приклад і без обмеження, вектори, описані авторами Herrera-Estrella et al. (1983), Nature, 303:209-13; Bevan et al. (1983), Nature, 304:184-7; Klee et al. (1985), Bio/Technol. 3:637-42, і в європейському патенті ЕР 0120516, і вектори, одержані з чого-небудь вищеперерахованого. Можна модифікувати інші бактерії, такі як Sinorhizobium, Rhizobium і Mesorhizobium, які в природі взаємодіють з рослинами, щоб зробити їх медіаторами перенесення генів для деяких різних рослин. Ці асоційовані з рослинами симбіотичні бактерії можна робити компетентними для перенесення гена шляхом введення як нейтралізованої плазміди Ti, так і придатного бінарного вектора. Після введення екзогенної ДНК в клітини-реципієнти звичайно проводять ідентифікацію трансформованих клітин для подальшого культивування і регенерації рослин. Щоб підвищити можливість ідентифікації трансформованих клітин може бути бажаним використовувати селектований або скринований маркерний ген, як указано вище, з вектором, застосовуваним для створення трансформанта. У випадку використання селектованого маркера ідентифікацію трансформованих клітин в клітинній популяції потенційно трансформованих клітин проводять шляхом впливу на клітини селективного агента або агентів. У випадку використання скринованого маркера можна проводити скринінг клітин на маркерний ген бажаної ознаки. Клітини, що вижили після впливу селективного агента, або клітини, визначені в скринінгу як позитивні, можна культивувати в середовищі, яке сприяє регенерації рослин. У деяких варіантах здійснення будь-яке придатне середовище для культивування рослинної тканини (наприклад, середовища MS і N6) можна модифікувати шляхом включення в нього додаткових речовин, таких як регулятори росту. Тканина може знаходитися в базовому середовищі з регуляторами росту доти, поки є достатня кількість тканини для початку спроби регенерації рослин, або після неодноразових циклів ручної селекції, поки морфологія тканини придатна для регенерації (наприклад, протягом щонайменше 2 тижнів), і потім переноситься в середовище, яке сприяє утворенню паростків. Перенесення культури здійснюють періодично до моменту достатнього утворення паростків. Після утворення паростків їх переносять в середовище, яке сприяє утворенню коренів. Після утворення достатньої кількості коренів рослини можна переносити в ґрунт для подальшого росту і дозрівання. Для підтвердження присутності в регенеруючій рослині молекули нуклеїнової кислоти, що представляє інтерес (наприклад, нуклеотидної послідовності, що кодує поліпептид, який містить щонайменше один синтетичний СТР), можна проводити множину аналізів. Такі аналізи включають в себе, наприклад, молекулярно-біологічні дослідження, такі як саузерн-блотинг, нозерн-блотинг, ПЛР і секвенування нуклеїнових кислот; біохімічні аналізи, такі як виявлення присутності білкового продукту, наприклад, за допомогою імунологічних способів (імуноферментний аналіз ELISA і/або вестерн-блотинг) або за допомогою ферментативної 17 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 функції; дослідження частини рослин, наприклад аналізи листів або коренів, і дослідження фенотипу усієї регенерованої рослини. Як приклад, об'єкт інтеграції можна аналізувати за допомогою ПЛР-ампліфікації з використанням, наприклад, олігонуклеотидних праймерів, специфічних для нуклеотидної послідовності, що представляє інтерес. Потрібно розуміти, що ПЛР-генотипування включає в себе без обмеження ампліфікацію з полімеразною ланцюговою реакцією (ПЛР) геномної ДНК, одержаної з виділеної тканини рослини-хазяїна, яка передбачувано містить молекулу нуклеїнової кислоти, що представляє інтерес, інтегровану в геном, з подальшим стандартним клонуванням і аналізом послідовностей продуктів ПЛР-ампліфікації. Способи ПЛРгенотипування добре описані (див., наприклад, Rios G. еt al. (2002), Plant J. 32:243-53) і можуть застосовуватися до геномної ДНК, одержаної з будь-яких видів рослин (наприклад, Z. Mays або G. max) або типів тканин, в тому числі з клітинних культур. Трансгенна рослина, утворена з використанням опосередковуваних Agrobacterium способів трансформації, звичайно містить єдину рекомбінантну послідовність ДНК, вставлену в одну хромосому. Ця єдина рекомбінантна послідовність ДНК називається "трансгенним об'єктом" або "об'єктом інтеграції". Такі трансгенні рослини є гетерозиготними по вставленій послідовності ДНК. У деяких варіантах здійснення можна одержувати трансгенну рослину, гомозиготну відносно трансгена, шляхом статевого схрещування (самозапилення) незалежної трансгенної рослини-сегреганта, що містить єдину екзогенну для себе послідовність гена, наприклад рослина F0, для одержання насіння F1. Одна чверть одержаного насіння F1 буде гомозиготним відносно цього трансгена. Проростаюче насіння F1 перетворюється в рослини, які можна тестувати на гетерозиготність, звичайно за допомогою аналізу однонуклеотидного поліморфізму (SNP) або термальної ампліфікації, які дозволяють визначати відмінності між гетерозиготами і гомозиготами (тобто аналіз на зиготність). У конкретних варіантах здійснення копії щонайменше одного поліпептиду, що містить щонайменше один синтетичний СТР, одержують в пластидовмісній клітині, в яку була введена щонайменше одна молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує щонайменше один поліпептид, що містить щонайменше один синтетичний СТР. Кожний поліпептид, що містить щонайменше один синтетичний СТР, може експресуватися з множини послідовностей нуклеїнових кислот, вставлених в різні об'єкти трансформації, або з єдиної послідовності нуклеїнової кислоти, вставленої в єдиний об'єкт трансформації. У деяких варіантах здійснення множина таких поліпептидів експресується під контролем єдиного промотору. У інших варіантах здійснення множина таких поліпептидів експресується під контролем декількох промоторів. Можна експресувати одиночні поліпептиди, які містять множину пептидних послідовностей, і кожна з цих пептидних послідовностей повинна бути націлена на пластиду. На доповнення до прямої трансформації рослин з молекулою рекомбінантної нуклеїнової кислоти, трансгенні рослини можна одержувати шляхом схрещування першої рослини, що має щонайменше один трансгенний об'єкт, з другою рослиною, що не має такого об'єкта. Наприклад, молекулу рекомбінантної нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує поліпептид, що містить щонайменше один синтетичний СТР, можна вставляти в рослину першої лінії, яка піддається трансформації, для одержання трансгенної рослини, і цю трансгенну рослину можна схрещувати з рослиною другої лінії, для інтрогресії нуклеотидної послідовності, яка кодує поліпептид, в рослину другої лінії. VI. Рослинні матеріали, що містять поліпептид, орієнтований на синтетичний транзитний пептид хлоропластів У деяких варіантах здійснення розглядається рослина, відмінна тим, що ця рослина містить рослинну клітину, яка містить нуклеотидну послідовність, що кодує поліпептид, який містить щонайменше один синтетичний СТР. У конкретних варіантах здійснення таку рослину можна одержувати шляхом трансформації тканини рослини або клітини рослини і регенерації в цілу рослину. У інших варіантах здійснення таку рослину можна одержувати з комерційних джерел або за допомогою інтрогресії нуклеїнової кислоти, яка містить нуклеотидну послідовність, що кодує поліпептид, який містить щонайменше один синтетичний СТР в зародковій плазмі. Також винахід стосується рослинних матеріалів, що містять рослинну клітину, яка містить нуклеотидну послідовність, що кодує поліпептид, який містить щонайменше один синтетичний СТР. Такий рослинний матеріал може бути одержаний з рослини, що містить цю рослинну клітину. Трансгенна рослина або рослинний матеріал, що містить нуклеотидну послідовність, яка кодує поліпептид, що містить щонайменше один синтетичний СТР, в деяких варіантах здійснення може показувати одну або декілька з наступних властивостей: експресію поліпептиду в клітині рослини, експресію частини поліпептиду в пластиді з клітини цієї рослини, 18 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 надходження поліпептиду з цитозолю клітини цієї рослини в пластиди цієї клітини, специфічну для пластиди експресію поліпептиду в клітині цієї рослини і/або локалізацію поліпептиду в клітині цієї рослини. Така рослина може додатково мати одну або декілька інших бажаних ознак, крім експресії кодованого поліпептиду. Такі ознаки можуть включати в себе, наприклад: стійкість до комах, інших шкідників і хвороботворних агентів; толерантність до гербіцидів, підвищену стабільність, врожайність або термін придатності, толерантність до умов навколишнього середовища, фармацевтичне виробництво, промислове виробництво продукції і поліпшення поживних властивостей. Трансгенна рослина за винаходом може являти собою будь-яку рослину, яку можна трансформувати з молекулою нуклеїнової кислоти згідно з винаходом. Відповідно, рослина може бути дводольною або однодольною. Необмежувальні приклади дводольних рослин, які можна використовувати в способах даного винаходу, включають в себе Arabidopsis, люцерну, боби, броколі, капусту, моркву, цвітну капусту, селеру, китайську капусту, бавовну, огірки, баклажани, салат, диню, горох, перець, арахіс, картоплю, гарбуз, редиску, рапс, шпинат, соєві боби, кабачки, цукровий буряк, соняшник, тютюн, томат і кавун. Необмежувальні приклади однодольних рослин, які можна використовувати в способах даного винаходу, включають в себе кукурудзу, Brassica, цибулю, рис, сорго, пшеницю, жито, просо, цукрову тростину, овес, тритикале, просо і газонну траву. Трансгенні рослини згідно з винаходом можна використовувати і культивувати будь-яким способом. Деякі варіанти здійснення також стосуються товарних продуктів, що містять одну або декілька нуклеотидних послідовностей, які кодують поліпептид, що містить щонайменше один синтетичний СТР, наприклад товарного продукту, одержуваного з рекомбінантної рослини або насіння, що містить одну або декілька згаданих нуклеотидних послідовностей. Товарні продукти, які містять одну або декілька нуклеотидних послідовностей, що кодують поліпептид, який містить щонайменше один синтетичний СТР, включають в себе, як приклад і без обмеження: харчові продукти, борошно, олії, дроблені або цільні зерна або насіння рослин, які містять одну або декілька нуклеотидних послідовностей, що кодують поліпептид, який містить щонайменше один синтетичний СТР. Виявлення однієї або декількох нуклеотидних послідовностей, що кодують поліпептид, який містить щонайменше один синтетичний СТР, в одному або декількох споживчих виробах або товарних продуктах є фактичним доказом, що споживчий виріб або товарний продукт щонайменше частково одержаний з рослини, яка містить одну або декілька нуклеотидних послідовностей, що кодують поліпептид, який містить щонайменше один синтетичний СТР. У конкретних варіантах здійснення опис товарний продукт за винаходом містить визначувану кількість послідовностей нуклеїнової кислоти, що кодують поліпептид, який містить щонайменше один синтетичний СТР. У деяких варіантах здійснення такі товарні продукти можна одержувати, наприклад, шляхом створення трансгенних рослин і приготування з них їжі або корму. У деяких варіантах здійснення трансгенна рослина або насіння, що містить трансген, який містить нуклеотидну послідовність, що кодує поліпептид, який містить щонайменше один синтетичний СТР, також може містити в своєму геномі щонайменше один інший трансгенний об'єкт, що включає в себе без обмеження: трансгенний об'єкт, з якого транскрибується молекула іРНК; ген, що кодує інсектицидний білок (наприклад, інсектицидний білок Bacillus Thuringiensis); ген толерантності до гербіцидів (наприклад, ген, що забезпечує толерантність до гліфосату) і ген, що сприяє появі бажаного фенотипу у трансгенної рослини (наприклад, підвищеної врожайності, зміненого метаболізму жирних кислот або відновлення цитоплазматичної чоловічої стерильності). VII. Локалізація генних продуктів в пластидах, опосередковувана синтетичним транзитним пептидом хлоропластів Деякі варіанти здійснення даного винаходу стосуються способу експресії і/або локалізації генного продукту в пластиді (наприклад, в хлоропласті). У конкретних варіантах здійснення генним продуктом може бути маркерний генний продукт, наприклад флуоресцентна молекула. Експресія генного продукту як частини поліпептиду, який також містить синтетичний СТР, може служити системою оцінки можливості локалізації в пластидах конкретної послідовності синтетичного CTP. У деяких варіантах здійснення експресія маркерного генного продукту як частини поліпептиду, що містить синтетичний CTP, використовується для цільової експресії маркерного генного продукту в пластидах в клітині, де експресується поліпептид. У деяких варіантах здійснення такий маркерний генний продукт локалізований в пластиді (пластидах) клітини-хазяїна. Наприклад, маркерний генний продукт може мати більш високий рівень експресії в пластиді (пластидах), ніж в цитозолі або в інших органелах клітини-хазяїна; маркерний генний продукт може мати набагато більш високий рівень експресії в пластиді 19 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 (пластидах); маркерний генний продукт може експресуватися по суті тільки в пластиді (пластидах) або маркерний генний продукт може повністю експресуватися в пластиді (пластидах), так що неможливо виявити його експресію в цитозолі або в непластидних органелах. У деяких варіантах здійснення для оцінки властивостей функціонального варіанта пептиду використовується поліпептид, що містить функціональний варіант синтетичного CTP, відмінний тим, що цей поліпептид функціонально зв’язаний з маркерним генним продуктом. Наприклад, послідовність синтетичного CTP можна варіювати, наприклад, шляхом вставки в синтетичний СТР щонайменше однієї консервативної мутації, і одержаний пептидний варіант можна приєднувати до маркерного генного продукту. Після експресії у придатній клітині-хазяїні (наприклад, в клітині, в якій один або декілька регуляторних елементів в експресованій конструкції є функціональними) можна визначати експресію маркерного генного продукту. Шляхом порівняння субклітинної локалізації маркерного генного продукту в еталонній конструкції синтетичний CTP - маркер і в конструкції варіантний пептид - маркер, можна визначити, чи має варіантний пептид, наприклад, більш значну локалізацію пластид або, по суті, ідентичну локалізацію пластид. Такий варіант може розглядатися як функціональний варіант. Шляхом виявлення функціональних варіантів синтетичного CTP, які мають більш значну локалізацію пластид, мутації в таких варіантах можуть включатися в інші варіанти синтетичного СТР. Проведення декількох циклів такого способу оцінки і подальше включення виявлених корисних мутацій в послідовність синтетичного CTP може в результаті створити ітеративний процес для оптимізації послідовності синтетичного CTP. Такі оптимізовані послідовності синтетичного СТР і кодуючі їх нуклеотидні послідовності вважаються частиною даного винаходу, незалежно від можливості додаткової оптимізації шляхом додаткової мутації таких оптимізованих послідовностей синтетичного CTP. Всі посилання, що включають в себе цитовані публікації, патенти і патентні заявки, включені в дане розкриття шляхом посилання тією мірою, що вони не суперечать явним подробицям даного розкриття, і таким чином, включені тією ж мірі, як якби по кожному посиланню було окремо і конкретно указано, що воно включене як посилання і викладене в повному обсязі. Посилання, згадувані в цьому документі, представлені виключно для їх розкриття до дати подачі цієї заявки. Ніщо в цьому документі не повинно бути витлумачене як визнання того, що автори винаходу не мають права датувати заднім числом таке розкриття на основі попереднього винаходу. Наступні приклади наведені для ілюстрації визначених конкретних ознак і/або аспектів. Ці приклади не повинні розглядатися як обмеження даного розкриття конкретними описаними ознаками або аспектами. Приклади Приклад 1. Конструювання і одержання послідовності синтетичного транзитного пептиду хлоропласта (TraP) Пластиди являють собою цитоплазматичні органели, що виявляються у вищих видів рослин і розташовані у всіх тканинах рослин. Хлоропласти є специфічним типом пластид, що містяться в зелених фотосинтезуючих тканинах, і відповідають за найважливіші фізіологічні функції. Наприклад, однією з таких первинних фізіологічних функцій є синтез ароматичних амінокислот, необхідних для рослини. У цьому шляху біосинтезу необхідні кодовані в ядрі ферменти, які транспортуються з цитоплазми до внутрішньої частини хлоропласта. Ці кодовані в ядрі ферменти звичайно мають N-кінцевий транзитний пептид, який взаємодіє з мембраною хлоропласта для полегшення транспорту пептиду в строму хлоропласта. Bruce В. (2000), Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10:440-447. Після перенесення стромальні пептидази розщеплюють транзитний пептид, залишаючи зрілий функціональний білок перенесеним в хлоропласт. Richter S. Lamppa G.K. (1999), Stromal processing peptidase binds transit peptides and initiates their ATP-dependent turnover in chloroplasts. Journ. Cell Bio. 147:33:-43. Транзитні пептиди хлоропластів є варіабельними послідовностями, які значною мірою відрізняються по довжині, складу і будові. Bruce В. (2000), Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10:440-447. Подібність послідовностей у транзитних пептидів хлоропластів значною мірою розрізнюється серед гомологічних білків з різних видів рослин. Кількість відмінностей між транзитними пептидами хлоропластів є непередбачуваною, враховуючи, що гомологічні білки, одержані з різних видів рослин, звичайно мають відносно високі рівні схожості послідовностей при порівнянні процесованого зрілого функціонального білка. Була розроблена, одержана і досліджена in planta послідовність нового синтетичного транзитного пептиду хлоропластів. Було показано, що новий синтетичний транзитний пептид 20 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 хлоропластів має ефективні властивості транслокації і процесування для надходження агрономічних важливих білків в хлоропласти. Спочатку аналізували нативні білкові послідовності 5-енолпірувілшикімат-3-фосфатсинтази (EPSPS) з різних видів рослин за допомогою комп'ютерної програми ChloroP™, щоб визначити передбачувані послідовності транзитного пептиду хлоропласта (Emanuclsson О., Nielsen Н., von Heijne G. (1999), ChloroP, а neural network-based method for predicting chloroplast transit peptides and their cleavage sites, Protein Science, 8:978-984), доступної за адресою http://www.cbs.dtu.dk/services/ChloroP/. За допомогою вирівнювання послідовностей транзитного пептиду хлоропластів були розроблені нові синтетичні транзитні пептиди хлоропластів шляхом випадкового вибору амінокислот для одержання послідовності нового синтетичного передбачуваного транзитного пептиду хлоропластів. Ілюстративною послідовністю нового сконструйованого синтетичного транзитного пептиду хлоропластів є TraP23 (SEQ ID NO: 11). Новий синтетичний транзитний пептид хлоропластів досліджували за допомогою ряду тестів, які включали в себе транзиторне тестування in planta системи експресії і трансгенне дослідження у вигляді стабільної трансформації об'єкта, що містить елемент генної експресії, злитий з агрономічно важливою послідовністю трансгена. Приклад 2. Транзиторне in planta тестування послідовностей синтетичного транзитного пептиду хлоропластів (TraP) Транзиторний аналіз тютюну Спочатку тестували послідовність TraP23 синтетичного транзитного пептиду хлоропластів за допомогою транзиторного аналізу in planta. Була синтезована полінуклеотидна послідовність, яка кодує TraP23 v2 (SEQ ID NO: 12) послідовності синтетичного транзитного пептиду хлоропластів. Одержана конструкція містила дві одиниці транскрипції рослин (PTU). Перша PTU складалася з промотору убіквітину 10 Arabidopsis thaliana (промотор AtUbi10; Callis et al. (1990), J. Biol. Chem. 265:12486-12493), злиття генів TraP-зелений флуоресцентний білок (TraP-GFP; патент США № 7678893) і 3'-нетрансльованої області ORF23 Agrobacterium tumefaciens (AtuORF23 3'UTR; патент США № 5428147). Друга PTU складалася з промотору вірусу мозаїки маніоки Cassava Vein Mosaic Virus (промотор CsVMV; Verdaguer et al. (1996), Plant Molecular Biology, 31:1129-1139), DSM-2 (DSM2; патент США App № 2011/0107455) і 3'нетрансльованої області ORF1 Agrobacterium tumefaciens (AtuORF1 3'UTR; Huang et al. (1990), J. Bacteriol. 172:1814-1822). Конструкція pDAB107640 містить синтетичний транзитний пептид хлоропластів TraP23 v2 (фіг. 3). Конструкції підтверджували шляхом розщеплення ферментом рестрикції і секвенування. І, нарешті, конструкції трансформували в Agrobacterium tumefaciens і зберігали у вигляді гліцеринового стокового розчину. Повну петлю замороженої культури інокулювали з гліцеринового стокового розчину Agrobacterium в 2 мл пептон-декстрози дріжджів (YPD) (100 мкг/мл спектиноміцину) в стерильній пробірці об'ємом 14 мл. Інокульоване середовище інкубували при 28 °C протягом ночі із збовтуванням при 200 обертах на хвилину. На наступний день приблизно 100 мкл культури використовували для інокуляції 25 мл YPD (100 мкг/мл спектиноміцину) в стерильній колбі 125 мл з трьома перегородками, і інкубували протягом ночі при 28 °C із збовтуванням протягом ночі при 200 обертах на хвилину. На наступний день культури розбавляли до OD 600 0,5 в стерильній ddH2O (рівень рН 8,0). Розбавлений штам Agrobacterium змішували з другим штамом Agrobacterium, що містить допоміжний білок P19 у співвідношенні 1:1. Цю культуру використовували для інфільтрації листів тютюну за допомогою способу Voinnet О., Rivas S., Mestre Р., Baulcombe D. (2003), An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus, The Plant Journal, 33:949-956. Інфільтровані рослини тютюну поміщали в набір Conviron™ на 16 годин з освітленням при температурі 24 °C на період щонайменше три дні до проведення аналізу. Результати мікроскопії Інфільтровані Agrobacterium листи тютюну відділяли від рослини і поміщали в чашки Петрі з водою для запобігання дегідратації. Інфільтровані листи тютюну обстежували із збудженням блакитним світлом зі скляним довгохвильовим проникним фільтром, фіксованим на місці, за допомогою лампи Dark Reader Hand Lamp™ (Clare Chemical Research Co.; Dolores, CO), щоб визначити непошкоджені зони листів, які успішно експресували репортерні білки GFP. Конкретні визначені зони листів вирізали з листів і поміщали у воду для візуалізації за допомогою конфокальної мікроскопії (Leica TCS-SP5 AOBS™, Buffalo Grove, IL). Репортерний білок GFP збуджували лінією лазерного випромінювання 514 нм з використанням багатопотокового аргонового іонного лазера. Ширину щілин виявлення регулювали за допомогою неекспресуючого (темного) контрольного зразка листів для виключення фонової аутофлуоресценції листів. Аутофлуоресценцію хлорофілу одночасно виявляли у другому каналі 21 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 для прямого порівняння з сигналом флуоресцентного білка-репортера для визначення локалізації хлорпластів. Результати мікроскопічної візуалізації показали, що флуоресцентний білок GFP, який містить транзитний пептид хлоропластів TraP23, не накопичується з виявлюваною кількістю білка GFP в хлоропластах, розташованих в цитоплазмі клітин тютюну (фіг. 4). Результати вестерн-блотингу Зразки інфільтрованих рослин тютюну аналізували за допомогою вестерн-блотингу. Вирізані зони листів були зібрані і піддані подрібненню в кульовому млині. Приблизно від 100 до 200 мг матеріалу листів змішували з 2 BB (стальні кульки; Daisy; Rogers, AR) і 500 мл розчину фосфатного буфера Твін (ФБР-Т) протягом 3 хвилин в кульовому млині Kleco™. Потім зразки центрифугували в центрифузі при 14000×g при 4 °C. Видаляли супернатант і аналізували або безпосередньо за допомогою вестерн-блотингу, або шляхом імунопреципітації. Імунопреципітацію проводили з використанням комплекту Pierce Direct IP kit™ (Thermo Scientific; Rockford, IL), відповідно до протоколу виробника. Приблизно 50 мкг анти-GFP зв'язували зі смолою. Зразки інкубували зі смолою протягом ночі при 4 °C. Потім на наступний ранок зразки промивали, елюювали і підготовляли до аналізу шляхом об'єднання рівних об'ємів 2× 8М буфера для зразків з сечовиною, після чого зразки кип'ятили протягом 5 хвилин. Прокип'ячені зразки піддавали впливу 4-12% SDS-біс Тріс-гелю в буфері MOPS протягом 40 хвилин. Потім гель блотували за допомогою Invitrogen iBlot™ (Life Technologies, Carlsbad, CA), відповідно до протоколу виробника. Блотовану мембрану фіксували протягом 10 хвилин з використанням 5% знежиреного сухого молока в розчині ФБР-Твін. Мембрану зондували первинними антитілами (моноклональними анти-GFP в кролячому), які використовували в розведенні 1:1000 в 5% знежиреному сухому молоці в розчині ФБР-Твін протягом 1 години. Потім мембрану промивали три рази протягом п'яти хвилин з розчином ФБР-Твін для видалення всіх незв'язаних первинних антитіл. Мембрану зондували з вторинним моноклональним антикролячим козячим антитілом (Life Technologies), використовуваним в розведенні 1:1000, протягом 60 хвилин. Мембрану промивали, як описано вище, і виводили шляхом додавання субстрату Themo BCIP/NBT. Колориметричний субстрат залишали для розвитку протягом від 5 до 10 хвилин, а потім блоти промивали водою, після чого висушували. Результати вестерн-блотингу показали, що білок GFP експресується в інфільтрованих клітинах тютюну. В інфільтрованих pDAB107640 тканинах листів від рослин тютюну експресувався білок GFP, що визначалося по наявності смуги білка, яка реагувала з GFPантитілом і була еквівалентна по розміру смузі білка GFP, одержаного від контрольного GFP, який не містить транзитний пептид хлоропластів. Крім того, ці результати показували, що синтетичний транзитний пептид хлоропластів TraP процесувався і відщеплювався від білка GFP. Конструкція TraP23-GFP показує смугу попередньо процесованого білка, який має більш високу молекулярну вагу, ніж контрольний білок GFP. Присутність смуг у вестерн-блотингу, які еквівалентні по розміру смугам контрольного GFP, вказує, що послідовності транзитного пептиду хлоропластів TraP23 були процесовані, тим самим зменшувався розмір GFP до значення молекулярної ваги, яка еквівалентна контрольному GFP. Транзиторний аналіз протопластів кукурудзи Полінуклеотидну послідовність, що кодує синтетичний транзитний пептид хлоропластів TraP23 v2 (SEQ ID NO: 12), клонували в 3'-5'-напрямку від гена зеленого флуоресцентного білка і вставляли в конструкцію pDAB106598 (фіг. 5) для тестування за допомогою транзиторного аналізу протопластів кукурудзи in planta. Одержана конструкція містила описані нижче одиниці транскрипції рослин (PTU). Перша PTU складалася з промотору убіквітину 1 Zea mays (промотор ZmUbil; Christensen А., Sharrock R. and Quail Р. (1992), Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18:675-689), злиття генів TraPзелений флуоресцентний білок (TraP23-GFP; патент США № 7678893) і 5'-3'-нетрансльованої області пероксидази Zea mays (ZmPer5 3'UTR; патент США № 6384207). Конструкції верифікували шляхом розщеплення ферментом рестрикції і секвенування. Насіння Zea mays var. B104 піддавали поверхневій стерилізації шляхом енергійного збовтування в 50% Clorox (3% гіпохлорит натрію), що містить 2-3 краплі Твін-20, протягом приблизно 20 хвилин. Насіння ретельно промивали стерильною дистильованою водою. Стерильне насіння висівали на середовище ½ МS в бокси Phytatrays або бокси подібного типу, і залишали для росту в темряві (28 °C) протягом від 12 до 20 днів. Для одержання і трансфекції протопластів кукурудзи з листів B104-кукурудзи використовували транзиторний аналіз протопластів кукурудзи. Цей аналіз протопластів кукурудзи є модифікацією системи, описаної авторами Yoo S.-D., Cho Y.-H. and Sheen J. (2007), Arabidopsis Mesophyll Protoplasts: А Versitile 22 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 Cell System for Transient Gene Expression Analysis, Nature Protocols, 2:1565-1572. Розчини готували, як описано в публікації Yoo et. al. (2007), з тим виключенням, що використовувану в подальших експериментах концентрацію маніту змінювали до 0,6М. 5 Трансфекцію від 100 до 500 мкл протопластів (1-510 ) здійснювали шляхом додавання протопластів в мікроцентрифужній пробірці об'ємом 2 мл, що містить приблизно 40 мкг плазмідної ДНК (pDAB106598), при кімнатній температурі. Об'єм ДНК переважно підтримували приблизно до 10% від об'єму протопластів. Протопласти і ДНК періодично перемішували протягом 5-хвилинного періоду інкубації. До протопластів і ДНК повільно додавали еквівалентний об'єм розчину ПЕГ, 2 краплі за один раз при змішуванні між додаванням крапель розчину ПЕГ. Пробірки інкубували протягом приблизно 10 хвилин при періодичному акуратному перемішуванні. Потім додавали 1 мл розчину W5+ і змішували шляхом багаторазового перевертання пробірки. Пробірку (пробірки) центрифугували протягом 5 хвилин при 75g при температурі 4 °C. В кінці видаляли супернатант, осад ресуспендували в 1 мл розчину WI, і протопласти поміщали в невелику чашку Петрі (35×10 мм) або в 6-коміркові багатоямкові планшети і інкубували протягом ночі в темряві при кімнатній температурі. Флуоресценцію GFP візуалізували за допомогою мікроскопії через 12 годин інкубації. Для візуалізації застосовували умови мікроскопії, описані вище. Результати візуалізації за допомогою мікроскопії показали, що флуоресцентний білок GFP, що містить синтетичний транзитний пептид хлоропластів TraP23, який накопичується в хлоропластах, розташований в цитоплазмі клітин кукурудзи, на відміну від контрольних флуоресціюючих білків GFP, які не транслокувалися в хлоропласти цитоплазми клітин кукурудзи (фіг. 6). Ці результати візуалізації за допомогою мікроскопії показують, що транслокація білка GFP в хлоропласт була зумовлена синтетичним транзитним пептидом хлоропластів TraP23. Приклад 3. Послідовності синтетичного транзитного пептиду хлоропластів (TraP) для експресії агрономічно важливих трансгенів в Arabidopsis Мутація єдиної амінокислоти (G96A) в ферменті 5-енолпірувілшикімат-3-фосфатсинтазі (EPSP-синтаза) Escherichia coli може викликати відсутність чутливості до гліфосату (Padgette et al. (1991); Eschenburg et al. (2002); Priestman et al. (2005); Haghani et al. (2008)). Ця мутація надає толерантність до гліфосату, разом з тим також відомо, що вона негативно впливає на зв’язування EPSP-синтази з його природним субстратом фосфоенолпіруватом (РЕР). Внаслідок змін в ефективності зв’язування субстрату мутантний фермент може виявитися непридатним для досягнення in planta толерантності до гліфосату. У базі даних NCBI GenBank проводили скринінг in silico на білок EPSP-синтази і полінуклеотидні послідовності, які в природі в ферменті EPSP-синтазі містять аланін в аналогічному положенні, як і мутація G96A, яка була вставлена в фермент версії Escherichia coli (Padgette et al. (191); Eschenburg et al. (2002); Priestman et al. (2005); Haghani et al. (2008)). Був ідентифікований один фермент, який в природі містив аланін в цьому положенні, що являє собою DGT-28 (GENBANK ACC NO: ZP_06917240.1) в Streptomyces sviceus ATCC29083. Подальший глибокий аналіз даних in silico виявив три інших унікальних ферменти Streptomyces з більш високим ступенем гомології до DGT-28: DGT-31 (GENBANK ACC NO: YP_004922608.1), DGT-32 (GENBANK ACC NO: ZP 04696613) і DGT-33 (GENBANK ACC NO: NC_010572). Кожний з цих ферментів містить природний аланін в аналогічному положенні в ферменті EPSP-синтазі, як і мутація G96A, яка була вставлена в фермент версії Е. coli. Оскільки білки EPSP-синтази з різних організмів мають різну довжину, нумерація мутації для версії E.coli ферменту EPSP-синтази не обов'язково відповідають нумерації мутації для ферментів EPSP-синтаз з інших організмів. Ці ідентифіковані ферменти EPSP-синтази раніше не були описані відносно властивостей толерантності до гліфосату або афінності РЕРсубстрату. Крім того, ці ферменти EPSPS-синтази являють собою новий клас ферментів EPSPсинтази і не містять яких-небудь мотивів послідовностей, які були використані для опису вищезазначених ферментів EPSP-синтази класу I (послідовності рослинного походження, додатково описані в патенті США № RE39247), класу II (одержані з бактерій послідовності, додатково описані в патенті США № RE39247) і класу III (одержані з бактерій послідовності, додатково описані в міжнародній патентній заявці WO 2006/110586). Характеристики нових ферментів DGT-28, DGT-31, DGT-32 і DGT-33 були описані відносно толерантності до гліфосату і афінності РЕР-субстрату в порівнянні з ферментами EPSPсинтазами класу I. Для порівняння взяли наступні ферменти класу I: DGT-1 з Glycine max, DGT3 з Brassica napus (GENBANK ACC NO: PI 7688) і DGT-7 від Triticum aestivum (GENBAN ACC NO: EU977181). Були синтезовані і досліджені ферменти EPSP-синтази класу I і мутантні варіанти. Мутація, вставлена в рослинні ферменти EPSP-синтази, складалася з мутації від гліцину до 23 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 аланіну, яку вводили в таке ж місцерозташування в ферменті EPSP-синтазі, як і мутацію G96A в ферменті версії Е.coli. Додатково, в ці ферменти EPSPS-синтази класу I були введені мутації від треоніну до ізолейцину і від проліну до серину в положеннях, аналогічних положенням амінокислоти 97 (Т до I) і амінокислоти 101 (Р до S) в EPSP-синтазі з Е.coli, як описано авторами Funke et al. (2009). DGT-28, DGT-31, DGT-32 і DGT-33 Нещодавно створена полінуклеотидна послідовність дводольних рослин, оптимізована dgt28 v5, показана в SEQ ID NO: 14. Нещодавно створена полінуклеотидна послідовність дводольних рослин, оптимізована dgt-28 v6, показана в SEQ ID NO: 15, ця послідовність була трохи модифікована шляхом включення аланіну в положенні другої амінокислоти, для вставки сайта рестрикції ферменту. Одержані послідовності ДНК мають більш високий ступінь різноманітності кодонів, бажаний склад основ, містять стратегічно розташовані сайти розпізнавання ферментів рестрикції і не містять послідовностей, які можуть перешкоджати транскрипції гена або трансляції продукту мРНК. Синтез фрагментів ДНК, які містять SEQ ID NO: 14 і SEQ ID NO: 15, що несуть додаткові послідовності, такі як 6-рамкові стоп-кодони (стоп-кодони, розташовані у всіх шести рамках зчитування, які додаються на 3'-кінці кодуючої послідовності), і 5'-сайт рестрикції для клонування, був проведений комерційними постачальниками (DNA2.0, Menlo Park, CA). Потім молекули синтетичної нуклеїнової кислоти клонували у вектори експресії і трансформували в рослини або бактерії, як описано в наведених нижче прикладах. Подібні стратегії оптимізації кодонів були використані для розробки dgt-1, dgt-3 v2 (G173A), dgt-3 v3 (G173A; P178S), dgt-3 v4 (T174I; P178S), dgt-7 v4 (T168I; P172S), dgt-32 v3, dgt-33 v3 і dgt-31 v3. Кодон-оптимізовані версії цих генів перераховані як SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22 і SEQ ID NO: 23, відповідно. Конструювання бінарного вектора рослин Застосовували стандартні способи клонування при конструюванні вихідних векторів, що містять полінуклеотидну послідовність транзитного пептиду хлоропластів, сполучену з dgt-28 у вигляді лігування із збереженням рамки зчитування. Вихідні вектори, що містять транзитний пептид (TraP), злитий з dgt-28, були зібрані з використанням технології INFUSION™ Advantage Technology (Clontech, Mountain View, CA). Внаслідок злиття з dgt-28 була видалена перша амінокислота метіонін. Кожна з полінуклеотидних послідовностей, що кодують транзитний пептид: TraP4 v2 (SEQ ID NO: 24), TraP5 v2 (SEQ ID NO: 25), TraP8 v2 (SEQ ID NO: 26), TraP9 v2 (SEQ ID NO: 27), TraP12 v2 (SEQ ID NO: 28) і TraP13 v2 (SEQ ID NO: 29), була синтезована за допомогою DNA2.0 (Menlo Park, CA) і злита з 5'-кінцем фрагмента dgt-28, до унікального сайта AccI розпізнавання рестрикції ендонуклеази і включаючи в себе цей сайт. Бінарні плазміди, які містили різні касети експресії TraP і dgt-28, запускалися промотором убіквітин 10 з Arabidopsis thaliana (AtUbi10 v2; Callis et al. (1990), J. Biol. Chem. 265:12486-12493) і фланкувалися 3'-нетрансльованою областю двадцять третьої відкритої рамки зчитування Agrobacterium tumefaciens (AtuORF23 3'UTR v1, патент США № 5428147). Зібрані касети експресії TraP і dgt-28 були сконструйовані з використанням технології GATEWAY® Technology (Invitrogen, Carlsbad, CA) і трансформовані в рослини за допомогою опосередковуваної Agrobacterium трансформації рослин. Ендонуклеази рестрикції були одержані з лабораторії New England Biolabs (NEB; Ipswich, MA), і для лігування ДНК використовували Т4 ДНК-лігази (Invitrogen). Вхідні реакції проводили з використанням суміші ферментів GATEWAY® LR Clonase® (Invitrogen) для збирання одного вихідного вектора у векторі єдиного призначення, який містив промотор вірусу мозаїки маніоки Cassava Vein касети селектованих маркерів (CsVMV v2; Verdaguer et al. (1996), Plant. Mol. Biol. 31:1129-1139) - DSM-2 (патентна заявка США № 2007/086813) - першу 3'-нетрансльовану область відкритої рамки зчитування Agrobacterium tumefaciens (AtuORF1 3'UTR V6; Huang et al. (1990), J. Bacteriol. 172:1814-1822). Плазмідні препарати були приготовані за допомогою набору NucleoSpin® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) або набору Plasmid Midi (Qiagen), згідно з інструкціями виробників. Фрагменти ДНК виділяли з використанням набору QIAquick Gel Extraction™ Kit (Qiagen) після електрофорезу в агарозному Тріс-ацетатному гелі. Проводили вихідний скринінг колоній всіх зібраних плазмід за допомогою рестрикційного розщеплення мініпрепаративної ДНК. Плазмідну ДНК з відібраних клонів секвенували за допомогою комерційного обладнання для секвенування (Eurofins™ MWG Operon, Huntsville, AL). Дані про послідовності збирали і аналізували за допомогою програмного забезпечення SEQUENCHER™ (Gene Codes Corp., Ann Arbor, MI). 24 UA 115546 C2 5 10 15 20 25 30 35 Вказані нижче бінарні конструкції експресують різноманітні послідовності генів злиття TraP:dgt-28: pDAB107527 містить TraP4 v2:dgt-28 v5 (SEQ ID NO: 30), pDAB105530 містить TraP5 v2:dgt-28 v5 (SEQ ID NO: 31), pDAB105531 містить TraP8 v2:dgt-28 v5 (SEQ ID NO: 32), PDAB 105532 містить TraP9 v2:dgt-28 v5 (SEQ ID NO: 33), pDAB105533 містить TraP12 v2:dgt-28 v5 (SEQ ID NO: 34) і pDAB105534 містить TraP13 v2:dgt-28 v5 (SEQ ID NO: 35). Послідовність dgt-28 v5 з pDAB105534 була модифікована, при цьому перший кодон (GCA) змінювався на (GCT). Конструювання додаткового бінарного вектора рослин Застосовували стратегії клонування, аналогічні описаним вище, для конструювання бінарних плазмід, які містять dgt-31, dgt-32, dgt-33, dgt-1, dgt-3 і dgt-7. Одержані з мікроорганізмів гени dgt-31, dgt-32 і dgt-33 зливали з різними транзитними пептидами хлоропластів, як описано вище. Були використані наступні транзитні пептиди хлоропластів: TraP14 v2 (SEQ ID NO: 36), TraP23 v2 (SEQ ID NO: 37), TraP24 v2 (SEQ ID NO: 38). pDAB107532 містить dgt-32 v3, злитий з TraP14 v2 (SEQ ID NO: 39), pDAB107534 містить dgt-33 v3, злитий з TraP24 v2 (SEQ ID NO: 40), і pDAB 107533 містить dgt-31 v3, злитий з TraP23 v2 (SEQ ID NO: 41). Касети експресії dgt запускалися за допомогою промотору убіквітину 10 з Arabidopsis thaliana (AtUbi10 промотор v2) і фланкувалися 3'-нетрансльованою областю двадцять третьої відкритої рамки зчитування Agrobacterium tumefaciens (AtuORF23 3'UTR v1). У бінарному векторі також була присутня касета селектованих маркерів DSM-2, що містить промотор вірусу мозаїки маніоки Cassava Vein Mosaic Virus (CsVMV v2) - DSM-2 - першу 3'нетрансльовану область відкритої рамки зчитування Agrobacterium tumefaciens (AtuORFl 3'UTR v6). Створювали додаткові бінарні конструкції, в яких dgt-31 v3, dgt-32 v3 і dgt-33 v3 були злиті з раніше описаними послідовностями транзитного пептиду хлоропластів. Наприклад, послідовність v2 TraP8 була злита з dgt-31 v3, dgt-32 v3 і dgt-33 v3 і клонована в бінарні вектори, як описано вище. Були сконструйовані бінарні вектори, що містять гени класу I (dgt-1, dgt-3 і dgt-7). Були сконструйовані і трансформовані в рослинах наступні бінарні вектори: pDAB4104, що містить послідовність dgt-1 v4, описану в опублікованій патентній заявці США № 2011/0124503, який фланкований послідовностями Nicotiana tabacum Osmotin, згідно з описом в опублікованій патентній заявці США № 2009/0064376; pDAB102715, pDAB102716, pDAB102717 і pDAB102785. До генів класу I не належать різні транзитні пептиди хлоропластів TraP, які були злиті з dgt-28, dgt-31, dgt-32 і dgt-33, оскільки ці послідовності рослинного походження мають нативні рослинні транзитні пептиди хлоропластів. Більш докладний опис згаданих векторів наведений в таблиці 1. Таблиця 1 Опис бінарних векторів, які містять ген EPSPS-синтази класу I (тобто dgt-1, dgt-3 або dgt-7) Найменування pDAB4104 pDAB102715 pDAB102716 pDAB102717 pDAB102785 40 Опис RB7 MAR v2:CsVMV промотор v2/NtOsm 5'UTR v2/dgt-1 v4/NtOsm 3'UTR v2/AtuORF24 3'UTR v2:AtUbi10 промотор v4/pat v3/AtuORF1 3'UTR v3 бінарний вектор AtUbi10 промотор v2/dgt-3 v2/AtuORF23 3'UTR v1:CsVMV промотор v2/pat v9/AtuORF1 3'UTR v6 бінарний вектор AtUbi10 промотор v2/dgt-3 v3/AtuORF23 3'UTR v1:CsVMV промотор v2/pat v9/AtuORF1 3′UTR v6 бінарний вектор AtUbi10 промотор v2/dgt-3 v4/AtuORF23 3'UTR v1:CsVMV промотор v2/pat v9/AtuORF1 3'UTR v6 бінарний вектор AtUbi10 промотор v2/dgt-7 v4/AtuORF23 3'UTR:CsVMV промотор v2/DSM-2 v2/AtuORF1 3'UTR v6 бінарний вектор EPSPSмутація TI PS GA GA PS TI PS TI PS Трансформація Arabidopsis thaliana Трансформацію Arabidopsis проводили з використанням способу занурення квіткових бруньок (Clough and Bent, 1998). Вибрану колонію Agrobacterium, що містить одну з описаних вище бінарних плазмід, використовували для інокуляції однієї або декількох прекультур YEP бульйону в об'ємі 100 мл, що містить спектиноміцин (100 мг/л) і канаміцин (50 мг/л). Культуру інкубували протягом ночі при 28 °C при постійному перемішуванні при 225 обертах на хвилину. 25 UA 115546 C2 5 10 15 20 25 30 35 40 45 50 55 60 Клітини преципітували приблизно при 5000×g протягом 10 хвилин при кімнатній температурі, і видаляли одержаний супернатант. Клітинний осад акуратно ресуспендували в 400 мл змочувальному середовищі, що містить: 5% (ваг./об'єм) сахарози, 10 мкг/л 6-бензиламінопурину і 0,04% Silwet™ L-77. Рослини у віці приблизно 1 місяця занурювали в середовище на 5-10 хвилин з акуратним струшуванням. Рослини укладали набік і накривали прозорими або непрозорими пластиковими пакетами на 2-3 години, а потім приводили їх у вертикальне положення. Рослини вирощували при 22 °C, з фотоперіодом 16 годин освітлення/8 годин темряви. Приблизно через 4 тижні після занурення збирали насіння. Селекція трансформованих рослин Свіжозібране насіння T1 [що містить касети експресії dgt і DSM-2] залишали для висихання протягом 7 днів при кімнатній температурі. Насіння T 1 висівали в лотки для пророщування розміром 26,5×51 см, при цьому в кожний лоток вносили аліквотну кількість 200 мг стратифікованого насіння T 1 (приблизно 10000 насінин), яке попередньо суспендували в 40 мл 0,1% розчину агарози і зберігали при 4 °C протягом 2 днів, щоб забезпечити необхідний спокій і синхронне проростання насіння. Суміш Sunshine Mix LP5 покривали дрібним вермикулітом і злегка зрошували розчином Хогланда до зволоження, потім дозволяли рідині стекти самопливом. Кожну аліквоту стратифікованого насіння об'ємом 40 мл рівномірно висівали на вермикуліт за допомогою піпетки і накривали куполами для підтримання вологості протягом 4-5 днів. Куполи видаляли за 1 день до початку селекції трансформантів, яку здійснювали шляхом післясходового розпилення глюфосинату (селекція на котрансформований ген DSM-2). На сьомий день після посіву (ПП) і повторно на 11 день ПП рослини T 1 (сім’ядолі і стадії 2-4 листів, відповідно) обприскували 0,2% розчином гербіциду Liberty (глюфосинат 200 г активного інгредієнта (а.і.)/л, Bayer Crop Sciences, Kansas City, MO) з об'ємом розпилення 10 мл/на лоток (703 л/га), використовуючи пневматичний розпилювальний наконечник DeVilbiss для доставки ефективної кількості 280 г.к.е./га глюфосинату при кожному застосуванні. Рослини, що вижили (активно зростаючі рослини), визначали на 4-7 день після останнього розпилення і пересаджували в окремі 3-дюймові горщики (7,6 см) з підготовленим горщиковим субстратом (Metro Mix 360). Пересаджені рослини вирощували в теплиці (при температурі 22±5 °C, 2 1 відносній вологості 50±30%, 14 годин освітлення:10 годин темряви, мінімальне мкЕ/м с природного + додаткового освітлення). Рослини Т 1, що вижили, піддавали молекулярному підтверджуючому аналізу для верифікації факту стабільної інтеграції в геном цих рослин гена толерантності до гліфосату. Молекулярне підтвердження Була підтверджена присутність трансгенів dgt-28 і DSM-2 в геномі рослин Arabidopsis, які були трансформовані pDAB107527, pDAB105530, pDAB105531, pDAB105532, pDAB105533 або pDAB105534. Присутність цих полінуклеотидних послідовностей підтверджували за допомогою аналізів гідролізу зонда, ПЛР касети експресії генів (також званої ПЛР одиниці транскрипції рослини - PTU ПЛР), саузерн-блотингу і кількісної ПЛР зі зворотною транскрипцією. Проводили вихідний скринінг рослин Arabidopsis Т 1 за допомогою аналізу гідролізу зонда, аналогічного TaqMan™, для підтвердження присутності трансгенів dgt-28 і DSM-2. Об'єкти піддавали скринінгу за допомогою ПЛР касети генної експресії, щоб визначити, чи є касета експресії dgt повністю інтегрованою в геном рослин без перестановок. Одержані в цих дослідженнях дані використовували для визначення числа копій трансгена і ідентифікації селектованих об'єктів Arabidopsis для самозапилення і розвитку до покоління Т 2. Рослини T2 Arabidopsis, що розвиваються, також скринували за допомогою аналізів гідролізу зонда, щоб підтвердити наявність і оцінити кількість копій генів DSM-2 і dgt-28 в хромосомі рослини. Нарешті, використовували аналіз саузерн-блотинг для підтвердження розрахункової кількості копій у підгрупи рослин T1 Arabidopsis. Аналогічні аналізи використовували для підтвердження присутності трансгена dgt-1 з рослин, трансформованих pDAB4104, присутності трансгена dgt-32 з рослин, трансформованих pDAB107532, присутності трансгена dgt-33 з рослин, трансформованих pDAB107534, присутності трансгена dgt-31 з рослин, трансформованих pDAB107533, присутності трансгена dgt-3 з рослин, трансформованих pDAB102715, присутності трансгена dgt-3 з рослин, трансформованих pDAB102716, присутності трансгена dgt-3 з рослин, трансформованих pDAB102717, і присутності трансгена dgt-7 з рослин, трансформованих pDAB102785. Аналіз гідролізу зондів У рослин T1 і Т2 Arabidopsis визначали кількість копій з використанням аналізу гідролізу зондів, описаного нижче. Були виявлені рослини з варіабельною кількістю трансгенів, які вирощували для подальших досліджень толерантності до гліфосату. 26 UA 115546 C2 5 10 15 20 Зразки тканини збирали в 96-ямкові планшети і ліофілізували протягом 2 днів. Мацерацію тканини проводили за допомогою тканинного розпилювача KLECKO™ і вольфрамових кульок (Environ Metal INC., Sweet Home, Oregon). Після мацерації тканини виділяли геномну ДНК в форматі високої пропускної здатності за допомогою набору Biosprint™ 96 Plant (Qiagen™, Germantown, MD), відповідно до протоколу, запропонованого виробником. Геномну ДНК кількісно визначали з використанням набору для аналізу ДНК QUANT-IT™ PICO GREEN (Molecular Probes, Invitrogen, Carlsbad, CA). Підраховану геномну ДНК доводили приблизно до 2 нг/мл для аналізу гідролізу зондів з використанням автоматизованого рідинного маніпулятора BIOROBOT3000™ (Qiagen, Germantown, MD). Визначення кількості копій трансгенів шляхом аналізу гідролізу зондів проводили за допомогою ПЛР в реальному часі за допомогою системи LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Аналізи були розроблені для DSM2, dgt-28 і внутрішнього референс-гена TAFII15 (GenBank ID: NC 003075; Duarte et al. (2010), BMC Evol. Biol. 10:61) Для ампліфікації готували зонди LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) в кінцевій концентрації 1× в 10 мкл об'єму мультиплексної реакційної суміші, що містить 0,1 мкМ кожного праймера для DSM-2 і dgt-28, 0,4 мкМ кожного праймера для TAFII15 і 0,2 мкМ кожного зонда. Таблиця 2. Двоетапну реакцію ампліфікації проводили з подовженням при 60 °C протягом 40 секунд з одержанням флуоресценції. Були перевірені всі зразки і використовувалися середні значення порогового циклу (Ct) для аналізу кожного зразка. Аналіз даних ПЛР в реальному часі проводили з використанням програмного забезпечення LightCycler™, версія 1,5, за допомогою відносного кількісного модуля і на основі способу ΔΔCt. Для цього аналізу в кожний цикл були включені зразок геномної ДНК з малокопійного калібратора і перевірка 2 відомих копій. Результати по кількості копій в аналізі гідролізу зондів були визначені для трансгенних рослин T1 і Т2 Arabidopsis. 25 Таблиця 2 Дані по праймерах і зондах для аналізу гідролізу зондів DSM-2, dgt-28 і внутрішнього референсгена (TAFII15) Найменування зонда DSM2A (SEQ ID NO: 42) DSM2S (SEQ ID NO: 43) Зонд DSM2 Cy5 (SEQ ID NO: 44) DGT28F (SEQ ID NO: 45) DGT28R (SEQ ID NO: 46) Зонд UPL154 Зонд TAFFY-HEX (SEQ ID NO: 47) TAFII15-F (SEQ ID NO: 48) TAFII15-R (SEQ ID NO: 49) 30 35 40 Послідовність 5'-AGCCACATCCCAGTAACGA-3' 5'-CCTCCCTCTTTGACGCC-3' 5'-CAGCCCAATGAGGCATCAGC-3' 5'-CTTCAAGGAGATTTGGGATTTGT-3' 5'-GAGGGTCGGCATCGTAT-3' Cat# 04694406001 (Roche, Indianapolis, IN) 5'-AGAGAAGTTTCGACGGATTTCGGGC-3' 5'-GAGGATTAGGGTTTCAACGGAG-3' 5'-GAGAATTGAGCTGAGACGAGG-3' Підтвердження інтеграції dgt-28 в аналізі саузерн-блотинг Застосовували саузерн-блотинг для встановлення інтегрованості структури вставленого фрагмента Т-ланцюга ДНК і ідентифікації об'єктів, які містили dgt-28. Одержані дані повинні були показати інтеграцію і цілісність трансгенних вставок в геномі Arabidopsis. Дані саузернблотингу використовували для визначення простої інтеграції інтактної копії Т-ланцюга ДНК. Деталізований саузерн-блот-аналіз проводили з використанням ПЛР-ампліфікованого зонда, специфічного для касети експресії генів dgt-28. При гібридизації зонда з геномною ДНК, яку до цього розщеплювали за допомогою специфічних ферментів рестрикції, були виявлені ферменти геномної ДНК з конкретними значеннями молекулярної маси, структури яких були використані для ідентифікації повнорозмірних, простих вставлених трансгенних об'єктів T1 для подальшого розвитку наступного покоління. Зразки тканини збирали в 2 мл конічні пробірки (Еппендорф™) і ліофілізували протягом 2 днів. Мацерацію тканини проводили за допомогою тканинного розпилювача KLECKO™ і вольфрамових кульок. Після мацерації тканин виділяли геномну ДНК з використанням методики виділення СТАВ. Геномну ДНК додатково очищали з використанням набору Qiagen Genomic™ Tips. Кількісне визначення геномної ДНК проводили за допомогою набору для аналізу ДНК Quant-IT™ Pico Green (Molecular Probes, Invitrogen, Carlsbad, CA). Підраховану геномну ДНК доводили до 4 мкг для відповідності концентрації. 27 UA 115546 C2 5 10 15 20 25 30 Для кожного зразка проводили повне розщеплення 4 мкг геномної ДНК за допомогою рестриктази Swal (New England Biolabs, Beverley, MA) і інкубували при 25 °C протягом ночі, потім до реакційної суміші додавали NsiІ і інкубували при 37 °C протягом 6 годин. Розщеплену ДНК концентрували шляхом преципітації з розчином для преципітації Quick Precipitation Solution™ (Edge Biosystems, Gaithersburg, MD), відповідно до протоколу, запропонованого виробником. Після цього геномну ДНК ресуспендували в 25 мкл води при 65 °C протягом 1 години. Ресуспендовані зразки занурювали в 0,8% агарозний гель, приготований в 1× TAE, і піддавали електрофорезу протягом ночі при 1,1 В/см в буфері 1× ТАЕ. Гель послідовно піддавали денатурації (0,2М NaOH/0,6М NaCl) протягом 30 хвилин і нейтралізації (0,5М Тріс-HCl (рН 7,5)/1,5М NaCl) протягом 30 хвилин. Перенесення ферментів ДНК на нейлонові мембрани проводили шляхом пасивного капілярного поширення 20× SSC розчину протягом ночі через гель на оброблену Immobilon™ NY+ мембрану для перенесення (Millipore, Billerica, MA) з використанням хроматографічного капілярного паперу і паперових рушників. Після перенесення мембрану короткочасно промивали розчином 2× SSC з приєднаним Stratalinker™ 1800 (Stratagene, LaJolla, CA) і нагрівали у вакуумі при 80 °C протягом 3 годин. Блоти інкубували з розчином для передгібридизації (Perfect Hyb plus, Sigma, St. Louis, MO) протягом 1 години при 65 °C в скляних ролер-флаконах з використанням гібридизаційного інкубатора моделі 400 (Robbins Scientific, Sunnyvale, CA). Зонди одержували з ПЛР-фрагмента, що містить повну кодуючу послідовність. Амплікон ПЛР очищали за допомогою набору для 32 екстракції гелю QIAEX II™і мітили з α P-dCTP за допомогою набору випадкових міток Random RT Prime IT™ (Stratagene, La Jolla, CA). Блоти гібридизували протягом ночі при 65 °C з денатурованим зондом, доданим безпосередньо в буфер для гібридизації, приблизно до 2000000 імпульсів на блот на мл. Після гібридизації блоти послідовно промивали розчином 0,1× SSC/0,1% SDS протягом 40 хвилин при 65 °C. В кінці на блоти впливали фосфором з тривалим післясвітінням з проеціюванням зображень і візуалізували з використанням системи візуалізації Molecular Dynamics Storm 860™. Проведені в цьому дослідженні саузерн-блот-аналізи були використані для визначення кількості копій і підтвердження, що вибрані об'єкти містили трансген dgt-28 в геномі Arabidopsis. Підтвердження касети генної експресії dgt-28 за допомогою ПЛР-аналізу Виявлення присутності касети генної експресії dgt-28, що міститься в об'єктах рослин T 1, проводили за допомогою кінцевої реакції ПЛР. Для виявлення використовували праймери (Таблиця 3), специфічні для промотору AtUbi10 v2 і AtuORF23 3'UTR v1 ділянок в касеті генної експресії dgt-28. 35 Таблиця 3 Олігонуклеотидні праймери, використовувані для підтвердження касети генної експресії dgt-28 Найменування праймера прямий оліго (SEQ ID NO: 50) зворотний оліго (SEQ ID NO: 51) 40 45 50 Послідовність 5'-CTGCAGGTCAACGGATCAGGATAT-3' 5'-TGGGCTGAATTGAAGACATGCTCC-3' Для реакцій ПЛР був необхідний стандартний триетапний протокол ПЛР для ампліфікації касети експресії генів. Всі реакції ПЛР проводили з використанням наступних умов ПЛР: 94 °C протягом трьох хвилин з подальшими 35 циклами при 94 °C протягом тридцяти секунд, 60 °C протягом тридцяти секунд і 72 °C протягом трьох хвилин. Реакції завершували з використанням набору для ПЛР EX-TAQ™ (TaKaRa Biotechnology Inc. Otsu, Shiga, Японія), відповідно до інструкцій виготовлювача. Після завершального циклу реакційну суміш інкубували при 72 °C протягом 10 хвилин. Використовували агарозний гель ТАЕ для визначення розміру амплікону ПЛР. Амплікони ПЛР очікуваного розміру вказували на присутність повнорозмірної касети генної експресії в геномі трансгенних об'єктів Arabidopsis. Підтвердження відносної транскрипції dgt-28 за допомогою кількісного аналізу ПЛР зі зворотною транскрипцією Зразки тканин рослин з трансгенним dgt-28 збирали в 96-ямкові планшети і заморожували при 80 °C. Мацерацію тканини проводили за допомогою тканинного розпилювача KLECO™ і вольфрамових кульок (Environ Metal INC., Sweet Home, Oregon). Після мацерації тканини виділяли геномну ДНК в форматі високої пропускної здатності за допомогою набору Qiagen™ Rneasy 96 (Qiagen™, Germantown, MD), відповідно до протоколу, запропонованого виробником, який включав в себе додаткову обробку Dnasel на колонці. Після цього етапу проводили 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthetic chloroplast transit peptides
Автори англійськоюLira, Justin M., Cicchillo, Robert M., Yerkes, Carla, Robinson, Andrew E.
Автори російськоюЛира Джастин М., Чиккилло Роберт М., Йеркс Карла, Робинсон Эндрю Э.
МПК / Мітки
МПК: C12N 15/62, A01H 5/00, C12N 15/82, C12N 15/63, C12N 15/29
Мітки: пептид, хлоропластів, одержання, спосіб, транзитній, синтетичний
Код посилання
<a href="https://ua.patents.su/109-115546-sintetichnijj-tranzitnijj-peptid-khloroplastiv-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Синтетичний транзитний пептид хлоропластів та спосіб його одержання</a>
Попередній патент: Транзитний пептид хлоропластів та спосіб його одержання
Наступний патент: Синтетичний транзитний пептид хлоропластів, що походить з brassica, та спосіб його одержання
Випадковий патент: Горілка особлива "волинська казка (волынская сказка)"