Лікарський засіб у формі розчину для ін’єкцій, що містить морфоліній [(5-метил-1н-1,2,4-триазол-3-іл)тіо)]ацетат
Номер патенту: 109708
Опубліковано: 25.08.2016
Автори: Сапсай Ірина Віталіївна, Шалата Володимир Ярославович, Юрченко Леся Іванівна, Кувайсков Юрій Геннадійович, Смалюх Оксана Григорівна, Кравчук Жанна Миколаївна
Формула / Реферат
1. Лікарський засіб у формі розчину для ін'єкцій, що проявляє протиішемічні та гепатопротекторні властивості, містить морфолінієву сіль тіазотної кислоти та воду для ін'єкцій, який відрізняється тим, що вміст морфолінієвої солі тіазотної кислоти в розчині складає 40,0-60,0 мг/мл.
2. Лікарський засіб за п. 1, який відрізняється тим, що вміст морфолінієвої солі тіазотної кислоти в розчині складає 50,0 мг/мл.
Текст
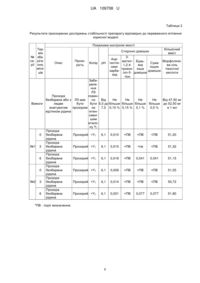
Реферат: Лікарський засіб у формі розчину для ін'єкцій, що проявляє протиішемічні та гепатопротекторні властивості, містить морфолінієву сіль тіазотної кислоти та воду для ін'єкцій. Вміст морфолінієвої солі тіазотної кислоти в розчині складає 40,0-60,0 мг/мл. UA 109708 U (12) UA 109708 U UA 109708 U 5 Корисна модель належить до медицини та фармацевтичної промисловості, зокрема до лікарських засобів, що містять як активний інгредієнту морфолінію [(5-метил-1Н-1,2,4-триазол-3іл)тіо)]ацетат (морфолінієву сіль тіазотної кислоти) та можуть бути використані як протиішемічні та гепатопротекторні засоби. Активний інгредієнт морфолінію [(5-метил-1Н-1,2,4-триазол-3-іл)тіо)]ацетат (морфолінієва сіль тіазотної кислоти, морфолінію тіазотат) є похідним 1,2,4-триазолів та має наступну формулу: H N + H2N O H3C N N S COO 10 15 20 25 30 35 40 45 50 55 Способи отримання морфолінієвої солі тіазотної кислоти описані в патентах України UA 57476, UA 100355 та UA 102809 [1-3]. Морфолінієва сіль тіазотної кислоти є представником групи засобів, що впливають на серцево-судинну систему. Фармакологічний ефект морфолінієвої солі тіазотної кислоти зумовлений протиішемічною, мембраностабілізуючою, антиоксидантною та імуностимулюючою дією [4, 5]. Вплив препарату реалізується за рахунок посилення компенсаторної активації анаеробного гліколізу і активації процесів окислення в циклі Кребса зі збереженням резервів АТФ [5]. Наявність в структурі молекули морфолінієвої солі тіазотної кислоти тіольної групи, якій притаманні окислювально-відновні властивості, та третинного азоту, який зв'язує надлишок іонів водню, зумовлює активацію антиоксидантної системи. Сильні відновлювальні властивості тіольної групи викликають реакцію з активними формами кисню та ліпідними радикалами. Реактивація антирадикальних ферментів супероксиддисмутази, каталази та глутатіонпероксидази - запобігає ініціації активних форм кисню [6]. Дія морфолінієвої солі тіазотної кислоти викликає гальмування процесів окиснення ліпідів в ішемізованих ділянках міокарда, зменшення чутливості міокарда до катехоламінів, стабілізацію та зменшення відповідно зон некрозу та ішемії міокарда, запобігає прогресивному пригніченню скоротливої функції серця. Поліпшення реологічних властивостей крові відбувається за рахунок активації фібринолітичної системи. Поліпшення процесів метаболізму міокарда, підвищення його скоротливої здатності, сприяння нормалізації серцевого ритму дозволяють рекомендувати препарати морфолінієвої солі тіазотної кислоти для лікування пацієнтів з різноманітними формами ішемічної хвороби серця [4-7]. Паралельно з використанням препарату в кардіології, через високі гепатопротекторні властивості морфолінієву сіль тіазотної кислоти призначають для лікування захворювань печінки та інших внутрішніх органів. Препарат запобігає руйнуванню гепатоцитів, знижує ступінь жирової інфільтрації та поширення центролобулярних некрозів печінки, сприяє процесам репаративної регенерації гепатоцитів, нормалізує в них білковий, вуглеводневий, ліпідний та пігментний обміни. Збільшує швидкість синтезу та виділення жовчі, нормалізує її хімічний склад [4-6, 8]. Лікарські засоби, що містять морфолінієву сіль тіазотної кислоти як активний фармацевтичний інгредієнт, випускаються у формі розчину для ін'єкцій, у формі таблеток негайного вивільнення, очних крапель та мазей. Особливістю препарату є необхідність чергування різних лікарських форм в процесі терапії. Це пов'язано з тим, що важкі стани (гострий інфаркт міокарда, цироз печінки тощо) протягом перших днів терапії потребують ін'єкційного введення лікарських засобів, а протягом процесу реабілітації зручнішим є прийом препаратів в оральних формах (наприклад, у вигляді таблеток). Використання ступінчастої терапії дозволяє отримати швидкий позитивний зсув метаболічних процесів за рахунок парентерального введення та продовжити їх нормалізацію та стабілізацію при подальшому оральному прийомі лікарського засобу [9]. За найближчий аналог запропонованої корисної моделі прийнятий лікарський засіб ® Тіотриазолін , розчин для ін'єкцій, 25 мг/мл по 2 мл в ампулах № 10 (10×1) в контурних чарункових упаковках; по 4 мл в ампулах № 10 (5×2) в контурних чарункових упаковках, виробництва ПАТ "Галичфарм", Україна [Реєстраційне посвідчення UА/2931/01/02, з 18.02.2015 по 18.02.2020; Наказ МОЗ №76 від 18.02.2015]. 1 мл розчину Тіотриазоліну® містить морфолінієвої солі тіазотної кислоти у перерахуванні на 100 % речовину 25 мг, що еквівалентно 16,6 мг тіазотної кислоти, та воду для ін'єкцій. 1 UA 109708 U 5 10 15 20 25 30 35 40 45 50 55 Відповідно до інструкції для медичного застосування при інфаркті міокарда і нестабільній стенокардії препарат вводять внутрішньовенно повільно по 4 мл 25 мг/мл розчину (100 мг) зі швидкістю 2 мл/хв або внутрішньовенно краплинно зі швидкістю 20-30 крапель на хвилину (4 мл розчину 25 мг/мл розводять у 150-250 мл 0,9 % розчину натрію хлориду) або вводять внутрішньом'язово по 4 мл 25 мг/мл розчину (100 мг) 2-3 рази на добу. При стенокардії напруження і спокою та постінфарктному кардіосклерозі препарат вводять внутрішньом'язово по 2 мл 25 мг/мл розчину 3 рази на добу. При хронічному гепатиті з вираженою активністю процесу препарат у перші дні вводять внутрішньом'язово по 2 мл 25 мг/мл розчину (по 50 мг) 23 рази на добу або внутрішньовенно повільно зі швидкістю 2 мл/хв по 4 мл 25 мг/мл розчину (100 мг) 1 раз на добу, або краплинно зі швидкістю 20-30 крапель на хвилину (2 ампули 25 мг/мл розчину розводять у 150-250 мл 0,9 % розчину натрію хлориду). При хронічному гепатиті мінімального та помірного ступенів активності, препарат вводять внутрішньом'язово, по 2 мл 25 мг/мл розчину 3 рази на добу. При цирозі печінки курс лікування починають з внутрішньом'язового введення 2 мл 25 мг/мл розчину (по 50 мг) 3 рази на добу. Далі лікування продовжують таблетками [4]. Недоліком цього лікарського засобу є низькі разова та добова дози діючої речовини морфолінію тіазотату (відповідно, 50-100 мг та 100-300 мг), що часто не дозволяє досягнути оптимального терапевтичного ефекту без збільшення частоти застосування препарату або об'єму разової дози, що створює труднощі та дискомфорт при введенні ін'єкційного препарату, особливо при внутрішньом'язовому введенні, оскільки за необхідності ввести разову дозу, більшу за 125 мг, при концентрації розчину 25 мг/мл доводиться робити дві ін'єкції. Оскільки при тяжких станах (інфаркт міокарда, цироз печінки) морфолінієва сіль тіазотної кислоти використовується в складі комплексної терапії, що включає ін'єкційне введення багатьох інших препаратів у великих сумарних об'ємах, недоцільно підвищувати добову дозу морфолінію тіазотату за рахунок збільшення кратності прийому чи об'єму препарату, що вводиться пацієнту. В основу корисної моделі поставлена задача створення нових препаратів морфолінієвої солі тіазотної кислоти у формі розчину для ін'єкцій, які забезпечували б більш виражений протиішемічний та гепатопротекторний ефекти за рахунок збільшення добової дози морфолінію тіазотату зі збереженням комплаєнтності існуючої лікарської форми (кратність прийому та об'єм разової дози не повинні збільшуватися), що може бути досягнуто за рахунок збільшення концентрації розчину морфолінієвої солі тіазотної кислоти. Поставлена задача вирішується шляхом збільшення концентрації активного фармацевтичного інгредієнту (морфолінієвої солі тіазотної кислоти) до 40-60 мг/мл. Збільшення концентрації діючої речовини часто призводить до появи місцевоподразнюючого ефекту та зменшення стабільності протягом терміну зберігання препарату і, як наслідок, може вимагати перегляду складу допоміжних речовин. Саме тому заявником були проведені дослідження, представлені нижче в Прикладах, в яких було виявлено, що розчин для ін'єкцій, що містить 50 мг/мл морфолінієвої солі тіазотної кислоти та воду для ін'єкцій, не має місцевоподразнюючих властивостей та є стабільним протягом всього терміну зберігання. На противагу, розчин для ін'єкцій, що містить 100 мг/мл морфолінієвої солі тіазотної кислоти та воду для ін'єкцій, у тій же дозі, мав помірно виражену місцевоподразнюючу дію при внутрішньом'язовому введенні, хоч і не викликав проявів системної токсичності. Тому, для збільшення добової дози морфолінію тіазотату зі збереженням кратності прийому та об'єму разової дози, оптимально збільшити концентрацію розчину морфолінієвої солі тіазотної кислоти до 40-60 мг/мл. Введення додаткових допоміжних речовин, окрім води для ін'єкцій, що виконує функції розчинника, не є доцільним. Корисна модель стосується лікарського засобу у формі розчину для ін'єкцій, що містить активний інгредієнт морфолінію [(5-метил-1Н-1,2,4-триазол-3-іл)тіо)]ацетат (морфолінієву сіль тіазотної кислоти) в концентрації 40-60 мг/мл та воду для ін'єкцій. Відповідно до переважного втілення корисної моделі, заявлений засіб містить морфолінієву сіль тіазотної кислоти в концентрації 50 мг/мл та воду для ін'єкцій. Технічний результат, який досягається при здійсненні корисної моделі, полягає у створенні лікарського засобу у формі розчину для ін'єкцій, що містить морфолінієву сіль тіазотної кислоти та забезпечує збільшення добової дози морфолінію тіазотату без збільшення кратності прийому та об'єму разової дози. Таким чином, забезпечується досягнення більш вираженого протиішемічного та гепатопротекторного ефекту зі збереженням комплаєнтності існуючої лікарської форми. Цей технічний результат забезпечується збільшенням концентрації морфолінієвої солі тіазотної кислоти до 40-60 мг/мл. Корисна модель проілюстрована Прикладами, наведеними нижче. 2 UA 109708 U 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 1: Спосіб отримання лікарського засобу у формі розчину для ін'єкцій відповідно до переважного втілення корисної моделі Корисна модель здійснюється наступним чином. При виготовленні розчину для ін'єкцій, що містить морфолінієву сіль тіазотної кислоти у концентрації 50 мг/мл, дотримуються наступних стадій: 1. Приготування розчину морфолінієвої солі тіазотної кислоти. 2. Ампулювання. 3. Стерилізація та перевірка ампул на герметичність. 4. Контроль ампул на механічні включення. 5. Маркування. Стадія 1. Приготування розчину морфолінієвої солі тіазотної кислоти. Зважують воду для ін'єкцій та морфолінієву сіль тіазотної кислоти. Розчин готують в реакторі. В реактор подають воду для ін'єкцій, охолоджують її пуском питної води в обгортку реактора до температури (20-25)°С, загружають морфолінієву сіль тіазотної кислоти та перемішують до повного розчинення, але не менше 15 хвилин. Визначають рН розчину, за необхідності проводять його корекцію 0,1 Μ розчином гідроксиду натрію. Розчин фільтрують через фільтр з фільтроелементом грубої фільтрації, з порогом затримання частинок 1 мкм (1,2 мкм), та тонкої фільтрації, з порогом затримання частинок 0,22 мкм. Стадія 2. Ампулювання. Ампулювання проводять на автоматичних лініях ампулювання, які виконують наступні операції: миття ампул шприцевим методом водою для ін'єкцій, стерилізацію та охолодження ампул, подачу ампул на машину наповнення та запайки. Стадія 3. Стерилізація та перевірка ампул на герметичність. Стерилізацію та перевірку ампул на герметичність проводять в стерилізаторі. Температура стерилізації розчину морфолінієвої солі тіазотної кислоти складає 121 °C, тривалість - 15 хвилин. Перевірку ампул на герметичність проводять розчином метиленового синього з концентрацією 0,0025 % або за допомогою краш-тесту. Стадія 4. Контроль ампул на механічні включення. Контроль ампул на механічні включення проводять візуально та на інспекційній машині. Стадія 5. Маркування. Ампули маркують. Приклад 2: Дослідження місцевоподразнюючої дії препарату відповідно до переважного втілення корисної моделі А. Вивчення місцевоподразнюючої дії препарату при внутрішньовенному введенні Для дослідження місцевоподразнюючої дії при внутрішньовенному введенні використовували самців нелінійних кролів масою 2500±500 г. Всім тваринам внутрішньовенно болюсно в крайову вену вуха справа вводили розчин морфолінієвої солі тіазотної кислоти, 50 мг/мл, в об'ємі 0,5 мл. Як негативний контроль в контралатеральну вену одночасно виконувалася внутрішньовенна ін'єкція 0,5 мл фізіологічного розчину (0,9 % розчин натрію хлориду). Після введення препарату протягом всього дослідження проводили щоденне спостереження за станом тварин. Оцінку реакції тканин на введення препарату проводили через 24 і 72 години після введення. Реакцію тканини в місці ін'єкції оцінювали візуально за допомогою лупи за трибальною шкалою. Встановлено, що через 24 та 72 години після введення розчину морфолінієвої солі тіазотної кислоти, 50 мг/мл, рухова та поведінкова активність, а також споживання корму та води тваринами не порушувались, шкіра та шерстяний покрив у місці введення, а також по ходу крайової вени, не змінювались, явища гіперемії, зміни забарвлення тканин, крововиливів, дегенерації тканин та некрозу були відсутні. Візуальна морфологічна оцінка встановила відсутність змін венозної стінки в місці введення, ознак гіперемії, зміни кольору прилеглих тканин, гематом, дегенеративних та некротичних процесів. Б. Вивчення місцевоподразнюючої дії препарату при внутрішньом'язовому введенні Для дослідження місцевоподразнюючої дії при внутрішньом'язовому введенні використовували самців нелінійних кролів масою 2500±500 г. За день до введення препарату в місці ін'єкції обережно видаляли шерсть. Внутрішньом'язове введення розчину морфолінієвої солі тіазотної кислоти, 50 мг/мл, в об'ємі 1,0 мл здійснювали в латеральний широкий м'яз стегна (т. vastus lateralis) справа. Як негативний контроль в лівий латеральний широкий м'яз стегна виконували внутрішньовенну ін'єкцію 1,0 млфізіологічного розчину (0,9 % розчин натрію хлориду). Після введення препарату протягом всього дослідження проводили щоденне 3 UA 109708 U 5 10 15 20 25 30 35 40 45 50 55 60 спостереження за станом тварин. Оцінку реакції тканин на введення препарату проводили через 24, 48 і 72 години після введення в умовах медикаментозного тіопенталового наркозу. Попередньо проводили оцінку стану шкірного покриву та пальпацію тканин в місці ін'єкції. Потім латеральні широкі м'язи стегна з обох боків поздовжньо розсікали та візуально визначали стан тканин в місці ін'єкції за п'ятибальною шкалою. Встановлено, що через 24, 48 та 72 години після введення розчину морфолінієвої солі тіазотної кислоти, 50 мг/мл, рухова та поведінкова активність, а також вживання корму та води тваринами не порушувались, шкіра та шерстяний покрив у місці введення не змінювались, явища гіперемії, інфільтрації, зміни забарвлення прилеглих тканин, крововиливів, дегенерації тканин та некрозу були відсутні. Візуальна морфологічна оцінка при поздовжньому розрізі шкірних покривів та м'язової тканини задньої поверхні стегна у місці введення встановила відсутність змін прилеглих тканин. Гематоми, абсцеси та некротичні зміни виявлені не були. Таким чином, дослідження підтвердили відсутність місцевоподразнюючої дії розчину морфолінієвої солі тіазотної кислоти, 50 мг/мл, при внутрішньовенному та внутрішньом'язовому введенні. В. Вивчення місцевоподразнюючої дії препарату при повторному внутрішньом'язовому введенні Дослідження місцевоподразнюючої дії та токсичності при повторному введенні розчинів морфолінієвої солі тіазотної кислоти різного складу були проведені на 40 нелінійних білих щурах обох статей вагою 170-200 г, що утримувалися у стандартних умовах віварію. Тваринам першої групи один раз на день протягом 28 днів у м'язи стегна вводився розчин морфолінієвої солі тіазотної кислоти, 25 мг/мл, в об'ємі 0,4 мл. Тварини другої групи отримували розчин морфолінієвої солі тіазотної кислоти, 50 мг/мл, в об'ємі 0,4 мл. Тварини третьої групи отримували розчин морфолінієвої солі тіазотної кислоти, 100 мг/мл, в об'ємі 0,2 мл. Тварини четвертої (контрольної) групи отримували фізіологічний розчин в об'ємі 0,4 мл. Через 24 години після останнього введення тварини виводилися з експерименту під тіопенталовим наркозом, забиралася кров на аналізи, м'язи стегна розсікалися для макроскопічного дослідження, після чого проводилося гістологічне дослідження. Встановлено, що протягом експерименту споживання корму та води тваринами не порушувались, тварини набирали вагу однаково в усіх групах, візуально шкіра та шерстяний покрив у місці введення не змінювались. Відмічено, що під час введення розчину морфолінієвої солі тіазотної кислоти, 100 мг/мл тварини були більш неспокійними та сильніше пищали порівняно з тваринами інших груп, що могло свідчити про біль під час введення препарату. Поведінка тварин у першій та другій групах (25 мг/кг та 50 мг/кг) суттєво не відрізнялась від поведінки тварин контрольної групи. При макроскопічному дослідженні, тканини стегна були незмінені в усіх тварин першої та контрольної групи, у 9-ти з 10-ти тварин другої групи, та у 5-ти з 10-ти тварин третьої групи. Незначна гіперемія була виявлена у однієї тварини другої групи та у 4-х з 10-ти тварин третьої групи, ознаки фіброзу - у 3-х з 10-ти тварин третьої групи. При мікроскопічному дослідженні прояви гіперемії, набряку м'язових волокон та клітинної інфільтрації були відмічені у 4-х з 10-ти тварин третьої групи. У решти тварин дослідних груп суттєвих відмінностей від контролю не виявлено. Також, не виявлено відмінностей параметрів загального та біохімічного аналізів крові, проведених у день виведення тварин з експерименту. Таким чином, дослідження підтвердило відсутність токсичності та місцевоподразнюючої дії розчину морфолінієвої солі тіазотної кислоти у концентрації 25 мг/мл та 50 мг/мл. Розчин 100 мг/мл, у тій же дозі, не викликав проявів системної токсичності, проте мав помірно виражену місцевоподразнюючу дію при внутрішньом'язовому введенні щурам протягом 28 днів. Приклад 3: Дослідження стабільності препарату відповідно до переважного втілення корисної моделі. Стабільність препарату вивчалась в умовах довгострокових досліджень (за температури (25±2)°С та відносної вологості (60±5) %) протягом дванадцяти місяців з контрольними точками 0, 3, 6, 9 та 12 місяців; в умовах прискорених досліджень (за температури (40±2)°С та відносної вологості (75±5) %) протягом шести місяців з контрольними точками 0, 3 та 6 місяців та в умовах стресових досліджень(охолодження до температури (5±3)°С та заморожування при температурі (-20±5)°С) протягом двох тижнів з контрольними точками 0, 7 та 14 днів. Препарат вважається стабільним, якщо витримуються наступні умови: відповідність межам за показником "кількісний вміст"; - відповідність критеріям прийнятності за візуальними характеристиками ("опис", "колір", "прозорість"); - відповідність межам рН; 4 UA 109708 U 5 відсутність додаткових піків на хроматограмах, наявність яких свідчить про утворення сторонніх домішок або про збільшення кількісного вмісту існуючих домішок. Результати довгострокових досліджень стабільності препарату відповідно до переважного втілення корисної моделі наведені у Таблиці 1, прискорених досліджень стабільності - у Таблиці 2, стресових досліджень стабільності (охолодження до температури (5±3)°С) - у Таблиці 3, стресових досліджень стабільності (заморожування за температури (-20±5)°С) - у Таблиці 4. Таблиця 1 Результати довгострокових досліджень стабільності препарату відповідно до переважного втілення корисної моделі Термін збе№ рігасення, рії місяців Показники контролю якості Кількісний вміст Сторонні домішки Опис Прозорість Колір рН 3-метилАцетил- 1,2,4- Будь-яка Сума тіосемі- триазоінша інших карбазид ліл-5- домішка домішок тіон Забарвлення ЛЗ повинПрозора но безбарвна або з ЛЗ має Не бути Від 5,0 Вимоги ледве бути більше не до 7,0 жовтуватим прозорим 0,15 % інтенвідтінком рідина сивнішим еталону Y7 Прозора 0 безбарвна Прозорий
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 1/16, A61K 9/08, A61K 31/4196
Мітки: розчину, морфоліній, 5-метил-1н-1,2,4-триазол-3-іл)тіо)]ацетат, лікарський, засіб, містить, ін'єкцій, форми
Код посилання
<a href="https://ua.patents.su/11-109708-likarskijj-zasib-u-formi-rozchinu-dlya-inehkcijj-shho-mistit-morfolinijj-5-metil-1n-124-triazol-3-iltioacetat.html" target="_blank" rel="follow" title="База патентів України">Лікарський засіб у формі розчину для ін’єкцій, що містить морфоліній [(5-метил-1н-1,2,4-триазол-3-іл)тіо)]ацетат</a>
Попередній патент: Спосіб виготовлення ажурного ламбрекена
Наступний патент: Лікувально-профілактична добавка на основі личинок великої воскової молі “молодій”
Випадковий патент: Посуд для теплової обробки харчових продуктів