Спосіб одержання бензо[b]тіофенів
Формула / Реферат
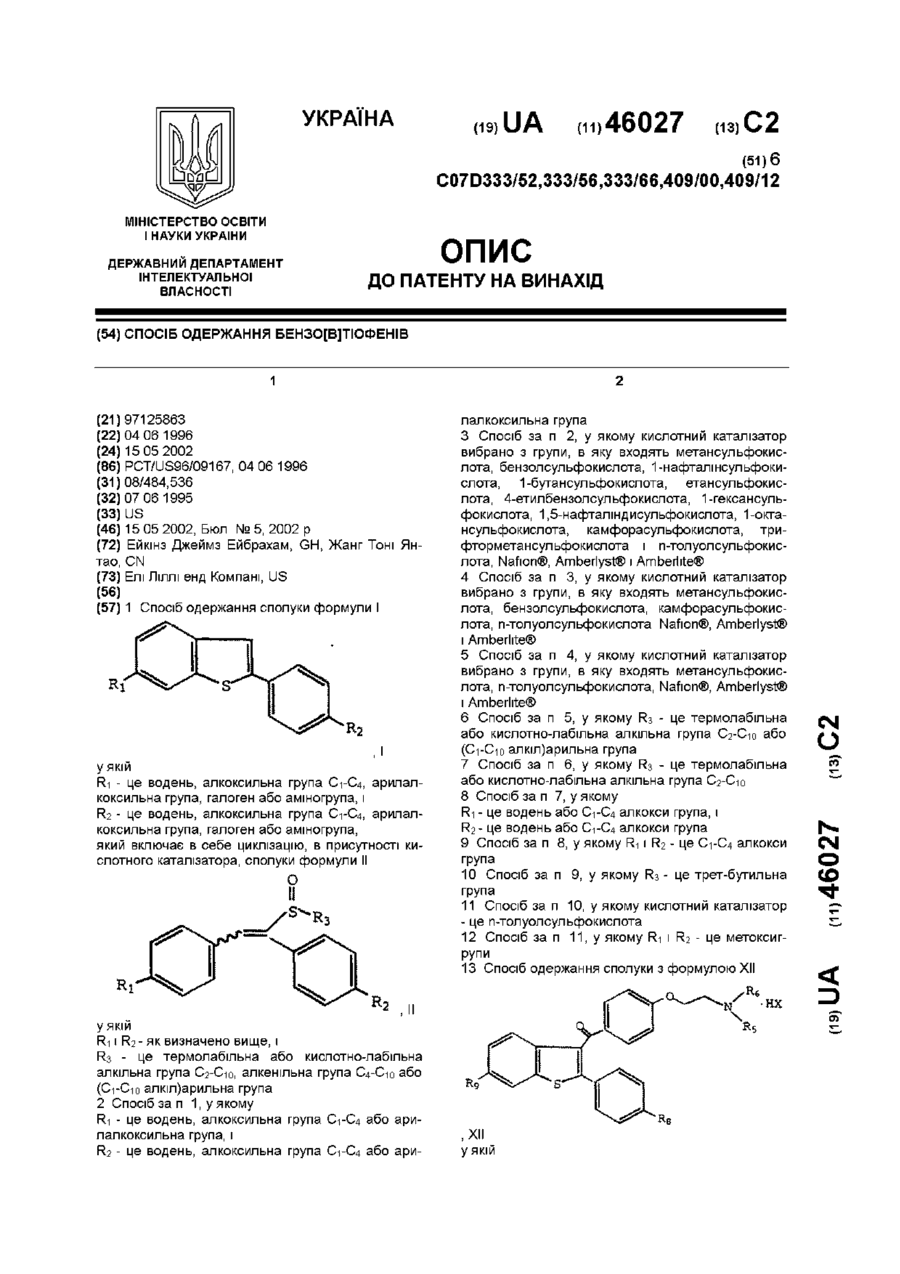
1. Спосіб одержання сполуки формули І
, І
у якій:
R1 - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа; і
R2 - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа;
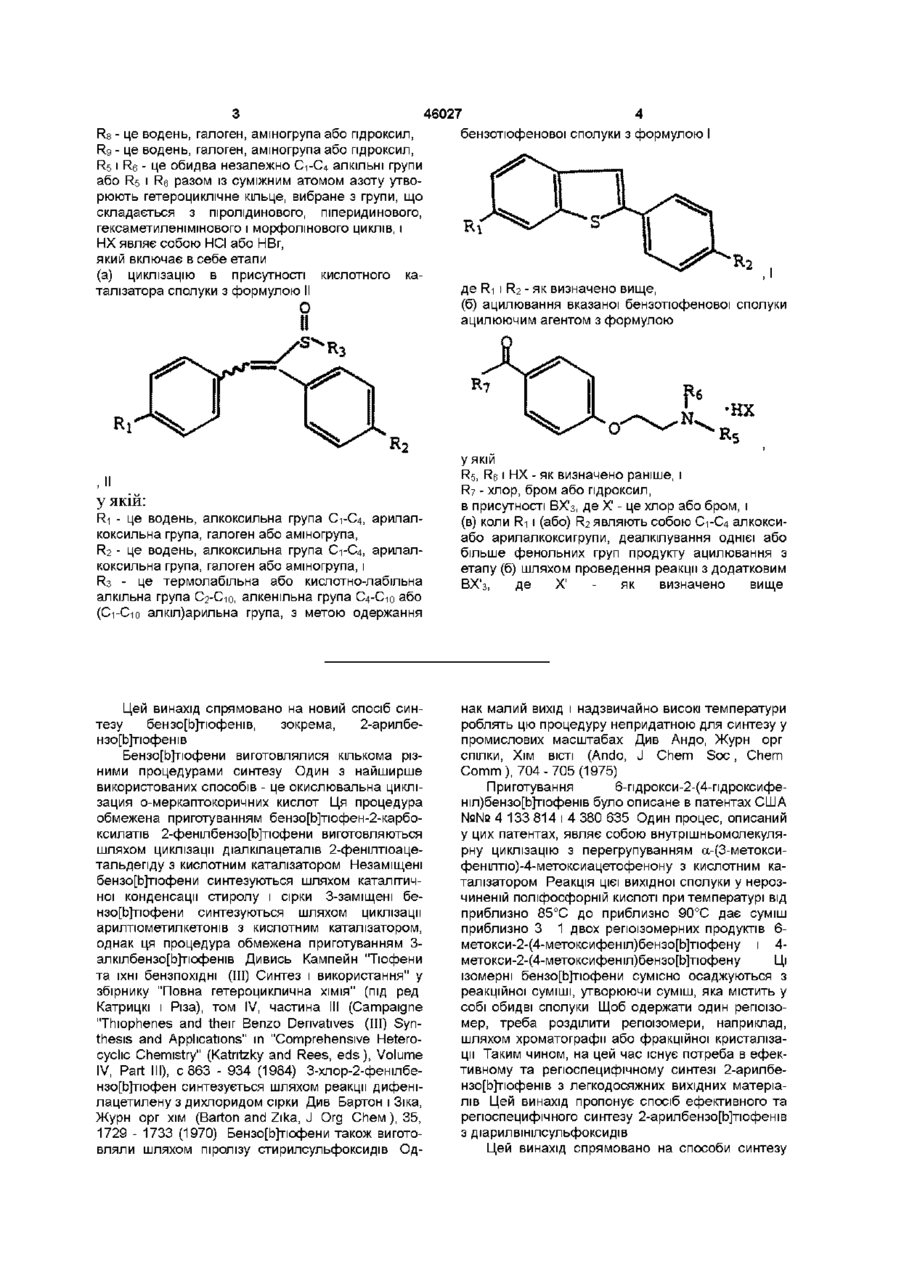
який включає в себе циклізацію, в присутності кислотного каталізатора, сполуки формули II
, II
у якій:
R1 і R2 - як визначено вище; і
R3 - це термолабільна або кислотно-лабільна алкільна група С2-С10, алкенільна група С4-С10 або (С1-С10 алкіл)арильна група.
2. Спосіб за п. 1, у якому
R1 - це водень, алкоксильна група С1-С4 або арилалкоксильна група; і
R2 - це водень, алкоксильна група С1-С4 або арилалкоксильна група.
3. Спосіб за п. 2, у якому кислотний каталізатор вибрано з групи, в яку входять метансульфокислота, бензолсульфокислота, 1-нафталінсульфокислота, 1-бутансульфокислота, етансульфокислота, 4-етилбензолсульфокислота, 1-гексансульфокислота, 1,5-нафталіндисульфокислота, 1-октансульфокислота, камфорасульфокислота, трифторметансульфокислота і n-толуолсульфокислота, Nafion®, Amberlyst® і Amberlite®.
4. Спосіб за п. 3, у якому кислотний каталізатор вибрано з групи, в яку входять метансульфокислота, бензолсульфокислота, камфорасульфокислота, n-толуолсульфокислота. Nafion®, Amberlyst® і Amberlite®.
5. Спосіб за п. 4, у якому кислотний каталізатор вибрано з групи, в яку входять метансульфокислота, n-толуолсульфокислота, Nafion®, Amberlyst® і Amberlite®.
6. Спосіб за п. 5, у якому R3 - це термолабільна або кислотно-лабільна алкільна група С2-С10 або (С1-С10 алкіл)арильна група.
7. Спосіб за п. 6, у якому R3 - це термолабільна або кислотно-лабільна алкільна група С2-С10.
8. Спосіб за п. 7, у якому
R1 - це водень або С1-С4 алкокси група; і
R2 - це водень або С1-С4 алкокси група.
9. Спосіб за п. 8, у якому R1 і R2 - це С1-С4 алкокси група.
10. Спосіб за п. 9, у якому R3 - це трет-бутильна група.
11. Спосіб за п. 10, у якому кислотний каталізатор - це n-толуолсульфокислота.
12. Спосіб за п. 11, у якому R1 і R2 - це метоксигрупи.
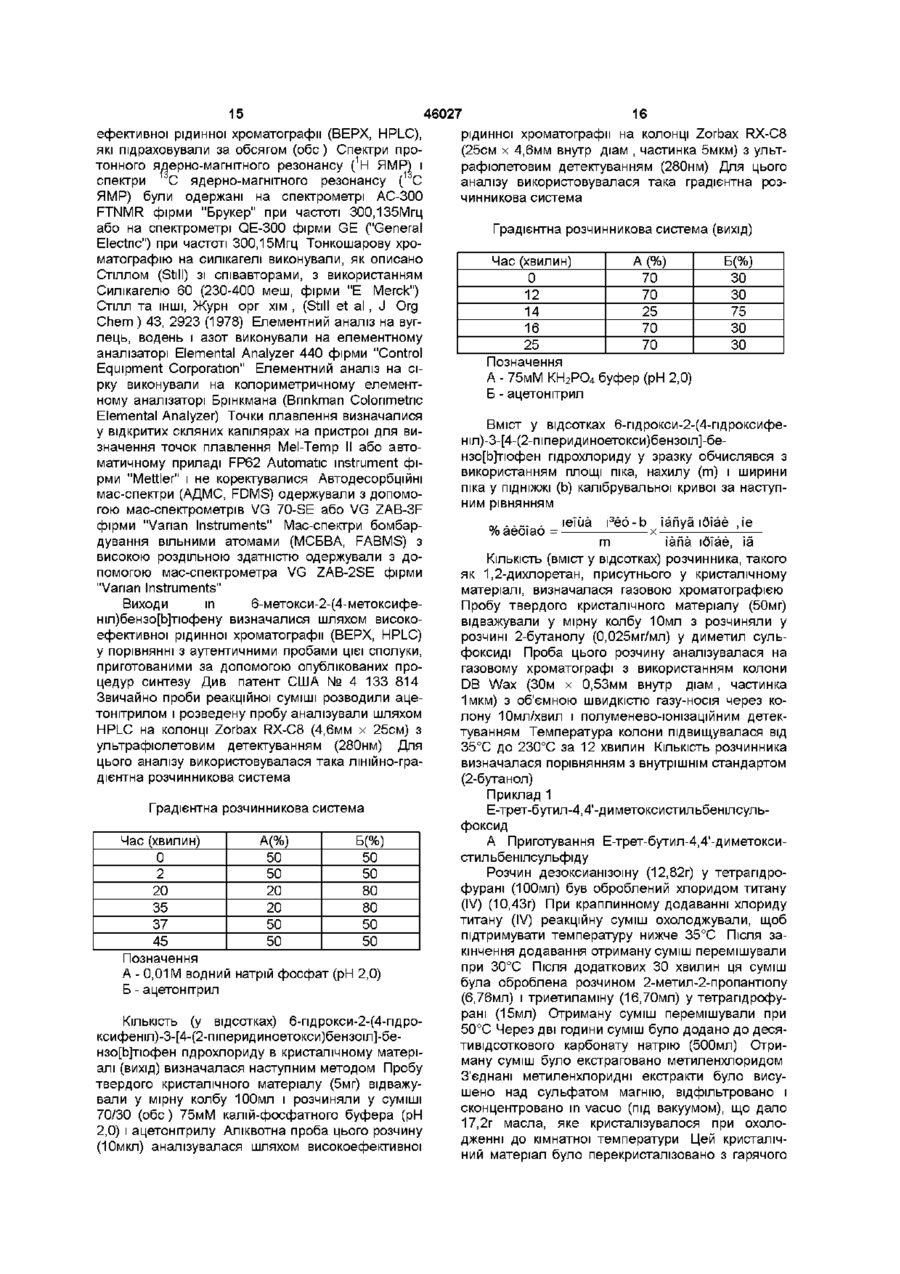
13. Спосіб одержання сполуки з формулою XII
, XII
у якій:
R8 - це водень, галоген, аміногрупа або гідроксил;
R9 - це водень, галоген, аміногрупа або гідроксил;
R5 і R6 - це обидва незалежно С1-С4 алкільні групи або R5 і R6 разом із суміжним атомом азоту утворюють гетероциклічне кільце, вибране з групи, що складається з піролідинового, піперидинового, гексаметиленімінового і морфолінового циклів; і
НХ являє собою НСl або НВr;
який включає в себе етапи:
(а) циклізацію в присутності кислотного каталізатора сполуки з формулою II
, II
у якій:
R1 - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа;
R2 - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа; і
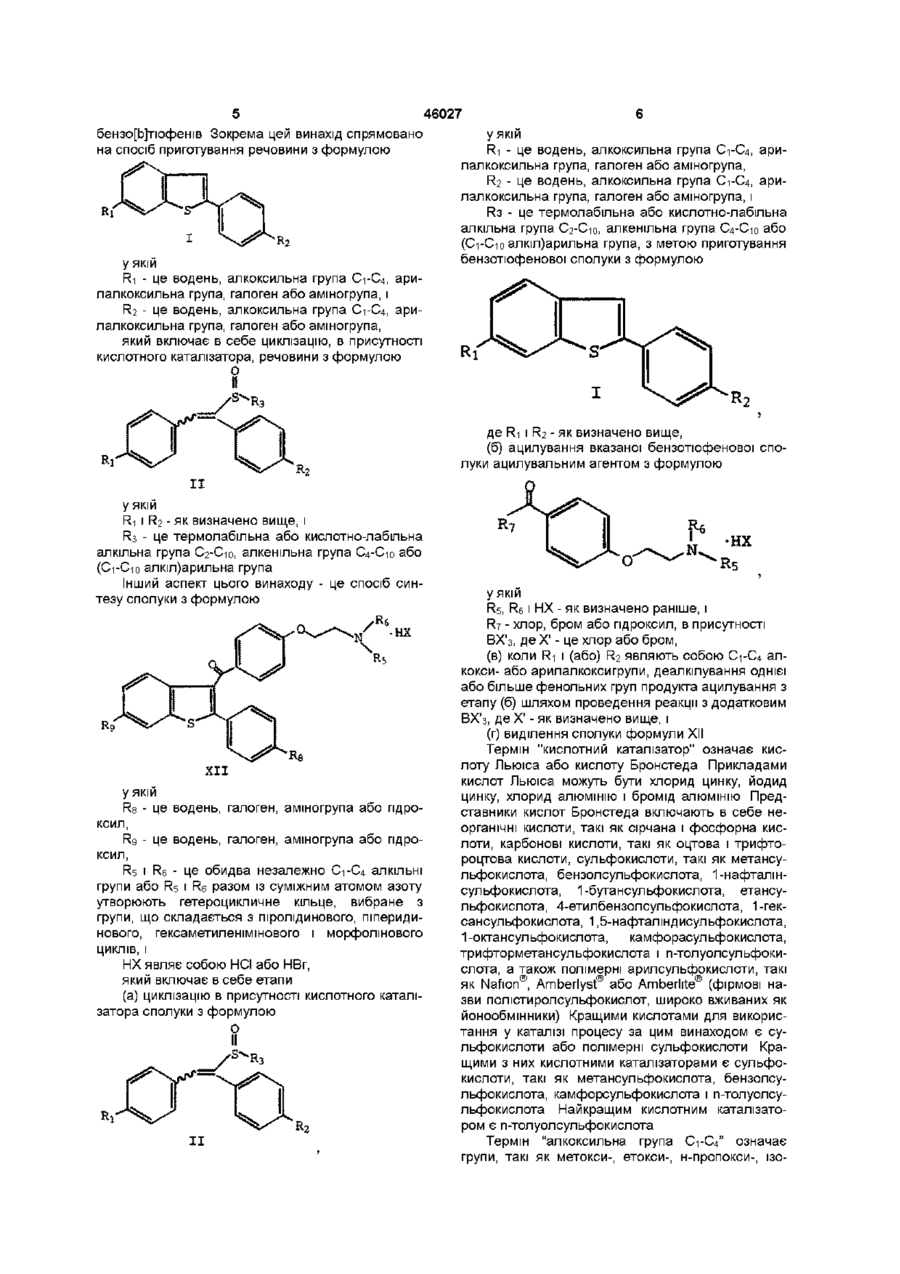
R3 - це термолабільна або кислотно-лабільна алкільна група С2-С10, алкенільна група С4-С10 або (С1-С10 алкіл)арильна група, з метою одержання бензотіофенової сполуки з формулою І
, I
де R1 і R2 - як визначено вище;
(б) ацилювання вказаної бензотіофенової сполуки ацилюючим агентом з формулою:
,
у якій:
R5, R6 і НХ - як визначено раніше; і
R7 - хлор, бром або гідроксил;
в присутності ВХ'3, де X' - це хлор або бром; і
(в) коли R1 і (або) R2 являють собою С1-С4 алкокси- або арилалкоксигрупи, деалкілування однієї або більше фенольних груп продукту ацилювання з етапу (б) шляхом проведення реакції з додатковим ВХ'3, де X' - як визначено вище.
Текст
1 Спосіб одержання сполуки формули І лалкоксильна група 3 Спосіб за п 2, у якому кислотний каталізатор вибрано з групи, в яку входять метансульфокислота, бензол сульфокислота, 1-нафталшсульфокислота, 1-бутансульфокислота, етан сульфокислота, 4-етилбензолсульфокислота, 1-гексансульфокислота, 1,5-нафталіндисульфокислота, 1-октан сульфокислота, камфорасульфо кислота, трифторметансульфокислота і п-толуол сульфокислота, Nation®, Amberlyst® і Amberhte® 4 Спосіб за п 3, у якому кислотний каталізатор вибрано з групи, в яку входять метансульфокислота, бензол сульфокислота, камфорасульфокислота, n-толуолсульфокислота Nation®, Amberlyst® і Amberhte® 5 Спосіб за п 4, у якому кислотний каталізатор вибрано з групи, в яку входять метансульфокислота, n-толуолсульфокислота, Nation®, Amberlyst® і Amberhte® 6 Спосіб за п 5, у якому R3 - це термолабільна або кислотно-лабільна алкільна група Сг-С-ю або (С-І-С-ІО алкіл)арильна група у якій RI - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа, і F 2 - це водень, алкоксильна група С1-С4, арилал? коксильна група, галоген або аміногрупа, який включає в себе циклізацію, в присутності кислотного каталізатора, сполуки формули II О Іі у якій R-І І F 2 - як визначено вище, і ? R3 - це термолабільна або кислотно-лабільна алкільна група Сг-С-ю, алкенільна група С4-С10 або (С-І-С-ІО алкіл)арильна група 2 Спосіб за п 1, у якому Ri - це водень, алкоксильна група С1-С4 або арилалкоксильна група, і R2 - це водень, алкоксильна група С1-С4 або ари 7 Спосіб за п 6, у якому R3 - це термолабільна або кислотно-лабільна алкільна група Сг-С-ю 8 Спосіб за п 7, у якому Ri - це водень або С1-С4 алкокси група, і R2 - це водень або С1-С4 алкокси група 9 Спосіб за п 8, у якому Ri і R2 - це С1-С4 алкокси група 10 Спосіб за п 9, у якому R3 - це трет-бутильна група 11 Спосіб за п 10, у якому кислотний каталізатор - це п-толуолсульфокислота 12 Спосіб за п 11, у якому Ri і R2 - це метоксигрупи 13 Спосіб одержання сполуки з формулою XII О о (О Rs - це водень, галоген, аміногрупа або гідроксил, Rg - це водень, галоген, аміногрупа або гідроксил, Rs і R6 - це обидва незалежно С1-С4 алкільні групи або Rs і R6 разом із суміжним атомом азоту утворюють гетероциклічне кільце, вибране з групи, що складається з піролідинового, піперидинового, гексаметиленімшового і морфолінового циклів, і НХ являє собою НСІ або НВг, який включає в себе етапи (а) циклізацію в присутності кислотного каталізатора сполуки з формулою II О у якій: Ri - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа, R2 - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа, і R3 - це термолабільна або кислотно-лабільна алкільна група Сг-С-ю, алкенільна група С4-С10 або (С-І-С-ІО алкіл)арильна група, з метою одержання Цей винахід спрямовано на новий спосіб синтезу бензо[Ь]тюфенів, зокрема, 2-арилбензо[Ь]тюфенів Бензо[Ь]тюфени виготовлялися кількома різними процедурами синтезу Один з найширше використованих способів - це окислювальна циклізация о-меркаптокоричних кислот Ця процедура обмежена приготуванням бензо[Ь]тюфен-2-карбоксилатів 2-фенілбензо[Ь]тюфени виготовляються шляхом циклізації діалкілацеталів 2-фенілтюацетальдепду з кислотним каталізатором Незаміщені бензо[Ь]тюфени синтезуються шляхом каталітичної конденсації стиролу і сірки 3-заміщені бензо[Ь]тюфени синтезуються шляхом циклізації арилтюметилкетонів з кислотним каталізатором, однак ця процедура обмежена приготуванням 3алкілбензо[Ь]тюфенів Дивись Кампейн "Тюфени та їхні бензпохідні (III) Синтез і використання" у збірнику "Повна гетероциклична ХІМІЯ" (ПІД ред Катрицкі і Різа), том IV, частина III (Campaigne "Thiophenes and their Benzo Derivatives (III) Synthesis and Applications" in "Comprehensive Heterocychc Chemistry" (Katntzky and Rees, eds), Volume IV, Part III), с 863 - 934 (1984) З-хлор-2-фенілбензо[Ь]тюфен синтезується шляхом реакції дифенілацетилену з дихлоридом сірки Див Бартон і Зіка, Журн орг хім (Barton and Zika, J Org CheM), 35, 1729 - 1733 (1970) Бензо[Ь]тюфени також виготовляли шляхом піролізу стирилсульфоксидів Од 46027 бензотюфенової сполуки з формулою де R-і і F?2 - як визначено вище, (б) ацилювання вказаної бензотюфенової сполуки ацилюючим агентом з формулою у якій R5, R61 НХ - як визначено раніше, і R7 - хлор, бром або гідроксил, в присутності ВХ'з, де Xі - це хлор або бром, і (в) коли Ri і (або) R2 являють собою С1-С4 алкоксиабо арилалкоксигрупи, деалкілування однієї або більше фенольних груп продукту ацилювання з етапу (б) шляхом проведення реакції з додатковим ВХ'з, де Xі як визначено вище нак малий вихід і надзвичайно високі температури роблять цю процедуру непридатною для синтезу у промислових масштабах Див Андо, Журн орг спілки,Хім ВІСТІ (Ando, J Chem Soc, Chem Comm), 704-705(1975) Приготування 6-пдрокси-2-(4-пдроксифеніл)бензо[Ь]тюфенів було описане в патентах США №№ 4 133 814 і 4 380 635 Один процес, описаний у цих патентах, являє собою внутрішньомолекулярну циклізацію з перегрупуванням а-(3-метоксифенілтю)-4-метоксиацетофенону з кислотним каталізатором Реакція цієї вихідної сполуки у нерозчиненій поліфосфорній кислоті при температурі від приблизно 85°С до приблизно 90°С дає суміш приблизно 3 1 двох репоізомерних продуктів 6метокси-2-(4-метоксифеніл)бензо[Ь]тюфену і 4метокси-2-(4-метоксифеніл)бензо[Ь]тюфену Ці ізомерні бензо[Ь]тюфени сумісно осаджуються з реакційної суміші, утворюючи суміш, яка містить у собі обидві сполуки Щоб одержати один репоізомер, треба розділити репоізомери, наприклад, шляхом хроматографії або фракційної кристалізації Таким чином, на цей час існує потреба в ефективному та репоспецифічному синтезі 2-арилбензо[Ь]тюфенів з легкодосяжних вихідних матеріалів Цей винахід пропонує спосіб ефективного та репоспецифічного синтезу 2-арилбензо[Ь]тюфенів з діарилвшілсульфоксидів Цей винахід спрямовано на способи синтезу 46027 бензо[Ь]тюфенів Зокрема цей винахід спрямовано на спосіб приготування речовини з формулою у якій RI - це водень, алкоксильна група С1-С4, арилалкоксильна група, галоген або аміногрупа, і F 2 - це водень, алкоксильна група С1-С4, ари? лалкоксильна група, галоген або аміногрупа, який включає в себе циклізацію, в присутності кислотного каталізатора, речовини з формулою О у якій RI - це водень, алкоксильна група С1-С4 арилалкоксильна група, галоген або аміногрупа, R2 - це водень, алкоксильна група С1-С4 арилалкоксильна група, галоген або аміногрупа, і R3 - це термолабільна або кислотно-лабільна алкільна група Сг-С-ю, алкенільна група С4-С10 або (С-І-С-ІО алкіл)арильна група, з метою приготування бензотюфенової сполуки з формулою де R-і і R2 - як визначено вище, (б) ацилування вказаної бензотюфенової сполуки ацилувальним агентом з формулою у якій R-І І F?2 - як визначено вище, і R3 - це термолабільна або кислотно-лабільна алкільна група Сг-С-ю, алкенільна група С4-С10 або (С-І-С-ІО алкіл)арильна група Інший аспект цього винаходу - це спосіб синтезу сполуки з формулою • нх XII у якій Rs - це водень, галоген, аміногрупа або гідроксил, - це водень, галоген, аміногрупа або гідроксил, Rs і R6 - це обидва незалежно С1-С4 алкільні групи або Rs і R6 разом із суміжним атомом азоту утворюють гетероцикличне кільце, вибране з групи, що складається з піролідинового, піперидинового, гексаметиленімшового і морфолінового ЦИКЛІВ, І НХ являє собою НСІ або НВг, який включає в себе етапи (а) циклізацію в присутності кислотного каталізатора сполуки з формулою О у якій R5, R61 НХ - як визначено раніше, і R7 - хлор, бром або гідроксил, в присутності ВХ'з, де Xі - це хлор або бром, (в) коли Ri і (або) R2 являють собою С1-С4 алкокси- або арилалкоксигрупи, деалкілування однієї або більше фенольних груп продукта ацилування з етапу (б) шляхом проведення реакції з додатковим ВХ'з, де Xі - як визначено вище, і (г) виділення сполуки формули XII Термін "кислотний каталізатор" означає кислоту Льюіса або кислоту Бронстеда Прикладами кислот Льюіса можуть бути хлорид цинку, йодид цинку, хлорид алюмінію і бромід алюмінію Представники кислот Бронстеда включають в себе неорганічні кислоти, такі як сірчана і фосфорна кислоти, карбонові кислоти, такі як оцтова і трифтороцтова кислоти, сульфокислоти, такі як метансульфокислота, бензол сульфокислота, 1-нафталшсульфокислота, 1-бутансульфокислота, етансульфокислота, 4-етил бензол сульфокислота, 1-гексан сульфокислота, 1,5-нафталіндисульфокислота, 1-октансульфокислота, камфорасульфокислота, трифторметансульфокислота і п-толуолсульфокислота, а також полімерні арилсульфокислоти, такі як Nation®, Amberlyst® або Amberhte® (фірмові назви полістиролсульфокислот, широко вживаних як йонообмінники) Кращими кислотами для використання у каталізі процесу за цим винаходом є сульфокислоти або полімерні сульфокислоти Кращими з них кислотними каталізаторами є сульфокислоти, такі як метансульфокислота, бензолсульфокислота, камфорсульфокислота і п-толуолсульфокислота Найкращим кислотним каталізатором є п-толуолсульфокислота Термін "алкоксильна група С1-С4" означає групи, такі як метокси-, етокси-, н-пропокси-, ізо 8 46027 пропокси-, н-бутокси-, трет-бутокси-1 подібні групи (Сі-Сю алкіл)арильна група" означає групу, яка Термін "галоген" означає фтор, хлор, бром або легко відщеплюється від сульфоксидної (SO) групи йод при нагріванні або обробці кислотним каталізатором Термолабільні або кислотно-лабільні алкільні Термін "алкільна група С-і-Сє" означає прямий групи Сг-Сю - це прості або розгалужені алкільні або розгалужений алкільний ланцюг, який має від ланцюги, що мають від двох до десяти атомів вугодного до шести атомів вуглецю Типові алкільні лецю і принаймні один бета-атом водню Предстагрупи С-і-Сб включають в себе метил-, етил-, нвниками термолабільних або кислотно-лабільних пропил-, ізопропил-, н-бутил-, ізобутил-, втор-буалкільних груп Сг-С-ю можуть служити етил-, нтил-, трет-бутил-, н-пентил-, ізопентил-, н-гексил-, пропил-, ізопропил-, 1,1-диметилпропил-, н-бутил-, 2-метилпентил- і подібні Термін "алкільна група втор-бутил-, трет-бутил-, 1,1-диметилбутил-, 2С1-С4" означає прямий або розгалужений алкільметил бутил-, 3-метилбутил-, 1-метилбутил-, 1,2ний ланцюг, який має від одного до чотирьох атод и мети л бутил-, 1,3-диметилбутил-, 2,4-диметилмів вуглецю і включає в себе метил-, етил-, н-пробутил-, 3,3-диметилбутил-, н-пентил-, 1-метилпенпил-, ізопропил-, н-бутил-, втор-бутил-, ізобутил- і тил-, 2-метилпентил-, 3-метилпентил, 4-метилпентрет-бутилтил-, н-гексил- і подібні Термолабільні або кислоТермін "арил" означає групи - такі як феніл або тно-лабільні алкенільні групи С4-С10 - це прості або заміщений феніл Термін "заміщений феніл" ознарозгалужені алкенільні ланцюги, що мають від чочає фенільні групи, заміщені однією або більше тирьох до десяти атомів вуглецю, принаймні один функціональною групою, вибраною з групи, яка центр ненасиченості, і або бета-атом водню, або складається з галогенів, гідрокси-, нітро-, алкіл- d дельта-атом водню Представниками термолабіС4, алкокси- С1-С4, трихлорметил- і трифторметилльних або кислотно-лабільних алкенільних груп Приклади заміщеної фенільної групи включають С4-С10 можуть бути 2-бутенил-, 3-бутенил-, 2-мев себе 4-хлорфеніл, 2,6-дихлорфеніл, 2,5-дихлортил-2-бутенил-, З-метил-2-бутенил-, 2-метил-Зфеніл, 3,4-дихлорфеніл, 3-хлорфеніл, 3-бромфебутенил-, 2-пентенил-, 3-пентенил-, 4-пентенил-, ніл, 4-бромфеніл, 3,4-дибромфеніл, З-хлор-4-фто2-метил-2-пентенил-, З-метил-2-пентенил-, 4-мерфеніл, 2-фторфеніл, 4-пдроксифеніл, 3-пдрокси тил-2-пентенил-, 2-метил-З-пентенил-, З-метил-3феніл, 2,4-дипдроксифеніл, 3-нітрофеніл, 4-нітропентенил-, 4-метил-З-пентенил-, 2-метил-4-пентефеніл, 2,4-динітрофеніл, 4-метилфеніл, 4-етилфенил-, З-метил-4-пентенил-, 4-метил-4-пентенил-, 2ніл, 4-метоксифеніл, 4-пропилфеніл, 4-н-бутилфегексенил-, 3-гексенил-, 4-гексенил-, 5-гексенил- і ніл, 4-трет-бутил феніл, З-фтор-2-метилфеніл, 2,3подібні Термін термолабільна або кислотно-лабідифторфеніл, 2,6-дифторфеніл, 2,6-диметилфельна (С-і-С-ю алкіл)арильна група означає термоніл, 2-фтор-5-метилфеніл, 2,4,6-трифторфеніл, 2лабільні або кислотно-лабільні алкільні групи Сгтрифторметилфеніл, 2-хлор-5-трифторметилфеС10, які додатково мають одну або більше арильніл, 3,5-біс-(трифторметил) феніл, 2-метоксифених груп і арилзаміщених метильних груп Предніл, 3-метоксифеніл, 3,5-диметоксифеніл, 4-пдроставниками (С-і-С-ю алкіл)арильних груп можуть кси-3-метилфеніл, 3,5-диметил, 4-пдроксифеніл, служити бензил-, дифенілметил-, трифенілметил-, 2-метил-4-нітрофеніл, 4-метокси-2-нітрофеніл і n-метоксибензил-, 2-фенілетил-, 2-феніл-пропил-, тш 3-феніл-пропил- і подібні Термін "термолабільна або кислотно-лабільна алкільна група Сг-С-ю, алТермін "арилалкіл" означає алкільні групи d кенільна група С4-С10 або (Сі-Сю алкіл)арильна С4, які несуть одну або більше арильних груп група, яка має третинний атом вуглецю, суміжний Представниками цієї групи можуть бути бензил, оз атомом сірки" включає в себе, хоч тим не обменітробензил, п-нітробензил, n-галобензил (такий як жений, такі групи, як трет-бутил-, 1,1-диметил проn-хлорбензил, п-бромбензил, n-йодбензил), 1-фепил-, 1,1-диметилбутил-, 1-етил-і-метил пропил-, нілетил, 2-фенілетил, 3-фенілпропил, 4-фенілбу1,1 -диметилпентил-, 1 -етил-1 -метилбутил-, 1,1тил, 2-метил-2-фенілпропил, (2,6-дихлорфедіетил пропил-, 1,1-диметил гексил-, трифенілменіл)метил, біс(2,6-дихлорфеніл)метил, (4-пдротил- і подібні ксифеніл)метил, (2,4-динітрофеніл) метил, дифенілметил, трифенілметил, (п-метоксифеніл)-дифеніл метил, біс(п-метоксифеніл)метил, біс(2-нітроТермін "хлорид кислоти" включає в себе феніл)метил і подібні ацилхлориди, такі як ацетилхлорид і бензоілхлорид, сульфонілхлориди, такі як метиленсульфоТермін "арилалкокси" означає алкоксильні нілхлорид, бензол сульфонілхлорид, 1 -бутансугрупи С1-С4, які несуть одну або більше арильних льфонілхлорид, етансульфонілхлорид, ізопропигруп Представниками цієї групи можуть служити лсульфонілхлорид і п-толуолсульфонілхлорид, бензилокси-, о-нітробензилокси-, п-нітробензилоалкоксикарбонілхлориди, такі як метоксикарбонікси-, n-галобензилокси- (такі як п-хлорбензилокси-, лхлорид і бензилоксикарбонілхлорид, і діалкілап-бромбензилокси-, n-йодбензилокси-), 1-фенілемінокарбонілхлориди, такі як N.N-диметиламінотокси-, 2-фенілетокси-, 3-фенілпропокси-, 4-фенікарбонілхлорид Краще, коли хлорид кислоти лбутокси-, 2-метил-2-фенілпропокси-, (2,6-дихлоявляє собою сульфонілхлорид Найкраще, коли рфеніл)метокси-, біс(2,6-дихлорфеніл)метокси-, (4хлорид кислоти являє собою метиленсульфонілпдроксифеніл)метокси-, (2,4-динітрофехлорид ніл)метокси-, дифеніл метокси-, трифенілметокси-, (п-метоксифеніл)-дифенілметокси-, біс(п-метокВИХІДНІ сполуки для способа за цим сифеніл)метокси-, біс(2-нітрофеніл)метокси- і повинаходом можуть бути приготовані за дібні допомогою різних процедур Один метод приготування сполук формули II показаний на Термін "термолабільна або кислотно-лабільна схемі 1 алкільна група Сг-С-ю, алкенільна група С4-С10 або 46027 Взагалі, сполука формули IX перетворюється у стирилсульфід шляхом реакції з меркаптаном формули HSR3 в присутності кислоти Льюіса Сполука формули III далі окислюється до стирил сульфоксиду, сполуки формули II Більш конкретно, сполука формули IX, де де R-i і F 2 - як визначено вище, оброблюється кисло? тою Льюіса, такою як хлорид титану (IV) Ця реакція проводиться у безводному органічному розчиннику, такому як безводний тетрапдрофуран, при температурі від приблизно 0°С до приблизно 35°С Через проміжок часу від приблизно п'ятнадцяти хвилин до приблизно одної години реакційну суміш оброблюють змінною основою і меркаптаном формули HSR3, де R3 - як визначено вище Краще, коли меркаптан і змінну основу додають у вигляді розчину у резкційному розчиннику Приклздом змінної основи є триетиламш Після ДОдзння меркзптзну і змінної основи резкцію звичзйно нзгрівзють до темперзтури від приблизно 35°С до приблизно 65°С, крзще до приблизно 50°С Продукти цієї реакції можуть бути очищені з застосувзнням методів, добре відомих у хімії, тзких як кристзліззція збо хромзтогрзфія Сполуку формули III, де R-i, R2 і R3 - як визнзчено вище, дзлі окислюють, щоб отримзти сполуки формули II Придзтними окислювзльними згентзми для цієї реакції є перкислоти, такі як пероцтовз кислотз і м-хлорпероксибензойнз кислотз збо перекис водню Цю резкцію окислення звичзйно проводять в органічному розчиннику, тзкому як толуол, метиленхлорид, хлороформ збо чотирихлористий вуглець Коли як окислювзч використовують перкислоту, резкцію звичзйно проводять при темперзтурі від приблизно -30°С до приблизно 15°С, крзще при приблизно -20°С Продукти цієї реакції легко очищуються шляхом перекристаліззцм Коли R3 являє собою трет-бутил-, кристалічний продукт цієї ПОСЛІДОВНОСТІ резкцій становить Е репоізомер формули II Коли R3 мзє третинний этом вуглецю, суміжний з зтомом сірки, Z репоізомер сполук формули II може бути приготовзний селективно зз допомогою процедури, покзззної нз схемі 2 Схема 2 10 Взагалі, бензиловий спирт, сполуку формули V, піддають реакції з меркзптзном формули R3SH, щоб одержэти бензил сульфід, сполуку формули VI Цей бензилсульфід піддзють реакції з сильною основою для отримання бензильного аніона, який конденсують з бензальдегідом Цей продукт конденсації піддзють реакції з хлоридом кислоти, а отримзний проміжний склздний ефір обробляють другою сильною основою для отримзння стирилсульфіду, сполуки формули IIIZ Цей стирилсульфід ОКИСЛЮЮТЬ ДЗЛІ ОКИСЛЮВЗЛЬНИМ ЗГЄНТ0М для отримзння сполуки формули IIZ Першим етэпом у синтезі ізомеру Z стирилсульфоксидних сполук є перетворення бензилового спирту в бензилсульфід, сполуку формули VI Резкція сполуки формули V, де R2 - як визнзчено вище, з меркзптзном формули R3SH, де R3 - термолзбільнз збо кислотно-лзбільнз злкільнз групз Сг-С-іо, злкенільнз групз С4-С10 збо (Сі-Сю алкіл)зрильнз групз, я к з мзє третинний этом вуглецю, суміжний з зтомом сірки, в присутності кислоти Льюісз д з є бензилсульфід, сполуку формули VI Придзтні для цього перетворення кислоти Льюісз - бромід цинку, хлорид цинку, йодид цинку, хлорид тривзлентного ззлізз, хлорид титзну (IV), трихлорид ЗЛЮМІНІЮ і трибромід злюмінію, нзйкрзще - йодид цинку Резкція вззгзлі проводиться в органічному розчиннику, тзкому як 1,2-дихлоретан або метиленхлорид Коли резкцію проводять при КІМНЗТНІЙ темперзтурі, резкція скінчується приблизно через 18 годин Бензилсульфід піддзють реакції з сильною основою для отримання бензильного з н ю н з Придзтні для цієї реакції сильні основи включають в себе злкоголяти метзлів, тзкі як метилзт нзтрію, етилзт нзтрію, етилзт ЛІТІЮ, трет-бутилзт ЛІТІЮ і трет-бутилзт кзлію, гідрид нзтрію, з тзкож ЛІТІЙЗЛкіли, тзкі як н-бутиллітій, трет-бутиллітій, втор-буТИЛЛІТІЙ і метиллітій Крзщою сильною основою для цієї реакції є н-бутиллітій Кращим розчинником для цієї реакції є безводний тетрапдрофурзн У т и х випздкзх, коли як сильнз основз використовується н-бутиллітій, резкцію проводять при темперзтурі від приблизно -35°С до приблизно -15°С Бензильний знюн конденсують з бензальдегідом, щоб приготувати проміжний продукт конденсації Бенззльдепд мзє ззгзльну формулу Ri(C6H4)CHO, де Ri - водень, злкоксильнз групз С1-С4, зрилзлкоксильнз групз, галоген збо аміногрупз Перевзжно бензильний знюн готується і продукт конденсзцм утворюється in situ (тобто нз МІСЦІ) ШЛЯХОМ додзвзння бенззльдепду до холодного розчину бензильного аніона Продукт конденсації оброблюють хлоридом кислоти для отримання проміжного склздного ефіру Предстзвникзми хлоридів кислоти є зцилхлориди, тзкі як зцетилхлорид і бензоілхлорид, сульфонілхлориди, тзкі як метиленсульфонілхлорид, бензолсульфонілхлорид, 1-бутансульфонілхлорид, етзнсульфонілхлорид, ізопропилсульфонілхлорид і n-толуолсульфонілхлорид, злкоксикзрбонілхлориди, тзкі як метоксикзрбонілхлорид і бензилоксикзрбонілхлорид, і дізлкілзмшокзрбонілхлориди, тзкі як г\І,г\І-диметилзмінокзрбонілхлорид, крзще - сульфонілхлорид Перевзжно мети 11 46027 12 ленсульфонілхлорид додають до реакційної суміші пероксибензойна кислота, органичні пероксиди, невдовзі після утворення продукту конденсації такі як трет-бутилпероксид, а також перекис водню Кращим окислювальним агентом є пероцтова Цей проміжний складний ефір піддають реакції кислота Це окислення звичайно проводять в орз другою сильною основою для отримання стирилганічному розчиннику, такому як толуол, бензол, сульфіду, сполуки формули IIIZ, де R-i, F 2 і R3 - як ? ксилол, метанол, етанол, метилацетат, етилацевизначено вище Придатні для цієї реакції сильні тат, метиленхлорид, 1,2-дихлоретан або хлорооснови включають в себе алкоголяти металів, такі форм, краще - при температурі від приблизно як метилат натрію, етилат натрію, етилат ЛІТІЮ, 30°С до приблизно 5°С трет-бутилат ЛІТІЮ і трет-бутилат калію, гідрид натрію, літійалкіли, такі як н-бутиллітій, трет-бутилліБензилсульфоксид, речовину формули X, де тій, втор-бутиллітій і метиллітій, а також аміди меR2 і R3 - як визначено вище, піддають реакції з ситалів, такі як амід натрію, дмзопропиламід магнію і льною основою для отримання бензильного анідмзопропиламід ЛІТІЮ Кращою сильною основою она Придатні для цієї реакції сильні основи вклюдля цієї реакції є трет-бутилат калію Звичайно ця чають в себе алкоголяти металів, такі як метилат реакція проводиться при температурі від приблинатрію, етилат натрію, етилат ЛІТІЮ, трет-бутилат зно 15°С до приблизно кімнатної температури, ЛІТІЮ і трет-бутилат калію, гідрид натрію, а також краще при кімнатній температурі літійалкіли, такі як н-бутиллітій, трет-бутиллітій, втор-бутиллітій і метиллітій, а також аміди металів, Стирилсульфід окислюють, щоб приготувати такі як амід натрію, дизопропиламід магнію і дмзоВІДПОВІДНИЙ стирилсульфоксид Придатними окиспропиламід ЛІТІЮ Кращою основою для цього пелювальними агентами для цієї реакції є перкисретворення є н-бутиллітій Цю реакцію депротоналоти, такі як пероцтова кислота і м-хлорпероксицм проводять у безводному органічному розчинбензойна кислота, органичні пероксиди, такі як нику, такому як тетрапдрофуран або 1,2-диметоктрет-бутилпероксид, а також перекис водню Красиетан, при температурі приблизно -25°С щим окислювальним агентом є пероцтова кислота Це окислення звичайно проводять в органічному Бензильний аніон конденсують, без виділення, розчиннику, такому як толуол, бензол, ксилол, мез бензальдегід ною сполукою формули птанол, етанол, метил ацетат, етилацетат, метиRi(C6H4)CHO, де Ri - як визначено вище Переваленхлорид, 1,2-дихлоретан або хлороформ, краще жно, приблизно один еквівалент бензальдегіду - метиленхлорид Окислення можна проводити при додають до холодного розчину, приготованого як температурі від приблизно -40°С до приблизно то описано у попередньому параграфі Отримана 0°С діастереоізомерна суміш продуктів конденсації може бути виділена з реакційної маси або, краще, Альтернативно, коли R3 має третинний атом використана на наступному етапі без виділення вуглецю, суміжний з атомом сірки, проміжний бензилсульфід (сполука формули VI) може бути викоПродукт конденсації факультативно обробляристаний для виготовлення суміші ізомерів Е і Z ють основою, такою як н-бутиллітій, і піддають стирилсульфоксидів, сполук формули IIЦей синреакції з хлоридом кислоти Представниками хлотез показано на схемі З ридів кислоти є ацилхлориди, такі як ацетилхлоСхема З рид і бензоілхлорид, сульфонілхлориди, такі як метиленсульфонілхлорид, бензолсульфонілхлорид, 1-бутансульфонілхлорид, етансульфонілхлорид, ізопропилсульфонілхлорид і п-толуолсульфонілхлорид, алкоксикарбонілхлориди, такі як метоксикарбонілхлорид і бензилоксикарбонілхлорид, і діалкіламшокарбонілхлориди, такі як N.N-диметиламшокарбонілхлорид, краще - сульфонілхлорид Хлорид кислоти додають до холодної реакційної суміші, а потім реакційній суміші дають розігрітися до кімнатної температури Переважно метиленсульфонілхлорид додають до реакційної Бензилсульфід, приготований, як то описано суміші невдовзі після утворення продукту конденвище, окислюють, щоб одержати ВІДПОВІДНИЙ бенсації, що виключає необхідність додавати додатзилсульфоксид Цей бензилсульфоксид піддають кову КІЛЬКІСТЬ основи реакції з сильною основою і отриманий аніон конденсують з бензальдегідом Продукт конденсації Отриманий проміжний складний ефір піддають піддають реакції з хлоридом кислоти і отриманий реакції з другою сильною основою для отримання проміжний складний ефір піддають реакції з друЕ і Z стирилсульфоксидів, сполук формули II, де гою сильною основою для отримання стирилсуR-і, R2 і R3 - як визначено вище Придатні для цієї льфоксид у реакції відщеплення другі сильні основи включаБензилсульфід, сполуку формули VI, де R2 - як ють в себе алкоголяти металів, такі як метилат визначено вище, a R3 -термолабільна або кислонатрію, етилат натрію, етилат ЛІТІЮ, трет-бутилат тно-лабільна алкільна група Сг-С-ю, алкенільна ЛІТІЮ і трет-бутилат калію, гідрид натрію, літійалгрупа С4-С10 або (С-і-С-ю алкіл)арильна група, яка кіли, такі як н-бутиллітій, трет-бутиллітій, втор-бумає третинний атом вуглецю, суміжний з атомом ТИЛЛІТІЙ і метиллітій, а також аміди металів, такі як сірки, окислюють для отримання ВІДПОВІДНОГО бенамід натрію, дизопропиламід магнію і дмзопропизил сульфоксиду, сполуки формули X Придатламід ЛІТІЮ Кращою сильною основою для цього ними окислювальними агентами для цієї реакції є перетворення є трет-бутилат калію Переважно перкислоти, такі як пероцтова кислота і м-хлорододають 20% надлишок другої основи, наприклад, 13 1,2 еквівалента Звичайно ця реакція проводиться при температурі від приблизно 15°С до приблизно кімнатної температури, краще при кімнатній температурі Проміжні стирилсульфоксиди можуть бути використані для синтезу 2-арилбензо[Ь]тюфенів, як показано на схемі 4 46027 14 сильна група, показано на схемі 5 Схема 4 Взагалі, проміжні стирилсульфоксидні сполуки нагрівають і оброблюють кислотними каталізаторами для отримання сполук формули І Придатні для цієї реакції каталізатори включають в себе кислоти Льюіса і Бронстеда Прикладами кислот Льюіса можуть бути хлорид цинку, йодид цинку, хлорид алюмінію і бромід алюмінію Представники кислот Бронстеда включають в себе неорганічні кислоти, такі як сірчана і фосфорна кислоти, карбонові кислоти, такі як оцтова і трифтороцтова кислоти, сульфокислоти, такі як метан сульфокислота, бензол сульфокислота, 1-нафталшсульфокислота, 1-бутансульфокислота, етан сульфокислота, 4-етилбензолсульфокислота, 1-гексансульфокислота, 1,5-нафталіндисульфокислота, 1-октан сульфокислота, камфорасульфо кислота, трифторметансульфокислота і п-толуол сульфокислота, а також полімерні арилсульфокислоти, такі (Rl (Rl (RI як Nation , Amberlyst або Amberhte Кращими кислотними каталізаторами є сульфокислоти, такі як метан сульфокислота, бензолсульфокислота, камфорасульфо кислота і п-толуолсульфокислота Найкращим кислотним каталізатором є п-толуолсульфокислота Звичайно розчин кислотного каталізатора в органічному розчиннику, такому як толуол, бензол, ксилол або висококиплячі галогеновані вуглеводневі розчинники, такі як 1,1,2-трихлоретан, нагрівають до температури від приблизно 80°С до приблизно 140°С і оброблюють розчином стирилсульфоксиду утому ж розчиннику Використовується надлишкова КІЛЬКІСТЬ КИСЛОТНОГО каталізатора, переважно два еквіваленти кислоти Для кращих наслідків кінцева концентрація вихідної сполуки має становити від приблизно 0,01 М до приблизно 0,2М, краще 0.05М Далі, найкращий вихід досягається, коли стирилсульфоксид повільно додають до нагрітого кислотного розчину на протязі часу від приблизно 20 хвилин до приблизно трьох годин Для кращих наслідків залишкову воду усувають з реакційного розчину шляхом застосування уловлювача Діна-Старка або екстрактора Сокслета, і реакцію очищають шляхом продувки очищеним азотом Сполуки формули І можуть бути використані як проміжні у синтезі ряду З-ароіл-2-арилбензо[Ь]тюфенів Патенти США №№4133814 і 4418068, які включені сюди як посилання, описують ці 3-ароіл-2-арилбензо[Ь]тюфени, а також способи їх приготування зі сполук формули І Удосконалений синтез групи цих З-ароіл-2-арилбензо[Ь]тюфенів зі сполук формули І, де Ri і R2 - це водень, алкоксильна група С1-С4 або арилалкок Бензтюфенову сполуку формули І, де Ri і F 2 ? це водень, алкоксильна група С1-С4 або арилалкоксильна група, ацилують сполукою формули XI, де R7 -хлор- або пдроксилгрупа, в присутності трихлориду бору або триброміду бору, краще - трихлориду бору Реакцію можна проводити у різноманітних органічних розчинниках, таких як хлороформ, метиленхлорид, 1,2-дихлоретан, 1,2,3-трихлорпропан, 1,1,2,2-тетрахлоретан, 1,2-дихлорбензол, хлорбензол і фторбензол Кращий розчинник для цього синтезу - 1,2-дихлоретан Реакція проводиться при температурі від приблизно -10°С до приблизно 25°С, краще при 0°С Цю реакцію найкраще проводити при концентрації бензтіофенової сполуки формули І від приблизно, 0,2М до приблизно 1,0М Реакція ацилування звичайно закінчується за проміжок часу від приблизно двох годин до приблизно восьми годин Коли Ri і (або) R2 - це алкоксильна група С1-С4 або арилалкоксильна група, ацилований бензтюфен перетворюється у сполуку формули XI, де Rs і (або) Rg - це гідроксили, без виділення продукту з реакції ацилування Це перетворення виконується шляхом додавання додаткового трихлориду бору або триброміду бору і нагрівання реакційної суміші Переважно до реакційної суміші додають від двох до п'яти молярних еквівалентів тригаліду бору, найкраще -три молярні еквіваленти Ця реакція проводиться при температурі від приблизно 25°С до приблизно 40°С, краще при 35°С Реакція звичайно закінчується за проміжок часу від приблизно 4 до 48 годин Реакцію ацилування або ацилування-деалкілування зупиняють спиртом або сумішшю спиртів Придатні для зупинення реакції спирти включають в себе метанол, етанол і ізопропанол Переважно до суміші реакції ацилування-деалкілування додають суміш 95 5 етанолу і метанолу (ЗА етанол) ЗА етанол може мати кімнатну температуру або бути нагрітим до кипіння, краще при КИПІННІ КОЛИ зупинення виконано у такий спосіб, сполука формули XII звичайно кристалізується з отриманої спиртової суміші Звичайно використовується від 1,25мл до 3,75мл спирту на МІЛІМОЛЬ вихідного бензотюфенового матеріалу Наступні приклади додатково ілюструють цей винахід Приклади не призначені до обмежування області винаходу у будь-який спосіб і не повинні так розглядатися Всі досліди проводилися під позитивним тиском безводного азоту Усі розчинники і реагенти були використані у стані поставки Відсотковий склад звичайно підраховували за масою (мас), за винятком розчинників для високо 15 46027 ефеїсгивної рідинної хроматографії (ВЕРХ, HPLC), які підраховували за обсягом (обе) Спектри про1 тонного ядерно-магнітного резонансу ( Н ЯМР) і 1 спектри С ядерно-магнітного резонансу ( С ЯМР) були одержані на спектрометрі АС-300 FTNMR фірми "Брукер" при частоті 300,135Мгц або на спектрометрі QE-300 фірми GE ("General Electric") при частоті 300,15Мгц Тонкошарову хроматографію на силікагелі виконували, як описано Стіллом (Still) зі співавторами, з використанням Силікагелю 60 (230-400 меш, фірми "Е Merck") Стілл та ІНШІ, Журн орг хім , (Still et al , J Org Chem) 43, 2923 (1978) Елементний аналіз на вуглець, водень і азот виконували на елементному аналізаторі Elemental Analyzer 440 фірми "Control Equipment Corporation" Елементний аналіз на сірку виконували на колориметричному елементному аналізаторі Брінкмана (Bnnkman Colonmetric Elemental Analyzer) Точки плавлення визначалися у відкритих скляних капілярах на пристрої для визначення точок плавлення Mel-Temp II або автоматичному приладі FP62 Automatic instrument фірми "Mettler" і не коректувалися Автодесорбційні мас-спектри (АДМС, FDMS) одержували з допомогою мас-спектрометрів VG 70-SE або VG ZAB-3F фірми "Vanan Instruments" Мас-спектри бомбардування вільними атомами (МСБВА, FABMS) з високою роздільною здатністю одержували з допомогою мас-спектрометра VG ZAB-2SE фірми "Vanan Instruments" Виходи in 6-метокси-2-(4-метоксифеніл)бензо[Ь]тюфену визначалися шляхом високоефективної рідинної хроматографії (ВЕРХ, HPLC) у порівнянні з аутентичними пробами цієї сполуки, приготованими за допомогою опублікованих процедур синтезу Див патент США № 4 133 814 Звичайно проби реакційної суміші розводили ацетонітрилом і розведену пробу аналізували шляхом HPLC на колонці Zorbax RX-C8 (4,6мм х 25см) з ультрафіолетовим детектуванням (280нм) Для цього аналізу використовувалася така лінійно-градієнтна розчинникова система Градієнтна розчинникова система Час (хвилин) 0 2 20 35 37 45 А(%) 50 50 20 20 50 50 Б(%) 50 50 80 80 50 50 Позначення А - 0,01 М водний натрій фосфат (рН 2,0) Б - ацетонітрил КІЛЬКІСТЬ (у відсотках) 6-пдрокси-2-(4-пдроксифеніл)-3-[4-(2-піперидиноетокси)бензоіл]-бензо[Ь]тюфен пдрохлориду в кристалічному матеріалі (вихід) визначалася наступним методом Пробу твердого кристалічного матеріалу (5мг) відважували у мірну колбу ЮОмл і розчиняли у суміші 70/30 (обе) 75мМ калій-фосфатного буфера (рН 2,0) і ацетонітрилу Аліквотна проба цього розчину (Юмкл) аналізувалася шляхом високоефективної 16 рідинної хроматографії на колонці Zorbax RX-C8 (25см х 4,6мм внутр діам , частинка 5мкм) з ультрафіолетовим детектуванням (280нм) Для цього аналізу використовувалася така градієнтна розчинникова система Градієнтна розчинникова система (вихід) Час (хвилин) 0 12 14 16 25 А (%) 70 70 25 70 70 Б(%) ЗО ЗО 75 ЗО ЗО Позначення А - 75мМ КН2РО4 буфер (рН 2,0) Б - ацетонітрил Вміст у відсотках 6-пдрокси-2-(4-пдроксифеніл)-3-[4-(2-піперидиноетокси)бензоіл]-бензо[Ь]тюфен пдрохлориду у зразку обчислявся з використанням площі піка, нахилу (т) і ширини піка у ПІДНІЖЖІ (Ь) калібрувальної кривої за наступним рівнянням %аеоіао = іеїйа i 3 e6-b х Tanya ібїае ,іе m iana ібїае, іа КІЛЬКІСТЬ (ВМІСТ у відсотках) розчинника, такого як 1,2-дихлоретан, присутнього у кристалічному матеріалі, визначалася газовою хроматографією Пробу твердого кристалічного матеріалу (50мг) відважували у мірну колбу Юмл з розчиняли у розчині 2-бутанолу (0,025мг/мл) у диметил сульфоксиді Проба цього розчину аналізувалася на газовому хроматографі з використанням колони DB Wax (30м х 0,53мм внутр діам , частинка 1мкм) з об'ємною швидкістю газу-носія через колону Юмл/хвил і полуменево-юнізаційним детектуванням Температура колони підвищувалася від 35°С до 230°С за 12 хвилин КІЛЬКІСТЬ розчинника визначалася порівнянням з внутрішнім стандартом (2-бутанол) Приклад 1 Е-трет-бутил-4,4'-диметоксистильбенілсульфоксид А Приготування Е-трет-бутил-4,4'-диметоксистильбенілсульфіду Розчин дезоксианізошу (12,82г) у тетрапдрофурані (ЮОмл) був оброблений хлоридом титану (IV) (10,43г) При краплинному додаванні хлориду титану (IV) реакційну суміш охолоджували, щоб підтримувати температуру нижче 35°С Після закінчення додавання отриману суміш перемішували при 30°С Після додаткових ЗО хвилин ця суміш була оброблена розчином 2-метил-2-пропантюлу (6,76мл) і триетиламіну (16,70мл) у тетрапдрофурані (15мл) Стриману суміш перемішували при 50°С Через дві години суміш було додано до десятивідсоткового карбонату натрію (500мл) Отриману суміш було екстраговано метиленхлоридом З'єднані метиленхлорид ні екстракти було висушено над сульфатом магнію, відфільтровано і сконцентровано in vacuo (під вакуумом), що дало 17,2г масла, яке кристалізувалося при охолодженні до кімнатної температури Цей кристалічний матеріал було перекристалізовано з гарячого 18 17 46027 етанолу, що дало 12,3г вказаної у назві прикладу В Приготування 2-трет-бутил-4,4'-дисполуки Точка плавлення 71 - 73°С метоксистильбенілсульфоксиду Обчислено для C20H24O2S С 73,13, Н 7,36, S Сполуку з прикладу 2Б було перетворено у 9,76 вказану в назві прикладу сполуку шляхом процедури, практично такої ж, як описано у прикладі 1Б Знайдено С 73,37, Н 7,51, S 9,87 1 Б Приготування Е-трет-бутил-4,4'-диметоксиН ЯМР (CDCI3) 5 7,61 (d, H), 7,56 (d, H), 7,1 (s, стильбенілсульфоксиду Н), 6,9 (dd, 2Н), 3,83 (s, ЗН), 1,05 (s, 9H) 13 Кристалічну сполуку, приготовану як описано у С ЯМР(СОСІз) 5 142, 132,5, 131, 118, 117, прикладі 1А, було розчинено у толуолі (150мл) і 56, 24 отриманий розчин охолоджено приблизно до Обчислено для C20H24O3S С 69,74, Н 7,02 20°С Холодний розчин було оброблено пероцтоЗнайдено С 69,98, Н 6,94 вою кислотою (32% обе у розведеній оцтовій кисПриклад З лоті, 1,24г) на протязі 10 хвилин Отримана суміш Е і Z-трет-бутил 4,4'-диметоксистильбенілсубула екстрагована насиченим сульфітом натрію і льфоксид А Приготування трет-бутил-4-метоксирозсолом Органічна фаза була сконцентрована m бензилсульфіду vacuo Залишок був перекристалізований з етилаДо розчину 4-метоксибензилового спирту цетату/гептану, що дало 14,11г вказаної у назві (10,13г) і йодиду цинку (11,7г) у 1,2-дихлоретані прикладу сполуки Точка плавлення 104°С (з роз(120мл) було додано 2-метил-2-пропантюл кладом) (9,92мл) однією порцією Отриману суміш переміОбчислено для C20H24O3S С 69,74, Н 7,02, S шували при кімнатній температурі Через прибли9,31 зно 18 годин реакційну суміш було розведено водою (ЮОмл) і метиленхлоридом (ЮОмл) ОрганіЗнайдено С 69,47, Н 7,04, S 9,54 чну фазу було виділено, висушено над сульфатом Приклад 2 магнію, відфільтровано і сконцентровано in vacuo, 2-трет-бутил-4,4'-диметоксистильбенілсульщо дало 14,4г масла фоксид 1 А Приготування трет-бутил-4-метоксибензилН ЯМР (CDCI3) 5 7,28 (d, 2H), 6,85 (d, 2H), сульфіду 3,77 (s, ЗН), 3,73 (s, 2H), 1,36 (s, 9H) 13 До розчину 4-метоксибензилового спирту С ЯМР (CDCI3) 5 13О, 114, 56, 35, 32 (10,13г) і йодиду цинку (11,7г) у 1,2-дихлоретані Обчислено для Ci 2 Hi 8 0S С 68,52, Н 8,63 (120мл) було додано 2-метил-2-пропантюл Знайдено С 68,8, Н 8,67 (9,92мл) однією порцією Отриману суміш переміБ Приготування трет-бутил-4-метоксибензилшували при кімнатній температурі Через приблисульфоксиду зно 18 годин реакційну суміш було розведено воРозчин сполуки, приготованої як описано у дою (ЮОмл) і метиленхлоридом (ЮОмл) Органіприкладі ЗА (14,4г), у 1,2-дихлоретані (50мл) було чну фазу було виділено, висушено над сульфатом охолоджено приблизно до 5°С і холодний розчин магнію, відфільтровано і сконцентровано in vacuo, було оброблено пероцтовою кислотою (32% обе у що дало 14,4г масла розведеній оцтовій кислоті, 14,2мл) на протязі ЗО 1 Н ЯМР (CDCI3) 5 7,28 (d, 2H), 6,85 (d, 2H), хвилин Після закінчення додавання пероцтової 3,77 (s, ЗН), 3,73 (s, 2H), 1,36 (s, 9H) кислоти реакційну суміш було оброблено розсо13 С ЯМР (CDCI3) 5 13О, 114, 56, 35, 32 лом і бікарбонатом натрію Органічну фазу було виділено, висушено над сульфатом магнію, відфіОбчислено для Ci 2 Hi 8 0S С 68,52, Н 8,63 льтровано і сконцентровано у жовтий осадок Цей Знайдено С 68,8, Н 8,67 залишок було оброблено гексаном (ЮОмл), і Б Приготування 7-трет-бутил-4,4'-диметоксисотриману суміш перемішували при кімнатній темтильбенілсульфіду пературі Через приблизно 18 годин суміш було Розчин сполуки, приготованої як описано у відфільтровано і тверду фазу промито гексаном прикладі 2А (2,51г) у тетрапдрофурані (50мл) було (100мл) Твердий матеріал був висушений m охолоджено приблизно до -20°С Цей холодний vacuo, і це дало 14,07г сполуки, вказаної у назві розчин було оброблено розчином н-бутиллітію у прикладу Точка плавлення 124 - 126°С гексані (1,6М, 7,47мл) на протязі 10 хвилин Отри1 маному розчину дали розігрітися до приблизно Н ЯМР (CDCI3) 5 7,26 (d, 2H), 6,89 (d, 2H), 0°С на протязі 35 хвилин Цей холодний розчин 3,79 (d, H), 3,78 (s, ЗН), 3,58 (d, H), 1,3 (s, 9H) було оброблено п-анізальдепдім (1,46мл) Після 1 Х ЯМР (CDCI3) 5 132, 114, 56, 53, 23 додаткових 15 хвилин реакційний розчин було обОбчислено для Ci 2 Hi 8 0 2 S С 63,68, Н 8,02 роблено метиленсульфонілхлоридом (0,95мл) Знайдено С 63,72, Н 7,93 В Отриманому реакційному розчину дали розігрітися Приготування Е і 7-трет-бутил-4,4'-диметоксидо кімнатної температури Після додаткових 45 стильбенілсульфоксиду хвилин реакційну суміш було оброблено розчином Розчин сполуки, приготованої як описано у трет-бутилату калію у тетрапдрофурані (1,0М, прикладі ЗБ (10,0г), у тетрапдрофурані (140мл) 12,0мл) Після додаткових 45 хвилин реакцію були було охолоджено до температури від приблизно припинено доданням 1N хлористоводневої кис30°С до -25°С (у бані з сухого льоду з ацетоном) лоти (12,0мл) Органічну фазу було виділено, виЦей холодний розчин було оброблено н-бутиллісушено над сульфатом магнію, відфільтровано і тієм у циклогексані (1,6М, 27,65мл) на протязі 25 сконцентровано у масло (4,4г) хвилин Після перемішування на протязі 35 хвилин 1 Н ЯМР (CDCI3) 5 7,95 (d, H), 7,05 (s, H), 6,9 (d, реакційну суміш було оброблено п-анізальдепдом Н), 6,8 (dd, 2Н), 3,75 (s, ЗН), 0,95 (s, 9H) (5,4мл) Баню з сухого льоду з ацетоном усунули і 13 реакційній суміші дали розігрітися приблизно до С ЯМР (CDCI3) 5 153, 139, 137, 114, 56, 32 20 19 46027 20°С Цю суміш було оброблено метиленсульфо6-метокси-2-(4-метоксифеніл)бензо[Ь]тюфен нілхлоридом (3,5мл) При додаванні метиленсуРозчин моногідрату п-толуолсульфокислоти льфонілхлориду температура реакційної суміші (2,49г) у толуолі (108мл) було нагріто до кипіння зі піднялася від приблизно 20°С до приблизно 35°С зворотним холодильником, і воду видалили, даСуміш було охолоджено до приблизно 25°С, а далі вши їй зібратися в уловлювачі Діна-Старка Розчин оброблено розчином трет-бутилату калію у тетрасполуки, приготованої, як то описано у прикладі 1 пдрофурані (1М, 50,9мл) Після додаткових 35 (9,00г), в толуолі (32мл) додавався до киплячого хвилин перемішування реакційну суміш було оброзчину кислоти на протязі шести годин Після роблено 1N хлористоводневою кислотою (51,0мл) закінчення додавання до реакційного розчину було Фази було розділено, органічний шар висушено додано чистий етанол (35мл) і отриманій суміші над сульфатом магнію, відфільтровано і сконцентдозволили охолонути до кімнатної температури ровано у масло (16,67г) Цей матеріал був викориПриблизно через 18 годин осадок був виділений станий на наступному етапі без подальшої очисшляхом фільтрування Цей осадок був промитий тки Спектри вуглецевого і протонного ЯМР були сумішшю толуолу з чистим етанолом (4 1, 29мл) і подібні до тих, які одержали для сполуки, приготовисушений in vacuo при 40°С на протязі приблизно ваної, як описано у прикладах 1 і 2 18 годин, що дало 4,86г твердої речовини Ця сполука була ідентична сполуці, приготованій за доПриклад 4 помогою опублікованої процедури Точка плав2-трет-бутил-4,4'-дилення 199-200°С метоксистильбенілсульфоксид Розчин сполуки, приготованої як описано у прикладі ЗБ (3,0г), у тетрапдрофурані (40мл) було охолоджено до приблизно -15°С Цей холодний розчин було оброблено н-бутиллітієм у циклогексані (1,6М, 8,3мл) на протязі 15 хвилин Після перемішування на протязі десяти хвилин реакційну суміш було зігріто до 0°С і оброблено п-анізальдепдом (1,61мл) Баню було усунено і реакційній суміші дали розігрітися до приблизно кімнатної температури Цю суміш було оброблено ацетилхлоридом (0,95мл) Приблизно через одну годину реакційну суміш було оброблено розчином третбутилату калію у тетрапдрофурані (1М, 16,0мл) Після додаткових 1,5 годин перемішування реакційну суміш було оброблено 1N хлористоводневою кислотою (17,0мл) Фази було розділено, органічний шар висушено над сульфатом магнію, відфільтровано і сконцентровано у масло (5,26г) Цей матеріал був використаний на наступному етапі без подальшої очистки Спектри вуглецевого і протонного ЯМР були подібні до тих, які одержали для сполуки, приготованої, як описано у прикладі 2 Приклад 5 6-метокси-2-(4-метоксифеніл)бензо[Ь]тюфен Розчин моногідрату п-толуолсульфокислоти (2,25г) у толуолі (60мл) було нагріто до кипіння зі зворотним холодильником, і воду видалили, давши їй зібратися в уловлювачі Діна-Старка Застосовуючи продувку газоподібним азотом, який випускали через верхню частину конденсатора, розчин сполуки, приготованої, як то описано у прикладі 1 (2,04г), в толуолі (ЗЗмл) додавався до киплячого розчину кислоти на протязі 1,5 годин Отриману суміш було охолоджено до приблизно 5°С під азотною продувкою, а далі оброблено водою (8мл) Отриману суспензію перемішувано на протязі трьох годин Далі суспензію було відфільтровано і кристалічний продукт промито водою (8мл) і ацетоном (8мл) Кристалічний продукт був висушений in vacuo при 40°С на протязі приблизно 18 годин, і це дало 1,30г сполуки, вказаної у назві прикладу, у вигляді світлої рудувато-коричневої твердої речовини Ця сполука була ідентична сполуці, приготованій за допомогою опублікованої процедури Точка плавлення 196 - 199°С Приклад 6 Приклад 7 6-пдрокси-2-(4-пдроксифеніл)-3-[4-(2-піперидиноетокси)-бензоіл]бензо[Ь]тюфен пдрохлорид (у вигляді розчину в 1,2-дихлоретані) А Приготування стил-4-(2-піперидиноетокси)бензоату Суміш етил-4-пдроксибензоату (8,31г), 1-(2хлоретил)піперидин монопдрохлориду (10,13г), вуглекислого калію (16,59г) і метилетилкетону (60мл) було нагріто до 80°С Через одну годину суміш було охолоджено приблизно до 55°С і оброблено додатковим 1-(2-хлоретил)піперидин монопдрохлоридом (0,92г) Отриману суміш було нагріто до 80°С Реакцію контролювали шляхом тонкошарової хроматографії (TLC), застосовуючи силікагельні платівки і суміш етилацетату, ацетонітрилу і триетиламшу (10 6 1, обе) Додаткові порції 1 -(2-хлоретил)піперидин пдрохлориду додавалися, доки не було витрачено весь вихідний етил-4-пдроксибензоат Після закінчення реакції реакційну суміш обробили водою (60мл) і дали їй охолонути до кімнатної температури Водяний шар був усунений, а органічний шар сконцентровано m vacuo при 40°С і 40мм рт ст (5,ЗкПа) Отримане масло було використане на наступному етапі без подальшої очистки Б Приготування пдрохлориду 4-(2-піперидиноетокси)бензойноі кислоти Розчин сполуки, приготованої, як то описано у прикладі 7А (приблизно 13,87г), у метанолі (ЗОмл) був оброблений 5N гідроксидом натрію (15мл) і нагрітий до 40°С Через 4,5 години була додана вода (40мл) Отриману суміш було охолоджено до 5 - 10°С, а потім була повільно додана концентрована хлористоводнева кислота (18мл) Під час підкислення кристалізувалася вказана у назві сполука Цей кристалічний продукт був зібраний шляхом фільтрації і висушений in vacuo при 40 - 50°С, і це дало вихід 83% сполуки, вказаної у назві прикладу Точка плавлення 270 - 271 °С В Приготування пдрохлориду 4-(2-піперидиноетокси)бензоілхлориду Розчин сполуки, приготованої, як то описано у прикладі 7Б (30,01г), і диметилформаміду (2мл) у метиленхлориді (500мл) був оброблений оксалілхлоридом (10,5мл) на протязі ЗО - 35 хвилин Після перемішування на протязі 18 годин реакція була 22 21 46027 проаналізована на повноту шляхом аналізу HPLC (52мл) було охолоджено приблизно до 0°С ГазоДо реакційної суміші може бути доданий додаткоподібний трихлористии бор був сконденсований у вий оксалілхлорид, якщо присутня вихідна карбохолодному градуйованому циліндрі (2,8мл) і доданова кислота Після завершення реакційний розний до холодної суміші, описаної вище Після вочин було випаровано до сухості in vacuo Залишок сьми годин при 0°С реакційна суміш була оброббуло розчинено у метиленхлориді (200мл) і отрилена додатковим трихлористим бором (2,8мл) маний розчин було випаровано до сухості Ця проОтриманий розчин був нагрітий до 35°С Через 16 цедура розчинення-випаровування повторювагодин реакція була скінчена лася, щоб одержати сполуку, вказану у назві приМетанол (ЗОмл) було оброблено отриманою кладу, у твердому стані Сполуку, вказану у назві вище реакційною сумішшю на протязі 20 хвилин прикладу, можна зберігати у твердому стані або у при температурі кипіння метанолу зі зворотним стані 0,2-мольного розчину в метиленхлориді холодильником Отриману суспензію перемішу(500мл) вали при 25°С Через одну годину кристалічний продукт був відфільтрований, промитий холодним Г Приготування 6-пдрокси-2-(4-пдроксифеметанолом (8мл) і висушений in vacuo при 40°С, ніл)-3-[4-(2-піперидиноетокси)-бенщо дало 5,14г сполуки, вказаної у назві прикладу зоіл]бензо[Ь]тюфен пдрохлориду (у вигляді розТочка плавлення 225°С чину в 1,2-дихлоретані) Суміш сполуки, приготованої, як описано у Вихід 86,8% прикладі 5 або 6 (2,92г), сполуки, приготованої, як 1,2-дихлорстан 6,5% (газова хроматографія) описано у прикладі 7В (3,45г), і 1,2-дихлоретану ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 333/56, C07D 333/54, C07D 333/58
Мітки: бензо[b]тіофенів, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/11-46027-sposib-oderzhannya-benzobtiofeniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання бензо[b]тіофенів</a>
Попередній патент: Робочий орган розпушувача
Наступний патент: Спосіб розробки надто зближених пластів в умовах слабких вміcних порід
Випадковий патент: Фільтрувальний елемент до фільтра немцова