Пептиди, фармацевтична композиція з протипухлинною активністю та спосіб лікування пухлин у ссавців
Формула / Реферат
1. Пептиди формули І:
, І
де R1 позначає метил, етил або ізопропіл;
R2 позначає водень, метил або етил;
R1-N-R2 разом можуть утворювати піролідинове кільце;
А позначає залишок валілу, ізолейцилу, лейцилу, 2-трет-бутилгліцилу, 2-етилгліцилу, норлейцилу або норвалілу;
В позначає залишок N-метил-валілу, -лейцилу, -ізолейцилу, -норвалілу, -норлейцилу, -2-трет-бутилгліцилу, -3-трет-бутилаланілу або -2-етилгліцилу;
D позначає залишок 3,4-дегідропролілу, 4-фторпролілу, 4,4-дифторпролілу, азетидин-2-карбонілу, 3-метилпролілу, 4-метилпролілу або 5-метилпролілу;
Е позначає залишок пролілу, гомопролілу, гідроксипролілу або тіазолідин-4-карбонілу;
F позначає залишок валілу, 2-трет-бутилгліцилу, ізолейцилу, лейцилу, 2-циклогексилгліцилу, норлейцилу, норвалілу, неопентилгліцилу, аланілу, -аланілу або аміноізобутироїлу;
X позначає алкіл (бажано C2-5), циклопропіл або циклопентил;
t позначає 0 або 1; і
К позначає алкоксигрупу (бажано С1-4), бензилоксигрупу або заміщену чи незаміщену
аміногрупу;
та їх солі з фізіологічно прийнятними кислотами.
2. Фармацевтична композиція з протипухлинною активністю, яка включає активний інгредієнт на основі пептиду та фармацевтично прийнятний носій, яка відрізняється тим, що як пептид вона включає принаймні одну сполуку за п.1 в терапевтично ефективній кількості.
3. Спосіб лікування пухлини у ссавця, який включає введення ссавцю пептиду, який відрізняється тим, що як пептид використовують принаймні одну сполуку за п.1 в терапевтично ефективній кількості.
Текст
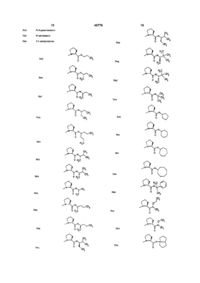
1 Пептиди формули І R1R2N-CHX~CO~A-B-D-E-(F)rK , де R1 позначає метил, етил або ізопропіл, R2 позначає водень, метил або етил, R1-N-R2 разом можуть утворювати піролідинове кільце, А позначає залишок валілу, ізолейцилу, лейцилу, 2-трет-бутилгліцилу, 2-етилгліцилу, норлейцилу або норвалілу, В позначає залишок N-метил-валілу, -лейцилу, ізолейцилу, -норвалілу, -норлейцилу, -2-третбутилгліцилу, -3-трет-бутилаланілу або -2етилгліцилу, D позначає залишок 3,4-депдропролілу, 4фторпролілу, 4,4-дифторпролілу, азетидин-2 Відомо, ЩО пептиди, ізольовані з продуктів морського походження, такі як доластатин-10 (США №4816444) та доластатин-15 (ЕР-А-398558), мають сильну інгібуючу дію на ріст клітин (див Biochem Pharmacology, 40, №8, 1859 - 64, 1990, J Natl Cancer Inst, 85, 483 - 88, 1993, та посилання у них) На основі одержаних цікавих результатів експериментальних досліджень пухлинних систем in vivo зараз проводяться подальші доклінічні дослідження цих природних продуктів для того, щоб розпочати КЛІНІЧНІ дослідження у хворих на рак пацієнтів Однак, природні продукти мають недоліки, такі як низька розчинність у водних розчинниках та карбонілу, 3-метилпролілу, 4-метилпролілу або 5метилпролілу, Е позначає залишок пролілу, гомопролілу, пдроксипролілу або тіазолідин-4-карбонілу, F позначає залишок валілу, 2-трет-бутилгліцилу, ізолейцилу, лейцилу, 2-циклогексилгліцилу, норлейцилу, норвалілу, неопентилгліцилу, аланілу, Р -аланілу або аміноізобутироілу, X позначає алкіл (бажано С25), циклопропіл або циклопентил, t позначає 0 або 1, і К позначає алкоксигрупу (бажано Сі 4), бензилоксигрупу або заміщену чи незаміщену аміногрупу, та їх солі з фізіологічно прийнятними кислотами 2 Фармацевтична композиція з протипухлинною активністю, яка включає активний інгредієнт на основі пептиду та фармацевтично прийнятний носій, яка відрізняється тим, що як пептид вона включає принаймні одну сполуку за п 1 в терапевтично ефективній КІЛЬКОСТІ 3 Спосіб лікування пухлини у ссавця, який включає введення ссавцю пептиду, який відрізняється тим, що як пептид використовують принаймні одну сполуку за п 1 в терапевтично ефективній КІЛЬКОСТІ дорогі компоненти, потрібні для синтезу Даний винахід стосується нових пептидів та їх похідних, які мають поліпшений терапевтичний потенціал для лікування пухлинних захворювань порівняно з доластатином-15 Більш того, сполуки за цим винаходом можуть бути легко синтезовані, як детально описано нижче Сполуки за цим винаходом включають нові пептиди формули І R1R2N-CHX-CO-A-B-D-E-(F)t-K I де R1 позначає метил, етил або ізопропіл, R2 позначає водень, метил або етил, R1-N-R2 разом можуть утворювати піролідинове кільце, q (О ^^ ^^ (О 46776 А позначає залишок валілу, ізолейцилу, лейцилу, 2-трет-бутилгліцилу, 2-етилгліцилу, норлейцилу або норвалілу, В позначає залишок N-метил-валілу, -лейцилу, -ізолейцилу, -норвалілу, -норлейцилу, -2-третбутилгліцилу, -3-трет-бутилаланілу або -2етилгліцилу, D позначає залишок 3,4-дипдропролілу, 4фторпролілу, 4,4-дифторпролілу, азетидин-2карбонілу, 3-метилпролілу, 4-метилпролілу або 5метилпролілу, Е позначає залишок пролілу, гомопролілу, пдроксипролілу або тіазолідин-4-карбонілу, F позначає залишок валілу, 2-третбутилгліцилу, ізолейцилу, лейцилу, 2циклогексилгліцилу, норлейцилу, норвалілу, неопентилгліцилу, аланілу, р-аланілу або аміноізобутироілу, X позначає алкіл (бажано С25), циклопропіл або циклопентил, t позначає 0 або 1, і К позначає алкоксигрупу (бажано Сі 4), бензилоксигрупу або заміщену чи незаміщену аміногрупу, та їх солі з фізіологічне прийнятними кислотами Даний винахід описує також способи одержання сполук формули І, фармацевтичні композиції, що містять такі сполуки разом з фармацевтичне прийнятним носієм, та способи їх використання для лікування раку у ссавців Конкретно, К може позначати Сі 4-алкокси, бензилокси, -NH2, -NH-C1 12-алкіл, -NH-C(CH3)-CN, NH-C(CH3)CCH, -NH-C(CH3)2C=CH2, -NHC(CH3)2CH2CH2OH, -NH-C3 8-ЦИКЛоалкіл, -NH[3,3,0]-біциклооктил, норефедрил, норпсевдоефедрил, -NH-ХІНОЛІЛ, -NH-піразил, -ІЧН-СНгбензімідазоліл, -NH-адамантил, -ІЧН-СНгадамантил, -І\ІН-СН(СНз)-феніл, -NH-C(CH3)2феніл, -N(Ci 4-алкокси)-Сі 4-алкіл, -N(Ci 4-алкокси)СН2-феніл, -N(Ci 4-алкокси)-феніл, -N(CH3)OBzl, МН-(СН2)у-феніл (v = 0, 1, 2 або 3), -NH-(CH2)mнафтил ( т = 0 або 1), -МН-(СН2)и-бензпдрил (w = 0, 1 або 2), -NH-біфеніл, -NH-тридил, -NH-CH2тридил, -ІЧН-СНг-СНг-тридил, -NH-бензотіазоліл, -NH-бензоізотіазоліл, -NH-бензопіразоліл, -NHбензоксазоліл, -І\ІН-(СН2)т-флуореніл ( т = 0 або 1), -NH-тримідил, -г\ІН-(СН2)т-шданіл ( т = 0 або 1), -NH-(CH2CH2O)y-CH3 (у = 0, 1, 2, 3, 4 або 5), -NH(СН2СН2О)У-СН2СН3 (у = 0, 1, 2, 3, 4 або 5), (СН2СН2О)у-СН3 (у = 0, 1, 2, 3, 4 або 5), (СН2СН2О)у-СН2СН3 (у = 0, 1, 2, 3, 4 або 5), -NCH3NH-C6H5, -NCHs-NH-CHb-CeHs, або К позначає f ^ _з - д о -с., -MJLJ -««ЧД - « Ч Д -ИЧ"! -Є0ЄОЦ *«*Ч\ і ЕХ C(CE S ), -N«4 j -Ч I J -ЛЗ S1 CQOCH, ci CH. -на cooEt ;? 4-s ci " NH '^\ l ! cooca. CQOCH, CH, 2, С \ -ын-Ч, 1 ев, о V-OEt •4;-iJ N 0 s s ~u Перевага надається сполукам формули І, у яких замісники Ri, R2, А, В, D, Е, X, F та t мають такі значення R1 позначає метил або етил, R2 позначає водень, метил або етил, А позначає залишок валілу, ізолейцилу, 2трет-бутилгліцилу, В позначає залишок N-метил-валілу, -лейцилу, 46776 -ізолейцилу, -2-трет-бутилгліцилу, фумарова кислота, яблучна кислота, бурштинова кислота, малонова кислота, сірчана кислота, LD позначає залишок 3,4-депдропролілу, 4глутамшова кислота, L-аспарапнова кислота, пірофторпролілу, азетидин-2-карбонілу, 3виноградна кислота, слизова кислота, бензойна метилпролілу або 5-метилпролілу, кислота, глюкуронова кислота, щавлева кислота, Е позначає залишок пролілу, гомопролілу, пдаскорбінова кислота та ацетилгліцин роксипролілу або тіазолідин-4-карбонілу, F позначає залишок D-валілу, 2-третНові сполуки можуть бути одержані методами, бутилгліцилу, D-ізолейцилу, D-лейцилу або аміновідомими у хімії пептидів Так, пептиди можуть ізобутироілу, бути зібрані шляхом послідовного приєднання амінокислот або шляхом з'єднання придатних малих X позначає -СН(СН3)2, -С(СН3)з або фрагментів пептидів При послідовному складанні СН(СНз)СН2СН3, пептидний ланцюг поступово подовжується, почиt позначає 0 або 1, і наючи з С-кінця, по одній амінокислоті за раз При К бажано має такі значення з'єднанні фрагментів можна зв'язувати фрагменти -ОС(СН3)з, -NHCH3, -NHCH2CH3, -NH(CH2)CH3, різної довжини, а самі фрагменти у свою чергу -NH(CH2)3CH3, -NH(CH2)4CH3, -NH(CH2)5CH3, можуть бути одержані шляхом послідовного склаNH(CH2)6CH3, -NH(CH2)7CH3, -NHCH(CH3)2, дання амінокислот чи також з'єднанням фрагменNHCH(CH3)CH2CH3, -NHCH(CH3)CH2CH2CH3, тів NHCH(CH2CH3)2, -NH(CH2CH2CH3)2, -NHC(CH3)3, NHCH(CH2CH3)2CH2CH2CH3, -NHCH(CH3)CH(CH3)2, Як при послідовному складанні, так і при з'єд-NHCH(CH2CH3)CH(CH3)2, -NHCH(CH3)C(CH3)3, нанні фрагментів блоки треба зв'язувати шляхом NH-циклопропіл, -NH-циклобутил, -NHутворення амідного зв'язку Придатними для цього методами є ферментативні та ХІМІЧНІ циклопентил, -NH-циклогексил, -NH-циклогептил, NH-циклооктил, -г\ІН-біцикло[3,3,0]октил, ХІМІЧНІ методи утворення амідного зв'язку деN(CH3)OCH3, -N(CH3)OCH2CH3, тально описані у Mueller, Methoden der orgamschen Chemie, Vol XV/2, pp 1 - 364, Thieme Verlag, N(CH3)OCH2CH2CH3, -N(CH3)OCH(CH3)2, Stuttgart, 1974, Stewart, Young, Solid Phase Peptide N(CH2CH3)OCH3, -N(CH2CH3)OCH2CH3, Synthesis, pp 31 - 34, 71 -82, Pierce Chemical N(CH(CH3)2)OCH3, -N(CH3)OCH2C6H5, Company, Rockford, 1984, Bodanszky, Klausner, N(OCH3)CH2C6H5, -N(CH3)OC6H5, -NH-CH2-C6H5, Ondetti, Peptide Synthesis, pp 85 - 128, John Wiley NH(CH2)2C6H5, -NH(CH2)3C6H5, -NHCH(CH3)C6H5, & Sons, New York, 1976, та інших стандартних роNHC(CH3)2C6H5, -NHC(CH3)2CH2CH3, ботах по хімії пептидів Особлива перевага надаNHC(CH3)(CH2CH3)2, -NHCH(CH3)CH(OH)C6H5, ється азидному методу, методу симетричних та МНСН2-циклогексил, -NH-CH2CF3, -NHCH(CH2F)2, змішаних ангідридів, методу синтезуємих in situ NHC(CH3)2CH2CH2OH, -NH(CH2CH2O)2CH2CH3, або попередньо синтезованих ефірів, використанNHC(CH3)2CH(CH3)2, -NHC(CH3)2CN, ню захищених уретановою групою N-карбоксиМНС(СНз)2ССН, норефедрил, норпсевдоефедрил, анпдридів амінокислот та утворенню амідного -NH-ХІНОЛІЛ, -NH-піразил, -І\ІН-адамантил(2), -NHзв'язку за допомогою реагентів/активаторів для адамантил(1), -NH-СНг-адамантил, -NH-CH2проведення реакції сполучення, особливо дицикнафтил, -NH-бензпдрил, -NH-біфеніл, -NHлогексилкарбодиміду (DCC), дмзопропілкарбодиміпіридил, -NH-СНг-піридил, -ІЧН-СНг-СНг-піридил, ду (DIG), 1-етоксикарбоніл-2-етокси-1,2NH-бензотіазоліл, -NH-бензоізотіазоліл, -NHбензопіразоліл, -NH-бензоксазоліл, -NHдипдрохшоліну (EEDQ), 1-етил-3-(3флуореніл, -NH-піримідил, -І\ІН-СН2-(4-метил)диметиламшопропіл)карбодмміду пдрохлориду тіазоліл(2), -І\ІН-СН2-фураніл(2), -МН-СН 2 -ТІЄНІЛ(2), (EDCI), н-пропанфосфонового ангідриду (РРА), -МН-СН2-(5-метил)-тієніл(2), -І\ІН-тіазоліл(2), -NHМ,І\І-біс(2-оксазолідиніл)-амідофосфорил хлорид ізоксазоліл(З), -МН-(3-метил)ізоксазоліл(5), -NH-(3(BOP-СІ), бром-трис-піролідинфосфоній гексафтометил)ізотіазоліл(5), -NH-(2рфосфат (РуВгор), дифенілфосфорилазид (DPPA), реагент Кастро (ВОР, РуВор), солі Отрифторметил)тіадіазоліл(5), -NH-(2бензотріазоліл-М,г\І,г\Г,І\Г-тетраметилуронію циклопропіл)тіадіазоліл(5), -І\ІНС(СНз)2С=СН2, або (HBTU), солі O-a3a6eH3OTpia3onin-N,N,N',N'К може позначати тетраметилуронію(НАТІІ), діетилфосфорил ціанід M (DEPCN), 2,5-дифеніл-2,3-дипдро-3-оксо-4~ \ J "u° ~ vJ пдрокситюфен дюксид (реагент Штегліха, HOTDO) та 1,1'-карбонілдимідазол (CDI) Реагенти для проведення реакції сполучення можуть застосовуваN / тись самі або у сполученні з домішками, такими як г\І,г\І-диметил-4-амінопіридин (DM АР), NЦІ приклади Ілюструють, але не обмежують пдроксибензотриазол (HOBt), Nобсяг даного винаходу пдроксибензотриазин (HOOBt), азабензотриазол Пептиди формули І складаються із L(HOAt), N-пдроксисукцинімід (HOSu) або 2амінокислот, але F може також бути Dпдроксипіридин амінокислотою Якщо при ферментативному синтезі пептидів Нові сполуки можуть також бути одержані у визвичайно можна обійтись без захисних груп, то при гляді солей з фізіологічне прийнятними кислотами, хімічному синтезі для обох реагентів потрібен оботакими як хлористоводнева кислота, лимонна ротний захист реакційноздатних груп, які не беруть кислота, винна кислота, молочна кислота, фосфоучасті в утворенні амідного зв'язку При хімічному рна кислота, м етан сул ьфо нова кислота, оцтова синтезі пептидів перевага надається трьом метокислота, мурашина кислота, малеїнова кислота, 8 46776 ної основи Умови, за яких можливо провести віддам введення захисних груп це методи введення щеплення для смол різних типів, описані у бензилоксикарбонільної (Z), т-бутоксикарбонільної літературі Реакціями відщеплення, які найчастіше (Вос) та 9-флуоренілметоксикарбонільноі (Fmoc) використовуються, є такі з кислотним чи паладієгруп У кожному випадку це стосується захисної вим каталізатором, особливо відщеплення у рідгрупи на альфа-амшогрупі фрагмента, що приєдкому безводному фтористому водні, у безводній нується до ланцюга Детальний огляд захисних трифторметансульфокислоті, у розведеній чи конгруп для амінокислот наведено у Mueller, центрованій трифторооцтовій кислоті, каталізоваMethoden der organischen Chemie, Vol XV/1, pp не паладієм відщеплення у ТГФ чи сумішах ТГФ20 - 906, Thieme Verlag, Stuttgart, 1974 Реакція ДХМ у присутності слабкої основи, такої як морсполучення фрагментів, що використовуються для фолін, або відщеплення у суміші оцтова кислотаскладання пептидного ланцюга, може бути проведихлорметан-трифторетанол У залежності від дена у розчині, у суспензії, або за методом, подібобраних захисних груп, вони можуть бути збереним до того, який було описано Mernfield у J Amer жені або також можуть бути відщеплені за умов Chem Soc , 85 (1963) 2149 Особлива перевага проведення реакції відщеплення Часткове обезнадається методам, за якими сполучення пептидів захищення пептиду може також бути потрібним у проводиться послідовно або шляхом з'єднання разі необхідності проведення певних реакцій одефрагментів з використанням методів введення ржання похідних Пептиди, деалкіловані з N-кінця, захисних груп Z, Вос або Fmoc Згідно із зазначеможуть бути одержані а) шляхом приєднання ВІДною методикою Mernfield один із реагентів іммобіПОВІДНИХ г\І,г\І-діалкіламінокислот у розчині або на лізується на нерозчинній полімерній основі (яка полімерній основі, Ь) відновлювальним алкілувандалі називається також смолою) Типово це приням іммобілізованого на смолі пептиду у суміші зводить до послідовного складання пептиду на ТГФ/1% оцтової кислоти ІЧаСІЧВНз та ВІДПОВІДНИМ полімерній основі з використанням методики захиальдегідом чи кетоном, с) пдрогенуванням пептисних груп Вос або Fmoc, причому пептидний ландів у розчині у присутності альдегіду або кетону та цюг, що зростає, є ковалентно зв'язаним на КІНЦІ С Pd/C з нерозчинними частинками смоли (див фіг 1 та 2) Цей метод дозволяє вилучати реагенти та поРІЗНІ описані у цьому винаході амінокислоти, біжні продукти фільтруванням і, таким чином, пещо не трапляються у природі, можуть бути одеррекристалізація проміжних продуктів не потрібна жані із комерційних джерел або синтезовані із комерційно-доступних матеріалів з використанням Захищені амінокислоти можуть бути зв'язані з методів, відомих фахівцям у даній галузі Комербудь-якими придатними полімерами, які мають ційно-доступними вихідними матеріалами є азетилише бути нерозчинними у розчинниках, що викодин-2-карбонова кислота, 3-метил-І_-пролін, 5ристовуються, та мати стабільну фізичну форму, метил-І_-пролш, і Вос- або Fmoc-захищений 3,4яка забезпечує простоту фільтрування Полімер депдропролін (ACROS, NOVABIOCHEM, повинен мати функціональну групу, до якої перша захищена амінокислота може бути міцно приєднаВАСНЕМ) Цис- та транс-4-фторпролш можуть на шляхом утворення ковалентного зв'язку Різнобути одержані за методом, описаним PanasikTa ш манітні полімери є придатними для застосування з (N Panasik, E S Eberhardt, A S Edison, DR цією метою, наприклад, целюлоза, ПОЛІВІНІЛОВИЙ Powell, RT Raines, Int J Peptide Protein Res, 44, спирт, поліметакрилат, сульфонований полісти1994, 262 - 269) із пдроксипроліну рол, хлорметилований співполімер стироСполуки за цим винаходом можуть бути виколу/дившілбензолу (смола Мерифілда), 4ристані для інгібування або іншого лікування щільметилбензпдриламшова смола (МВНА-смола), них пухлин (наприклад, пухлин легенів, грудної фенілацетамідометильна смола (Рат-смола), залози, товстої кишки, простати, сечового міхура, смола п-бензилоксибензилового спирту, бензпдпрямої кишки, або ендометріальних пухлин) або риламшова смола (ВНА-смола), 4-(пдроксиметил)гематологічних злоякісних утворень (наприклад, бензоілоксиметильна смола, смола за Breipohl та лейкемії, лімфоми) шляхом введення сполуки ссаш , (Tetrahedron Letters 28 (1987) 565, надана фірвцю мою ВАСНЕМ), 4-(2,4Особливою перевагою нових сполук є те, що диметоксифеніламшометил)-фенокси-смола (навони мають більшу СТІЙКІСТЬ проти ферментативдана фірмою Novabiochem) або о-хлортритильна ного розкладу, ніж Доластатин-15 смола (надана фірмою Biohellas) Введення може бути здійснено будь-яким шляхом, який є звичайним для фармацевтичних, Для синтезу пептидів у розчині придатні усі бажано онкологічних, агентів, включаючи перорарозчинники, що є інертними за умов проведення льні та парентеральні шляхи, такі як підшкірний, реакції, особливо вода, N.N-диметилформамід внутрішньовенний, внутрішньом'язовий та внутрі(ДМФ, DMF), д и мети л сульфоксид (ДМСО, DMSO), шньочеревинний ацетонітрил, дихлорметан (ДХМ, DCM), 1,4дюксан, тетрапдрофуран ЛТФ, THF), ІЧ-метил-2Сполуки можуть бути введені самі або у формі піролідон (НМП, NMP), та суміші зазначених розфармацевтичних композицій, що містять сполуку чинників Синтез пептидів на полімерній основі формули І разом з фармацевтично прийнятним може бути проведений в усіх інертних розчинниках носієм, придатним для потрібного шляху введенпохідних амінокислот Але додаткова перевага ня Такі фармацевтичні композиції можуть бути надається таким розчинникам, у яких смола буде комбінованими продуктами, тобто можуть містити набухати, таким як ДМФ, ДХМ, НМП, ацетонітрил ІНШІ терапевтично активні інгредієнти та ДМСО, та сумішам цих розчинників Після завеДоза, що вводиться ссавцю, повинна містити ршення синтезу пептид відщеплюють від полімерефективну для інгібування пухлини КІЛЬКІСТЬ акти 46776 10 вного інгредієнта, яка залежить від звичайних фалоти, Z-захищеного N-карбоксіанпдриду (NCA) кторів, утому числі біологічної активності конкретамінокислоти, або півалоілхлориду у якості агента ної сполуки, що використовується, шляху введенконденсації, ВІДПОВІДНО ня, віку, стану здоров'я та ваги тіла пацієнта, II Відновлювальне алкілування N-кінця природи та ступеню виявлення симптомів, періВилучають захисні груми на N-КІНЦІ пептидної одичності лікування, введення інших препаратів, смоли, одержаної за методикою Ala (етапи 2-4 у та бажаного ефекту Типова денна доза становить Ala), а потім проводять реакцію з 3-кратним молявід приблизно 0,5 до 50 міліграм на кілограм ваги рним надлишком альдегіду чи кетону у суміші тіла при пероральному введенні і від приблизно ДМФ/1% оцтової кислоти при доданні 3 еквівален0,05 до 20 при парентеральному введенні тів ІЧаСІЧВНз Після ПОВНОГО проходження реакції (негативний тест Кайзера) смолу кілька разів проНові сполуки можуть бути введені у вигляді мивали водою, ізопропанолом, ДМФ та дихлормезвичайних твердих чи рідких фармацевтичних літаном карських форм, наприклад, таблеток без покриття або з (плівковим) покриттям, капсул, порошків, Відновлювальне алкілування у розчині може гранул, супозиторіїв чи розчинів, їх виготовлення бути здійснено, наприклад, шляхом проведення здійснюють у звичайний спосіб Активні сполуки реакції пептидів, фрагментів пептидів, або амінопри цьому можуть перероблятись із звичайними кислот зі знятим на N-КІНЦІ захистом з ВІДПОВІДНИфармацевтичними допоміжними речовинами, таМИ альдегідами чи кетонами з використанням кими як зв'язуюче для таблеток, наповнювачі, конІЧаСІЧВНз або водню у присутності Pd/C серванти, розпушувальні засоби для таблеток, III Доопрацювання пептидної смоли, одержарегулятори течи, пластифікатори, змочувальні ної, як описано у ІЬта II агенти, диспергуючі агенти, емульгатори, розчинПептидну смолу сушили при зменшеному тисники, композиції з подовженим строком виділення, ку, а потім піддавали обробці сумішшю трифтороантиоксиданти та/або газами-пропелентами (див оцтової кислоти (TFA) з водою (95 5) протягом 1, Н Sucker та ш , Pharmaceutische Technology, 5 години (Wade, Tregear, Howard Florey Fmoc Thieme Verlag, Stuttgart, 1978) Лікарські форми Workshop Manual, Melbourne 1985) Після цього для введення, одержані таким чином, звичайно смолу відокремлювали на фільтрі та промивали містять 1 - 90% мас активної речовини трифторооцтовою кислотою (TFA) та ДХМ Фільтрат та промивну рідину концентрували, і пептид Наведені нижче приклади призначені для ілюосаджували доданням діетилового ефіру Після страції винаходу Протешогенні амінокислоти у охолодження на льодяній бані осад відокремлюприкладах скорочено позначаються з використанвали на фільтрі, розводили у 30%-ній оцтовій кисням відомого трибуквенного коду Інші використані лоті та люфілізували скорочення МегУаІ = N.N-диметилвалін, MeVal = N-метилвалш, Z = бензилоксикарбоніл IV При використанні о-хлортритильної смоли (поставлена фірмою (Biohellas) суспензію пептидА Загальні процедури ної смоли у суміші оцтової кислоІ Пептиди, що описані у пункті 1, є або синтети^рифторетанолу/дихлорметану (1 1 3) перезованими шляхом класичного синтезу у розчині з мішували при кімнатній температурі протягом 1 використанням стандартної Z- та Вос-методики, як год Після ЦЬОГО смолу відокремлювали на фільтрі було описано вище, або стандартними методами з відсмоктуванням та ретельно промивали відщетвердофазного синтезу з використанням методик плювальним розчином Об'єднані фільтрати конвведення Вос-та Fmoc-захисних груп центрували під вакуумом та обробляли ефіром а) Цикл синтезу за методикою використання Осаджену тверду речовину вилучали фільтруванFmoc-захисноі групи ням чи центрифугуванням, промивали діетиловим 1 Промивка ДМФ 1х1хв ефіром та сушили при зниженому тиску 2 20% піперидину у ДМФ 1 х 4хв 3 20% піперидину у ДМФ 1х16хв V Очищення та характеризування пептидів Очищення здійснювали гель-хроматографією 4 Промивка ДМФ 5х1хв 5 Додання попередньо активо(SEPHADEX G-10, G-15/10% HOAc, SEPHADEX ваної захищеної амінокислоти І_Н20/МеОН) та/або хроматографією при серед(активація 1 еквівалентом ньому тиску (стаціонарна фаза HD-SIL С-8, 20 - 45 TBTU та 5 еквівалентами мікрон, 100 ангстрем, рухома фаза градієнт з А ОІРЕАуДМФ), 0,1% трифторооцтова кислота/вода, В = 0,1% трифторооцтова кислота/МеОН), або препаративРеакція приєднання пептиду 1 хбіхв ною рідинною хроматографією високого тиску 6 Промивка ДМФ Зхіхв (стаціонарна фаза Waters Delta-Pak C-18, 15 мік7 Якщо ступінь перетворення рон, 100 ангстрем, рухома фаза градієнт з А = неповна, повторення реакції 0,1% трифторооцтова кислота/вода, В = 0,1% приєднання (назад до 5) трифторооцтова кислота/МеОН) 8 Промивка ДМФ Зхіхв 9 Назад до 2 Ступінь чистоти одержаних продуктів визначаBOP-СІ та РуВгор використовували як реагенли методом аналітичної рідинної хроматографії ти для приєднання амінокислот після Nвисокого тиску (стаціонарна фаза 100 2,1 мм метиламшокислот Час реакції ВІДПОВІДНО збільшуVYDAC С-18, 300 ангстрем, рухома фаза градієнт вали, включаючи ПОДВІЙНІ приєднання При синтезі ацетонітрил-вода, буферизована 0,1% трифтороу розчині для цього типу приєднання найбільша оцтової кислоти, 40°С) перевага надається використанню ВосВ Специфічні методи захищеного N-карбоксіанпдриду (NCA) амінокисПРИКЛАД 1 (Амінокислотна ПОСЛІДОВНІСТЬ №1) 11 46776 12 Мв2\/аІ-\/аІ-Ме\/аІ-3,4-депдропроліл-Рго-амід на деревному вугіллі реакційну суміш пдрогенували протягом ночі Після фільтрування та упарюПроводили реакцію 0,53г Fmoc-RINK-смоли вання до сухого залишку одержували 1,88г дипеп(ступінь заміщення 0,46ммоль/г), що відповідає тиду зі знятим захистом розміру порції 0,25ммоль, як описано у Ala, з 0,4ммоль кожного із d) Z-MeVal-[(2S,3S)-3-Me™-|-mponiflHH-2Fmoc-Pro-OH карбоніл]-Рго-бензиламід Fmoc-3,4-fleriflponponiHy 1,54r Z-MeVal-OH (5,8ммоль) і 1,88г (2S,3S)-3Fmoc-MeVal-OH метил-піролідин-2-карбоніл-І_-проліл-бензиламіду (5,8ммоль) розчиняли у 58мл дихлорметану та Fmoc-Val-OH охолоджували до 4°С Після додання 0,78мл NFmoc-Val-OH метилморфоліну (6,96ммоль), 0,266г HOBt Проводили реакцію приєднання амінокислоти, (1,93ммоль) і 1,12г EDCI (5,8ммоль) реакційну сунаступної за N-метиламшокислотою, з викорисміш перемішували при кімнатній температурі протанням РуВгор у якості агента приєднання, за реатягом ночі, розводили 120мл дихлорметану, і прокцією подвійного приєднання Після завершення мивали насиченим розчином бікарбонату натрію, повторюваних циклів синтезу проводили зняття один раз (Зх), водою (1х), 5% лимонної кислоти захисних груп N-кінця пептидної смоли (етапи 2-4 у (Зх), водою (1х), і насиченим розчином NaCI (1x) Ala), а потім реакцію з водним розчином формальОрганічний шар зневоднювали над сульфатом дегіду, як описано у All, і сушили при зниженому натрію і концентрували при зниженому тиску, одетиску Одержану смолу піддавали процедурі відржуючи 3,01г продукту у вигляді сухої білої піни щеплювання у трифторооцтовій кислоті, як описано у АІІІ Сировий продукт (132мг) очищали метоє) MeVal-[(2S,3S)-3-Me™i-niponiflHH-2дом препаративної хроматографії середнього карбоніл]-Рго-бензиламід тиску, одержуючи 32мг потрібного чистого пептиду 3,01 г Z-MeVal-[(2S,3S)-3-Me™-|-mponiflHH-2(10 - 40% А за Юхв , 40 - 90% А за 140хв) Додаткарбоніл]-Рго-бензиламіду (5,33ммоль) розчиняли ковий аналіз сполуки проводили шляхом масу 39мл метанолу Після додання 96мг 10% паласпектрометри з бомбардуванням швидкими атодію на деревному вугіллі реакційну суміш пдроге+ мами ([М+Н] = 548) нували протягом 3 годин Після фільтрування та упарювання до сухого залишку одержували 2,18г ПРИКЛАД 2 (Амінокислотна ПОСЛІДОВНІСТЬ №1) трипептиду зі знятим захистом Me2Val-Val-MeVal-[(2S,3S)-3-Me™-|-mponiflHH2-карбоніл]-Рго-бензамід f) Z-Val-MeVal-[(2S,3S)-3-Me™-|-mponiflHH-2карбоніл]-Рго-бензиламід a) 7-(23,33)-3-метил-піролідин-2-карбонова кислота 1,28r Z-Val-OH (5,11ммоль) розчиняли у Юмл дихлорметану Після додання 0,73мл триетиламі1,5г (23,33)-3-метил-піролідин-2-карбоновоі ну (5,37ммоль) і охолодження до -10°С повільно кислоти (11,6ммоль) розчиняли у 4мл води і додавали 0,66мл півалоілхлориду (5,37ммоль) 2,33мл 5Н NaOH При 4°С протягом 1 години доПісля 1,5 годин перемішування суміші при -10°С давали 2,12мл бензилхлороформіату (Z-CI, додавали розчин 2,18г MeVal-[(2S,3S)-3-MeTnn12,8ммоль) і 6,5мл 2Н NaOH Реакційну суміш пепіролідин-2-карбоніл]-Рго-бензиламіду (5,11 ммоль) ремішували протягом ночі при кімнатній темпераі 0,73мл триетиламшу (5,37ммоль) у Юмл дихлортурі, після цього встановлювали рН 10 Водний метану Реакційну суміш перемішували при -Ю°С шар екстрагували дихлорметаном (4х), встановпротягом 1,5 годин і при кімнатній температурі лювали рН 2 за допомогою 5Н НСІ та екстрагувапротягом ночі, розводили дихлорметаном, і проли дихлорметаном (2х) Об'єднані органічні екстмивали насиченим розчином бікарбонату натрію ракти зневоднювали над сульфатом натрію та (Зх), водою (1х), 5% лимонною кислотою (Зх), воупарювали у вакуумі, одержуючи 1,75г потрібного дою (1х) і насиченим розчином NaCI (1x) Органічпродукту у вигляді маслянистої рідини ний шар зневоднювали над сульфатом натрію і b) 2-(23,33)-3-метил-піролідин-2-карбоніл-іконцентрували у вакуумі, одержуючи 2,75г продукпроліл-бензиламід ту у вигляді сухої піни 1,75 г (23,33)-3-метил-піролідин-2-карбоновоі кислоти (6,62ммоль) та 1,59г пролш-бензиламіду пдрохлориду (6,62ммоль) розчиняли у 66мм дихлорметану та охолоджували до 4°С Після додання 0,89мл N-метилморфолшу (7,94ммоль), 0,304г HOBt (2,21 ммоль) та 1,28г EDCI (6,62ммоль) реакційну суміш перемішували при кімнатній температурі протягом ночі, розводили Юмл дихлорметану, і промивали насиченим розчином бікарбонату натрію (Зх), водою (1х), 5% лимонної кислоти (Зх), водою (1х), і насиченим розчином NaCI (1x) Органічний шар зневоднювали над сульфатом натрію і концентрували при зниженому тиску, одержуючи 2,63г дуже в'язкої маслянистої рідини c) (23,33)-3-метил-піролідин-2-карбоніл-І_проліл-бензиламід 2,63г 2-(23,33)-3-метил-піролідин-2-карбонілL-проліл-бензиламіду (5,8ммоль) розчиняли у 43мл метанолу Після додання 105мг 10% паладію д) Val-MeVal-[(2S,3S)-3-Me™-|-mponiflHH-2карбоніл]-Рго-бензиламід 2,75г Z-Val-MeVal-[(2S,3S)-3-Me™-|-mponiflHH2-карбоніл]-Рго-бензиламіду (4,13ммоль) розчиняли у Юмл метанолу Після додання 0,34мл концентрованої НСІ (4,13ммоль) та 78мг 10% паладію на деревному вугіллі реакційну суміш пдрогенували протягом 3 годин Після фільтрування та упарювання до сухої речовини одержували 2,23г трипептиду зі знятим захистом у вигляді білої сухої піни Сировий продукт після цього розчиняли у 50мл води, доводили рН до 2-3 за допомогою 1Н НСІ Водний шар екстрагували дихлорметаном (Зх), встановлювали рН 10 за допомогою 5Н NaOH і знову екстрагували дихлорметаном (Зх) Об'єднані органічні витяжки зневоднювали над сульфатом натрію і концентрували при пониженому тиску, одержуючи 1,71г бензиламіду тетрапептиду зі зня 13 тим захистом h) Me2Val-Val-MeVal-[(2S,3S)-3-MeTHnтролідин-2-карбоніл]-Рго-бензиламід 0,47г Me2Val-OH (3,24ммоль) і 1,71г Val-MeVal[(23,33)-3-метил-піролідин-2-карбоніл]-Ргобензиламіду (3,24ммоль) розчиняли у 32мл сухого ДМФ Після охолодження до 4°С додавали 1,07мл DEPCN (6,48ммоль) та 1,88мл триетиламшу (12,96ммоль) Реакційну суміш перемішували при кімнатній температурі протягом ночі у ДМФ упарювали при зниженому тиску Залишок розчиняли у ЮОмл дихлорметану і промивали насиченим розчином бікарбонату натрію (Зх), водою (1х), 5% лимонною кислотою (Зх), водою (1х) і насиченим розчином NaCI (1x) Органічний шар зневоднювали над сульфатом натрію і концентрували при зниженому тиску, одержуючи 0,88г продукту у вигляді безбарвної маслянистої рідини Сировий продукт розчиняли у кип'ячому дизопропіловому ефірі і осаджували при охолодженні Осад збирали та сушили, одержуючи 0,56г чистого продукту Сполуку додатково аналізували методом масспектрометри з бомбардуванням швидкими атомами ([М+Н]+ = 655,6) Згідно З прикладами 1 та 2 були одержані та можуть бути одержані такі продукти 3. 4. 5, 6. 7. 8. 9, 10. 11. 12. 13. 14. 15. 16. 17. 18. 19, 20. 21. 22. 23, 24, 25. 26. 27. 28. 29. ЗО. 31, 32. 33. 34. 35, 36. 37. 38. 39. 40. 41, Хаа Val Xab Xac Хаа Val Xab Xac Хаа Val Xab Xac Хаа Val Xab Xac Хаа Val Xab Xac Хаа Val Xab Xac Хаа val Xab Xac Хаа Val Xab Xac 14 46776 Xad xae Xaf Xag Xah Xal Xa* Xal Хаа Val Xab Xac Xarn Хаа Val Xab me Xan Хаа Val Xab Xac Xao Хаа Val Xab Xac Xap Хаа Val Xab Xao Xaq Хаа Val Xab Xac Xar Хаа Val Xab Д Д С Xas Хаа val Xab Xat Хаа val Xab Xac Xat Хаа Val Xab Xac Xav Хаа Val Xab Xac Xaw Хаа Val Xab • A G S W Xax Хаа Val Xab Ac**-* Xay Хаа Val Xab Xac Xaz Хаа Val Xab Xac Xba Хаа ValXab Xac Xbb Хаа Val Xab V a n Xtoc Хаа Val Xab Xac Xbd Хаа Val Xab A a C Xbe Xaa Val Xab Xbf Xbg Val' xab Xac Xar xbg Val Xab Xac Xas xbh Val Xab Xac Xar xbh Val Xab Xac Xas Хаз lie Xab Xac Xar Хаа lie Xab Xac Xas Хаа Xbk Xab Xac Xar Хаа xbk Xab Xac Xas Хаа Val Xbi Xac Xar Хаа Val ХЫ Xac Xas Хаа Val Xab Xac Xbl 42. Xaa Val Xab Xac Xbm 43. Xaa Val Xab Xac Xbn 44. Xaa Val Xab Xbo Xae 45. Xaa Val Xab Xbo Xbp 46. Xaa Val Xab Xbo Xar 47. Xaa Val Xafa %bo Xas 43. Xaa Val Xab Xbo Xbm 49. Xaa Val Xab Xbg Xae 50. Xaa Val Xab Xbq Xar 51. Xaa Val Xab Xbq Xas 52. Xaa Val Xab Xbq Xbm 53 . Xaa Val Xab Xbr Xbp 54. Xaa Val Xab Xbr Xae 55. Xaa Val Xab Xbr Xas 56. Xaa Val Xab Xbr Xar 57. Xaa Val Xab Xbs Xae 58. Xaa Val Xab Xbs Xas 59. Xaa Val Xab Xbs Xar 60. Xaa Val Xab Xac Xbu 61. Xaa Val Xab Xac Xbt 62. Xaa Val Xab ^bq Xbu 63. Xaa Val Xab Xbq Xbt 64. Xaa Val Xab Xac Pro Xbv 65. Xaa Val Xab Xac Pro Xbw 66. Xaa Val Xab Xac Pro Xbx 67. xaa Val Xab Xac Pro Xby 68. Xaa Val Xab Xac Pro Xbz 64. Xaa Val Xab Xbq Pro Xbv 65. Xaa Val Xab Xbq Pro Xbw 66. Xaa Val Xab Xbq Pro Xbx 67. Xaa Val Xab Xbq Pro Xby 68. Xaa Val Xab y±q Pro Xbz 69. Xaa Val Xab Xbo Xas 70. Xaa Val Xab Xbq Xaz 71. Xaa Val Xab Xbq Xbn 72. Xaa Val,,Xab Xbo Xbn приклади аналізу синтезованих нових сполук методом мас-спектрометри наведено у таблиці гюмі/пдп МС-аналіз з бомбардуванням швиІ І \ VІKJI i\L\ (№) дкими (визначена)) Іол вага атомами 45 627 53 655 Таблиця Ідентифікація амінокислотних послідовностей сполук, одержаних згідно з Прикладами 1 та 2 Номер(а) сполуки 1-34, 39-63, 69-72 35, 36 37,38 64-68 Номер амінокислотної ПОСЛІДОВНОСТІ 1 2 3 4 Символи Хаа у короткому описові мають такі значення 46776 15 Xaa N М-диметиявалін Xab N метилвапін Xac 16 3 4 депдропролін OH, Xap н3с Xad Xaq H3C Sar °H3C Xas TV* Xag Xat СНз Xau 'ПГО Xah Xav II И z онэс Xai CH, Saw Xak H3G Xax Xal Xam он 3 с сн, Xay О Xan Xao Xsz О £L г & M—I Xba CH, 1 17 18 46776 Xbu ХЬс Xbv Xbd Xbw Xbx ХЬе: Xby Xbg N N диметилізолейции Xbh N N-диметал-трет бутил-глщин ХЬЇ N-метилізолеицин Xbk 2-трет бутилглщин хы XUz YV0^ II SMB. ХЬП, Xbo 1-азетмдин-2-карбонт Xbq (4-фтор)-і-пролін Xbr (5-метип)-і.~пролін Xbs О (3~ме-пія)-і-пролін OH Xbt * ЛІ Сполуки за цим винаходом можуть бути перевірені на протиракову активність за звичайними методами, включаючи описані нижче методи А Метод перевірки in vitro Цитотоксичність вимірювали згідно зі стандартною методологією для ЛІНІЙ прилипаючих клітин, таких як аналіз мікрокультур з використанням тетразолію (МІГ) Детальний опис цього аналізу був опублікований (Alley М С та ш , Cancer Research, 48 589 - 601, 1988) Культури клітин пухлини на стадії експоненціального росту, таких як клітин НТ29 карциноми прямої кишки або LX-1 пухлини легенів, використовували для одержання культур на планшетах для титрування Клітини висівали при ЩІЛЬНОСТІ 5000 - 20000 клітин на лунку на 96луночні планшети (на 150мкл середовища), і вирощували протягом ночі при 37°С Додавали сполуки, що аналізуються, при 10-кратному розведенні від 10 4 М до 10 1 0 М Після ЦЬОГО КЛІТИНИ шкубували протягом 48 годин Для визначення КІЛЬКОСТІ життєздатних клітин у кожній лунці додавали барвник МТТ (50мкл розчину 3-(4,5диметилтіазол-2-іл)-2,5-дифенілтетразолій бромиду у сольовому розчині з концентрацією Змг/мл) Цю суміш шкубували при 37°С протягом 5 годин, після чого до кожної лунки додавали 50мкл 25% ДСН, рН 2 Після інкубування протягом ночі вимірювали поглинання кожної лунки при 550нм за допомогою пристрою для проведення імуноферментного аналізу на твердих носіях (ELISA) Розраховували середні значення ± середньоквадратову помилку для даних від реплікованих лунок, використовуючи формулу для % Т/С (% життєздатних клітин після обробки/контрольний дослід) Оптична густина клітин теля обробки _ X 1UU /о — /о 1 / О Оптична густина контрольних клітин Концентрацію аналізованої сполуки, яка дава 20 19 46776 ла 50% інгібування росту Т/С клітин, позначали як (1) ТЕЛЕКС 1762175170 (м) НАЗВА В И Н А Х О Д У Нові ПОХІДНІ доластавеличину ІС50 тину, їх одержання т а використання СПОЛУКА ЗА ПРИКЛАДОМ ІС50[М] (їм) КІЛЬКІСТЬ ПОСЛІДОВНОСТЕЙ 4 9 1 1хЮ (iv) ФОРМА, ПРИДАТНА Д Л Я КОМП'ЮТЕРНОГО ЗЧИТУВАННЯ 2 1 хЮ (A) ТИП НОСІЯ Дискета, 3,5 дюйма, 2 DD 45 1 хЮ (B) комп'ютер ІВМ-АТ-сумісний, процесор 53 ІХІСГ 80286 В Метод перевірки in vivo (C) ОПЕРАЦІЙНА СИСТЕМА MS-DOS версія Сполуки за даним винаходом було піддано 50 додатковому аналізу при проведенні ДОКЛІНІЧНИХ (D) ПРИКЛАДНА ПРОГРАМА WordPerfect випробувань на активність in vivo, я к а є показни(3) ІНФОРМАЦІЯ ПРО АМІНОКИСЛОТНУ ПОком їх клінічної придатності Такі тести було проСЛІДОВНІСТЬ №1 ведено з голими мишами, яким було транспланто(і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ вано (ксенотрансплантовано) пухлинну тканину, (A) ДОВЖИНА 5 амінокислот бажано людського походження, я к це відомо фахі(B) ТИП амінокислота вцям у даній галузі Оцінювали протипухлинну (D) ТОПОЛОГІЯ лінійна ефективність сполук, що тестуються, після їх вве(м) ТИП МОЛЕКУЛИ пептид дення мишам із ксенотрансплантатами (хі) ОПИС АМІНОКИСЛОТНОЇ ПОСЛІДОВНОБільш конкретно, пухлину грудної залози л ю СТІ ПОСЛІДОВНІСТЬ №1 дини (МХ-1), яку було вирощено у голих мишей, Хаа Val Xaa Хаа Хаа що не мали вилочкової залози, трансплантували (2) ІНФОРМАЦІЯ ПРО АМІНОКИСЛОТНУ ПОновим мишам-реципієнтам, використовуючи фраСЛІДОВНІСТЬ №2 гменти пухлини розміром біля 50мг День транс(і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ плантування позначали як день 0 Через період від (A) ДОВЖИНА 5 амінокислот шести до десяти днів мишам, розбитим на групи (B) ТИП амінокислота по 5-10 мишей для кожної дози, вводили сполуки, (D) ТОПОЛОГІЯ лінійна що випробовувались, у вигляді внутрішньовенних (м) ТИП МОЛЕКУЛИ пептид ІН'ЄКЦІЙ Сполуки вводили кожного другого дня (хі) ОПИС АМІНОКИСЛОТНОЇ ПОСЛІДОВНОпротягом трьох тижнів, дозами по 1 - 100мг/кг ваги СТІ ПОСЛІДОВНІСТЬ №2 тіла Діаметр пухлини і вагу тіла вимірювали ДВІЧІ Хаа Не Хаа Хаа Хаа на тиждень Об'єм пухлин розраховували з вико(2) ІНФОРМАЦІЯ ПРО АМІНОКИСЛОТНУ ПОристанням діаметрів, визначених за допомогою СЛІДОВНІСТЬ №3 штангенциркуля з ноніусом, за формулою (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ (довжина х ширина 2 ) 12= м м 3 об'єму пухлини (A) ДОВЖИНА 5 амінокислот Для кожної групи, що одержували лікування, (B) ТИП амінокислота розраховували середній об'єм пухлин, і для кожної (D) ТОПОЛОГІЯ лінійна групи визначали значення Т/С порівняно з контро(м) ТИП МОЛЕКУЛИ пептид льними пухлинами, які не одержували лікування (хі) ОПИС АМІНОКИСЛОТНОЇ ПОСЛІДОВНОНові сполуки мають добрі інгібуючі властивості СТІ ПОСЛІДОВНІСТЬ №3 щодо пухлин Хаа Хаа Хаа Хаа Хаа ПЕРЕЛІК АМІНОКИСЛОТНИХ ПОСЛІДОВНО(2) ІНФОРМАЦІЯ ПРО АМІНОКИСЛОТНУ ПОСТЕЙ СЛІДОВНІСТЬ №4 (2) ЗАГАЛЬНА ІНФОРМАЦІЯ (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ (і) З А Я В Н И К (A) ДОВЖИНА 6 амінокислот (A) BASF Aktiengeselleschaft (B) ТИП амінокислота (B) ВУЛИЦЯ Carl-Bosch-Strasse 38 (D) ТОПОЛОГІЯ лінійна (C) МІСТО Ludwigshafen (м) ТИП МОЛЕКУЛИ пептид (Е) КРАЇНА Федеративна Республіка Німеччи(хі) ОПИС АМІНОКИСЛОТНОЇ ПОСЛІДОВНОна СТІ ПОСЛІДОВНІСТЬ №4 (F)ZIP D-67056 Хаа Val Хаа Хаа Pro Хаа (G) ТЕЛЕФОН 0621/6048526 (Н) ТЕЛЕФАКС 0621/6043123 21 46776 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 22
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 38/00, C07K 7/06, C07K 1/04, A61P 35/00
Мітки: активністю, ссавців, лікування, композиція, пептиди, фармацевтична, протипухлинною, пухлин, спосіб
Код посилання
<a href="https://ua.patents.su/11-46776-peptidi-farmacevtichna-kompoziciya-z-protipukhlinnoyu-aktivnistyu-ta-sposib-likuvannya-pukhlin-u-ssavciv.html" target="_blank" rel="follow" title="База патентів України">Пептиди, фармацевтична композиція з протипухлинною активністю та спосіб лікування пухлин у ссавців</a>
Попередній патент: Пептиди, фармацевтична композиція з протипухлинною активністю та спосіб лікування пухлин у ссавців
Наступний патент: Турбінна магнітна машина
Випадковий патент: Пристрій для обробки просторової феритної поверхні