Гепатотропний кон’югат антивірусного лікарського засобу, спосіб його одержання та фармацевтична композиція
Номер патенту: 47386
Опубліковано: 15.07.2002
Автори: ФІУМЄ Луіджі, Ді СТЕФАНО Джиусеппіна, МАТТІОЛІ Алєссандро, БУЗІ Коррадо, БАЛДАЧЧІ Массімо
Формула / Реферат
1. Конъюгат основной полиаминокислоты с остатками галактозы или лактозы и остатками антивирусного лекарственного средства, отличающийся тем, что большинство аминогрупп указанной основной полиаминокислоты замещено остатками галактозы или лактозы и остатками антивирусного лекарственного средства.
2. Конъюгат по п. 1, отличающийся тем, что указанная основная полиаминокислота выбрана из поли-L-лизина и поли-L-орнитина.
3. Конъюгат по п. 1, отличающийся тем, что антивирусное средство выбрано из аденин-![]() -арабинозид-5'монофосфата (аrа-АМР), ацикловира, рибавирина и азидотимидина.
-арабинозид-5'монофосфата (аrа-АМР), ацикловира, рибавирина и азидотимидина.
4. Конъюгат по п. 1, отличающийся тем, что он представляет собой Lat-поли-L-лизин-аrа-АМР.
5. Конъюгат по п. 1, отличающийся тем, что он представляет собой Lat-поли-L-лизин-ACVMP.
6. Фармацевтическая композиция, отличающаяся тем, что она содержит в качестве активного материала эффективное количество конъюгата по любому из пунктов 1-5.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что она находится в форме, пригодной для парентерального или внутримышечного введения.
8. Способ получения конъюгата по любому из пунктов 1-3, отличающийся тем, что включает стадии: а) конъюгирования основной полиаминокислоты с антивирусным лекарственным средством и b) лактозаминирования основной полиаминокислоты путём восстановительного лактозаминирования с цианоборгидридом.
9. Способ по п. 8, отличающийся тем, что конъюгирование лекарственного средства выполняется при помощи имидазолата лекарственного средства и путём проведения конъюгирования в буферной среде при щелочном рН.
Текст
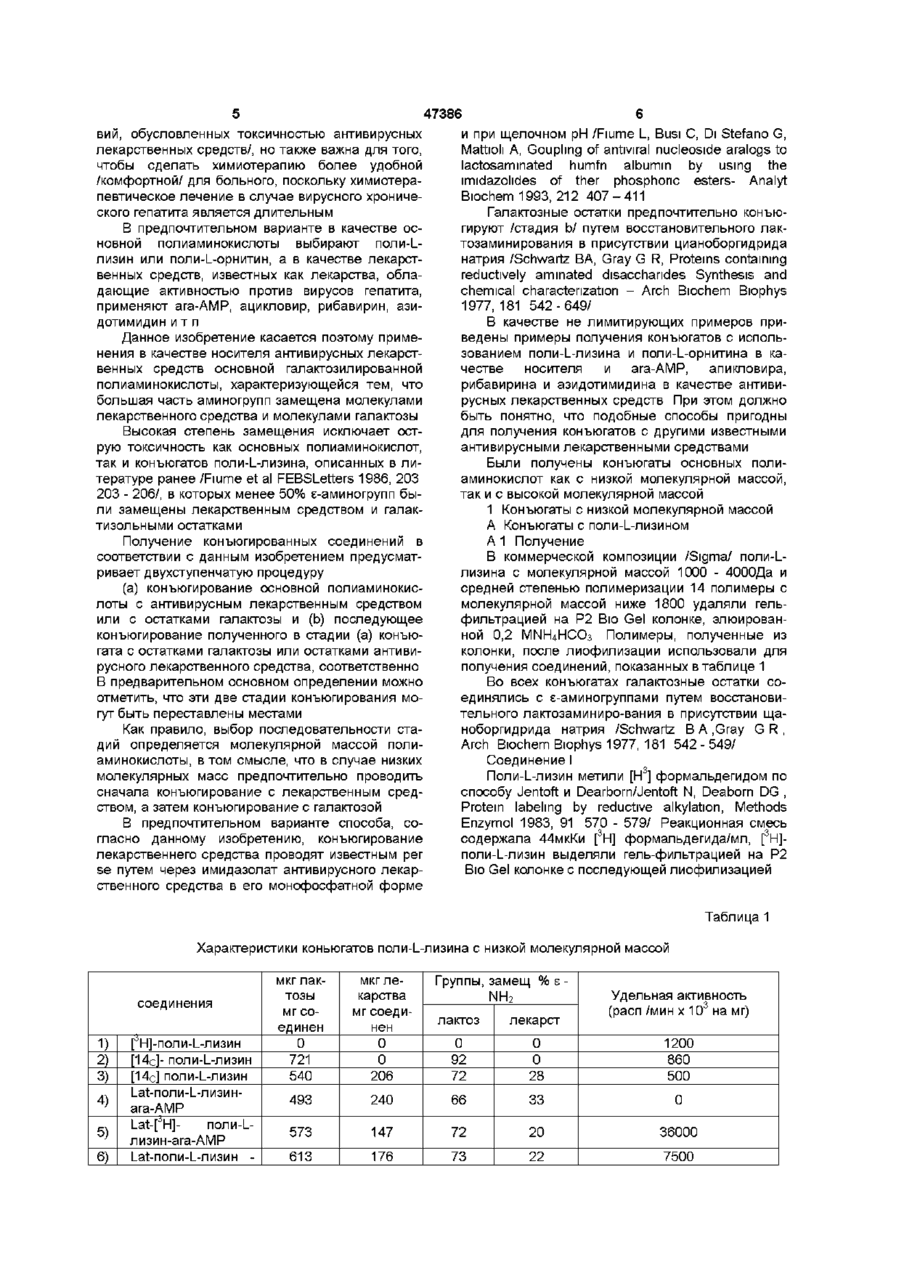
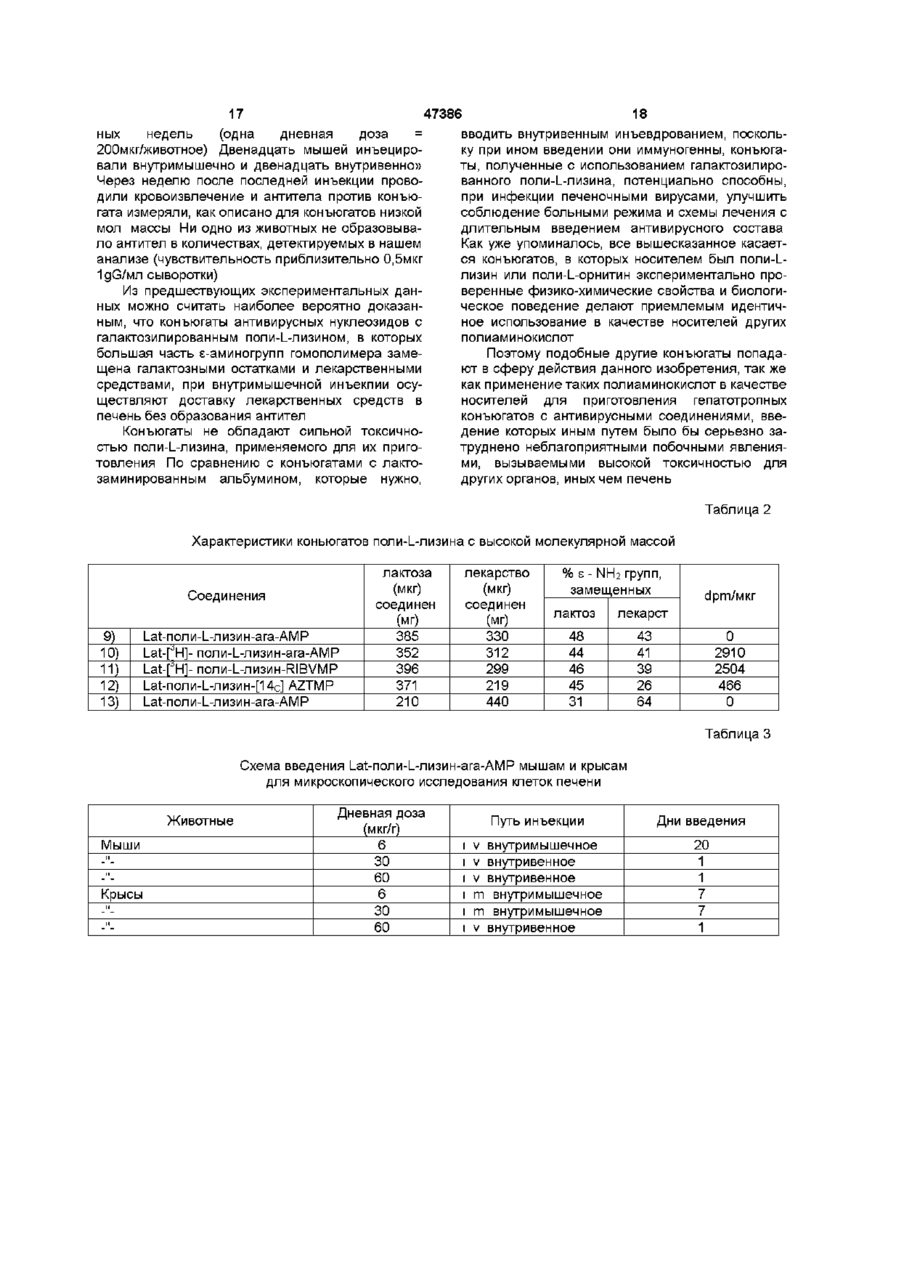
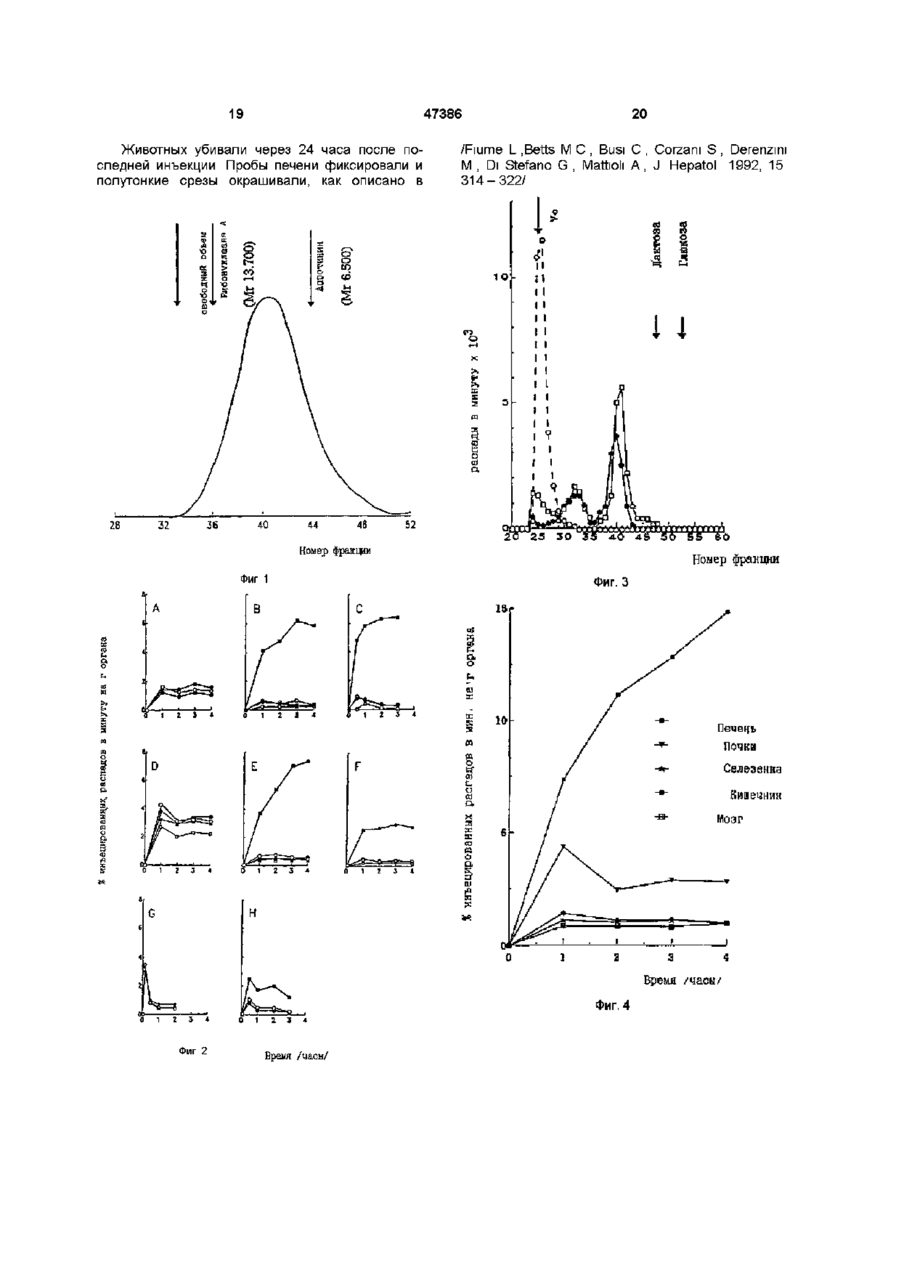
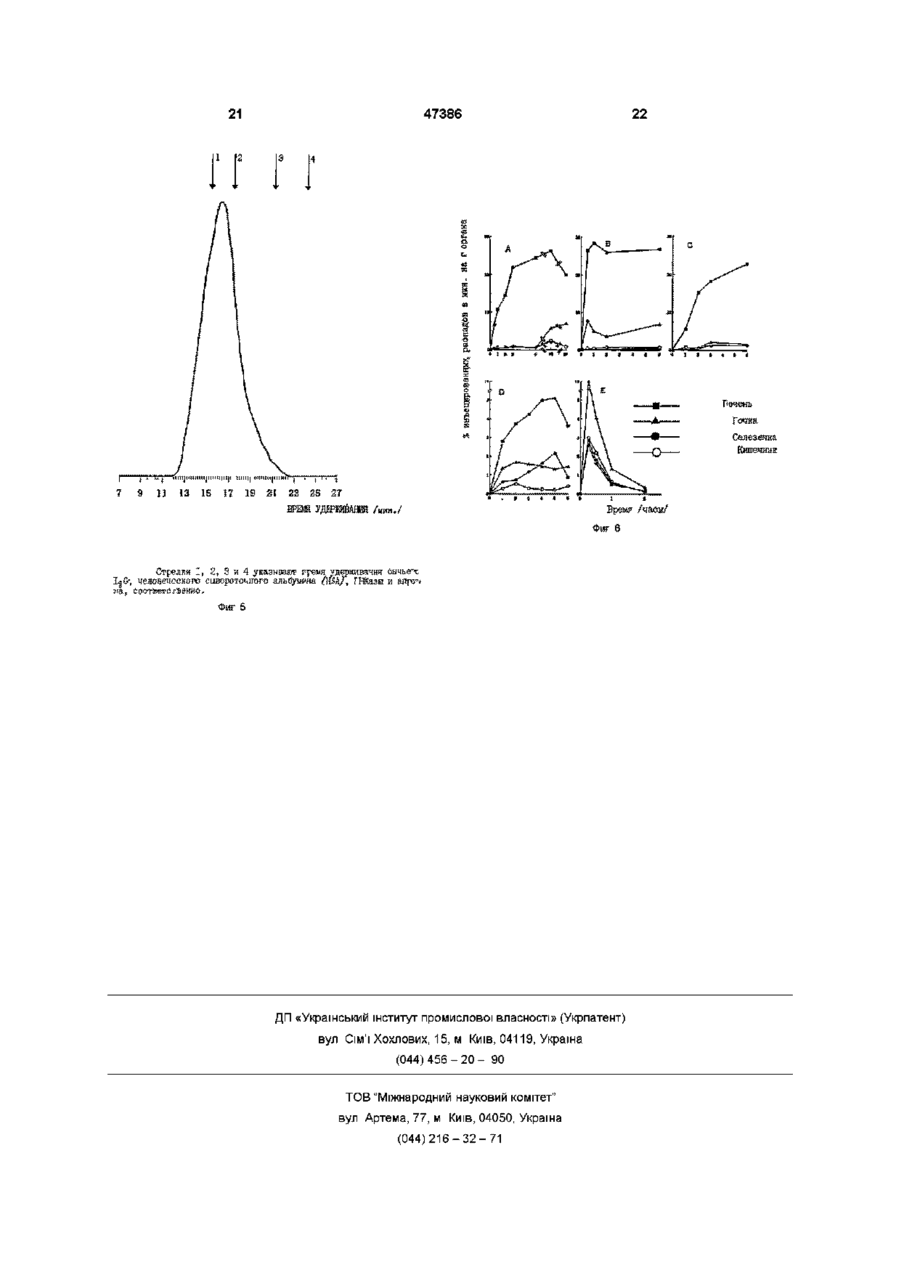
1 Конъюгат основной полиаминокислоты с остатками галактозы или лактозы и остатками антивирусного лекарственного средства, отличающийся тем, что большинство аминогрупп указанной основной полиаминокислоты замещено остатками галактозы или лактозы и остатками антивирусного лекарственного средства 2 Конъюгат по п 1, отличающийся тем, что указанная основная полиаминокислота выбрана из поли-І_-лизина и поли-І_-орнитина 3 Конъюгат по п 1, отличающийся тем, что ан Данное изобретение касается соединений с антивирусной активностью и, более конкретно, конъюгированных соединений антивирусного лекарственного средства с носителями, имеющими гепатотропную активность В лечении инфекции, вызываемой вирусами, побочные действия антивирусных лекарственных средств можно уменьшить с применением химиотерапевтического лизосомотропного подхода /Balboni PG, Mima A Grossi MP, Barbanti - Brodano G, Mottioh A, Fiume L , Activity of albumin conjugates of sfluorodeoxyundme and cytosme arabmoside on poxviruses as a lysosomotropic approach to antiviral chemotherapy, Nature 1976, 264 181 - 183/ тивирусное средство выбрано из аденин- J3 арабинозид-5'монофосфата (ага-АМР), ацикловира, рибавирина и азидотимидина 4 Конъюгат по п 1, отличающийся тем, что он представляет собой 1_а1:-поли-1_-лизин-ага-АМР 5 Конъюгат по п 1, отличающийся тем, что он представляет собой 1_а1:-поли-1_-лизин-АС\/МР 6 Фармацевтическая композиция, отличающаяся тем, что она содержит в качестве активного материала эффективное количество конъюгата по любому из пунктов 1-5 7 Фармацевтическая композиция по п 6, отличающаяся тем, что она находится в форме, пригодной для парентерального или внутримышечного введения 8 Способ получения конъюгата по любому из пунктов 1-3, отличающийся тем, что включает стадии а) конъюгирования основной полиаминокислоты с антивирусным лекарственным средством и Ь) лактозаминирования основной полиаминокислоты путем восстановительного лактозаминирования с цианоборгидридом 9 Способ по п 8, отличающийся тем, что конъюгирование лекарственного средства выполняется при помощи имидазолата лекарственного средства и путем проведения конъюгирования в буферной среде при щелочном рН Этот подход состоит в конъюгировании лекарственного средства с макромолекулой, которая избирательно захватывается из инфицированных клеток и транспортируется из них в лизосомы Если, как и требуется, ферменты лизосом расщепляют связь между носителем и лекарственным средством, то лекарственное средство концентрируется в фармакологически активной форме внутри инфицированных клеток Хронический гепатит, вызываемый вирусом В /HBV/ и хронический гепатит, вызываемый вирусом С /HCV/, является подходящей мишенью для такого химиотерапевтического подхода, поскольку (а) эти вирусы растут в основном в печеночных о (О 00 го 47386 клетках, в гепатоцитах, (Ь) гепатоциты специфиadenme arabmoside monophosphate coupled to чески вносят и транспортируют в лизосомы некоlactosammated albumin Efficfcy, minimal effective торые гликопротеины с остатками галактозы, коdose and plasma clearance of conjugate Y Hepatolторые, следовательно, могут функционировать в 1994, 20 307 - 309/ ara-AMP, конъюгированный с качестве гепатотропных векторов лекарственных L-SA, ингибировал репликацию вируса в дозах, в 2 средств, (с) конъюгаты лекарственное средстраза меньших, чем дозы свободного лекарственво/гликопротеины могут легко входить в контакт с ного средства поверхностью гепатоцитов, т к печеночный синуКонъюгат с L-SA должен вводиться внутрисоид не является барьером для белков венно из-за большого объема, требуемого для инъекции, а также потому, что при введении его Согласно этому подходу и дал уменьшения иными путями образуются антитела, что ведет к нейротоксических побочных действий антивирусплохому соблюдению больным режима и схемы ное лекарственное средство арабинозидаденинлечения при долгосрочной терапии монофосфат /ага-АМР/, активное против HBV /Yacyna MR, Thomas НС , Antiviral therapy Hepatitis Поэтому гепатотропный носитель ага-АМР и В , Brit Med Bull 1990, 46 369 - 382/ было кщнъюдругих антивирусных лекарственных средств, дегировано с азиалофетуином /AF/ /Fiume L, Mattioh лающий возможным внутримышечное введение соответствующих конъюгатов, представлял бы F, Busi C, Balboni PG, Barbanti-Brodano G, De Vnes собой значительное усовершенствование с тераJ, Altman R, Wieland Th , Selective inhibition of певтической точки зрения Ectromeha virus DNA synthesis in hepatocytes by adenme -9-p-D-arabmofuranoside /ara-A/n adenmeИзвестно также, что основная полиаминокисP-D-arabmofuranoside 5'-monophosphate /ara-AMP/ лота, поли^-лизин, с 1/3 аминогрупп, замещенных conjugated to asialofetum, FEBS Letters 1980, 116 остатками галактозы, при внутривенном введении, 185 - 188/ и с лактозаминированным альбумином осуществляет направленную доставку в печень /L-SA/ /Fiume L, Busi C, Mattioh A, Balboh PG, ara-AMP /Fiume L, Bassi В, Busi С, Mattioh A, Barbanty-Brodano G , Hepatocyte targeting of Spmosa G, Faulztich H , Galactosylated pole (Ladenme -9-p-D-arabmofuranoside 5'-monophosphate лизин) asa a htpatotropic carrier of 9-p-D/ara-AMP/ coupled to lactosammated albumin, FEBS arabmofuranoside 5'-monophosphate, FEBSLetters Lett 1981, 129 261 - 264, Fiume L.Bassi B, Busi C, 1986, 203 203-206/ Кроме того, поли^-лизин, в Mattioh A, Spmosa G , Drug targeting in antiviral котором все или большая часть его є-аминогрупп chemotherapy A chemically stable conjugate of 9-pзамещены, не вызывает образования антител даD-arabmofuranosyladtnme 5'-monophosphate with же при введении иными путями, чем внутривенная lactosammated albumin accomplishes a selective инъекция /Levme BB, Studies on antigenicity The delivery of the drugto liver cells, Biochem Pharmacol effect of succmylation of є-ammo groups on 1986, 35 967 - 972/ В мышах оба эти носителя antigenicity of benzylpemcilloyl-pole-L-lysine приводят к направлению лекарственного средства conjugates in random-bred and in strain 2G-umea pig, в печень Proc Sos Exptl Biol Med 1964, 116 1127 -1131, Sela M Immunological atudies with synthetic polypeptides, L-SA имеет большое преимущество по сравAdran Immunol, 1966, 5 29-129/ нению с AF фактически конъюгаты, приготовленВ настоящее время обнаружено, что если в ные с гомогологичным лакто-заминированным поли^-лизине большая часть є-аминогрупп замеальбумином л" е альбумином из того же вида/ при щена галактозой и одним из антивирусных лекарвнутривенном введении не индуцируют образоваственных средств, активных против вирусов гепание антител /Fiume L, Mattioh A, Busi С, Spmosa G, тита, то можно получить на мышах три очень Wieland Th , Conjugates of adenme-9-p-Dважных терапевтических эффекта arabmofuranoside monophosphate /ara-AMP/ with lactosammated homologous albumin are not (і) этот конъюгат теряет высокую токсичность imnunogenic in the mouse, Expenentia 1982, 38 поли^-лизина, которая отличала прежнее галак1087 - 1089, Fiume L, Butosammated albumin a тозилированные конъюгаты поли^-лизин-ага-АМР study on their immunogeneti city in mouse and rat /Fiume et al, FEBSLetters -1986, 203 203 - 206/, в Cfncer Drug Delivery 1987, 4 145-150/ У лесного которых большая часть є-аминогрупп оставалась сурка с гепатитом, вызываемым WHV /Pronzetto A, незамещенной, Eiume L, Forzam В, Song SY, Вцєі С, Mattioh A, (м) направленная доставка антивирусного леSpmelh C, Mannelh M, Smedile A, Chiaberge E, карственного средства к печени осуществляется Bonmo F, Gervasi G B, Rapicetta M, Verme G , даже в том случае, если конъюгат вводится не Adenme arabmoside monophosphate and acyclovir внутривенно и, в частности, путем внутримышечmonophosphate coupled to lactosammated albumin ной инъекции, redurce woodchuck hepatitis virus viremia at doses (ш) повторное введение конъюгата внутримыlower than do the unconjugated drugs, Hepatology шечной или внутривенной инъекцией не приводит j1991, 14 16 - 24/ и у больных с хроническим HBV к образованию антител /Fiume L, Torram Cerenzia MR, Bonmo Ft Busi C, Терапевтическое значение этого свойства буMattiole A, Brunetto MR, Chiaberge E, Verme G, дет очевидным, если иметь ввиду, что возможInhibition of hepatitis В virus replication by viadabme ность направленной доставки в печень лекарстmonophosphqte conjugated with lactosammated венного средства при помощи внутримышечной serum albumin, Lancet 1988, 2 1 3 - 1 5 Torram инъекции не только участвует в использовании Cerenzia MR, Fiume L, Busi C, Vattioh A,Di Stefano интересных особых свойств, уже упоминавшихся ранее в отношении лизосомотропного подхода G, Gervasi GB, Brunetto MR, Piantmo H, Verme G, л" е значительное уменьшение побочных дейстBonmo F, Inhibition of hepatitis В virus replication by 47386 вий, обусловленных токсичностью антивирусных и при щелочном рН /Fiume L, Busi С, Di Stefano G, лекарственных средств/, но также важна для того, Mattioh A, Gouplmg of antiviral nucleoside aralogs to чтобы сделать химиотерапию более удобной lactosaminated humfn albumin by using the /комфортной/ для больного, поскольку химиотераimidazohdes of ther phosphoric esters- Analyt певтическое лечение в случае вирусного хроничеBiochem 1993, 212 407-411 ского гепатита является длительным Галактозные остатки предпочтительно конъюгируют /стадия Ь/ путем восстановительного лакВ предпочтительном варианте в качестве остозаминирования в присутствии цианоборгидрида новной полиаминокислоты выбирают поли-Lнатрия /Schwartz BA, Gray G R, Proteins containing лизин или поли-1_-орнитин, а в качестве лекарстreductively ammated disacchandes Synthesis and венных средств, известных как лекарства, облаchemical characterization - Arch Biochem Biophys дающие активностью против вирусов гепатита, 1977, 181 542-649/ применяют ага-АМР, ацикловир, рибавирин, азидотимидин и т п В качестве не лимитирующих примеров приведены примеры получения конъюгатов с испольДанное изобретение касается поэтому примезованием поли-І_-лизина и поли-І_-орнитина в канения в качестве носителя антивирусных лекарстчестве носителя и ага-АМР, апикловира, венных средств основной галактозилированной рибавирина и азидотимидина в качестве антивиполиаминокислоты, характеризующейся тем, что русных лекарственных средств При этом должно большая часть аминогрупп замещена молекулами быть понятно, что подобные способы пригодны лекарственного средства и молекулами галактозы для получения конъюгатов с другими известными Высокая степень замещения исключает остантивирусными лекарственными средствами рую токсичность как основных полиаминокислот, так и конъюгатов поли-1_-лизина, описанных в лиБыли получены конъюгаты основных политературе ранее /Fiume et al FEBSLetters 1986, 203 аминокислот как с низкой молекулярной массой, 203 - 206/, в которых менее 50% є-аминогрупп бытак и с высокой молекулярной массой ли замещены лекарственным средством и галак1 Конъюгаты с низкой молекулярной массой тизольными остатками А Конъюгаты с поли-І_-лизином Получение конъюгированных соединений в А 1 Получение соответствии с данным изобретением предусматВ коммерческой композиции /Sigma/ поли-Lривает двухступенчатую процедуру лизина с молекулярной массой 1000 - 4000Да и средней степенью полимеризации 14 полимеры с (а) конъюгирование основной полиаминокисмолекулярной массой ниже 1800 удаляли гельлоты с антивирусным лекарственным средством фильтрацией на Р2 Bio Gel колонке, элюированили с остатками галактозы и (Ь) последующее ной 0,2 MNH4HCO3 Полимеры, полученные из конъюгирование полученного в стадии (а) конъюколонки, после лиофилизации использовали для гата с остатками галактозы или остатками антивиполучения соединений, показанных в таблице 1 русного лекарственного средства, соответственно В предварительном основном определении можно Во всех конъюгатах галактозные остатки соотметить, что эти две стадии конъюгирования моединялись с є-аминогруппами путем восстановигут быть переставлены местами тельного лактозаминиро-вания в присутствии щаноборгидрида натрия /Schwartz В A .Gray G R , Как правило, выбор последовательности стаArch Biochem Biophys 1977, 181 542-549/ дий определяется молекулярной массой полиаминокислоты, в том смысле, что в случае низких Соединение I молекулярных масс предпочтительно проводить Поли-І_-лизин метили [Н3] формальдегидом по сначала конъюгирование с лекарственным средспособу Jentoft и Dearborn/Jentoft N, Deaborn DG , ством, а затем конъюгирование с галактозой Protein labeling by reductive alkylation, Methods Enzymol 1983, 91 570 - 579/ Реакционная смесь В предпочтительном варианте способа, сосодержала 44мкКи [3Н] формальдегида/мл, [3Н]гласно данному изобретению, конъюгирование поли-І_-лизин выделяли гель-фильтрацией на Р2 лекарственнего средства проводят известным per Bio Gel колонке с последующей лиофилизацией se путем через имидазолат антивирусного лекарственного средства в его монофосфатной форме Таблица 1 Характеристики коньюгатов поли-І_-лизина с низкой молекулярной массой соединения 1) 2) 3) 4) 5) 6) [ Н]-поли-І_-лизин [14с]- поли-І_-лизин [14с] поли-І_-лизин Lat-nonn-L-nH3HHara-AMP Lat-pH]поли-Lлизин-ara-AMP І_аі-поли-І_-лизин мкг лактозы мг соединен 0 721 540 мкг лекарства мг соединен 0 0 206 493 Группы, замещ % s NH2 Удельная активность (расп /мин х 103 на мг) лактоз лекарст 0 92 72 0 0 28 1200 860 500 240 66 33 0 573 147 72 20 36000 613 176 73 22 7500 7 7) ага-ҐН] AMP Lat-nonH-L-nH3HH[3H] ACVMP 47386 638 81 Соединение 2 Галаїсгозу соединили с полилизином восстановительным лаісгозаминированием в присутствии цианоборгидрида натрия, 20мг поли-І_-лизина растворили в 2мл буфера 0,1 М борная кислота/бура (рН 8,5) и добавили 80мг а-лаїсгозьі, содержащей 50мкКи [О-глюко-1-14С] лаісгозьі /Amersham/ и 50мг NaBbbCN Смесь инкубировали при 37°С в течение 48 часов и [14С] Lat -поли-Ь-лизин выделяли в качестве соединения 1 Содержание лактозы измеряли по способу Duboiset al /Dubois M, Gilles КА, Hamilton JK, Rebers PA, Smith F, Golonmetnc method for determination of sugar and related substances Anal Chem 1956, 28 350 - 356/ и относили к сухому весу соединения Соединения 3 и 4 Ага-АМР конъюгировали при помощи его имидазолата /Fiume L, Busi С, Di Stefano G, Mattioh A , Analet Biochem 1993, 212 407-411/ Этот способ более эффективен, чем применение водорастворимых карбодиимидов, и не имеет химических побочных реакций продуцируемых этими веществами Имидазолат ага-АМР получали по способу /Lohrmann и Orgel/Lohrmann R, Orgel LE, Preferential for mation of (2'-5')-lmked mternucleotide bonds in non-enzymatic reactions, Tetrahedron 1978, 34 853 - 855/ Поли-І_-лизин растворяли (50мг/мл) в буфере 0,1 М ІЧаНСОз, Na2CO3, pH 9,5 После добавления имидазолата ага-АМР (75мг/мл) рН доводили до рН 9,5 при помощи HCI и смесь инкубировали в течение 48 часов при 37°С Конъюгаты выделяли, как соединение 1, содержание ага-АМР определяли спектрофотометр и чески и относили к сухому весу конъюгатов, которые затем лактозаминировали (для соединения 4 применяли немеченную лактозу) Соединение 5 Конъюгат поли-Ь-плизин/ ага-АМР, полученный, как указано для соединений 3 и 4, метили [3Н] формальдегидом (ЮОмКи/ммоль) Реакционная смесь содердала 2800мкКи [3Н] формальдегида на мл Меченый конъюгат затем лактозаминировали, как описано выше Этот конъюгат применяли в качестве антигена в определении антител по способу Mmden и Farr /Mmden Р, Farr RS, The ammonium sulphate method to measure antigen-binding capacity, Wier DM ed , Hand-book of Experiment al Immunology, Blackwell, Oxford 1973, 15 1 -15-21 Соединение 6 Конъюгирование тритированногоага-АМР в этом соединении проводили с применением 1этил-3-(диметиламинопропил)ка-рбодиимида /ECDI/, так как превращение ага-[ Н]АМР в его имидазолат приводит почти к полной потере трития Поли-І_--лизин сначала лактозаминировали, как описано выше /соединение 2/, но с уменьшением периода реакции с 48 часов до 24 часов для замещения сахаром только 2/3 є-аминогрупп После этого ага-[ЗН]АМР конъюгировали по описанному выше способу Fiume L.Bassi В, Busi С, 80 8 12 440 Mattioh A .Spmosa G, Fauifstich H, FEBC Letters 1993, 212 407 - 411/ При получении этого конъюгата первой стадией было лактозаминирование для уменьшения числа свободных є-аминогрупп ко времени использования ECDI, что позволяло полимеризовать молекулы поли-І_-лизина при помощи этого соединения Соединение 7 [зН] ACVMP, примененный для получения этого конъюгата, получали при помощи фосфорилирования /Yoshikawa M, Kato T, Takemshi Т, A novel method for phsohorylation of nucleosides to 5'-nucleotides, Tetrahedron Lett 1967, 50 5065 - 5068/ [зН] ACV л-рициат в положении 2 боковой цепи/ (N Е N ) Конъюгат получали, как в случае соединений 3 и 4, с той разницей, что инкубирование поли^-лизина [3H]ACvMP продолжали только 6 часов Имидазолат [3H]ACVMP получали по описанному выше способу Лормана и О р геля Конъюгированный продукт данного изобретения, полученный в предшествующих примерах, подвергали физико-химическим определениям и биологическим тестам с целью обнаружения экспериментального подтверждения терапевтических свойств этих соединений Следующие определения относятся к прилагаемым рисункам, в которых Фиг 1 изображает хроматографический график на Bio Gel p 10 Lat-nonn-L-nH3HH-ara-AMP /соединение 4 таблицы11/ Фиг, 2А - 2С показывают распределение радиоактивности в печени /п/, в селезенке /•/, в кишечнике /°/ и в мозгу / D / самок швейцарских /Swiss / мышей (28 - ЗОг), которым соединения данного изобретения /Таблица 1/ и неконъюгированные соединения для сравнения вводили при помощи внутримышечной инъекции Фиг 3 изображает хроматографический график на Bio Gel P 2 экстрактов печени мышей, инъецированных соединением 3 таблицы 1 А 2 Экспериментальные наблюдения а/ Средняя мол масса соединения 4 Фиг 1 изображает хроматографию Lat-nonn-Lлизин-ara-AMP /соединение 4 таблицы I/ на Вю Gel P 10 /1,6 х 92/ колонке, калиброванной декстраном синим 2000 /свободный объем/, рибонуклеазой /мол масса 13700/ и апротинином /мол масса 6500/ 25мг конъюгата наносили на 1,6 х 92 см колонку, уравновешенную и элюированную 0,2М NH4HCO3 Собирали фракции по 2мл Объемы элюции как конъюгата, так и маркеров /последние указаны стрелками/ определяли По способу Whltaker /Whltaker JR, Determination of molecular weghts of proteins by gelfiltration on sephadex, Anaby Chem 1963, 35 1950 - 1953/ было рассчитано, что средняя мол масса конъюгата равна 9100, что соответствует носителю с 19 остатками лизина и средней мол массе 2400 Ь/ Распределение соединений в органах 47386 10 Как уже упоминалось, фиг,, 2A-2G показывают аминогруппами галактозилированного поли-Lраспределение радиоактивности в органах мышей лизина внутри клеток печени было показано преж3 после внутримышечной инъекции А [ Н]поли- Lними исследованиями /Fiume L, Bassi, Bongmi 14 лизина (24мкг/г) В [ С] 1_а1:-поли-1_-лизина A .Conjugates of 9-p-D-arabi nofuranosyladenme , 5' 3 14 (24мкг/г), С ara-[ H] AMP (5 мкг/г), D [ C] Latmonophosphate /ara-AMP/ with lactosammated поли-І_-лизин-ага-АМР (24мкг/г), Е Lat-nonn-Lalbumin characterization of the drug-carrier bonds 3 лизин-ага-[ Н] AMP (28мкг/г), что соответствует Pharm Acta Helv 1988, 63 137 -139/ 3 3 5мкг/г ara-[ H] AMP, F [ H] ACVMP (4мкг/г), G LatФиг, 3 показывает хроматографические про3 поли-І_-лизин-[ Н]АСУМР (50мкг/г, что соответстфили на Вю Gel P2 экстрактов печени мышей че3 вует 4 мкг/г [ H]ACVMP) Все соединения инъецирез 2 и 6 часов после внутримышечной инъекции |4 ровали в объеме Юмкл на 1 животное в мышцы [ С] Lat-nonn-L-nH3HHa-ara-AMP /24мкг/г/ задних ног при помощи микрошприца Hamilton Самки швейцарских мышей 28 - ЗОг получили на25 мкл путем внутримышечной инъекции конъюгат (24мкг/г в общей объеме Юмкл) Был рассчитан вклад радиоактивности, даваемый плазмой, содержащейся в органах /Fiume После 3 /•/ или 6 /•/ часов мышей убивали L, Busi С, Vattioh A Lsctocammated human serum (каждый раз по два животных) и печени гомогениalbumin hehatotropicdrug carnen - Rate of uptake by зировали с 4 объемами холодной воды, сразу же mouse lever, FEBSLetters 1982, 146 42 - 46/, Эта добавляли 5 объемов перхлорной кислоты и почасть радиоактивности вычиталась сле центрифугирования супернатанты нейтрализовали при помощи КОН Каждый результат обозначает среднее из результатов, полученных для 2 - 3 животных Через два часа выдерживания на холоде перхлорат калия осаждали центрифугированием и Стандартная ошибка варьировалась от 0,1 до супернатанты лиофилизировалию Лиофилизиро2% от среднего ванный материал перерастворяли в 2мл НгО и Как показано после введения [3Н]поли- Lпосле центрифугирования для осветления раслизина /2А/, ara-fH]AMP /2C/ и [3Н] ACVMP /2F/ твора 1мл хроматографировали на Вю Gel P2 (1,6 количества радиоактивности в печени, селезенке, X 92) колонке и элюировали при помощи 0,2 М кишечнике и мозгу практически эквивалентны, И NH4HCO3 напротив, после инъекции [14С] Lat-поли-і-лизина /2В/ и конъюгатов Lat-поли-і-лизина с ага-АМР и Радиоактивность, присутствующая во фракACVMP, меченых в лактозе /2D/ или в лекарственциях, в которых элюировались молекулы, вклюных средствах/2Е, 2G/, уровни радиоактивности в ченные в гель и имеющие размеры, большие, чем печени выше уровней радиоактивности других размеры молекул лактозы, показывает, что полиорганов L-лизин в печени распадался на фрагменты, хотя его е-аминогруппы все еще были связаны с сахаПроценты радиоактивности, измеренной на 1г ром печени, после введения ara-[3H] AMP и [3Н] ACVMP были подобны процентам, рассчитанным Символ О в рисунке относится к хроматограпосле инъекции равной дозы этих лекарственных фическому профилю экстракта гомогенизировансредств, конъюгированных с Lat-поли-і-лизином ной печени, полученной из двух необработанных /2Е, 2G/ мышей, к которому конъюгат (14мкг/мл) добавляли непосредственно перед осаждением перхлорной В почках уровни радиоактивности достигают кислотой тех же величин, что и в печени, через час после инъекции меченых конъюатов /соединение 3 в d/ Получение антител в мышах, обработанных таблице I/ или они в 1,5 - 2 раза выше /соединения соединением А 6 и 7/ В последующие точки времени уровни ра12 самок швейцарских мышей (вес 28 - ЗОг в диоактивности в почках равны или ниже, по сравначале теста) получали конъюгат № 4 (таблица 1), нению с уровнями в печени Высокие уровни равведенный в мышцы задней ноги 5 дней в неделю диоактивности в почках могут объясняться тем, в течение 4 недель (одна дневная доза = что различные полипептиды, после гломеруляр700мкг/животное в Юмкл 0,9% NaCI) ной фильтрации, включаются клетками проксиКровоизвлечение проводили из заглазничного мальних почечных канальцев /Maack Th, Johnson сосудистого сплетения при эфирной анестезии V, Kau ST, Figueiredo J, Sigulem D , Renal filtration, через неделю после последней инъекции transport and metabolism of low molecular weight Антитела измеряли в 50мкл сыворотки в трех proteins, Kidney Int 1979, 16 251 - 270/, Проникноповторностях при помощи способа осаждения вение в почечные клетки не должно действовать сульфатом аммония по Миндену и Фарру ' на химиотерапевтический индекс конъюгатов LatВ качестве антигена применяли конъюгат 5 поли-І_-лизина с антивирусными лекарственными (таблица 1) средствами В действительности, за исключением В присутствии 50мкл сыворотки из 5 необраацикловира, который имеет тенденцию к оседаботанных мышей количество распадов в минуту нию в почечных канальцах /Balfour НН, Acyclovir /dpm/ было 78 ± 11 (стандартная ошибка, SE) В and other chemok herapy for herpes group viral присутствии Юмкл сыворотки мышей, способной infection, Ann Rev Med 1984, 35 279 - 291/, антивисоединяться либо с ага-А (938 пикомолей ага-А, русные нуклеозиды не очень токсичны для клеток вязанных 1мл сыворотки), либо с ага-АМР, конъюэтого органа, гированным с L-HAS /Fiume L, Bassi В, Busi С, Mattioh A, Wieland Th , A study on the с/ Биологическая переработка соединения 3 в pharmacokmeties in mouse of adenme-9-p-D-ara hn печени ofuranoside 5-monophosphate conjig ated with Разрушение связи между ага-АМР и є 12 47386 близительно 90% є-аминогрупп полимера были 1328/ количество распадов в минуту в осадке бызамещены 17% лекарственным средством, 73% ло 1599 ±21 лактозой В присутствии сывороток из 12 мышей, обраВ 2 Экспериментальные наблюдения ботанных конъюгатом 1_а1:-поли-1_-лизин-ага-АМР, а/ - Распределение по органам соединения 8 осажденные dpm были в диапазоне от 41 ± 5 (миФиг 4 показывает распределение по органам нимум) до 80 ± 6 (максимум) радиоактивности в мышах после внутримышечной 3 инъекции конъюгата Lat-[ H] поли-І_-орнитин агаЭтот результат показал, что ни одна из обраАМР) (36,5 мкг/г, что соответствует 5 мкг/г агаботанных мышей не образовала антитела, колиАМР)/ Экспериментальная процедура была такой чество которых измеримо при помощи примененже, как в подобных экспериментах с конъюгатами ного способа, чувствительность которого была 1_а1:-поли-1_-лизина Уровни радиоактивности в пеприблизительно 0,5 мкг Iqe/m сыворотки чени выше, чем в других органах Величины рае/ Острая токсичность соединения 4 диоактивности в почках были в 3 - 4 раза выше, Конъюгат 1_а1:-поли-1_-плизин-ага-АМР /№ 4/, чем в селезенке, кишечнике и мозгу растворенный в 0,9% NaCI, вводили внутривенно 5-ти самкам швейцарских мышей или подкожно (5II конъюгаты с высокой молекулярной массой ти животным) в виде одной инъекции 0,4 У больных с вирусным гепатитом выведение мл/животное и в дозе 1,3мг/г из организма макромолекул, имеющих на конце галактозил, гораздо медленнее, чем у мышей, Токсичность не была обнаружена крыс и здоровых людей, возможно, вследствие Инъецированная доза была в 50 раз выше по более медленного проникновения в гепатоциты сравнению с дозой, вводимой внутримышечной /Marshall JS, Williams S, Jones P Seru de sialylated инъекцией в опытах по изучению распределения glycoprotems in patients with hepatobihary конъюгата в органах/фиг 2/ dystunctions J Lab Clm Med 1978, 92 30 - 37, Было показано, что летальная доза LDso для Torram Cerenzia MR et al J Htpatol 1994, 20 307 самок мышей поли-І_-лизина, примененного для 309/ Вследствие этого у этих больных можно получения этого конъюгата, инъецированного ожидать даже более высокое почечное выведение внутривенно в виде соли соляной кислоты, нахоконъюгатов, полученных с полиаминокислотами дилась в диапазоне 30 - бОмкг/г низкой мол массы, чем измерено у мышей f/ Растворимость соединения 4 Больным с хроническим гепатитом В неконъюДля преодоления этого недостатка мы полугированный ага-АМР вводили в дозах 2,5 или чили конъюгаты с применением поли-І_-лизина с 5мг/кг при помощи двух инъекций в день высокой мол массой В этих конъюгатах также большая часть є-аминогрупп поли-І_-лизина была Конъюгат 1_а1:-поли-1_-лизин-ага-АМР /№ 4/ легзамещена молекулами лекарственного средства и ко растворяется в физиологическом растворе при галактозы концентрации 400мг/мл Следовательно, доза 24мг/кг, соответствуюМы наблюдали, что щая 5мг/кг ага-АМР может быть введена больному 1/ Конъюгаты с высокой мол массой также спевесом 70кг в объеме меньшем 5мл цифически проникают в клетки печени после внутримышечного введения В конъюгат с поли-1_-орбитином В 1 Получение 2/ Почечное выведение этих конъюгатов очень низко, и вследствие этого, процент инъецированСоединение 8 ной дозы, входящей в гепатопиты, выше процента, Это соединение получали с применением поизмеренного после введения конъюгатов с низкой ли-І_-орнитина-НВг /Sigma/ с мол массой 5300 мол массой 7600/ Поли-І_-орнитин /25мг/ метили [3Н] формальдегидом (ЮОмКи/ммоль) /NEN/ согласно 3/ Конъюгаты с высокой молю массой лишены Jentoft и Dearbon/Methods Enzymoi 1983, 91 570 высокой токсичности и после повторного внутри579/ Реакционная смесь содержала 98мкКи [3Н] мышечного и внутривенного введения не индуци3 формальдегида/мл [ Н] поли-І_-орнитин выделяли руют образование антител из реакционной смеси гель-фильтрацией на Вю 4/ Благодаря их высокой растворимости (более Gel P2 колонке с элювдей при помощи 0,5М 150мг/мл) и высокой загрузки лекарственным NH4HCO3 и затем лиофилизировали Ага-АМРсредством фармакологически активная доза моимидазолат соединяли с меченым полимером по жет вводиться в малом объеме, хорошо совмесспособу, примененному для соединений 3 и 4, тимом с внутримышечным путем введения II 1 Получение Дяя последующего лактозаминирования 10мг /3Н/ поли-І_-орнитин-ага-АМР растворяли в 1мл Эти конъюгаты получали с применением поли0,1 М бура/NaOH буфере, рН 10, вместе с 80 мг аL-лизина-НВг с мол массой 30 - 70000 и степенью лактозы и 50мг ІЧаВНзСІ Раствор инкубировали в полимеризации 145 - 335 (Sigma) Как и при полутечение 72ч при 37°С Лактозаминированный чении конъюгатов поли-І_-лизина с низкой мол конъюгат (Lat-[3H] поли-L -орнитин ага-АМР) измассой, лекарственные средства соединяли через влекали гель-фильтрацией на Вю Gel P2 колонке, имидазолат их фосфорных эфиров, а лактозу соэлюированной при помощи 0,5 NH3HCO3, и затем единяли при помощи восстановительного аминилиофилизировали 1мг соединения (удельная акрования в присутствии ІЧаВНзСІЧ Однако, процетивность 668 распадов в минуту /dpm/ на мкг) содура была модифицирована рН, температура, держал 134мкг ага-АМР (определено спектрофопродолжительность времени реакции, а также тометрически) и 604мкг лактозы/измерено по концентрация имидазо-лата увеличивались на Dubois et al Anal Chem 1956, 28 350 - 356/ Пристадии конъюгирования лекарственного средства 11 lactosamina ted albumin, Expenentia 1985, 41, 1326 14 13 47386 Кроме того, лаісгозаминирование проводили перед Затем соль пиридиния этого фосфорилиросоединением с лекарственным средством, т к при ванного производного превращали в имидазолат высоком рН поли-І_-лизин высокой мол массы /Lormann and Orgel Tetrahedron 1978, 853 - 855/, 3 осаждается, если часть e-NH2-rpynn не замещена который соединяли с Lat-[ H] поли-І_-лизином, как галактозными остатками описано для конъюгата с ага-АМР В этом конъюгате количество соединенного RIBVMP измеряли Соединение 9 по органическому фосфату согласно /Ames BN, Восстановительное лактозаминирование єAssay of inorganic phosphate Total phosphate and групп проводили растворением 200мг поли-Lphosphatasses Methoda Enzymol 1966, 8 115 лизина в 20мм 0,4М К-фосфатного буфера с рН 7 118/ вместе с 800мг а-лактозы и 500мг NaBbbCN После инкубировнния при 37°С в течение 24ч рН Вследствие сильных помех, вызываемых RIBV повышали до 8 с помощью 5М КОН и раствор оспри колориметрическом определении сахара, нетавляли при 37°С еще на 6ч 1_а1:-поли-1_-лизин возможно было измерить лактозу, как описано для диафильтровали с 0,9% NaCI и концентрировали Lat-nonn-L-nH3HH-ara-AMP, и потому определяли 3 до 100мг/мл Лактозу измеряли способом фенолсодержание Lat [ Н]поли-І_-лизина конъюгата подсерная кислота счетом радиоактивности Соединение 12 1956, 28 350 - 356/ с применением галактозы 3'-азидо-3-[2-|4с]деокситимидин ([I4C]AT) в качестве стандарта, полилизин определяли пу(Morave k) фосфорилировали согласно тем измерения азота по Къельдалю 2мл раствора Yoshikawaet ysshikawa et al /Tetrahedron Lett 1967, 1_а1:-поли-1_-лизина (= 200мг) разбавляли 2мл 1М 50 5065 - 5068/ Соль пиридиния фосфорилироNa-карбонатным буфером, рН 11 800мг имидазованного производного превращали в имидозалат и лата ага-АМР, синтезированного по Лорману и затем соединяли с І_АТ-поли-І_-лизином СоединеОргелю [Tetrahedron , 1978, 34 853 - 855/, раствоние проводили, как описано для соединения 9, но ряли и рН доводили до II 5 М NaOH в реакционной среде отношение количества имиПосле инкубирования при 50°С в течение 96ч дазолата лекарственного средства к количеству конъюгат диафильтровали с 0,9% NaCI Химичеполимера было 2,7 вместо 4 Химическую харакские характеристики комплекса получали спектеристику этого конъюгата выполняли, как описатрофотометрическим определением связавшегося но для соединения 9 лекарственного средства и измерением лактозыо Вклад ага-АМР при проведении колориметричеСоединение 13 ского анализа вычитали Содержание поли-LЭтот конъюгат получали, как соединение 9, но лизина конъюгата рассчитывали из количества лактоза-минирование поли-І_-лизина прерывали лактозы по известному отношению лактоза/полипосле первых 24 ч Кроме того, отношение колиL-лизин, определенному перед связыванием лечества имидазолата ага-АМР к количеству поликарственного средства (см выше) Это было возмера было 4,6 вместо 4 30% є-аминогрупп этого можно, поскольку связь между сахаром и єполимера были замещены галактозильными осгруппами лизина не разрывалась во время конъютатками и 64% были замещены ага-АМР гирования лекарственного средства, как было II 2 Экспериментальные наблюдения 9 проверено экспериментально Конъюгат концежа/- Средние мол массы соединения 9 трировали в солевом растворе (0,9% NaCI) до Их определяли при помощи проникающей 150мг/мл и лиофшшзировали после замораживахроматографии с применением оборудования ния приблизительно до -80°С Концентрацию HPLC (ЖХВР) (Waters) с двумя соединенными конъюгата рассчитывали, не принимая во внимаколонками Protem-Pak (125 и 300SW) Соединение ние противоионы 9 (80мкг) растворяли в 20мкл подвижной фазы (125мМ Na2SO4 + 2 мМ NaH2PO4 H2O, доводили до Перед применением конъюгат Lat-nonn-LрН 6,0 0,1 N NaOH, фильтровали и дегазировали) лизин-ага-АМР разбавляли водой при концентраи хроматографирова-ли при следующих условиях ции 150мг/мл Он легко растворялся при условии, Скорость потока 0,9мл/мин, детектирование УФ что замораживание было быстрым При необхопри 260нм, 0,1 единиц поглощения на всю шкалу димости конъюгат разбавляли 0,9% NaCI (AUFS) Колонки калибровали апротинином (Mr Соединение 10 6500), РНКазо (ММ 13700), HSA (человеческий Перед соединением с ага-АМР Lat-nonn-Lсывороточный альбумин) /Mr 69000/ и IgG (Mr лизин метили [3Н|формальдегидом /NEN/ согласно 158000) Среднемассовую молекулярную массу и Jentoft и Dearbon/Methods Enzymol 1983, 91 570 3 среднечисловую молекулярную массу определяли 579/ Реакционная смесь содержала 78мкКи [ Н] с применением GPC 745/745B Wafers Sojtware формальдегида/мл После диафильтрования о 3 Они были равны 140339 и 72419, соответственно 0,9% NaCI 1_а1:-[ Н]поли-1_-лизин конъюгировалв с Гель-проникащая хроматография соединения 9 ага-АМР, как описано выше показана на фигю 5ю Соединение 11 Ь/ - Распределение соединений по органам Рибаварин (RIBV) (i-p-D-рибофуранозилПрименяли экспериментальную процедуру, 1,2,4-триазол-З-карбоксамид) сначала фосфориописанную для подобных экспериментов с конъюлировали (RIBVMP) согласно/Allen LB, Boswell KH, гатами низкой мол массы Результаты представKhwaja ТА, Meyer RB, Sidwell RW, Witkowski JT лены на фиг 6 Syhthesis and antiviral achivite of some phosphates of the broad-spectrum antiviralnucleoside, l-p-DКонъюгаты ака-АМР и RIBVMP были радиоакRibofuranosyl-1,2f4-tnazole-3-carboxamide тивны в носителе, в то время как конъюгат AZTMP /Ribavann/ J Med Chem 1978, 21 742-746/ был меченым в молекуле лекарственного сред 15 47386 16 ства которые получили тот же самый конъюгат внутриПосле внутримышечного введения конъюгамышечно (фиг 6, А) Это можно объяснить с учетов, меченых в носителе (фиг 6, А, С), радиоактом того, что тивность была высокой в печени и низкой в селе/і/ часть молекул конъюгата имела мол, массу зенке, кишечнике и почках Проценты более низкую, чем мол, масса HSA (человеческого инъецированной радиоактивности (dpm), извлесывороточного альбумина) /фиг 5/, ченной в почках, были в 10 - 20 раз ниже, чем из/и/ существует прямая зависимость между меренные после внутримышечного введения комконцентрацией плазмы и гломерулярной фильтплексов, полученных с поли-І_-лизином низкой рацией малых белков /Maack TH al Kidney Int мол массы Поскольку почечное накопление бел1979, 16 251 -270/, ков является следствием их гломерулярной /їм/ концентрация конъюгата в плазме, которая фильтрации /Maack TH, Johnson V, Kau ST, постоянно низка (менее 0,9мкг/мл) после внутриFiguereido J, Sigulem D Renal filtration, transport, мышечного введения, достигает высоких величин and metabolism of low-molecular weigt proteins A после внутривенной инъекции (104мкг/мл при 3 review Kidney Int 1979, 16 251 - 270/, данный ремин) зультат показывает, что, как и ожидалось, только с/ - Эксперименты по толерантности к лекармалые количества конъюгатов высокой мол масственному средству и иммуногенности сы проходили через почечные клубочки, по меньЭксперименты проводили с применением сошей мере после внутримышечного введения единения 9, Конъюгат, введенный внутривенно (см ниже) (i v) 5 мышам в дозе 1,5г/кг, не вызвал какоголибо признака страдания 0 1,5г І_аі-поли-І_-лизинУ мышей, инъецированных внутримышечно ara-AMP содержали 480мг лекарственного средстконъюгатом Lat-nonH-L-nH3HH-([l4C]AZTMP, урова (см таблицу 2), дозу в 300 раз более высокую, вень радиоактивности в печени был в 2,5 - 6 раз чем доза, при которой ага-АМР, конъюгированный выше, чем в почках, селезенке и кишечнике (фиг с L-HAS, ингибирует рост вируса у инфицирован6, 1 ) Различие между количеством радиоактивных HBV больных У мышей LDso поли-І_-лизина, ности в печени и в других органах было менее примененного для получения конъюгата, при заметным, чем у животных, которым вводили внутривенном введении в виде соли HCI была конъюгаты, меченые в носителе (фиг 6, 1, С) между 15 и 30мг/кг Для выяснения, может ли LatЭтот результат, возможно, обусловлен частичным поли-І_-лизин-ага-АМР, растворенный в солевом выделением лекарственного средства /и (или) его растворе в концентрации 150мг/мл, разрушать метаболитов/ из клеток печени в кровоток после ткани в месте введения, проводили эксперимент внутриклеточного расщепления связи между лепо первичному раздражению глаз у 6 кроликов карственным средством и носителем Подобное путем помещения 0,1мл этого раствора в конъюквыделение лекарственного средства из клеток тивалъный мешочек Ни у одного животного не печени в кровоток наблюдали после введения наблюдали изменений в глазах других гепатотропных конъюгатов лекарство /носитель /Fiume L, BHSI С, Corzam S, Di Stefano G, Gervasi GB, Mattioh A Organ distribution of a conjugate of adenme arabmoside monophosphate with lactosammated albumin in the rat J Hepatol 1994, in press, Fiume L, Mattioh A, Balbom A, Tognon M, Barbanti-Brodano G, De Vnes Jand Wiel and Th Enhanced inhibition of virus DNA synthesis by hepatocytes by triflurothymidme cjupled to asialofetuin FEBC Lett 1979, 103 4 7 - 5 1 / При внутримышечной инъекции свободного [I4C]AZTMP мышам радиоактивность одинаково распределялась в печени, селезенке и кишечнике с более высокими величинами в почках (фиг 6, Е)„ Скорость накопления и снижения радиоактивности после введения свободного или связанною [I4C]AZTMP была различной После инъекции свободного лекарственного средства радиоактивность накапливалась в тканях в течение первых 15 минут и затем быстро снижалась, после инъекции конъюгиро-ванного лекарственного средства радиоактивность в печени увеличивалась до 4 5ч При 1 - 2ч количества радиоактивности в печени были выше в животных, инъецированных конъюгированным [I4C]AZTMP при дозе 2 МКГ/Г, чем в животных, которым вводили 5мкг/г свободного лекарственного средства У мышей, инъецированных внутривенно Lat [3Н]поли-І_-лизин-ага-АМР (фиг 6, В), конъюгат быстро накапливался в печени, у этих животных радиоактивность в почках была выше, чем у тех, Полутонкие срезы печени из мышей и крыс, которые получили Lat-nonn-L-nH3HH-ara-AMP, введенный по различным схемам (см таблицу 3), наблюдали под световым микроскопом, ни в одном из этих животных не обнаружили изменений ни в паренхимных, ни в синусоидальных печеночных клетках Накопление во вторичных лизосомах не полностью расщепленных молекул (дисахаридов, пептидов), которые не могут проходить через мембрану лизосом, приводит к быстрому набуханию этих органелл, которые в световом микроскопе выгладят как цито-плазматические вакуоли Такие вакуоли наблюдали в печеночных клетках мышей и крыс через 24ч после одного введения LHSA-ara-AMP при дозах в 5 - 10 раз более высоких, чем дозы, которые активны в инфицированных HBV больных /Fiume L, Betts CM, Busi С, Corzam S, Derenzim M, Di Stefano G, Mattioh A The pathogenesis of vacuoles produced in rat and mouse liver cell by a conjugate of adenme arabmoside monophosphate with lactosammat al bumm J Hepatol 1992, 15 314 - 322/ Отсутствие вакуолей в печеночных клетках мышей и крыс после введения высоких доз Lat-nonn-L-nH3HH-ara-AMP дало косвенное доказательство быстрого расщепления этого конъюгата до продуктов, способных проходить через мембрану лизосом Для исследования иммуногенности доз Latполи-І_-лизин-ага-АМР 24 мыши получали конъюгат 5 дней в неделю в течение 4 последователь 18 17 47386 ных недель (одна дневная доза = вводить внутривенным инъевдрованием, посколь200мкг/животное) Двенадцать мышей инъецироку при ином введении они иммуногенны, конъюгавали внутримышечно и двенадцать внутривенно» ты, полученные с использованием галактозилироЧерез неделю после последней инъекции провованного поли-І_-лизина, потенциально способны, дили кровоизвлечение и антитела против конъюпри инфекции печеночными вирусами, улучшить гата измеряли, как описано для конъюгатов низкой соблюдение больными режима и схемы лечения с мол массы Ни одно из животных не образовывадлительным введением антивирусного состава ло антител в количествах, детектируемых в нашем Как уже упоминалось, все вышесказанное касаетанализе (чувствительность приблизительно 0,5мкг ся конъюгатов, в которых носителем был поли-LigG/мл сыворотки) лизин или поли-І_-орнитин экспериментально проверенные физико-химические свойства и биологиИз предшествующих экспериментальных данческое поведение делают приемлемым идентичных можно считать наиболее вероятно доказанное использование в качестве носителей других ным, что конъюгаты антивирусных нуклеозидов с полиаминокислот галактозилированным поли-1_-лизином, в которых большая часть є-аминогрупп гомополимера замеПоэтому подобные другие конъюгаты попадащена галактозными остатками и лекарственными ют в сферу действия данного изобретения, так же средствами, при внутримышечной инъекпии осукак применение таких полиаминокислот в качестве ществляют доставку лекарственных средств в носителей для приготовления гепатотропных печень без образования антител конъюгатов с антивирусными соединениями, введение которых иным путем было бы серьезно заКонъюгаты не обладают сильной токсичнотруднено неблагоприятными побочными явлениястью поли-1_-лизина, применяемого для их пригоми, вызываемыми высокой токсичностью для товления По сравнению с конъюгатами с лактодругих органов, иных чем печень заминированным альбумином, которые нужно, Таблица 2 Характеристики коньюгатов поли-І_-лизина с высокой молекулярной массой Соединения 9) 10) 11) 12) 13) 1_а1:-поли-1_-лизин-ага-АМР Lat-pH]- поли-І_-лизин-ага-АМР Lat-pH]- поли-І_-лизин-тВ\/МР Lat-nonH-L-nH3HH-[14c] AZTMP І_а1:-поли-І_-лизин-ага-АМР лактоза (мкг) соединен (мг) 385 352 396 371 210 лекарство (мкг) соединен (мг) 330 312 299 219 440 % s - NH2 групп, замещенных лактоз 48 44 46 45 31 dpm/мкг лекарст 43 41 39 26 64 0 2910 2504 466 0 Таблица З Схема введения 1_а1:-поли-1_-лизин-ага-АМР мышам и крысам для микроскопического исследования клеток печени Животные Мыши -"-"Крысы -"-" Дневная доза (мкг/г) 6 30 60 6 30 60 Путь инъекции і і і і і і Дни введения v внутримышечное v внутривенное v внутривенное m внутримышечное m внутримышечное v внутривенное 20 1 1 7 7 1 19 47386 Животных убивали через 24 часа после последней инъекции Пробы печени фиксировали и полутонкие срезы окрашивали, как описано в 20 /Fiume L ,Betts M С , Busi С , Corzam S , Derenzmi M , Di Stefano G , Mattioh A, J Hepatol 1992, 15 314-322/ io 28 32 36 40 44 48 52 Номер франции 3 4 25 30 35 АО 4S 50 55 60 Номер фракции Фиг 1 12 20 Фиг. 3 0 1 2 3 4 0 \ 2 1 * Печень ПОЧКИ Селезенка Кишеинин Мозг О 1 2 б 3 і І з \ а і з з * 3 4 Бремя /часы/ Фиг. 4 а і ! ї * Фиг 2 о і і з Бремя /часы/ 21 і 1 ' "і ? 9 11 •'"Г" 13 15 22 47386 ""¥ *НІН | ••••• Ч " " (ҐГ~— • і " 17 1 9 21 23 S S Ш У Стрелки I, 2, 3 и 4 указывают Icfr, человеческого cuEppOTOiiiroro альбу^ /млн./ Время /чаек/ уіерживачия" йи ЙДЛ ГНКазы и Фиг 5 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюHepatotropic conjugate of antiviral drug, process for preparing conjugate and farmaceutical formulation
Назва патенту російськоюГепатотропный конъюгат противовирусного лекарственного средства, способ его получения и фармацевтическая композиция
МПК / Мітки
МПК: A61P 31/12, A61K 47/48
Мітки: засобу, одержання, кон'югат, антивірусного, фармацевтична, гепатотропний, композиція, спосіб, лікарського
Код посилання
<a href="https://ua.patents.su/11-47386-gepatotropnijj-konyugat-antivirusnogo-likarskogo-zasobu-sposib-jjogo-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Гепатотропний кон’югат антивірусного лікарського засобу, спосіб його одержання та фармацевтична композиція</a>
Попередній патент: Розпилювальна сушильна установка для рідких харчових продуктів
Випадковий патент: Суміш для приготування спеціальних рідин