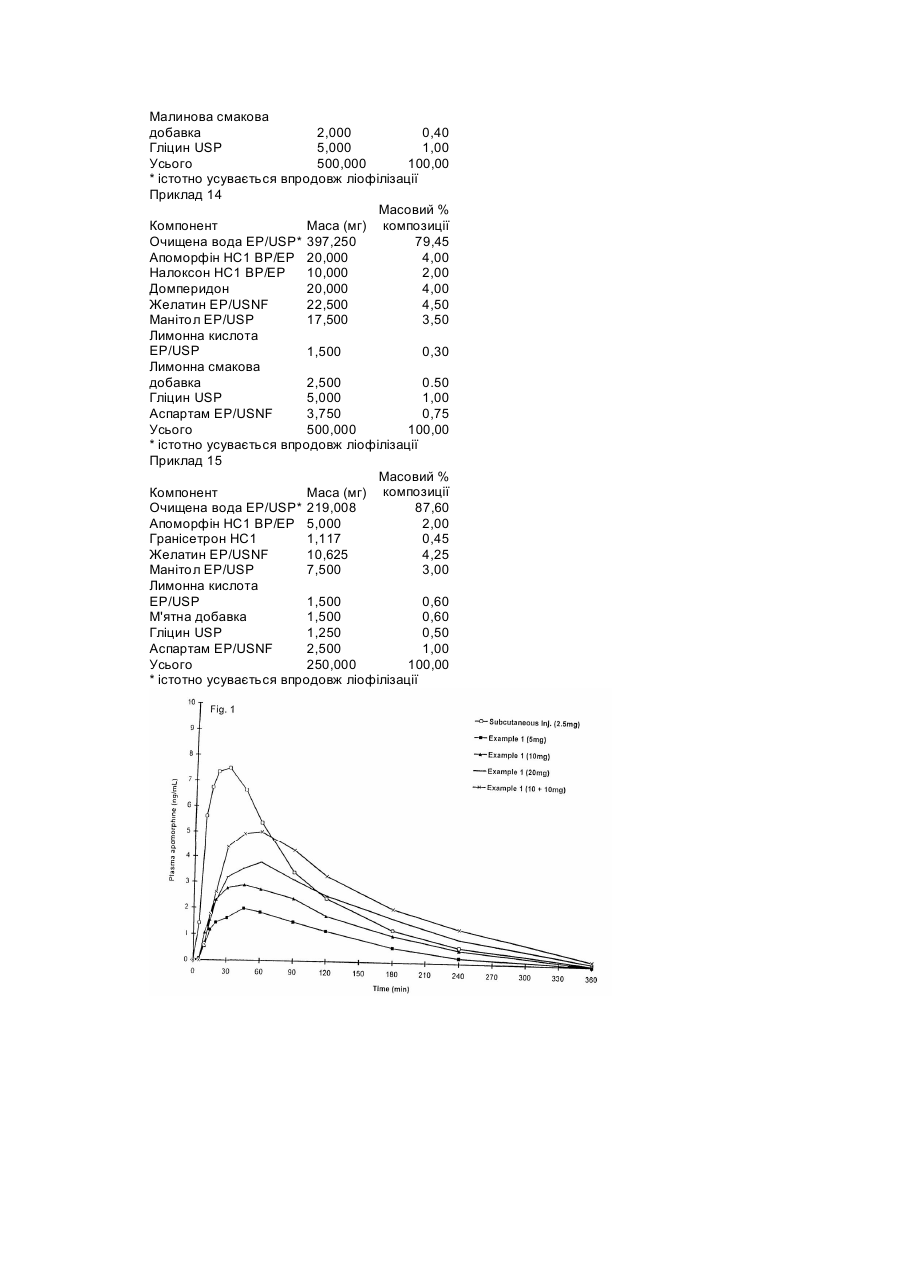
Оральні швидкорозчинювані композиції агоністів допаміну та спосіб лікування хвороби паркінсона
Номер патенту: 64700
Опубліковано: 15.03.2004
Автори: Грін Річард Девід, Джонсон Едвард Стюарт, Кларк Ентоні
Формула / Реферат
1. Фармацевтична композиція для орального введення, яка складається, по суті, з желатину у концентрації до 5 % по масі як носія, води і, як активного інгредієнта, апоморфіну або його солі, яка відрізняється тим, що композиція являє собою тверду одиничну лікарську форму, що швидко диспергується, яка складається, по суті, з просторової сітки активного інгредієнта і носія, який є інертним по відношенню до активного інгредієнта після сублімації зазначеної води з зазначеної композиції у твердому стані, і де вказана лікарська форма повністю дезінтегрується протягом від 1 до 30 секунд після введення в ротову порожнину.
2. Композиція за пунктом 1, яка відрізняється тим, що містить принаймні один додатковий носій.
3. Композиція за пунктом 1, яка відрізняється тим, що вона додатково містить принаймні один агент, вибраний з групи, яка складається з антиблювотних засобів, опіоїдних антагоністів, ексципієнтів і смакових добавок.
4. Спосіб лікування хвороби Паркінсона, який відрізняється тим, що, по суті, включає введення у ротову порожнину пацієнта терапевтично ефективної кількості композиції за п. 1.
5. Спосіб за п. 4, який відрізняється тим, що зазначена композиція додатково містить, принаймні один агент, вибраний з групи, яка складається з антиблювотних засобів, опіоїдних антагоністів, ексципієнтів і смакових добавок.
6. Спосіб за п. 4, який відрізняється тим, що зазначена композиція містить принаймні один додатковий носій.
7. Спосіб лікування хвороби Паркінсона, який відрізняється тим, що, по суті, включає введення у ротову порожнину пацієнта терапевтично ефективної кількості композиції за п. 2.
8. Тверда лікарська форма, яка швидко диспергується, одержана сублімацією розчинника з композиції у твердому стані, де композиція складається по суті з:
(а) води;
(b) принаймні одного опіоїдного агоніста, вибраного з групи, що складається з апоморфіну, N – пропілнорапоморфіну, бромкриптину, каберголіну, лізуриду, метерголіну, наксаголіду, перголіду, пірибедилу, ропінеролу, тергуриду і хінаголіду, їх солей і сумішей;
(c) принаймні одного агента, що формує матрицю;
(d) принаймні одного агента, вибраного з групи, що складається з поверхнево-активних речовин, консервантів, антиоксидантів, загусників, підфарбовуючих речовин, смакових добавок, модифікаторів рН, підсолоджувачів, протиблювотних агентів, опіоїдних антагоністів і ексципієнтів; і,
де зазначена тверда лікарська форма, що швидко диспергується повністю дезінтегрується протягом від 1 до 30 секунд після введення у ротову порожнину.
9. Тверда лікарська форма, яка швидко диспергується, за п. 8, яка відрізняється тим, що складається по суті з:
(а) води;
(b) апоморфіну солянокислого;
(c) желатину;
(d) манітолу; і
(е) лимонної кислоти.
10. Тверда лікарська форма, яка швидко диспергується, за п. 9, яка відрізняється тим, що до її складу додатково входить підсолоджувач.
11. Тверда лікарська форма, яка швидко диспергується, за п. 10, яка відрізняється тим, що до її складу додатково входить смакова добавка.
12. Тверда лікарська форма, яка швидко диспергується, за п. 11, яка відрізняється тим, що до її складу додатково входить гліцин.
13. Тверда лікарська форма, яка швидко диспергується, за п. 9, яка відрізняється тим, що до її складу додатково входить принаймні один агент, вибраний з групи, яка складається з антиблювотних засобів, опіоїдних антагоністів, ексципієнтів і смакових добавок.
14. Тверда одинична лікарська форма, яка дезінтегрується протягом від 1 до 30 секунд після введення в ротову порожнину, одержана у спосіб, який включає:
(а) диспергування у воді принаймні одного агента, що формує матрицю, з утворенням дисперсії/розчину;
(b) додавання до зазначеної дисперсії/розчину принаймні одного агоніста допаміну для одержання дисперсії/розчину агоніста;
(c) додавання до зазначеної дисперсії/розчину агоніста принаймні одного агента, вибраного з групи, що складається з поверхнево-активних речовин, консервантів, антиоксидантів, загусників, підфарбовуючих речовин, смакових добавок, модифікаторів рН підсолоджувачів, протиблювотних агентів, опіоїдних антагоністів і ексципієнтів для одержання кінцевої дисперсії;
(d) розподілення кінцевої дисперсії у попередньо сформовані блістерні поглиблення і заморожування кінцевої дисперсії у зазначених блістерних поглибленнях для одержання замороженої кінцевої дисперсії; і
(е) сублімаційне висушування у пристрої для сублімаційного висушування зазначеної замороженої кінцевої дисперсії для одержання зазначеної твердої одиничної лікарської форми.
15. Тверда одинична лікарська форма, яка відрізняється тим, що зазначена кінцева дисперсія містить:
(а) не більше ніж 5 % (за масою) желатину;
(b) гідрохлорид апоморфіну;
(c) манітол; і
(d) лимонну кислоту.
Текст
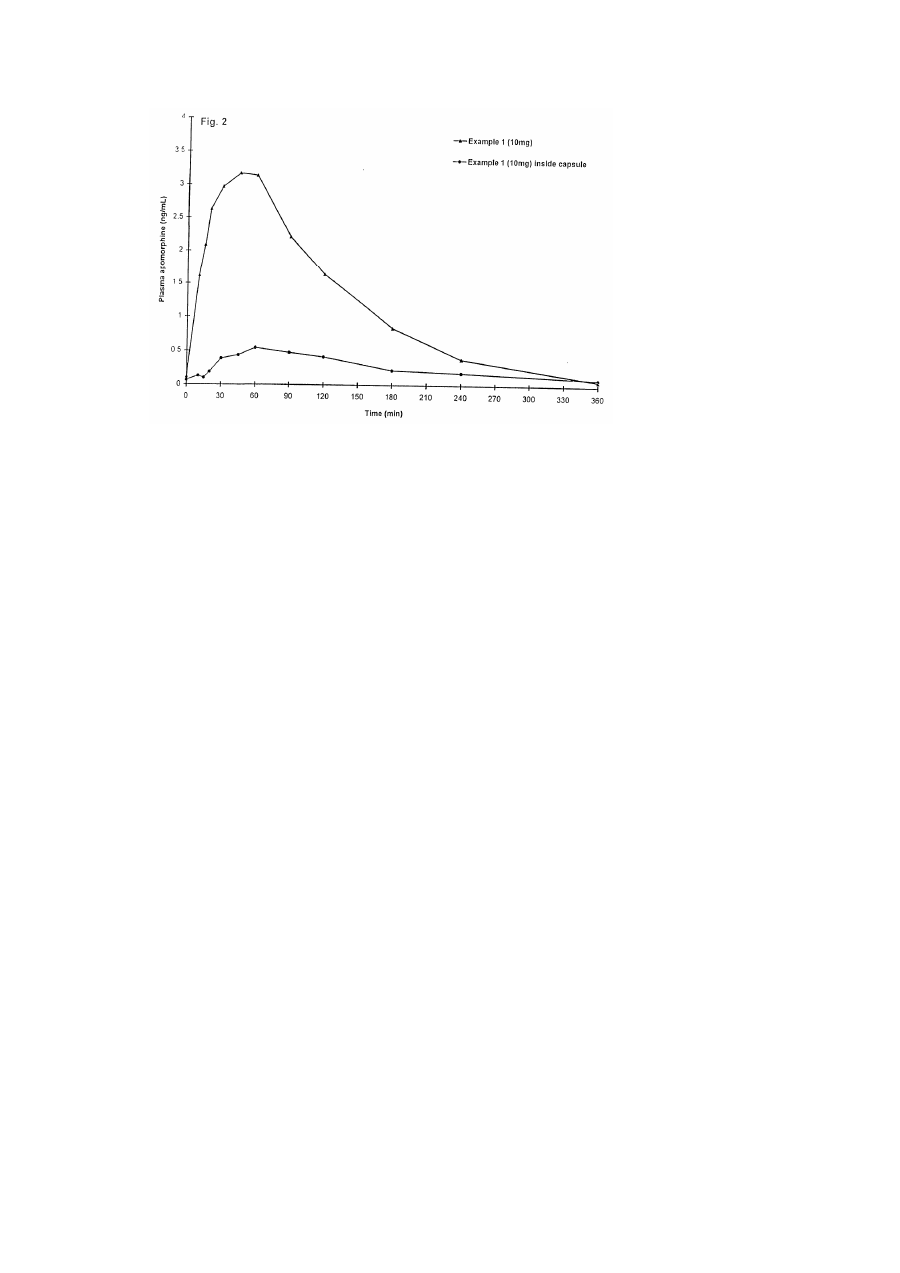
Цей винахід стосується фармацевтичних композицій, способу приготування таких композицій, використанню таких композицій для лікування і/або оцінки ступеню розвитку хвороби Паркінсона, продуктів і наборів реактивів для введення агоніста допаміну та спільного введення агоніста допаміну і протиблювотного засобу і/або опіоїдного антагоніста. Хвороба Паркінсона - прогресуюче нейродегенеративне порушення, що виникає через втрату клітинних тіл дофамінергетичних нейронів з чорної речовини (substantia nigra) та дегенерацію нервових терміналей у смугастому тілі (corpus striatum) на тлі низького рівня дофаміну в чорній речовині та смугастому тілі. Хвороба Паркінсона характеризується хронічною прогресуючою дисфункцією активності, її головними симптомами є тремор у спокої, ригідність мускулатури та зниження частоти довільних рухів (гіпокінезія), що супроводжується труднощами при ходінні напочатку та наприкінці руху, а також при виконанні повторів. Постійний тремор накладається на гіпертонус груп м'язів-антагоністів, тому початок рухів стає все складнішим і повільнішим. У задавнених випадках рухи хворих фактично стають "замороженими" і вони втрачають здатність самостійно пересуватися. Дослідження довели, що симптоми хвороби Паркінсона виявляються тоді, коли вміст дофаміну у смугастому тілі знижується до 20-40% від нормального. Оскільки хвороба Паркінсона пов'язана зі втратою смугастим тілом дофаміну, вона як правило, лікується препаратами, які заміщують дофамін, з них найчастіше використовується леводофа. Леводофа під впливом дофадекарбоксилаза у мозку перетворюється на дофамін, який має терапевтичний ефект. Але, незважаючи на те, що леводофа добре, всмоктується тонким кишечником, більша його частина інактивуєсться під впливом моноамінооксидази у стінках кишечнику. Окрім того період піввіку леводофа у плазмі крові малий і близько 95% препарату перетворюється на дофамін у периферійних тканинах де поширена дофадекарбоксилаза, внаслідок чого до мозку потрапляє менше ніж один відсоток препарату. Отже, леводофа має вводитися часто та великими дозами. Окрім того, утворення дофаміну в периферійних тканинах спричиняє до появи небажаних побічних ефектів. Таким чином, леводофа, як правило, назначається разом з іншими препаратами, які збільшують його вплив на мозок, максимально зменшуючи периферійні ефекти. Зокрема, леводофа зазвичай застосовується разом з інгібітором активності дофадекарбоксилази периферійних тканин, не спроможним подолати гематоенцефалічний бар'єр, таким як карбідофа, який уповільнює розпад леводофа до дофаміну поза мозком, зменшуючи, таким чином, небажані периферійні ефекти. Результатом дії інгібітора є також те, що досить значна кількість оральної дози леводофа досягає мозку, внаслідок чого стає можливим зменшення дози леводофа, що також знижує периферійні побічні ефекти. Окрім того, периферійний антагоніст дофаміну, який не потрапляє крізь гематоенцефалічний бар'єр, такий як домперидон, також може вводитися для зменшення нудоти та блювоти як побічних ефектів леводофа. Окрім згаданих вище побічних ефектів, існують інші небажані явища, пов'язані з тривалістю вживання леводофа. Зокрема, у багатьох пацієнтів розвиваються мимовільні хореєподібні рухи, які є наслідком надмірної активації дофамінових рецепторів. Ці рухи охоплюють обличчя та кінцівки і можуть переноситися дуже важко. Вони зникають, якщо зменшити дозу леводофа, але це знову призводить до ригідності. Більш того, межа між бажаними та небажаними ефектами, напевно, поступово стає все вужчою залежно від того, як збільшується тривалість лікування з допомогою леводофа. Традиційний метод боротьби з цим ефектом полягає у збільшенні частоти введення леводофа із дотриманням при цьому постійної сумарної дози. Цей підхід знижує погіршення стану після введення дози та зменшує ймовірність розвитку у пацієнтів дискінезії, яка проявляється при великих разових дозах. Ще одним ускладненням у разі тривалого лікування препаратом леводофа є розвиток швидких флуктуацій у клінічному стані пацієнта, що супроводжується раптовими переходами від рухливості до нерухливості та навпаки впродовж інтервалів часу від кількох хвилин до кількох годин. Цей феномен відомий як ефект включення га виключення", де "включення" є найкращим станом, за якого можлива майже нормальна робота моторних функцій, а стан "виключення" характеризується дистонічними позами під час періодів зниженої рухливості. Дійсно, внаслідок цього впливу можлива така раптова втрата рухливості, що хворий може різко зупинитися при ходінні, або буде неспроможний встати зі стула, на який він нормально сів за кілька хвилин до того. Маніпуляції з дозами леводофа на цей ефект, як правило, не впливають, тож може знадобитися лікування альтернативними препаратами. На додаток до згаданих вище побічних ефектів у разі тривалого застосування леводофа винайдено, що ефективність леводофа постійно знижується зі збільшенням періоду його використання доти, поки він повністю не втрачає ефективність. Спостерігалося також збільшення випадків злоякісної меланоми у пацієнтів, яких лікували препаратом леводофа. У зв'язку з цим припускається, що лікування препаратом леводофа може мати відношення до розвитку злоякісної меланоми. Таким чином, використання леводофа не є найкращим засобом для лікування хвороби Паркінсона. Альтернативним підходом до лікування хвороби Паркінсона є використання ліків, які мають дофаміноподібний ефект. Уцілому такі ліки відомі як агоністи дофаміну, тому що вони безпосередньо стимулюють дофамінові рецептори в області нігростриатумного тракту при дефіциті в ньому дофаміну. На відміну від леводофа, агоністи дофаміну не потребують перетворення у мозку на активні сполуки. Агоністи дофаміну ефективні також у пацієнтів із задавненими стадіями хвороби Паркінсона, коли леводофа втрачає ефективність, оскільки вони (агоністи) діють безпосередньо на дофамінові рецептори, отже на них не позначається нестача у таких хворих дофамінопродукуючих нервових клітин. Проте, дія цих агоністів дофаміну на дофамінові рецептори також спричиняє небажані дофаміноергічні ефекти, такі як нудота, блювота й екстрапірамідальні ефекти, здатні послабити здоров'я. Окрім того, деякі агоністи дофаміну, такі як апоморфін, пов'язані, особливо при використанні великими дозами, з додатковими небажаними побічними ефектами, такими як седативна дія, ускладнене дихання, гіпотензія, брадикардія, спітніння та позіхання. На складність і природу побічних ефектів може впливати спосіб введення ліків. Наприклад, під час дослідження дії апоморфіну вивчалися різні способи введення цього препарату. Щоб досягти необхідного терапевтичного ефекту в разі орального введення таблеток апоморфіну, потрібні великі дози, оскільки апоморфін, введений у такий спосіб, зазнає інтенсивного метаболізму в тонкому кишечникові та/або печінці до потрапляння в системну циркуляцію (ефект первинного проходження). Окрім того, дослідження тривалості дії таких введених орально форм припинялися через 7-10 днів через незрозуміле підвищення у крові азоту сечовини. Сублінгвальне введення таблеток апоморфіну за такого способу лікування спричиняло важкий стоматит при позитивному вживанні з укриванням виразками слизової щік у половини пацієнтів. Інтраназальне введення спричинило тимчасову блокаду носового дихання, відчуття опіку та набрякання носу і губ, а у деяких обстежуваних пацієнтів мало припинитися через появу хімічно індукованого запалення слизової носу. Таким чином, єдиним задовільним способом введення апоморфіну, за якого можна уникнути великого ступеню метаболізму при первинному надходженні, як було показано, є підшкірне введення, тому єдиним комерційно доступним препаратом апоморфіну є рідкий препарат для підшкірного введення або підшкірної інфузії. Навіть у разі підшкірного введення не можна уникнути побічних ефектів звичайних антагоністів дофаміну, таких як нудота і блювота, до того ж підшкірне введення, ін'єкція це чи інфузія, складне для виконання, особливо у пацієнтів із порушенням моторних функцій. Зважаючи на це пацієнтів і персонал потрібно навчати догляду за хворими. Окрім того, місце введення необхідно змінювати кожні 12 годин для максимального зменшення ризику зміни кольору шкіри та утворення вузлів. З огляду на ці проблеми не дивно, що використання агоністів дофаміну, таких як апоморфін, у лікуванні хвороби Паркінсона здебільшого пов'язане з терапією в період "виключення", спричиненого лікуванням препаратом леводофа, незважаючи на очевидні клінічні переваги таких препаратів над леводофа. З наведеного вище стає зрозумілим, що з клінічного погляду було б дуже бажано винайти спосіб застосування агоністів дофаміну, таких як апоморфін, який був би простим для введення пацієнтові, зменшував цим необхідність спостереження за введенням і не зазнавав метаболізму при первинному потраплянні в печінку. Таким чином, цей винахід являє собою фармацевтичну композицію для орального введення із носієм та агоністом дофаміну як активний компонент, який характеризується в цьому складі тим, що має швидкодисперговувану лікарську форму, призначену для швидкого вивільнення активного компонента у ротовій порожнині. Виявлено, що такі швидкодисперговувані лікарські форми індукують передгастральну абсорбцію активного компонента, тобто відбувається абсорбція активного компонента частини травного шляху, розташованого до шлунку. Термін "передгастральна абсорбція" має на увазі абсорбцію у слизовій щік, сублінгвальну, орофарингеальну абсорбцію та абсорбцію у стравоході. Агоністи дофаміну, абсорбовані такою передгастральною абсорбцією, потрапляють безпосередньо у системну циркуляцію, уникаючи, таким чином, метаболізму під час первинного потрапляння в печінку. Отже, фізіологічна доступність агоністів дофаміну, абсорбованих у такий спосіб, також може збільшуватися. Це означає, що доза таких агоністів дофаміну може бути зменшена при збереженні його бажаної лікувальної дії, і це зменшення дози супроводжуватиметься відповідним зменшенням небажаних побічних ефектів. Окрім того, клінічні дослідження довели, що у 23-52% пацієнтів із хворобою Паркінсона спостерігаються труднощі з ковтанням, і що такі пацієнти мають тенденцію пускати слину. Отже, такі швидкодіючі лікарські форми мають додаткову перевагу, оскільки вони швидко диспергуватимуться в роті, максимально зменшуючи згадані вище проблеми, тому що разом з ними не вводитимуться значні обсяги води. Таким чином, очікується, що ці швидкодисперговувані лікарські форми легше переноситимуться пацієнтами та полегшуватимуть медичному персоналу їх введення. Один приклад швидкодисперговуваної лікарської форми описано в патенті США №4855326, в якому розплавлюваний волоконний агент-носій, такий як цукор, комбінується з активним компонентом, -і кінцевій суміші надається волоконна форма у вигляді препарату "льодяникової нитки". Волоконний продукт "льодяникової нитки" потім ущільнюється на швидкодисперговувану великопористу тверду лікарську форму. У патенті США №5120549 розкрито швидкодисперговувану зв'язуючу систему, отриману шляхом первинного затвердіння зв'язуючої системи, розчиненої в першому розчиннику, та наступного контакту затверділого матрикса з другим розчинником, який легко змішується з першим розчинником пои температурі нижчій за точку затвердіння першого розчинника; елементи, що формують матрикс, та активний компонент погано розчиняються у другому розчиннику, за рахунок чого більша частина першого розчинника вилучається та формується швидкодисперговуваний матрикс. Патент США №5079018 розкриває швидкодисперговувану лікарську форму, яка має пористу волоконну структуру розчинюваного у воді гідратованого гелю або піноутворюючого матеріалу, попередньо гідратованого обробкою водою та затверділого в гідратованому стані за присутності агента-затверджувача, і диспергованого за допомогою рідкого органічного розчинника за температури близько 0°С або нижче для вивільнення простору, зайнятого гідратуючою рідиною. Опублікована міжнародна заявка № WO 93/12769 (PCT/JP93/01631) містить опис швидкодисперговуваних лікарських форм наднизької щільності, утворених формуванням желе агару, рідких систем, які містять елементи зв'язувального матрикса та активний компонент, з наступним видаленням води за допомогою стисненого повітря або вакуумного сушіння. У патенті США №5298261 описано швидкодисперговувані лікарські форми, які являють частково злиплу сітку матрикса, висушеного під вакуумом за температури, яка перевищує температуру злипання матрикса. Але, краще, щоб матрикс принаймні частково висушувався при температурі, меншій за рівноважну точку його замерзання. Опублікована міжнародна заявка № WO 91/04757 (PCT/US90/05206) містить опис швидкодисперговуваних лікарських форм, які мають диспергований агент, що індукує утворення бульбашок, і призначений для утворення бульбашок при контакті зі слиною, що забезпечує швидке розчинення лікарської форми та розсіювання активного компонента у ротовій порожнині. Таким чином, термін "швидкодисперговувана лікарська форма" охоплює всі типи лікарських форм, опис яких наведено у попередніх параграфах. Проте, особлива перевага надається лікарській формі згідно з патентом U.K. №1548022. яка є твердою швидкодисперговузаною лікарською формою із волоконною структурою лікарської форми та водорозчинним або еодорозсіюваним носієм, інертним до активного компонента Волоконну структуру отримують сублімацією розчинника зі сполуки, що має тверду форму та містить активний компонент і розчин носія в розчиннику. Перевага віддається тому, щоб сполука згідно з винаходом дісінтегрувалася впродовж від 1 до 60 секунд, краще від 1 до 30 секунд, особливо від 1 до 10 секунд та найкраще від 2 до 8 секунд, при потраплянні її в ротову порожнину. У разі описаної вище швидкодисперговуваної лікарської форми, якій надається перевага, композиція на додаток до активного компонента повинна містити агенти, що утворюють матрикс, і компоненти вторинного призначення. Придатні для використання у цьому винаході агенти, що утворюють матрикс, містять сполуки - похідні тваринних або рослинних білків, такі як желатини, декстрини та соя, білки насіння пшениці та psyllium; камеді, такі як аравійська камедь, quar, агар і ксантан; полісахариди; альгінати; карбоксиметилцелюлози, карагени (препарати червоної водорості Chondrus crispus); декстрини; пектини; синтетичні полімери, такі як полівінілпіролідон та комплекси поліпептид-білок або полісахаридні комплекси, такі як желатин-аравійська камедь. Інші агенти, що формують матрикс, придатні для використання у запропонованому винаході, містять цукри, такі як манітол, декстроза, лактоза, галактоза та треголоза; циклічні цукри, такі як циклодекстрин, неорганічні солі, такі як фосфат натрію, хлорид натрію та силікат алюмінію та амінокислоти, що мають від 2 до 12 вуглеводних атомів, таких як гліцин, L-аланін, L-аспарагінова кислота, L-глутамінова кислота, L-оксипролін, L-ізолейцин, L-лейцин і Lфенілаланін. Перед затвердінням у розчин або суспензію може додаватися один чи більше агентів, що формують матрикс. Вони можуть бути присутніми як добавка до сурфактанта або використовуватися замість нього. На додаток до здатності утворювати матрикс агенти, що його формують, можуть використовуватися для підтримання дисперсного стану якого-небудь активного компонента у розчині чи суспензії. Це особливо зручно за таких активних компонентів, які недостатньо добре розчинюються у воді, тож мають більше суспендуватися, аніж розчинюватися. Компоненти вторинного призначення, такі як консерванти, антиоксиданти, сурфактанти, підсилювачі в'язкості, засоби для забарвлення, смакові добавки, модифікатори pH, підсолоджувані або засоби, що маскують смак, також можуть включатися до композиції Придатні забарвлювальні засоби місять червоний, чорний та жовтий окиси заліза, а також FD і С барвники, такі як FD і С блакитний №2 та FD і С червоний №40, які поставляє Ellis та Everard. Придатні смакові добавки містять м'ятний, малиновий, лакричний, апельсиновий, лимонний, грейпфрутовий, карамельний, ванільний, вишневий та виноградний смакові відтінки та їхні комбінації. Придатні модифікатори pH містять лимонну кислоту, винну кислоту, фосфорну кислоту, соляну кислоту та малеїнову кислоту. Придатні підсолоджувачі містять аспартам, ацесульфам К і тауматик. Придатні засоби маскування смаку містять бікарбонат натрію, іонообмінні смоли, компоненти із вмістом циклодекстрину, адсорбовані сполуки або мікроінкапсульовані активні сполуки. Краще, щоб агоніст дофаміну обирався з 5, 6, 6а, 7-тетрагідро-6-метил-ДНдібензо[de,g]іхінолін-10,11-діол (апоморфін), 5, 6, 6а, 7-тетрагідро-6-пропіл-4Н-дібензо[ае,д]хінолін-10,11-діол(N-пропілнорапоморфін), (5'a)-2-бромо-12'-окси-2'-(1-метилетил)-5'-(2метилпропіл)ерго-таман-3',6',18-трион (бромокриптін), 1-[(6-аллілерголін-8b-іл)карбоніл]-1-[3діметиламіно)пропіл]-3-етилсечовина (каберголін), N'-[(8a)-9,10-дідегідро-6-метилерголін-8-іл]N,N-діетилсечовина (лізурид), [[(8b)-1,6-діметилерголін-8-іл]метил]-фенілметиловий ефір карбамінової кислоти (метерголін), (4аR)-транс-3,4,4а,5,6,10b-гексагідро-4-пропіл-2Н-нафт[1,2b]-1,4-оксазін-9-ол (наксаголід), 8-[(метилтіо)метил-6-пропілерголін (перголід), 2-[4-1,3бензодіоксол-5-ілметил)-1-піперазиніл]піримідин (пірибеділ), 4-[2-(діпропіламіно)етил]індолін-2он (ропінірол), N,N-діетил-N'-[(8a)-6-метилерголін-8-іл]сечовина (тергурид) і (±)-N,N-діетил-N' [(3R, 4aR*,10aS*)-1,2,3,4,4а,5,10, 10а-октагідро-6-окси-і-пропілбензо[g]іхінолін-3-іл]сульфамід (хінаголід), їхні солі та суміші. Ще переважніше, щоб агоністом дофаміну був апоморфін або його сіль, краще кисла сіль, особливо гідрохлорид. Також бажано, щоб агонісі дофаміну містився в композиції у кількості від 0,05 до 100мг, бажаніше від 0,05 до 20мг. Точна кількість активного компонента залежатиме від- обраного агоніста дофаміну. Краще, щоб добова норма агоністів дофаніму, перелічених вище, коливалася в таких межах: Апоморфін 1-150мг краще 10-60мг N-пропілнорапоморфін 1-150мг краще 10-60мг Бромокриптін 0,5-100мг краще 0,5-10мг Каберголін 0,5-2мг краще 0,2-0,6мг Лізурид 0,05-5мг краще 0,05-1мг Метерголін 4-20мг краще 4-8мг Наксаголід 0,1-10мг краще 0,1-5мг Перголід 0,5-10мг краще 0,05-1мг Пірибеділ 1-20мг краще 3-20мг Ропінірол 0,25-20мг краще 2-10мг Тергурид 1,0-10мг краще 3-6мг Хінаголід 0,1-5мг краще 0,1-1мг Якщо потрібна більша добова норма, її можна ввести в кілька прийомів меншими дозами. Як зазначалося вище, агоністи дофаміну мають побічні ефекти, такі як нудота і блювота. Тому композицію винаходу краще вводити разом з протиблювотним засобом. Протиблювотний засіб зручніше вводити у такій самій композиції, що й агоніст дофаміну. За одним з варіантів, яким віддається перевага, композиція винаходу, як йшлося вище, додатково містила протиблювотний засіб. У протилежному разі протиблювотций засіб може вводитися окремо від агоніста дофаміну будь-яким оральцим чи парентеральним способом введення, наприклад, за допомогою таблеток, капсул, суспензій, супозиторіїв, інфузій, ін’єкцій тощо, у належний час, тобто до, після чи водночас із введенням агоніста дофаміну. Особливо бажано, щоб протиблювотний засіб мав вигляд швидкодисперговуваної лікарської форми за типом, описаним вище, де розглядалося, що така швидкодисперговувана лікарська форма протиблювотного засобу дійсно має багато переваг, пов'язаних зі складанням таких композицій, які дають змогу збільшити біологічну доступність, зменшити дозу, полегшити введення тощо, як описано вище, хоча певні переваги залежатимуть від природи вибраного протиблювотного засобу. Бажано, щоб протиблювотний засіб становив у композиції від 1 до 120мг, краще 1-60мг. Проте, точна кількість протиблювотного засобу, яку слід ввести пацієнтові, залежатиме від обраного варіанта. Придатні проіиблювотні засоби містять периферічні антагоністи дофаміну, такі як 5-хлоро-1-[1-[3-(2,3-дігідро-2оксо-1Н-бензімідазол-1-іл)пропіл]-4-піперидініл]-1,3-дігідро2Н-бензімідазол-2-он (домперидон) та його солі, а також антагоністи рецептора серотоніну (5НТ3), такі як ендо-1-метил-N-(9-метил-9-азабіцикло[3,3,1]нон-3-іл)-1Н-індазол-3-карбоксамід (гранісетрон), 1,2,3,9-тетрагідро-9-метил-3[(2-метил-1Н-імідазол-1-іл)метил]-4Н-карбазол-4-он) ондансетрон), а також 1аН, 5aН-тропан-3a-іл-індол-3-карбоксилат (тропісетрон) та їхні солі. З них найкращим є домперидон. Добова доза згаданих вище протиблювотних засобів, якій віддається перевага, коливається в таких інтервалах: Домперидон 20-120мг краще 30-60мг Гранісетрон 1-10мг краще 1-3мг Ондасетрон 4-32мг краще 4-8мг Тропісетрон 1-10мг краще 1-5мг Якщо потрібна більша добова норма, п можна ввести в кілька прийомів меншими дозами. Апоморфін є опіумним алкалоїдом. Таким чином, як зазначалося вище, коли апоморфін або інший алкалоїд опіуму чи його синтетичний похідний обирається як агоніст дофаміну, додаткові побічні ефекти, такі як седативна дія, пригнічене дихання, гіпотензія, брадихардія, спітніння та позіхання додаватимуться до нудоти і блювоти. Проте було виявлено, що всі ці побічні ефекти можуть компенсуватися введенням опіоїдного антагоніста разом з опіоїдним агоністом дофаміну. Опіоїдний антагоніст зручніше вводити у такій самій композиції, що й агоніст дофаміну. Отже, за іншим варіантом, якому надається перевага, композиція винаходу, як йшлося вище, додатково містить опіоїдний антагоніст. Така композиція може містити протиблювотний засіб як додаток до агоніста дофаміну та антагоніста опіоїдів, хоча це несуттєво, оскільки опіоїдний антагоніст також протидіє деяким ефектам агоніста дофаміну, що спричиняють блювання. З іншого боку, опіоїдний антагоніст може вводитися окремо від агоніста дофаміну будь-яким оральним чи парентеральним способом введення у належний час, тобто до, після чи водночас із введенням агоніста дофаміну. Ще краще, щоб композиція опіоїдного антагоніста мала вигляд швидкодисперговуваної лікарської форми за типом, описаним вище, де розглядалося, що така швидкодисперговувана лікарська форма опіоїдного антагоніста дійсно має багато переваг, пов'язаних зі складанням таких композицій, які дають змогу збільшити біологічну доступність, зменшити дозу, полегшити введення тощо, як йшлося вище, хоча деякі переваги залежатимуть від природи вибраного опіоїдного антагоніста. Краще, щоб опіоїдний антагоніст становив у композиції від 0,5 до 100мг, ще краще від 0,5 до 50мг. Проте, точна кількість опіоїдного антагоніста, яку слід ввести пацієнтові, залежатиме від обраного типу опіоїдного антагоніста. Придатні опіоїдні антагоністи містять 4,5-епокси-3,14дігідрокси-17-(2-пропеніл)морфінан-6-он (налоксон) та 17-(циклопропілметил)-4,5-епокси-3-14дігідроксиморфінан-6-он (налтрексон) та їхні солі, особливо кислі солі, надто їхні гідрохлориди. Перевагу віддають добовим дозам для налоксону від 0,25 до 10мг, краще 0,5-2мг, для налтрексону - 10-100мг, краще - 25-50мг. Більшу добову дозу можна вводити в кілька прийомів меншими дозами. Відповідно до другого варіанта винаходу пропонується метод для приготування будь-якої з фармацевтичних композицій винаходу, як згадувалося вище, який включає створення зв’язку носія з активним компонентом і/або з протиблювотним засобом і/або опіоїдним антагоністом. За другим варіантом винаходу пропонується використовувати швидкодисперговувану лікарську форму, призначену для швидкого вивільнення активного компонента в ротовій порожнині з метою прискорення надходження агоніста дофаміну. Пропонується також метод введення агоніста дофаміну пацієнтові, який включає введення композиції в ротову порожнину пацієнта за описаним вище способом. Як йшлося раніше, композиція винаходу може використовуватися для боротьби з проявами хвороби Паркінсона. Відповідно, винаходом також пропонується композиція для лікування хвороби Паркінсона, а також спосіб лікування хвороби Паркінсона, який включає введення в ротову порожнину пацієнта композиції у терапевтично ефективній кількості, як зазначалося вище. Окрім того, агоністи дофаміну, особливо апоморфін, можуть використовуватися для прогнозування зворотної реакції на препарат леводофа у пацієнтів із хворобою Паркінсона, Відповідно до цього у винаході додатково пропонується композиція, про яку йшлося вище для оцінки ступеню розвитку хвороби Паркінсона, а також метод для оцінки ступеню розвитку хвороби Паркінсона, до якого входить введення в ротову порожнину пацієнта певної кількості композиції, про яку йшлося раніше, та визначення ступеню проявлення клінічного ефекту у цього пацієнта. За другим варіантом винаходом пропонується використання композиції, про яку йшлося вище, для виробництва медикаменту для лікування і/або оцінки ступеню розвитку хвороби Паркінсона. Як зазначалося вище, виявлено, що агоністи дофаміну можуть вводитися разом з протиблювотним засобом і/або антагоністом опюїдів за наявними показаннями, але при цьому протиблювотний засіб і/або антагоніст опюїдів може вводитися у різні способи, а індивідуальні компоненти можуть вводитися у різній послідовності. За другим варіантом винаходу пропонується набір для спільного введення композиції, який містить агоніст дофаміну, як йшлося раніше, та протиблювотний засіб і/або опюїдний антагоніст. Наприклад, набір може включати щонайменше одну дозу швидкодисперговуваної лікарської форми агоніста дофаміну згідно з винаходом, принаймні одну дозу лікарської форми протиблювотного засобу та, якщо агоністом дофаміну є алкалоїд опіуму, принаймні одну дозу лікарської форми опюїдного антагоніста разом з інструкціями щодо її введення. У наборі, якому віддається перевага, антиблювотний засіб вводиться до агоніста дофаміну. Для полегшення введення краще, щоб протиблювотний засіб та антагоніст опюїдш, якщо він є, мали форму швидкодисперговуваних лікарських форм, таких як описано вище Відповідно набір може включати комбінацію швидкодисперговуваних лікарських форм, як йшлося вище, краще з інструкціями щодо послідовності їх введення. За формою, якій віддається найбільша перевага, набір може мати блістерну упаковку з дозуванням лікарських форм композиції, як йшлося вище Краще, щоб послідовність введення цього дозування лікарських форм наводилася на блістерніи упаковці Ще краще, коли набір має швидкодисперговувані лікарські форми з вмістом апоморфіну та домперидону і/або налаксону. Другим варіантом винаходу пропонується спосіб для спільного введення пацієнтові агоніста дофаміну та протиблювотного засобу і/або опюїдного антагоніста, який включає введення в ротову порожнину пацієнта композиції зі вмістом агоніста дофаміну, як йшлося вище, а введення пацієнтові протиблювотного засобу і/або опіоїдного антагоніста орально або парентерально. Краще, щоб проти блювотний засіб та опіоїдний антагоніст, якщо він є, також мали форму швидкодисперговуваних лікарських форм, подібних до описаних вище, окремо або в комбінації з агоністом дофаміну, який також може вводитися пацієнтові в ротову порожнину. Наведені нижче приклади ілюструють винахід. Приклад 1 Приготування швидкодисперговуваної лікарської форми апоморфіну (а) Приготування 2% дислерговуваного складу апоморфін гідро хлориду. Желатин (792г) та манітол (594г) диспергували в порції очищеної води (16кг), обережно змішуючи в чані вакуумного змішувача. Потім суміш нагрівали до 40°С±2°С та гомогенизуваливпродовж десяти хвилин. Суміш охолоджували до кімнатної температури (20-24°С). Після охолодження додавали апоморфін гідрохлорид (360г). Суміш гомогенизували, забезпечуючи розчинення ліків. Перемішуючи, поступово додавали лимонну кислоту (166,32г) до досягнення pH розчину, що дорівнює 3,0. Решту води (87,68г) додавали у змішувач і суміш гомогенизували до повного розчинення. (б) Приготування 10 міліграмових доз апоморфін гідрохлориду 500мг 2% дисперговуваного складу апоморфін гідрохлориду, утвореного після описаної вище процедури (а), розфасовували в кожний з серійно приготовлених заздалегідь блістерів, поміщених в ямки діаметром 16мм. Оболонка блістера складалася з 200мкм PVC (полівінілхлориду), покритого PVdC (полівінілдіхлоридом) з розрахунку 40г на квадратний метр. Продукт негайно заморожували у посудині з рідким азотом. Заморожений продукт зберігали за температури нижче ніж мінус 20°С мінімум упродовж 12 годин, а потім висушували із замороженого стану за допомогою ліофільної сушильні за температури висушування 10°С та тиску в камері 50н/м2. Після цього заморожені сухі одиниці доз перевіряли на наявність небезпечних дефектів та решту порції цієї партії герметично пакували за допомогою фольгового покриття, яке складається з шару паперу та фольги (20мкм алюмінію). На блістерній упаковці кожної одиниці дози проставляли номер партії та пакували в заздалегідь приготовлений мішечок через укладання в нього пакетика і щільного запаювання відкритого кінця мішечка. На кожному мішечку вказували номер продукту, номер партії, дату випуску та назву постачальника. Кожна одиниця дози мала такий склад: Масовий % Компонент Маса (мг) композиції Очищена вода USP/EP* 446,880 89,4 Апоформін НСl ВР/ЕР 10,000 2,0 Желатин EP/USNF 22,000 4,4 Манітол EP/USP 16,500 3,3 Лимонна кислота EP/USP 4,620 0,9 500,000 100,0 * істотно видаляється впродовж ліофілізації Приклад 2 Мета цього дослідження полягала у порівнянні біологічної доступності апоморфіну гідрохлориду після його введення оральним способом у вигляді швидкодисперговуваної лікарської форми, приготовленої за методом, представленим у Прикладі 1 (Приклад 1), або введення комерційно доступного складу підшкірною ін'єкцією (підшкірне) 12-ти здоровим добровольцям. Проводили відкрите, рандомізоване, порівнювальне, 5-ти факторне перехресне фармакокінетичне дослідження. Через властивості апоморфіну індукувати блювоту досліджувані завчасно отримували домперидон як протиблювотний засіб. Після попереднього приймання домперидону впродовж 2-х днів випадкові групи досліджуваних отримували такі типи лікування апоморфіном протягом 5-ти наступних днів: 5мг апоморфіну (половина одиниці дози з Прикладу 1) 10мг апоморфіну (одиниця дози з Прикладу 1) 20мг апоморфіну (дві одиниці дози з Прикладу 1, введені одночасно) 2,5мг підшкірна ін'єкція (Britaject) апоморфіну у стінку очеревини 10мг апоморфіну (одна одиниця дози з Прикладу 1), з додатковим введенням через 5 хвилин 10мг апоморфіну (одна одиниця дози з Прикладу 1) Зразки крові для фармакокінетичного аналізу збирали до введення дози та з 6-ти годинним інтервалом після введення кожної дози апоморфіну. Біологічну доступність апоморфіну оцінювали, застосовуючи фармакокінетичний параметр AUC (область, що відбиває криву залежності концентрації апоморфіну у плазмі від часу). Дози в 5мг, 10мг і 20мг Прикладу 1 спричиняли залежне від дози збільшення біологічної доступності апоморфіну, оціненої за допомогою AUC (дивись таблицю 1). Окрім того, отримання двох 10мг доз з п'ятихвилинним інтервалом призводило до збільшення біологічної доступності, що перевищувала доступність при одночасному застосуванні дози в 20мг (див. рисунок 1). Таблиця І Біологічна доступність апоморфіну, отримуваного орально як у Прикладі 1 (від 5мг від 20мг), як дві дози по 10мг, отримувані орально з п'ятихвилинним інтервалом, та як підшкірна ін'єкція 2,5мл (Середні значення величин). Дозування в групі AUC 2,5мг підшкірно 831,0 5мг (Приклад 1) 337,6 10мг (Приклад 1) 504,8 20мг (Приклад 1) 690,1 2х10мг (Приклад 1) 908,6 У Прикладі 2 показано, що загальна абсорбція апоморфіну при введенні його у вигляді швидкорозсіюваної лікарської форми збільшувалася, коли доза у 20мг вводилася як дві порції по 10мг з п'ятихвилинним інтервалом порівняно з одночасним введенням двох порцій по 10мг. Передбачається, що спостережуване збільшення абсорбції може зумовлюватися дією композиції на pH слини рота, в якій ліки мають розчинюватися до того, як відбудеться передгастральна абсорбція. Апоморфін є ліками з властивостями основи, що як відомо, виявляє оптимальну хімічну стабільність у кислому середовищі. У зв'язку з цим композиції апоморфіну зазвичай містять такі наповнювачі, як лимонна кислота, винна кислота або малеїнова кислота для створення максимальної хімічної стабільності. Не виключено, що ці наповнювачі могли б спричинити зниження pH слини, що може впливати на абсорбцію ліків. Дивно, але цей ефект можна звести до мінімуму, якщо ввести ще одну дозу через деякий часовий інтервал. Отже, за іншим варіантом винаходу пропонується-фармацевтичний продукт, який включає терапевтичну дозу фармацевтичної композиції зі вмістом агоніста дофаміну, як зазначалося вище, в якій терапевтичну дозу композиції розділено принаймні на дві порції, і фармацевтичний продукт додатково має інструкції щодо послідовності введення принаймні двох порцій з певним часовим інтервалом між введенням кожної порції. Винахід також пропонує спосіб введення пацієнту фармацевтичного продукту, який включає терапевтичну дозу фармацевтичної композиції із вмістом агоніста дофаміну, як йшлося вище, в якій вказану дозу терапевтичної композиції розділено щонайменше на дві порції, і спосіб введення якої включає послідовне введення в ротову порожнину пацієнта принаймні двох порцій з певним часовим інтервалом між кожною порцією. Краще, щоб специфічний часовий інтервал між введенням кожної порції становив від 2 до 15 хвилин, ще краще від 5 до 10 хвилин. Бажано також, щоб пакет з цими порціями мав інструкції щодо їх введення. Ще краще, щоб принаймні дві порції були у блістерній упаковці з інструкцією щодо введення. У додатковому варіанті винаходу пропонується набір для введення композиції із агоністом дофаміну, як йшлося раніше, який містить принаймні першу та другу визначені одиниці лікарських форм композиції та інструкції щодо часових інтервалів послідовного введення визначених одиниць лікарських форм. Винахід також пропонує спосіб введення пацієнтові композиції з агоністом дофаміну, як йшлося вище, яка містить принаймні першу та другу визначені одиниці лікарських форм композиції. Цей спосіб включає послідовне введення цих першої та другої визначених одиниць лікарських форм у ротову порожнину пацієнта відповідно до назначеної часової послідовності. Краще, щоб часовий інтервал між введенням першої та другої визначених одиниць становив від 2 до 15 хвилин, ще краще від 5 до 10 хвилин. Бажано, щоб пакет із визначеними одиницями лікарських форм мав інструкції щодо часового інтервалу послідовного введення першої та другої визначених одиниць. Ще краще, що ці одиниці лікарських форм були у блістерній упаковці, яка б мала інструкції. Особлива перевага надається тому, щоб агоніст дофаміну, який використовується як фармацевтичний продукт або набір, як зазначалося вище, являв собою апоморфін, Nпропілнорапоморфін або їхні солі. Ще краще, щоб кожна порція визначеної одиниці лікарської форми містила від 2,5 до 20мг, ще краще від 5 до 15мг особливо 10мг апоморфіну або його солі. Ще один аспект цього винаходу полягає в тому, що абсорбція апоморфіну може збільшуватися введенням дози у часовий інтервал, коли pH слини може підтримуватися в межах нормальних фізіологічних коливань у момент отримання композиції апоморфіну шляхом введення разом з нею антацидної композиції. Це може бути або спеціально приготовлена сполука, або комерційно доступні композиції -у вигляді таблеток або рідкої речовини, такі як Rennietm, Settlers.m, Bisodoltm, Aludroxtm, Asilontm, Remegeltm. Антацид має реагувати безпосердньо з кислим наповнювачем та запобігати зниженню pH слини, яке, як передбачається, зменшує кінцеву абсорбцію апоморфіну передгастральним відділом шлунково-кишкового тракту. Отже, відповідно до цього аспекту винаходу пропонується фармацевтичний продукт або набір, як зазначалося вище, який додатково містить антацид. Винахід також пропонує спосіб введення агоніста дофаміну, фармацевтичний продукт або визначені одиниці лікарських форм, які містять агоніст дофаміну, як зазначалося вище, спосіб спільного введення агоніста дофаміну та протиблювотного засобу і/або опіоїдного антагоніста, як йшлося вище, та спосіб лікування і/або оцінки ступеню розвитку хвороби Паркінсона, як зазначалося вище, усі з яких мають додатковий етап введення антациду в ротову порожнину пацієнта. Антацид може вводитися безпосередньо до, одразу після або водночас з агоністом дофаміну. Пропонується також антацид, який використовується для збільшення передгастральної абсорбції активного компонента композиції із вмістом агоніста дофаміну, як зазначалося вище. Приклад .3 Дослідження передгастральної абсорбції Мета цього винаходу полягала у порівнянні біологічної доступності 10мг апоморфінгідрохлориду після орального введення його як швидкодисперговуваної лікарської форми (Приклад 1), введеної в ротову порожнину та здатної до розсіювання в ній, та при його вміщенні в тверду желатинову капсулу та ковтанні капсули цілою. Проводили відкрите, випадкове, порівнювальне, 2-х факторне перехресне фармакркінетичне дослідження 6-ти добровольців. Через здатність апоморфіну спричиняти блювоту досліджувані попередньо отримували домперидон як протиблювотний засіб. Після дводенного вживання домперидону рандомізовані групи досліджуваних наступні два дні отримували такі варіанти лікування апоморфіном: 10мг апоморфіну (Приклад 1) 10мг апоморфіну у твердій желатиновій капсулі. Зразки крові для фармакокінетичного аналізу відбирали перед введенням апоморфіну та через 6 годин після кожної дози апоморфіну. Біологічну доступність апоморфіну оцінювали, застосовуючи фармакокінетичний параметр AUC. Дози в 10мг (Приклад 1) спричиняли профіль зміни концентрації апоморфіну у плазмі, подібний до спостережуваного в Прикладі 2 (див. рисунок 2). Проте, та сама композиція, взята у тверду желатинову капсулу, викликала при її введенні суттєво знижений профіль зміни концентрації апоморфіну у плазмі. Це чітко простежується за зміною фармакокінетичного параметра AUC, що вказує на значне зниження абсорбції у групі, яка отримувала інкапсульований апоморфін (Таблиця II). Ці результати підтверджують припущення, що апоморфін абсорбується передгастрально при його надходженні в ротову порожнину у вигляді швидкодисперговуваної лікарської форми з Прикладу 1, оскільки, коли така сама композиція вводиться інкапсульованою (що має запобігати її передгастральній абсорбції), кількість апоморфіну, який визначається в плазмі, істотно знижується. Таблиця II Біологічна доступність апоморфіну, який вводиться орально в формі, зазначеній у Прикладі 1 (10мг), та у вигляді 10мг у твердій желатиновій капсулі (опосереднені величини). Тип введення групі AUC 10мг (Приклад 1) 402,2 10мг у твердій желатиновій капсулі 92,3 Наведені нижче приклади додатково ілюструють композиції, які можна приготувати, застосувавши процес, описаний у Прикладі 1: Приклад 4 Маса Масовий % Компонент (мг) композиції Очищена вода EP/USP* 438,500 87,70 Апоморфін НС1 ВР/ЕР 10,000 2,00 Желатин EP/USNF 25,000 5,00 Манітол EP/USP 20,000 4,00 Лимонна кислота EP/USP 1,500 0,30 Аспартам EP/USNF 2,500 0,50 Смакова добавка з м'яти перцевої 2,500 0,50 Усього 500,000 100.00 * істотно усувається впродовж ліофілізаціі Приклад 5 Маса Масовий % Компонент (мг) композиції Очищена вода EP/USP* 215,000 86,00 Апоморфін НС1 ВР/ЕР 10,000 4,00 Желатин EP/USNF 11,500 4,60 Манітол EP/USP 10,000 4,00 Лимонна кислота EP/USP 1,500 0,60 Аспартам EP/USNF 2,000 0,80 Усього 250,000 100,00 * істотно усувається впродовж ліофілізації Приклад 6 Маса Масовий % Компонент (мг) композиції Очищена вода EP/USP* 441,000 88,20 Апоморфін НС1 ВР/ЕР 10,000 2,00 Желатин EP/USNF 25,000 5,00 Манітол EP/USP 20,000 4,00 Лимонна кислота EP/USP 1,500 0,30 Аспартам EP/USNF 2,500 0,50 Усього 500,000 100,00 * істотно усувається впродовж ліофілізації Приклад 7 Маса Масовий % Компонент (мг) композиції Очищена вода EP/USP* 425,000 85,00 Апоморфін НС1 ВР/ЕР 10,000 2,00 Домперидон 20,000 4,00 Желатин EP/USNF 20,000 4,00 Манітол EP/USP 15,000 3,00 Гліцин USP 5,000 1,00 Аспартам EP/USNF 2,500 0,50 Смакова добавка з м'яти перцевої 2,500 0,50 Усього 500,000 100,00 * істотно усувається впродовж ліофілізації Приклад 8 Масовий % Компонент Маса (мг) композиції Очищена вода EP/USP* 138,2500 92,1667 Лізурид малеат 0,2000 0,1333 Желатин EP/USNF 6,0000 4,0000 Манітол EP/USP 4,5000 3,0000 Аспартам EP/USNF 0,3000 0,2000 Вишнева смакова добавка 0,7500 0,5000 Усього 150,0000 100.0000 * істотно усувається впродовж ліофілізації Приклад 9 Масовий % Компонент Маса (мг) композиції Очищена вода F.P/USP*138,9500 92 6333 Пероглід мезілат 0,2500 0,1667 Желатин EP/USNF 6,0000 4,0000 Манітол EP/USP 4,5000 3,0000 Аспартам EP/USNF 0,3000 0,2000 Усього 150,0000 100,0000 * істотно усувається впродовж ліофілізації Приклад 10 масовий % Компонент Маса (мг) композиції Очищена вода EP/USP* 226,250 90,50 Бромокриптін мезілат 2,500 1,00 Желатин EP/USNF 10,000 4,00 Манітол EP/USP 7,500 3,00 Аспартам EP/USNF 1,250 0,50 Вишнева смакова добавка 1,250 0,50 Смакова добавка з м"яти перцевої 1,250 0,50 Усього 250,000 100,00 * істотно усувається впродовж ліофілізації Приклад 11 Маса Масовий % Компонент (мг) композиції Очищена вода EP/USP* 137,750 91,8333 Ропенірол 1,000 0,6667 Желатин EP/USNF 6,000 4,0000 Манітол EP/USP 4,500 3,0000 Аспартам EP/USNF 0,750 0,5000 Усього 150,000 100,0000 * істотно усувається впродовж ліофілізації Приклад 12 Маса Масовий % (мг) композиції Компонент Очищена вода EP/USP* 431,500 86,30 Апоморфін НС1 ВР/ЕР 10,000 2,00 Налоксон НСl ВР/ЕР 10,000 2,00 Желатин EP/USNF 20,500 4,10 Манітол EP/USP 15,000 3,00 Лимонна кислота EP/USP 1,500 0,30 Аспаргам EP/USNF 3,000 0,60 Грейпфрутова смакова добавка 1,000 0,20 Гліцин USP 7,500 1,50 Усього 500,000 100.00 * істотно усувається впродовж ліофілізації Приклад 13 Маса Масовий % Компонент (мг) композиції Очищена вода EP/USP* 413,500 82,60 Апоморфін НС1 BP/EP 10,000 2,00 Налтрексон НС1 25,000 5,00 Желатин EP/USNF 22,500 4,50 Манітол EP/USP 15,00 3,00 Лимонна кислота EP/USP 2,500 0,50 Аспартам EP/USNF 5,000 1,00 Малинова смакова добавка 2,000 0,40 Гліцин USP 5,000 1,00 Усього 500,000 100,00 * істотно усувається впродовж ліофілізації Приклад 14 Масовий % Компонент Маса (мг) композиції Очищена вода EP/USP* 397,250 79,45 Апоморфін НС1 ВР/ЕР 20,000 4,00 Налоксон НС1 ВР/ЕР 10,000 2,00 Домперидон 20,000 4,00 Желатин EP/USNF 22,500 4,50 Манітол EP/USP 17,500 3,50 Лимонна кислота EP/USP 1,500 0,30 Лимонна смакова добавка 2,500 0.50 Гліцин USP 5,000 1,00 Аспартам EP/USNF 3,750 0,75 Усього 500,000 100,00 * істотно усувається впродовж ліофілізації Приклад 15 Масовий % Компонент Маса (мг) композиції Очищена вода EP/USP* 219,008 87,60 Апоморфін НС1 ВР/ЕР 5,000 2,00 Гранісетрон НС1 1,117 0,45 Желатин EP/USNF 10,625 4,25 Манітол EP/USP 7,500 3,00 Лимонна кислота EP/USP 1,500 0,60 М'ятна добавка 1,500 0,60 Гліцин USP 1,250 0,50 Аспартам EP/USNF 2,500 1,00 Усього 250,000 100,00 * істотно усувається впродовж ліофілізації
ДивитисяДодаткова інформація
Назва патенту англійськоюOral pharmaceutical fast-dispersing composition of dopamine agonist and method for treatment of parkinson's disease
Назва патенту російськоюПероральные быстрорастворимые композиции агонистов допамина и способ лечения болезни паркинсона
Автори російськоюClarke, Anthony
МПК / Мітки
МПК: A61P 25/16, A61K 9/20, A61K 31/485
Мітки: допаміну, оральні, спосіб, агоністів, хвороби, композиції, швидкорозчинювані, паркінсона, лікування
Код посилання
<a href="https://ua.patents.su/11-64700-oralni-shvidkorozchinyuvani-kompozici-agonistiv-dopaminu-ta-sposib-likuvannya-khvorobi-parkinsona.html" target="_blank" rel="follow" title="База патентів України">Оральні швидкорозчинювані композиції агоністів допаміну та спосіб лікування хвороби паркінсона</a>
Попередній патент: Спосіб двозонного управління перетворювачами в транспортних електроприводах з позитивним зворотним зв’язком по швидкості
Наступний патент: Лікувальний капілярно-сітчастий костюм
Випадковий патент: N-6-заміщені 7-деазапурини (варіанти), спосіб їх одержання, фармацевтична композиція для лікування аденозинопосередкованих захворювань (варіанти)