Модифікована ацил-апб-десатураза
Номер патенту: 72180
Опубліковано: 15.02.2005
Автори: Шнайдер Гюнтер, Кехун Едгар, Ліндквіст Ілва, Шенклін Джон
Формула / Реферат
1. Спосіб модифікування довжини ланцюга і специфічності розташування подвійних зв'язків розчинної десатурази рослинних жирних кислот, що включає модифікування амінокислотних контактових залишків у каналі, що зв'язує субстрат, розчинної десатурази жирних кислот, які контактують з жирною кислотою.
2. Спосіб за п. 1, у якому розчинна десатураза рослинних жирних кислот являє собою ацил-АПБ-десатуразу.
3. Спосіб за п. 2, у якому ацил-АПБ-десатураза є ![]() -десатуразою.
-десатуразою.
4. Спосіб за п. 3, у якому ![]() -десатуразу одержують за допомогою рослин, вибраних з групи, що складається з Thunbergia alata або Ricinus communis.
-десатуразу одержують за допомогою рослин, вибраних з групи, що складається з Thunbergia alata або Ricinus communis.
5. Спосіб за п. 4, у якому амінокислотні контактові залишки вибирають з групи, що складається з залишків 114, 115, 117, 118, 179, 181, 188 і 189.
6. Спосіб модифікування довжини ланцюга і специфічності розташування подвійних зв'язків ацил-АПБ-десатурази, що включає:
a) приготування первинної амінокислотної послідовності ацил-АПБ-десатурази;
b) вирівнювання первинної амінокислотної послідовності ацил-АПБ-десатурази з первинною амінокислотною послідовністю ![]() -десатурази Ricinus communis для максимального збереження послідовності;
-десатурази Ricinus communis для максимального збереження послідовності;
c) побудову тривимірної моделі ацил-АПБ-десатурази на основі консервативної послідовності ![]() -десатурази Ricinus communis;
-десатурази Ricinus communis;
d) ідентифікацію амінокислотних контактових залишків усередині каналу, що зв'язує субстрат, структури, яку змодельовано на стадії с); і
e) створення мутантної ацил-АПБ-десатурази, що має модифіковану довжину ланцюга і особливості розташування подвійних зв'язків, шляхом заміщення одного або декількох амінокислотних контактових залишків, ідентифікованих на стадії d), на інший амінокислотний залишок.
7. Мутантна ацил-АПБ-десатураза, яка характеризується здатністю каталізувати створення подвійного зв'язку у першій жирній кислоті і у другій жирній кислоті, причому перша і друга жирні кислоти відрізняються довжиною ланцюга, і швидкості створення подвійних зв'язків у першій і другій жирних кислотах розрізняються не більш ніж приблизно у 4 рази.
8. Мутантна ацил-АПБ-десатураза за п. 7, яка містить точкову мутацію у амінокислотному контактовому залишку у каналі, що зв'язує субстрат.
9. Мутантна ацил-АПБ-десатураза за п. 7, у якій перша жирна кислота має довжину ланцюга 16:0, а друга жирна кислота має довжину ланцюга 18:0.
10. Мутантна ацил-АПБ-десатураза, яка має амінокислотне заміщення у контактовому залишку усередині каналу, що зв'язує субстрат.
11. Мутантна ацил-АПБ-десатураза за п. 10, яка характеризується змінами у довжині ланцюга і специфічності розташування подвійних зв'язків в порівнянні з копією ацил-АПБ-десатурази природного типу.
12. Мутантна ацил-АПБ-десатураза за п. 11, у якій ацил-АПБ-десатураза є ![]() -ацил-АПБ-десатуразою і контактові залишки у межах каналу, що зв'язує субстрат, вибирають з групи, що складається з 114, 115, 117, 118, 179, 181, 188 і 189.
-ацил-АПБ-десатуразою і контактові залишки у межах каналу, що зв'язує субстрат, вибирають з групи, що складається з 114, 115, 117, 118, 179, 181, 188 і 189.
13. Мутантна ацил-АПБ-десатураза за п. 12, у якій ![]() -ацил-АПБ-десатуразу одержують шляхом мутагенезу нуклеїнової кислоти, яку клоновано з Thunbergia alata або Ricinus communis.
-ацил-АПБ-десатуразу одержують шляхом мутагенезу нуклеїнової кислоти, яку клоновано з Thunbergia alata або Ricinus communis.
14. Послідовність нуклеїнових кислот, що кодує мутантну ацил-АПБ-десатуразу, яка характеризується здатністю каталізувати створення подвійного зв'язку у першій жирній кислоті і у другій жирній кислоті, причому перша і друга жирні кислоти відрізняються довжиною ланцюга, і швидкості створення подвійних зв'язків у першій і другій жирних кислотах розрізняються не більш ніж приблизно у 4 рази.
15. Послідовність нуклеїнових кислот за п. 14, у якій мутантна ацил-АПБ-десатураза містить точкову мутацію у амінокислотному контактовому залишку у каналі, що зв'язує субстрат.
16. Послідовність нуклеїнових кислот за п. 15, у якій мутантна ацил-АПБ-десатураза є ![]() -десатуразою.
-десатуразою.
17. Послідовність нуклеїнових кислот за п. 16, у якій амінокислотні контактові залишки вибирають з групи, що складається з залишків 114, 115, 117, 118, 179, 181, 188 і 189.
18. Конструкція експресії ДНК, яка містить у експресованій формі послідовність нуклеїнових кислот, що кодує мутантну ацил-АПБ-десатуразу, яка характеризується здатністю каталізувати створення подвійного зв'язку у першій жирній кислоті і у другій жирній кислоті, причому перша і друга жирні кислоти відрізняються довжиною ланцюга, і швидкості створення подвійних зв'язків у першій і другій жирних кислотах розрізняються не більш ніж приблизно у 4 рази.
19. Конструкція експресії ДНК за п. 18, у якій мутантна ацил-АПБ-десатураза містить точкову мутацію у амінокислотному контактовому залишку у каналі, що зв'язує субстрат.
20. Конструкція експресії ДНК за п. 19, у якій ацил-АПБ-десатураза є ![]() -десатуразою.
-десатуразою.
21. Конструкція експресії ДНК за п. 20, у якій амінокислотні контактові залишки вибирають з групи, що складається з залишків 114, 115, 117, 118, 179, 181, 188 і 189.
22. Клітина, трансформована конструкцією експресії ДНК, що містить у експресованій формі послідовність нуклеїнових кислот, що кодує мутантну ацил-АПБ-десатуразу, яка характеризується здатністю каталізувати створення подвійного зв'язку у першій жирній кислоті і у другій жирній кислоті, причому перша і друга жирні кислоти відрізняються довжиною ланцюга, і швидкості створення подвійних зв'язків у першій і другій жирних кислотах розрізняються не більш ніж приблизно у 4 рази.
23. Клітина за п. 22, у якій мутантна ацил-АПБ-десатураза містить точкову мутацію у амінокислотному контактовому залишку у каналі, що зв'язує субстрат.
24. Клітина за п. 23, у якій ацил-АПБ-десатураза є ![]() -десатуразою.
-десатуразою.
25. Клітина за п. 24, у якій амінокислотні контактові залишки вибирають з групи, що складається з залишків 114, 115, 117, 118, 179, 181, 188 і 189.
26. Клітина за п. 22, яка є прокаріотичною клітиною.
27. Клітина за п. 22, яка є еукаріотичною клітиною.
28. Клітина за п. 27, яка є рослинною клітиною.
29. Химерна ацил-АПБ-десатураза, яка характеризується здатністю каталізувати створення подвійного зв'язку у першій жирній кислоті і у другій жирній кислоті, причому перша і друга жирні кислоти відрізняються довжиною ланцюга, і швидкості створення подвійних зв'язків у першій і другій жирних кислотах розрізняються не більш ніж приблизно у 4 рази.
30. Химерна ацил-АПБ-десатураза за п. 29, що містить ![]() , у якій амінокислоти 172-201 замінені амінокислотами 178-207 з
, у якій амінокислоти 172-201 замінені амінокислотами 178-207 з ![]() -АПБ-десатурази.
-АПБ-десатурази.
31. Химерна ацил-АПБ-десатураза за п. 29, що містить ![]() , у якій амінокислоти 172-196 замінені амінокислотами 178-202 з
, у якій амінокислоти 172-196 замінені амінокислотами 178-202 з ![]() -АПБ-десатурази.
-АПБ-десатурази.
32. Химерна ацил-АПБ-десатураза за п. 29, що містить ![]() , у якій амінокислоти 176, 183, 184, 200, 201 і 202 замінені, відповідно, амінокислотами 181, 188, 189, 205, 206 і 207 з
, у якій амінокислоти 176, 183, 184, 200, 201 і 202 замінені, відповідно, амінокислотами 181, 188, 189, 205, 206 і 207 з ![]() -АПБ-десатурази.
-АПБ-десатурази.
33. Химерна ацил-АПБ-десатураза за п. 29, що містить ![]() , у якій амінокислоти 183 і 184 замінені, відповідно, амінокислотами 188 і 189 з
, у якій амінокислоти 183 і 184 замінені, відповідно, амінокислотами 188 і 189 з ![]() -АПБ-десатурази.
-АПБ-десатурази.
34. Химерна ацил-АПБ-десатураза за п. 32, що містить ![]() , у якій амінокислоти 176 і 195 замінені, відповідно, амінокислотами 181 і 200 з
, у якій амінокислоти 176 і 195 замінені, відповідно, амінокислотами 181 і 200 з ![]() -АПБ-десатурази.
-АПБ-десатурази.
35. Химерна ацил-АПБ-десатураза за п. 32, що містить ![]() , у якій амінокислоти 176, 195, 200, 201 і 202 замінені, відповідно, амінокислотами 181, 200, 205, 206 і 207 з
, у якій амінокислоти 176, 195, 200, 201 і 202 замінені, відповідно, амінокислотами 181, 200, 205, 206 і 207 з ![]() -десатурази.
-десатурази.
Текст
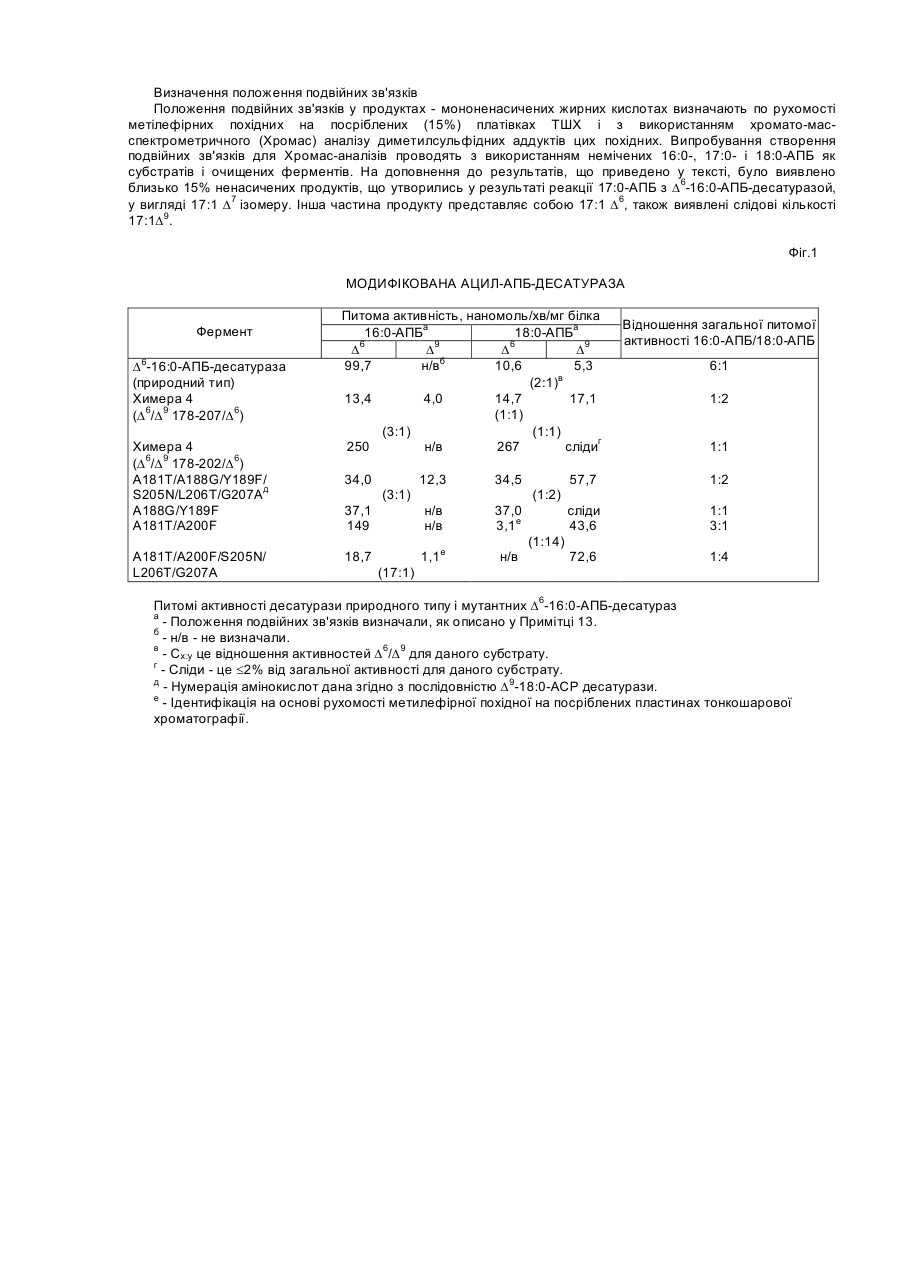
Біологічний синтез жирних кислот у вищих рослинах нещодавно став притягати пристальну увагу у зв'язку з можливістю використання рослинних масел як поновлюємих джерел відновленого вуглецю. Біологічний синтез жирних кислот у рослинах відбувається у хлоропластах зеленої тканини або у пластидах тканин, що не ведуть фотосинтез. В більшості рослин основними продуктами є складні ефіри ацил-переносівного білка (АПБ) насичених кислот - пальмітинової і стеаринової. D9-стеароіл-ацил-переносівний білок-десатураза (D9-десатураза) є пластидолокалізованим, немембранно пов'язаним, розчиненим ферментом, який вводить перший подвійний зв'язок у молекулу насиченої жирної кислоти (що приводить до відповідних моно-ненасичених жирних кислот). Нещодавно у тканинах насіння різних рослин було ідентифіковано декілька родинних розчинених десатураз, які містять жирні кислоти з незвичним розташуванням подвійних зв'язків. Ферменти цього класу розчинених десатураз є специфічними для конкретної довжини ланцюга субстрату і вводять подвійний зв'язок між визначеними атомами вуглецю, рахуючи від карбоксильного кінця жирної кислоти; наприклад, D9-десатураза є специфічною для стеароилАПБ, і вона вводить подвійний зв'язок між дев'ятим і десятим атомами вуглецю. Початкові реакції введення подвійного зв'язку у тварин і грибків і подальші реакції введення подвійного зв'язку у рослинах передаються визначеним класом десатураз жирних кислот, які є інтегральними мембранними білками. Оскільки у більшості рослин відсутні інші десатурази, які діють на рівні 18:0, співвідношення насичених жирних кислот до ненасичених жирних кислот у вищих рослинах регулюється толовим чином ферментами, які каталізують перетворення насичених жирних кислот у моно-ненасичені жирні кислоти. кДНК D9-десатурази кодують білки - попередники, що містять N-термінальний транзитний пептід, для націлювання у пластиду. Для сафлорового і касторового масел залишковий транзитний пептід 33 залишку транзитного пептіда відщеплюється, утворюючи зрілу десатуразу, що складається з 363 амінокислот з уявною молекулярною масою 37000 одиниць Дальтона (37кДа) на субодиницю по методу SDS-PAGE. Цей фермент виникає у вигляді димерів з приблизною молекулярною масою 70кДа. Для цієї ферментативної реакції потрібен молекулярний кисень, NAD (Ρ) Н-ферредоксиноксидо-редуктаза і ферредоксин. В попередніх дослідженнях було показано, що для каталітичної активності як розчинених, так і пов'язаних з мембраною D9-десатураз необхідно негемне залізо. Порівняно нещодавно при спектроскопічному аналізі і зіставленні амінокислотної послідовності було встановлено, що D9-десатураза містить кластер з двох атомів заліза. Цей клас білків з двома атомами заліза відрізняється двома місцезнаходженнями мотиву послідовності Е-Х-Х-Н, які поділені приблизно ста амінокислотами, і містять R2 субодиницу рибонуклеотидної редуктази і гідроксилазний компонент монооксигенази метана. Краще розуміння механізму каталіза ферментами ацилАПБ-десатурази може дати можливість застосування таких ферментів у виробництві масла з насіння рослин. Цей винахід відноситься до способу модифікування довжини ланцюга і специфічності розташування подвійних зв'язків розчинної десатурази рослинних жирних кислот. Більш конкретно, цей спосіб містить модифікування амінокислотних контактових залишків у каналі зв'язування субстрату у розчинній десатуразі жирних кислот, яка контактує з жирними кислотами. В переважних варіантах втілення розчинна десатураза рослинних жирних кислот представляє собою ацил-АПБ-десатуразу. Амінокислотні контактові залишки, які знаходяться усередині каналу зв'язування субстрату, ідентифікують, наприклад, спочатку показуючи головну послідовність амінокислот ацил-АПБ-десатурази. Відомо багато таких послідовностей, а інші можуть бути визначені з використанням звичайного експериментування. Потім такі амінокислотні послідовності вирівнюють з головною амінокислотною послідовністю D9-десатурази Ricinus communis для максимального збереження послідовності. Потім трьохрозмірну модель ацил-АПБ-десатурази конструюють на основі послідовності консервативної з послідовністю D9-десатурази Ricinus communis. Потім ідентифікують амінокислотні контактові залишки усередині каналу зв'язування субстрату модельованої структури. Потім, шляхом заміщення одного або декількох амінокислотних контактових залишків на інший амінокислотний залишок генерують мутантну ацил-АПБ-десатуразу, що має модифіковану довжину ланцюга і особливості розташування подвійних зв'язків. В іншому аспекті цей винахід відноситься до мутантній ацил-АПБ-десатурази, яка характеризується здатністю каталізувати створення подвійного зв'язку у першій жирній кислоті і у другій жирній кислоті, причому перша і друга жирні кислоти відрізняються довжиною ланцюга. Цей мутант додатково характеризується здатністю до створення подвійних зв'язків у першій жирній кислоті і у другій жирній кислоті з швидкостями, які розрізняються не більш, ніж приблизно у 4 рази. Цей винахід також відноситься до композицій, таким як послідовності нуклеїнових кислот і вектори експресії, які кодують мутантну ацил-АПБ-десатуразу описаного вище типу. Інші композиції цього винаходу містять клітини, трансформовані такими векторами експресії. В іншому аспекті цей винахід відноситься до химерних ацил-АПБ-десатураз, що мають модифіковану довжину ланцюга і особливості розташування подвійних зв'язків. На Фігурі 1 узагальнені значення питомих активностей десатураз природного типу і мутантних ацил-АПБдесатураз. Цей винахід частково засновано на ідентифікації жолобка, що зв'язує субстрат, і критичних контактних залишків, які встановлюють западину у ацил-АПБ-десатуразі. Крім того, цей винахід містить аналіз впливу логічно обґрунтованих, сайт-направлених мутацій. До цього винаходу були невідомі відносне місцерозташування каналів, що зв'язують субстрат у ацил-АПБ-десатуразах, і критичні залишки, що контактують з субстратом. Ацил-АПБ-десатурази є вельми консервативними, причому знайдено більш 70% гомологичності амінокислотної послідовності між ферментами різних сімейств, такими як D4, D6 і D9 ацил-АПБ-десатурази. Відомо, що кожна з цих десатураз каталізує створення подвійних зв'язків між атомами вуглецю того ж самого або аналогічного субстрату - жирних кислот. Основне відрізнення між активністю різних ацил-АПБ-десатураз є у розташуванні атомів вуглецю усередині субстратних жирних кислот, які стануть ненасиченими. Збереження амінокислотної послідовності є навіть більш значним у конкретному сімействі ацил-АПБ десатураз, такому як D9. На основі цього опису фахівець у цій області хімії зможе завбачати, які контактові залишки усередині каналу, що зв'язує субстрат, з усіх ферментів D9-ацил-АПБ-десатураз є практично подібними, якщо не ідентичними до тих, що ідентифіковані у D9-ацил-АПБ-десатуразі, яку описано нижче у Прикладі 1. Висока ступінь гомологичності амінокислотної послідовності між сімействами ацил-АПБ-десатураз, які каталізують ті ж самі ферментативні реакції, і гомологичності амінокислотної послідовності між сімействами ацил-АПБ-десатураз, які каталізують інші ферментативні реакції, дозволяє припустити, що визначені частини ферментів можуть мати аналогічні третинні структури. Це узгоджується з спостереженнями для інших молекул, таких як антитіла, у яких збереження гомологичності амінокислотного залишку звичайно є найбільшим для тих амінокислот, які залучені у підтримання функціональної структури молекули, що розглядається. Одною такою областю структури у ацил-АПБ-десатуразах, яка зберігається між різними ацил-АПБдесатуразами, є канал, що зв'язує субстрат, описаний у подальшому розділі Прикладів. Описаний нижче канал, що зв'язує субстрат, має архітектуру, яка забезпечує майже чудову аккомодацію для субстрату - жирної кислоти. Подібна досконала відповідність є вельми незвичною, якщо не є безпрецедентною. Той факт, що цей канал, що зв'язує субстрат, є конче консервативним, може бути підтверджений шляхом вирівнювання по максимальної ідентичності (по загальноприйнятих методиках) амінокислотних послідовностей представників інших сімейств ацил-АПБ-десатураз з амінокислотною послідовністю касторової (тобто, Ricinus communis) D9-ацил-АПБ-десатурази, яку описано нижче у Прикладі 1. Виведена амінокислотна послідовність цього касторового білка була опублікована Шанкліном і Сомервіллем (у Рrос. Natl. Acad. Sci. USA, т.88, с.2510 (1991)). Згідно з цим вирівнюванням може бути створена трьохрозмірна модель, у якій буде виявлений характерний канал, що зв'язує субстрат. Серед встановлених до цього часу послідовностей ацилАПБ-десатурази з різних рослинних джерел, доступних з Генетичного банку, є такі (у квадратних дужках вказані коди доступу): [BRSACP] В. rapa; [CAHSACPD] С. tinctorius; [SMMSACPD] Simmondsia chinensis; [SOACCPDS] S. oleracea; [SSMSACPD] рослинне джерело - кунжут; [TAU07597] Thunbergia alata (клон pTAD2D9); [TAU07605] Thunbergia alata (клон pTAD3D9); [ATSTACPDS] A. thaliana; [BNAACPDES] B. napus; [BNSACPD] B. napus; [GHSACPDES] G. hinsutum; [LUSACPDE] L. usitatissimum; [RCSTEA] R. communis; [SOYSACPD] Glycine max; [SSMSACPDA] рослина - кунжут; [SSMSACPDB] рослина - кунжут; [TAU07552] Thunbergia alata (клон pTADlD9). При вивченні результатів молекулярного моделювання для будь-якої з ацил-АПБ-десатураз, що проведено нижче у зв'язку з касторовою D9-ацил-АПБ-десатуразою, можуть бути ідентифіковані амінокислотні залишки усередині каналу, що зв'язує субстрат, які орієнтовані таким чином, що можуть знаходитись у безпосередній близькості до субстрату - жирній кислоті. Такі залишки називаються "контактовими залишками". Як виявлено нижче у результаті опису експериментального дослідження, модифікація контактового залишку (а у деяких випадках - інших залишків, як наприклад химерних з Прикладу 2) може змінювати довжину ланцюга і особливості розташування подвійних зв'язків ацил-АПБ-десатурази. Наприклад, як показано нижче у Прикладі 2, був одержаний химерний фермент, у якому амінокислоти 172202 у D6-16:0-АПБ-десатуразі були замінені амінокислотами 178-207 D9-18:0-ΑΠΒ-десатурази. Це приводить до введення 9 нових амінокислот у канал, що зв'язує субстрат, D6-16:0-АПБ-десатурази, які відрізняються від амінокислот у відповідних положеннях у D6-16:0-АПБ-десатуразі природного типу. Ця химера не тільки була здатна утворити подвійний зв'язок у жирній кислоті 16:0, яка краще всього перетворюється на ферменті природного типу, але також здатна утворити подвійний зв'язок у кислоті 18:0 у обох положеннях, D6 і D9, і у однаковій мірі. Той факт, що амінокислотні контактові залишки у каналі ацил-АПБ-десатурази, що зв'язує субстрат, грають таку важливу роль при визначенні довжини ланцюга і позиційній специфічності подвійних зв'язків, забезпечує можливість для розумного конструювання мутантних ацил-АПБ-десатураз, які мають унікальні і корисні властивості. Такі нові мутантні молекули можуть бути створені, наприклад, шляхом початкової ідентифікації контактових залишків усередині каналу, що зв'язує субстрат (як описано вище, шляхом вирівнювання по касторовій D9-амінокислотній послідовності з подальшим трьохрозмірним моделюванням). Потім у молекулу ацил-АПБ-десатурази, що розглядається, можуть бути введені специфічні точкові мутації. Найбільш зручно це виконується на генетичному рівні з використанням загальноприйнятих методик, таких як сайт - направлений мутагенез. Для введення специфічного змінення (тобто заміщення) амінокислотного кодону усередині таких ДНК можна використати численні методики сайт - направленого мутагенезу. Необхідно проявляти обережність у виборі залишку, що підлягає введенню замість існуючого контактового залишку у каналі, що зв'язує субстрат, у ацил-АПБ-десатуразі природного типу. Це особливо важливо на початку дослідження, наприклад для вибору заміщуючих залишків, які істотно не відрізняються по розміру бокового ланцюга або заряду. Наприклад, якщо усередині каналу, що зв'язує субстрат, ідентифікується гліциновий контактовий залишок (відрізняється компактністю власного аліфатичного ланцюга), то заміщення його таким амінокислотним залишком, як аргінін (відрізняється наявністю об'ємного основного бокового ланцюга), може привести до блокування надходження субстратної жирної кислоти у канал, що зв'язує субстрат, за рахунок стеричних ускладнень. Загалом, початкові заміщення амінокислот у контактових залишках мають бути здійснені з використанням амінокислот, що мають аналогічні зарядові характеристики при відносно невеликих розбіжностях у значеннях об'єму бокового ланцюга. Проте при обумовлених обмеженнях цілком можливо, що при заміщенні амінокислотою, що має абсолютно інші властивості, ніж контактовий залишок природного типу, можна одержати особливо ефективну мутантну ацил-АЛБ-десатуразу. Така молекула буде охоплена цім винаходом. Приведене вище коротке обговорення стратегії заміщення призначається тільки для того, щоб служити проводом для послідовного модифікування ацил-АПБ-десатурази. Таким чином, саме знання ідентичності контактових залишків у межах ацил-АПБ-десатурази дозволяє фахівцеві у цій області хімії здійснити такі модифікації ферменту, які можуть змінити довжину ланцюга і особливості розташування подвійних зв'язків ферменту без інгібування його здатності вести процес ферментативного каталіза. В свою чергу, ці знання залежать від здатності фахівця у цій області хімії ідентифікувати канал, що зв'язує субстрат, і створити трьохрозмірну модель. Як вже обговорювалось, описані нуклеотидні послідовності багатьох ацил-АПБ-десатураз. Більш того, приведені їх високі ступені консервативності, рутинні експерименти по гібридизації нуклеїнових кислот, проведені з використанням ДНК, яку виділено з рослин, що розглядаються, які, імовірно, могли б дати ДНК, що кодує додаткові ацил-АПБ-десатурази. Крім того, як вказано вище, фахівець у цій області хімії зможе передбачити, що у межах сімейства D9ацил-АПБ-десатурази амінокислотні контактові залишки усередині жолобка, що зв'язує субстрат, можуть бути практично подібними, якщо не ідентичними. Амінокислотні контактові залишки, ідентифіковані методом рентгенівської кристалографії, як описано у Прикладі 1, є залишками M114, L115, T117, L118, P179, T181, G188 і F189. Те, що модифікація цих залишків у D9-ацил-АПБ-десатуразі дійсно змінює довжину ланцюга і особливості розташування подвійних зв'язків ферменту, підтверджено у експериментах, описаних у Прикладі 2. Більш конкретно, у попередньому експериментальному дослідженні було виявлено, що єдине заміщення амінокислоти у положенні 118 (лейцин на фенілаланін) у касторовій D9-ацил-АПБ-десатуразі приводить приблизно до десятикратного збільшення її активності з 16:0-АПБ. Таким чином, одне амінокислотне заміщення у положенні контактового залишку може створити ацил-АПБ-десатуразу з новими і корисними властивостями. До цього винаходу єдиним джерелом варіантних ацил-АПБ-десатураз була тканина рослин, які синтезують незвичні ізомери моно-ненасичених жирних кислот. Наприклад, D4-16:0-АПБ-десатуразу одержували з насіннєвої ендосперми кориандра - тканини, яка продукує великі кількості петроселінової кислоти (18:1D6), незвичної ненасиченої жирної кислоти. Цей винахід забезпечує конструювання і виробництво нових типів ацил-АПБ-десатураз без необхідності виділення кДНК для цих ферментів з рослинних джерел. Крім того, цей винахід забезпечує конструювання ацил-АПБ-десатураз, які можуть каталізувати синтез економічно цінних мононенасичених жирних кислот, які не зустрічаються у природі. В більш конкретному прикладі цей винахід надає альтернативний засіб для одержання петроселінової кислоти у рослинах. Ця жирна кислота має ряд можливих промислових і харчових галузях застосувань. Єдиний відомий шлях створення петроселінової кислоти у рослинах містить введення D4-ненасищенности 16:0-АПБ з подальшим подовженням, що утворилась 16:1D4-АПБ, щоб одержати 18:1D6 (або петроселіноіл)АЛЕ. Для цього шляху потрібна, поруч з іншими засобами, нова ацил-АПБ-десатураза і специфічна система подовження ацил-АПБ. Серед описаних нижче мутантних десату-раз існують ферменти, які можуть каталізувати введення D6 нена-сиченості 18:0-АПБ, щоб утворити петроселіноіл-АПБ. Такі ферменти корисні для одержання петроселінової кислоти у трансгенних культурних рослинах без необхідності у передачі додаткових генів для шляху подовження 16:1D4-АПБ. Цей шлях представляє собою у теперішній час обмеження можливостей одержання петро-селінової кислоти у трансгенних культурних рослинах шляхом введення гену для D4-16:0-АПБ-десатурази. Таким чином, мутанти, створені шляхом змінення ідентичності одного або декількох контактових залишків у каналі, що зв'язує субстрат, можуть бути використані для створення ацил-АПБ-десатураз, що мають унікальні функціональні характеристики. Такі ферменти можуть бути використані, наприклад, для створення рослинних масел, збагачених моно-ненасиченими жирними кислотами. Такі рослинні масла важливі для харчування людей і можуть бути використані як поновлюємих джерел промислових хімічних реагентів. Крім того, можливість маніпулювання перевагами довжини ланцюга і положень подвійних зв'язків цих молекул забезпечує спосіб управління фізичними властивостями і промисловим застосуванням традиційних рослинних масел. До того ж, на основі цього опису можна експлуатувати розробку трансгенних культур, здатних продукувати незвичні типи мононенасичених жирних кислот. Мутанти, описані нижче у Прикладі 2, проявляють певно унікальні властивості. Наприклад, у ацил-АПБдесатураз природного типу існує тенденція до прояву дуже сильної переваги до жирних кислот з визначеною довжиною ланцюга і розташуванням зв'язків. Проте у описаних нижче експериментах було показано, що амінокислотні заміщення у контактових залишках усередині каналу, що зв'язує субстрат, модифікують цю перевагу. Наприклад, описано химерні мутанти, які мають здатність каталізувати створення ненасиченості у субстратах різної довжини (наприклад 16:0 і 18:0) з швидкостями, що розрізнюються не більш, ніж у 4 рази. Послідовності нуклеїнових кислот, що кодують ці мутантні ацил-АПБ-десатурази, можуть бути використані для експресії мутантного ферменту з використанням методик рекомбінантної ДНК. Наприклад, при клонуванні у придатному векторі експресії мутантна ацил-АПБ-десатураза може бути піддана експресії у різноманітних типах клітин, включаючих, наприклад, прокаріотичні і еукаріотині клітини. Вектори прокаріотиної експресії застосовуються, наприклад, для приготування великих кількостей білка, кодованого послідовністю ДНК, що розглядається. Після очищення традиційними методами цей білок може бути використаний для введення ненасиченості у жирні кислоти. Крім того, у деяких галузях застосування можна використати неочищений продукт лізиса такої культури прокаріотичних клітин. Вектори еукаріотичної експресії використовуються тоді, коли важливим є додавання вуглеводних бокових ланцюгів (тобто глікозилування) до білка. Бокові вуглеводні ланцюги впливають на активність білка різним чином. Наприклад відомо, що деякі білки є неактивними у неглікозилованому стані. Крім того, здатність негликозилованого білка створювати комплекс з іншими білками (наприклад антитілами або регуляторними молекулами) може бути сильно подавлена у відсутності гликозилування. Після очищення традиційними методами мутант ацил-АПБ-десатурази, експрессований у еукаріотичній системі (наприклад, у системі експресії бакуловіруса), може бути використаний для модифікування довжини ланцюга і положення подвійного зв'язку у жирній кислоті. У багатьох випадках цей білок також можна використати як частину неочищеного продукту лізиса. Мутантні ацил-АПБ-десатурази також можна клонувати у векторі експресії рослини. Ці вектори дозволяють одержати цільовий білковий продукт, наприклад мутантну ацил-АПБ-десатуразу, усередині середовища рослинної клітини, у межах якої залишається субстратна жирна кислота. При одержанні ферменту in situ модифікація продукту може відбуватись до збору клітин, що забезпечує швидке очищення цільової жирної кислоти, що має придатне розташування подвійного зв'язку, і без необхідності у коштовних стадіях виробництва. В деяких випадках, у конкретній трансгенній рослині, цільовими можуть бути декілька мутантних ацил-АПБ-десатураз, для того щоб одержати жирні кислоти, що мають подвійні зв'язки у декількох положеннях. Рослини також можна легко культивувати і вирощувати у великих кількостях. У багатьох випадках цей білок також можна використати як частину неочищеного продукту лізиса. ПОЯСНЕННЯ ПРИКЛАДАМИ. Приклад 1 Результати і їх обговорення Карта електронної густини і якість моделі Трьохрозмірну структуру рекомбінатної гомодимерної D9-стеароіл-ацилнесучої білкової десатурази, архетип розчинених десатураз рослинних жирних кислот, які перетворюють насичені жирні кислоти у ненасичені, визначають методами кристалографії білка з розрізнювальністю 2,4 Ангстрема (А). Шестикратно усереднена густина електронів для основного ланцюга і бокових ланцюгів добре розрізнюється для більшої частини поліпептидного ланцюга. Винятком є перші 18 залишків на N-кінці ланцюга, які не розрізнюються по електронній густини і, можливо, згинаються у кристалічній решітці. Залишки 336-347, розташовані у області петлі, досить погано розрізнені у картах електронної густини, і також саме у цій частині білкової структури були знайдені найбільші відхилення від некристалографічної симетрії. Сумарний реальний фактор просторової кореляції по залишках (субодиниця Вг і карта шестикратно усередненої густини електронів 2Fo-Fc) дорівнює 0,76. Такі критерії, як кристалографічний R-фактор (R=22,0%, Rсвоб.=28,5% з обмеженнями некристалографічної симетрії) , добра стереохімія моделі (середньоквадратична помилка довжини зв'язку 0,008 А), графік Рамачандрана (тільки одна стороння область з можливих областей у субодиниці, за вийнятком гліцинових залишків) і характер водневих зв'язків, що спостерігається, все це вказує, що прослідковування ланцюга для десатурази жирних кислот є вірним. Існує дуже ясна картина для пептидного атому кисню лізина 262, залишку з недозволеного конформацією основного ланцюга. Високе середнє значення бета-фактору дозволяє припустити, що ця молекула є гнучкою. Найбільш упорядковані частини молекули представляють собою області, залучені у взаємодію димера і гексамера, у той час як поверхові петлі часто мають дуже високі значення бета-фактору. Знайдено, що головні зв’язуючи центри для іонів диціаніду золота [Au(CN)2] у кристалах дериватизованої десатурази близькі до бокових ланцюгів К56 і С61 на поверхні молекули. Одним з другорядних центрів є внутрішній центр, між боковими ланцюгами Н203 і С222, причому другий другорядний центр знаходиться у області, у якій імовірно розташований N-кінець ланцюга. Загальна форма субодиници D9-десатурази представляє собою компактний циліндр з розмірами 35x35x50 і з доступною площею поверхні 16773. Окрім петлі візирної осі на самому С-кінці ланцюгу, ця субодиниця у основному складається з спіральних вторинних структур, укладених усередині одного великого домена. Дев'ять із загальних одинадцяти a-спіралей створюють антипаралельний пучок спіралей. Частина ланцюга при N-кінці розупорядкована, причому для перших 18 залишків не спостерігається картина електронної густини. В наступних 15 залишках відсутня повторна структура, і вони створюють довгий ланцюг, упакований уздовж спірального пучка з слабими специфічними взаємодіями, які стабілізують цю структуру. Перша спіраль a1, що складається з 23 залишків, починається і закінчується у конфигурации-310 і є настільки гнучкою, що її перша половина створює ковпачок на одному кінці пучка, а її друга частина представляє собою першу спіраль пучка. Ланцюжок продовжується в тому ж напрямку, утворюючи витки, зв'язані водневим зв'язком, і спіраль-310. Ковпачок на другому кінці пучка створюється з спіралей a2 і aD9 і Стермінальної візирної осі. Чотири з цих спіралей, a3, a4, a6 і a7, які є дуже довгими і мають відповідно 28, 29, 30 і 31 залишків, надають ліганди для центру з двох атомів заліза. Хоч a3 має злом у спіральній структурі у середині залишку 107-108, спіралі a3 і a4 є симетричними по відношенню до a6 і a7 і можуть бути суміщені з середньоквадратичною помилкою 1,39 А для 44 залишків. При такому суміщенні також вирівнюються атоми заліза у межах 1А. Вирівнювання відповідних послідовностей показує, що існує незначне збереження послідовностей, окрім залишків, залучених у зв'язування з кластером заліза. Це суміщення також орієнтує частина ковпачка a1 на a2. Зв'язки між цими спіралями також приблизно суміщуються, хоч і відсутня детальна структурна подібність. Між a3b і a4 існує виступаюча петельна структура, стабілізована декількома витками з водневими зв'язками. Пучок завершується спіралями a5, a8, a10 і a11, які дуже викривлені. Існує велике число сольових містків, 26, за винятком тих, що взаємодіють з іонами заліза у межах субодиниці. Це відповідає 0,069 іонної пари на 1 залишок, що вище середнього числа іонних пар на залишок (0,04), виведеного з огляду 38 білкових структур високої розрізнювальності. Сім таких сольових містків у D9десатуразі залучаються у взаємодії між спіралями у межах пучка, забезпечуючи правильну взаємну упаковку і, у деяких випадках, правильну орієнтацію лігандів заліза. Вісім пар здійснюють контакти між спіралями, а три інші залучені у маятникове зв'язування витків між спіралями пучка. Три пари залучені у контакти зі спіраллю310 і петлею після a8. Специфічною рисою субодиниці D9-десатурази є досить плоска поверхня, яку створюють спіралі a1, a6, a7, a10 і a11. Ця поверхня не залучена у контакти між субодиницами у димері, але доступна з розчину. Димер Поверхня розділу між субодиницами у димері займає площу поверхні 5826А2 на димер, тобто 17,4% поверхні димера. Ці двократні взаємодії містять простяжні контакти між спіралями у пучці; від a3b до тієї ж спіралі у другий субодиниці, між a 4 і a 5, і зверху a 2 і a 4 до відповідних спіралей у другій субодиниці. Також існує множина контактів між виступаючою петлею між a3b і a 4 і N-кінцем a3b і a 5. Крім того, залишки у зв'язці між a1 і a 2 здійснюють контакти з a 4 і a 5 у другій субодиниці. Існують три зарядових взаємодії у контактовій ділянці димера, у дві з яких залучені залишки з a 5. Центри з двох атомів заліза ізольовані у димері на відстані більше, ніж 23А, і між ними відсутні прямі контакти. Некристалографічна симетрія і кристалична упаковка Кристалична асиметрична комірка містить три димера D9-десатурази. В цих димерах субодиниці співвідносяться по некристалографічних вісях другого порядку, які для одного з димерів паралельні одній з кристалографічних осей другого порядку. Під прямим вуглом до неї, паралельно "а", існує некристалографічна гвинтова вісь третього порядку, що відноситься до трьох димерів. Трансляція становить одну третину довжини "а", тобто вона є локальною віссю 31. Контакти між димерами не є простяжними і мають той ж порядок величини, що і інші контакти кристала, і, мабуть, вплив контактів кристала на його структуру є незначним, що підтверджується спостережуваними малими відхиленнями від не-кристалографічної симетрії. Найбільш великі відхилення одержані для залишків 336-347, де R336, Е347 і/або К346 здійснюють контакти кристала, включаючи сольові містки, у деяких субодиницях. Як відзначалось вище, у цій області електронна густина є малою. Інша область з відхиленнями від некристалографічної симетрії містить залишки від 19 до 50, які намотувані навколо субодиници, і також здійснюють різні контакти вільних кристалів у субодиниці. Упаковка субодиниць, що відповідають одній асиметричній комірці, розглядається уздовж осі третього порядку і однієї з осей другого порядку. Центр з двох атомів заліза В попередніх дослідженнях було показано, що D9-десатураза містить чотири атома заліза в одному димері, причому методами оптичної і Мессбауровської спектроскопії було встановлено, що ці іони заліза складають кластери оксо-дизаліза. Тепер ці кластери оксо-дизаліза виявлені у великій множині білків, які здійснюють як каталітичні, так і некаталітичні функції. Вони містить два атому заліза, пов'язаних містковими або оксо-, або гидрокси-лігандами, причому їх класифікують на основі різних мотивів первинних послідовностей, що надають кластерні ліганди, і на основі структурних розбіжностей, виявлених методом рентгенівської кристалографії. Було описано чотири класу: один містить гемеритрин і міогемеритрин, другий містить субодиницю R2 рибонуклеотидної редуктази, бактеріальні вуглеводневі гідроксилази і D9-десатуразу, третій містить рубреритрин і четвертий містить Fe(III)-Zn(II) фосфатазу пурпурової кислоти (Fe(III)-Zn(II) кислу фосфатазу Strmaimalian). Окрім цих розчинених білків, існує окремий клас функціонально родинних інтегральних мембранних білків, включаючих десатурази жирних кислот і вуглеводневі гідроксилази, які містять центри негемного заліза, активованого киснем, які ще мають бути структурно охарактеризовані. З кристалічної структури D9-десатурази випливає, що цей фермент належить до класу II білків з двома атомами заліза і що він містить металевий кластер. Відстань між іонами заліза становить 4,2А, а координаційною геометрією цих іонів заліза є спотворений октаедр, у якому одна позиція ліганда є незайнятою. Структура кластера має високу симетрію. Роль місткових лігандів виконують обидва залишку Е143 з спіралі a 4 і Е229 з a 7. Е105 з a 3а є бідентатним лігандом для одного іона заліза і відповідно Е196 з a6 є бідентатним лігандом для другого іона заліза. Кожен іон заліза також пов'язується атомом азоту, Νd1 у Н146 з a4 і Н232 з a7 відповідно. Орієнтація лігандів заліза у деяких випадках підтримується водневими зв'язками з боковими ланцюгами; Е105 взаємодіє з Н203, Е143 з атомом Νe1 у W139, Νe2 у Н146 з боковим ланцюжком D228, який, в свою чергу, взаємодіє з боковими ланцюгами R145 і W62, Νe2 у Н232 з боковим ланцюжком Е143, який, в свою чергу, взаємодіє з боковим ланцюжком R231. Ще далі від одного з іонів заліза виявлений атом Νe1 у W139, який можна розглядати як ліганд другої оболонки. Біля кластера заліза електронна густина відповідає молекулі розчинника. Вона знаходиться на відстані від іонів заліза відповідно 3,2 і 3,4А, і тому вона не є частиною першої координаційної оболонки кластерного центру. Форма десатурази у кристаличній структурі Наявність в D9-десатуразі кластера з двох атомів заліза, пов'язаних m-оксо-містком у стані дизалізо(III), було однозначно продемонстровано з використанням Мессбауеровської і Рамановскої резонансної спектроскопії. Тому дивно, що m-okco-місток не був виявлений на карті електронної густини D9-десатурази, оскільки використаний у експериментах фермент знаходився у окисленому стані і у маточний розчин не додавали відновлюючі агенти. Крім того, відстань між іонами заліза (4,2А) більше очікуваного для кластера з двох атомів заліза з непошкодженим m-оксо-містком. В окисленій формі рибонуклеотидної редуктази, що містить m-оксо-місток, відстань залізо-залізо становить 3,3А. Геометрія, що спостерігається для D9-десатурази разюче аналогічна тій, що спостерігається у відновленій формі рибонуклеотидної редуктази, у якій, при хімічному відновленні R2, відстань між іонами заліза зростає до 3,8А, m-оксо-місток видаляється, і лігандне оточення стає вельми симетричним, що видно з кристалографії білка і Мессбауеровської спектроскопії. Можна припустити, що при впливі рентгенівського випромінювання на десатуразу відбувається фотохімічне відновлення металевого центру, яке супроводжується втратою m-оксо-містка і перебудовою лігандів. Таким чином, представлена тут структура D9-десатурази найбільш імовірно відбиває відновлену форму ферменту. В кристаличній структурі D9-десатурази виявлено високосиметричне лігандне оточення залізного кластера у дизалізній формі ферменту, згідно з дослідженнями резонансної Рамановскої спектроскопії. Відхилення у симетрії лігандного оточення у відновленому стані ферменту, як було припущено раніше з температурної залежності даних Мессбауєровскої спектроскопії, можливо, обумовлені зміненнями довжини і кутів зв'язків у двох металевих центрах, які надто малі, щоб їх можна було спостерігати у картах електронної густині при існуючій розрізнювальній здатності. Активний центр і взаємодії з іншими білками Описана тут структура D9-десатурази дуже імовірно представляє собою структуру дизалізної форми ферменту, яка є результатом взаємодії D9-десатурази і ферредоксина у рослині. З трьохрозмірної структури можна припустити два можливих шляху перенесення електронів від поверхні до залізного центру. Один шлях простирається уздовж осі пучка спіралей і містить структурно послідовні кластери ароматичних бокових ланцюгів W139, W135, Y236, F189, W132. Атом Νe1 у W139 знаходиться на досить близькій відстані до одного з атомів заліза, а атом Νe1 у W132 є направленим до поверхні субодиниці, близької до виступаючої петлі між a3b і a4. Ця петля і ковпачкова частина a1 потім можуть утворити поверхню для взаємодії молекули ферредоксина. Другий можливий шлях перенесення електронів від поверхні до залізного центру містить залишки W62, D228 і Η146, аналогічні тим, що запропоновані для R2. Цей шлях приводить до створення плоскої поверхні, що створена спіралями a1, a6, a7, a10 та a11. Молекула розчинника, зв'язана коло залізного центру, розташована у невеликому гідрофобному кармані, і найбільш близькими амінокислотними боковими ланцюгами до цієї молекули розчинника є Т199 і W139. Аналогічна порожнина з треоніновим боковим ланцюгом у еквівалентному положенні була виявлена у ММО, і було припущено, що ця порожнина може забезпечити придатне місце для зв'язування молекули кисню. Розуміється, що боковий ланцюг Т213 у ΜАΟ залучений у активацію кисню таким ж чином, як залишок Т252 у цитохромі Р450. Оскільки залізний центр занурений у внутрішню частину D9-десатурази, можна очікувати, що буде ідентифікована западина для субстрату, облицьована гідрофобними залишками, що з'єднує поверхню ферменту з активним центром. Дійсно, можна виявити вузький, дуже глибокий канал, що простирається від поверхні далеко всередину білка. Цей канал підходить до дизалізного центру з тієї ж самої сторони, що і передбачуване місце зв'язування кисню. На дні цього каналу виявлений боковий ланцюг L115 і стінки, що складаються з залишків W139, Т192, Y111, M114, Y191, Q195, Р266, Т99 і T104. Потім цей канал проходить залізний кластер і продовжується по напрямку до поверхні, причому у вузькому вході у цю западину знаходяться залишки Y292, М265, F279 і S283. Загальна форма субстратного каналу, який зігнутий у місці залізного кластера, сприяє зв'язуванню продукту, олеоіл-АПБ, що має цис-конфігурацію при подвійному зв'язку. Після очищення, у карті усередненої густини електронів 2Fo-Fc у цьому каналі була виявлена сильно розтягнута електронна густина, яку не можна приписати розчиннику або атомам білка. На основі форми цієї густини і гідрофобного характеру кармана, можна зробити висновок, що ця електронна густина може представляти гідрофобний ацильний кінець молекули бета-октилглюкозиду. Вуглеводневий кінець октилглюкозиду міг б добре відповідати цій густині, але густина, що відповідає функціональній групі цукру, погано визначена. Ця передбачувана молекула октилглюкозиду орієнтована своїм кінцем глибоко униз у гідрофобний канал, коло дизалізного кластера, а вуглеводна функція простирається по напрямку до поверхні. Низька електронна густина у цій частині молекули можливо вказує на локальне розвпорядкування, яке є результатом менш специфічних взаємодій з ферментом. При моделюванні стеаринової кислоти у передбачуваному суб-страт-зв'язуючому кармані атом вуглецю С9 зображається на відстані приблизно 5,5А від одного з іонів заліза. Цей атом вуглецю, при якому буде формуватись подвійний зв'язок, також близький до малого карману з пов'язаною молекулою розчинника. Дійсно, молекула води є зв'язуючим містком на відстані між атомом С9 субстрата і найближчим іоном заліза. Імовірно, що у активному ферменті цей карман зайнято молекулою кисню, що пов'язана з одним або обома атомами заліза. В ході каталіза може створюватись пероксидний радикал, який здатний видаляти один з атомів водню у положенні С9 жирної кислоти. Зіставлення з іншими білками з двома атомами заліза Накладення структури D9-десатурази на трьохрозмірні структури двох інших білків з двома атомами заліза субодиниці R2 рибонуклеотидної редуктази з Escherichia coli і a-субодиниці ММО з Methylococcus capsulate показує, що їх загальні структури досить подібні і узгоджуються з середньоквадратичною помилкою 1,90А для 144 Сa-атомів (D9-десатураза відносно R2) і 1,98А для 117 еквівалентних Сa-атомів (D9-десатураза відносно ММО). Дуже подібні їх складки, що складаються головним чином з a-спіралей, від a1 до a8 і a10 дають свій внесок у R2 і ММО. Існує мало збережених амінокислот, окрім лігандів заліза, проте не може бути сумнівів, що ці ферменти є еволюційно пов'язаними. Існують значні розбіжності у структурі залізних центрів цих трьох білків. Загалом, металевий центр у D9-десатуразі є значно більш симетрічний, ніж у двох інших білках. Проте, при зіставленні з структурою відновленої форми R2 координаційна геометрія диядерних центрів заліза у D9десатуразі і R2 стає більш подібною. Найбільш значне відрізнення у тому, що у D9-десатуразі кінцеві карбоксилати Ε105 і Е196 відповідно діють як бідентатні ліганди, тоді як у R2 еквівалентні бокові ланцюги є монодентатними лігандами для іонів заліза. Серед цих ферментів R2 є унікальним у тому смислі, що він створює сталий радикал у положенні Υ122. Відповідний залишок у D9-десатуразі представляє собою L150, який розташований у гідрофобному кластері, здійснюючи взаємодії упаковці у чотириспіральному пучці, що зв'язує кластер заліза, причому відсутні дані, які могли б вказати, що цей залишок необхідний для каталітичної активності. Існує мало амінокислотних залишків, які зберігаються у всіх трьох ферментах. Серед них є ліганди до іонів металу, за винятком Е105, який заміщений аспарагіновою кислотою у R2. Єдиними іншими незмінними залишками є 1225 і D228. Залишок 1225 знаходиться коло дизалізного кластера (найближча відстань 4,6А) на протилежній стороні субстратного каналу. Боковий ланцюжок упакований між Н203, Н146 і W62 у трьохрозмірній структурі, і для більш докладного дослідження його функції необхідно чекати результатів вивчення локально направленого мутагенезу. Інший незмінний білковий залишок у трьох ферментах, D228, є частиною шляху перенесення електрона від двоядерного залізного центру до поверхні білка, який запропонований для R2. Цей шлях у R2 проходить від одного з іонів заліза через боковий ланцюг Н118, від D237 до W48, який розташований на поверхні білка. Ці залишки зберігаються у D9-десатуразі, і може бути постульованим аналогічний шлях для перенесення електрона, включаючий структурно еквівалентні залишки H146, D228 і W62, як згадувалось раніше. Більш того, для ММО також можна припустити злегка модифікований шлях для перенесення електрона. У цьому випадку зберігаються ліганд заліза (H147) і залишки аспарагінової кислоти (D242), проте структура на поверхні є різною. Проте ароматичний боковий ланцюжок (Y67) на поверхні знаходиться близько від бокового ланцюга D242. Більша частина інших залишків, збережених між D9-десатуразою і R2, з одного боку, і D9-десатуразою і ММО, з іншого боку, розташована на поверхні білка або залучена у взаємодії упаковки. Консервативні залишки, спільні між R2 і D9-десатуразою біля центру з двох атомів заліза, представляють собою залишки W135 і W139. Хоч W135 і W139 точно зберігаються у десатуразах, відповідні залишки W107 і W111 у R2 не є точно консервативними. За винятком Т4 і білка E.coli, W135 заміщається фенілаланіновим або тирозиновим боковим ланцюжком. Аналогічно, W139 заміщається глутаміновим залишком. Матеріали і методи Очищення і кристалізація ферменту Рекомбінантну D9-десатуразу експресують у клітинах Е.соlі і очищають, як описано раніше (Фокс і ін., Biochemistry, 33:127766 (1993)). Кристалізацію ферменту здійснюють згідно публікації (Шнайдер і ін., J. Моl. Віоl., 225:561 (1992)) з невеликими зміненнями. Зразки ферменту концентрують до вмісту 12-18мг/мл. Аликвоту білкового розчину (7,5мл) змішують з такою ж кількістю резервуарного розчину, поміщують на накрівне скло і при 20°С доводять до рівноваги з 1мл розчину джерела. Резервуарний розчин містить 0,08моль/л какодилового буфера з рН 5,4, 200ммоль/л ацетата магнію, 75ммоль/л сульфата амонію, 2ммоль/л хлориду літію, 1ммоль/л хлоріда калію, 0,2% бета-октилглюкозиду і 12-15% поліетиленгліколю (ПЕГ) 400 у якості осадника. Кристали були орторомбічними, просторова група Ρ212121 з розмірами комірки а=82,2, b=147,8 і с=198,2А. Збір даних і приготування похідних тяжких металів Спроби приготування похідних тяжких металів шляхом просочення природних кристалів ферменту розчинами різних солей тяжких металів у маточному розчині були не зовсім успішними. Здебільшого експерименти з просоченням приводили до розщеплення кристалів або до неізоморфних кристалів, і тільки одна корисна похідна тяжкого металу може бути приготовлена просоченням кристалів десатурази у маточному розчині, вміщуючому 5ммоль/л KAu(CN)2, протягом 1 тижня. Дані рентгенографії для природних і дериватизованих кристалів збирали на багатожильній зонній детекторній системі UCSD (див. Хемлін, Methods Enzymol., 114:416 (1985)) при відділі молекулярної біології у м.Уппсала (Швеція). Виміряні кадри були оброблені за допомогою системи зонного детектора MADNES (Munich area detector NE system, Пфлю-грат, Довідник користувача. Лабораторія фірми "Cold Spring Harbor", Нью-Йорк, США (1987)). Другий набір даних для природних кристалів збирали на спектральній лінії Х12-3 при NSLS, відділ молекулярної біології у Брукхевенської національної лабораторії. Кадри даних збирали у вигляді 10 осциляцій, використовуючи плату зображення MAR Research. Кадри даних були оброблені за допомогою DENZO і масштабовані, використовуючи SCALEPACK. Визначення фаз, побудова моделі і кристалографічне вдосконалення Більшу частку кристалографічних обчислень здійснюють, використовуючи комплект програм ССР4 (Проект комп'ютерної співпраці, №4, Acta Crystallogr., D50:760 (1994)). Початковий кристалографічний аналіз проводять з набором даних, зібраних на багатожильному детекторі при розрізнювальній здатності до 3,1А. Різністну карту Паттерсона для похідної золота аналізують, використовуючи RSPS (Кнайт, докторська дисертація. Шведський університет сільськогосподарських наук, Уппсала, 1989). Для розрахунку різністних карт Фур'є були використані два центру, пов'язані з сильним перехресним піком у різністній карті Паттерсона, і були ідентифіковані два нових центра. Остаточно були виявлені б головних центрів і 12 другорядних центрів, причому параметри тяжкого металу вдосконалили, використовуючи MLPHARE. З результатів розрахунків обертальної функції і положень іонів металу, можна визначити напрямок і положення операторів локальної симетрії, віднесених до шести субодиниць D9-десатурази у асиметричній комірці. Потім застосовують шестикратне усереднення некристалографічної симетрії з використанням програми RAVE (Джонс, на Вихідному семінарі по ССР4, 1992: Молекулярне заміщення, під ред. Додсона, Гоувера і Вольфа, с.91-105, Дейрсбюрська лабораторія, Дєйрсбюрі, Великобританія (1992)) і сферичної оболонки з центром у передбачуваному положенні однієї субодиниці D9-десатурази, для того щоб уточнити початкові фази SIR. З карти електронної густини при низькій розрізнювальній здатності, на основі цих фаз, можна ідентифікувати частину центрального чотириспірального пучка, координуючого центр з двох атомів заліза і атоми заліза. Координати атомів заліза були уточнені з аномальних нативних даних, а нові фази були розраховані на основі похідної золота і аномального внеска від атомів заліза. Нова оболонка для субодиниці була виконана з використанням методу МАМА (Клейвегт і Джоне, Acta Cryst. D50:178 (1994)) шляхом приблизної орієнтації субодиниці R2 у правильному положенні для пучка спіралей. Після некристалографічного усереднення стала можливою побудова вихідної моделі десатурази по карті електронної густини. Були здійснені цикли побудови моделі, її вдосконалення у XPLOR (Брюнгер Α., Acta Cryst. A45:50 (1989)), (Брюнгер Α., Довідник по X-PLOR, Йельський університет, Нью Хевен, шт. Коннектікут (1990)), повторне визначення оболонки, вдосконалення операторів симетрії з використанням IMP (Клейвегт і Джоне, Acta Cryst. D50: 171 (1994)) і усереднення, доти поки у усереднених картах не з'являлась нова електронна густина. На цій стадії з карт 2Fo-Fc була побудована ще одна петля, яка, мабуть, має іншу структуру у субодиницях. Кристалографічне вдосконалення здійснювали у XPLOR, використовуючи силове поле Енга і Хубера (Енг і Хубер, Acta Cryst. А47: 392 (1991)) і обмеження некристалографічної симетрії. З-за низької розрізнювальної здатності (3,1А) набору даних використали сумарне В-значення. На цій стадії модель мала кристалографічний R-фактор рівний 26,7% при обмеженнях шестикратної некристалографічної симетрії, накладених цим вдосконаленням. На цій стадії уточнення став доступним новий нативний набор з розрізнювальностю до 2,4А, зібраний на NSLS, і уточнення продовжувалось з цим набором даних. Процес вдосконалення слідкувався по 2,5% відображенням, які не були включені у уточнення, але були використані для розрахунку вільного значення фактору RCB (A. Nature, 355:472 (1992)). Навіть при розрізнювальності 2,4А спостереження до параметричного відношення становить тільки близько одиниці, і проблема уточнення погано виконується. Тому у ході всього процесу вдосконалення були використані обмеження некристалографічної симетрії, для того щоб уникнути пере-апроксимації даних по дифракції. Обмеженням не піддавались тільки тічастини структури, для яких з карт усередненої електронної густини було підтверджено, що вони не підпорядковуються некристалографічної симетрії. Ці частини містять залишки 19-50, 121-122, 127-129, 208-212, 241-253, 259-260, 308-319, 336-348 і деякі бокові ланцюги. Електронна густина для деяких залишків у області 336-347 настільки низька, що їх положення слід розглядати умовно, і тому зайнятість для цих атомів встановлена рівною нулю. Сумарне анізотропне вдосконалення знижує вільне значення фактору RCВ приблизно на 2%. На цій стадії у модель були введені молекули води. Крім того, були уточнені індивідуальні значення В-факторів, але при обмеженні некристалографічної симетрії. Остаточна модель мала кристалографічний фактор R, який дорівнював 22,0% (RCВ=28,5%). Середньоквадратичні відхилення для обмежених положень Сa (263 атома) субодиниці А до відповідних частин інших субодиниць становлять 0,06 і для всіх атомів Сa (345 атомів) - 0,26; 0,23; 0,24; 0,32; 0,25, відповідно. Цю білкову модель аналізували, використовуючи варіанти PEPFLIP і RSFIT у О (Джоне та ін. Acta cryst. A47:100 (1991)) і програму PROCHECK (Ласковській та ін. J. Appl. Cryst. 26:282 (1993)). Координати атомів будуть депоновані у Брукхевенській банк даних білків. Порівняння структур Всі структурні суперпозиції були здійснені по методу найменших квадратів, використовуючи О (Джонс та ін. Acta cryst. А47: 100 (1991)), причому вони були виконані попарно. Суміщення було виконано шляхом вибору початкового набору атомів Сa, вміщуючих чотири відрізка поліпептидного ланцюга (у кожному приблизно по 10 залишків) від чотирьох спіралей, вміщуючих ліганди для центру з двома атомами заліза. Цю початкову орієнтацію послідовно максимізували шляхом включення всіх атомів Сa з атомних моделей. Залишки вважались структурно еквівалентними, якщо вони були у межах 3,8 один від одного і у межах послідовного відрізка більше ніж від трьох еквівалентних залишків. Приклад 2 Результати і їх обговорення Підхід поєднання елементів амінокислотної послідовності з структурно родинних ферментів з різними властивостями виявилея ефективним при одержанні характеристики субстрату і позиційних особливостей ферментів, модифікуючих жирні кислоти, таких як ліпоксигенази ссавців і рослинні ацил-АПБ-тіоестерази. Цей підхід був використаний тут для ідентифікації залишків, які відповідальні за розбіжності у властивостях D9-18:0АПБ-десатурази і D6-16:0-АПБ-десатурази, кодуємих кДНК T.alata pTAD і рΤΑD4 відповідно. Зрілі поліпептіди, кодовані цими кДНК, розподіляють 65% ідентичності амінокислотної послідовності. Початково були створені два химерних мутанта: а) Химера 1, вміщуюча перші 171 амінокислот зрілої D6-16:0-АПБ-десатурази, пов'язаної з іншими 185 амінокислотами D9-18:0-АПБ-десатурази, і б) Химера 2, вміщуюча перші 227 амінокислот зрілої D9-18:0-АПБ-десатурази, пов'язаної з іншими 134 амінокислотами D6-16:0-АПБ-десатурази. Обидва ферменту проявляють тільки детектуєму активність D9-18:0-АПБ-десатурази. Окрім аналогічної каталітичної активності, ці мутанти розподіляють область перекривання 50 залишків (залишки 178-227) D918:0-АПБ-десатурази. Це дозволяє припустити, що детермінанти довжини ланцюга і особливостей розташування подвійного зв'язку присутні у цій частині D9-18:0-АПБ-десатурази. Таким чином, була створена Химера 3, у якій залишки 172-221 D6-16:0-АПБ-десатурази були замінені відповідною ділянкою з 50 амінокислот з D9-18:0-АПБдесатурази. Одержаний фермент каталізував створення ненасиче-ності D6 або D9 як у 16:0-АПБ, так і 18:0АПБ. Майже ідентична активність була одержана для Химери 4, у якій підгрупа з 30 амінокислот цього домена (залишки 178-207 D9-18:0-АПБ-десатурази) була переміщена у D6-16:0-АПБ-десатуразу. Як показано на фіг.1, у різкому відрізненні від активності D6-16:0-АПБ-десатурази природного типу, цей фермент каталізує створення ненасиченості D6 і D9 в співвідношенні майже 3:1 і 1:1 відповідно у 16:0-АПБ і 18:0-АПБ. Більш того, питома активність для субстрату 18:0-АПБ була майже вдвічі більше, ніж вимірена для 16:0-АПБ. Ці результати знаходяться у сильному контрасті з активністю D6-16:0-АПБ-десатурази природного типу. Хоч цей химерний фермент здатний каталізувати введення подвійного зв'язку більше ніж в одне положення 18:0-АПБ, у той самий час D6-16:0-АПБ-десатураза природного типу має помітну активність тільки у створенні ненасиченості D6 у 16:0-АПБ. Крім того, фермент природного типу має у 6 раз більшу активність відносно 16:0-АПБ, ніж з 18:0АПБ. Для додаткової характеристики області 50 амінокислот D9-18:0-АПБ-десатурази меншу частину цієї послідовності переміщали у D6-16:0-АПБ-десатуразу (Химера 5). На відміну від питомої активності D6-16:0АПБ-десатурази природного типу, питомаактивність одержаного ферменту була майже однаковою, як для 16:0-АПБ, так і для 18:0-АПБ. Окрім розширеної специфічності довжини ланцюга жирних кислот, мутантна десатураза каталізує введення подвійного зв'язку майже винятково у D6-положенні 16:0-АПБ і 18.-0-АПБ. Більш того, питома активність цього ферменту була більш, ніж у два рази вище активності D6-16:0-АПБдесатурази природного типу. Частково це може бути наслідком підвищеної сталості мутантного ферменту у Е.соlі (тобто, мутантна десатураза має більш високі рівні експресії і проявляє підвищену розчинюваність, ніж D6-16:0-АПБ-десатураза природного типу). Область 178-207 D9-18:0-АПБ-десатурази містить дев'ять амінокислот, які відрізняються від амінокислот, виявлених у аналогічній частині D6-16:0-АПБ-десатурази. Шляхом сайт - направленого мутагенезу D6-16:0АПБ-десатурази кожен з цих залишків, або індивідуально, або у сполученні, був перетворений у той, що присутній у D9-18:0-АПБ-десатуразі. Була одержана активність, якісно аналогічна активності Химери 4 у результаті такої мутації D6-16:0-АПБ-десатурази: A181T/A188G/Y189F/S205N/L206T/G207A (Примітка: нумерація амінокислот дана згідно з D9-18:0-АПБ-десатуразою). Крім того, фенотип Химери 5 (тобто, розширена специфічність довжини ланцюга) був якісно реалізований шляхом мутації A188G/Y189F у D6-16:0АПБ-десатуразі. В цих експериментах також були одержані мутантні десатурази з неочевидними значеннями активності. Наприклад мутація A181T/A200F у D6-16:0-АПБ-десатуразі привела до одержання ферменту, який каталізує толовим чином введення D9-ненасиченості у 18:0-АПБ, але з 16:0-АПБ працює як D6-десатураза. Проте питома активність цього ферменту з 18:0-АПБ була майже у 3 рази менше активності, виявленої для 16:0-АПБ. Більш того, мутація A181T/A200F/S205N/L206T/G207A у D6-16:0-АПБ-десатуразі дає фермент, який має тільки вимірювану активність введення D9-подвійного зв'язку у 18:0-АПБ, і був майже у чотири рази активніше з цим субстратом, ніж з 16:0-АПБ. Подібно мутанту A181T/A200F, цей фермент зберігає активність введення D6-подвійного зв'язку у 16:0-АПБ. Змінення властивостей зв'язування субстратів цими ферментами можуть бути зменшені, як основна причина ефектів, що спостерігаються, оскільки їх значення незначно відрізняються від таких для ферменту природного типу. Були оцінені значення констант Михаеліса, Km, для D6-16:0-АПБ-десатурази природного типу, Химери 5 і мутанта A18 8G/Y189F, які знаходяться у інтервалі від 0,2 до 0,6мкмоль/л, як для 16:0-, так і для 18:0-АПБ. Як описано у Прикладі 1, була визначена кристалична структура касторової D9-18:0-АПБ-десатурази, що забезпечує можливість інтерпретації результатів, одержаних для химер і мутантів, в аспекті оточення активного центру. В структурі субодиниці міститься дуже глибокий і вузький канал, який, як виявилось, відповідає зв'язуючому центру для стеариновокислотної частини субстрату. Форма каналу нав'язуває зігнуту конформацію аліфатичного ланцюга в тому місці, де вводиться подвійний зв'язок (між дев'ятим і десятим атомами вуглецю), що відповідає цис-конфігурації продукту - олеїнової кислоти, причому можливий подвійний зв'язок розташовується досить близько до атому заліза каталітичного центру у субодиниці. Таким чином канал, зв'язуючий субстрат, накладає жорсткі обмеження на довжину аліфатичного ланцюга за межами введеного подвійного зв'язку, що може частково пояснити розбіжності специфічності дії ферментів цього сімейства. Як можна бачити, у варіантах ферменту, які можуть приймати субстрати з меншим числом атомів вуглецю поза подвійним зв'язком, зв’язуючи западини закриті шляхом заміщення амінокислотами з більш об'ємними боковими ланцюгами. Ці амінокислоти, залучені у визначення специфічності, у цій частині зв'язуючого центру представляють собою 114-115, 117-118, 179, 181 і 188-189. У відсутності структурної моделі для комплексу фермент-субстрат-АПБ, важко безпосередньо прослідкувати за детермінантами особливостей довжини ланцюга по іншу сторону подвійного зв'язку, у напрямку до білка, що переносить ацил. Вважаючи, що АПБ у різних ферментах цього типу пов'язує аналогічним чином, розбіжності амінокислотних бокових ланцюгів у верхній частині субстратного каналу і при вході на поверхні субодиниці дозволили б ферментам пристосувати алкільні ланцюги різної довжини між подвійним зв'язком і фосфопантеїн-простетичною групою АПБ. Проте амінокислоти, оточуючі верхню частину центру зв'язування від подвійного зв'язку до поверхні білка, зберігаються у доступних послідовностях ферменту, і найбільш імовірно, що детермінанти специфічності знаходяться на вході у субстратний канал і на поверхні ферменту, яка взаємодіє з ацил-АПБ. Тут зв'язуючий карман розширюється, і неможливо змоделювати фосфопантеїнову частину стеароіл-АПБ. Залишки 280, 283, 286 і 294 у цій області не зберігаються між різними ферментами, і вони можуть бути залучені у визначення специфічності субстрату. З структури зв'язуючого центру у цій області можна дати раціональне пояснення деяким результатам по химерах і мутантах. Всі химери і мутанти містять детермінант 179-189 (фактично залишки 179, 181, 188-189), і таким чином, недивно виявити їх дію на специфічність. Як Химера 1, так і Химера 2 мають дуже низьку залишкову активність, імовірно, з-за деяких стеричних ускладнень при їх створенні. Химера 1 має цей детермінант D9-18:0-АПБ-десатурази у глибокому кармані, а також поверховий детермінант, специфічний для D9-18:0-АПБ-десатурази; тільки один детермінант, залишки 114-115 и 117-118, є специфічним для D6-16:0АПБ-десатурази, і таким чином низька залишкова активність цієї химери представляє собою активність Δ 918:0-десатурази. Химера 2 має повний детермінант D9-18:0-десатурази у області прихованого кармана і відомого детермінанта D6-16:0-АПБ-десатурази на поверховому кінці; ця химера також має D9-18:0-АПБ активність. Химери 3 і 4 зберігають свою активність, один з детермінантів у глибокому кармані є визначником для D9-18:0-АПБ, залишок А181 заміщається більш великим треоніновим боковим ланцюгом, але між тим А188 заміщається гліцином, a Y189 - на фенілаланін, фактично створюючи більше вільного простору у глибині порожнини, і таким чином забезпечуючи активність навіть для D6-18:0-АПБ-десатурази. Химера 5 відрізняється від химери 4 тільки тим, що в ній зберігається послідовність D6-16:0-АПБ-десатурази для залишків 203-207. Ці залишки знаходяться у верхній частині субстратного каналу, але не здійснюють безпосереднього контакту з субстратами, і важко зрозуміти їх вплив на специфічність до субстрату. Ці залишки добре зберігаються між відомими десатуразами у цьому сімействі, тільки D6-16:0-ΑΠΒ-десатураза має іншу послідовність для залишків від 205 до 207, і ця область, імовірно, не є частиною природнього детермінанта для специфічності до субстрату. На випадок мутанта A181T/A200F зниження D6-16:0 активності, в порівнянні з ферментом природного типу, узгоджується з структурними зміненнями у субстратному каналі зза зменшення розміру цієї порожнини при заміні А181 на треонін. Вплив A200F неможливо пояснити раціонально, цей залишок знаходиться на поверхні субодиниці і направлений у сторону від субстратного каналу. У всіх секвенованих десатуразах у цьому сімействі, за вийнятком D6-16:0-ΑΠΒ цей залишок є фенілаланіном. З передуючого обговорення ясно, що активність мутанта A181T/A200F/S205N/L206T/G207A неможливо пояснити у межах структури, ми не змогли знайти розумне пояснення впливу змінень у залишках 200 і 205-207. Таким чином, було показано, що регіо-специфічність і специфічність довжини ланцюга десатурази жирних кислот можуть бути змінені шляхом спеціальних заміщень амінокислот. Детермінанти специфічності довжини ланцюга частково наносять на карту область трьохрозмірної структури, яка визначає форму і розмір каналу, що зв'язує субстрат. Проте деякі з цих залишків знаходяться за межами каналу, що зв'язує субстрат, і змінення у таких залишках можуть привести до нової і корисної активності. При доступності трьохрозмірної структури АПБ-десатурази жирних кислот, представлені тут успішні спроби змінення специфічності до субстратів тепер можуть бути розповсюджені на розумно сконструйовані варіанти ферментів, що мають іншу специфічність до довжини ланцюга, а також регіо-специфічність. Проте це може бути успішним тільки за умови, що на основі кристаличної структури субстратного комплексу і доступності множини амінокислотних послідовностей ферментів у цьому сімействі ми зможемо вирішити, що представляють собою детермінанти специфічності, розташовані на вході у субстратний канал. Матеріали і методи Назви жирних кислот скорочені у форматі x:ydz, де x це довжина ланцюга або число атомів вуглецю у жирній кислоті, у - число подвійних зв'язків і z - положення подвійного зв'язку у жирній кислоті відносно карбоксильного кінця молекули (наприклад, олеїнова кислота або 18:1D9 є вісімнадцативуглецевою жирною кислотою з одним подвійним зв'язком, яка розташована при дев'ятому атомі вуглецю відносно карбоксильного кінця молекули). Одержання химерних мутантів Химерні мутанти одержують шляхом зшиття частин кодувальної послідовності зрілих D6-16:0- і D9-18:0АПБ-десатураз T.alata через нативні ферментні сайти рестрікціі або ферментні сайти рестрікції, створені за допомогою PCR. Сайт-специфічні мутації у кодувальній послідовності амінокислот 178-202 у D9-18:0-АПБдесатуразі (еквівалентні залишкам 172-196 у D6-16:0-АПБ-десатуразі) вводять шляхом подовження і ампліфікації олігонуклеотидних праймерів, що перекриваються, з використанням PCR з Pfu-полімеразою (фірма Стратаген). Мутації A181T/A188G/Y189F зроблені з такими олігонуклеотидами: 5'ATGGATCCTGGCACGGATAACAACCCGTAC3' (Праймер 1А); 5'ACGAGGTGTAGATAAATCCGAGGTACGGGTTGTTATCCGS' (Праймер 2А); 5'TATCTACACCTCGTATCAGGAGAGGGCGACA3' (Праймер 3А); 5'TTGAATTCCATGGGAAATCGCTGTCGCCCTCTCCTG3' (Праймер 4А). Мутації A18 8G/Y18 9F вводять, використовуючи такі олігонуклеотиди: 5'ATGGATCCTGGCGCGGATAACAACCCGTACS' (Праймер 1В); Праймер 2А; Праймер 3А; Праймер 4А. Мутації A181T/A200F були створені таким чином: Праймер 1А; 5'ACGAGGTGTAGATATATGCGAGGTACGGGTTGTTATCCG3' (Праймер 2В); Праймер 3А; 5'TTGAATTCCATGGGAAATGAATGTCGCCCTCTCCTG3' (Праймер 4В). Реакції PCR проводять без додавання матриці, використовуючи 12,5 піомолів Праймерів 1А або В і 4А або В і 6,25 пікомолів Праймерів 2А або В і 3А. Для перших десяти циклів PCR використовують температуру відпалу 37°С і температуру подовження 72°С. Після цього слідують 20 додаткових циклів з підвищеною температурою відпалу, до 55°С. Продукти реакції PCR розщепляють з ВаmНІ і EcoRI і вбудовувають у відповідні сайти pBluescript II KS(-) (Стратаген), з яких визначають нуклеотидну послідовність, використовуючи набір Секвенази 2.0 (фірма Амершам). Потім цю плазміду розщепляють з ВаmНІ і EcoRI і виділену вставку легують послідовністю, що кодує амінокислоти 1-171 зрілої D6-16:0-АПБ-десатурази у векторі експресії рЕТ3а (Новаген). Створену конструкцію (що містить тепер кодувальну послідовність амінокислот 1-196 мутантної або природної D6-16:0АПБ-десатурази) піддають рестрікції дією Ncol і EcoRI і легують фрагментом Ncol/EcoRI, що містить кодувальну послідовність решти амінокислот (залишки 197-355) Δδ-16: О-АПБ-десатурази і частиною плазміди рЕТ3d (нуклеотиди). Мутацію S205N/L206T/G207A створюють шляхом PCR ампліфікації кодувальної послідовності амінокислот 197-355 у D6-16:0-АПБ-десатуразі, використовуючи як матрицю початкову кДНК для цього ферменту у pBluescript II SK(-). 5’-олігонуклеотид (5'TTTCCATGGGAACAAGGCTCGGCTAGCGAGGCAGAAGG3'), містив придатні мутантні кодони, а Т7-праймер був використаний як 3'-олігонуклеотид у реакціях PCR. Продукт ампліфікації розщепляють з Ncol і BelI і вбудовувають у сайт NcoI/BamHI плазміди pET3d. Потім фрагмент Ncol/EcoRI з цієї конструкції легують кодувальною послідовністю амінокислот 1-196 придатної мутантної D6-16:0-АПБ-десатурази (наприклад A181T/A200F) , щоб створити повнорозмірну кодувальну послідовність. В продуктах реакцій PCR секвенують послідовності, щоб підтвердити наявність цільових мутацій. Продукування ацил-АПБ-десатураз Ацил-АПБ-десатурази природного типу і мутантні одержують шляхом експресії кодувальних послідовностей у Е.соіі BL21 (DE3) під контролем промотора Т7 РНК-полімерази з використанням векторів рЕТ3а або pET3d. Рекомбінантні ферменти, активність яких описана на Фіг.1, очищають з бактеріальних культур (об'ємом від 6 до 9 л), що культивуються при температурі від 20 до 25°С. Очищення білка здійснюють, використовуючи DEAE-аніонно-обмінну хроматографію з подальшою 20HS (фірма Персептив Байосистемз) катіонно-обмінною хроматографією з використанням рідкісної хроматографії високого тиску Байокад Спрінт (фірма Персептив Байосистемз). Мутантні десатурази були одержані з чистотою r 90%, а D6-16:0-АПБдесатуразу природного типу виділяли з чистотою приблизно 80%. Після очищення ферменти піддають обміну у буфері, що складається з 40ммоль/л гідрохлоріда-Тріс (рН 7,5), 40ммоль/л хлоріда натрію і 10% гліцеріну, і зберігають у аліквотах при -75°С після миттєвого заморожування у рідкому азоті. Випробування і аналіз ацил-АПБ-десатураз. Випробування і аналіз продуктів реакції ацил-АПБ-десатурази проводять, як описано раніше (Кейхун і ін. Ргос. Nat. Acad. ScL, USA. 89: 1184 (1994)) з такими зміненнями: використали рекомбінантний рослинний фередоксин Anaebena (22 фем-то-г на 1 випробування) і корінь кукурудзи FNR (0,4од./випробування) замість фередоксина шпинату і FNR, причому кількості NADPH і радіоактивної [1-14С]16:0 або 18:0-АПБ, взятих на одне випробування, збільшили відповідно до 2,5ммоль/л і 178 пікомолів (або 1,2 фемто-моль/л). Використана у синтезі субстратів АПБ представляє собою рекомбінатну АПБ-І шпинату. Питома активність [1-14С]16:0 або 18:0-АПБ (від фірми Амерікен Рейдіолейблд Кемікалз) становить 55мКюрі/ммоль. Активність ферментів виміряють шляхом визначення концентрації (%) моно-ненасиченого продукту, що утворився при випробуванні десатурази. Розподіл радіоактивності між продуктами і субстратом, що не прореагував, визначають за допомогою фосфоресціювальних зображень продуктів поділення на посрібленій платівці тонкошарової хроматографії (ТШХ) з використанням програмного забезпечення Імідж-Квант і методом рахунку рідкісних сцинциляцій для зскрібків ТШХ. Визначення положення подвійних зв'язків Положення подвійних зв'язків у продуктах - мононенасичених жирних кислотах визначають по рухомості метілефірних похідних на посріблених (15%) платівках ТШХ і з використанням хромато-масспектрометричного (Хромас) аналізу диметилсульфідних аддуктів цих похідних. Випробування створення подвійних зв'язків для Хромас-аналізів проводять з використанням немічених 16:0-, 17:0- і 18:0-АПБ як субстратів і очищених ферментів. На доповнення до результатів, що приведено у тексті, було виявлено близько 15% ненасичених продуктів, що утворились у результаті реакції 17:0-АПБ з D6-16:0-АПБ-десатуразой, у вигляді 17:1 D7 ізомеру. Інша частина продукту представляє собою 17:1 D6, також виявлені слідові кількості 17:1D9. Фіг.1 МОДИФІКОВАНА АЦИЛ-АПБ-ДЕСАТУРАЗА Фермент D6-16:0-АПБ-десатураза (природний тип) Химера 4 (D6/D9 178-207/D6) Химера 4 (D6/D9 178-202/D6) A181T/A188G/Y189F/ S205N/L206Т/G207Ад A188G/Y189F A181T/A200F A181T/A200F/S205N/ L206T/G207A Питома активність, наномоль/хв/мг білка 16:0-АПБа 18:0-АПБа 6 9 6 D D D D9 б 99,7 н/в 10,6 5,3 (2:1)в 13,4 4,0 14,7 17,1 (1:1) (3:1) (1:1) 250 н/в 267 слідиг 34,0 12,3 34,5 37,1 149 н/в н/в 37,0 3,1е 18,7 1,1е н/в (3:1) Відношення загальної питомої активності 16:0-АПБ/18:0-АПБ 6:1 1:2 1:1 (1:14) 57,7 1:2 сліди 43,6 (1:2) 1:1 3:1 72,6 1:4 (17:1) Питомі активності десатурази природного типу і мутантних D6-16:0-АПБ-десатураз - Положення подвійних зв'язків визначали, як описано у Примітці 13. б - н/в - не визначали. в - Сх:у це відношення активностей D6/D9 для даного субстрату. г - Сліди - це £2% від загальної активності для даного субстрату. д - Нумерація амінокислот дана згідно з послідовністю D9-18:0-АСР десатурази. е - Ідентифікація на основі рухомості метилефірної похідної на посріблених пластинах тонкошарової хроматографії. а
ДивитисяДодаткова інформація
Назва патенту англійськоюModified acyl-acp desaturase
Назва патенту російськоюМодифицированная ацил-апб-десатураза
МПК / Мітки
МПК: C12N 15/82, C12N 1/15, C12N 9/02, C12N 15/09, C12N 5/10, C12N 1/21
Мітки: ацил-апб-десатураза, модифікована
Код посилання
<a href="https://ua.patents.su/11-72180-modifikovana-acil-apb-desaturaza.html" target="_blank" rel="follow" title="База патентів України">Модифікована ацил-апб-десатураза</a>