Фармацевтична композиція для перорального або місцевого введення (варіанти) та спосіб її одержання
Номер патенту: 72539
Опубліковано: 15.03.2005
Автори: Єгоров Алєксандр, Андришек Томас, Врана Алес, Стухлік Мілан, Стухлік Йозеф, Мата Владімір
Формула / Реферат
1. Фармацевтична композиція для перорального або місцевого застосування, яка включає:
а) від 0,1 до 30,0 % одного або кількох гідрофобних активних інгредієнтів,
б) від 0,1 до 60,0 % одного або кількох гелеутворювачів, вибраних з
полігліцеринових естерів жирних кислот формули (1)
CH2OR-CHOR-CH2O-[CH2CHOR-CH2O-]NCH2-CHOR-CH2OR, (1)
де n є цілим числом від 4 до 13, і R є Н або COR', причому R' є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і де принаймні одна група R не є воднем, що мають значення HLB не менше 10,
в) від 0,1 до 60,0 % однієї або кількох гелеутворюючих речовин, вибраних з полігліцерил-3-естерів олеїнової кислоти, що мають значення HLB не більше 9,
г) від 1,0 до 60 % однієї або кількох додаткових гелеутворюючих речовин, вибраних з тригліцериду макроголу та естерів гліцерину, часткових гліцеридів або жирних кислот або естерів жирних кислот з макроголом, у яких середня кількість прореагованого етиленоксиду у синтезі цих речовин становить від 50 до 150 моль, і водночас співвідношення між компонентами б та г становить від 0,1:1 до 10:1,
д) від 5,0 до 30 % одного або кількох С2-С4 спиртів,
де вищезгаданий відсоток у цілому становить 100 %,
причому після розведення водою композиція утворює дисперсію частинок поліморфного гелю, які мають розмір від 0,2 до 500 мкм.
2. Композиція за п. 1, яка відрізняється тим, що співвідношення а:в та/або а:д становить від 0,001:1 до 10:1.
3. Композиція за п. 1 або 2, яка відрізняється тим, що R' є С16-18 насиченим або ненасиченим алкілом.
4. Композиція за п. 3, яка відрізняється тим, що R є вибраним з групи, яка складається з олеатів, лінолеатстеарату, лінолату, міристату, лаурату та їх сумішей.
5. Композиція за п. 4, яка відрізняється тим, що компонент б) є вибраним з полігліцерил-10-естерів жирних кислот.
6. Композиція за будь-яким з пп. 1-5, яка відрізняється тим, що компонент г) є макроголглікольгідрогенізованою рициновою олією.
7. Композиція за будь-яким з пп. 1-6, яка відрізняється тим, що компонент б) є вибраним з полігліцерил-10-естерів олеїнової кислоти, компонент в) є вибраним з полігліцерил-3-естерів олеїнової кислоти, і компонент г) є макрогол(1760)гліцерингідрогенізованою рициновою олією.
8. Композиція за будь-яким з пп. 1-7, яка відрізняється тим, що компонент а) є вибраним з циклоспоринів, зокрема циклоспорину А, циклоспорину D або циклоспорину G, причому співвідношення компонентів а:в+д становить від 1,001:1 до 1,5:1.
9. Композиція за будь-яким з пп. 1-8, яка відрізняється тим, що компонент а) є вибраним з таксанів, зокрема докатакселу або паклітакселу, причому співвідношення між компонентами а:в+д становить від 0,001:1 до 1,5:1.
10. Композиція за будь-яким з пп. 1-9, яка відрізняється тим, що компонент а) включає принаймні одну речовину, вибрану з групи, яка складається з циклоспоринів, та принаймні одну речовину, вибрану з групи, яка складається з таксанів.
11. Композиція за будь-яким з пп. 1-10, яка відрізняється тим, що також включає наповнювачі для зміни фізичних, хімічних властивостей, стійкості до мікробів, органолептичних властивостей або властивостей композиції, що стосуються фізичної обробки.
12. Фармацевтична дозована форма, яка відрізняється тим, що включає желатинову капсулу, яка містить композицію за будь-яким з пп. 1-11.
13. Спосіб одержання фармацевтичної композиції для перорального або місцевого застосування, що включає комбінування активних інгредієнтів та допоміжних речовин, який відрізняється тим, що комбінують:
а) від 0,1 до 30,0 % одного або кількох гідрофобних активних інгредієнтів,
б) від 0,1 до 60,0 % одного або кількох гелеутворювачів, вибраних з
полігліцеринових естерів жирних кислот формули (1)
CH2OR-CHOR-CH2O-[CH2CHOR-CH2O-]NCH2-CHOR-CH2OR, (1)
де n є цілим числом від 4 до 13, і R є Н або COR', причому R' є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і де принаймні одна група R не є воднем, що мають значення HLB не менше 10,
в) від 0,1 до 60,0 % однієї або кількох гелеутворюючих речовин, вибраних з полігліцерил-3-естерів олеїнової кислоти, що мають значення HLB не більше 9,
г) від 1,0 до 60 % однієї або кількох додаткових гелеутворюючих речовин, вибраних з тригліцериду макроголу та естерів гліцерину, часткових гліцеридів або жирних кислот або естерів жирних кислот з макроголом, у яких середня кількість прореагованого етиленоксиду у синтезі цих речовин становить від 50 до 150 моль, і водночас співвідношення між компонентами б) та г) становить від 0,1:1 до 10:1,
д) від 5,0 до 30 % одного або кількох С2-С4 спиртів,
де вищезгаданий відсоток у цілому становить 100 %, причому після розведення водою композиція утворює дисперсію частинок поліморфного гелю, які мають розмір від 0,2 до 500 мкм.
14. Спосіб за п. 13, який відрізняється тим, що співвідношення а:в та/або а:д становить від 0,001:1 до 10:1.
15. Спосіб за п. 13 або 14, який відрізняється тим, що R' є С16-18 насиченим або ненасиченим алкілом.
16. Спосіб за п. 15, який відрізняється тим, що R є вибраним з групи, яка складається з олеатів, лінолеатстеарату, лінолату, міристату, лаурату та їх сумішей.
17. Спосіб за п. 16, який відрізняється тим, що компонент б) є вибраним з полігліцерил-10-естерів жирних кислот.
18. Спосіб за будь-яким з пп. 13-17, який відрізняється тим, що компонент г) є макроголглікольгідрогенізованою рициновою олією.
19. Спосіб за будь-яким з пп. 13-18, який відрізняється тим, що компонент б) вибирають з полігліцерил-10-естерів олеїнової кислоти, компонент в) вибирають з полігліцерил-3-естерів олеїнової кислоти, і компонент г) є макрогол(1760)гліцерингідрогенізованою рициновою олією.
20. Спосіб за будь-яким з пп. 13-19, який відрізняється тим, що компонент а) вибирають з циклоспоринів, зокрема циклоспорину А, циклоспорину D або циклоспорину G, причому співвідношення компонентів а:в+д становить від 1,001:1 до 1,5:1.
21. Спосіб за будь-яким з пп. 13-20, який відрізняється тим, що компонент а) вибирають з таксанів, зокрема, докатакселу або паклітакселу, причому співвідношення між компонентами а:в+д становить від 0,001:1 до 1,5:1.
22. Спосіб за будь-яким з пп. 13-21, який відрізняється тим, що компонент а) включає принаймні одну речовину, вибрану з групи, яка складається з циклоспоринів, та принаймні одну речовину, вибрану з групи, яка складається з таксанів.
23. Спосіб за будь-яким з пп. 13-22, який відрізняється тим, що також включає додавання наповнювачів для зміни фізичних, хімічних властивостей, стійкості до мікробів, органолептичних властивостей або властивостей композиції, що стосуються фізичної обробки.
Текст
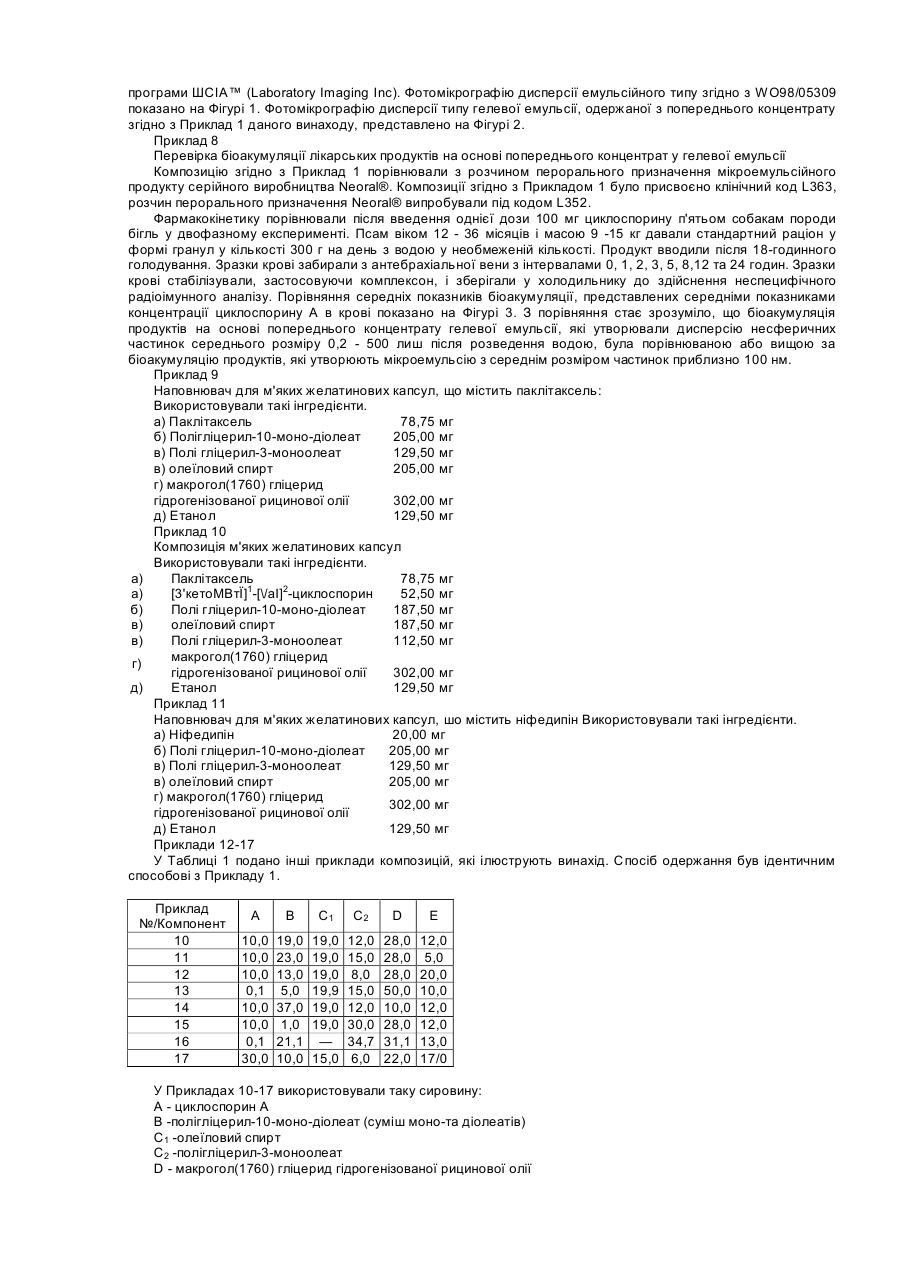
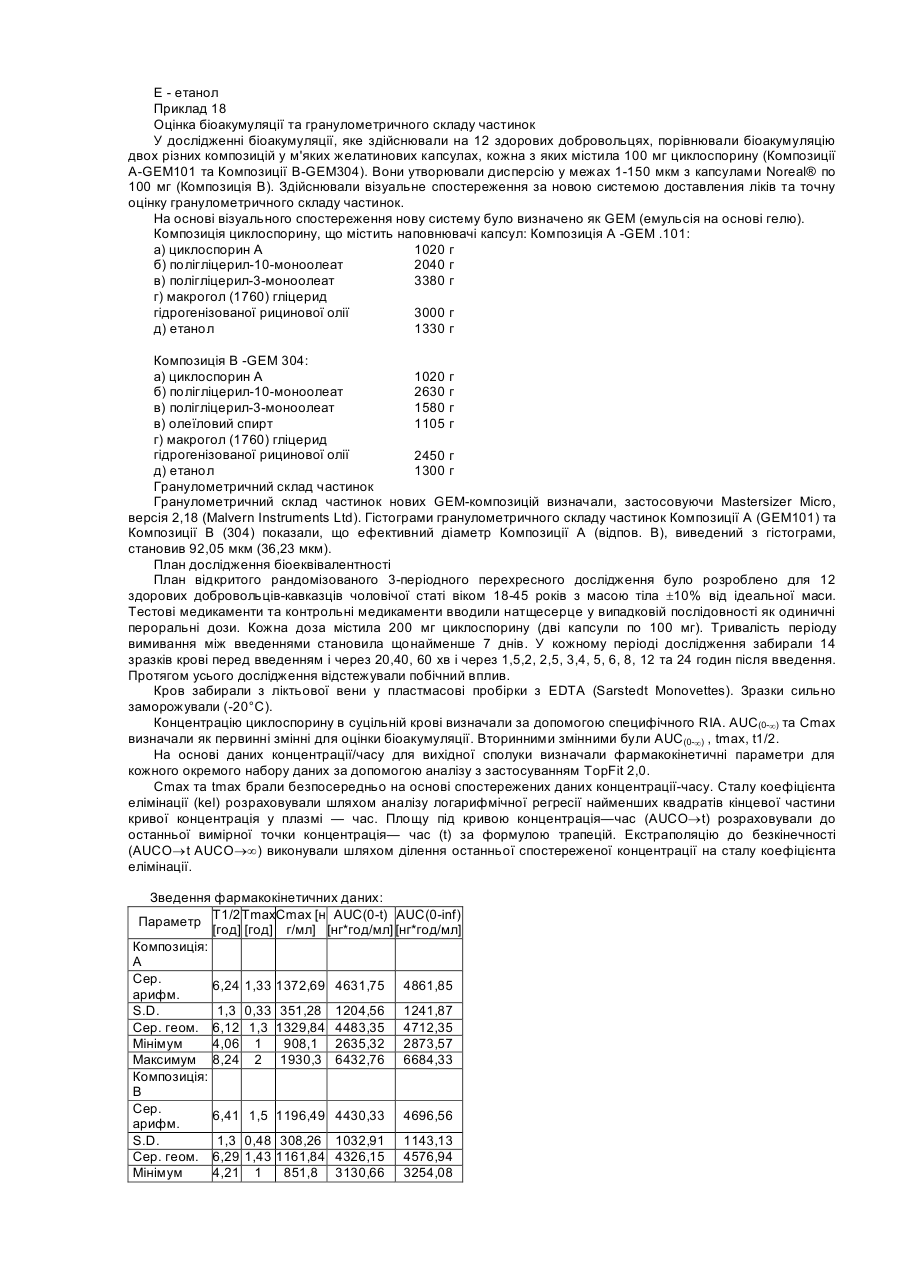
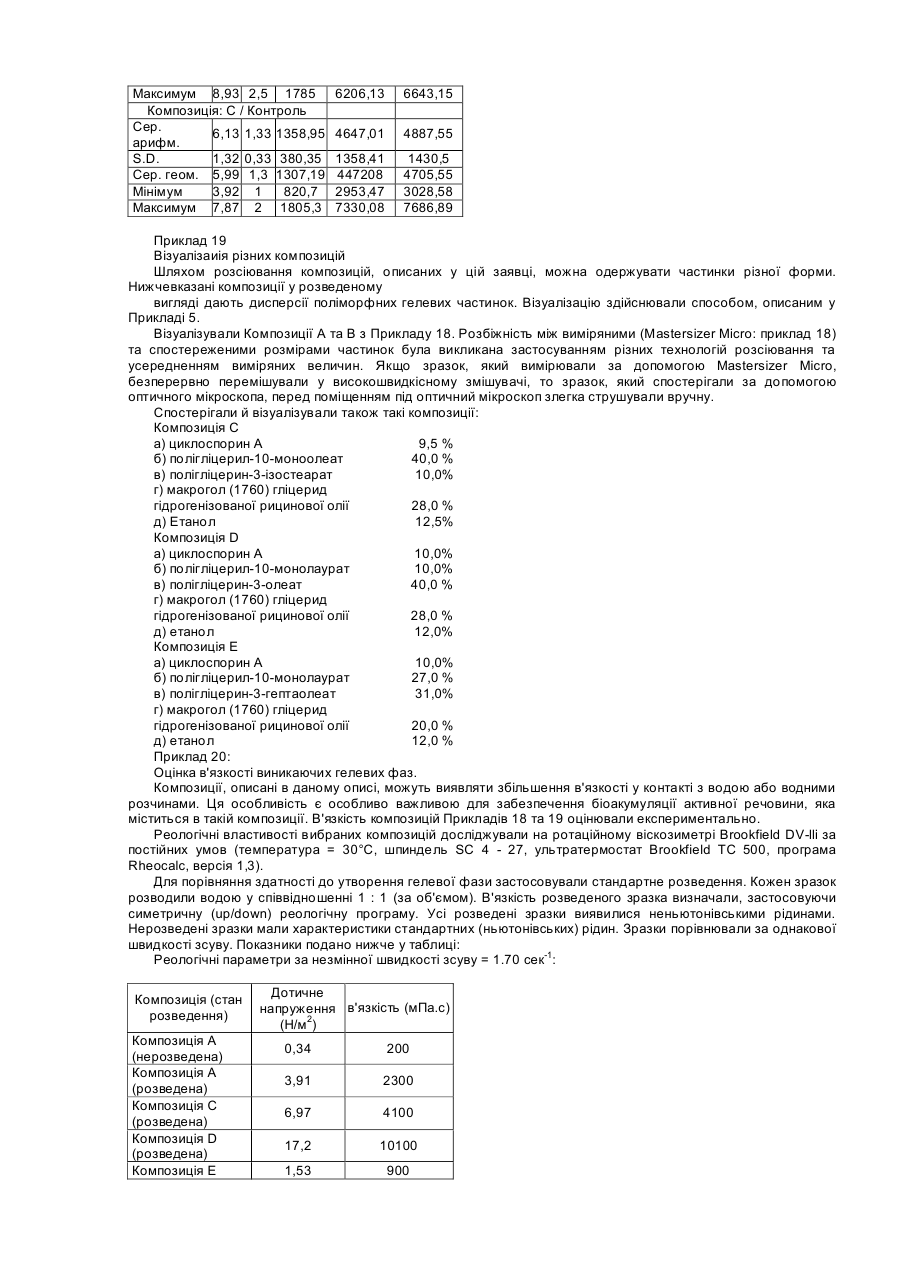
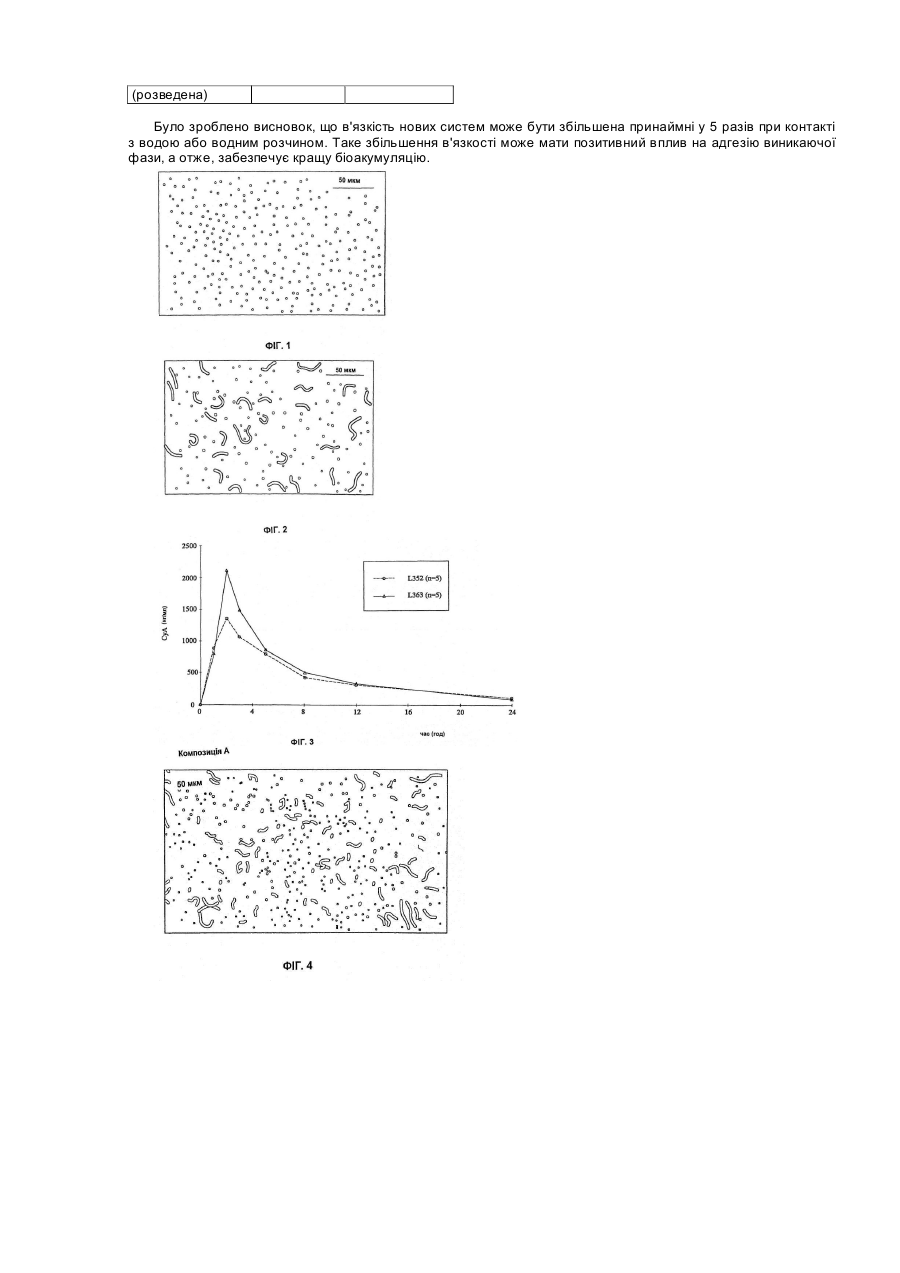
Цей винахід стосується фармацевтичних композицій, які включають, як активний інгредієнт, речовини, погано розчинні у воді, наприклад, терапевтично активні циклоспорини, таксоїди та таксани. Циклоспорини являють собою групу моноциклічних, полі-N-метильованих ундекапептидів, які в природі виробляються як вторинні метаболіти певними волокнистими грибками, зокрема, видів Tolypocladium та Cylindrocarpon. Деякі терапевтично корисні циклоспорини можуть бути одержані шляхом часткового синтезу або спеціальної ферментації. CICLOSPORIN (Циклоспорин А) є першою природною речовиною, що має селективний імунопригнічувальний вплив на лімфоїдні клітини, зокрема, Т-лімфоцити. Він також значною мірою впливає на функції інших клітини імунної системи. Системно введений циклоспорин має терапевтичне застосування у трансплантації органів або трансплантації кісткового мозку. Циклоспорин може застосовуватися для лікування від різних аутоімунних хвороб із запальною етіологією, а також як протипаразитичний агент. Деякі циклоспорини без імунопригнічувальної дії виявляють інгібуючий вплив на реплікацію вірусу ВІЛ-1 і можуть бути застосовані у терапії для лікування та профілактики СНІДу або пов'язаного зі СНІДом комплексу. Група циклоспоринів також включає хемомодулятори, які застосовують для впливу на перехресну резистентність клітин пухлин до цитостатика. На біоакумуляцію циклоспорину впливають, з одного боку, конкретні властивості цієї групи речовин, а також склад та властивості конкретної дозованої форми. Важливу роль у складанні терапевтичних композицій, які містять циклоспорин, відіграє їх висока ліпофільність. Розчинність цих активних речовин у воді, як правило, не перевищує 25мкг/мл, що є показником, приблизно у 100 разів нижчим, ніж потрібно для належної абсорбції організмом. Про помітну ліпофільність циклоспорину свідчать значення його коефіцієнта розподілу Ρ у системі п-октанол/вода. Для циклоспорину значення log P становлять від 2,08 до 2,99. Для досягнення прийнятної біоакумуляції циклоспоринових композицій, які застосовують на практиці для утворення дисперсійних систем і які характеризуються присутністю гідрофільної фази, гідрофобної фази та тензоактивного компонента. Одержані в результаті дисперсії є або класичними емульсіями, або оптично прозорими мікроемульсіями. Композиції серійного виробництва для перорального введення відомі під торговими назвами Sandimunn®, Sandimunn®-Neoral, Consupren®, Implanta®, Imusporin®, як описано у GB-A2015339, GB-A-2222770, GB-A-2270842 та GB-A-2278780. Модифікації попередніх систем, у яких гідрофільну основу заміщено частковими естерами жирних кислот з поліолами на зразок пропіленгліколю, гліцерину або сорбіту, описано у GB-A-2228198. У DE-A-4322826, як систему-носій для слабкорозчинних у воді ліків, описано композицію, яка містить полігліцерилові естери жирних кислот як котензиди для неіонних тензидів, що мають HLB вище за 10, у присутності триацилгліцерину як ліпофільного компонента. Композиції, які містять циклоспорини у носії, що включає пропіленгліколь, змішаний моно-, ди- та тригліцерид і гідрофільний тензид, описані у GB-A-2248615, є типовими мікроемульсійними попередніми концентратами типу "олія у воді". Згідно з біофармацевтичною класифікацією, циклоспорини належать до класу IV, тобто до речовин з поганою розчинністю у воді та слабкою біоакумуляцією (G L Amidon, Biopharmaceutics Drug Classification and International Drug Regulation, Capsgel Library, Bornem 1996, ρ 15-30). Таксоїди є групою природних речовин, які виділяють із деяких штамів Taxus. Таксоїди виявляють протипухлинну дію, впливаючи на клітинний мітоз. Вони є дитерпенними речовинами, які містять таксанове циклічне угруповання з 4-членним окситановим кільцем та естерним боковим ланцюгом у позиції СізПриродний паклітаксель та його напівсинтетичну похідну доцетаксель застосовують для лікування від пухлин. Таксани є ще менше розчинними у воді, ніж циклоспорини. Відразу після одержання розчинність паклітакселю у воді становить приблизно 5мкг/мл, однак утворені гідрати паклітакселю мають рівноважну концентрацію, нижчу на порядок величини (0,3 - 0,6мкг/мл). Композиції на основі полігліцеринових ацилестерів відомі з патентної літератури, наприклад, WO98/05309. Описано фармацевтичні композиції для внутрішнього застосування, що містять циклоспорин як активний інгредієнт та носій, який складається з одного або кількох часткових естерів жирних кислот з гліцеринами від ди- до декагліцерину та часткових ацилестерів з гліцеринами від пентагліцерину до пентадекагліцерину. Композиції, одержані таким способом, дозволяють спеціалістам одержувати дисперсію емульсійного типу з середнім розмір частинок приблизно 1-2 мкм після розведення. Частинки мають сферичну форму, як показано на Фігурі 1. Однак досягнення високої біоакумуляції залишається нерозв'язаною проблемою. Так само, у WO97/26003 описано застосування полігліцеринових ацилестерів. Крім вищезгаданих полігліцеринових естерів, носій містить гліцеринові моноацилестер та, необов'язково, речовини вибрані зпоміж похідних ангідрогексодиметилу та/або поліетиленгліцеринів. Композиція також може містити інші речовини, які поліпшують стабільність носія та ліпоамінокислот, які є придатними, зокрема, для місцевих продуктів. Ці композиції забезпечують слабкодисперсійні системи, що містять сферичні частинки. Інші системи, в яких застосовують полігліцеринові естери з жирними кислотами, є мікроемульсіями. У ЕРА-670715 або ЕР-А-334777 описано застосування естерів жирних кислот з полігліцеринами для фармацевтичних або косметичних мікроемульсій або композицій, що утворюють мікроемульсії. Як визначено, наприклад, у роботі Lachman et al.; Theory and Practice of Industrial Pharmacy, Lea & Febiger, Philadelphia 1970, p. 463, мікроемульсія є прозорою дисперсією олії у воді або води в олії, що має розмір диспергованих частинок у межах 100 - 600 А. Дисперговані частинки в мікроемульсії складаються з нанокраплин або сукупності міцел диспергованої фази у середовищі дисперсії. Форма диспергованих частинок є здебільшого сферичною. Так само, у CZ-A-283516 описано застосування полігліцеринових ацилестерів як одного з компонентів носія, який утворює ліотропні рідкі кристали у контакті з водною фазою. Згідно з цим описом та іншими патентами (наприклад, ЕР-А-314689 або ЕР-А-126751), лише фармацевтичні композиції на основі систем, що забезпечують ліотропні рідкі кристали, є придатними й оптимальними для композицій біологічно активних речовин, які розчиняються у даній системі і/або мають гідрофобний характер. Водночас здатність до утворення рідкокристалічної фази in vivo після введення у шлунково-кишковий тракт пов'язана з високою біоакумуляцією гідрофобних фармацевтичних композицій. Згідно зі статтею Cyclosporine Modified Capsules для USP 23, опублікованої в часописі Pharmaceopeial Forum, том 24, номер 3, 1998 р., стор. 6155, висока біоакумуляція циклоспорину викликається дисперсією фармацевтичної композиції у формі попереднього концентрату після введення мікроемульсії у шлунковокишковий тракт. У статті рекомендується перевіряти, чи забезпечує дисперсія, яка утворюється після розведення такої композиції, середній розмір частинок 50 нм у диспергованій фазі. Ці тема обговорюється в кількох патентах, у яких, однак, не описано застосування полігліцеринових естерів вищих жирних кислот. Згідно з першим аспектом даного винаходу, спосіб підвищення в'язкості фармацевтичної композиції для перорального або місцевого введення включає етапи комбінування: а) ефективної кількості одного або кількох гідрофобних активних інгредієнтів; б) від 5 до 50% однієї або кількох сполук, вибраних з-поміж полігліцеринових естерів жирних кислот формули (1) CH2OR-CHOR-CH2O-[CH2CHOR-CH2O-]NCH2CHOR-CH2OR (1) де n є цілим числом від 4 до 13, і R є Η або CO.R1, де R' є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і принаймні одна група R не є воднем; в) від 5 до 50% однієї або кількох сполук, вибраних з-поміж полігліцеринових естерів жирних кислот та/або ненасичених жирних кислот формули (2) и CH2OR-CHOR-CH2O-[CH2CHOR-CH2O]NCH2-CHOR-CH2OR (2) де n є цілим числом від 0 до 10, і R = Η або CO.R", де R" є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і при цьому принаймні одна група R не є воднем; г) від 5 до 50% однієї або кількох сполук, вибраних з-поміж тригліцеридмакроголгліцеринових естерів, часткових гліцеридів або жирних кислот або макроголестерів жирних кислот, у яких середня кількість прореагованого етиленоксиду в синтезі цих речовини становить від 50 до 150 моль, і одночасно співвідношення між компонентами б) та г) становить від 0,1:1 до 10:1; де вищезгаданий відсоток може сягати 100%; і після розведення водою 1:1 за об'ємом в'язкість композиції збільшується принаймні у 5 разів порівняно з нерозведеною композицією. В оптимальних композиціях застосовано мінімальну кількість інертних наповнювачів. В результаті це забезпечує економію коштів на виробництво і спрощує регулювання. Перевагу віддають одній сполуці з кожної з груп від б) до д). Згідно з другим аспектом даного винаходу, пропонується фармацевтична композиція для перорального або місцевого введення, яка включає а) ефективну кількість однієї або кількох гідрофобних активних інгредієнтів; б) від 5 до 50% однієї або кількох сполук, вибраних з-поміж полігліцеринових естерів жирних кислот формули (1) CH2OR-CHOR-CH2О-[CH2CHOR-CH2O-]NCH2-CHOR-CH2OR (1) де n є цілим числом від 4 до 13, і R є Η або CO.R', де R1 є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і принаймні одна група R не є воднем; в) від 5 до 50% однієї або кількох сполук, вибраних з-поміж полігліцеринових естерів жирних кислот та/або ненасичених жирних кислот формули (2). CH2OR-CHOR-CH2O-[CH2CHOR-CH2O]NCH2-CHOR-CH2OR (2) де n є цілим числом від 0 до 10, і R = Η або CO.R", де R" є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і при цьому принаймні одна група R не є воднем; г) від 5 до 50% однієї або кількох сполук, вибраних з-поміж тригліцеридмакроголгліцеринових естерів, часткових гліцеридів або жирних кислот або макроголестерів жирних кислот, у яких середня кількість прореагованого етиленоксиду у синтезі цих речовини становить від 50 до 150 моль, і одночасно співвідношення між компонентами б) та г) становить від 0,1:1 до 10:1; де вищезгаданий відсоток може сягати 100%; і після розведення водою 1:1 за об'ємом в'язкість композиції збільшується принаймні у 5 разів порівняно з нерозведеною композицією. Винахід також пропонує застосування композиції згідно з другим аспектом цього винаходу для одержання дозованої форми для введення речовини класу IV. Несподівано було виявлено, що висока біоакумуляція циклоепоринів та таксанів після перорального введення може бути досягнута через застосування системи, в основі якої не лежать ні рідкі кристали, ані мікроемульсія. Було також виявлено, що система, одержана згідно з даним винаходом, в результаті не дає дисперсії емульсійного типу. Несподівано було виявлено, що частинки, утворені спонтанно або майже спонтанно при змішуванні фаз, мають несферичну форму. Водночас не було виявлено ніяких ознак анізотропних угруповань молекул, навіть коли утворені частинки виявляли значне збільшення в'язкості. Ці спостереження дозволяють твердити, що це дисперсія у воді з частинками, які мають гелеподібні властивості. У даному описі під частинками гелеподібного характеру слід розуміти частинки, стійка форма або структура яких у дисперсії є несферичною. Несферичними частинками є частинки, які мають принаймні два різні розміри по перпендикулярних напрямках. У даному описі під гелевою емульсією (GEM) слід розуміти дисперсію частинок гелевого характеру у водній фазі. Під попереднім концентратом гелевої емульсії (PRO-GEM) слід розуміти композицію, яка в результаті дає гелеву емульсію після розведення або у контакті з водною фазою. Утворення гелевих частинок викликається взаємодією між гідрофільним гелеутворювачем (агентом, який викликає утворення гелю) та ліпофільною гелеутворювальною фазою. Така композиція може містити компоненти, які беруть участь в утворенні макрочастинкової гелевої структури і які сприяють спонтанній дисперсії у водному середовищі. Вона також може містити компоненти, які забезпечують окиснювапьну або мікробну стабільність, приховують смак, коректують зовнішній вигляд або сприяють розчиненню активних інгредієнтів у суміші. Композиція також може містити компоненти, які регулюють в'язкість. Фармацевтичні композиції згідно з даним винаходом застосовують для формулювання активних речовин класу IV згідно з біофармацевтичною класифікацією. Вигідним також є застосування речовин класу II та III. Згідно з третім аспектом даного винаходу, фармацевтична композиція для перорального або місцевого введення включає а) від 0,1 до 30,0% одного або кількох гідрофобних активних інгредієнтів; б) від 0,1 до 60,0% одного або кількох гелеутворювачів, вибраних із групи, яка складається з: естерів з жирними кислотами полігліцерину; в) від 0,1 до 60,0% однієї або кількох гелеутворювальних речовин, вибраних із групи, яка складається з: естерів полігліцерину з жирними кислотами та/або ненасичених жирних спиртів; г) від 1,0 до 60% однієї або кількох співгелеутворювачів вибраних із групи, яка складається з: макроголгліцеринестерів жирних кислот, макроголгліцеринестерів рослинних олій, макроголестерів жирних кислот, моно-та димакроголестерів моно-, ді- та триацилгліцеринів. д) від 5,0 до 30% одного або кількох С2-С4 спиртів; де вищезгаданий відсоток може сягати 100%; і після розведення водою композиція утворює дисперсію поліморфних гелевих частинок, що мають розмір від 0,2 до 500 мкм. Відсотки та кількість, вказані у даному описі, подано за масою, якщо спеціально не вказано іншого. В оптимальних композиціях співвідношення а : в та/або а : д становить від 0,001 : 1 до 10: 1. На відміну від вищезгаданих, частинки в рідинно-рідинних емульсіях мають здебільшого сферичну форму. Серед частинок даного винаходу значну частку, наприклад, більше половини, можуть складати частинки несферичної, наприклад, еліпсоїдної, стрижнеподібної або ниткоподібної форми. В оптимальному варіанті більше половини частинок за масою складають видовжені частинки, які мають довжину, яка більше, ніж удвічі перевищує їхню ширину або діаметр. Композиції цього винаходу можуть мати гранулометричний склад частинок із середнім розміром у межах від 1 до 100 мкм, в оптимальному варіанті — від 5 до 20 мкм. Композиції можуть містити окремі частинки розміром до 10 мкм або більше, наприклад, від 20 до 50 мкм. Композиції даного винаходу можуть бути одержані шляхом змішування, наприклад, шляхом перемішування вручну або збовтування in vitro. Рідкі композиції змішують з водою, молоком або іншим напоєм перед введенням. Перемішування на більшій швидкості є менш зручним, але воно може бути застосоване, зокрема, для забезпечення, у разі необхідності, меншого розміру частинок, наприклад, приблизно 200 нм. Дозовані форми, які включають попередній концентрат гелевої емульсії, наприклад, у капсулах, змішуються з водною фазою у шлунково-кишковому тракті. У шлунково-кишковому тракті діє достатнє зсувне зусилля для утворення поліморфних частинок даного винаходу. Фармацевтичні композиції згідно з даним винаходом можуть характеризуватися тим, що після розведення шляхом змішування з водною фазою у співвідношенні від приблизно 1 : 5 (композиція : водна фаза) до приблизно 1:100 одержують дисперсію частинок гелю у воді з середнім розміром частинок 0,2 - 500 мкм. Таку дисперсію можна назвати гелевою цим винаходом, вибирають з-поміж диклофенаку, ібупрофену, ніфедипіну, триамцинолону, токоферолу і т. ін. Згідно з даним винаходом, композиції можуть містити 30% активного інгредієнта. Компонент б), який може розглядатися як гелеутворювач, вибирають з-поміж полігліцеринових естерів жирних кислот загальної формули (І) CH2OR-CHOR-CH2O-[CH2CHOR-CH2O-]nCH2-CHOR-CH2OR (1) де n є цілим числом від 4-13, і R = Η або CO.R1, де R1 є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і принаймні одна група R не є воднем. Оптимальні компоненти б) є полігліцериновими естерами та частковими естерами середньо- або довголанцюгових жирних кислот. Вони в оптимальному варіанті мають значення HLB не менше 10. Полігліцеринові естери з жирними кислотами як правило, одержують шляхом часткової або повної естерифікації полігліцеринів відповідними жирними кислотами або транс-естерифікації рослинних олій полігліцерином. Кожен полігліцериновий моноестер може характеризуватися числом омилення. Рівень полімеризації найкраще визначається гідроксильним числом. Полігліцеринові естери зі значенням HLB, більшим, ніж приблизно 10, можуть вважатися гідрофільними. Полігліцеринові естери зі значенням HLB, меншим, ніж приблизно 9, можуть вважатися ліпофільними. До речовин, придатних для компонентів б), належать такі: Назва (INCI) Полігліцерин-6-монолаурат 6 14,5 Полігліцерил-10монолаурат 10 15,5 Полігл іцерил-10мономіристат 10 14,0 Полігліцерил-1010 12,0 моностеарат Полігліцерил-10-моно10 11,0 діолеат Полігліцерил-1010 10,0 діізостеарат Полігліцерил-66 11,0 мономіристат Полігліцерил-8-моноолеат 8 11,0 Полігліцерил-10-моноолеат 10 12,0 Вищезгадані полігліцеринові естери отримували від Nikko Chemicals Co під торговою назвою NIKKOL®, Durkee Foods під торговою назвою S ANTONE® та від Th. Goldschmidt під товарним знаком iSOLAN® або Abitec Corp під торговою назвою CAPROL®. Полігліцерилові естери серійного виробництва можуть бути сумішами, що містять переважно зазначений естер або суміш естерів, що мають аналогічні властивості, які визначаються, наприклад, гідроксильним числом. Полігліцеринові естери компонентів б) та в) для застосування у композиціях даного винаходу в оптимальному варіанті відповідають таким вимогам очищення: кислотне число = макс. 6; вміст важких металів = макс. 10 млн-1; вміст води = макс. 2%; вміст натрієвих солей жирних кислот = макс. 2% (як Na стеарат); загальна зольність = макс. 1%. Оптимальні гелеутворювальні сполуки б) вибирають з-поміж полігліцерилових естерів С12-22 насичених, ненасичених або гідроксильованих жирних кислот, які включають міристат, лаурат, олеати, стеарат, лінолеат та лінолат. Особливу перевагу віддають С16-22 кислотам. Найкращими є С16-18, тобто стеарат, олеати, лаурат, лінолеат та лінолат. Можуть бути застосовані суміші. Найкращими є олеатні естери або їх суміші. Зокрема, придатними виявили себе тригліцерилові естери цих кислот, у яких N=1, особливо, для композицій циклоспоринів. Компонент в), який може розглядатись як гелеутворювальна речовина, вибирають з-поміж полігліцеринових естерів жирних кислот та/або ненасичених жирних спиртів і в оптимальному варіанті має загальну формулу (2) CH2OR-CHOR-CH2O-[CH2CHOR-CH2O]NCH2-CHOR-CH2OR (2) де n є цілим числом від 0 до 10, і R = Η або CO.R", де R" є С8-22 насиченим, ненасиченим або гідроксильованим алкілом, і при цьому принаймні одна група R не є воднем. Оптимальними компонентами в) є полігліцеринові естери та часткові естери жирних кислот та/або жирних спиртів. Оптимальні компоненти в) мають значення HLB не більше 9. До речовин, придатних для компонентів в), належать такі: Кількість гліцеринових Назва (INCI) HLB одиниць Полігліцерил-33 6,5 моноолеат Полігліцерил-66 8,5 діолеат Полігл іцерил-1010 6,2 тетраолеат Полігліцерил-1010 3,5 декаолеат Полігліцерил-22 5,0 моностеарат Полігліцерил-1010 3,5 пентастеарат Вищезгадані полігліцеринові естери отримували від Nikko Chemicals Co під назвою NIKKOL®; або Abitec Corp під торговою назвою CAPROL®. Оптимальні компоненти в) включають гелеутворювальні речовини, вибрані з-поміж полігліцеринових естерів жирних кислот та/або ненасичених жирних спиртів згідно з даним винаходом є речовиною, вибраною, зокрема, з-поміж С8-22 ненасичених жирних спиртів. В оптимальному варіанті застосовують олеїловий спирт (9-октадецен-1-ол), який відповідає, наприклад, таким вимогам очищення: Мr = 268,49; коефіцієнт заломлення = 1,458 -1,460; кислотне число < 1; гідроксильне число = 205-215; йодне число = 85-95. Оптимальні гелеутворювальні компоненти в) вибирають з-поміж полігліцерилових естерів С8-22 насичених, ненасичених або гідроксильованих жирних кислот, які включають міристат, лаурат, олеати, стеарат, лінолеат та лінолат. Перевагу віддають Свив кислотам, ще більшу перевагу віддають С8-16 кислотам, включаючи лаурат, олеати та міристат. Можуть бути застосовані суміші. Найбільшу перевагу віддають олеатові. Полігліцерил-10-естери цих кислот, де N = 8, виявили себе найбільш придатними, зокрема для композицій циклоспоринів. Компонент г), який може розглядатися як співгелеутворювач, вибирають з-поміж: макроголгліцеринових естерів жирних кислот. До них належать естери С8-22 насичених або ненасичених жирних кислот з макроголгліцеринами. Особливу перевагу віддають макроголгліцеринам з рослинними оліями наприклад, рициновою олією, як гідрогенізованою, так і негідрогенізованою, мигдалевою або кукурудзяною олією. їх, як правило, одержують шляхом реакції різних кількостей етиленоксиду та відповідного типу олії за відомих умов. Особливу перевагу віддають представленим нижче речовинам, які характеризуються кількістю моль прореагованого етиленоксиду (1+m + n + x + y+z) та значенням HLB. (1+m+n+x+y+z) HLB макрогол(1540) гліцерид 35 12-14 рицинової олії макрогол(1760) гліцерид 40 12,5-16 гідрогенізованої рицинової олії макрогол(2200) гліцерид гідрогенізованої рицинової 50 13,5 олії макрогол(2640) гліцерид 60 14,5 гідрогенізованої рицинової олії макрогол(3520) гліцерид 80 15 гідрогенізованої рицинової олії макрогол(4400) гліцерид гідрогенізованої рицинової 100 16,5 олії макрогол(2640) гліцерид 60 15 мигдалевої олії макрогол(2640) гліцерид 60 15 кукурудзяної олії Визначальними фізичними та хімічними параметрами вищезгаданих речовин є: кислотне число < 2; гідроксильне число = 40 - 60; йодне число < 1*; число омилення = 40 - 70; вміст води < 3%; (*- для макрогол(1540) гліцериду рицинової олії = 28 - 32). Ці речовини серійно виробляються, наприклад, під торговими назвами Cremophor®, Nikkol®, Simulsol®, Mapeg®, Crovol®. Придатними також є змішані моно- та димакроголестери моно-, ді- та триацилгліцерину, які серійно виробляються під торговою назвою Gelucire®. Найкращі продукти продаються під назвою Gelucire® 50/13 та 44/14. Оптимальними фізико-хімічними властивостями є: кислотне число ≤ 2,00; число омилення = 65 - 95; йодне число < 2; гідроксильне число = 36 - 56; пероксидне число < 6; лужні включення < 80 млн-1 ; вільний гліцерин < 3,00%. Альтернативними оптимальними для застосування як сполука г) композиціями є макроголестери жирних кислот наприклад, макрогол(660)-12-гідроксистеарат серійного виробництва під торговою назвою Solutol® HS 15, які мають кислотне число < 1; вміст води < 0,5%; число омилення = 53-63 та гідроксильне число = 90 -110. Компонент г) зазвичай є присутнім у композиціях у кількості 1 - 60 %, в оптимальному варіанті — у межах від 5 до 50 %, краще — 15 - 50%, і найкраще —15-40%. Компонент д) вибирають з-поміж С2-С4 алканолів, в оптимальному варіанті це етиловий спирт фармацевтичної якості. Альтернативними алканолами є ізомери пропенолу та бутеролу. Можуть бути застосовані суміші. Для місцевого введення оптимальними є пропан-2-ол або 2-метил-1-пропанол. Іншими інертними наповнювачами, які застосовують у композиціях даного винаходу, є такі, що впливають на фізико-хімічну та мікробну стабільність (наприклад, антиоксиданти, протимікробні додатки, такі, як токоферол, метилпарабен), органолептичні властивості (наприклад, регулятори смаку на основі природних або ідентичних природних ароматів) або фізичні властивості, які можуть обмежувати обробку (наприклад, в'язкість або точка плавлення). До цих речовин можуть належати такі: вода або інші фармацевтично прийнятні розчинники, гідрофільні колоїди, наприклад, вибрані з-поміж похідних целюлози, хітозанів, альгінату, полікарбофілу і т. ін. Композиції на основі гелевого попереднього концентрату можуть характеризуватися тим, що вони диспергуються на частинки гелевого характеру, здебільшого неправильної форми, після внесення у водне середовище. Висока біоакумуляція таких композицій пов'язана з біоадгезією. В результаті своєї амфілічності ці частинки є менш схильними до коалесценції і можуть бути гомогенно дисперговані у водному середовищі. У контакті з ліпофільною поверхнею вони залишаються на поверхні і таким чином забезпечують градієнт концентрації, достатній для проникнення ліків крізь мембрану завдяки їх в'язкості та клейкості. Винахід також описано за допомогою прикладів, які ніяким чином не обмежують його, і з посиланням на супровідні фігури, серед яких: Фігура 1 є фотомікрографією дисперсії згідно з WO98705309; Фігура 2 є фотомікрографією дисперсії згідно з даним винаходом; Фігура 3 є графіком, на якому показано рівень циклоспорину в крові у Прикладі 6; і Фігури з 4 по 8 є фотомікрографіями інших дисперсій згідно з цим винаходом. Приклад 1 Циклоспоринвмісний розчин для перорального або місцевого введення: Використовували такі інгредієнти. а) циклоспорин А 3600 г б) полігліцерин-10-моно-діолеат 7200 г в) олеїловий спирт 7200 г г) макрогол(1760) гліцерид гідрогенізованої рицинової олії 14400 г Д) Етанол 4000 г Е) D-a-токоферол 180 г Композицію а) змішували з композиціями д) та в). Усю суміш після цього гомогенізували до розчинення активного інгредієнта. Потім додавали композиції б) та г) та будь-які інші допоміжні інгредієнти. Після повної гомогенізації одержаний в результаті розчин фільтрували крізь гідрофобну мембрану GVHP (Millipore) з розміром пор 0,2 - 5,0 мкм у газонепроникну посудину в інертній атмосфері. Якщо вимагалося для застосування, фільтрований розчин в інертній атмосфері розфасовували по 50 мл флаконах, оснащених газонепроникними пробками. Приклад 2 Тверді желатинові капсули розміру "Elongated 0" Використовували такі інгредієнти. а) циклоспорин А 50,0 мг Б) полігліцерил-10-моноолеат 100,0 мг в) полігліцерил-3-моноолеат 15,0 мг г) макрогол(2640) гліцерид гідрогенізованої рицинової олії 140,0 мг Д) етанол 80,0 мг Наповнювач для твердих желатинові капсули одержували, застосовуючи робочу процедуру, ідентичну описаній у Прикладі 1, і заповнювали ним тверді желатинові капсули розміру ΈΟ". Приклад 3 Циклоспоринвмісний розчин для перорального введення Використовували такі інгредієнти. а) Циклоспорин 5,00 г Б) Полі гліцерин(10) олеат 9,50 г в) Полі гліцерил(3) олеат 15,50 г РОЕ(40) гідрогенізована рицинова олія (макрогол(1760) гліцерид гідрогенізованої рицинової олії) 14,00 г абсолютний етанол 6,00 г Компоненти змішували й гомогенізували до розчинення активного інгредієнта, після чого здійснювали фільтрацію та фасування по 50 мл флаконах, як описано у Прикладі 1, для одержання розчину перорального призначення з дозою 100 мг/мл. Приклад 4 М'які желатинові капсули Використовували такі інгредієнти. Склад наповнювача: а) циклоспорин 100,00 мг б) полігліцерин(10) олеати 210,00 мг в) полігліцерин(3) олеати 350,00 мг г) РОЕ(40) гідрогенізована рицинова 315,00 мг олія д) етанол 135,00 мг Наповнювач для м'яких желатинових капсул одержували, застосовуючи процедуру, подібну до описаної у Прикладі 1. Желатинові капсули одержували шляхом змішування очищеної води, гліцерину, сорбіту та желатину. Гомогенізацію розчину, додавання барвників та виробництво капсул з дозою 100 мг здійснювали традиційним способом. Приклад 5 М'які желатинові капсули розміру Oblong 20: Використовували такі інгредієнти. а) циклоспорин А 100,0 мг б) полігліцерил-6-монолаурат 120,0 мг в) полігліцерил-10-тетраолеат 410,0 мг г) Gelucire 50/13 300,0 мг д) етанол 170,0 мг Наповнювач для м'яких желатинових капсул одержували, застосовуючи процедуру, подібну до описаної у Прикладі 1. Наповнювач фільтрували у 20-літрову посудину з нержавіючої сталі, оснащену газонепроникною кришкою. Наповнювач між фільтрацією та інкапсулюванням тримали в інертній атмосфері. Інкапсулювання здійснювали з застосуванням традиційної процедури у желатинову суміш стандартного типу. Приклад 6 Тверді НРМС капсули (Shionogi Oualicaps) розміру 3: Використовували такі інгредієнти. а) циклоспорин А 25,0 мг б) полігліцерил-10-міристат 50,0 мг в) полігліцерил-10-пентастеарат 70,0 мг г) макрогол(2640) гліцерид 75,0 мг мигдалевої олії д) етанол 30,0 мг Композицію а) змішували з композиціями д) та б). Суміш нагрівали до 40-50°С і гомогенізували до розчинення композиції а). Потім додавали композицію г). І нарешті, додавали композицію в). Суміш безперервно перемішували. Температура суміші під час приготування не перевищувала 60°С. Після повного розчинення та гомогенізації всіх інгредієнтів продукт фільтрують крізь попередній фільтр і наповнюють ним тверді целюлозні капсули (наприклад, від Syntapharm) розміру 3. Приклад 7 Візуалізаиія гелевої емульсії Кожен з попередніх концентратів згідно з патентною заявкою WO98/05309, Приклад 1, і описані у Прикладі 1 цього винаходу розводили водою у співвідношенні 1 : 20 (продукт:вода) і диспергували на лабораторному струшувачі (ІКА HS - В20) протягом 10 хвилин при температурі 25±1°С. Знімки диспергованих зразків було зроблено за допомогою камери COHU, під'єднаної до оптичного мікроскопа. Знімки аналізували за допомогою програми ШСІА™ (Laboratory Imaging Inc). Фотомікрографію дисперсії емульсійного типу згідно з WO98/05309 показано на Фігурі 1. Фотомікрографію дисперсії типу гелевої емульсії, одержаної з попереднього концентрату згідно з Приклад 1 даного винаходу, представлено на Фігурі 2. Приклад 8 Перевірка біоакумуляції лікарських продуктів на основі попереднього концентрат у гелевої емульсії Композицію згідно з Приклад 1 порівнювали з розчином перорального призначення мікроемульсійного продукту серійного виробництва Neoral®. Композиції згідно з Прикладом 1 було присвоєно клінічний код L363, розчин перорального призначення Neoral® випробували під кодом L352. Фармакокінетику порівнювали після введення однієї дози 100 мг циклоспорину п'ятьом собакам породи бігль у двофазному експерименті. Псам віком 12 - 36 місяців і масою 9 -15 кг давали стандартний раціон у формі гранул у кількості 300 г на день з водою у необмеженій кількості. Продукт вводили після 18-годинного голодування. Зразки крові забирали з антебрахіальної вени з інтервалами 0, 1, 2, 3, 5, 8,12 та 24 годин. Зразки крові стабілізували, застосовуючи комплексон, і зберігали у холодильнику до здійснення неспецифічного радіоімунного аналізу. Порівняння середніх показників біоакумуляції, представлених середніми показниками концентрації циклоспорину А в крові показано на Фігурі 3. З порівняння стає зрозуміло, що біоакумуляція продуктів на основі попереднього концентрату гелевої емульсії, які утворювали дисперсію несферичних частинок середнього розміру 0,2 - 500 лиш після розведення водою, була порівнюваною або вищою за біоакумуляцію продуктів, які утворюють мікроемульсію з середнім розміром частинок приблизно 100 нм. Приклад 9 Наповнювач для м'яких желатинових капсул, що містить паклітаксель: Використовували такі інгредієнти. а) Паклітаксель 78,75 мг б) Полігліцерил-10-моно-діолеат 205,00 мг в) Полі гліцерил-3-моноолеат 129,50 мг в) олеїловий спирт 205,00 мг г) макрогол(1760) гліцерид гідрогенізованої рицинової олії 302,00 мг д) Етанол 129,50 мг Приклад 10 Композиція м'яких желатинових капсул Використовували такі інгредієнти. а) Паклітаксель 78,75 мг а) [3'кетоМВтЇ]1-[\/аІ]2-циклоспорин 52,50 мг б) Полі гліцерил-10-моно-діолеат 187,50 мг в) олеїловий спирт 187,50 мг в) Полі гліцерил-3-моноолеат 112,50 мг макрогол(1760) гліцерид г) гідрогенізованої рицинової олії 302,00 мг д) Етанол 129,50 мг Приклад 11 Наповнювач для м'яких желатинових капсул, шо містить ніфедипін Використовували такі інгредієнти. а) Ніфедипін 20,00 мг б) Полі гліцерил-10-моно-діолеат 205,00 мг в) Полі гліцерил-3-моноолеат 129,50 мг в) олеїловий спирт 205,00 мг г) макрогол(1760) гліцерид 302,00 мг гідрогенізованої рицинової олії д) Етанол 129,50 мг Приклади 12-17 У Таблиці 1 подано інші приклади композицій, які ілюструють винахід. Спосіб одержання був ідентичним способові з Прикладу 1. Приклад №/Компонент 10 11 12 13 14 15 16 17 А В С1 С2 D Ε 10,0 10,0 10,0 0,1 10,0 10,0 0,1 30,0 19,0 23,0 13,0 5,0 37,0 1,0 21,1 10,0 19,0 19,0 19,0 19,9 19,0 19,0 — 15,0 12,0 15,0 8,0 15,0 12,0 30,0 34,7 6,0 28,0 28,0 28,0 50,0 10,0 28,0 31,1 22,0 12,0 5,0 20,0 10,0 12,0 12,0 13,0 17/0 У Прикладах 10-17 використовували таку сировину: А - циклоспорин А В -полігліцерил-10-моно-діолеат (суміш моно-та діолеатів) С1 -олеїловий спирт С2 -полігліцерил-3-моноолеат D - макрогол(1760) гліцерид гідрогенізованої рицинової олії Ε - етанол Приклад 18 Оцінка біоакумуляції та гранулометричного складу частинок У дослідженні біоакумуляції, яке здійснювали на 12 здорових добровольцях, порівнювали біоакумуляцію двох різних композицій у м'яких желатинових капсулах, кожна з яких містила 100 мг циклоспорину (Композиції А-GEM101 та Композиції B-GEM304). Вони утворювали дисперсію у межах 1-150 мкм з капсулами Noreal® по 100 мг (Композиція В). Здійснювали візуальне спостереження за новою системою доставления ліків та точну оцінку гранулометричного складу частинок. На основі візуального спостереження нову систему було визначено як GEM (емульсія на основі гелю). Композиція циклоспорину, що містить наповнювачі капсул: Композиція A -GEM .101: а) циклоспорин А 1020 г б) полігліцерил-10-моноолеат 2040 г в) полігліцерил-3-моноолеат 3380 г г) макрогол (1760) гліцерид гідрогенізованої рицинової олії 3000 г д) етанол 1330 г Композиція В -GEM 304: а) циклоспорин А 1020 г б) полігліцерил-10-моноолеат 2630 г в) полігліцерил-3-моноолеат 1580 г в) олеїловий спирт 1105 г г) макрогол (1760) гліцерид гідрогенізованої рицинової олії 2450 г д) етанол 1300 г Гранулометричний склад частинок Гранулометричний склад частинок нових GEM-композицій визначали, застосовуючи Mastersizer Micro, версія 2,18 (Malvern Instruments Ltd). Гістограми гранулометричного складу частинок Композиції A (GEM101) та Композиції В (304) показали, що ефективний діаметр Композиції А (відпов. В), виведений з гістограми, становив 92,05 мкм (36,23 мкм). План дослідження біоеквівалентності План відкритого рандомізованого 3-періодного перехресного дослідження було розроблено для 12 здорових добровольців-кавказців чоловічої статі віком 18-45 років з масою тіла ±10% від ідеальної маси. Тестові медикаменти та контрольні медикаменти вводили натщесерце у випадковій послідовності як одиничні пероральні дози. Кожна доза містила 200 мг циклоспорину (дві капсули по 100 мг). Тривалість періоду вимивання між введеннями становила щонайменше 7 днів. У кожному періоді дослідження забирали 14 зразків крові перед введенням і через 20,40, 60 хв і через 1,5,2, 2,5, 3,4, 5, 6, 8, 12 та 24 годин після введення. Протягом усього дослідження відстежували побічний вплив. Кров забирали з ліктьової вени у пластмасові пробірки з EDTA (Sarstedt Monovettes). Зразки сильно заморожували (-20°С). Концентрацію циклоспорину в суцільній крові визначали за допомогою специфічного RIA. AUC(0-¥) та Сmах визначали як первинні змінні для оцінки біоакумуляції. Вторинними змінними були AUC(0-¥) , tmax, t1/2. На основі даних концентрації/часу для вихідної сполуки визначали фармакокінетичні параметри для кожного окремого набору даних за допомогою аналізу з застосуванням TopFit 2,0. Сmах та tmax брали безпосередньо на основі спостережених даних концентрації-часу. Сталу коефіцієнта елімінації (kel) розраховували шляхом аналізу логарифмічної регресії найменших квадратів кінцевої частини кривої концентрація у плазмі — час. Площу під кривою концентрація—час (AUCO®t) розраховували до останньої вимірної точки концентрація— час (t) за формулою трапецій. Екстраполяцію до безкінечності (AUCO®t AUCO®¥) виконували шляхом ділення останньої спостереженої концентрації на сталу коефіцієнта елімінації. Зведення фармакокінетичних даних: Т1/2 TmaxСmах [н AUC(0-t) AUC(0-inf) Параметр [год] [год] г/мл] [нг*год/мл] [нг*год/мл] Композиція: А Сер. 6,24 1,33 1372,69 4631,75 4861,85 арифм. S.D. 1,3 0,33 351,28 1204,56 1241,87 Сер. геом. 6,12 1,3 1329,84 4483,35 4712,35 Мінімум 4,06 1 908,1 2635,32 2873,57 Максимум 8,24 2 1930,3 6432,76 6684,33 Композиція: В Сер. 6,41 1,5 1196,49 4430,33 4696,56 арифм. S.D. 1,3 0,48 308,26 1032,91 1143,13 Сер. геом. 6,29 1,43 1161,84 4326,15 4576,94 Мінімум 4,21 1 851,8 3130,66 3254,08 Максимум 8,93 2,5 1785 Композиція: С / Контроль Сер. 6,13 1,33 1358,95 арифм. S.D. 1,32 0,33 380,35 Сер. геом. 5,99 1,3 1307,19 Мінімум 3,92 1 820,7 Максимум 7,87 2 1805,3 6206,13 6643,15 4647,01 4887,55 1358,41 447208 2953,47 7330,08 1430,5 4705,55 3028,58 7686,89 Приклад 19 Візуалізаиія різних композицій Шляхом розсіювання композицій, описаних у цій заявці, можна одержувати частинки різної форми. Нижчевказані композиції у розведеному вигляді дають дисперсії поліморфних гелевих частинок. Візуалізацію здійснювали способом, описаним у Прикладі 5. Візуалізували Композиції А та В з Прикладу 18. Розбіжність між виміряними (Mastersizer Micro: приклад 18) та спостереженими розмірами частинок була викликана застосуванням різних технологій розсіювання та усередненням виміряних величин. Якщо зразок, який вимірювали за допомогою Mastersizer Micro, безперервно перемішували у високошвидкісному змішувачі, то зразок, який спостерігали за допомогою оптичного мікроскопа, перед поміщенням під оптичний мікроскоп злегка струшували вручну. Спостерігали й візуалізували також такі композиції: Композиція С а) циклоспорин А 9,5 % б) полігліцерил-10-моноолеат 40,0 % в) полігліцерин-3-ізостеарат 10,0% г) макрогол (1760) гліцерид гідрогенізованої рицинової олії 28,0 % д) Етанол 12,5% Композиція D а) циклоспорин А 10,0% б) полігліцерил-10-монолаурат 10,0% в) полігліцерин-3-олеат 40,0 % г) макрогол (1760) гліцерид гідрогенізованої рицинової олії 28,0 % д) етанол 12,0% Композиція Ε а) циклоспорин А 10,0% б) полігліцерил-10-монолаурат 27,0 % в) полігліцерин-3-гептаолеат 31,0% г) макрогол (1760) гліцерид гідрогенізованої рицинової олії 20,0 % д) етанол 12,0 % Приклад 20: Оцінка в'язкості виникаючих гелевих фаз. Композиції, описані в даному описі, можуть виявляти збільшення в'язкості у контакті з водою або водними розчинами. Ця особливість є особливо важливою для забезпечення біоакумуляції активної речовини, яка міститься в такій композиції. В'язкість композицій Прикладів 18 та 19 оцінювали експериментально. Реологічні властивості вибраних композицій досліджували на ротаційному віскозиметрі Brookfield DV-lli за постійних умов (температура = 30°С, шпиндель SC 4 - 27, ультратермостат Brookfield ТС 500, програма Rheocalc, версія 1,3). Для порівняння здатності до утворення гелевої фази застосовували стандартне розведення. Кожен зразок розводили водою у співвідношенні 1 : 1 (за об'ємом). В'язкість розведеного зразка визначали, застосовуючи симетричну (up/down) реологічну програму. Усі розведені зразки виявилися неньютонівськими рідинами. Нерозведені зразки мали характеристики стандартних (ньютонівських) рідин. Зразки порівнювали за однакової швидкості зсуву. Показники подано нижче у таблиці: Реологічні параметри за незмінної швидкості зсуву = 1.70 сек-1: Композиція (стан розведення) Композиція А (нерозведена) Композиція А (розведена) Композиція С (розведена) Композиція D (розведена) Композиція Ε Дотичне напруження в'язкість (мПа.с) (Н/м2) 0,34 200 3,91 2300 6,97 4100 17,2 10100 1,53 900 (розведена) Було зроблено висновок, що в'язкість нових систем може бути збільшена принаймні у 5 разів при контакті з водою або водним розчином. Таке збільшення в'язкості може мати позитивний вплив на адгезію виникаючої фази, а отже, забезпечує кращу біоакумуляцію.
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulation for oral or topical administration (variants) and method for its manufacture
Назва патенту російськоюФармацевтическая композиция для перорального или местного применения (варианты) и способ ее получения
Автори російськоюStuchlik, Milan
МПК / Мітки
МПК: A61K 47/14, A61K 31/337, A61K 31/44, A61K 38/13
Мітки: спосіб, місцевого, композиція, варіанти, фармацевтична, одержання, введення, перорального
Код посилання
<a href="https://ua.patents.su/11-72539-farmacevtichna-kompoziciya-dlya-peroralnogo-abo-miscevogo-vvedennya-varianti-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція для перорального або місцевого введення (варіанти) та спосіб її одержання</a>
Попередній патент: Спосіб прокатування-розділяння сортових заготівок
Наступний патент: Електрогідравлічний підсилювач
Випадковий патент: Спосіб автоматичного розпізнавання номера тварини по його коду