Застосування лігандів молекул мнс класу іі як ад’ювантів для вакцинації і lag-3 в лікуванні злоякісних пухлин
Формула / Реферат
1. Застосування ліганду МНС класу II, здатного посилювати антиген-специфічну імунну відповідь, вибраного з групи, що складається з CD4, LAG-3, і похідного CD4 або LAG-3, яке зберігає здатність зв’язуватись з молекулою МНС класу II, з якою зв’язується CD4 або LAG-3 для виробництва лікарського засобу, призначеного для профілактики або лікування патологічних станів, пов'язаних з антигенспецифічною імунною відповіддю.
2. Застосування за п. 1, яке відрізняється тим, що вказана антигенспецифічна імунна відповідь є опосередкованою Т-клітинами імунною відповіддю.
3. Застосування за п. 1 або 2, яке відрізняється тим, що вказане похідне LAG-3, яке зберігає здатність зв’язуватись з молекулою МНС класу II, з якою зв’язується LAG-3, являє собою мутант або розчинний фрагмент LAG-3.
4. Застосування за п. 3, яке відрізняється тим, що розчинний фрагмент LAG-3 вибраний з групи, яка складається з фрагментів D1-D2 і D1-D4 LAG-3.
5. Застосування за п. 3 або 4, яке відрізняється тим, що антигенспецифічна імунна відповідь являє собою опосередковану СD8+ Т-клітинами імунну відповідь.
6. Застосування за п. 1, яке відрізняється тим, що лікарський засіб містить ліганд МНС класу II у формі трансфікованих клітин, що експресують ліганд, або у формі розчинної молекули зазначеного ліганду.
7. Застосування за п. 1 або 2, яке відрізняється тим, що лікарський засіб являє собою вакцину для профілактики патологічного стану або лікування патологічного стану у разі його виникнення.
8. Застосування за будь-яким з пп. 1-7, яке відрізняється тим, що ліганд МНС класу ІІ вводиться в комбінації з антигеном, проти якого формується імунна відповідь.
9. Застосування за п. 8, яке відрізняється тим, що антиген вибраний з групи, яка складається з вірусних, бактеріальних і паразитарних антигенів.
10. Застосування за п. 8, яке відрізняється тим, що антиген являє собою пухлинний антиген.
11. Застосування за п. 7, яке відрізняється тим, що вакцина містить ліганд МНС класу ІІ у вигляді голої плазміди, яка включає послідовність ДНК, що кодує LAG-3 або CD4
12. Застосування за п. 11, яке відрізняється тим, що гола плазміда додатково містить послідовність ДНК, яка кодує антиген, проти якого формується імунна відповідь.
13. Застосування за будь-яким з пп. 1-8, яке відрізняється тим, що патологічний стан являє собою злоякісну пухлину.
14. Застосування за будь-яким з пп. 1-8, яке відрізняється тим, що патологічний стан являє собою інфекційне захворювання.
15. Застосування розчинного фрагменту LAG-3 за п. 4 або 5 для виробництва лікарського засобу, призначеного для протипухлинної імунотерапії або імунотерапії при інфекційних захворюваннях.
16. Фармацевтична композиція, що містить ефективну кількість антигену, здатного індукувати антигенспецифічну імунну відповідь, разом з ефективною кількістю ліганду МНС класу II, здатного посилювати антигенспецифічну імунну відповідь, вибраного з групи, що складається з CD4, LAG-3 і похідного CD4 або LAG-3, яке зберігає здатність зв’язуватись з молекулою МНС класу ІІ, з якою зв’язується CD4 або LAG-3.
17. Фармацевтична композиція за п. 16, яка відрізняється тим, що ліганд МНС класу ІІ являє собою LAG-3 або похідне LAG-3, яке зберігає здатність зв’язуватись з молекулою МНС класу ІІ, з якою зв’язується LAG-3.
Текст
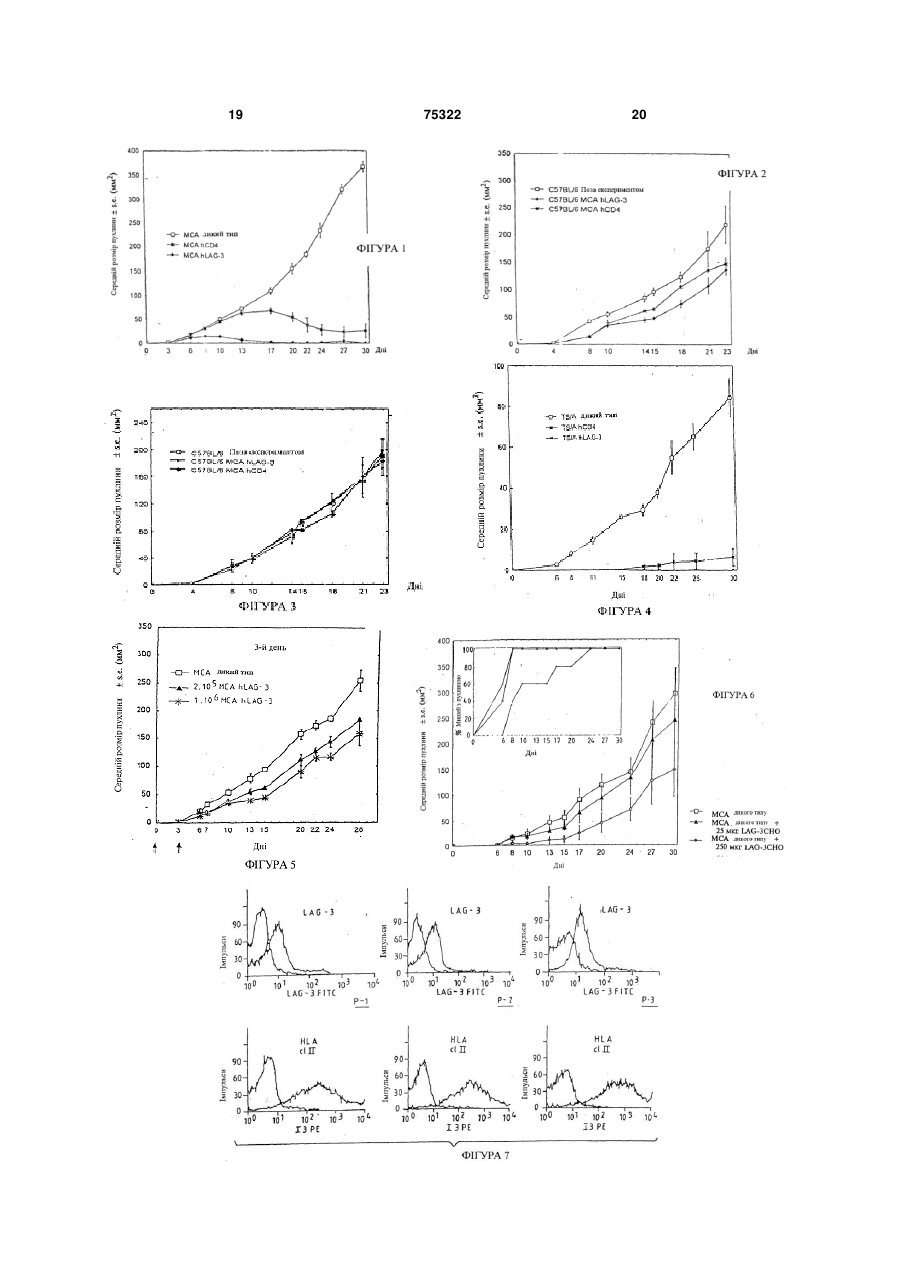
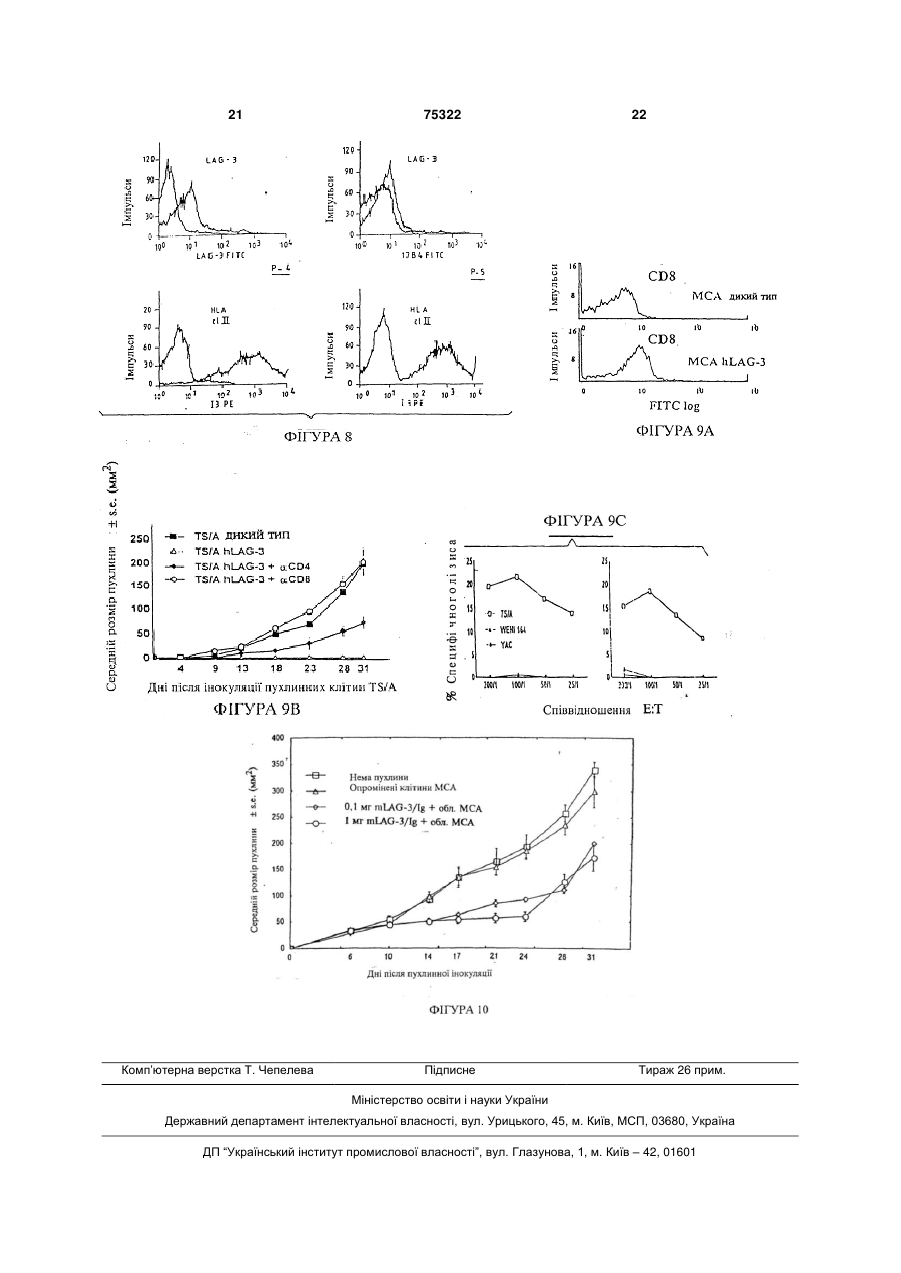
1. Застосування ліганду МНС класу II, здатного посилювати антиген-специфічну імунну відповідь, вибраного з групи, що складається з CD4, LAG-3, і похідного CD4 або LAG-3, яке зберігає здатність зв’язуватись з молекулою МНС класу II, з якою зв’язується CD4 або LAG-3 для виробництва лікарського засобу, призначеного для профілактики або лікування патологічних станів, пов'язаних з антигенспецифічною імунною відповіддю. 2. Застосування за п.1, яке відрізняється тим, що вказана антигенспецифічна імунна відповідь є опосередкованою Т-клітинами імунною відповіддю. 3. Застосування за п.1 або 2, яке відрізняється тим, що вказане похідне LAG-3, яке зберігає здатність зв’язуватись з молекулою МНС класу II, з якою зв’язується LAG-3, являє собою мутант або розчинний фрагмент LAG-3. 4. Застосування за п.3, яке відрізняється тим, що розчинний фрагмент LAG-3 вибраний з групи, яка складається з фрагментів D1-D2 і D1-D4 LAG-3. 5. Застосування за п.3 або 4, яке відрізняється тим, що антигенспецифічна імунна відповідь являє собою опосередковану СD8+ Т-клітинами імунну відповідь. 6. Застосування за п.1, яке відрізняється тим, що лікарський засіб містить ліганд МНС класу II у формі трансфікованих клітин, що експресують ліганд, або у формі розчинної молекули зазначеного ліганду. 2 (19) 1 3 Цей винахід стосується застосування LAG-3 і CD4, а в загальнішому сенсі -лігандів молекул МНС класу II або МНС-ll-подібних лігандів в якості ад'ювантів для вакцин, з метою бустингу антигенспецифічної імунної відповіді, так само як і застосування LAG-3 в якості терапевтичного засобу в імунотерапії злоякісних пухлин. В даний час установлено, що білки, які кодуються ділянкою МНС (головний комплекс гістосумісності) класу II, втягнуті в багато напрямків імунних реакцій, включно взаємодію між різними типами лімфоїдних клітин, таких, як лімфоцити і антиген-презентуючі клітини. Різні дослідження також продемонстрували, що й інші механізми, не пов'язані з участю молекул CD4, беруть участь у прояві ефекторної функції Т-хелперів. Ген активації лімфоцитів-3 (LAG-3), експресований CD-4 і CDS-позитивними активованими Тклітинами людини, так само як і інактивованими клітинами NK, кодує поліпептид, що складається з 503 амінокислот і відноситься до мембранних білків І типу, і має чотири позаклітинних імуноглобуліно-подібних домени (IgSF) [1], що є лігандом молекул МНС класу II [2]. Аналіз цієї амінокислотної послідовності дозволив виявити виразні сегменти ідентичності в порівнянні з амінокислотними послідовностями, які виявляються у відповідних ділянок CD4, хоча загальний рівень гомології амінокислотних послідовностей CD4 і LAG-3 людини практично не перевищує контрольний рівень (приблизно 20%-на ідентичність послідовностей поліпептидів). Також є кілька внутрішніх ділянок гомології послідовностей в молекулі LAG-3 між доменами 1 (D1) i 3 (D3), так само як і між доменами 2 (D2) і 4 (D4): це підтверджує, що LAG-3 еволюціонував так само, як і CD4, шляхом дуплікації відповідних генів, при тому, що предковою була структура з двома доменами IgSF [1]. Крім того, гени LAG-3 і CD4 локалізовані дуже близько один до одного в дистальній частині короткого плеча хромосоми 12 [3]. Таким чином, гени (і білки) LAG-3 і CD4 можуть бути визначені як "двоюрідні брати" в складі суперсімейства імуноглобуліно-подібних білків [2]. Як і CD4, LAG-3 людини має Ig-подібні позаклітинні домени, при тому, що в доменах 2 і 4 є мотиви WxC; однак відмінністю від CD4 є присутність додаткової випетленої послідовності в складі 1-го домену (що розпізнається моноклональним антитілом 17В4) і цитоплазматичного багатого проліном мотиву (Ер-повтори) в складі LAG-3 людини (hLAG-3). Недавно ген активації лімфоцитів-3 миші (mLAG-3) був клонований і було виявлено приблизно 70%-ний рівень гомології з hLAG-3: зокрема, є той самий багатий проліном цитоплазматичний "хвіст". Антиген-специфічна стимуляція СD4позитивних Т-клітинних клонів в присутності моноклонального антитіла проти LAG-3 приводить до посилення клітинної проліферації і виробляння цитокінів [5]. Була підтверджена регуляторна роль hLAG-3 в активації СD4-несучих Т-лімфоцитів за рахунок перехресного зв'язування молекул МНС класу II, експресованих Т-клітинами, з химерними 75322 4 білками LAG-3/Ig [6]. Взаємодія між LAG-3 і молекулами МНС класу II придушує сигнали, передані молекулами МНС класу II, що експресуються СD4позитивними Т-лімфоцитами (ослаблення проліферації клітин і виробляння цитокінів): це підтверджує, що і LAG-3, і МНС класу II є ефекторними молекулами механізму негативної регуляції імунних відповідей, опосередковуваних Т-хелперними лімфоцитами. Для химерного білка hLAG-3/Ig було показано зв'язування чужорідних молекул МНС класу II (миші і мавпи). Крім того, передбачається, що mLAG-3 опосередковує позитивний сигнал в ефекторних клітинах: на це вказує те, що трансгенні миші, які несуть нульову мутацію в гені LAG3, характеризуються порушенням в пулі клітин NK [7]. Лінії пухлинних клітин мишей, методами генной інженерії змінених таким чином, щоб експресувати мембранні (В7.1, В7.2, CD95L і ін.) або секретирувати молекули (інтерлейкин-2, інтерлейкин12 та ін.), часто використовують в дослідженнях імунних відповідей або протипухлиинних проявів. Такий підхід показує, що багато пухлинних клітин є потенційно антигенними [9] і стають імуногенними тоді, коли вони експресують які-небудь молекули. Отримані в експерименті у мишей пухлини класифікують як імуногенні тоді, коли після однієї ін'єкції сингенним мишам клітинних вакцин, що не реплікуються, ці миші виробляють ефективну імунну відповідь проти наступних летальних впливів. Пухлини, що не забезпечують збереження такої залишкової імуногенності, визначаються як слабоімуногенні або неімуногенні. Протипухлинні імунні відповіді в першу чергу опосередковуються Т-лімфоцитами [12]. Недавні дослідження підтвердили дефіцит в презентуванні антигенів і прилігруванні Т-клітин, що створює проблеми для практичного втілення ідеї універсальної протипухлинної вакцини. Дійсно, було встановлено, що трансфекція пухлинних клітин генами, що кодують різні цитокіни, такі як IL-2, IL-4, IL-12 або GM-CSF, або генами, що кодують костимуляторні молекули, такі, як В7, не тільки приводить до первинного відторгнення модифікованих клітин, але і часто забезпечує захисний імунітет проти наступних впливів немодифікованими пухлинними клітинами [13]. Функціональні антиген-презентуючі клітини (АРС) здатні приймати, процесувати і презентувати антиген Т-лімфоцитам у контексті костимуляторних сигналів, необхідних для активації Т-лімфоцитів, що приводить до оптимального презентування антигену. Зокрема, вірогідно встановлено, що позитивні за молекулами МНС класу II дендритні клітини відіграють принципову роль у процесуванні і презентуванні антигенів в імунній системі. Заявники висловили гіпотезу, згідно з якою пухлинна імуногенність повинна зростати, якщо пухлину вдасться модифікувати так, щоб вона безпосередньо направляла АРС організмухазяїна, такі, як макрофаги і дендритні клітини. Дійсно, було повідомлено про те, що перехресне зв'язування молекул МНС класу II, специфічно експресованих такими клітинами, з використанням 5 75322 6 моноклонального антитіла або суперантигену, кулами МНС класу II. опосередковує сигнали, що приводять до виробОтже, оскільки, індукція CD8+ -Т-клітинного лення TNFa і IL-12 [14, 15]. Раніше було повідомімунітету втягнута у вірусні (наприклад, ВІЛ-СНІД, лено, що ген активації лімфоцитів-3 (LAG-3), що гепатит або герпес) і внутрішньоклітинні паразитавходить в склад локуса CD4 [1,6], кодує білок, що рні і бактеріальні (наприклад, проказа, туберкузв'язується з молекулами класу II головного комльоз) інфекції і злоякісні пухлини, LAG-3 може буплексу гістосумісності людини і миші з великим ти, зокрема, використаний для терапевтичної рівнем афінності в порівнянні з CD4 [17,6]. вакцинації проти патогенних агентів, зв'язаних з Заявники цього винаходу досліджували, чи цими захворюваннями, так само як і для лікування може експресія hLAG-3, CD4 людини (hCD4) і злоякісних пухлин. mLAG-3 на трьох МНС класу II-позитивних пухлиУ відповідності до одного з аспектів цей винанах миші (слабоімуногенна саркома МСА-205 і хід стосується використання ліганду молекул МНА неімуногенна аденокарцинома TS/A+RENCA) опокласу II і лігандів подібних молекул для виробницсередкувати імунну відповідь таким чином, щоб тва лікарського засобу, призначеного для профівідторгати пухлину в миші з індукуванням системлактики або лікування патологічних станів, що втяного імунітету. гують антиген-специфічну імунну відповідь, В результаті заявники встановили, що LAG-3 переважно антиген-специфічну, опосередковувану людини або миші у випадку його експресії у вигляТ-лімфоцитами імунну відповідь. ді мембранного білка в лінії клітин солідної пухлиВ першому варіанті молекулою, що зв'язується ни або у випадку його інокуляції мишам у вигляді з МНС класу II, є білок LAG-3, так само як і його розчинного білка індукує формування імунітету до похідні, здатні зв'язуватися з лігандом LAG-3, що найбільш злоякісних пухлин миші. Імунітет виявиввходить в МНС. ся залежним від Т-лімфоцитів і антигенВ контексті цього винаходу під похідними LAGспецифічним. 3 маються на увазі мутанти, варіанти і фрагменти Автори також дослідили роль CD4 і виявили, LAG-3, а саме розчинні фрагменти LAG-3, які збещо CD4 людини (hCD4) також індукує системну рігають здатність самого LAG-3 зв'язуватися з мопротипухлинну відповідь. лекулами МНС класу II. Індукований імунітет, як було встановлено, Таким чином, можуть бути використані такі опосередковується Т-лімфоцитами, оскільки таку форми LAG-3: саму протипухлинну відповідь було виявлено у - повний білок LAG-3; мутантних мишей лінії "nude", у яких через аплазію - розчинний фрагмент поліпептиду LAG-3, до гіпофізу відсутні Т-лімфоцити. якого входить принаймні один з чотирьох позакліПротипухлинний ефект був також виявлений, тинних імуноглобуліно-подібних доменів, а саме коли були використані різні лінії пухлинних клітин, розчинна частина LAG-3, до якого входить позакщо виявляють різні варіанти власної імуногенності, літинний сегмент, що тягнеться від 23-ї амінокистак само як і різні лінії мишей, що експресують лоти до 448-ї амінокислоти послідовності LAG-3, різні гени комплексу МНС. наведеної [в заявці на видачу патенту Франції Крім того, індуковані білками hLAG-3 і hCD4 №90-00-12]; ефекти були виявлені тоді, коли лінії пухлинних - фрагмент LAG-3, до якого входять по суті поклітин, що експресують hLAG-3 і hCD4, були ін'єквні перший і другий домени; ційоновані в ділянці, що відрізняється від місця - фрагмент LAG-3, до якого входять по суті повихідної інокуляції у ліній пухлинних клітин дикого вні перший і другий домени або всі чотири домени, типу. такі, як визначені [в міжнародній патентній заявці Далі, системне введення розчинного hLAG-3 WO 95/3075], такий фрагмент як: прямо індукує пригнічення росту пухлини in vivo. - мутантний варіант розчинного LAG-3 або йоВсі вказані вище результати показують, що го фрагмент, до якого входять позаклітинні домени LAG-3 і CD4 здатні обумовлювати антигенD1 і D2, до яких входить: специфічну, опосередковувану Т-лімфоцитами - заміна амінокислоти за одним з наступних імунну відповідь і можуть бути використані в імуположень: нотерапії з метою запобігання розвитку злоякісних 73-є положення, в якому аргінін замінений на пухлин в популяціях, що характеризуються відпоглутамінову кислоту; відним ризиком або, в загальнішому змісті, для 75-е положення, в якому аргінін замінений на будь-яких імунотерапевтичних цілей, що ґрунтуаланін або глутамінову кислоту; ються на антиген-специфічній, опосередкованій Т76-е положення, в якому аргінін замінений на клітинами імунній відповіді, а також показують, що глутамінову кислоту; або поєднання однієї або LAG-3 також може застосовуватись в якості засобу кількох таких замін; для пригнічення росту пухлини in vivo. 30-е положення, в якому аспарагінова кислота Далі заявники продемонстрували, що розчинзамінена на аланін; ний LAG-3 у випадку введення одночасно з анти56-е положення, в якому гістидін замінений на геном, стосовно якого виробляється імунна відпоаланін; відь, здатний функціонувати в якості вакцинного 77-е положення, в якому тіразин замінений на ад'юванта. фенілаланін; Такий вияв може бути пояснений поліпшенням 88-е положення, в якому аргінін замінений на презентування даного антигену спеціальними АРС аланін; (дендритними клітинами і макрофагами), розташо103-е положення, в якому аргінін замінений на ваними під шкірою, що опосередковується молеаланін; 7 75322 8 109-е положення, в якому аспарагінова кислоЛікарський засіб у відповідності до цього вината замінена на глутамінову кислоту; ходу може бути використаний в якості вакцини для 115-е положення, в якому аргінін замінений на профілактики захворювань, пов'язаних з антигеналанін; або делеція ділянки, що знаходиться між специфічною імунною відповіддю, перевагу слід 54-м і 66-м положеннями, або поєднання двох або надавати опосередкованій Т-лімфоцитами імунній більшої кількості таких замін. відповіді. Такі мутантні варіанти [описані в PNAS, Proc. У цьому випадку його вводять разом з відповіNatl. Acad. Sci. USA - червень 1997] [4]; дним наповнювачем з одним або кількома антиге- або фізіологічний варіант LAG-3, до якого нами, проти якого (яких) формується дана імунна входять розчинний білок з молекулярною масою відповідь. Антиген може бути інактивованим або 52кДа за наявності в ньому доменів D1, D2 і D3. ослабленим інфекційним початком або очищеним У відповідності до другого варіанту цього виантигеном, наприклад, отриманим методами конснаходу білком, що зв'язується з МНС класу II, є труювання рекомбінантних білків, таким, як антиCD4 або його похідна, здатна зв'язуватися з ліганген інфекційного агента або пухлинний антиген, які дом CD4 з складу молекул МНС класу II. переважно здатні обумовлювати опосередковану Похідні CD4 такі ж самі, як ті, що були визнаТ-лімфоцитами імунну відповідь. чені для похідних LAG-3. Тобто вони є мутантниВакцина може бути використана для запобіми, варіантами і фрагментами CD4, а саме розгання виникнення у суб'єкта інфекційного захвочинними (не зв'язаними з мембраною) рювання, такого, як вірусне, бактеріальне або пафрагментами CD4, що зберігають здатність CD4 разитарне захворювання, якщо відповідний зв'язуватися з молекулами МНС класу II. інфекційний агент обумовлює формування специLAG-3 і CD4, а саме, hLAG-3 і hCD4 або їх пофічної імунної відповіді, перевагу слід надати імухідні, такі, як були визначені вище, можуть бути нній відповіді, опосередкованій Т-лімфоцитами. введені в якості рекомбінантних складових, що Вакцина може бути використана для лікування експресують такі молекули, наприклад, в складі пацієнта від інфекційного захворювання, такого, як трансфікованих клітин або рекомбінантних вірусів. згадувалося вище, пов'язаного з опосередкованим Цей винахід стосується також пухлинних кліТ-лімфоцитами імунною відповіддю, а саме імунтин, трансфікованих молекулою ДНК, що кодує ною відповіддю, опосередкованою СО8принаймні один ліганд молекул МНС класу II, тапозитивними Т-клітинами. кий, як CD4 або LAG-3, або їх похідні. Приклади захворювань, пов'язаних з формуЩе одним об'єктом цього винаходу є викорисванням опосередкованої Т-лімфоцитами імунної тання клітин, таких, як пухлинні клітини, трансфівідповіді, наведені нижче в таблиці. кованих молекулою ДНК, що кодує принаймні один ліганд молекул МНА класу II, такий, як CD4 або Таблиця LAG-3, або їх похідні, для виробництва лікарського засобу, переважно лікарського засобу, призначеного для профілактики або лікування патологічних Тип патогену Збудник Захворювання станів, пов'язаних з антиген-специфїчною імунною Віруси ВІЛ ВІЛ-інфекція відповіддю, такою, як антиген-специфічна, опосеHBV, HCV Гепатити редкована Т-лімфоцитами імунна відповідь, або HSV, CMV, Саркома Капоші, для лікування таких патологій, як злоякісні пухHHV відторгнення при лини. трансплантаціях Трансфіковані клітини переважно є клітинами ВнутрішньListeria Лістеріоз ссавців, а, зокрема, - пухлинними клітинами ссавоклітинні бактерії Mycobacteria Проказа, туберців. кульоз У відповідності до одного із своїх аспектів, цей Внутрішньоклітин- Plasmodium Малярія винахід стосується способу одержання клітин, ні паразити І т.д. трансфікованих молекулою ДНК, що кодує приОнкогени Більшість карцинаймні один ліганд молекул МНС класу II, такий, як ном, CD4 або LAG-3, або їх похідні, до яких відноситься І т.д. меланом, лейковиділення клітин у пацієнта (донора), трансфекція зов згаданих клітин молекулою ДНК, що кодує принаймні один ліганд молекул МНС класу II, такий, як В цих випадках антиген розподіляється по кліCD4 або LAG-3, або їх похідні, і виділення транстинах і відповідні пептиди завантажуються на мофікованих клітин. лекули МНС класу І і презентуються на поверхні Для одержання пухлинних клітин у відповіднотаких клітин, де вони розпізнаються CDS-носними сті до цього винаходу, даний спосіб може бути Т-клітинами. Дані, отримані заявниками, які показдійснений на матеріалі виділених у пацієнта (дозують, що молекули LAG-3/Ig індукують ефективну нора) пухлинних клітин. Т-клітинну імунну відповідь у тварин і стимулюють Однак, у відповідності до варіанту, якому слід незрілі дендритні клітини і макрофаги in vitro, чітко надати перевагу, білок, що зв'язується з молекупідтверджують, що білок LAG-3 є ад'ювантом Тлами МНС класу II, а саме CD4 або LAG-3, або їх клітин в ситуаціях, коли він взаємодіє з молекулапохідні, вводять у вільному вигляді, а саме в розми МНС класу II на спеціальних клітинах АРС. чинній формі, шляхом системного введення, наВакцина може бути також використана для заприклад, за допомогою підшкірної, внутрішньом'яхисту суб'єкта від злоякісної пухлини, причому як зової або внутрішньовенної ін'єкцій. солідної пухлини, так і лейкозу. 9 75322 10 Вакцина також може бути використана для ліпухлинними клітинами МСА-205, трансфікованими кування пацієнта від злоякісної пухлини. hLAG-3 (MCA hLAG-3); У цьому випадку білок, що зв'язується з молеФіг.2 показує результати (середній розмір пухкулами МНС класу II, а саме LAG-3 або CD4, вволин), отримані після повторної стимуляції тих садять суб'єкту .(реципієнтові) підшкірно або внутрімих мишей пухлинними клітинами МСА дикого шньошкірно або у формі назального аерозолю типу в мінімальній пухлинорідній дозі; разом з одним або кількома антигенами, здатними Фіг.3 показує результати (середній розмір пухобумовлювати імунну відповідь; перевагу слід налин), отримані після повторної стимуляції тих садавати імунній відповіді, опосередкованій Тмих мишей сторонньою лінією пухлинних клітин лімфоцитами. Антиген може бути пептидом, ліпоМС38; протеїном, рекомбінантним білком або молекулою Фіг.4 показує результати (середній розмір пухДНК, що кодує такі антигени. лин), отримані при використанні іншої лінії мишей Протипухлинна вакцина може прищіплюватись (BALB/c) і іншої лінії пухлинних клітин (TS/A) як в популяціях, що характеризуються ризиками, які дикого типу (TS/A дикий тип), так і трансфікованих визначають генотипово (профілактична вакцина), hCD4 (TS/A hCD4) або hLAG-3 (TS/A hLAG-3); або пацієнтам (лікувальна вакцина), у яких є пухФіг.5 показує результати (середній розмір пухлина або є високий ступінь ризику її рецидиву післин), отримані на існуючих пухлинах, на які вплиля хірургічного втручання. вали різними дозами клітин МСА, що експресують Якщо вакцина використовується в якості станhLAG-3; дартної (профілактичної) вакцини або лікувальноФіг.6 показує результати (середній розмір пухго препарату, вона може бути введена у вигляді лин), отримані з використанням розчинного LAG-3, "голої" плазміди [19], до якої входить послідовність що вводиться разом з клітинами MCA (MCA wt. ДНК, що кодує LAG-3 або CD4, перевагу слід надикий тип; MCA wt+25мкг LAG-3; і MCA wt+250мкг дати вміщенню під контроль сильного промотора. LAG-3); Також слід надати перевагу наявності у складі Фіг. збоку від рамки фігури 6 показує частку плазміди ДНК, що кодує антиген, стосовно якого мишей, у яких розвинулася пухлина; формується імунна відповідь. Фіг.7 і 8 показують дані про експресію LAG-3 Наступним об'єктом цього винаходу, таким чина мембрані лімфоцитів, що інфільтруються в пухном, є фармацевтична композиція, що містить лину (TILs у п'ятьох пацієнтів (Р1-Р5), у яких є карефективну кількість ліганду молекул МНС класу II цинома ниркових клітин (RCC); в поєднанні з ефективною кількістю антигену, здаФіг.9 демонструє відторгнення hLaG-3тного стимулювати імунну систему, перевагу слід позитивних пухлинних клітин, опосередковуване надавати здійсненню цього по шляху формування CDS-позитивними лімфоцитами. Т-клітинної імунної відповіді. А: FACS-аналіз (за допомогою клітинного Ще в одному своєму аспекті цей винахід стофлуоресцентного сортера) експресії CD8 лімфосується використання LAG-3 з якості лікарського цитами, що інфільтруються в пухлину (ЛІП) у контзасобу, призначеного для проведення протипухрольних мишей (МСА-205 дикого типу) у порівнянлинної імунотерапії в пацієнтів, у яких розвинулась ні з ЛІП мишей варіанту МСА-205+hLAG-3. В: CDSзлоякісна пухлина. позитивні Т-лімфоцити беруть участь у контролі У цьому випадку надають перевагу введенню росту пухлини TS/A hLAG-3. Мишам внутрішньоLAG-3 у вигляді вільного білка LAG-3 або його почеревно шляхом ін'єкції вводили 200мкг очищенохідної разом із фармацевтично прийнятним наповго CD4- або СО8-специфічного моноклонального нювачем, перевагу слід надавати у вигляді розантитіла в дні -3, -2, -1, +4 і +8. Пухлинні клітини чинної похідної у відповідності до того, як воно TS/A дикого типу або TS/A hLAG-З (MTD) були було охарактеризовано вище. введені ін'єкцією підшкірно в 0-й день. Дані покаLAG-3 може бути введений шляхом внутрішзані як середні ± середнє квадратичне відхилення ньопухлинної ін'єкції або за допомогою системної (s.e.) для 5 мишей у кожній групі окремого експеін'єкції, наприклад, підшкірно, внутрішньовенно рименту. Ці експерименти були проведені в двох або внутрішньом'язово. повтореннях і були отримані подібні результати. С: Іншим об'єктом цього винаходу є спосіб геноЗбільшена активність протипухлинних CTL у митерапії пухлин, в якому є такі етапи, як виділення шей, що виявляють відторгнення клітин hLAGчастини пухлинних клітин пацієнта, трансфікуван3/TS/A. Мишам вводили підшкірні трансплантати ня вказаних клітин молекулою ДНК, що кодує при50тис. клітин hLAG-3/TS/A, а потім проводили їх наймні один ліганд молекул МНС класу II, такий, як повторну стимуляцію на 30-й день з використанCD4 або LAG-3, або їх похідні, і повторне введення ням 250 тисяч вихідних клітин TS/A. Селезінки трансфікованих клітин цьому ж пацієнту. були взяті на 60-й день життя безпухлинних миНижченаведені приклади характеризують акшей, і спленоцити культивували протягом 6 днів з тивність LAG-3 і CD4 у зв'язку з профілактикою поміченими клітинами-мішенями, які були опроміабо лікуванням патологічних станів, що втягують нені. Цитолітична активність стосовно помічених опосередковану Т-лімфоцитами імунну відповідь. клітин-мішеней була протестована в стандартному Для кращого розуміння цього винаходу можна 4-годинному тесті з виходом радіоактивного хрозвернутися до Фіг., що додаються, на яких: му-51 при різних співвідношеннях "ефекФіг.1 показує середній розмір пухлин у мишей тор:мішень" (Е:Т). Показано результати експериC57BL/6, заражених пухлинними клітинами МСАменту на двох особинах мишей. Ці експерименти 205 дикого типу (MCA WT), пухлинними клітинами були здійснені в двох повтореннях на 4 особинах і МСА-205, трансфікованими hCD4 (MCA hCD4), були отримані подібні результати; 11 75322 12 Фіг.10 показує дані (середній розмір пухлини) RENCA і TS/A при 200мкг/мл. Резистентні клітини, для мишей (20 особин лінії C57BL/6), яким транспщо експресували трансфіковані молекули, були лантували клітини MTD, сингенні пухлинним клітиідентифіковані з використанням цитофлуориметра нам MCA-20.5, яким проводили одноразове ввеElite (Coulter, Hialeah, FL, США) і клоновані шляхом дення вакцини, що містить LAG-3/Ig. На 6-й день обмежуючого розведення. В даному аналізі викобули сформовані 4 групи по 5 мишей, яким провористовували кращий клон для кожної з конструкцій дили одноразове підшкірне введення вакцини у випадку кожної лінії пухлинних клітин. (200мкл). Антиген привносили жорстко опроміне4. Цитофлуориметричний аналіз ними (100Гр) клітинами МСА-205. Резистентні клітини, що експресують трансфіЕксперименти, що ілюструють дані приклади, ковані молекули, були забарвлені шляхом непрябули проведені з використанням наступних матемої імунофлуоресценції з використанням насичуріалів і методів. ючих кількостей очищених або взятих з асцитиої Матеріали і методи рідини моноклональних антитіл. Спочатку клітини 1. Лінії пухлинних клітин інкубували з моноклональними антитілами: 17В4 Використані лінії пухлинних клітин, позитивні (антитіло, специфічне стосовно hLAG-З) [2], ОКТ4 за класом І і негативні за класом II МНС, були та(антитіло, специфічне стосовно hCD4), в якості кими: слабко імуногенна, індукована метилхолантнегативного контролю використовувалась преімуреном лінія саркомних клітин МСА-205 (сингенна нна сироватка кролика (позначалася як PIS) і імунмишам лінії C57BL/6 Н-2); імуногенна лінія клітин на сироватка кролика до mLAG-3 (позначена як ниркової карциноми RENCA; і неімуногенна лінія IS). Експресія молекул класів І і II МНС миші на клітин недиференційованої спонтанної аденокарпухлинах виявляли з використанням наступних циноми молочної залози TS/A (обидві сингенні моноклональних антитіл: 34-1-2S - у відношенні Нмишам лінії BALB/c H-2d). Лінія клітин карциноми 2 Kd і D2; 28-8-6S - у відношенні Н-2 Kb і Db; 14-4-4S товстої кишки МС38 (сингенна мишам лінії (у відношенні Ed; M50114 (у відношень ІА і IE). C57BL/6) були використані в експериментах з поПотім клітини промивали і інкубували з поєдвторної стимуляції в якості контрольної пухлини. наною з FITC Клітини підтримували при 37°С у вологій атмос(флуоресцинізотіоціанат) козячою антимишифері повітря при 10% СО2 у повному середовищі ною сироваткою (GAM Coulter) або поєднаною з (культуральне середовище RPMI-1640 з додаванFITC козячою антикролячою сироваткою (GAR ням глутаміна, пірувата натрію, пеніциліну і стрепSouthern Biotechnologies Inc.). Для аналізу присуттоміцину, 10% звільненої від ендотоксинів навконості клітин, що інфільтруються, або заповнення лоплідної сироватки теляти і 0,05мМ 2-βклітин на периферії пухлини деякі миші були забимеркаптоетанолу). Для експериментів по імунному ті, а їх пухлини розмацеровані. Клітини забарвлюфарбуванню й в експериментах in vivo клітини відвали шляхом прямої імунофлуоресценції з викобирали з відповідних культуральних ємностей з ристанням 17B4-FITC або наступних фосфатним буфером, що містить 1мМ ЕДТА. Пемоноклональних антитіл (Pharmingen): антиред проведенням підшкірної ін'єкції клітини промиmСD4-РЕ (L3T4), анти-mСD8 (Ly-2 і Ly3.2), антивали тричі холодним фосфатним буфером (1х) і mNK (2В4) і анти-mСD22 (Lyb-8.2). Клітини відсорресуспендували в тому ж буфері. Клітини не культовували з використанням цитофлуориметра Elite тивували протягом більш двох тижнів. (Coulter). 2. Миші Позитивні клітинні лінії потім клонували шляСамки мишей лінії C57BL/6 у віці 6 або 8 тижхом обмежуючого розведення LaG-3-позитивних нів були придбані у фірмі IFFRA-CREDO Lab. або СD4-позитивних клонів, а отримані клони були (Lyon, Франція). Самки мишей лінії BALB/c у віці 4 заморожені для проведення подальшого аналізу. або 8 тижнів були придбані у фірми JANVIER Lab. Для створення розчинних молекул LAG-3 по(Франція). Всі миші утримувались в умовах, вільзаклітинні домени в складі hLAG-3 і mLAG-3 були них від конкретних патогенів. Самки мишей лінії приєднані до Fc-сегментів імуноглобулінів hlgGl і "nude" були придбані в віварії Institut Gustave mIgG2a, відповідно, згідно з описаним раніше [6]. Roussy і утримувались в захищеному мкросередоКінцеві рекомбінантні білки - hLAG-3/Ig і mLAG-3/Iq вищі. - були отримані в клітинах СНО й очищені на ко3. Генетичні конструкції лонках з протеїном А. кДНК hLAG-3, mLAG-3 і hCD4 були клоновані у 5. Експерименти з пухлинами in vivo вектор, що несе ген гігроміцинової резистентності 5.1. Досягнення росту пухлин і вакцинація (сайтами, що клонують, були Xbal-сайт для hLAGВпровадження ліній пухлинних клітин було 3 і hCD4 і Xhol-сайт для mLAG-3), уміщаючи під здійснено підшкірно з використанням мінімальної контроль промотора SRa [18]. В якості негативного пухлинорідної дози (МОД) - 20 тисяч клітин на 1 контролю використовували клонування кДНК мишу для лінії МСА-205, 50 тисяч клітин для лінії hLAG-3 в протилежній орієнтації. Всі лінії пухлинTS/A і 100 тисяч клітин для лінії RENCA, - або з них клітин (2,5млн. клітин) використовували для використанням 5-кратної МОД. Мишам, у яких не трансфекції шляхом електропорації з використанрозвивалась пухлина протягом 30 днів після проням пристрою Eurogentec (Бельгія): клітини МСАведення ін'єкції, проводили повторну стимуляцію 205 при 200 В, клітини TS/A і RENCA при 300 В, вихідною лінією пухлинних клітин (5-кратна МОД). при опорі 1500мкФ і необмеженому опорі шунта. Клітини МС38 (карцинома товстої кишки) були виТрансфектантів селектували в присутності гігромікористані в кількості 100 тисяч для індукції контроцину-В (Sigma): трансфектанти МСА-205 при конльної пухлини в мишей лінії C57BL/6, які відторгацентрації 100мкг/мл, а трансфектанти клітин ли пухлину TS/A. Пухлинні клітини вводили 13 75322 14 ін'єкцією узгодженим за віком мишам лінії C57BL/6 Результати і BALB/c, які раніше не піддавались яким-небудь Приклад 1 подібним діям. Поверхнева експресія hCD4, hLAG-3,. mLAG-3 Ріст пухлин контролювали 2-3 рази в тиждень і молекул МНС в лініях пухлинних клітин шляхом вимірювання двох лінійних параметрів Трансфіковані пухлинні клони були забарвлені пухлини (перпендикулярних один до одного) з виу відповідності до описаного в розділі 2.2 і проанакористанням штангенциркуля. В день проведення лізовані з метою порівняння рівнів експресії hCD4, аналізу пухлини in vivo клітини аналізували цитоhLAG-3 і mLAG-3. В даному аналізі використовуфлуориметрично і ставили тест на проліферацію вали для кожної з конструкцій по одному клону, in vitro. який показав найкращі результати. Серед ліній 5.2. Моделі лікування пухлин пухлинних клітин найвищий рівень молекул МНС В 0-й день лінії пухлинних клітин дикого типу класу І експресували клітини TS/A, а найменший були інокульовані підшкірно в лівий бік (МОД) . В рівень експресії молекул МНС класу І - клітини 0-й, на 3-й або 6-й день LaG-3-позитивні пухлинні МСА-205. Які-небудь істотні відмінності в рівні ексклітини вводили ін'єкцією в правий бік (МОД або 5пресії молекул МНС класу І при порівнянні вихідкратна МОД) з метою визначення протипухлинного них і трансфікованих клонів пухлинних клітин видії на нетрансфіковані клітини, розташовані у відявлено не було. даленій частині тіла. Ріст пухлин контролювали Приклад 2 так само, як це було описано вище. Формування пухлинних моделей і вакцинація: 5.3. Для цитометрического аналізу мишей інопорівняння дії hCD4 і hLAG-3 кулювали підшкірно 5-кратною МОД пухлинних Дані експерименти були проведені з метою клітин у відповідності до описаного вище. На 8-й визначення пухлинорідності клітин після їх трансдень пухлини розмецеровували і тестували з вифікування: клітинами МСА-205, TS/A, як показано користанням моноклональних антитіл CD3-PE, на Фіг.1 і 4 і RENCA. Індукція протипухлинного імуCD4-PE, CD8-PE, CD80-FITC, CD86-FITC, 2В4-РЕ нітету LaG-3-позитивної пухлини порівнювали з (клітини NK), CD22-PE (В-клетки) або hLAG-3-FITC вихідними лініями пухлинних клітин. з використанням цитофлуориметра Elite (Coilter). Клітини МСА-205, TS/A і RENCA дикого типу 5.4. Для виснаження лімфоцитів мишам внутефективно проліферували у випадку, коли їх підшрішньочеревинно вводили 200мкг очищеного [18] кірно імплантували або сингенним мишам ліній анти-СБ4 (YTS 191.1.2) або анти-СО8 (YTS C57BL/6 і BALB/c, або мутантним мишам 169.4.2.1) моноклонального антитіла в дні -3, -2, nude/nude. Пухлинні клітини, що виявляли стабі1, +4 і +8. Пухлинні клітини дикого типу або hLAGльну трансфікованість клонами hLAG-3 в зворотній 3-TS/A були інокульовані підшкірно на 0-й день орієнтації, визначену в процесі гігроміцинового (МОД). Цитофлуориметричний аналіз контрольних добору, характеризувалися подібними параметмишей, що одержували такі дози моноклональних рами росту. антитіл, показав більш ніж 95%-ную редукцію марТварини, яким вводили MCA-LAG-3, відторгакерної мішені в селезінці (дані в заявку не внели пухлину. Тварини, яким вводили MCA-CD4, сено). виявляли низьку інтенсивність росту пухлини в 6. Дослідження in vitro порівнянні з тваринами, яким вводили клітини Для тестування цитотоксичності були сформоМСА дикого типу. Дві особини (з 5) повністю відтовані пухлино-специфічні короткочасні культури ргали пухлину (Фіг.1). CTL на основі змішаної лімфоцитарної культури Подібні результати були отримані в аналізі пухлинних клітин. Коротше, 30млн. спленоцитів mLAG-3 (дані в заявку не внесено). були відібрані на 30-й день у мишей, які відторгнуЦі результати вказують на те, що ектопічна ли пухлини, які у них утворилися. Ці клітини були експресія hLAG-3, mLAG-3 і hCD4 підвищує імунопростимульовані 3млн. опромінених вихідних пухгенність лінії саркомних клітин МСА і запобігає линних клітин у повному середовищі протягом 4 утворенню пухлини в МСА-трансфектанта, тобто днів, а потім додавали 50од./мл рекомбінантного вона обумовлює формування імунітету проти злоінтерлейкину-2 людини (Cetus) на 2 дні. Ефекторні якісної пухлини в миші. функції спленоцитів були протестовані на 6-й день Подібні результати були отримані в аналізі пув рамках стандартного 4-годинного тесту на вихід хлинних клітин TS/A у мишей лінії BALB/c (Фіг.2). радіоактивного хрому-51 (при співвідношенні Подібні результати також були отримані при "ефектор:мішень" від 25:1 до 200:1) проти відмічеаналізі пухлинних клітин RENCA у сингенних миних клітин-мішеней, аутологічних пухлинних клішей лінії BALB/c. тин, сторонньої саркомної лінії H-2d WEHI-164 і Таким чином, протипухлинна дія виявляється: NK-чутливої клітинної лінії YAC. Ефективність лі- в різних лініях мишей, що експресують різні зису в трьох повторах була підрахована як {[різнигени головного комплексу гістосумісності (МНС); ця шкідливих експериментального і спонтанного - при використанні різних ліній пухлинних клівипромінювань в імп/хв.]/[різниця середніх макситин (що виявляють різний рівень власної імуногенмального і спонтанного випромінювань в ності - TS/A
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of mhc class ii ligands as adjuvant for vaccination and lag-3 for cancer immunotherapy
Назва патенту російськоюПрименение лигандов молекул мнс класса ii в качестве адъювантов для вакцинации и lag-3 для лечения злокачественных опухолей
МПК / Мітки
МПК: A61K 48/00, A61P 31/12, A61K 38/00, A61P 35/00, A61P 31/04, A61K 39/00, A61K 38/17, A61P 33/10, A61M 36/00, A61K 39/39
Мітки: пухлин, вакцинації, лікуванні, ад'ювантів, лігандів, класу, молекул, злоякісних, lag-3, мнс, застосування
Код посилання
<a href="https://ua.patents.su/11-75322-zastosuvannya-ligandiv-molekul-mns-klasu-ii-yak-adyuvantiv-dlya-vakcinaci-i-lag-3-v-likuvanni-zloyakisnikh-pukhlin.html" target="_blank" rel="follow" title="База патентів України">Застосування лігандів молекул мнс класу іі як ад’ювантів для вакцинації і lag-3 в лікуванні злоякісних пухлин</a>
Попередній патент: Гідроавтоматична фільтрувальна установка
Наступний патент: Спосіб і пристрій для взяття біологічних проб
Випадковий патент: 2-(3,5-діоксо-4-азатрицикло[5.2.1.02-ендо,6-ендо]дец-8-ен-4-іл)ацет піперидид, який виявляє аналгетичну та транквілізуючу дію