Спосіб ранньої діагностики злоякісних пухлин
Номер патенту: 13616
Опубліковано: 17.04.2006
Автори: Гульчій Микола Васильович, Швачко Людмила Павлівна, Бух Інна Георгіївна, Процик Володимир Семенович, Климнюк Григорій Іванович, Степаненко Аркадій Павлович, Кикоть Володимир Онуфрійович
Формула / Реферат
Спосіб ранньої діагностики злоякісних пухлин, що включає дослідження соматичних клітин крові, за результатами якого діагностують злоякісну пухлину, який відрізняється тим, що під час дослідження соматичних клітин крові виконують молекулярно-генетичну експертизу стану ДНК-метилювання, а саме, попередньо проводять відділення лімфоцитів від еритроцитарної маси, отримують геномну ДНК з ядерних клітин-лімфоцитів, яку потім гідролізують метилспецифічним ферментом ендонукліазної рестрикції, за результатами гідролізу визначають стан профілю ДНК-гіпометилювання геному, а на основі стану ДНК-гіпометилювання у порівнянні з відсутністю або майже відсутністю ДНК-гіпометилювання геномних ДНК здорових донорів встановлюють або не встановлюють онкологічну прогресію.
Текст
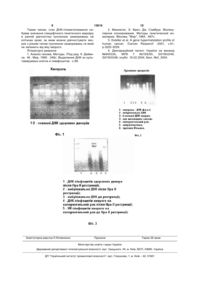
Спосіб ранньої діагностики злоякісних пухлин, що включає дослідження соматичних клітин крові, за результатами якого діагностують злоякісну пухлину, який відрізняється тим, що під час дослідження соматичних клітин крові виконують молекулярно-генетичну експертизу стану ДНКметилювання, а саме, попередньо проводять відділення лімфоцитів від еритроцитарної маси, отримують геномну ДНК з ядерних клітинлімфоцитів, яку потім гідролізують метилспецифічним ферментом ендонукліазної рестрикції, за результатами гідролізу визначають стан профілю ДНК-гіпометилювання геному, а на основі стану ДНК-гіпометилювання у порівнянні з відсутністю або майже відсутністю ДНК-гіпометилювання геномних ДНК здорових донорів встановлюють або не встановлюють онкологічну прогресію. Пропонована корисна модель відноситься до медицини, зокрема до онкології. Вона може бути застосована для ранньої діагностики онкологічного захворювання. Відомий спосіб ранньої діагностики злоякісних пухлин, відповідно до якого шкіру хворого сканують парою когерентних відбитих променів і визначають зони анізотропії, за якою діагностують злоякісну пухлину [Патент України №17968, МПК 6 А61В5/00; А61Н39/00. Опубл. 31.10.1997. Бюл. №5]. Описаний спосіб може бути застосований у практиці профілактичних оглядів, може дати інформацію для подальших досліджень хворого, але не дає можливості поставити остаточний діагноз, через наявність, наприклад, на шкірі хворого забруднень, звичайного або незвичайного загару (від електричної дуги), мутацій шкіри і т.ін. Тому згаданий спосіб може бути використаний лише для відбору пацієнтів для подальших досліджень. До того ж, коли результат дії злоякісної пухлини вже вийшов на шкіру, остання достатньо розвинена в організмі і для лікування пацієнта треба залучити досить значні засоби, наприклад хіміотерапію. Тобто, описану діагностику важко назвати ранньою. Також відомий спосіб ранньої діагностики онкологічного захворювання, який включає дослідження стану ДНК метилювання на пухлинах та пухлинних клітинних лініях, а за результатами згаданого дослідження встановлюють або не встановлюють онкологічну прогресію [Hypomethylation and hypermethylation of DNA in Wilms tumors. Ehrlich M., Jiang G., Fiala E., Dome JS., Yu MC., Long TL., JonnB., Sohn OS., Widschwendter M., Tomlinson GE., Chintagumpala M., Champague M., Parham D, Liang G., Malik, Laird PW. //Oncogene 2002, v.21, No43, p.694-702]. В описі даного способу зазначається, що "ДНК гіпометилювання інколи має очевидне місце в ранньому канцерогенезі, але воно також може асоціюватися з онкологічною прогресією" але при цьому не виявлений взаємозв'язок між рівнем геномного ДНК метилюванням та відносними варіа (19) UA (11) 13616 (13) U (21) u200508943 (22) 21.09.2005 (24) 17.04.2006 (46) 17.04.2006, Бюл. № 4, 2006 р. (72) Швачко Людмила Павлівна, Бух Інна Георгіївна, Степаненко Аркадій Павлович, Процик Володимир Семенович, Кікоть Володимир Онуфрійович, Климнюк Григорій Іванович, Гульчій Микола Васильович (73) ІНСТИТУТ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ І ГЕНЕТИКИ НАЦІОНАЛЬНОЇ АКАДЕМІЇ НАУК УКРАЇНИ, ІНСТИТУТ ОНКОЛОГІЇ АКАДЕМІЇ МЕДИЧНИХ НАУК УКРАЇНИ, Швачко Людмила Павлівна, Бух Інна Георгіївна, Степаненко Аркадій Павлович, Процик Володимир Семенович, Кікоть Володимир Онуфрійович, Климнюк Григорій Іванович, Гульчій Микола Васильович 3 13616 4 нтами геномного (патерн) та de novo ДНК метилту відповідності до описаного способу є соматичні рансферазного гену, що зменшує достовірність клітини крові - ядерні лімфоцити периферійної ранньої діагностики онкологічного захворювання крові, а не пухлини. таким способом. Недолік описаного способу полягає у невизнаТакож відомий спосіб ранньої діагностики онченості молекулярно-генетичних причин декондекологічного захворювання, який включає дослінсації центромерного/перицентримерного гетеродження злоякісних та доброякісних пухлин колорехроматину при онкологічній прогресії на стадії ктального раку. [Differential DNA hypermethylation мітотичних хромосом лімфоцитів, що знижує досand hypomethylation signatures in colorectal cancer. товірність отриманих результатів. Jordi Fridola, Xavier Sole, Maria F., Pazi Victor У основу пропонованої корисної моделі постаMoreno, Manel Esteller, Gabriel Capella, Miguel A. влено задачу створення такого способу ранньої Peinado. //Human Molecular Genetics -2005, v.14, діагностики злоякісних пухлин, який би був більш No2, p.319-326]. У якості об'єкта дослідження під достовірним за рахунок створення умов для вичас застосування згаданого способу використовузначення молекулярно-генетичних причин деконють пухлинні клітини, а не соматичні клітини лімденсації центромерного/перицентримерного гетефоцитів периферійної крові хворого, поза пухлирохроматину при онкологічній прогресії на стадії ною. мітотичних хромосом лімфоцитів. В описі даного способу зазначається, що пухПропонований, як і відомий спосіб ранньої діалинні клітини характеризуються генералізованим гностики злоякісних пухлин, включає дослідження порушенням ДНК метилювання, включаючи загасоматичних клітин крові, за результатами якого льне зниження в рівні 5-метилцитозину разом з діагностують злоякісну пухлину, а, відповідно до регіональним гіперметилюванням, зокрема, CpG пропозиції, під час дослідження соматичних клітин острівців промоторних ділянок багатьох онкосупкрові виконують молекулярно-генетичну експертиресорних генів. Існування обох - ДНК гіпометилюзу стану ДНК метилювання, а саме, попередньо вання та ДНК гіперметилювання в пухлинних кліпроводять відділення лімфоцитів від еритроцитартинах на прикладі колоректального раку "можливо, ної маси, отримують геномну ДНК з ядерних клівідображує відмінні біологічні та клінічні особливотин-лімфоцитів, яку потім гідролізують метилсті пухлинної прогресії", не конкретизуючи їх та не специфічним ферментом ендонуклиазної рестриквказуючи про можливий асоціативний зв'язок між ції, за результатами гідролізу визначають стан гіперметилюванням та гіпометилюванням, лише профілю ДНК-гіпометилювання геному, а на основі зауважуючи на те, що у карциномах (злоякісна стану ДНК-гіпометилювання у порівнянні з відсутпухлина) має місце вищий рівень ДНК гіперметиністю або майже відсутністю ДНКлювання чим у аденомах (доброякісна пухлина), гіпометилюванням геномних ДНК здорових доноале при цьому мають місце подібні рівні ДНК гіпорів встановлюють або не встановлюють онкологічметилювання. Тому спосіб має пріоритетним саме ну прогресію. ДНК гіперметилювання, як генетичного маркеру в Пропонований спосіб ранньої діагностики злодіагностиці злоякісних пухлин. А отже, достовірякісних пухлин встановлює кореляцію між ДНК ність ранньої діагностики онкологічного захворюгіпометилюванням як раннього маркеру пухлинної вання за таким способом є недостатньою. прогресії та деконденсацією гетерохроматину на Найбільш близьким до пропонованого за досярівні мітотичних хромосом, що є також цитогенегнутим результатом є спосіб ранньої діагностики тичним маркерорм ранньої діагностики. Авторами злоякісних пухлин, що включає дослідження сомапропонованого способу виявлено, що стан ДНК тичних клітин крові, за результатами якого викогіпометилювання у хворих з онкологічною прогренують ранню діагностику злоякісної пухлини [Десією на рівні лімфоцитів крові не залежить від типу клараційний патент України на винахід №64533А, пухлинного захворювання та віку хворого, що є МПК 7 A61D5/00, G01N33/49, G01N33/48; опубл. вірогідним генетичним маркером у ранній діагнос16.02.2004, Бюл. №2, 2004]. Об’єктом дослідження тиці онкозахворювань. Таблиця Відносне співвідношення рівня геномного ДНК-гіпометилювання у здорових донорів та у хворих з онкологічною прогресією n 112 Здорові донори M+m 34,2+4,0 n 136 Встановлено, (n=136, P 0,001) що на клітинах крові хворих, поза пухлиною, а саме ядерних лімфоцитах, можна з'ясовувати та діагностувати пухлинний процес за станом ДНК-гіпометилювання. Злоякісна пухлина має клональне соматичне походження та є наслідком тривалого специфічного захворювання геному, пізнання факторів етнології якого, нажаль, не ототожнюється з пізнанням самих механізмів канцерогенезу. Пошук специфіч Хворі на пухлинну прогресію M+m 141,7+5,6 P 0,001 них молекулярних маркерів поза пухлиною - на лімфоцитах крові, що корелюють з пухлинною прогресією, є вірогідний шлях до раннього прогнозування та діагностики онкозахворювань. З наявністю ж подібних маркерів в самих пухлинах та клітинних пухлинних лініях переконливо може пов'язуватись специфічність їх дії по відношенню до вірогідного механізму розвитку онкозахворювання. 5 13616 6 За пропонованим способом діагностики покарестрикції, а отже профіль ДНК-гіпометилювання є зано, що аномальне (аберантне) ДНКпринциповим молекулярним маркером в ранній метилювання при канцерогенезі, а саме - глобальдіагностиці пухлинної прогресії на рівні геномної не геномне ДНК-гіпометилювання на рівні лімфоДНК лімфоцитів крові, поза пухлиною та до її пояцитів периферійної крові у хворих з різним типом ви. онкозахворювань (Фіг.2), що асоціюється з глобаОсновним методом діагностики ДНК- гіпо- та льним деметилюванням ALU-ДНК сателітних погіперметилювання по відомим, описаних вище вторів (Фіг.3), є достовірним молекулярним маркеспособам ["Hypomethylation and hypermethylation of ром пухлинної прогресії. В аналогах DNA in Wilms tumors." Ehrlich M., Jiang G., Fiala E., пропонованого способу аномальне ДНКDome JS., Yu MC., Long TL., JonnB., Sohn OS., метилювання виявлено на самих пухлинах та пухWidschwendter M., Tomlinson GE., Chintagumpala линних клітинних лініях і пов'язується, насампеM., Champague M., Parham D., Liang G., Malik, Laird ред, з переважним гіперметилюванням CpG остріPW. //Oncogene -2002, v.21, No43, p.694-702. вців у 5'-промоторних ділянках онкосупресорних "Differential DNA hypermethylation and генів (альтернативного механізму інактивації ексhypomethylation signatures in colorectal cancer." пресії цих генів при онкологічній прогресії) [3], на Jordi Fridola, Xavier Sole, Maria F., Pazi Victor рівні загального патерн ДНК-гіпометилювання геMoreno, Manel Esteller, Gabriel Capella, Miguel A. ному пухлин та пухлинних клітин. Тому, за даними Peinado. //Human Molecular Genetics -2005, v.14, авторів аналогів ДНК-гіперметилюванню CpG No2, p.319-326] є метил-специфічна ампліфікація, промоторних ділянок генів надається перевага як яка включає такі операції: молекулярному маркеру у діагностиці пухлин, як - виділення ДНК з пухлини, незалежному від ДНК-гіпометилювання. - двостадійна послідовна рестрикція ДНК Smal Пропонований спосіб діагностики, побудова(специфічна до неметильованих залишків цитозиний на визначенні стану ДНК-гіпометилювання на ну, на протязі 6год.) та Xmal (ізошизомер, метилклітинах крові, що корелює з онкологічною прогреспецифічна ендонуклеаза, на протязі 16год.) сією, включає: а) отримання нативної геномної Преципітація ДНК фрагментів етанолом. ДНК з лімфоцитів периферійної крові хворого (з 1Адапторне лігування ДНК фрагментів за до5мл) [1], б) електрофоретичний аналіз нативного помогою адапторного праймеру. препарату геномної ДНК у 0,8% агарозному гелі, в) ПЦР - ампліфікація такої пострестрикційноподальше, чутливе до ДНК-гіпометилювання, мелігованою ДНК зі специфічними метилчутливими тил-специфічній Нра II - ендонуклеазній рестрикції праймерами. геномної ДНК, у продовж 16 годин при температурі Електрофоретичний аналіз профілю метил37°С та г) електрофоретичне розділення в 1% специфічної ампліфікації. агарозному гелі профілю Нра II - метил1. Суттєвого значення в діагностиці ДНКспецифічної ДНК- рестрикції. В аналізуючу пробу, метилювання за відомими способами об'ємом 20мкл, з концентрацією ДНК 5-10мкг, до["Hypomethylation and hypermethylation of DNA in давали 20 одиниць активності Нра II ферменту Wilms tumors." Ehrlich M., Jiang G., Fiala E., Dome рестрикції, селективному до неметильованих CpG JS., Yu MC., Long TL., Jonn B., Sohn OS., сайтів ДНК [2] та 2мкл 10-кратного буферу для Widschwendter M., Tomlinson GE., Chintagumpala Нра IІ - рестрикції. За контрольну пробу мали геM., Champague M., Parham D., Liang G., Malik, Laird номну ДНК лімфоцитів здорового донора. Після PW. //Oncogene -2002, v.21, No43, p.694завершення ендонуклеазної рестрикції реакцію 702."Differential DNA hypermethylation and зупиняли внесенням у кожну з проб по 1мкл 0,5% hypomethylation signatures in colorectal cancer. розчину ЕДТА для інгібування ферменту. Елект"Jordi Fridola, Xavier Sole, Maria F., Pazi Victor рофоретичним розділенням в 1% агарозному гелі Moreno, Manel Esteller, Gabriel Capella, Miguel A. аналізували появу специфічного профілю ДНКPeinado. //Human Molecular Genetics -2005, v.14, гіпометилювання після Нра II-рестрикції геномної No2, p.319-326] має збереження нативної послідоДНК лімфоцитів у хворого з онкологічною прогревності пострестрикційно-лігованої ДНК для метилсією, по відношенню до його відсутності, або майспецифічної ПЦP-ампліфікації. же відсутності у здорових донорів, що засвідчує 2. Діагностична достовірність геномного папро глобальний загальний стан ДНКтерн ДНК-гіпометилювання як специфічного маргіпометилювання геному при онкологічній прогрекеру для ранньої діагностики онкозахворювань сії. В нормі в геномі людини має місце глобальне лежить насамперед у площині процентного спів(майже на 95%) епігенетичне (постреплікаційне) відношення геномного ДНК метилювання (на 80ДНК-метилювання, що асоціюється з транскрип90%) та долі неметильованих CpG острівців у ційним "мовчанням" геному, за виключенням (до складі промоторних ділянок генів (10-20%). 10%) неметильованих CpG острівців у 5'3. Тому, виходячи з пункту 2, показано, що на промоторних ділянках транскрипційно активних рівні лімфоцитів периферійної крові, поза пухлигенів [3], що робить геномну ДНК здорових донорів ною, саме ДНК-гіпометилювання має важливе майже недоступною дії специфічному до ДНК значення в пріоритеті ранньої діагностики та продеметилювання Нра II ферменту ендонуклеазної гнозуванні онкозахворювань. 7 13616 8 Таблиця Кореляція між геномним (патерн) ДНК-гіпометилюванням та деконденсацією перицентромерного/центромерного гетерохроматину метафазних хромосом лімфоцитів крові у хворих з онкологічною прогресією ДНК-гіпометилювання n % 136 100 Деконденсація гетерохроматину n % 500 метафаз 100 Суть пропонованого способу пояснюється за допомогою графічних матеріалів. На Фіг.1 показано стан ДНК гіпометилювання при пухлинній прогресії на основі Нра ІІ-чутливої до немитильованих CpG сайтів епдонуклеазної рестрикції - контроль, при цьому числами 1-9 позначені геномні ДНК здорових донорів. На Фіг.2 показано стан ДНК гіпометилювання при пухлинній прогресії на основі Нра ІІ-чутливої до немитильованих CpG сайтів епдонуклеазної рестрикції - пухлинна прогресія, при цьому: - числом 1 позначено контроль ДНК фага ; - числом 2 позначено ембріональна ДНК; - числами 3-6 позначено геномні ДНК хворих; - числом 3 позначено рак щитовидної залози; - числом 4 позначено колоректальний рак; - числом 5 позначено нейробластома; - числом 6 позначено пухлина Вільмса. На Фіг.3 показано молекулярна гібридизація DIG - (Alu) сателітних ДНК повторів з профілем ДНК-гіпометилювання при пухлинній прогресії, при цьому: 1 - ДНК лімфоцитів здорового донора після Нра II рестрикції, специфічної до неметильованих залишків цитозину у складі CCGG послідовностей ДНК (2), 2 - ембріональна ДНК після Нра II рестрикції; 3 - ембріональна ДНК до рестрикції; 4 - ДНК лімфоцитів хворого на колоректальний рак після Нра II рестрикції; 5 - ДНК лімфоцитів хворого на колоректальний рак до рестрикції. Приклад 1 Хвора, П., 22 років, пройшла лікування у Київському Центрі лікування та реабілітації хворих з патологією щитовидної залози. За експресдіагностикою морфології тканини щитовидної залози, діагностикою УЗІ та клінічним обстеженням хвора мала заключний діагноз - медулярний рак з метастазуванням. У відповідності до пропонованого способу діагностики досліджували 5мл периферійної крові хворої. А саме, відділяли лімфоцити від еритроцитарної маси, отримували (безфенольним методом) геномну ДНК з ядерних клітинлімфоцитів, яку потім гідролізували (на протязі 16год, при 37°) Нра II - специфічною до неметильованих CpG сайтів (було - у геномній ДНК, ендонуклеазою рестрикції та аналізували результати гідролізу ДНК за допомогою 0,7% агарозного гелю). У складі CCGG послідовностей геномної ДНК, ендонуклеазою рестрикції та аналізували результати гідролізу ДНК за допомогою 0,7% агарозного гель-електрофорезу. За результатами аналізу хвора мала специфічний профіль ДНК P 0,001 гіпометилювання у порівнянні з донорською геномною ДНК, що корелює з онкологічною прогресією (Фіг.1). Приклад 2 Хворий Федоров B.I., 54 років, пройшов лікування з хірургічним втручанням в Інституті онкології АМН України з верифікацією клінічного діагнозу на колоректальний рак. У відповідності до пропонованого способу діагностики досліджували 5мл периферійної крові хворого. А саме, відділяли лімфоцити від еритроцитарної маси, отримували (безфенольним методом) геномну ДНК з ядерних клітин-лімфоцитів, яку потім гідролізували (на протязі 16год. при 37°) Нра II - специфічних до неметильованих цитозинових CpG сайтів у геномній ДНК, ендонуклеазою рестрикції та аналізували результати гідролізу ДНК за допомогою 0,7% агарозного гельелектрофорезу. За результатами аналізу стану метилювання за метил-специфічною ендонуклеазною рестрикцією геномної ДНК лімфоцитів крові хворого достовірно мав місце профіль ДНК-гіпометилювання у порівнянні зі здоровими донорами, що корелює з онкологічною прогресією. Приклад 3 Хворий Олексієнко О.В., 11 років, пройшов лікування з хірургічним втручанням в Інституті Онкології АМН України з визначеним клінічним діагнозом за результатами УЗІ діагностики та ренгеноскопії - пухлина Юнга. У відповідності до пропонованого способу діагностики досліджували 5мл периферійної крові хворого. А саме, відділяли лімфоцити від еритроцитарної маси, отримували (безфенольним методом) геномну ДНК з ядерних клітин-лімфоцитів, яку потім гідролізували (на протязі 16год. при 37°) Нра II - специфічних до неметильованих цитозинових CpG сайтів у геномній ДНК, ендонуклеазою рестрикції та аналізували результати гідролізу ДНК за допомогою 0,7% агарозного гельелектрофорезу. За результатами аналізу генетичної діагностики ДНК-гіпометилювання геному на ядерних клітинах крові хворого - лімфоцитах, за результатом специфічної рестрикції до неметильованих залишків цитозину у складі CpG динуклеотидів, як головних молекулярних мішеней метилювання геному, мав місце стан ДНК-гіпометилювання геному хворого за специфічним профілем електрофоретичного аналізу ДНК хворого після такої рестрикції в агарозному гелі при порівнянні з донорською геномною ДНК. Стан глобального ДНКгіпометилювання корелював з онкологічним захворюванням хворого. 9 13616 10 Таким чином, стан ДНК-гіпометилювання на2. Маниатис, Э. Фрич, Дж. Сэмбрук. Молекубуває значення специфічного генетичного маркеру лярное клонирование. Методы генетической инв ранній діагностиці пухлинних захворювань на женерии. /Москва, "Мир", 1984. -487с. клітинах крові, за яким можна діагностувати хво3. Esteller et al. A gene hypermetylation profile of рих з різним типом пухлинних захворювань та який human cancer. /Cancer Research -2001, v.61, не залежить від віку хворого. p.3225-3229. Літературні джерела: 4. Деклараційний патент України на винахід 1. Анализ генома. Методы. /Под ред. К. Дейви№64533А, МПК 7 A61D5/00, G01N33/49, са. -М.: Мир, 1990. -246с. Выделение ДНК из кульG01N33/48; опубл. 16.02.2004, Бюл. №2, 2004. тивируемых клеток и лимфоцитов. -с.68. Комп’ютерна верстка Л.Литвиненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for early diagnosis of malignant tumors
Автори англійськоюShvachko Liudmyla Pavlivna, Protsyk Volodymyr Semenovych, Klymniuk Hryhorii Ivanovych, Hulchii Mykola Vasyliovych
Назва патенту російськоюСпособ ранней диагностики злокачественных опухолей
Автори російськоюШвачко Людмила Павловна, Процик Владимир Семенович, Климнюк Григорий Иванович, Гульчий Николай Васильевич
МПК / Мітки
МПК: G01N 33/49, A61B 10/00, A61P 35/00
Мітки: спосіб, ранньої, пухлин, злоякісних, діагностики
Код посилання
<a href="https://ua.patents.su/5-13616-sposib-ranno-diagnostiki-zloyakisnikh-pukhlin.html" target="_blank" rel="follow" title="База патентів України">Спосіб ранньої діагностики злоякісних пухлин</a>
Попередній патент: Спосіб визначення ефективності лікувально-реабілітаційних заходів
Наступний патент: Гідравлічна муфта
Випадковий патент: Спосіб одержання подвійного дифосфату натрію-нікелю (іі)