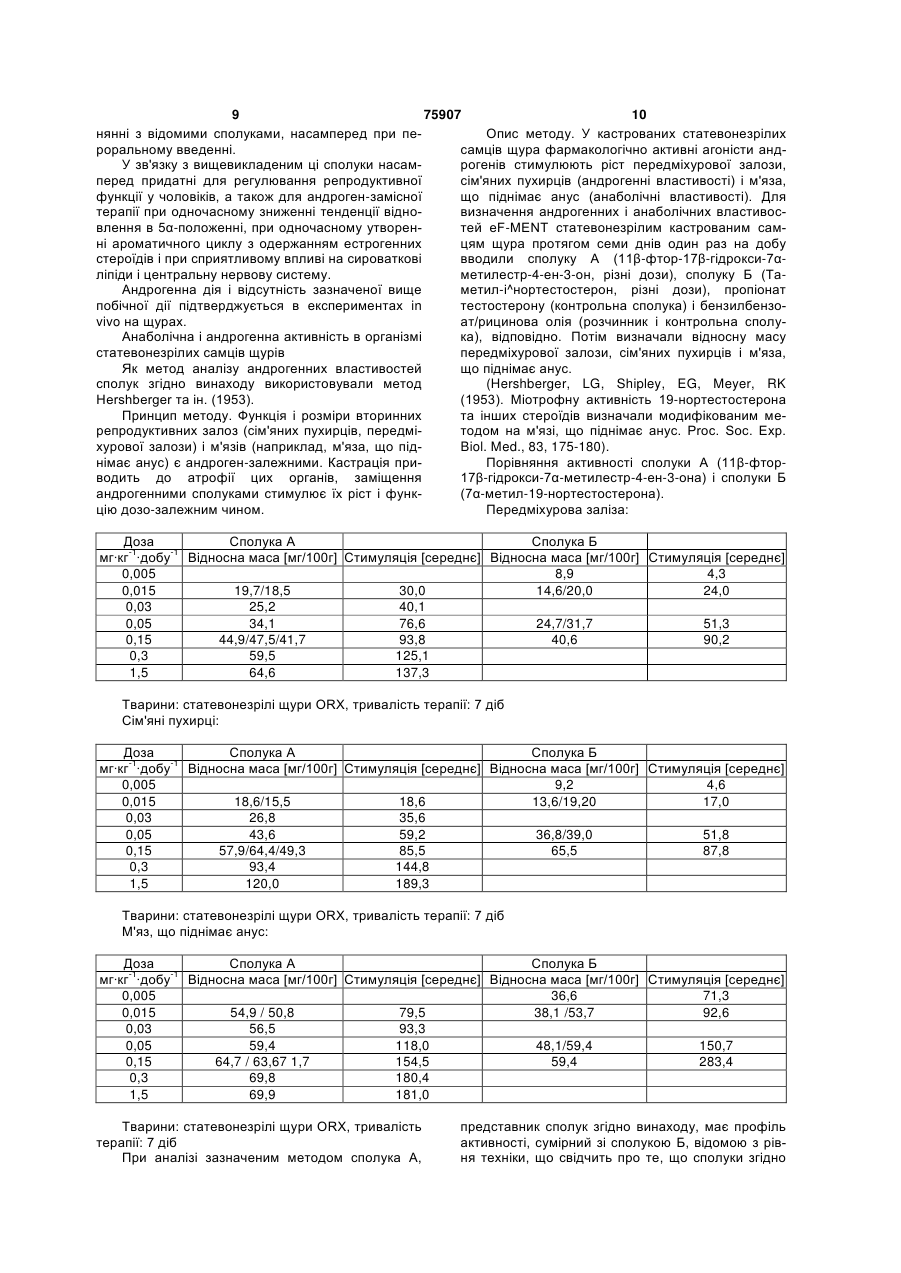
Андрогенні 7-заміщені-11-галогеновані стероїди
Номер патенту: 75907
Опубліковано: 15.06.2006
Автори: Цопф Дітер, Нуббемейер Райнхард, Больманн Рольф, Кюнцер Германн
Формула / Реферат
1. 11![]() -Галогеностероїди загальної формули I
-Галогеностероїди загальної формули I
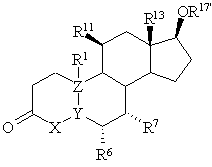
![]()
в якій
X-Y-Z означає групу CH=C-C або CH2-C=C,
R1 може знаходитися в ![]() - або в
- або в ![]() -положенні, означає водень, R або групу P-Q-R, що зв'язана зі стероїдною циклічною системою через групу P, причому P і Q означають прямі або розгалужені, необов'язково частково або повністю фторовані групи С1-С8алкілен, С1-С8алкенілен, С1-С8алкінілен, причому вказані групи можуть бути однаковими або різними, а R означає радикал CH3 або CF3, за умови, що Z не містить замісник R1, якщо X-Y-Z означає групу CH2-C=C,
-положенні, означає водень, R або групу P-Q-R, що зв'язана зі стероїдною циклічною системою через групу P, причому P і Q означають прямі або розгалужені, необов'язково частково або повністю фторовані групи С1-С8алкілен, С1-С8алкенілен, С1-С8алкінілен, причому вказані групи можуть бути однаковими або різними, а R означає радикал CH3 або CF3, за умови, що Z не містить замісник R1, якщо X-Y-Z означає групу CH2-C=C,
R6 означає водень або може мати значення, вказані для групи R7,
R7 означає R або групу P-Q-R, зв'язану зі стероїдною циклічною системою через групу P, причому ці групи мають значення, вказані вище,
R11 означає галоген,
R13 означає метил або етил,
R17 означає водень або C(O)-R18, де R18 означає прямий або розгалужений радикал С1-С18алкіл, С1-С18алкеніл, С1-С18алкініл або радикал арил, або групу T-U-V, зв'язану з C(O) через групу T, де T і U означають прямі або розгалужені групи С1-С18алкілен, С1-С18алкенілен, С1-С18алкінілен, С3-С12аліциклічні групи або арильні групи, і є однаковими або різними, а V означає прямий або розгалужений радикал С1-С18алкіл, С1-С18алкеніл, С1-С18алкініл або арильний радикал, або
R18 має одне зі значень, вказаних вище, і, крім того, заміщений однією або більше групами NR19R20 або однією або більше групами SOxR21, де х дорівнює 0, 1 або 2, а R19, R20 і R21 в кожному випадку означають водень або групу T-U-V, зв'язану з N, S через групу T, що має значення, вказане вище,
та їх фізіологічно прийнятні кислотно-адитивні солі органічних і неорганічних кислот.
2. 11![]() -Галогеностероїди за п. 1, в яких R11 означає фтор.
-Галогеностероїди за п. 1, в яких R11 означає фтор.
3. 11![]() -Галогеностероїди за п. 1 або п. 2, в яких R6 означає водень, метил, етил або трифторметил.
-Галогеностероїди за п. 1 або п. 2, в яких R6 означає водень, метил, етил або трифторметил.
4. 11![]() -Галогеностероїди за будь-яким з пп. 1-3, в яких R7 означає метил, етил або трифторметил.
-Галогеностероїди за будь-яким з пп. 1-3, в яких R7 означає метил, етил або трифторметил.
5. 11![]() -Галогеностероїди за будь-яким з пп. 1-4, в яких R1 означає водень.
-Галогеностероїди за будь-яким з пп. 1-4, в яких R1 означає водень.
6. 11![]() -Галогеностероїди за будь-яким з пп. 1-5, в яких R13 означає метил.
-Галогеностероїди за будь-яким з пп. 1-5, в яких R13 означає метил.
7. 11![]() -Галогеностероїди за будь-яким з пп. 1-6, в яких R17’ означає водень або С(O)-R18, де R18 означає С1-С18алкіл з прямим або розгалуженим ланцюгом.
-Галогеностероїди за будь-яким з пп. 1-6, в яких R17’ означає водень або С(O)-R18, де R18 означає С1-С18алкіл з прямим або розгалуженим ланцюгом.
8. 11![]() -Галогеностероїди загальної формули I за п. 1, а саме
-Галогеностероїди загальної формули I за п. 1, а саме
11![]() -фтор-17
-фтор-17![]() -гідрокси-7
-гідрокси-7![]() -метилестр-4-ен-3-он,
-метилестр-4-ен-3-он,
11![]() -хлор-17
-хлор-17![]() -гідрокси-7
-гідрокси-7![]() -метилестр-4-ен-3-он,
-метилестр-4-ен-3-он,
11![]() -бром-17
-бром-17![]() -гідрокси-7
-гідрокси-7![]() -метилестр-4-ен-3-он,
-метилестр-4-ен-3-он,
17![]() -гідрокси-11
-гідрокси-11![]() -йод-7
-йод-7![]() -метилестр-4-ен-3-он,
-метилестр-4-ен-3-он,
7![]() -етил-11
-етил-11![]() -фтор-17
-фтор-17![]() -гідроксіестр-4-ен-3-он,
-гідроксіестр-4-ен-3-он,
11![]() -фтор-7
-фтор-7![]() -(фторметил)-17
-(фторметил)-17![]() -гідроксіестр-4-ен-3-он,
-гідроксіестр-4-ен-3-он,
11![]() -фтор-17
-фтор-17![]() -гептаноїлокси-7α-метилестр-4-ен-3-он,
-гептаноїлокси-7α-метилестр-4-ен-3-он,
11![]() -фтор-7
-фтор-7![]() -метил-17β-ундеканоїлоксиестр-4-ен-3-он,
-метил-17β-ундеканоїлоксиестр-4-ен-3-он,
11![]() -фтор-17
-фтор-17![]() -гідрокси-7
-гідрокси-7![]() -метилестр-5(10)-ен-3-он.
-метилестр-5(10)-ен-3-он.
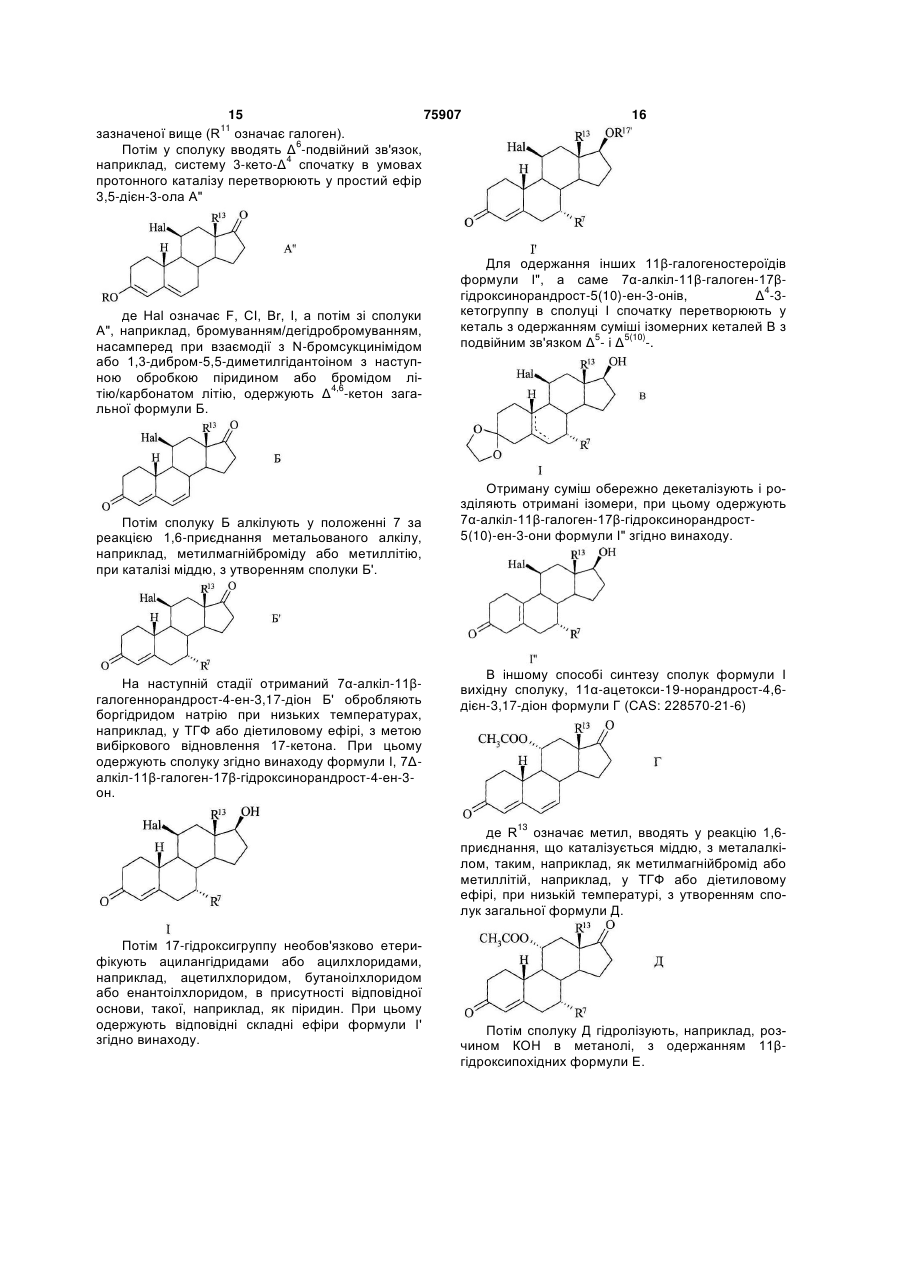
9. Спосіб одержання 11![]() -галогеностероїдів загальної формули I за будь-яким з пп. 1-8, у якому із сполуки загальної формули Б, Г
-галогеностероїдів загальної формули I за будь-яким з пп. 1-8, у якому із сполуки загальної формули Б, Г
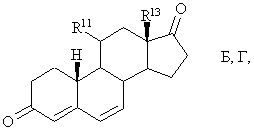
де R11 означає гідроксил, галоген або нуклеофільну групу, що відходить, а R13 має значення, вказані вище, за реакцією 1,6-приєднання з метальованим алкілом формули R7-M або R7-M'X, де М означає лужний метал, M' означає лужноземельний метал, Х означає галоген, а R7 має значення, вказані вище,
спочатку одержують сполуку загальної формули Б′,Д
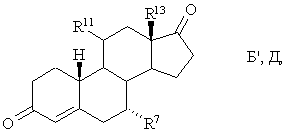
а потім цю сполуку або селективно відновлюють з утворенням сполуки загальної формули I, або, якщо R11 не є галогеном, вводять у реакцію нуклеофільного заміщення в 11-положенні з галогенуючим агентом, а потім селективно відновлюють з утворенням сполуки загальної формули I:
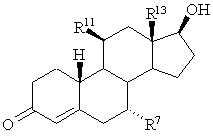 І.
І.
10. Застосування 11![]() -галогеностероїдів за будь-яким з пп. 1-8 як активного компонента фармацевтичної композиції.
-галогеностероїдів за будь-яким з пп. 1-8 як активного компонента фармацевтичної композиції.
11. Фармацевтичний препарат, який містить щонайменше один 11![]() -галогеностероїд за будь-яким з пп. 1-8, а також щонайменше один фармацевтично прийнятний носій.
-галогеностероїд за будь-яким з пп. 1-8, а також щонайменше один фармацевтично прийнятний носій.
Текст
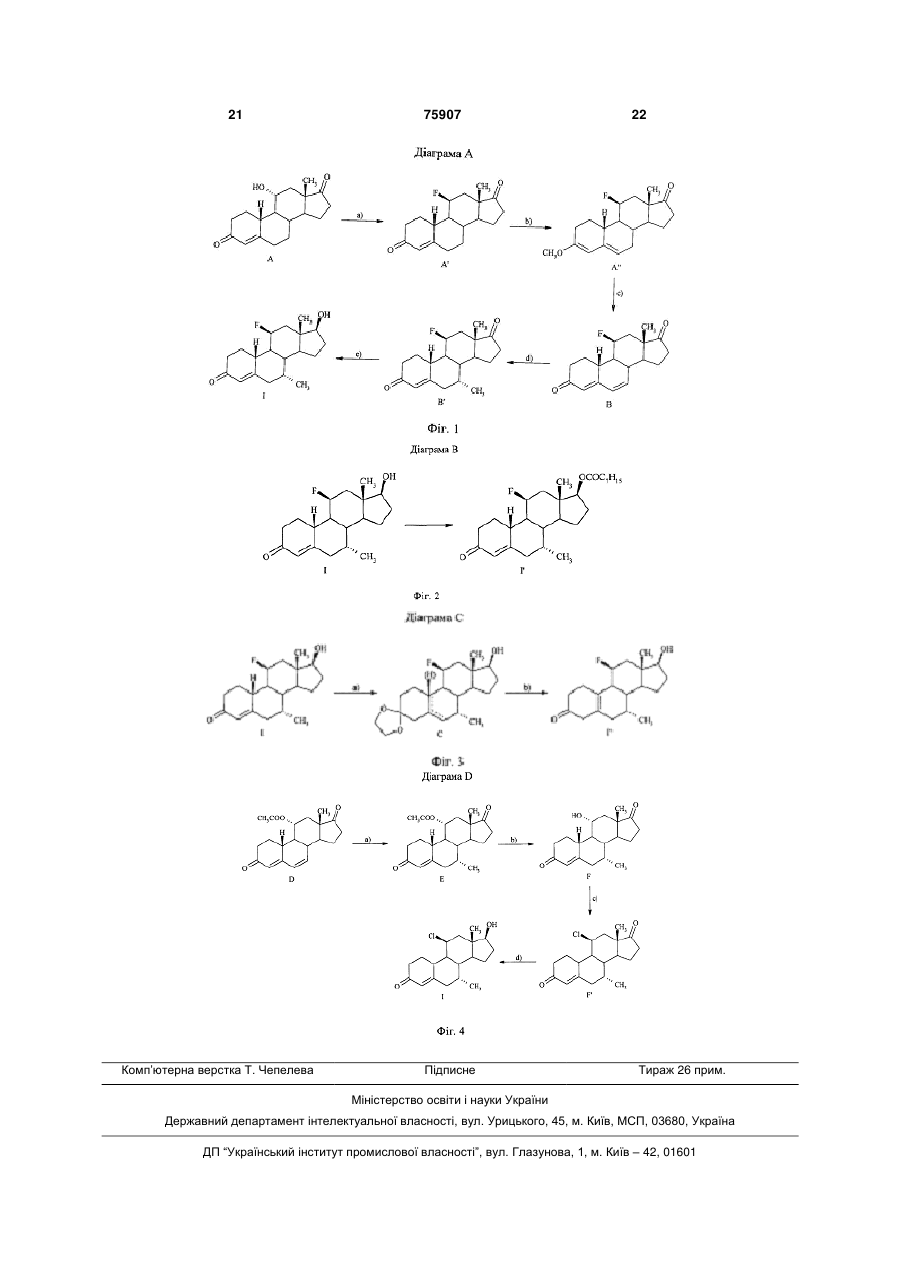
1. 11 -Галогеностероїди загальної формули I 2 (19) 1 3 75907 4 спочатку одержують сполуку загальної формули 17 -гідрокси-11 -йод-7 -метилестр-4-ен-3-он, Б′,Д 7 -етил-11 -фтор-17 -гідроксіестр-4-ен-3-он, R13 O 11 -фтор-7 -(фторметил)-17 -гідроксіестр-4-енR11 H 3-он, Б', Д, 11 -фтор-17 -гептаноїлокси-7α-метилестр-4-ен3-он, O R7 11 -фтор-7 -метил-17β-ундеканоїлоксиестр-4а потім цю сполуку або селективно відновлюють з ен-3-он, утворенням сполуки загальної формули I, або, 11 -фтор-17 -гідрокси-7 -метилестр-5(10)-ен-3якщо R11 не є галогеном, вводять у реакцію нуклеон. офільного заміщення в 11-положенні з галогеную9. Спосіб одержання 11 -галогеностероїдів загачим агентом, а потім селективно відновлюють з льної формули I за будь-яким з пп. 1-8, у якому із утворенням сполуки загальної формули I: сполуки загальної формули Б, Г R13 OH 11 R11 H R R13 O H Б, Г, O R7 де R означає гідроксил, галоген або нуклеофільну групу, що відходить, а R13 має значення, вказані вище, за реакцією 1,6-приєднання з метальованим алкілом формули R7-M або R7-M'X, де М означає лужний метал, M' означає лужноземельний метал, Х означає галоген, а R7 має значення, вказані вище, І. 10. Застосування 11 -галогеностероїдів за будьяким з пп. 1-8 як активного компонента фармацевтичної композиції. 11. Фармацевтичний препарат, який містить щонайменше один 11 -галогеностероїд за будь-яким з пп. 1-8, а також щонайменше один фармацевтично прийнятний носій. Винахід відноситься до 11β-галогеностероїдів, їх одержання і застосування для одержання фармацевтичних агентів, фармацевтичних препаратів, що містять 11β-галогеностероїди, а також до застосування деяких похідних 11β-стероїдів в якості складової частини сполук, що мають андрогенну дію. Андрогени, насамперед тестостерон, використовуються при терапії чоловічої менопаузи і для розвитку чоловічих статевих органів, а також для регулювання репродуктивної функції у чоловіків. Крім того, ці гормони частково включають анаболічно активні компоненти, що стимулюють, поряд з іншим, ріст м'язової маси. Для чоловічої менопаузи характерно залежне від віку зниження продукування ендогенного андрогену, для лікування якого використовують гормон-замісну терапію (ГЗТ). Введення рилізинг-фактора лютеїнізуючого гормону (РФ-ЛГ) з метою регулювання репродуктивної функції у чоловіків приводить, поряд зі зниженням сперматогенезу, до вивільнення ЛГ, зниження рівня тестостерону і лібідо, що компенсується введенням фармацевтичних агентів, що містять тестостерон [D.E.Cummings і ін., Prostate-Sparing Effects of the Potent Androgen 7αMethyl-19-Nortestosterone: A Potential Alternative to Testosteron for Androgen Replacememnt and Male Contraception, Journal of Clinical Endocrinology and Metabolism, т.83, №12, c.4212-4219(1998)]. Композиції, що включають андроген і прогестерон, можна використовувати для регулювання репродуктивної функції у чоловіків [див., наприклад, WO 01/60376 і джерела, цитовані в тексті заявки]. Встановлено, що лікування тестостероном супроводжується побічними діями, насамперед гіпертрофією передміхурової залози за рахунок росту чисельності клітин і залоз строми (доброякісна гіперплазія передміхурової залози, ДГПЗ). У процесі метаболізму тестостерону за участі 5αредуктази може утворюватися дигідротестостерон (ДГТ), що дійсно спостерігається при ДГПЗ [Cummings і ін., WO 99/13883 А1]. У зв'язку з цим у клінічній практиці для лікування ДГПЗ застосовують інгібування 5α-редуктази (фінастериди). Крім того, висока швидкість метаболічної трансформації андрогенного стероїду тестостерону в організмі людини з утворенням небажаного ДГТ викликає необхідність перорального введення більш високих доз з метою досягнення необхідного рівня тестостерону. Тому доводиться використовувати альтернативні форми введення, такі, як внутрішньом'язові ін'єкції або пластири великого розміру. При вищевказаних показаннях замість тестостерону пропонується використовувати 7α-метил19-нортестостерон (МеНТ), що має більш високу ефективність у порівнянні з тестостероном завдяки більш високій спорідненості до андрогенних рецепторів. Разом з тим передбачається, що завдяки стеричному інгібуванню за рахунок 7αметильної групи МеНТ більш стійкий до метаболічної трансформації під дією 5α-редуктази [Cummings і ін., WO 99/13883 А1, WO 99/13812 А1, US-A-5342834]. У процесі метаболізму тестостерону незначна частина цієї сполуки трансформується за рахунок O 11 5 75907 6 ароматизації кільця А стероїдної системи з утворенням естрадіолу, насамперед у тканині мозку, печінки і жировій тканині. З погляду загальної дії тестостерону і його метаболітів, естрадіол в основному відповідає за поведінку, залежну від статі, і регуляцію гонадотропіну. Отже, його дію, як і дію тестостерону на дорослих чоловічих індивідів, і 11β-галогеноестр-4-ен-3-ону формули: прийнято вважати сприятливою (Cummings і ін., див. вище). Однак встановлено, що тестостерон характеризується незадовільною фармакокінетикою. Тестостерон, насамперед при пероральному введенні, швидко виводиться з організму, і, отже, ефективність і тривалість дії отриманих у такий спосіб фармацевтичних агентів є незадовільною. Отже, були синтезовані інші похідні тестостерону. У дійсному винаході насамперед пропонуютьТакі похідні, описані, [наприклад, у US-A-5952319], ся андрогенні стероїди загальної формули І насамперед включають 7α,11β-диметилпохідні 19нортестостерону, а саме, 7α,11β-диметил-17βгідроксиестр-4-ен-3-он, 7α, 11β-диметил-17βгептаноілоксиестр-4-ен-3-он, 7α, 11β-диметил-17β[[(2-циклопентилетил)карбоніл]окси]естр-4-ен-3-он, 7α, 11β-диметил-17β-(фенілацетокси)естер-4-ен-3он і 7α, 11β-диметил-17β-[[(транс-4-[нбутил]циклогексил)карбоніл]окси]естр-4-ен-3-он. Вказані 7α,11β-диметилпохідні мають ті ж педе X-Y-Z означає групу СН=С-С або СН2-С=С, реваги, що і МеНТ, включаючи поліпшену фармаR1 може знаходитися в а- або в β-положенні і кокінетику, тобто мають більш високу ефективність означає водень, R або групу P-Q-R, що зв'язана зі і тривалість дії в порівнянні з тестостероном. Одстероїдною циклічною системою через групу Р, нак синтез вказаних похідних коштує дорого. причому Ρ і Q означають прямі або розгалужені, Об'єктом винаходу є похідні тестостерону, які необов'язково частково або повністю фторовані стійкі до відновлення 5α-редуктазою, що мають групи С1-С8алкілен, С1-С8алкенілен, С1поліпшені фармакокінетичні властивості в порівС8алкінілен, причому вказані групи можуть бути нянні з 7α-метил-19-нортестостероном і які можна однаковими або різними, a R означає радикал СН3 синтезувати більш простим способом у порівнянні або CF3, за умови, що Ζ не містить замісник R1, з 7α,11β-диметилпохідними. Ціль винаходу досяякщо Φ-Υ-Ζ означає групу СН2-С=С, гається завдяки одержанню 11β-галогеностероїдів R6 означає водень або може мати значення, за пунктом 1, застосуванню 11β-галогеностероїдів вказані для R7, як складової частини сполук, що мають андрогенR7 означає R або групу P-Q-R, зв'язану зі стену дію за пунктом 9, а також завдяки способу одероїдною циклічною системою через групу Р, приржання цих сполук за пунктом 10 і застосуванню чому ці групи мають значення, вказані вище, зазначених стероїдів для одержання фармацевтиR11 означає галоген, чних засобів за пунктом 11 і фармацевтичних преR13 означає метил або етил, паратів за пунктом 12. R17 означає водень або C(O)-R18, де R18 ознаКращі варіанти здійснення винаходу предстачає прямий або розгалужений радикал С1влені в залежних пунктах формули винаходу. С18алкіл, С1-С18алкеніл, С1-С18алкініл або радикал 11β-Галогеностероїди згідно дійсному винахоарил, або групу T-U-V, зв'язану з С(О) через групу ду, що пропонуються як складові частини сполук з Т, де Τ і U означають прямі або розгалужені групи андрогенною активністю, мають наступну основну С1-С18алкілен, С1-С18алкенілен, С1-С18алкінілен, структуру: С3-С12аліциклічні групи або групи арил, і є однаковими або різними, а V означає прямий або розгалужений радикал С1-С18алкіл, С1-С18алкеніл, С1С18алкініл або радикал арил, або R18 має одне із значень, вказаних вище, і, крім того, заміщений однією або більше групами NR19R20 або однією або більше групами SOхR21, де х дорівнює 0, 1 або 2, a R19, R20 і R21 у кожному випадку означають водень або групу T-U-V, зв'яде Φ-Υ-Ζ означає групу СН=С-С або СН2-С=С, зану з N, S через групу Т, що має значення, вказаінші зв'язки в кільці А є насиченими, R7 і R13 не 11 не вище, означають водень, a R означає галоген. і їх фізіологічно прийнятні кислотно-адитивні В інших положеннях стероїдної циклічної солі органічних і неорганічних кислот. системи можуть відповідно знаходитися інші заміГрупа R11 переважно означає фтор, однак в сники, включаючи водень. іншому варіанті може означати хлор, бром або Крім того, винахід власне кажучи відноситься йод. до наступних двох основних структур, а саме 11βГрупа R6 насамперед означає водень, метил, галогеноестр-5(10)-ен-3-ону формули: 7 75907 8 етил або фторметил, переважно водень. 11β-фтop-7α-(фтopмeтил)-17β-гiдpoкcиecтp-4Група R7 насамперед означає метил, етил або eн-3-oн, фторметил, переважно метил. 11β-фтор-17β-гептаноілокси-7α-метилестр-4R1 насамперед означає водень, наприклад, в ен-3-он, похідному 19-нортестостерона. Однак R1 може 11β-фтop-7α-мeтил-17β-yндeкaнoiлoкcиecтp-4також означати метил, етил, пропіл або бутил або eн-3-oн, фтор- або насамперед перфторпохідні вказаних 11β-фтор-17β-гідрокси-7α-метилестр-5(10)-енрадикалів. 3-он. R13 означає метил або етил, насамперед меДля одержання фармацевтичних агентів натил. самперед придатні вказані 11β-галогеностероїди R17 переважно означає водень або C(O)-R18, загальної формули І. де R18 означає радикал алкіл з прямим або розгаКрім того, винахід відноситься до фармацевлуженим ланцюгом. Коли R18 у складі групи C(O)тичних препаратів, які містять щонайменше один R18 (одного зі значень R17) означає алкіл, приклади фармацевтично прийнятний носій у суміші з щорадикала алкіл включають метил, етил, пропіл, найменше одним вказаним 11βбутил, пентил, гексил, октил, ноніл, децил, ундегалогеностероїдом. цил, додецил, тридецил, тетрадецил, пентадецил, 11β-Галогеностероїди загальної формули І згігексадецил, гептадецил і октадецил, а також радидно винаходу представляють собою сполуки, що кали з прямим або розгалуженим ланцюгом, такі, мають сильну андрогенну дію і не викликають вкаяк ізопропіл, ізобутил, трет-бутил, ізопентил, третзаної побічної дії, такої наприклад, як стимуляція пентил і неопентил, насамперед переважно гекпередміхурової залози (насамперед доброякісної сил, гептил, октил, ноніл та децил. гіперплазії передміхурової залози). Крім того, ці Якщо R18 означає алкеніл, то насамперед R сполуки можна легко синтезувати. Встановлено, означає етеніл, а також 1- або 2-пропеніл. Якщо що 11β-галогеностероїди можна використовувати R18 означає алкініл, то передусім R18 означає етине тільки для гормон-замісної терапії чоловічих ніл, а також 1- або 2-пропініл. захворювань, але й у якості ефективних чоловічих Якщо R18 означає групу T-U-V, то насамперед контрацептивів у відсутності інших активних інгреR18 означає метиленциклогексил, зв'язаний з грудієнтів, причому при тому дозуванні, яке є достатпою CO через метиленову групу, або етиленцикнім для зниження в крові рівнів ЛГ (лютеїнізуючого логексил, зв'язаний з групою CO через етиленову гормону), тестостерону і ФСГ (фолікулостимулююгрупу в 1 або 2 положенні. чого гормону), які у достатній кількості продукуПрямий вуглецевий ланцюг у групах P-Q-R і Tються в організмі. Рівні зазначених гормонів залеU-V може включати до 22 атомів вуглецю. жать від 11β-галогеностероїдів згідно винаходу, Арильні радикали в складі групи C(O)-R18 нащо інгібують вивільнення ЛГ і ФСГ. ЛГ стимулює самперед можуть означати феніл, 1-нафтил або 2клітини Лейдіга, що секретують тестостерон. При нафтил. Аналогічним чином, аралкільні радикали в низькому рівні ЛГ знижується також вивільнення групі T-U-V можуть означати бензил, фенілетил, ендогенного тестостерону. Тестостерон необхідфенілпропіл, нафтилметил і нафтилетил. ний для сперматогенезу, у той час як ФСГ стимуАналогічним чином, арил в складі групи C(O)лює статеві клітини. Отже, для ефективного сперR може означати гетероарил. Приклади радикалів матогенезу необхідний високий рівень у крові ФСГ гетероарил включають 2-, 3- і 4-піридиніл, 2- і 3і ЛГ, причому досить високий рівень ЛГ викликає фурил, 2- і 3-тієніл, 2- і 3-піроліл, 2-, 4- і 5вивільнення тестостерону, який необхідний для імідазоліл, піридазиніл, 2-, 4- і 5-піримідиніл, а тасперматогенезу. кож 2- і 4-піридазиніл. Оскільки терапія одними 11βКрім того, якщо R18 заміщений групою NR19R20, галогеностероїдами у відсутності додаткових акто R18 може означати метиламіно, диметиламіно, тивних інгредієнтів з метою стерилізації може заетиламіно, диетиламіно, циклогексиламіно, дицикбезпечити ефективну контрацепцію у чоловіків, логексиламіно, феніламіно, дифеніламіно, бензипроцедуру введення придатного фармацевтичного ламіно або дибензиламіно. агента можна зробити істотно більш простою і при У цьому випадку об'єкт винаходу включає тацьому значно знизити вартість лікування. кож фізіологічно прийнятні кислотно-адитивні солі 11β-Галогеностероїди згідно даного винаходу органічних і неорганічних кислот. Придатними фіможна також застосовувати для регулювання резіологічно прийнятними кислотно-адитивними сопродуктивної функції у чоловіків в комбінації з пролями є солі неорганічних кислот, такі, як гідрохлогестероном. риди, гідроброміди, і органічних кислот, такі, як Крім того, 11β-галогеностероїди згідно винаацетати, цитрати, оксалати, тартрати і метансуходу ефективно інгібують 5α-редуктазу і стероїдльфонати. 11-гідроксилазу [CYP11B (P450c11), G.Zhang, Кращими 11β-галогеностероїдами є наступні W.L.Miller, Journal of Clinical Endocrinology and сполуки: Metabolism, т.81, с.3254-3256 (1996)], що дозволяє, 11β-фтор-17β-гідрокси-7α-метилестр-4-ен-3наприклад, вибірково виключити стимуляцію пеон, редміхурової залози. Крім того, ці сполуки мають 11β-хлор-17β-гідрокси-7α-метилестр-4-ен-3-он, покращені фармакокінетичні властивості. Інгібу11β-бром-17β-гідрокси-7α-метилестр-4-ен-3ваннястероїд-11-гідроксилази приводить до гальон, мування інактивації андрогенних сполук і зниження 11β-гідрокси-11β-йод-7α-метилестр-4-ен-3-он, їх виведення з організму. У результаті підвищуєть7α-етил-11β-фтор-17β-гідроксиестр-4-ен-3-он, ся ефективність і тривалість дії цих сполук у порів 9 75907 10 нянні з відомими сполуками, насамперед при пеОпис методу. У кастрованих статевонезрілих роральному введенні. самців щура фармакологічно активні агоністи андУ зв'язку з вищевикладеним ці сполуки насамрогенів стимулюють ріст передміхурової залози, перед придатні для регулювання репродуктивної сім'яних пухирців (андрогенні властивості) і м'яза, функції у чоловіків, а також для андроген-замісної що піднімає анус (анаболічні властивості). Для терапії при одночасному зниженні тенденції відновизначення андрогенних і анаболічних властивосвлення в 5α-положенні, при одночасному утворентей eF-MENT статевонезрілим кастрованим самні ароматичного циклу з одержанням естрогенних цям щура протягом семи днів один раз на добу стероїдів і при сприятливому впливі на сироваткові вводили сполуку А (11β-фтор-17β-гідрокси-7αліпіди і центральну нервову систему. метилестр-4-ен-3-он, різні дози), сполуку Б (ТаАндрогенна дія і відсутність зазначеної вище метил-і^нортестостерон, різні дози), пропіонат побічної дії підтверджується в експериментах in тестостерону (контрольна сполука) і бензилбензоvivo на щурах. ат/рицинова олія (розчинник і контрольна сполуАнаболічна і андрогенна активність в організмі ка), відповідно. Потім визначали відносну масу статевонезрілих самців щурів передміхурової залози, сім'яних пухирців і м'яза, Як метод аналізу андрогенних властивостей що піднімає анус. сполук згідно винаходу використовували метод (Hershberger, LG, Shipley, EG, Meyer, RK Hershberger та ін. (1953). (1953). Міотрофну активність 19-нортестостерона Принцип методу. Функція і розміри вторинних та інших стероїдів визначали модифікованим мерепродуктивних залоз (сім'яних пухирців, передмітодом на м'язі, що піднімає анус. Proc. Soc. Exp. хурової залози) і м'язів (наприклад, м'яза, що підBiol. Med., 83, 175-180). німає анус) є андроген-залежними. Кастрація приПорівняння активності сполуки А (11β-фторводить до атрофії цих органів, заміщення 17β-гідрокси-7α-метилестр-4-ен-3-она) і сполуки Б андрогенними сполуками стимулює їх ріст і функ(7α-метил-19-нортестостерона). цію дозо-залежним чином. Передміхурова заліза: Доза Сполука А Сполука Б мг·кг-1·добу-1 Відносна маса [мг/100г] Стимуляція [середнє] Відносна маса [мг/100г] Стимуляція [середнє] 0,005 8,9 4,3 0,015 19,7/18,5 30,0 14,6/20,0 24,0 0,03 25,2 40,1 0,05 34,1 76,6 24,7/31,7 51,3 0,15 44,9/47,5/41,7 93,8 40,6 90,2 0,3 59,5 125,1 1,5 64,6 137,3 Тварини: статевонезрілі щури ORX, тривалість терапії: 7 діб Сім'яні пухирці: Доза Сполука А Сполука Б мг·кг-1·добу-1 Відносна маса [мг/100г] Стимуляція [середнє] Відносна маса [мг/100г] Стимуляція [середнє] 0,005 9,2 4,6 0,015 18,6/15,5 18,6 13,6/19,20 17,0 0,03 26,8 35,6 0,05 43,6 59,2 36,8/39,0 51,8 0,15 57,9/64,4/49,3 85,5 65,5 87,8 0,3 93,4 144,8 1,5 120,0 189,3 Тварини: статевонезрілі щури ORX, тривалість терапії: 7 діб М'яз, що піднімає анус: Доза Сполука А Сполука Б мг·кг-1·добу-1 Відносна маса [мг/100г] Стимуляція [середнє] Відносна маса [мг/100г] Стимуляція [середнє] 0,005 36,6 71,3 0,015 54,9 / 50,8 79,5 38,1 /53,7 92,6 0,03 56,5 93,3 0,05 59,4 118,0 48,1/59,4 150,7 0,15 64,7 / 63,67 1,7 154,5 59,4 283,4 0,3 69,8 180,4 1,5 69,9 181,0 Тварини: статевонезрілі щури ORX, тривалість терапії: 7 діб При аналізі зазначеним методом сполука А, представник сполук згідно винаходу, має профіль активності, сумірний зі сполукою Б, відомою з рівня техніки, що свідчить про те, що сполуки згідно 11 75907 12 винаходу можна використовувати аналогічно відопацієнта й одночасного введення інших фармацемим сполукам. втичних препаратів. Стабільність у мікросомах печінки Якщо метою терапії є контрацепція, то 11βМетаболічну стабільність сполук випробували галогеностероїди вводять у більш високій дозі, в мікросомах печінки різних видів комерційних щоб рівень у крові ЛГ і ФСГ у кожному випадку тварин. При використанні біологічного матеріалу з складав максимально 2,5МО/мл (МО означає міжорганізму людини можна прогнозувати першу станародну одиницю), насамперед максимально дію метаболізму в організмі людини. Швидка де1,0МО/мл, а рівень у крові тестостерону складав градація матеріалу, який аналізують, свідчить про максимально 10нмоль/л, насамперед 3нмоль/л. низку біодоступність сполук, які аналізують, при Якщо сполуки згідно винаходу використовують пероральному введенні. з метою гормон-замісної терапії без стимуляції Мікросоми, виділені з різних видів, інкубували контрацепції, дози є більш низькими. У цьому вив присутності сполук, які аналізують, щонайменше падку прагнуть створити такий рівень (активного при двох концентраціях протягом двох проміжків агента) у крові, щоб можливі рівні в крові ЛГ і ФСГ часу при сумірній метаболічній активності (фермескладали, відповідно, більше 2,5МО/мл, а тестоснти комплексу цитохром Р450). Проміжки часу відтерону більше 10нмоль/л. повідають часу деградації контрольних сполук. Дози 11β-галогеностероїдів згідно винаходу, Кількість сполуки, що залишилася, розраховували необхідні для підтримання в крові відповідного при порівнянні з вихідною кількістю (на час 0хв.) рівня ЛГ, ФСГ і тестостерону, залежать від ряду При відповідному проведенні експерименту факторів і, отже, повинні визначатися в залежності можна одержати дані про першу фазу метаболізму від способу введення. По-перше, доза природним і про ізоферменти CYP, що приймають участь у чином залежить від типу терапії. Якщо сполуки цьому процесі. Якщо до мікросомів печінки додати використовують для чоловічої контрацепції, то додаткові речовини, то поряд з першою фазою варто призначати більш високі дози, ніж у випадку метаболізму можна спостерігати стадію гліколізації гормон-замісної терапії. Крім того, дози залежать глюкуроновою кислотою (глюкуронідування), тобто від типу 11β-галогеностероїда і його біодоступносдругу фазу метаболічної трансформації. ті. Спосіб застосування залежить також від кількоВидоспецифічна стабільність сполук, які анасті агента, що вводиться. Нарешті, доза також залізують, у печінці при концентрації 3мкМ лежить від статури пацієнта, що підлягає лікуванню, і інших факторів, наприклад, від одночасного застосування інших фармацевтичних преСполука А Сполука Б паратів. (залишок у %) (залишок у %) Види тваСполуки можна вводити пероральним або парин Через Через Через Через рентеральним способом, наприклад, внутрішньо30хв. 60хв. 30хв. 60хв. черевинним, внутрішньовенним, внутрішньом'язоЛюдина 37 19 59 41 вим або черезшкірним способом. Крім того, Миша 4 4 20 11 сполуки можна імплантувати у тканини. Кількість щур 4 6 5 7 сполук, що підлягають введенню, якщо їх вводять в ефективній кількості, може змінюватися в широМетаболічна стабільність сполуки А, предстаких межах. Кількість сполуки, що підлягає введенвника сполук згідно даному винаходу, є більш виню, може змінюватися в широких межах у залежсокою у порівнянні із сполуками, відомими з рівня ності від стану хворого, необхідного результату техніки. лікування і способу введення. Для людини добова Сполуки згідно винаходу або фармацевтичні доза складає від 0,1мг до 100мг, краща добова препарати згідно винаходу, що містять ці сполуки, доза складає від 0,1мг до 10мг. Тривалість лікунайкраще придатні для терапії повноцінних (не вання залежить від цілі лікування. стерильних) пацієнтів чоловічої статі, а також самПридатними лікарськими формами є капсули, ців інших ссавців. Терапія з метою контрацепції пігулки, таблетки, таблетки в оболонці, креми, маприводить до того, що чоловіки стають стерильзі, лосьйони, рідини, такі, як сиропи, гелі, ін'єкційні ними тільки тимчасово. Після завершення терапії розчини, наприклад, для внутрішньочеревинної, активними інгредієнтами згідно винаходу або фавнутрішньовенної, внутрішньом'язової або підшкірмацевтичними препаратами, відновлюється порної ін'єкції і т.п., включаючи лікарські форми, що чатковий стан організму, тобто пацієнт, що пройвивільняють сполуки згідно винаходу в організмі шов терапію, більше не є стерильним і пацієнта поступово або відразу за короткий час у сперматогенез відновлюється до колишнього рівзалежності від типу лікарської форми. ня. Для підтримання тимчасової стерильності на Як фармацевтичні препарати для пероральнопостійному рівні протягом необхідного періоду го введення використовують капсули, пігулки, табчасу активний інгредієнт або препарат вводять у летки, таблетки в оболонці і рідини або інші відомі безперервному режимі, причому введення в залеформи для доставки пероральним способом. У жності від форми введення здійснюють щодня цьому випадку фармацевтичні препарати можна через короткі інтервали або ж періодично через приготувати таким чином, щоб вивільнення і досбільш тривалі інтервали. Після завершення однотавка в організм активних інгредієнтів відбувалися разового або повторного введення активного інгза короткий час, або щоб вони спричиняли депоредієнта або препарату повноцінний стан пацієнта нуючу, тобто пролонговану дію завдяки повільнонеобов'язково відновлюється не відразу, а тільки му вивільненню активного інгредієнта в організмі поступово, причому час реабілітації залежить від пацієнта. Разом з 11β-галогеностероїдом стандарряду факторів, наприклад, від дозування, статури 13 75907 14 тні форми можуть містити один або більше фаррганічну смолу. 11β-Галогеностероїди можна тамацевтично прийнятних носіїв, наприклад, речокож включити, наприклад, у пластир для черезшківин, що регулюють реологічні властивості фармарної доставки. цевтичного препарату, ПАР, солюбілізуючих 11β-Галогеностероїди згідно винаходу синтеагентів, мікрокапсул, мікрочастинок, гранулятів, зують різними методами. Два таких методи проірозріджувачів, зв'язуючих речовин, таких, як крохлюстровані нижче на конкретних прикладах. маль, сахароза, сорбіт і желатин, а також наповІз сполуки загальної формули Б, Г, нювачів, таких, як кремнієва кислота і тальк, змащуючих речовин, барвників, ароматизаторів та інших речовин. 11β-Галогеностероїди згідно винаходу насамперед можна приготувати у вигляді розчину, що призначений для перорального введення і який разом з активним 11β-галогеностероїдом містить де R11 означає гідроксил, галоген або нуклеофармацевтично прийнятну олію і/або фармацевфільну групу, що відходить, a R13 має значення, тично прийнятну ліпофільну ПАР і/або фармацеввказані вище, за реакцією 1,6-приєднання з метатично прийнятну гідрофільну ПАР і/або фармацевльованим алкілом формули R7-M або R7-M'X, де Μ тично прийнятний розчинник, що змішується з означає лужний метал, М' означає лужноземельводою. Подібні композиції [описані в WO-Aний метал, X означає галоген, a R7 має значення, 97/21440]. вказані вище, спочатку одержують сполуку загальДля покращення біодоступності стероїду можної формули Б', Д на також приготувати клатрати сполук з циклодекстрином. Для цього сполуки вводять у реакцію з α-, β- або γ-циклодекстрином або його похідними (РСТ/ЕР95/02656). Необхідні креми, мазі, лосьйони і рідини для введення місцевим способом готують таким чином, щоб сполуки згідно винаходу надходили в організм у достатній кількості. Ці форми доставки містять ад'юванти, наприклад, сполуки, що регулюють реологічні властивості фармацевтичних препаратів, ПАР, консерванти, солюбілізуючі агенти, розріджувачі, речовини, що сприяють усмоктуванню стероїдів згідно винаходу через шкіру, барвники, ароматизатори і засоби захисту шкіри, такі, як кондиціонери і зволожувачі. Разом із стероїдами згідно винаходу фармацевтичний препарат може містити інші активні інгредієнти. Для парентерального введення активні інгредієнти розчиняють або суспендують у фізіологічно прийнятному розріджувачі. Як розріджувач часто використовують масла без добавок або в суміші із солюбілізуючим агентом, ПАР, суспендуючим агентом або емульгатором. Приклади масел, які застосовують включають маслинову олію, арахісове масло, бавовняну олію, соєву олію, касторову олію і кунжутну олію. Для виготовлення ін'єкційного препарату можна використовувати будь-який рідкий носій, у якому сполуки згідно винаходу розчиняються або утворюють емульсії. Такі рідини часто містять речовини, що регулюють в'язкість, ПАР, консерванти, солюбілізуючі агенти, розріджувачі та інші добавки, що додають розчинові ізотонічні властивості. Разом з 11β-галогеностероїдами розчин може також містити інші активні інгредієнти. 11β-Галогеностероїди можна вводити у формі ін'єкції для уповільненого усмоктування або імплантованого препарату, наприклад, підшкірним способом, причому препарат можна приготувати таким чином, що він буде забезпечувати повільне вивільнення активних інгредієнтів. Нарешті, можна використовувати відомі способи, наприклад, створення депо, що розчиняється або взаємодіє з мембраною. Як інертні матеріали імплантати можуть містити біодеградуємі полімери або синтетичні кремнійорганічні сполуки, наприклад кремнійо а потім цю сполуку або селективно відновлюють з утворенням сполуки загальної формули І, або, якщо R11 не є галогеном, вводять в реакцію нуклеофільного заміщення в 11-положенні з галогенуючим агентом, а потім селективно відновлюють з утворенням сполуки загальної формули І: У цьому синтезі вихідною сполукою є перший варіант сполуки А, наприклад, 11β-гідрокси- 19норандрост-4-ен-3,17-діон (J.de Flines і ін., Recl. Trav. Chim. Pays-Bas, т.82, с.129 ff. (1963)): У 11 α-гідрокси- 19-норандрост-4-ен-3,17-діоні R11 означає ОН, a R13 означає метил. На першій стадії сполука А (де R11 означає ОН) спочатку взаємодіє з галогенгідроксилюючим реагентом, наприклад, фтористоводневою кислотою, хлористоводневою кислотою, бромистоводневою кислотою або йодистоводневою кислотою, тіонілхлоридом або тіонілбромідом, пентахлоридом фосфору, оксихлоридом фосфору, Nхлорсукцинімідом, трифенілфосфіном/чотирихлористим вуглецем, HF/піридином або трифторидом діетиламіносірки, або переважно з нонафлілфторидом/1,5діазабіцикло[5.4.0]ундеценом, з утворенням галогенонорандростендіону, а саме 11β-гідрокси-19норандрост-4-ен-3,17-діону загальної формули А', 15 75907 зазначеної вище (R11 означає галоген). Потім у сполуку вводять Δ6-подвійний зв'язок, наприклад, систему 3-кето-Δ4 спочатку в умовах протонного каталізу перетворюють у простий ефір 3,5-дієн-3-ола А" де Hal означає F, СІ, Вr, І, а потім зі сполуки А", наприклад, бромуванням/дегідробромуванням, насамперед при взаємодії з N-бромсукцинімідом або 1,3-дибром-5,5-диметилгідантоіном з наступною обробкою піридином або бромідом літію/карбонатом літію, одержують Δ4,6-кетон загальної формули Б. Потім сполуку Б алкілують у положенні 7 за реакцією 1,6-приєднання метальованого алкілу, наприклад, метилмагнійброміду або метиллітію, при каталізі міддю, з утворенням сполуки Б'. На наступній стадії отриманий 7α-алкіл-11βгалогеннорандрост-4-ен-3,17-діон Б' обробляють боргідридом натрію при низьких температурах, наприклад, у ТГФ або діетиловому ефірі, з метою вибіркового відновлення 17-кетона. При цьому одержують сполуку згідно винаходу формули І, 7Δалкіл-11β-галоген-17β-гідроксинорандрост-4-ен-3он. 16 Для одержання інших 11β-галогеностероїдів формули І", а саме 7α-алкіл-11β-галоген-17βгідроксинорандрост-5(10)-ен-3-онів, Δ4-3кетогруппу в сполуці І спочатку перетворюють у кеталь з одержанням суміші ізомерних кеталей В з подвійним зв'язком Δ5- і Δ5(10)-. Отриману суміш обережно декеталізують і розділяють отримані ізомери, при цьому одержують 7α-алкіл-11β-галоген-17β-гідроксинорандрост5(10)-ен-3-они формули І" згідно винаходу. В іншому способі синтезу сполук формули І вихідну сполуку, 11α-ацетокси-19-норандрост-4,6дієн-3,17-діон формули Γ (CAS: 228570-21-6) де R13 означає метил, вводять у реакцію 1,6приєднання, що каталізується міддю, з металалкілом, таким, наприклад, як метилмагнійбромід або метиллітій, наприклад, у ТГФ або діетиловому ефірі, при низькій температурі, з утворенням сполук загальної формули Д. Потім 17-гідроксигруппу необов'язково етерифікують ацилангідридами або ацилхлоридами, наприклад, ацетилхлоридом, бутаноілхлоридом або енантоілхлоридом, в присутності відповідної основи, такої, наприклад, як піридин. При цьому одержують відповідні складні ефіри формули I' згідно винаходу. Потім сполуку Д гідролізують, наприклад, розчином КОН в метанолі, з одержанням 11βгідроксипохідних формули Е. 17 Отримані сполуки вводять в реакцію з галогенгідроксилюючими реагентами, наприклад, фтористоводневою кислотою, хлористоводневою кислотою, бромистоводневою кислотою або йодистоводневою кислотою, тіонілхлоридом або тіонілбромідом, пентахлоридом фосфору, оксихлоридом фосфору, N-хлорсукцинімідом, трифенілфосфіном/чотирихлористим вуглецем, HF/піридином або трифторидом діетиламіносірки або переважно з нонафлілхлоридом/1,5діазабіцикло[5.4.0]ундеценом, з утворенням 7αaлкiл-11β-гaлoгeн-17β-гідроксинорандрост-4-ен3,17-діону, який потім селективно відновлюють у положенні 17 боргідридом натрію при низькій температурі, наприклад у ТГФ або діетиловому ефірі, з утворенням 7α-алкіл-11β-галоген-17βгідроксиандрост-4-ен-3-ону формули І. Нижче винахід пояснюється на прикладах. Приклад 1 Одержання 11β-фтор-17β-гідрокси-7αметилестр-4-ен-3-οна (сполука формули І) (Схема А, Фіг.1) а) 11β-Фторестр-4-ен-3,17-діон (А') До 5,0г 11β-гідроксиестр-4-ен-3,17-діону (A) (J. de Flines і ін., Reel. Trav. Chim. Pays-Bas, т.82, с. 129 ff. (1963)) у 100мл толуолу і 7,3мл 1,8діазабіцикло[5.4.0]ундец-7-ена при 0°С додавали по краплях 4,6мл фторангідриду перфторбутан-1сульфокислоти. Через 30хв. розчин розбавляли етилацетатом, промивали сольовим розчином, сушили і концентрували упарюванням у вакуумі. Неочищений продукт очищали хроматографією на силікагелі (елюент: градієнт гексан/етилацетат), при цьому одержували 3,8 г 1ір-фторестр-4-ен3,17-діону (А'). tпл.173-174°С. б) 11β-Фтор-3-метоксиестр-4-ен-3,17-он (А") 7,8г 11β-Фторестр-4-ен-3,17-діона (А') і 780мг толуол-4-сульфоната піридинію в 40мл 2,2диметоксипропану перемішували при 80°С протягом 5 годин, а потім додавали 1,5мл триетиламіну. Реакційну суміш розбавляли етилацетатом і промивали сольовим розчином. Продукт кристалізували з метанолу, при цьому одержували 5,3г 11βфтор-3-метоксиестр-4-ен-3,17-ону (A"). tпл..173°C. в) 11β-Фторестра-4,6-дієн-3,17-діон (Б) До 5,0г 11β-фтор-3-метоксиестра-3,5-дієн-17она (А") у 50мл ДМФА при 0°С додавали 5мл 10мас.% розчину ацетату натрію, а потім порціями додавали 2,5г 1,3-дибром-5,5-диметилгідантоїну. Через 30 хвилин додавали 2,3г сульфіту натрію, а потім 2,5г броміду літію і 2,0г карбонату літію і перемішували при 100°С протягом 2 годин. Реакційну суміш перемішували в крижаній воді. Осад відокремлювали фільтруванням у вакуумі, розчиняли в етилацетаті, отриманий розчин промивали водою, сушили і концентрували упарюванням у вакуумі. Продукт перекристалізували з етилацетату, при цьому одержували 3,6г 11β-фторестра-4,6-дієн3,17-діона (Б). tпл. 198°С. 75907 18 г) 11β-Фтор-7α-метилестр-4-ен-3,17-діон (Б') До розчину 2г 11β-фторестра-4,6-дієн-3,17діона (Б) у 36мл тетрагідрофурану при кімнатній температурі додавали 68,7мг хлориду міді (І). Реакційну суміш охолоджували до -15°С, перемішували протягом 10хв., додавали 427г хлориду алюмінію, перемішували при вказаній температурі протягом 30хв., додавали по краплях 4,63мл розчину метилмагнійброміду і перемішували при 10°С протягом ще 5ч. Потім у реакційну суміш при -10°С додавали 4н. хлористоводневу кислоту, перемішували при кімнатній температурі протягом 1,5 годин, виливали у воду, тричі екстрагували етилацетатом, екстракт сушили над сульфатом натрію і концентрували упарюванням у вакуумі. Продукт очищали хроматографією на силікагелі (елюент: гексан/етилацетат), при цьому одержували 1,0г очищеного 11β-фтор-7α-метилестр-4-ен-3,17-діону (Б'), tпл. 101,4°C, [α]D20+135,8° (с=0,525%, хлороформ). З останньої фракції одержували 0,17г ізомеру 11β-фтор-7β-метилестр-4-ен-3,17-діону, tпл. 84,8°С, [α]D20+93,7° (с 0,525%, хлороформ). д) 11β-Фтор-17β-гідрокси-7α-метилестр-4-ен-3он (І) Розчин 500мг 11β-фтор-7α-метилестр-4-ен3,17-діону (Б') у 10мл тетрагідрофурану, 5,8мл етанолу і 1,15мл води перемішували при -55°С протягом 2,5 годин у присутності 175,6мг боргідриду натрію. Потім додавали ще 351,2мг боргідриду натрію, перемішували при -55°С протягом ще 1,5 годин, виливали в крижану воду, тричі екстрагували етилацетатом, екстракт промивали до нейтральної реакції, сушили над сульфатом натрію і концентрували упарюванням у вакуумі. Продукт очищали хроматографією на силікагелі (елюент: гексан/етилацетат), при цьому одержували 230мг очищеного 11β-фтор-17β-гідрокси-7α-метилестр-4ен-3-она (І). tпл. 126,7°C, [α]D20+79,9° (с=0,53%, хлороформ). Вказаний синтез можна модифікувати з метою введення в стероїдную циклічну систему вищих гомологів 7α-метильної групи та їх похідних. Модифікація полягає у використанні на стадії г) замість метилмагнійброміду відповідного алкілмагнійброміду або відповідних похідних. У такий спосіб можна одержати, наприклад, 7α-етил-11βфтор-17β-гідроксиестр-4-ен-3-он і 11β-фтор-7α(фторметил)-17β-гідроксиестр-4-ен-3-он. Приклад 2 Одержання 11β-фтор-17β-гептаноілокси-7αметилестр-4-ен-3-она (сполука формули І') (Схема В, Фіг.2) До розчину 220мг 11β-фтор-17β-гідрокси-7αметилестр-4-ен-3-ону (І) у 5мл тетрагідрофурану і 1,09мл піридину при 0°С додавали по краплях 1,09мл гептаноілхлориду і перемішували протягом 1 години. Потім додавали розчин бікарбонату натрію, тричі екстрагували етилацетатом, екстракт промивали до нейтральної реакції, сушили над сульфатом натрію і концентрували упарюванням у вакуумі. Продукт очищали хроматографією на силікагелі (елюент: гексан/етилацетат), при цьому одержували 210мг очищеного 11β-фтор-17βгептаноілокси-7α-метилестр-4-ен-3-она (l') у вигляді піни. [α]D20+40,8° (с=0,56%, хлороформ). 19 75907 20 Вищенаведений синтез можна модифікувати з силікагелі (елюент: гексан/етилацетат), при цьому метою введення в стероїдную циклічну систему одержували 12,8г очищеного 11β-ацетокси-7αвищих гомологів 17β-гептаноільної групи. Модифіметилестр-4-ен-3,17-діону (Д). tпл..182,7°С, кація полягає у використанні замість гептаноілхло[α]D20+24,7° (с=0,525%, хлороформ). риду відповідного алканоілхлориду. У такий спосіб б) 11α-Гідрокси-7α-метилестр-4-ен-3,17-діон можна одержати 11β-фтор-7α-метил-17β(Е) ундеканоілоксиестр-4-ен-3-он. Розчин 1г 11α-ацетокси-7α-метилестр-4-енПриклад 3 3,17-діону (Д) у 20мл 0,2г розчину гідроксиду калію Одержання 11β-фтор-17β-гідрокси-7αв метанолі перемішували при кімнатній темпераметилестр-5(10)-ен-3-она (сполука формули І") турі протягом 3 годин. Потім суміш виливали у (Схема С, Фіг.3) воду, тричі екстрагували етилацетатом, екстракт а) 3-етилендіокси-11β-фтор-7α-метилестрпромивали до нейтральної реакції, сушили над 5(10)-ен-17β-ол (В) сульфатом натрію і концентрували упарюванням у До розчину 500мг 11β-фтор-17β-гідрокси-7αвакуумі. Продукт перекристалізували з діетилового метилестр-4-ен-3-ону (І) у 6,35мл дихлорметану ефіру/ацетону, при цьому одержували 878 мг додавали 3,63мл етиленгликолю, 1,82мл триметиочищеного 11α-гідрокси-7α-метилестр-4-ен-3,17лортоформіату і 23,6 мл гідрату парадіону (Е). tпл. 202,3°С, [α]D20+44,8° (с=0,5%, хлоротолуолсульфокислоти. Реакційну суміш перемішуформ). вали при кімнатній температурі протягом 20 годин, в) 11β-Хлор-7α-метилестр-4-ен-3,17-діон (Е') потім додавали розчин бікарбонату натрію, розбаРозчин 800мг 11α-гідрокси-7α-метилестр-4-енвляли етилацетатом, екстракт промивали до нейт3,17-діону (Е) у 8мл дихлорметану при 0°С змішуральної реакції, сушили над сульфатом натрію і вали з 1,21мл гексахлорацетону і 764мг трифеніконцентрували упарюванням у вакуумі. Продукт лфосфіну і перемішували при кімнатній темпераочищали хроматографією на силікагелі (елюент: турі протягом 4 годин. Потім реакційну суміш гексан/етилацетат), при цьому одержували 170мг розбавляли дихлорметаном, екстракт промивали 3-етилендіокси-11β-фтор-7α-метилестр-5(10)-ендо нейтральної реакції, сушили над сульфатом 17β-олу (В), який містив деяку кількість ізомерного натрію і концентрували упарюванням у вакуумі. за подвійним зв'язком 3-етилендіокси-11β-фторПродукт очищали хроматографією на силікагелі 7α-метилекстр-5-ен-17β-олу (В). (елюент: гексан/етилацетат), при цьому одержуваб) 11β-Фтор-17β-гідрокси-7α-метилестр-5(10')ли 430мг очищеного 11β-хлор-7α-метилестр-4-енен-3-он (І") 3,17-діону (Е'). tпл. 215,1°C, [α]D20+182,7° (с=0,5%, Розчин 170мг продукту (В), отриманого на хлороформ). стадії 3а), у 22,5мл метанолу перемішували при г) 11β-Хлор-17β-гідрокси-7α-метилестр-4-ен-3кімнатній температурі протягом 24 годин в присутон (I) ності 300мг щавлевої кислоти і 3мл води. Потім До розчину 380мг 11β-хлор-7α-метилестр-4додавали розчин бікарбонату натрію, тричі екстраен-3,17-діону (Е') у 7,6мл тетрагідрофурану, 4,4мл гували етилацетатом, екстракт промивали до нейетанолу і 1,15мл води при -55°С порціями додаватральної реакції, сушили над сульфатом натрію і ли 596мг боргідриду натрію і отриману суміш пеконцентрували упарюванням у вакуумі. Продукт ремішували при -55°С протягом 7 годин. Потім очищали хроматографією на силікагелі (елюент: реакційну суміш виливали в крижану воду, тричі гексан/етилацетат), при цьому одержували 62,7мг екстрагували етилацетатом, екстракт промивали очищеного 11β-фтор-17β-гідрокси-7α-метилестрдо нейтральної реакції, сушили над сульфатом 5(10)-ен-3-ону (І"). Після кристалізації з гексану натрію і концентрували упарюванням у вакуумі. одержували 47,6мг сполуки формули І". tпл.. Продукт очищали хроматографією на силікагелі 169,9°С, [α]D20+134,4° (с=0,56%, хлороформ). (елюент: гексан/етилацетат), при цьому одержуваПриклад 4 ли 130мг очищеного 11β-хлор-17β-гідрокси-7αОдержання 11β-хлор-17β-гідрокси-7αметилестр-4-ен-3-ону (І). tпл. 183,2°С, [α]D20+136,9° метилестр-4-ен-3-она (І) (хлороформ). (Схема D, Фіг.4) Вказаний синтез можна модифікувати з метою а) 11α-Ацетокси-7α-метилестр-4-ен-3,17-діон одержання 11β-бром- і 11β-йодпохідних, викорис(Д) товуючи бромуючі і йодуючі агенти. У такий спосіб До попередньо приготовленого розчину 20г можна одержати, наприклад, 11β-бром-17βйодиду міді (І) у 200мл тетрагідрофурану і 70мл гідрокси-7α-метилестр-4-ен-3-он і 17β-гідроксиметилмагнійброміду при -30°С протягом 1 години 11β-йод-7α-метилестр-4-ен-3-он. додавали по краплях розчин 20мг 11α7α-Етил-11β-фтор-17β-гідроксиестр-4-ен-3-он, ацетоксиестра-4,6-дієн-3,17-діону (Г) у 500мл тетtпл. 115,1°C, [α]D20+62,1° (хлороформ) отримували з рагідрофурану, 20мл 1,3-Диметил-3,4,5,6проміжної сполуки 7α-етил-11β-фторестр-4-ентетрагідро-2(1Н)-піримідинону і 20мл триметилх3,17-діону, tпл. 174,9°C, [α]D20+107,1°C (хлороформ) лорсилану і отриману суміш перемішували при і етилмагнійброміду (замість метилмагнійброміду) 20°С протягом 1 години. Потім до реакційної суміаналогічно тому, як описано в прикладі 1. Інші ші при -20°С додавали 20мл крижаної оцтової киссполуки згідно винаходу можна одержати відповілоти, перемішували при кімнатній температурі дно до відомих методик, описаних в даній області протягом 1 години, виливали у воду, тричі екстратехніки. гували етилацетатом, екстракт сушили над сульфатом натрію і концентрували упарюванням у вакуумі. Продукт очищали хроматографією на 21 Комп’ютерна верстка Т. Чепелева 75907 Підписне 22 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAndrogenic 7-substituted-11-halogenated steroids
Автори англійськоюBohlmann Rolf
Назва патенту російськоюАндрогенные 7-замещенные-11-галогенированные стероиды
Автори російськоюБольманн Рольф
МПК / Мітки
МПК: C07J 1/00, A61P 5/26, A61K 31/565
Мітки: андрогенні, 7-заміщені-11-галогеновані, стероїди
Код посилання
<a href="https://ua.patents.su/11-75907-androgenni-7-zamishheni-11-galogenovani-sterodi.html" target="_blank" rel="follow" title="База патентів України">Андрогенні 7-заміщені-11-галогеновані стероїди</a>
Попередній патент: Спосіб визначення складу важкого бетону з мінеральним наповнювачем
Наступний патент: Взуття
Випадковий патент: Набір інструментів для стабілізації верхньогрудного відділу хребта після операції дискектомії