Проміжні сполуки для отримання транс-5-хлор-2-метил-2,3,3а,12в-тетрагідро-1н-дибенз[2,3:6,7]оксепіно[4,5-с]піролу
Номер патенту: 93043
Опубліковано: 10.01.2011
Автори: ван дер Лінден Якобус Йоганнес Марія, Рідер Майкл Р., Кемперман Ґерардус Йоганнес
Формула / Реферат
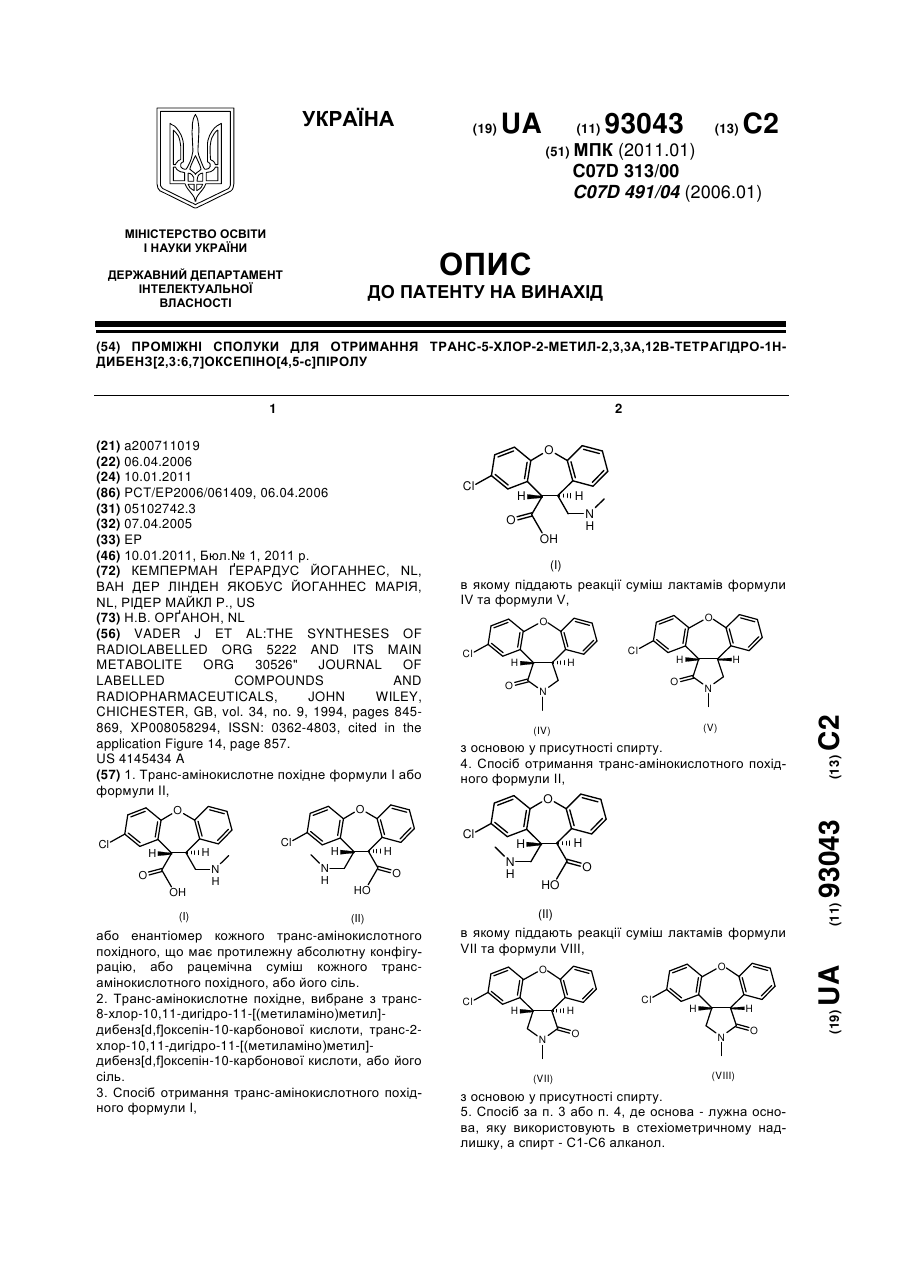
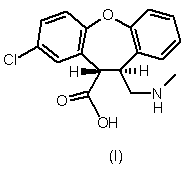
1. Транс-амінокислотне похідне формули І або формули II,
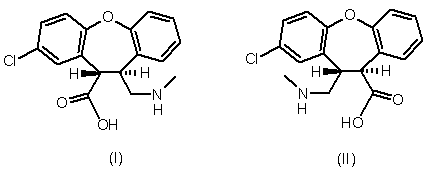
або енантіомер кожного транс-амінокислотного похідного, що має протилежну абсолютну конфігурацію, або рацемічна суміш кожного транс-амінокислотного похідного, або його сіль.
2. Транс-амінокислотне похідне, вибране з транс-8-хлор-10,11-дигідро-11-[(метиламіно)метил]-дибенз[d,f]оксепін-10-карбонової кислоти, транс-2-хлор-10,11-дигідро-11-[(метиламіно)метил]-дибенз[d,f]оксепін-10-карбонової кислоти, або його сіль.
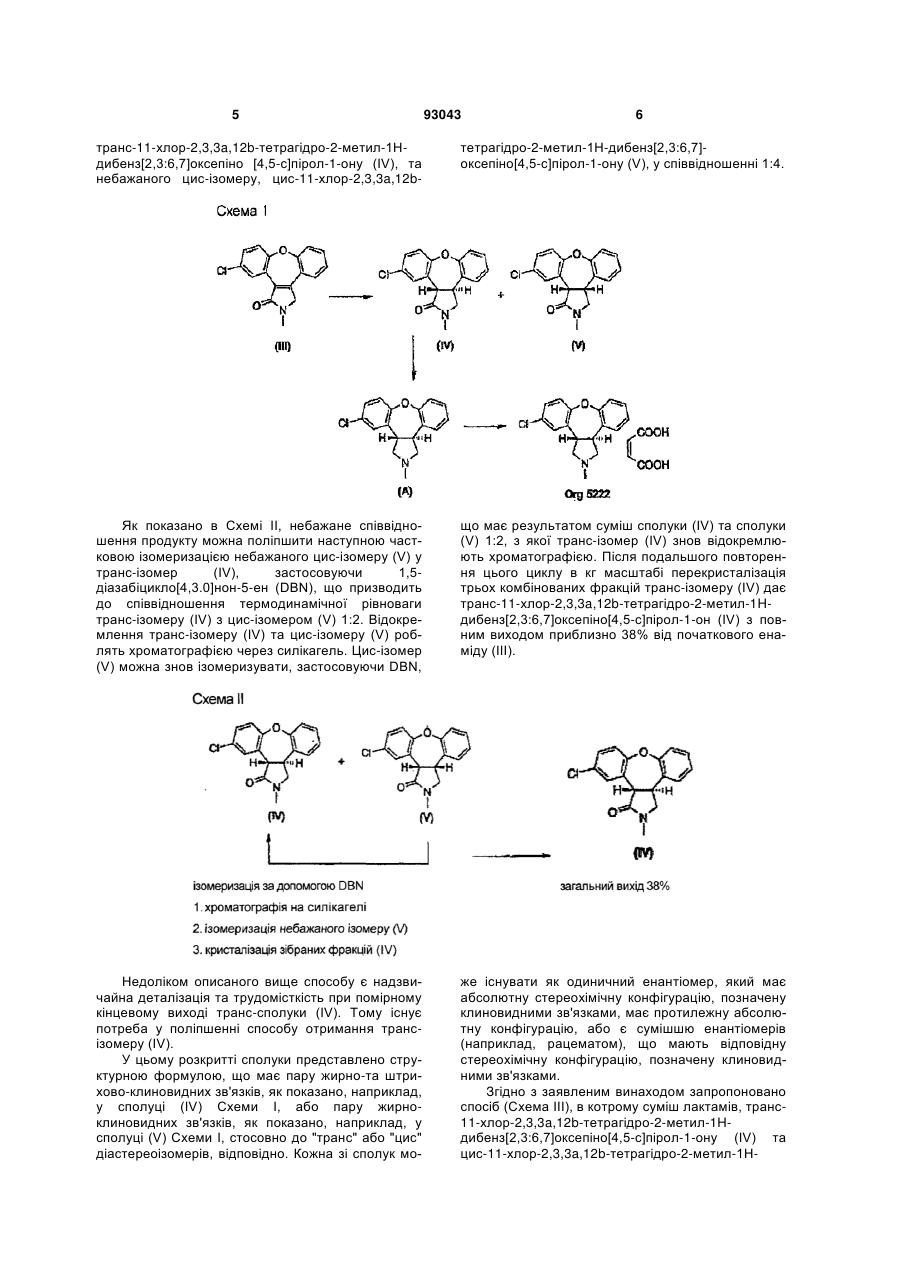
3. Спосіб отримання транс-амінокислотного похідного формули І,
в якому піддають реакції суміш лактамів формули IV та формули V,
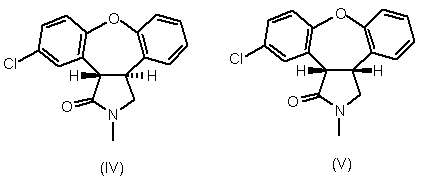
з основою у присутності спирту.
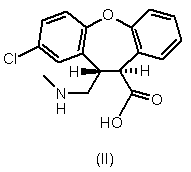
4. Спосіб отримання транс-амінокислотного похідного формули II,
в якому піддають реакції суміш лактамів формули VII та формули VIII,
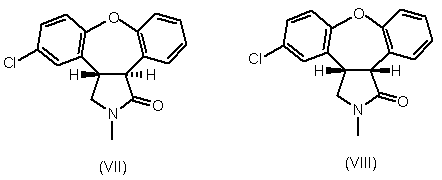
з основою у присутності спирту.
5. Спосіб за п. 3 або п. 4, де основа - лужна основа, яку використовують в стехіометричному надлишку, а спирт - С1-С6 алканол.
6. Спосіб за п. 3 або п. 4, де основа - калій гідроксид, а спирт - етанол.
7. Спосіб отримання азенапіну формули А,
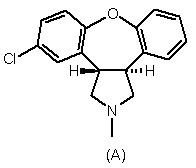 ,
,
або його солі, в якому здійснюють:
(а) циклізацію транс-амінокислотного похідного формули І або формули II,

або його солі, з одержанням лактаму формули IV або формули VII,
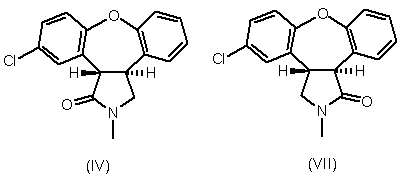 ;
;
b) відновлення карбонільної частини лактаму формули IV або формули VII, з одержанням азенапіну формули А; та
(с) як варіант, перетворення азенапіну формули А у його сіль.
8. Спосіб за п. 7, де циклізацію здійснюють нагріванням транс-амінокислотного похідного формули І або формули II у розчиннику.
9. Спосіб за п. 7, де циклізацію здійснюють нагріванням транс-амінокислотного похідного формули І або формул II у розчиннику та у присутності натрій ацетату.
10. Спосіб за п. 7, де циклізацію здійснюють шляхом активації карбоново-кислотної частини транс-амінокислотного похідного формули І або формули II, та обробки активованої карбонової кислоти основою.
11. Спосіб отримання азенапіну формули А,

або його солі, в якому здійснюють:
(a) обробку транс-амінокислотного похідного формули І або формули II,

або його солі відновником, з одержанням азенапіну формули А; та
(b) як варіант, перетворення азенапіну у його сіль.
12. Спосіб за п. 11, де відновник - боран або літій алюмогідрид.
Текст
1. Транс-амінокислотне похідне формули І або формули II, 3 93043 6. Спосіб за п. 3 або п. 4, де основа - калій гідроксид, а спирт - етанол. 7. Спосіб отримання азенапіну формули А, O Cl H H N (A) , або його солі, в якому здійснюють: (а) циклізацію транс-амінокислотного похідного формули І або формули II, O O Cl Cl H H O 8. Спосіб за п. 7, де циклізацію здійснюють нагріванням транс-амінокислотного похідного формули І або формули II у розчиннику. 9. Спосіб за п. 7, де циклізацію здійснюють нагріванням транс-амінокислотного похідного формули І або формул II у розчиннику та у присутності натрій ацетату. 10. Спосіб за п. 7, де циклізацію здійснюють шляхом активації карбоново-кислотної частини трансамінокислотного похідного формули І або формули II, та обробки активованої карбонової кислоти основою. 11. Спосіб отримання азенапіну формули А, O Cl H N O (A) HO OH (I) (II) або його солі, з одержанням лактаму формули IV або формули VII, або його солі, в якому здійснюють: (a) обробку транс-амінокислотного похідного формули І або формули II, Cl Cl H O H N H H N O (VII) ; b) відновлення карбонільної частини лактаму формули IV або формули VII, з одержанням азенапіну формули А; та (с) як варіант, перетворення азенапіну формули А у його сіль. Цей винахід стосується нових амінокислотних похідних, способів їх отримання та застосування амінокислотних похідних для отримання транс-5хлор-2-метил-2,3,3a,12b-тетрагідро-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]піролу. Транс-5-хлор-2-метил-2,3,3a,12b-тетрагідро1H-дибенз[2,3;6,7]оксепіно[4,5-с]пірол, котрий звичайно відомий як азенапін, є сполукою, яка має депресантну активність стосовно центральної нервової системи та має антигістамінову та антисеротонінову активність (Див. Патент США No. 4,145,434 van den Burg). Розглянуто фармакологічний профіль азенапіну, його кінетику та метаболізм, вперше безпечність та ефективність досліджень на людях-добровольцях та пацієнтахшизофрениках (Див. De Boer et al., Drugs of the Future, 18(12), 1117-1123,1993). Встановлено, що сіль малєату азенапіну, відома як Org 5222, є речовину широкого спектра дії, антагоністом високоефективного серотоніну, норадреналіну та допаміну. Азенапін показує потенційну протипсихотичну активність та може бути корис Cl H H N H O OH (I) (IV) O O O O Cl H H H N H N H 4 H H N H O HO (II) або його солі відновником, з одержанням азенапіну формули А; та (b) як варіант, перетворення азенапіну у його сіль. 12. Спосіб за п. 11, де відновник - боран або літій алюмогідрид. ним у лікуванні депресії (див. заявку на міжнародний патент WO 99/32108). Описано фармацевтичне отримання малєату азенапіну, придатного для сублінгвального або букального застосування (див. заявку на міжнародний патент WO 95/23600). Азенапін малєат тепер є предметом клінічного дослідження, що робить потрібним великомасштабний синтез речовини ліків. Загальна методологія отримання азенапіну описана в Патенті США No. 4,145,434. Повідомлено про фізико-хімічні властивості речовин ліків, Org 5222, (Funke et al., Arzneim.-Forsch/Drug.Res., 40, 536-539, 1990). Описано додаткові способи синтезу Org 5222 та мічені радіоактивними ізотопами його похідні (Vader et al., J. Labelled Camp. Radiopharm., 34, 845-869, 1994). Останні етапи відомого способу отримання азенапіну (А) зображено в Схемі І. У цьому способі подвійний зв'язок в енаміді, 11-хлор-2,3-дигідро-2метил-1Н-дибенз[2,3;6,7]оксепіно[4,5-с]пірол-1-оні (III), відновлюють обробкою магнієм в метанолі/толуолі, що дає суміш бажаного транс-ізомеру, 5 93043 6 транс-11-хлор-2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7]оксепіно [4,5-с]пірол-1-ону (IV), та небажаного цис-ізомеру, цис-11-хлор-2,3,3a,12b тетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-ону (V), у співвідношенні 1:4. Як показано в Схемі II, небажане співвідношення продукту можна поліпшити наступною частковою ізомеризацією небажаного цис-ізомеру (V) у транс-ізомер (IV), застосовуючи 1,5діазабіцикло[4,3.0]нон-5-ен (DBN), що призводить до співвідношення термодинамічної рівноваги транс-ізомеру (IV) з цис-ізомером (V) 1:2. Відокремлення транс-ізомеру (IV) та цис-ізомеру (V) роблять хроматографією через силікагель. Цис-ізомер (V) можна знов ізомеризувати, застосовуючи DBN, що має результатом суміш сполуки (IV) та сполуки (V) 1:2, з якої транс-ізомер (IV) знов відокремлюють хроматографією. Після подальшого повторення цього циклу в кг масштабі перекристалізація трьох комбінованих фракцій транс-ізомеру (IV) дає транс-11-хлор-2,3,3a,12b-тетрагідро-2-метил-1Hдибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-он (IV) з повним виходом приблизно 38% від початкового енаміду (III). Недоліком описаного вище способу є надзвичайна деталізація та трудомісткість при помірному кінцевому виході транс-сполуки (IV). Тому існує потреба у поліпшенні способу отримання трансізомеру (IV). У цьому розкритті сполуки представлено структурною формулою, що має пару жирно-та штрихово-клиновидних зв'язків, як показано, наприклад, у сполуці (IV) Схеми І, або пару жирноклиновидних зв'язків, як показано, наприклад, у сполуці (V) Схеми І, стосовно до "транс" або "цис" діастереоізомерів, відповідно. Кожна зі сполук мо же існувати як одиничний енантіомер, який має абсолютну стереохімічну конфігурацію, позначену клиновидними зв'язками, має протилежну абсолютну конфігурацію, або є сумішшю енантіомерів (наприклад, рацематом), що мають відповідну стереохімічну конфігурацію, позначену клиновидними зв'язками. Згідно з заявленим винаходом запропоновано спосіб (Схема III), в котрому суміш лактамів, транс11-хлор-2,3,3a,12b-тетрагідро-2-метил-1Hдибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-ону (IV) та цис-11-хлор-2,3,3a,12b-тетрагідро-2-метил-1Н 7 93043 8 дибенз[2,3;6,7]оксепіно[4,5-с]пірол-1-ону (V), обробляють в спиртовому розчині, що містить надлишок сильної лужної основи, таким чином, отримуючи суміш транс-8-флуоро-10,11-дигідро-11[(метиламіно)-метил]-дибенз[b,f]оксепін-10карбонової кислоти (І) та цис-8-хлор-10,11-дигідро11-[(метиламіно)метил]-дибенз[b,f]оксепін-10карбонової кислоти (Іа). Реакція розкриття циклу є стереоселективною, що має результатом співвід ношення транс-ізомеру (І) до цис-ізомеру (Іа)10:1. Транс-амінокислотне похідне (І) згодом відокремлюють та циклізують, що дає транс-11-хлор2,3,3b,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7Іоксепіно[4,5-с]пірол-1-он (IV) зі збереженням транс-стереохімії. Починаючи від похідного енаміду (III), вихід транс-ізомеру (IV) дорівнює приблизно 62%. (IV) загальний вихід 62% Вихідним матеріалом для реакції розкриття циклу може бути суміш транс-ізомеру (IV) та цисізомеру (V). Альтернативно вихідним матеріалом може бути чистий цис-ізомер (V). Суміш ізомерів (IV), (V) можна отримувати з сполуки(ІІІ) згідно вищенаведеній Схемі І або можна отримувати згідно етапів синтезу, описаних у Прикладі 8. Гідроліз лактамів (IV), (V) можна виконувати в спиртовому розчині при температурі дефлегмації у присутності стехіометричного надлишку сильної лужної основи. Переважні основи охоплюють гідроксиди лужного металу, як-то калій гідроксид або натрій гідроксид, котрі застосовують у 2 - 20разовому або в 10 - 20-разовому молярному надлишку, базованому на кількості ізомерів (IV), (V). Корисні спирти охоплюють алканоли С1-С6, залучаючи метанол, етанол, н-пропанол, 2-пропанол, н-бутанол та їхні суміші. Застосування висококиплячих спиртів, як-то н-пропанол та н-бутанол, має результатом коротший час реакції розкриття циклу. Після завершення реакції розкриття циклу додають воду та етанол, а потім можна виконувати екстракцію для видалення побічних продуктів. Похідні амінокислоти (І), (Іа) екстрагують у водно/спиртову фазу та підкислюють до рН 1, застосовуючи хлоридну кислоту. При наступному випарюванні спиртових розчинників селективно кристалізується амінокислотне похідне, транс-8хлор-10,11-дигідро-11-[(метиламіно)метил]дибенз[b,f]оксепін-10-карбонова кислота (І), як хлорид. Транс-8-хлор-10,11-дигідро-11[(метиламіно)метил]-дибенз[b,f]оксепін-10карбонову кислоту (І) можна отримувати як крис талічний цвітер-іон, тобто вільну основу, коли рН знижується до 6 замість 1. Крім того, цвітер-іон транс-8-хлор-10,11-дигідро-11[(метиламіно)метил]-дибенз[b,f]оксепін-10карбонової кислоти (І) можна отримувати із гідрохлориду розчиненням у суміші метанолу та води, нейтралізацією до рН 6 розчином аміаку або натрій гідроксиду та випарюванням метанолу, що дає вільну основу (1) як тверду речовину. Реакція замикання циклу (циклізація) амінокислотного похідного (І), що дає похідне транслактаму (IV) (див. Схему III) можна виконувати, застосовуючи гідрохлорид або цвітер-іонну форму, нагріванням суспензії амінокислоти (І) в розчиннику, у тому числі ароматичному розчиннику, як-то толуол або ксилол, з добавкою для зростання швидкості цієї реакції або без неї. Придатні добавки - силікагель, алюміній оксид, натрій гідроксид, та натрій ацетат. Переважним розчинником для замкнення кільця є толуол; переважними добавками є натрій гідроксид та натрій ацетат. Натрій ацетат є найбільш переважним для найкоротшого часу реакції. У альтернативному способі замкнення кільця амінокислотне похідне (1) перетворюється у активовану кислотну форму, як-то хлорангідрид, котрий після нейтралізації основою спонтанно циклізується до бажаного лактаму (IV). Наступний аспект винаходу стосується способу (Схема IV) отримання транс-2-хлор-10,11дигідро-11-[(метиламіно)метил]-дибенз[b,f]оксепін-10-карбонової кислоти (II), котра є регіоізомером амінокислотного похідного (І), зображеного в Схемі III. Спосіб складається з етапів: (а) відновлення енаміду, 5-хлор-2,3-дигідро-2-метил1Н-дибенз[2,3:6,7]-оксепіно[4,5-с]пірол-1-ону (VI), 9 93043 10 що дало суміш лактамів, транс-5-хлор-2,3,3a,12bтетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5с]пірол-1-ону (VII). та цис-5-хлор-2,3,3a,12bтетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-ону (VIII); (b) гідроліз лактамів (VII), (VIII) обробкою в спиртовому розчині надлишком сильної (лужної) основи, таким чином, даючи суміш амінокислотного похідного (II) та його відповідного ізомеру, цис-2-хлор-10,11дигідро-11-[(метиламіно)метил]-дибенз[d,f]оксепін10-карбонової кислоти (IIа); та (с) очищення амінокислотного похідного (II) із суміші. Циклізація амінокислотного похідного (II) бажаного лактаму (VII), котрий є регіоізомером лактаму (IV), зображеного вище в Схемі 1, та наступне відновлення амідної групи лактаму дає азенапін (А). Енамід, 5-хлор-2,3-дигідро-2-метил-1H-дибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-он (VI), можна, наприклад, отримувати згідно ряду етапів синтезу, починаючи з 4-хлорфенолу та метил 2бромфенілацетату, як описано в Прикладі 9. Наступний аспект винаходу стосується альтернативного способу отримання азенапіну (А), як показано в Схемі V. Спосіб полягає у обробці амінокислотного похідного (І) або (II) відновлювником, як-то боран або літій алюмогідрид, у комбінації з кислотою Льюїса, як-то алюміній хлорид. Ця одноетапна реакція дає азенапін (А) з типовим виходом 70%. Наступний аспект винаходу стосується трансамінокислотних похідних формули (І) або (II), як зображено в Схемах III-V, або енантіомеру кожного транс-амінокислотного похідного, що має протилежну абсолютну конфігурацію, або рацемічної суміші кожного транс-амінокислотного похідного, або його солі. Придатні солі охоплюють солі лужних металів, як-то солі натрію, калію або літію, або солі, отримані з комбінації з органічною основою, як-то триметиламін, триетиламін та подібне. Інші придатні солі охоплюють кислотно-адитивні солі, котрі можна отримувати обробкою вільних сполук (І) або (II) неорганічними кислотами, як-то хлоридна кислота, бромідна кислота, або органічними кислотами, як-то малеїнова кислота, оцтова кислота, метансульфонова кислота, тощо. Придатні кислотно-адитивні солі азенапіну (А) можна отримувати обробкою неорганічними кислотами, як-то хлоридна кислота, бромідна кислота, фосфатна кислота та сульфатна кислота, або 11 органічними кислотами, як-то, наприклад, аскорбінова кислота, лимонна кислота, винна кислота, молочна кислота, малеїнова кислота, малонова кислота, фумарова кислота, гліколева кислота, бурштинова кислота, пропіонова кислота, оцтова кислота та метансульфонова кислота. Переважною кислотно-адитивною сіллю азенапіну є малєат, тобто Org 5222. Приклади Наступні приклади ілюструють, але без обмеження, окремі втілення заявленого винаходу. В кожному з нижченаведених прикладів сполуки Org 5222, азенапін (А), та усі цис- та транспопередники, наприклад, сполуки (І), (II), (IV), (V), (VII) та (VIII) - рацемати, пари жирно-клиновидних зв'язків або жирно- та штрихово-клиновидних зв'язків, застосовані в їх структурних формулах, позначають відповідні стереохімічні конфігурації. Загальні способи У найбільшій кількості прикладів спектр ЯМР реєстрували на Брукер DPX 400. Хімічні зсуви 1НЯМР ( ) наведено в частках на мільйон (млн-1) та віднесено до тетраметилсилану як внутрішнього стандарту, застосовуючи наступні скорочення: s (синглет), d (дублет), dd (подвійний дублет) та m (мультиплет). Мас-спектри реєстрували на РЕ SCIEX AP1165. Хромато-грами ГХ реєстрували на HP6890N з колонкою Restek RTX. Приклад 1. Отримання транс-11-хлор2,3,3а,12b-тетрагідро-2-метил-1Hдибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-ону (IV) згідно зі Схемою II. A. Суміш транс-(ІV) та цис--хлор-2,3,3a,12bтетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5с]пірол-1-ону (V) Під атмосферою N2 при перемішуванні до суспензії магнію (1,75 грам, 71,87 ммоль) в толуолі (175 мл) додавали йод (4,95 г, 18 ммоль). Через 20 хвилин додавали розчин 11-хлор-2,3-дигідро-2метил-1Н-дибенз[2,3;6,7]оксепіно[4,5-с]пірол-1-ону (III) (25 грам, 84 ммоль; див. Vader et al., вище) в метанолі (175 мл). Реакційну суміш перемішували протягом 35 хвилин. Тоді через 2 години додавали 3 порції магнію (1 г, 41,06 ммоль) а потім - одну більшу порцію магнію (2 г, 82,12 ммоль). Додавали воду (600 мл) та 36% хлоридну кислоту (65 мл), підтримуючи температуру нижче 40°С. Додавали толуол (50 мл), шари відокремлювали, та водний шар екстрагували толуолом (2x100 мл). Комбіновані толуолові шари промивали водою (200 мл), сушили над магній сульфатом, фільтрували та випарювали. Це дало суміш транс-11-хлор2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3;6,7]оксепіно[4,5-с]-пірол-1-ону (IV) та цис-11-хлор-2,3,3а,12b-тетрагідро-2-метил-1Hдибенз[2,3:6,7]оксепіно[4,5-с]пірол-1-ону (V) (25,5г, -100%) в співвідношенні (IV):(V)=1:4, як визначено 1 Н-ЯМР та ГХ. B. Хроматографічне (оксид силіцію) очищення (IV) 5-Діазабіцикло[4,3,0]нон-5-ен (DBN, 1,6 л) додавали до толуолу (400 л), що містить суміш цисізомеру (V) та транс-ізомеру (IV) (10 кг у підсумку), та реакційну суміш перемішували протягом 1 години при 20°С. Додавали воду (200 л) та рН вод 93043 12 ного шару доводили до рН 4 оцтовою кислотою (приблизно 1,0 л). Перемішування продовжували протягом 15 хвилин та, якщо необхідно, додавали оцтову кислоту для доведення рН до 4,0 (±0,2). Шари відокремлювали. Толуоловий шар промивали водою (200 л), концентрували до об'єму 25 л та очищали хроматографією на оксиді силіцію (100кг) толуолом (115 л) та толуолом:етилацетатом 95:5 (900 л). Фракції поєднували та фракції, що містять тільки сполуку транс-11-хлор-2,3,3а,12bтетрагідро-2-метил-1Н-дибенз [2,3:6,7]оксепіно[4,5-с]-пірол-1-ону (IV), комбінували та концентрували до об'єму 50 л. Фракції, що містять цис-11-хлор-2,3,3a,12b-тетрагідро-2-метил1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-он (V) або суміші транс-11-хлор-2,3,3a,12b-тетрагідро-2метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1ону (IV) та цис-хлор-2,3,3a,12b-тетрагідро-2-метил1H-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-ону (V), комбінували. С. Повторна ізомеризація з DBN Комбіновані фракції, що містить цис-ізомер (V), знов ізомеризували, застосовуючи DBN в толуолі, і наступне очищення хроматографією, як описано вище, повторювали двічі. Фракції, що містять тільки транс-11-хлор-2,3,3a,12b-тетрагідро-2метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-он (IV) комбінували та випарювали у вакуумі, що дає 4,9 кг (49 мас.%) сирого транс-11 -хлор-2,3,3а, 12bтетрагідро-2-метил-1H-дибенз[2,3:6,7]оксепіно[4,5с]-пірол-1-ону (IV). Перекристалізація із метанолу дає транс-11-хлор-2,3,3a,12b-тетрагідро-2-метил1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-он (IV) (3,8 кг, 38%); т. пл,150,6°С; 1Н-ЯМР (400,13 МГц, CDCI3 стосовно ТМС) 3.03 (d, 3H), 4,03 (m, 1H), 3,53-3,65 (m, 2H), 3,82 (m, 1H), 7,01-7,28 (m, 6Н), 7,87 (dd, 1H). Приклад 2. Отримання транс-8-хлор-10,11дигідро-11-[(метил-аміно)метил]дибенз[b,f]оксепін-10-карбонової кислоти (І) До розчину цис-11-хлор-2,3,3a,12b-тетрагідро2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1ону (V) (2 грами, 67 ммоль) в етанолі (20 мл) додавали калій гідроксид (3,8 г, 67 ммоль). Реакційну суміш нагрівали при дефлегмації протягом 5 годин. Реакційну суміш випарювали та додавали воду (50 мл). Водну фазу промивали діетиловим етером (2x25 мл). Водну фазу підкислювали концентрованою хлоридною кислотою до рН 5-6, що дає у результаті смоляний осад. Додавали етилацетат (25 мл), котрий повільно розчиняв смолу та призводив до утворення чистих кристалів продукту. Кристали відфільтровували та сушили, що дає транс-8-хлор-10,11-дигідро-11[(метиламіно)метил]-дибенз[b,f]оксепін-10карбонову кислоту (І) (1,1г, 52%); т. пл. 154,4°С; 1 Н-ЯМР (399,87 МГц в MeOD стосовно ТМС) 2,09 (s, 3H), 2,45 та 2,66 (2х m, 2Н), 3,23 (s, 1H), 3,50 (m, 1H), 3,92 (d, 1H), 6,96-7,20 (m, 6H). Приклад 3. Отримання транс-8-хлор-10,11дигідро-11-[(метил-аміно)метил]дибенз[b,f]оксепін-10-карбонової кислоти гідрохлориду (І).НСІ Калій гідроксид (333,8 г, 6,30 моль) додавали до суміші транс-11-хлор-2,3,3a,12b-тетрагідро-2 13 метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1ону (IV) та цис-хлор-2,3,3a,12b-тетрагідро-2-метил1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-ону (V) (105 г, 351 ммоль, співвідношення транс/цис - 1:3), розчиненої в етанолі (1050 мл). Суміш нагрівали при дефлегмації протягом 18 годин. Частину етанолу (500 мл) випарювали та додавали воду (1,5л). Водну фазу екстрагували толуолом (2x750 мл). Потім до водної фази додавали толуол (500 мл) та концентровану хлоридну кислоту для доведення рН до 1. Протягом додавання хлоридної кислоти температура підвищувалась до 75°С. Водний шар відокремлювали і після охолодження утворювались кристали транс-8-хлор-10,11дигідро-11-[(метил-аміно)метил]дибенз[b,f]оксепін-10-карбонової кислоти гідрохлориду. Кристали збирали фільтруванням та сушили, що дає (І).НСІ (84 г, 68%); т. пл. 215°С (розкладання); 1Н-ЯМР (399-87 МГц в MeOD стосовно ТМС) 2,65 (s, 3H), 3,30 (s, 2H), 3,95 (m, 1H), 4,32 (d, 1H), 7,11-7,38 (m, 6H). Приклад 4. Отримання транс-11-хлор2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-ону (IV) Спосіб А Транс-8-хлор-10,11-дигідро-11-[(метиламіно)метил]-дибенз[b,f]оксепін-10-карбонової кислоти гідрохлорид (І).НСІ (55,5 г) та силікагель (55г) суспендували в ксилолі (550 мл). Суспензію нагрівали при дефлегмації протягом 1 ночі. Реакційну суміш охолоджували до 65°С та додавали етилацетат (550 мл). Силікагель фільтрували та промивали етилацетатом (550 мл). Органічну фазу випарювали. Сирий продукт розчиняли в метанолі (750 мл). Метанол частково випарювали, після чого продукт кристалізувався. Після охолодження до 5°С протягом 3 годин продукт отримували фільтрацією. Це дало транс-11-хлор-2,3,3a,12bтетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5с]-пірол-1-он (IV) (47,8 г, 86%); т. пл. 150,6°С; 1НЯМР (400,13 МГц в CDCI3 стосовно ТМС) 3,03 (d, 3H), 4,03 (m, 1H), 3,53-3,65 (m, 2Н), 3,82 (m, 1H), 7,01-728 (m, 6H), 7,87 (dd, 1H). Спосіб В Транс-8-хлор-10,11-дигідро-11-[(метиламіно)метил]-дибенз[b,f]оксепін-10-карбонової кислоти гідрохлорид (І).НСІ (50 г, 142 ммоль) суспендували в дихлорметані (1 л) та Ν,Νдиметилформаміді (50 мл). До цієї суспензії додавали тіонілхлорид (50 мл, 84 ммоль). Через 30 хвилин утворювався прозорий розчин. Цей розчин додавали краплями до холодної суміші метанолу (1 л) та триетиламіну (158,1150 ммоль). Для доведення рН до 8 додавали додатковий триетиламін (35 мл). Органічну фазу промивали 1H хлоридною кислотою (1 л) та розсолом (2x1 л). Потім органічну фазу промивали насиченим розчином натрій гідрокарбонату (1 л). Органічну фазу сушили магній сульфатом та випарювали. Сирий продукт (40,7 г) кристалізували із метанолу (100 мл). Це постачало транс-11-хлор-2,3,3a,12b-тетрагідро-2метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-он (IV) (32 г, 75%); 1Н-ЯМР (399,87 МГц в CDCI3 стосовно ТМС) 3,03 (d, 3H), 4,03 (m, 1Н), 3,53-3,65 93043 14 (m, 2Н), 3.В2 (m, 1H), 7,01-7,28 (m, 6Н), 7,87 (dd, 1H). Приклад 5. Отримання азенапіну, транс-5хлор-2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7]оксепіно[4,5-с]піролу (А) До першої посудини, що містить тетрагідрофуран (2,4 мл) при 0°С додавали алюміній хлорид (167 мг, 1,26 ммоль). Для отриманої суспензії повільно додавали літій алюмогідрид (3,77 ммоль). До другої посудини, що містить ТГФ (4 мл), додавали транс-8-хлор-10,11-дигідро-11[(метиаміно)метил]-дибенз[b,f]оксепін-10карбонової кислоти гідрохлорид (І).НСІ (04 г, 1,26 ммоль). При -10°С вміст першої посудини додавали до другої посудини. Через 30 хвилин реакційну суміш гасили водою та екстрагували толуолом. Толуол сушили магній сульфатом та випарювали. Це дало сирий транс-5-хлор-2,3,3a,12b-тетрагідро2-метил-1Н-дибенз[2,3:6,7]-оксепіно[4,5-с]пірол (А) з майже кількісним виходом з чистотою 63%; 1НЯМР (400,13 МГц в CDCI3 стосовно ТМС) 2,54 (s, 3H), 3,15 (m, 2Н), 3,25 та 3,61 (2x m,4H), 7.01-7,36 (m, 7H). Приклад 6. Отримання азенапіну, транс-5хлор-2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7]оксепіно[4,5-с]піролу (А) Алюміній хлорид (6,9 кг) додавали порціями до тетрагідрофурану (100 л) при 0°С. Підтримуючи температуру нижче 10°С продовжували перемішування, і додавали 10% розчин літій алюмогідриду в тетрагідрофурані (35,0 л). Суміш охолоджували до 0°С і перемішували протягом 15 хвилин. Додавали до суміші розчин транс-11-хлор-2,3,3a,12bтетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5с]пірол-1-ону (IV) (10.0 кг) в тетрагідрофурані (100л), підтримуючи температуру нижче 15°С. Додавали тетрагідрофуран (5 л), перемішування продовжували протягом 1 години при 10°С, та додавали 0,6 Η розчин натрій гідроксиду (100 л), підтримуючи температуру нижче 10°С. Перемішування продовжувалось протягом 15 хвилин при 20°С і тоді додавали толуол (150 л) та воду (100 л). Перемішування продовжували протягом 15 хвилин при 20°С і відокремлювали сольовий шар. Сольовий шар екстрагували толуолом (2x50 л). Комбіновані фільтрати відокремлювали та водний шар екстрагували толуолом (50 л). Комбіновані органічні шари випарювали у вакуумі при 70°С, що дає транс-5-хлор-2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7]оксепіно[4,5-с]пірол (А) (9,4 кг, 99%); 1 Н-ЯМР (400,13 МГц в CDCI3 стосовно ТМС) 2,54 (s, 3H), 3,15 (m, 2H), 3,25 та 3,61 (2x Μ, 4Η), 7,017,36 (m, 7H). Приклад 7. Отримання малєату азенапіну (Org 5222) Вільну основу транс-5-хлор-2,3,3a,12bтетрагідро-2-метил-1Н-дибенз[2,3:6,7]оксепіно[4,5с]пірол (А) (1,23 кг) розчиняли в етанолі (2 л) при 60°С. Додавали деревне вугілля (74 г); після перемішування протягом 30 хвилин при 60°С деревне вугілля фільтрували та промивали етанолом (1,2 л). Фільтрат нагрівали до 65°С та підтримували при цій температурі додаванням протягом 15 хвилин нагрітого (60°С) розчину малеїнової кислоти (554 г) в етанолі (3,5 л). Розчин охолоджували 15 та уводили кристали затравки при 15°С. Через 2 години перемішування при 15°С суспензію охолоджували до -10°С та кристали відфільтровували, промивали холодним етанолом та сушили. 1НЯМР (400,13 МГц в CDCI3 стосовно ТМС) 3,14 (s, 3H), 3,93 (m, 2Н), 3,79 та 4,08 (2x m, 4Н), ,6,24 (s, 2Н, вінілові протони малеїнової кислоти), 7,167,34-(m, 7Н); мас-спектрометрія m/z 286,1, 229, 220, 201, 194, 166 та 44. Приклад 8, Отримання суміші транс-11-хлор2,3,3a,12b-тетрагідро-2-метил-1Ндибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-ону (IV) та відповідного цис-ізомеру (V) A. (Е та Z) -2-[5-хлор-2-сренокси-феніл)гідроксіакрилової кислоти метиловий естер Розчин (5-хлор-2-фенокси-феніл)-оцтової кислоти метилового естеру (167 г, 605 ммоль) та метилформіату (173 мл, 2,8 моль) в т-бутилметиловому етері (1 л) охолоджували до -10°С. До цього розчину порціями додавали калій т-бутоксид (115 г, 1,03 моль) при підтримуванні температури нижче 0°С. Через 30 хвилин реакцію гасили додаванням 4 Η водної хлоридної кислоти (400 мл). Органічний шар відокремлювали та промивали водою (3x 350 мл) та насиченим розсолом (350 мл).Органічні фракції комбінували та концентрували до сухого стану та застосовували без очищення. Продукт - 90% Е, як показано ЯМР. 1Н ЯМР (400 МГц, CDCI3) 3,6 (s, 3H, Ε - метил; Z-метил - при 3,7), 6,8 (d, 1H), 6,9 (m, 2H), 7,0 (t, 1H), 7,2 (m, 3H), 7,3 (m, 2H), 11,8 (d, 1H, Ε- гідрокси-протон; Z-гідрокси-протон - при 4,7). B. 8-Хлор-дибенз[b,f]оксепін-10-карбонової кислоти метиловий естер Кашку 2-(5-хлор-2-фенокси-феніл)-3-гідроксиакрилової кислоти метилового естеру (210 г, 691 ммоль) нагрівали в пірофосфатній кислоті (420 г) до 60°С. Через дві години реакційну суміш охолоджували до 20°С та додавали гексан (250 мл), толуол (500 мл) та воду (500 мл) для гасіння реакції. Органічний шар відокремлювали та промивали насиченим водним натрій гідрокарбонатом (500мл) та насиченим розсолом (500 мл). Органічну фракцію концентрували та отримане масло кристалізували із н-бутанолу (500 мл; 20°С протягом одної години та -10°С протягом двох годин), що постачало заголовну сполуку як не зовсім білі кристали (172 г, 85% вихід для етапи А та В). 1Н ЯМР (400МГц, CDCI3) 3,9 (s, 3H), 7,1-7,2 (m, 3H), 7,3 (m, 2H), 7,4 (t, 1H), 7,6 (d, 1H), 8,0 (s, 1H). C. Транс-8-хлор-11-нітрометил-10,11-дигідродибензо[b,f]оксепін-10-карбонової кислоти метиловий естер До 5 л 3-горлої круглодонної колби додавали 8-хлор дибензо[b,f]оксепін-10-карбонової кислоти метиловий естер (305 г, 1.06 моль, 1 екв), а потім ТГФ (1,25 л) та т-бутил-тетраметилгуанідин (27 г, 0,15 моль, 0,14 екв.). До цього розчину додавали нітрометан (576 г, 9,45 моль, 6,9 екв.) в ТГФ (0,5л), підтримуючи температуру меншу 30°С. Отриману суміш перемішували при кімнатній температурі до оцінки повноти за допомогою ВЕРХ (протягом ночі, < 3% вихідного матеріалу). Після завершення додавали метил-трет-бутиловий етер (1,25 л), воду (0,6 л) та 1H НСІ (0,6 л), шари відокремлювали та 93043 16 водний шар екстрагували два рази МТВЕ (1 л). Комбіновані органічні шари промивали 1H НСІ (2x0,6 л) та насиченим натрій хлоридом (0,6 л). Після додавання толуолу (2 л) органічну фракцію концентрували у вакуумі до об'єму меншому 2 л, додавали толуол (1 л) та суміш концентрували до мінімального об'єму. Додавання ТГФ (0,5 л) давало заголовну сполуку як слабко забарвлений розчин, котрий застосовували без подальшого очищення (368 г, 1,06 моль, теоретично). Обсяг ВЕРХ: 45% толуол, 48% транс-нітроестер, 6% циснітроестер, 1% вихідний матеріал. Умови ВЕРХ: колонка - 3,5 мкм Zorbax SB-Phenil, 3 мм x 150 мм; розчинник-градієнт від 55% води (0,1% НОСl4)/45% метанолу (0,1% НОСl4) до 100% метанолу (0,1% НОСl4) за 10 хвилин та утримувати протягом 2 хвилин; потік 0,5 мл/хвилину; визначення при 210нм. D. 11-Амінометил-8-хлор-10,11-дигідродибензо[b,f]оксепін-10-карбонової кислоти метиловий естер та 11-хлор-2,3,3a,12-тетрагідро-2метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-он Водну кашку губчатого нікелевого каталізатору А7000 (111,74 г/60 мл, що містить приблизно 60,36г каталізатору на сухій основі) промивали додаванням ТГФ (40 мл), струшуючи та декантуючи надосадкову рідину. Тоді кашку каталізатору за допомогою ТГФ (200 мл) завантажували до автоклаву 1500-мл Hastelloy-C з перемішуванням. Посудину закривали, продували воднем та тримали під надлишковим тиском водню приблизно 50 фунт/кв.дюйм. Суміш перемішували при 1100 оберт./хвил. при кімнатній температурі та додавали розчин транс-8-хлор-11-нітрометил-10,11дигідро-дибензо[b,f]оксепін-10-карбонової кислоти метилового естеру (приблизно 369 г, 1.06 моль в 500 мл ТГФ), розбавленого до 850 мл за допомогою ТГФ, зі швидкістю приблизно 3,1 мл/хвилину курсом приблизно 4,5 години. Температура реакційної суміші зростала від екзотермічного характеру реакції але її підтримували при 20-32°С застосуванням зовнішньої водної охолоджувальної бані. Загальний тиск в реакторі тримали під надлишковим тиском 50-60 фунт/кв.дюйм постачанням водню по вимозі через регулятор тиску із резервуару високого тиску відомого об'єму. Після завершення додавання вихідного матеріалу систему постачання промивали ТГФ (2x25 мл) у реакторі. Завершену реакційну суміш перемішували при кімнатній температурі при тиску водню приблизно 60 надлишкове фунт/кв..дюйм протягом ночі. Після продування водню реакційну суміш обережно у вакуумі фільтрували та шар промивали ТГФ (примітка: слід уникати висихання шару каталізатору на повітрі), що дало суміш заголовних сполук (1,06 моль, теоретично) як розчину в ТГФ. Цей матеріал застосовували без подальшого очищення. Аналіз обсягу ВЕРХ %: комбіновані фільтрат та промивні складові (1266 г) позбавляли вихідного матеріалу і суміші складалася з очікуваного аміноестеру та цис- та транс-лактамів. Умови ВЕРХ: такі самі, як у етапі С, вище. Ε. Транс-11-хлор-2,3,3a,12b-тетрагідро-2метил-1Н-дибенз[2,3:6,7]оксепіно[4,5-с]-пірол-1-он (IV) та відповідний цис-ізомер (V) 17 До 5 л 3-горлої крулодонної колби, спорядженої механічним перемішуванням, додавали ТГФ (1.0 л), а потім - продукт гідрогенізації від етапу D (1.06 молей приблизно в 0,8 л ТГФ). Потім уміст посудини охолоджували до 0°С. Тоді порціями додавали твердий калій т-бутоксид (178 г, 1,59 моль, 1,5 екв.), підтримуючи температуру менше 5°С. Отриману темну суспензію перемішували при температурі меншій 5°С до повного споживання аміноестеру, як визначено ВЕРХ. Тоді повільно додавали диметилсульфат (170 мл, 1,8 моль; 1,7екв.), підтримуючи температуру менше 5°С, що дає оранжеву суспензію. Уміст посудини перемішували при температурі менше 5°С до завершення реакції згідно ВЕРХ (
ДивитисяДодаткова інформація
Назва патенту англійськоюIntermediate compounds for the preparation of trans-5-chloro-2-methyl-2,3,3a,12b-tetrahydro-1h-dibenz[2,3:6,7]oxepino[4,5-c]pyrrole
Автори англійськоюKemperman Gerardus Johannes, van der Linden Jacobus Johannes Maria, Reeder Michael R.
Назва патенту російськоюПромежуточные соединения для получения транс-5-хлор-2-метил-2,3,3а,12в-тетрагидро-1н-дибенз[2,3:6,7]оксепино[4,5-с]пирола
Автори російськоюКемперман Герардус Йоганнес, ван дер Линден Якобус Йоганнес Мария, Ридер Майкл Р.
МПК / Мітки
МПК: C07D 491/04, C07D 313/00
Мітки: сполуки, транс-5-хлор-2-метил-2,3,3а,12в-тетрагідро-1н-дибенз[2,3:6,7]оксепіно[4,5-с]піролу, проміжні, отримання
Код посилання
<a href="https://ua.patents.su/11-93043-promizhni-spoluki-dlya-otrimannya-trans-5-khlor-2-metil-233a12v-tetragidro-1n-dibenz2367oksepino45-spirolu.html" target="_blank" rel="follow" title="База патентів України">Проміжні сполуки для отримання транс-5-хлор-2-метил-2,3,3а,12в-тетрагідро-1н-дибенз[2,3:6,7]оксепіно[4,5-с]піролу</a>
Попередній патент: Спосіб обробки матеріалу для розмноження толерантних або резистентних до нематод рослин та матеріал для розмноження рослин
Наступний патент: Кристалічна форма малеату азенапіну
Випадковий патент: Спосіб відновлення рульового наконечника