Спосіб одержання 3-{2-[4-(6-фторбензо[d]ізоксазол-3-іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро-4н-піридо[1,2-а]піримідин-4-ону та проміжні сполуки цього способу
Номер патенту: 80114
Опубліковано: 27.08.2007
Автори: Кампс Франсеск Кс., Пасто Мірейя, Раментоль Хорхе, Сальярес Хуан, Гордо Естер, Петсчен Інес, Арменголь Мігель П., Фернандес-Кано Дьєго, Фогет Рафаель
Формула / Реферат
1. Спосіб одержання 3-{2-[4-(6-фторбензо[d]ізоксазол-3-іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин-4-ону формули I:
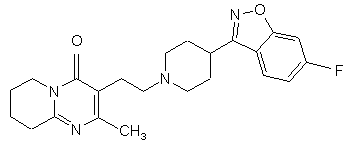 , I
, I
який включає конденсацію (2-метил-4-оксо-6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин-3-іл)ацетальдегіду формули II:
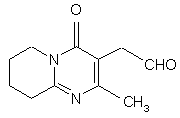 , II
, II
6-фтор-3-(4-піперидиніл)-1,2-бензізоксазолом формули IV:
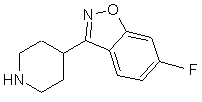 , IV
, IV
або будь-якою з його солей для одержання проміжного енаміну 3-{2-[4-(6-фторбензо[d]ізоксазол-3-іл)піперидин-1-іл]-вініл}-2-метил-6,7,8,9-тетрагідропіридо[1,2-а]піримідин-4-ону формули III:
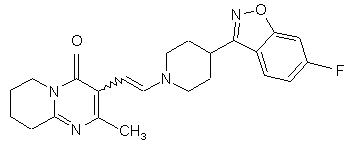 , III
, III
з наступним його відновленням у присутності гідриду, необов’язково в присутності солі, кислоти або неорганічної основи і в присутності прийнятного інертного розчинника реакціями, що здійснюють або з виділенням проміжної сполуки формули III, або без виділення в процесі одностадійного синтезу.
2. Спосіб за п. 1, в якому відновлення реакційноздатного проміжного енаміну формули III здійснюють гідридом або бораном у прийнятному розчиннику.
3. Спосіб за п. 2, в якому гідрид є ціаноборогідридом натрію або борогідридом натрію, а відновлення здійснюють при необхідності в присутності оцтової кислоти.
4. Спосіб за п. 2, в якому прийнятний розчинник є переважно етанолом.
5. Енамін формули III, який є реакційноздатною проміжною сполукою в синтезі сполуки формули I
 ІІІ.
ІІІ.
6. Альдегід формули II, який є ключовою проміжною сполукою для синтезу сполуки формули І
 ІІ.
ІІ.
7. Спосіб одержання сполуки формули II, який включає окиснення 3-(2-гідроксіетил)-2-метил-6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин-4-ону формули X:
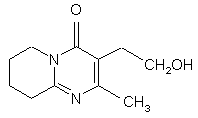 X.
X.
8. Спосіб за п. 7, в якому окиснення проводять переважно за допомогою методик, заснованих на використанні диметилсульфоксиду у присутності електрофільного агента, такого як оксалілхлорид, дициклогексилкарбодіімід, оцтовий ангідрид, трифтороцтовий ангідрид або триоксид сірки.
9. Спосіб за п. 8, в якому реакцію здійснюють з використанням переважно оксалілхлориду як електрофільного агента, у присутності триетиламіну з використанням метиленхлориду як реакційного розчинника.
Текст
1. Спосіб одержання 3-{2-[4-(6фторбензо[d]ізоксазол-3-іл)піперидин-1-іл]етил}-2метил-6,7,8,9-тетрагідро-4Н-піридо[1,2а]піримідин-4-ону формули I: 3 80114 7. Спосіб одержання сполуки формули II, який включає окиснення 3-(2-гідроксіетил)-2-метил6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин-4-ону формули X: O N X CH2OH N CH3 . Представлений винахід стосується способу одержання 3-{2-[4-(6-фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро4Н-піридо-[1,2-а]піримідин-4-ону формули I. Сполука формули І, що відома як рисперидон, є фармацевтично активною сполукою для його нейролептичних властивостей. Подальшим втіленням даного винаходу є сполуки формули ll, (2-метил-4-оксо-6,7Д9-тетрагідро4Н-піридо[1,2-а]піримідин-3-іл)-ацетальдегід і формули Іll, 3-{2-[4-(6-фторбензо[д]ізоксазол-3іл)піперидин-1-іл]-вініл}-2-метил-6,7,8,9тетрагідропіридо[1,2-а]піримідин-4-он. Ці сполуки є синтетичними проміжними сполуками в способі одержання сполуки формули l. Сполуки ll і llІ попередньо описані не були. [ЕР 0196132] розкриває різні способи одержання 3-{2-[4-(6-фторбензо[д]ізоксазол-3іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро4Н-піридо[1,2-а]піримідин-4-ону (l), що включають циклізацію різних проміжних сполук реакцією міжмолекулярної конденсації серед різних функціональних груп, одержуючи 2-метил-6,7,8,9-тетрагідро4Н-піридо[1,2-а]піримідин-4-онову систему. Більшість цих методик, як правило, полягає в сумісному використанні дуже складних проміжних сполук і здійсненні проблематичних реакцій на кінцевих стадіях синтезу, що неодмінно впливає на загальну вартість кінцевого процесу. [В ЕР 0196132], 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]етил}-2метил-6,7,8,9-тетрагідро-4Н-піридо[1,2а]піримідин-4-он (l) може також бути одержаний за допомогою іншого способу, що включає створення C-N зв'язку за допомогою міжмолекулярної реакції 4 8. Спосіб за п. 7, в якому окиснення проводять переважно за допомогою методик, заснованих на використанні диметилсульфоксиду у присутності електрофільного агента, такого як оксалілхлорид, дициклогексилкарбодіімід, оцтовий ангідрид, трифтороцтовий ангідрид або триоксид сірки. 9. Спосіб за п. 8, в якому реакцію здійснюють з використанням переважно оксалілхлориду як електрофільного агента, у присутності триетиламіну з використанням метиленхлориду як реакційного розчинника. N-алкілування 6-фтор-3-(4піперидиніл)бензо[д]ізоксазолу (IV) з 3-(2хлоретил)-2-метил-6,7,8,9-тетрагідро-4Нпіридо[1,2-а]піримідин-4-оном або аналогічних похідних з іншими групами, що відходять (V) (С хема 1). [ES2006888, ES2006889 і ES2050069] розкривають різні способи одержання 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]етил}-2метил-6,7,8,9-тетрагідро-4Н-піридо-[1,2а]піримідин-4-ону (l), які, як правило, полягають у заключній стадії внутрішньомолекулярної циклізації різних типів споріднених проміжних сполук для забезпечення наявності ізоксазольного кільця у бажаному продукті. [ES2074966] розкриває спосіб одержання 3-(2[4-(6-фторбензо[д]ізоксазол-3-іл)піперидин-1іл]етил}-2-метил-6,7,8,9-тетрагідро-4Н-піридо-[1,2а]піримідин-4-ону (l) заснований на кінцевій циклізації піперидинового кільця за допомогою подвійної міжмолекулярної реакції N-алкілування 3-(2аміноетил)-2-метил-6,7,8,9-тетрагідро-4Нпіридо[1,2-а]піримідин-4-ону (Vll) з пентанподібним похідним, що містить бензо[д]ізоксазол систему і дві групи, що відходять, в положеннях 1 і 5 загальної формули VIII, (Схема 2). 5 80114 Одним з вихідних матеріалів, що використовується при одержанні проміжної сполуки VIM. є 4тетрагідропіранкарбонілхлорид (lХ) який не наявний у продажу. Крім того, одержання VIll від lХ включає п'ять стадій [ES2074966]. Представлений винахід забезпечує альтернативний спосіб одержання 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]етил}-2метил-6,7,8,9-тетрагідро-4Н-піридо[1,2а]піримідин-4-ону (l), який проілюстрований у Схемі 3: 6 Сполуку формули Д представленого винаходу, (2-метил-4-оксо-6,7,8,9-тетрагідро-4Н-піридо[1,2а]піримідин-3-іл)-ацетальдегід одержують з 3-(2гідроксиетил)-2-метил-6,7,8,9-тетрагідро-4Нпіридо[1,2-а]піримідин-4-ону (X), одержання цієї сполуки [описано у Н. Fujita і інші Ann. Rep. Sankyo Res. Lab. 1977, 29, 75-78]. Енамін формули Іll, 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]-вініл}-2метил-6,7,8,9-тетрагідропіридо[1,2-а]піримідин-4он, одержують з альдегіду ll і конденсацією з 6фтор-3-(4-піперидиніл)бензо[д]ізоксазолу формули IV [одержання сполуки lV описано в ES8405791]. Заявники з'ясували, що енамін формули Іll здатний легко відновлюватися до 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]етил}-2метил-6,7,8,9-тетрагідро-4Н-піридо[1,2а]піримідин-4-ону (l) за допомогою дії відновлювапьного агента. Альтернативно, утворювання кінцевого продукту, 3-{2-[4-(6-фторбензо[д]ізоксазол-3іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро4Н-піридо[1,2-а]піримідин-4-ону (l), може відбуватися безпосередньо і переважно з (2-метил-4оксо-6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин3-іл)-ацетальдегіду (ll) і 6-фтор-3-(4піперидиніл)бензо[д]ізоксазолу (ІV) при умовах відновлювального амінування в процесі одностадійного синтезу. Спосіб, описаний в представленому винаході, унікальним чином об'єднує ефективний синтез і відповідність вимогам до витрат, екологічну безпеку при виробництві активної субстанції рисперидону (l). Хімічний спосіб можна легко відтворити в промисловому масштабі завдяки простим і високопродуктивним стадіям синтезу, з одержанням високоякісного кінцевого продукту. Сполуки формули ll і Іll попередньо не описані і складають частину даного винаходу. Для окиснення 3-(2-гідроксиетил)-2-метил6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин-4-ону (X), для одержання 2-метил-4-оксо-6,7,8,9тетрапдро-4Н-тридо[1,2-а]піримідин-3-іл)ацетальдегіду (ll), перевага надається способам, заснованим на використанні диметилсульфоксиду у присутності електрофільного агента, такого як дициклогексилкарбодіімід, оцтовий ангідрид, трифтороцтовий ангідрид, триоксид сірки або, переважно, оксалілхлорид. Реакція проводиться в інертному розчиннику, переважно метиленхлориді і в присутності основи, переважно триетиламіні, при температурі в діапазоні від -78°С до кімнатної температури. Реакція конденсації між (2-метил-4-оксо6,7,8,9-тетрагідро-4Н-піридо[1,2-а]піримідин-3-іл)ацетальдегідом (ll) і 6-фтор-3-(4-піперидиніл)-1,2бензізоксазолом (lV) або кожною з їх солей, для одержання проміжного енаміну lll, здійснюється в інертному розчиннику, переважно толуолі, при температурі в діапазоні від 20°С до 150°С, переважно, при температурі кипіння. Реакція може каталізуватися шля хом додавання кислоти або основи. Реакція може бути полегшена зсувом хімічної рівноваги завдяки видаленню з системи вивільнюваної води, наприклад, використанням 7 80114 молекулярних сит, або інших десікантів. Переважно, вода може бути видавлена з реакційного середовища азеотропною перегонкою. Відновлення проміжного енаміну lll, для одержання кінцевої сполуки І може бути здійснено, використовуючи різноманітні гідриди, такі як гідрид натрію, гідрид калію, гідрид магнію, гідрид кальцію, борогідрид натрію, ціаноборогідрид натрію, трисацетоксиборогідрид натрію, гідрид літію, алюмогідрид літію, алюмогідрид натрію, гідрид алюмінію, біс(2-метоксиетокси)алюмогідрид натрію, моно(С1літію, ді(С14алкокси)алюмогідрид літію, діетилалюмогідрид 4алкокси)алюмогідрид натрію або їх суміші, при необхідності в присутності солі, основи або неорганічної кислоти. Відновлення може також бути здійснено, використовуючи боран або диборан, при необхідності в присутності аміну. Переважно, використовують ціаноборогідрид натрію або борогідрид натрію в присутності оцтової кислоти. Реакція може бути здійснена в різних слабо полярних розчинниках, таких як тетрагідрофуран (ТГФ), етиловий етер, третбутилметиловий етер, суміші толуолу і ТГФ і т.п., або полярних розчинниках, таких як етанол, метанол, ізопропанол, бутанол, або інших спиртах з високою точкою кипіння, таких як вода, суміші етанолу та води і т.п., найбільш прийнятним є етанол. Температура реакції може знаходитися в діапазоні від -20°С до 80°С, переважно, приблизно 25°С. Наступні Приклади призначені для ілюстрації представленого винаходу, але без обмеження його рамок. Приклад 1: (2-метил-4-оксо-6,7,8,9-тетрагідро4Н-піридо[1,2-а]піримідин-3-іл)-ацетальдегід (ll). До суміші, яку перемішували 2,2мл (25,22ммолів) оксалілхлориду в 70мл зневодженого метиленхлориду, при низькій температурі (-70°С до -50°С) та в умовах інертної атмосфери додавали 4,1мл (57,78ммолів) диметилсульфоксиду. Після цього додавали розчин 5г (24,02ммолів) 3-(2гідроксиетил)-2-метил-6,7,8,9-тетрагідро-4Нпіридо[1,2-а]піримідин-4-ону (X) в 30мл метиленхлориду. Через 30 хвилин додавали 14,6мл (104,75ммолів) триетиламіну і суміш нагрівали протягом 45 хвилин при кімнатній температурі. Вливали 75мл води і зневоджували органічну фазу. Водну фазу вилучали метиленхлоридом. Всі органічні фази сушили над безводним сульфатом натрію, фільтрували і розчинник випаровували з одержанням 4,90г (99%) (2-метил-4-оксо-6,7,8,9тетрагідро-4Н-піридо[1,2-а]піримідин-3іл)ацетальдегіду (ll) у вигляді масляного залишку. Одержана таким чином сполука, була достатньо чистою для використання на наступній стадії реакції без попереднього очищення. 1 Н ЯМР (CDCI3), δ (м.ч.): 9,71 т, J=1,2Гц, 1H, альдегід; 3,93 т, J=6,0Гц, 2Н, CH2-N); 3,66 д, J=1,2Гц, 2Н, СН2СНО; 2,90 т, J=6,8Гц, 2Н, СН2СВrС (N)=N; 2,22 с, 3Н, СН3; 2,00-1,85м, 4Н, СН2СН2СН2СН2. 13 С ЯМР (CDCI3), δ (м.ч.): 198,59 СНО; 162,65 NCO; 160,69 N-C=N; 157,49 N-C=C; 113,25 C=C-N; 43,22, 41,31, 31,72 3´СН2; 22,06, 19,36 СН2СН2СН2СН2; 21,80 СН3. Rf (SiO2/етилацетат: метанол, 9:1)=0,2 8 Приклад 2: 3-{2-[4-(6-фторбензо[д]ізоксазол-3іл)піперидин-1-іл]-вініл}-2-метил-6,7,8,9тетрагідропіридо[1,2-а]піримідин-4-он (lll). Суміш 2,96г (14,33ммолів) (2-метил-4-оксо6,7,8,9-тетрапдро-4Н-піридо[1,2-а]піримідин-3іл)ацетальдегіду (ll), 3,16г (14,33ммолів) 6-фтор-3(4-піперидиніл)-1,2-бензізоксазолу (lV) і 50мл толуолу поміщали до Dean Stark апарату. Суміш доводили до точки кипіння, нагрівали зі зворотним холодильником протягом 3 годин і розчинник випаровували при зниженому тиску з одержанням 5,70г (97,3%) 3-{2-[4-(6-фторбензо[д]ізоксазол-3іл)піперидин-1-іл]вініл}-2-метил-6,7,8,9тетрагідропіридо[1,2-а]піримідин-4-ону (lll) у вигляді твердої речовини глибокого оранжевого кольору. Одержана таким чином сполука була достатньо чистою для використання в наступній стадії реакції без попереднього очищення або необхідності кристалізувати з органічного розчинника, переважно етанолу. 1 Н-ЯМР (CDCI3), δ (м.ч.): 7,85 д, J=14Гц, 1Н, =CHN; 7,67 дд, J1=8,8Гц, J2=4,8Гц, 1H, СН ароматичний; 7,25 дд, J1=8,4Гц, J2=2,0Гц, 1Н, СН ароматичний; 7,07м, 1Н, СН ароматичний; 5,16 д, J=14Гц, 1Н, CH=CHN; 3,97 т, J=6,4Гц, 2Н, CH2NCO; 3,65 д, J=12,8Гц, 2Н; 3,23 м, 1Н; 2,95 м, 2Н; 2,88 т, J=6,6Гц, 2Н, CH2C=N (Ν); 2,34 с, 3Н, СН3; 2,11 м, 4Н; 1,97м,2Н; 1,88 м, 2Н. 13 С-ЯМР (CDCI3), δ (м.ч.): 165,32-162,83, д, JC=249Гц, С ароматичний; 163,92-163,79, д JCF F=13Гц, С ароматичний; 162,83 С ароматичний; 160,98 С ароматичний; 160,64 С ароматичний; 152,60 С ароматичний; 143,59 СН енамін; 122,40122,29 д JC-F=11Гц, СН ароматичний; 118,42 С ароматичний; 117,13-117,1 д JC-F=2Гц, С ароматичний; 112,53-112,28 д, JC-F=25Гц, СН ароматичний; 97,58-97,31 д, JC-F=27Гц, СН ароматичний; 91,87 СН енамін; 48,16 СН2; 42,55 СН2; 34,43 СН; 31,29 СН2; 29,69 СН2; 22,19 СН2; 22,07 СН3; 19,38 СН2; Rf (SіО2/етилацетат: метанол, 9:1)=0,21 Rf (SіО2/хлороформ: метанол, 9:1)=0,50. Приклад 3: 3-{2-[4-(6-фторбензо[д]ізоксазол-3іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро4Н- піридо[1,2-а]піримідин-4-он (I). До суспензії 1,39г (3,42ммолів) 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]-вініл}-2метил-6,7,8,9-тетрагідропіридо[1,2-а]піримідин-4ону (III) у 22мл абсолютного етанолу і 1мл льодяної оцтової кислоти при перемішуванні при кімнатній температурі й у захисній атмосфері, додавали невеликими порціями 0,254г (4,04ммолів) ціаноборогідриду натрію протягом 1 години. Через 1,5 години, розчинник випаровували і одержаний неочищений продукт розчиняли у 250мл етилацетату. Органічну фазу послідовно промивали 50мл 1Μ водного розчину бікарбонату натрію, 50мл води і 50мл насиченого розчину хлориду натрію і висушували над безводним сульфатом магнію. Одержаний розчин фільтрували і розчинник випаровували з одержанням 1,17г залишку у вигляді твердої речовини (83%), який розводили у метиленхлориді й очищали за допомогою колоночної силікагелевої хроматографії. Елюювання колонки здійснювали метиленхлоридом, метанолом і триетиламіном (95:5:1). Очищені фракції збирали і 9 80114 розчинник випаровували при зниженому тиску, одержуючи 0,83г (70,9%) 3-{2-[4-(6фторбензо[д]ізоксазол-3-іл)піперидин-1-іл]етил}-2метил-6,7,8,9-тетрагідро-4Н-піридо[1,2а]піримідин-4-ону (I). При необхідності, неочищений продукт реакції очищали кристалізацією із прийнятного органічного розчинника, переважно етанолу або 4-метил-2-пентанону. 1 Н-ЯМР (CDCI3), δ (м.ч.): 7,71 дд, J1=8,8Гц, J2=5,2Гц, 1Н, СН ароматичний; 7,23 дд, J1=8,6Гц, J2=2,2Гц, 1Н, СН ароматичний; 7,05 ддд, J1=8,8Гц, J2=8,6Гц, J3=2,2Гц, 1Н, СН ароматичний; 3,93 т, J=6,2Гц, 2Н, СН2; 3,18 д, J=11,6Гц, 2Н, СН2; 3,08 м, 1Н, СН; 2,87 т, J=6,6Гц, 2Н, СН2; 2,77 м, 2Н, СН2; Комп’ютерна в ерстка Т. Чепелев а 10 2,55 м, 2Н, СН2; 2,31 с, ЗН, СН3; 2,27 м, 2Н, СН2; 2,09 м, 4Н, 2´СН2; 1,96 м, 2Н, СН2; 1,89 м, 2Н, СН2. 13 С-ЯМР (CDCI3), δ (м.ч.): 165,26-166, 77, д, JCF=249Гц, С ароматичний; 163,88-163,75, д, JCF=14Гц, С ароматичний; 162,56; 161,09 С ароматичний; 158,39 С ароматичний; 155,87 С ароматичний; 122,67-122,55 д, JC-F=11Гц, СН ароматичний; 119,27 С ароматичний; 117,28 С ароматичний; 112,35-112,10 д, JC-F=25Гц, СН ароматичний; 97,48-97,21 д, JC-F=27Гц, СН ароматичний; 56,68 СН2; 53,35 СН2; 42,66 СН2; 34,59 СН; 31,41 СН2; 30,53 СН2; 23,74 СН2; 21,95 СН2; 21,24 СН3; 19,20 СН2. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing 3-(2-(4-(6-fluorobenzo(d) isoxazol-3-yl)-piperidin-1yl)-ethyl)-2-methyl-6,7,8,9-tetrahydro-4h-pyrido-(1,2-a) pyrimidin-4-one and derivatives
Назва патенту російськоюСпособ получения 3-{2-[4-(6-фторбензо[d] изоксазол-3-ил) пиперидин-1-ил]этил}-2- метил-6,7,8,9-тетрагидро-4н-пиридо[1,2-а] пиримидин-4-она и промежуточные соединения этого способа
МПК / Мітки
МПК: C07D 413/14, A61K 31/505, C07D 471/04
Мітки: цього, одержання, сполуки, проміжні, спосіб, способу, 3-{2-[4-(6-фторбензо[d]ізоксазол-3-іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро-4н-піридо[1,2-а]піримідин-4-ону
Код посилання
<a href="https://ua.patents.su/5-80114-sposib-oderzhannya-3-2-4-6-ftorbenzodizoksazol-3-ilpiperidin-1-iletil-2-metil-6789-tetragidro-4n-pirido12-apirimidin-4-onu-ta-promizhni-spoluki-cogo-sposobu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-{2-[4-(6-фторбензо[d]ізоксазол-3-іл)піперидин-1-іл]етил}-2-метил-6,7,8,9-тетрагідро-4н-піридо[1,2-а]піримідин-4-ону та проміжні сполуки цього способу</a>
Попередній патент: Ручний пальник з постачанням порошку для лазерного зварювання плавленням
Наступний патент: Амінокислоти, споріднені до альфа-2-дельта-протеїну
Випадковий патент: Спосіб ранньої діагностики судомного синдрому у новонароджених з метаболічним ацидозом









