Схема синтезу лакозаміду
Формула / Реферат
1. Спосіб одержання (R)-2-ацетамідо-N-бензил-3-метоксипропіонаміду (лакозаміду), в якому здійснюють такі стадії:
(і) О-метилування сполуки формули І
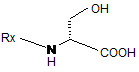
Формула І
з одержанням сполуки формули II
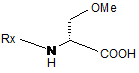 ,
,
Формула II
де Rx є група захисту N;
(іі) проведення реакції сполуки формули II, факультативно - після активації карбоксильної групи, з бензиламіном з одержанням сполуки формули III
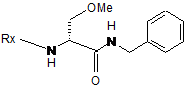 ,
,
Формула III
з подальшою заміною групи захисту Rx метилкарбонілом з одержанням (R)-2-ацетамідо-N-бензил-3-метоксипропіонаміду (лакозаміду);
який відрізняється тим, що реакцію О-метилування на стадії (і) виконують як одностадійну реакцію, а сполуку формули II одержують у формі R-енантіомера із чистотою щонайменше 88 %; причому спосіб здійснюють або (а) як міжфазний каталіз, або (b) шляхом додання до сполуки формули І метилувального реагенту та літійорганічної сполуки.
2. Спосіб за п. 1, який включає додання метилувального реагенту до реакційної системи з фазовим перенесенням, яка включає сполуку формули І, водну фазу, органічну фазу та каталізатор фазового перенесення.
3. Спосіб за п. 2, який відрізняється тим, що як каталізатор фазового перенесення застосовують сіль фосфонію, амонію або сульфонію.
4. Спосіб за будь-яким з пп. 2-3, який відрізняється тим, що каталізатор фазового перенесення вибраний з групи, до якої входять сполуки:
(а) загальної формули IV
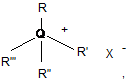
Формула IV
(b) загальної формули V
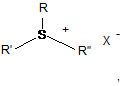
Формула V
де R, R', R" та R'", в разі їх присутності, - алкіли, арили або арилалкіли, що вибирають незалежно один від одного;
Q у сполуках формули IV - азот або фосфор; та
X - галоген, ацетат, пара-толуолсульфонат, трифторметансульфонат, гексафторантимонат, гідроксид, перхлорат, гідросульфат, тіоціанат або тетрафторборат.
5. Спосіб за будь-яким із пп. 2-4, який відрізняється тим, що каталізатором фазового перенесення є бромід тетрабутиламонію.
6. Спосіб за будь-яким із пп. 2-5, який відрізняється тим, що метилувальний агент, використовуваний у міжфазному каталізі, вибраний з групи, яку складають диметилсульфат, триметилфосфат та метилйодид.
7. Спосіб за будь-яким із пп. 2-6, який відрізняється тим, що водною фазою є водний розчин гідроксиду натрію, водний розчин гідроксиду літію, водний розчин гідроксиду калію, водний розчин карбонату натрію або водний розчин карбонату калію.
8. Спосіб за будь-яким із пп. 2-7, який відрізняється тим, що органічним розчинником є толуол, гексан, дихлорметан або метил-трет-бутиловий простий ефір.
9. Спосіб за будь-яким із пп. 1-8, який відрізняється тим, що міжфазний каталіз здійснюють при 0-10 °С протягом щонайменше 30 хв.
10. Спосіб за п. 1, який відрізняється тим, що метилувальним реагентом, застосовуваним у комбінації з літійорганічною сполукою, є диметилсульфат.
11. Спосіб за будь-яким із п. 1 або п. 10, який відрізняється тим, що літійорганічною сполукою є бутиллітій.
12. Спосіб за п. 1 або пп. 10, 11, який відрізняється тим, що О-метилування у присутності літійорганічної сполуки здійснюють при температурі 0-10 °С протягом щонайменше 5 год.
13. Спосіб за п. 1, який відрізняється тим, що реакцію сполуки формули II з бензиламіном здійснюють у присутності активатора карбоксильної групи та основи.
14. Спосіб за п. 13, який відрізняється тим, що основою є 4-метилморфолін, триетиламін, діізопропілетиламін, 1,8-діазабіцикло[5.4.0]ундец-7-ен або бікарбонат калію, а активатором карбоксильної групи є алкілхлорформіат або карбодіімід.
15. Спосіб за будь-яким із пп. 1, 13 та 14, який відрізняється тим, що групу Rx захисту N замінюють метилкарбонілом шляхом послідовного
(a) відщеплення групи захисту Rx від сполуки формули III шляхом додання (і) мінеральної кислоти або (іі) Н2 з каталізатором Pd/C з одержанням (R)-2-аміно-N-бензил-3-метоксипропіонаміду, та подальшого
(b) введення метилкарбонільної групи у (R)-2-аміно-N-бензил-3-метоксипропіонамід шляхом проведення реакції (R)-2-аміно-N-бензил-3-метоксипропіонаміду з оцтовим ангідридом.
16. Спосіб за п. 15, який відрізняється тим, що стадію (b) виконують за відсутності піридину.
17. Спосіб за будь-яким з пп. 1, 13 та 14, який відрізняється тим, що групу захисту Rx відщеплюють з одержанням (R)-2-аміно-N-бензил-3-метоксипропіонаміду.
18. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що лакозамід виділяють із кінцевої реакційної суміші шляхом кристалізації.
19. Спосіб за будь-яким із попередніх пунктів, який відрізняється тим, що групою захисту N є трет-бутоксикарбоніл (Вос).
20. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що здійснюють стадію N-ацетилювання (R)-2-аміно-N-бензил-3-метоксипропіонаміду оцтовим ангідридом за відсутності піридину.
21. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що сполукою формули ІІ є (R)-2-N-Вос-аміно-3-метоксипропіонова кислота (С936) або її сіль.
22. Спосіб за будь-яким із пп. 1 та 13-17, який відрізняється тим, що сполукою формули ІІІ є (R)-N-бензил-2-N-Вос-аміно-3-метоксипропіонамід (С937) або будь-яка його сіль.
23. Застосування (R)-N-бензил-2-N-Вос-аміно-3-метоксипропіонаміду (С937) або будь-якої його солі у способі одержання (R)-2-ацетамідо-N-бензил-3-метоксипропіонаміду (лакозаміду) за будь-яким із пп. 1-21.
24. Спосіб виготовлення фармацевтичної композиції, яка містить лакозамід, шляхом виконання послідовних стадій:
(a) одержання лакозаміду за будь-яким із пп. 1-21 та
(b) змішування лакозаміду із фармацевтично прийнятними допоміжними речовинами.
Текст
1. Спосіб одержання (R)-2-ацетамідо-Nбензил-3-метоксипропіонаміду (лакозаміду), в якому здійснюють такі стадії: (і) О-метилування сполуки формули І OH 2 3 95600 4 , Формула V де R, R', R" та R'", в разі їх присутності, алкіли, арили або арилалкіли, що вибирають незалежно один від одного; Q у сполуках формули IV - азот або фосфор; та X галоген, ацетат, паратолуолсульфонат, трифторметансульфонат, гексафторантимонат, гідроксид, перхлорат, гідросульфат, тіоціанат або тетрафторборат. 5. Спосіб за будь-яким із пп. 2-4, який відрізняється тим, що каталізатором фазового перенесення є бромід тетрабутиламонію. 6. Спосіб за будь-яким із пп. 2-5, який відрізняється тим, що метилувальний агент, використовуваний у міжфазному каталізі, вибраний з групи, яку складають диметилсульфат, триметилфосфат та метилйодид. 7. Спосіб за будь-яким із пп. 2-6, який відрізняється тим, що водною фазою є водний розчин гідроксиду натрію, водний розчин гідроксиду літію, водний розчин гідроксиду калію, водний розчин карбонату натрію або водний розчин карбонату калію. 8. Спосіб за будь-яким із пп. 2-7, який відрізняється тим, що органічним розчинником є толуол, гексан, дихлорметан або метил-третбутиловий простий ефір. 9. Спосіб за будь-яким із пп. 1-8, який відрізняється тим, що міжфазний каталіз здійснюють при 0-10 °С протягом щонайменше 30 хв. 10. Спосіб за п. 1, який відрізняється тим, що метилувальним реагентом, застосовуваним у комбінації з літійорганічною сполукою, є диметилсульфат. 11. Спосіб за будь-яким із п. 1 або п. 10, який відрізняється тим, що літійорганічною сполукою є бутиллітій. 12. Спосіб за п. 1 або пп. 10, 11, який відрізняється тим, що О-метилування у присутності літійорганічної сполуки здійснюють при температурі 0-10 °С протягом щонайменше 5 год. 13. Спосіб за п. 1, який відрізняється тим, що реакцію сполуки формули II з бензиламі ном здійснюють у присутності активатора карбоксильної групи та основи. 14. Спосіб за п. 13, який відрізняється тим, що основою є 4-метилморфолін, триетиламін, діізопропілетиламін, 1,8-діазабіцикло[5.4.0]ундец7-ен або бікарбонат калію, а активатором карбоксильної групи є алкілхлорформіат або карбодіімід. 15. Спосіб за будь-яким із пп. 1, 13 та 14, який відрізняється тим, що групу Rx захисту N замінюють метилкарбонілом шляхом послідовного (a) відщеплення групи захисту Rx від сполуки формули III шляхом додання (і) мінеральної кислоти або (іі) Н2 з каталізатором Pd/C з одержанням (R)2-аміно-N-бензил-3-метоксипропіонаміду, та подальшого (b) введення метилкарбонільної групи у (R)-2аміно-N-бензил-3-метоксипропіонамід шляхом проведення реакції (R)-2-аміно-N-бензил-3метоксипропіонаміду з оцтовим ангідридом. 16. Спосіб за п. 15, який відрізняється тим, що стадію (b) виконують за відсутності піридину. 17. Спосіб за будь-яким з пп. 1, 13 та 14, який відрізняється тим, що групу захисту Rx відщеплюють з одержанням (R)-2-аміно-N-бензил-3метоксипропіонаміду. 18. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що лакозамід виділяють із кінцевої реакційної суміші шляхом кристалізації. 19. Спосіб за будь-яким із попередніх пунктів, який відрізняється тим, що групою захисту N є трет-бутоксикарбоніл (Вос). 20. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що здійснюють стадію N-ацетилювання (R)-2-аміно-N-бензил-3метоксипропіонаміду оцтовим ангідридом за відсутності піридину. 21. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що сполукою формули ІІ є (R)-2-N-Вос-аміно-3-метоксипропіонова кислота (С936) або її сіль. 22. Спосіб за будь-яким із пп. 1 та 13-17, який відрізняється тим, що сполукою формули ІІІ є (R)-N-бензил-2-N-Вос-аміно-3метоксипропіонамід (С937) або будь-яка його сіль. 23. Застосування (R)-N-бензил-2-N-Восаміно-3-метоксипропіонаміду (С937) або будь-якої його солі у способі одержання (R)-2-ацетамідо-Nбензил-3-метоксипропіонаміду (лакозаміду) за будь-яким із пп. 1-21. 24. Спосіб виготовлення фармацевтичної композиції, яка містить лакозамід, шляхом виконання послідовних стадій: (a) одержання лакозаміду за будь-яким із пп. 1-21 та (b) змішування лакозаміду із фармацевтично прийнятними допоміжними речовинами. (R)-2-ацетамідо-N-бензил-3метоксипропіонамід (рекомендована міжнародна назва: лакозамід) є протисудомним лікарським засобом, корисним для лікування епілепсії та болю. Два способи одержання цієї сполуки описані в патенті США № 6,048,899. R Q + R' R''' X , R'' Формула IV (b) загальної формули V R S R' + R'' X 5 Схема 2 за патентом США № 6,048,899 включає утворення бензиламіду перед Ометилуванням. Однак ця схема реакції спричиняє утворення різноманітних домішок, які необхідно видаляти за допомогою хроматографії, що є незручним у промислових масштабах. Крім того, вихід на окремих стадіях становить лише 80-85 %. Схема 1 за патентом США № 6,048,899 включає О-метилування N-захищеного D-серину перед утворенням бензиламіду, відщепленням групи захисту азоту та N-ацетилюванням. Хоча ця схема є більш перспективною основою для переходу до синтезу у збільшеному масштабі, вона має значні вади. Найістотнішою вадою є те, що Ометилування N-захищеного D-серину із застосуванням оксиду срібла (І) та метилйодиду є незручним для практики та дорогим, а також спричиняє часткову рацемізацію (на приблизно 15 %), внаслідок чого вихід на цій стадії знижується до 79 %. Крім того, видалення S-енантіомера при виробництві (R)-2-ацетамідо-N-бензил-3метоксипропіонаміду є надзвичайно складним процесом. На даний час несподівано з'ясовано, що згаданої рацемізації можна уникнути, застосовуючи альтернативні способи О-метилування, наприклад, О-метилування з використанням міжфазного каталізу або О-метилування з використанням літійорганічних сполук та відповідного метилувального реагенту, наприклад, диметилсульфату. Цей винахід також пропонує вдосконалений спосіб синтезу лакозаміду, в якому спосіб Ометилування є селективним відносно спиртової гідроксильної групи N-захищеного D-серину. Відповідно, у порівнянні з неспецифічним метилуванням, запропонованим у схемі 1 за патентом США № 6,048,899, яке також призводить до естерифікації карбоксильної групи, цей винахід забезпечує більш короткий та більш ефективний спосіб синтезу, в якому уникнуто подальшої стадії гідролізу проміжного метилового складного ефіру. Відповідно, цей винахід стосується вдосконаленого способу одержання (R)-2-ацетамідо-Nбензил-3-метоксипропіонаміду, що включає Ометилування сполуки формули І з одержанням сполуки формули II де Rx є група захисту N, який відрізняється тим, що реакцію Ометилування виконують в одну стадію, і в якому 95600 6 рацемізація уникнута, так що сполуку формули II одержують у формі R-енантіомера з енантіомерною чистотою щонайменше 88 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 % і відповідно до варіанта, якому віддається більша перевага, щонайменше 95 %, 96 %, 97 %, 98 % або 99 %. Вислів "виконання реакції в одну стадію" у значенні, вживаному в цій заявці на патент, означає, що у процесі перетворення сполуки формули І у сполуку формули II не утворюється значна кількість (тобто 5 % (моль) або більше) складного ефіру карбоксильної групи, який необхідно гідролізувати на окремій стадії. Звичайно утворюється навіть менше ніж 1 % (моль) складного ефіру, який потім у процесі подальшої переробки у лакозамід видаляють, як описано нижче, без потреби у додатковій стадії гідролізу. О-метилування відповідно до цього винаходу можна виконувати шляхом додання до сполуки формули І, наприклад, до N-Boc-D-серину, метилувального реагенту у присутності металоорганічної сполуки, відповідно до варіанта, якому віддається перевага, літійорганічної сполуки. Придатними для цього метилувальними реагентами є, наприклад, диметилсульфат, триметилфосфат або метилйодид, найбільша перевага віддається диметилфульфату. Серед літійорганічних сполук перевага віддається алкіллітієвим сполукам, наприклад, бутиллітію, метиллітію або гексиллітію, або ариллітієвим сполукам, наприклад, феніллітію. Літійорганічними сполуками, яким віддається більша перевага, є трет-бутиллітій та нбутиллітій, а особлива перевага віддається нбутиллітію. Відповідно до альтернативного варіанта, можна застосовувати інші металоорганічні сполуки, які містять зв'язок метал-вуглець, наприклад, цинкорганічні сполуки, в тому числі цинкгалогенорганічні сполуки, алюмінійорганічні сполуки, в тому числі алюмінійгалогенорганічні сполуки, оловоорганічні сполуки, в тому числі оловогалогенорганічні сполуки, або/та магнійорганічні сполуки, в тому числі магнійгалогенорганічні сполуки (реагенти Гріньяра), де галоген означає СІ, Br або/та І. Органічним фрагментом може бути арил або алкіл. Перевага віддається реагентам Гріньяра алкіл-MgY або арил-Mg-Y, де Y є СІ, Br або І. Як розчинники можна застосовувати суміші THF/2метоксіетиловий простий ефір, діетоксиметан або відповідно до варіанта, якому віддається перевага, THF. Реакцію проводять, як правило, протягом щонайменше 5 год. при 0-10 °C, краще протягом 724 год. при 0-10 °C, найкраще протягом 9-18 год. при 0-5 °C. Реакцію можна виконувати також при вищих або нижчих температурах, наприклад, при будь-якій температурі в межах від -10 °C до +25 °C, за умови відповідного коригування часу проведення реакції. Якщо групою Rx захисту N у сполуці формули І є N-Boc, то типову реакцію можна ілюструвати поданою нижче схемою (Стадія 1-А): 7 Несподіваним є те, що в цьому процесі не утворюється метиловий складний ефір та не відбувається значна рацемізація продукту. Експериментальний вихід становить 91 %, причому основними домішками є продукти N-метилування (дивись, наприклад, Приклад 1). Тому вихід на стадії метилування способом відповідно до цього винаходу при застосуванні металоорганічної сполуки може становити щонайменше 85 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 %. У типових випадках кількість домішкового складного ефіру після метилування із застосуванням металоорганічної сполуки або, відповідно до варіанта, якому віддається перевага, літійорганічної сполуки, зокрема, після стадії 1а, становить значно менше 1 % (моль), відповідно до варіанта, якому віддається перевага, менше 0,1 % (моль), і, як правило, є нижчою від порога виявлення. Відповідно до альтернативного способу, селективне О-метилування спиртової групи Nзахищеного D-серину виконують шляхом міжфазного каталізу («PTC»). PTC - це метод, в якому використовуються гетерогенні двофазові системи, де одна фаза є водною або твердою фазою та джерелом реакційноздатних аніонів або основою для утворення органічних аніонів, а органічні реагенти та каталізатори знаходяться у другій, органічній фазі. Як каталізатори фазового перенесення звичайно застосовуються четвертинні солі амонію, фосфонію або сульфонію, наприклад, галогеніди тетраалкіламонію. Придатні для здійснення цього винаходу каталізатори та реагенти для РТС постачаються на ринок численними виробниками, наприклад, фірмами Sigma-Aldrich або Hawks Chemical. Відповідно, один із варіантів здійснення цього винаходу стосується способу одержання лакозаміду, який відрізняється тим, що сполуку формули І О-метилують для одержання сполуки формули II шляхом проведення реакції за методом міжфазного каталізу. У типових випадках цей метод включає додання метилувального реагенту, наприклад, диметилсульфату, метилйодиду або триметилфосфату, ' до реакційної системи з фазовим перенесенням, яка включає сполуку формули І, водну фазу, органічну фазу та каталізатор фазового перенесення. При виконанні РТС відповідно до цього винаходу відповідно до варіанта, якому віддається перевага: 95600 8 (a) метилувальний агент вибраний з групи, яку складають диметилсульфат, метилйодид та триметилфосфат, причому особлива перевага віддається диметилсульфату; (b) першою (водною) фазою є водний розчин лугу, наприклад, водний розчин гідроксиду натрію, гідроксиду літію, гідроксиду калію, карбонату натрію або карбонату калію, причому особлива перевага віддається водному розчину гідроксиду натрію; (c) друга (органічна) фаза вибрана з групи, яку складають толуол, гексан, дихлорметан та метилтрет-бутловий простий ефір, причому особлива перевага віддається толуолу; та (d) каталізатором фазового перенесення є сіль амонію або фосфонію формули IV, сіль сульфонію формули V або сіль піридинію формули VI. де R, R', R" та R'" - алкіли, арили або аралкіли, що вибираються незалежно один від одного; Q — азот або фосфор і X - галоген, ацетат, паратолуолсульфонат, трифторметансульфонат, гексафторантимонат, гідроксид, перхлорат, гідросульфат, тіоціанат або тетрафторборат. Прикладами придатних каталізаторів фазового перенесення є пара-толуолсульфонат тетраетил амонію, трифторметансульфонат тетрапропі 9 ламонію, гексафторантимонат тетрафенілфосфонію, бромід цетилпіридинію, хлорид трифенілметил-трифенілфосфонію, хлорид бензилтриетиламонію, хлорид бензилтриметиламонію, хлорид бензилтрифенілфосфонію, хлорид бензилтрибутиламонію, бромід бутилтриетиламонію, бромід бутилтрифенілфосфонію, бромід цетилтриметиламонію, хлорид цетилтриметиламонію, бромід етилтрифенілфосфонію, йодид етилтрифенілфосфонію, бромід метилтриоктил-амонію, бромід метилтрифенілфосфонію, йодид метилтрифенілфосфонію, хлорид фенілтриметиламонію, гідроксид тетрабутиламонію, перхлорат тетрабутиламонію, бромід тетрабутиламонію, гідросульфат тетрабутиламонію, йодид тетрабутил-амонію, тетрафторборат тетрабутиламонію, тіоціанат тетрабутиламонію, гідроксид тетраетиламонію, йодид тетраетиламонію, бромід тетраетиламонію, хлорид тетраметиламонію, йодид тетраметиламонію, хлорид тетраметиламонію, бромід тетраоктиламонію, бромід тетрафенілфосфонію, гідроксид тетрапропіламонію, бромід тетрапропіламонію та хлорид трибутилметиламонію, причому особлива перевага віддається солям тетрабутиламонію, зокрема, галогенідам тетрабутиламонію, наприклад, броміду. При виконанні РТС відповідно до цього винаходу придатні концентрації визначених вище компонентів (a)-(d) відповідають таким умовам: (a) кількість метилувального реагенту становить від 1 молярного еквівалента до 5 молярних еквівалентів відносно сполуки формули І; (b) водний розчин лугу має масову концентрацію від 5 % до 50 %, і кількість лугу становить від 1,1 молярного еквівалента до 10 молярних еквівалентів відносно сполуки формули І; (c) кількість органічного розчинника відносно сполуки формули І відповідно до варіанта, якому віддається перевага, становить від 3 об'ємів до 20 об'ємів, зокрема, 3-20 л/кг сполуки формули І; (d) кількість каталізатора фазового перенесення становить від 0,01 молярного еквівалента до 0,1 молярного еквівалента відносно сполуки формули І. У цьому винаході, зокрема, у формулах IV-VI, термін "арил" означає заміщену одним або кількома -замісниками або незаміщену ароматичну групу, яка містить у циклі (циклах) від 6 атомів вуглецю до 18 атомів вуглецю та загальну кількість атомів вуглецю до 25 атомів і охоплює поліциклічні ароматичні групи. Ці арильні групи можуть бути моноциклічними, біциклічними, трициклічними або поліциклічними і можуть являти собою системи з конденсованими циклами. Термін "поліциклічна ароматична сполука" у значенні, вживаному в цьому описі, означає біциклічні конденсовані ароматичні системи, які містять у циклах від 10 атомів вуглецю до 18 атомів вуглецю та загальну кількість атомів вуглецю до 25 атомів. В арильній групі атоми вуглецю в кількості від одного до шести можуть бути замінені гетероатомами, наприклад, атомами кисню, сірки або/та азоту. Термін "арил" охоплює незаміщений феніл; незаміщений наф 95600 10 тил; феніл або нафтил, заміщені одним або кількома замісниками, наприклад, вибраними з групи, до якої входять гідроксил, карбоксил, галоген, нітрогрупа, C1-С6-алкіл, C1-С6-алкокси-, аміногрупа; заміщені або незаміщені гетероарили, наприклад, піроліл, тієніл, індоліл тощо. У цьому винаході, зокрема, у формулі IV, арил відповідно до варіанта, якому віддається перевага, вибраний з групи, яка включає незаміщений феніл та заміщені феніли, наприклад, 2,6-дифторфеніл, пара-нітрофеніл та пара-толуїл. Особлива перевага віддається незаміщеному фенілу. У цьому винаході, зокрема, у формулах IV-VI, термін "алкіл" охоплює насичені вуглеводневі ланцюги розгалуженої або лінійної будови. Відповідно до варіанта, якому віддається перевага, "алкіл" є вуглеводневий ланцюг розгалуженої або нормальної будови з кількістю атомів вуглецю до 20 атомів, краще до 6 атомів, найкраще до 4 атомів. Цей вуглеводневий ланцюг може бути заміщеним одним або кількома замісниками або незаміщеним. Прикладами алкілів, яким віддається перевага, є цетил, октил, гептил, пентил, бутил, пропіл, етил та метил. У цьому винаході, зокрема, у формулах IV-VI, термін "аралкіл" означає арил-алкільну групу, де арил та алкіл відповідають поданим вище визначенням. Аралкілом, якому віддається перевага, є бензил. У цьому винаході термін "заміщення" означає заміну атома Н, наприклад, гідроксилом, карбоксилом, галогеном, нітрогрупою, C1-С6-алкілом, C1С6-алкокси-, аміногрупою. Реакцію РТС, як правило, проводять при 0-10 °C протягом щонайменше 30 хв, наприклад, протягом 0,5-24 год., відповідно до варіанта, якому віддається перевага, щонайменше протягом 45 хв, і відповідно до варіанта, якому віддається більша перевага, щонайменше протягом 1 год. РТС відповідно до цього винаходу у специфічних умовах, наприклад, Прикладу 2 (Стадія 1-В) забезпечувала вихід 96 %. Отже, вихід РТС відповідно до цього винаходу може становити щонайменше 85 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 %, відповідно до варіанта, якому віддається більша перевага, щонайменше 91 %, 92 %, 93 %, 94 %, 95 % або 96 %. Сполуку формули І можна одержати від численних постачальників, наприклад, від фірм Sigma-Aldrich або Lancaster. N-Boc-D-серин можна також одержати шляхом проведення реакції Dсерину з ди-тирет-бутилдикарбонатом з утворенням N-Boc-D-серину методом міжфазного каталізу, застосовуючи умови (наприклад, вибір. та концентрація або кількість лугу, розчинник, каталізатори РТС, температура, тривалість реакції тощо), практично аналогічні описаним вище, з тим винятком, що замість метилувального реагенту застосовують ди-трет-бутилдикарбонат. Якщо групою захисту N у сполуці формули І є Вос (трет-бутоксикарбоніл), то реакцію РТС, якій віддається перевага, можна ілюструвати поданою нижче схемою (Стадія 1-В): 11 Ця реакція не спричиняє рацемізації продукту або утворення складного ефіру з нього. Вихід додатково покращується внаслідок того, що кількість домішок становить лише приблизно 1 %. У типових випадках кількість домішкового складного ефіру після метилування із застосуванням РТС, зокрема, після Стадії 1-В, становить менше 1 % (моль), відповідно до варіанта, якому віддається перевага, менше 0,1 % (моль), і, як правило, є нижчою від порога виявлення. Спосіб відповідно до цього винаходу може додатково включати стадію перетворення сполуки формули II у сполуку формули III (Стадія 2): Бензиламід можна одержати шляхом додання до сполуки формули II певної кількості бензиламіну у присутності: (a) основи, наприклад, триетиламіну, діізопропілетиламіну, 1,8-діазабіцикло[5.4.0]ундец-7-ену, бікарбонату калію або похідного морфоліну, причому перевага віддається 4-метилморфоліну; та (b) активатора карбоксильної групи, наприклад, карбодііміду або алкілхлорформіату, причому перевага віддається ізобутилхлорформіату. В експерименті вихід на стадії одержання аміну в умовах, наприклад, Прикладу 3 (стадія 3) становив у типових випадках від 95 % до 100 %. Таким чином, вихід продукту на стадії одержання бензиламіду відповідно до цього винаходу може становити щонайменше 85 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 95600 12 В експерименті вихід на стадії одержання бензиламіду в умовах, наприклад, Прикладу 3 (стадія 2) становив у типових випадках від 90 % до 99 %. Таким чином, вихід продукту на стадії одержання бензиламіду відповідно до цього винаходу може лежати у межах від щонайменше 85 % до 99,9 %, відповідно до варіанта, якому віддається перевага, від щонайменше 90 % до 99 %. Ця стадія 2 в основному описана у патенті США № 6,048,899, який включено до цього опису шляхом посилання. Групами захисту, придатними у способі відповідно до цього винаходу, є, наприклад, третбутоксикарбоніл (Вос) або карбобензоксигрупа (Cbz), причому особлива перевага віддається групі Вос. Групу захисту Rx можна відщепити від сполуки формули III з одержанням (R)-2-аміно-N-бензил-3метоксипропіонаміду, застосовуючи відповідні способи, відомі у галузі. Наприклад, якщо групою захисту Rx є карбобензоксигрупа, її можна відщепити дією Н2 з каталізатором Pd/C, як описано у патенті США № 6,048,899. Якщо групою захисту є група Вос, то її зручно видаляти дією кислоти, наприклад, хлористоводневої кислоти, наприклад, при кімнатній температурі (стадія 3). %, відповідно до варіанта, якому віддається більша перевага, щонайменше 95 %. (R)-2-аміно-N-бензил-3-метоксипропіонамід можна потім перетворити у лакозамід шляхом Nацетилювання із застосуванням оцтового ангідриду (стадія 4). 13 В експерименті вихід на стадії ацетилювання в умовах, наприклад, Прикладу 3 (стадія 4) становив у типових випадках від 81 % до 95 %. Таким чином, вихід продукту на стадії ацетилювання відповідно до цього винаходу може лежати у межах від щонайменше 70 % до 99 %, відповідно до варіанта, якому віддається перевага, від щонайменше 80 % до 95 %. Ця стадія також описана у патенті США № 6,048,899. Однак патент США № 6,048,899 пропонує застосування оцтового ангідриду у присутності основи, наприклад, піридину. На даний час несподівано виявлено, що чистий (ІІ)-енантюмер можна також ефективно одержувати, якщо токсичний піридин видалений з реакційної суміші. Таким чином, одним із варіантів здійснення цього винаходу є одержання лакозаміду, яке включає стадію N-ацетилювання (R)-2-аміно-Nбензил-3-метоксипропіонаміду оцтовим ангідридом за відсутності основи, зокрема, за відсутності піридину. Перевагою реакції без застосування основи є виключення із процесу токсичних основ, наприклад, піридину. Нарешті, лакозамід можна виділити з реакційної суміші стадії 4 з підвищеним ступенем чистоти шляхом кристалізації з відповідних розчинників, наприклад, з етилацетату. В експерименті лакозамід був одержаний у конкретних умовах Прикладів 1-4 з виходом у типових випадках від 63 % до 70 % (при застосуванні на стадії 1-А бутиллітію) або від 66 % до 75 % (при застосуванні РТС на стадії 1-В). Таким чином, лакозамід можна одержати способом відповідно до цього винаходу із загальним виходом в межах від щонайменше 50 % до 90 %, відповідно до варіанта, якому віддається перевага, від щонайменше 60 % до 80 %. В разі застосування металоорганічної сполуки загальний вихід лакозаміду відповідно до варіанта, якому віддається більша перевага, може бути у межах від щонайменше 60 % до 70 %, відповідно до варіанта, якому віддається найбільша перевага, від щонайменше 63 % до 70 %. В разі застосування РТС загальний вихід лакозаміду відповідно до варіанта, якому віддається більша перевага, може бути у межах від щонайменше 60 % до 75 %, відповідно до варіанта, якому віддається найбільша перевага, від щонайменше 66 % до 75 %. Одержання сполуки формули II зі сполуки формули І охоплюється способом синтезу лакозаміду, як описано вище. Таким чином, предметом цього винаходу є спосіб одержання сполуки формули II зі сполуки формули І шляхом Ометилування, як описано вище, за практичної відсутності утворення метилового складного ефіру або значної рацемізації. У способі відповідно до цього винаходу можна застосовувати похідні D-серину або похідні Lсерину, або суміші похідних D- та L-серину у будьякому співвідношенні. Оскільки при О-метилуванні спиртової ОНгрупи похідних D- або/та L-серину способом відповідно до цього винаходу практично не мають місця ні утворення метилового складного ефіру, ні знач 95600 14 на рацемізація продукту, спосіб одержання сполуки формули II або/та лакозаміду відповідно до цього винаходу забезпечує підвищений вихід та підвищену енантіомерну чистоту одержаного продукту. Цей винахід стосується також важливих проміжних продуктів описаного процесу. Найважливіший проміжний продукт, (R)-2-NВос-аміно-3-метокси-пропіонову кислоту (С-936), одержують на вдосконаленій стадії О-метилування відповідно до цього винаходу (дивись Фіг. 1). Цю сполуку можна легко виділити з реакційної суміші у формі вільної кислоти або шляхом одержання солі, наприклад, солі циклогексиламонію. Відповідні солі С-936 також розглядаються як частина цього винаходу. Частину цього винаходу становить також (R)N-бензил-2-N-Boc-аміно-3-метоксипропіонамід (С937), який є результатом одержання бензиламіду (стадія 2 Фіг. 1). Ще одним аспектом цього винаходу є застосування С-936 або С-937, або будь-яких їхніх солей як аддуктів або проміжних продуктів у способі одержання (R)-2-ацетамщо-N-бензил-3метоксипропіонаміду (лакозаміду). Ще один аспект цього винаходу стосується способу одержання фармацевтичної композиції шляхом послідовних стадій: (a) одержання лакозаміду способом відповідно до цього винаходу та (b) змішування лакозаміду із фармацевтично прийнятними допоміжними речовинами. Ще одним аспектом цього винаходу є спосіб одержання сполуки формули VIII, який включає Ометилування сполуки формули VII, для одержання сполуки формули VIII, 15 4 де R - Н, група захисту N або/та група, яка мі1 2 3 стить 0-30 атомів С, та де R , R та R незалежно один від одного вибрані з групи, яка включає Н та групи, які містять 0-30 атомів С, який відрізняється тим, що О-метилування виконують в одну стадію, та в якому сполуку формули VIII одержують у такій самій конфігурації, яку має сполука формули VII, з енантіомерною чистотою щонайменше 88%, відповідно до варіанта, якому віддається перевага, щонайменше 90%, відповідно до варіанта, якому віддається більша перевага, щонайменше 95 %, 96 %, 97 %, 98 % або 99 %. Відповідно до варіанта, якому віддається пе1 2 3 ревага, R , R та R незалежно один від одного є водень, -ОН, -SH, -NH2, -NO2, -CN, -COOH, -SOH, 10 10 10 11 SO2H, -SO3H, галоген, -OR , -SR , -NR R , 10 10 10 SOR , -SO2R , -SO3R , заміщений або незаміщений алкіл за поданим вище визначенням, заміщений або незаміщений C2-С6-алкеніл, заміщений 10 або незаміщений C2-С6-алкініл, -(CO)-R , -(CO)-O10 10 R , -O-(CO)-R , заміщений або незаміщений арил за поданим вище визначенням, заміщений або незаміщений C3-С13-гетероарил, що містить 1-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О, заміщений або незаміщений аралкіл за поданим вище визначенням, заміщений або незаміщений C7-С15-алкіларил, заміщений або незаміщений C4-С14гетероарилалкіл, що містить 1-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О; заміщений або незаміщений С4С14-алкілгетероарил, що містить 1-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О; або заміщений або незаміщений C3-С12-циклоалкіл, що містить 0-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О. Відповідно до варіанта, якому віддається бі1 2 3 льша перевага, R - Н, R - Н або/та R - Н. Відповідно до варіанта, якому віддається найбільша 1 2 3 перевага, R - Н, R - Н та R - Н. Відповідно до варіанта, якому віддається пе4 1 ревага, R вибраний з групи, до якої входять R та групи захисту N. Відповідно до варіанта, якому 4 віддається більша перевага, R є група Rx захисту N, описана вище. Відповідно до варіанта, якому віддається ще 1 2 3 4 більша перевага, R - Н, R - Н, R - Н та R - Rx, описана вище. 4 1 2 3 10 11 У замісниках R , R , R , R групи R та R незалежно одна від одної є водень, заміщений або незаміщений алкіл за поданим вище визначенням, заміщений або незаміщений C2-С6-алкеніл, заміщений або незаміщений C2-С6-алкініл, заміщений або незаміщений арилза поданим вище визначенням, заміщений або незаміщений C3-С13гетероарил, що містить 1-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О, заміщений або незаміщений аралкіл за поданим вище визначенням, заміщений або незаміщений C7-С15-алкіларил, заміщений або незаміщений С4-С14-гетероарилалкіл, що містить 1-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О; заміщений або неза 95600 16 міщений C4-С14-алкілгетероарил, що містить 1-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О; або заміщений або незаміщений С3-С12-циклоалкіл, що містить 0-3 гетероатоми, незалежно один від одного вибрані з групи, яка включає N, S, О. 4 1 2 3 10 Термін "заміщення у групах R , R , R , R , R 11 та R " означає заміщення одним або кількома замісниками за поданими вище визначеннями, наприклад, гідроксилом, карбоксилом, галогеном, нітрогрупою, C1-С6-алкілом, C1-С6-алкоксигрупою, аміногрупою тощо. Термін "така сама конфігурація" сполуки формули VIII у порівнянні зі сполукою формули VII означає, що не має місця істотна рацемізація, або що сполуку формули VIII одержують у такій самій конфігурації, яку має сполука формули VII, з енантіомерною чистотою, вказаною вище. Якщо сполука формули VII має R-конфігурацію, то сполука формули VIII також має R-конфігурацію. Якщо сполука формули VII має S-конфігурацію, то сполука формули VIII також має S-конфігурацію. Перевага віддається R-конфігурації сполуки формули VII. Параметр енантіомерної чистоти можна з необхідними змінами застосовувати до сумішей енантіомерів. Якщо сполука формули VII є сумішшю R- та S-конфігурацій, то сполука формули VIII є практично такою самою сумішшю R- та Sконфігурацій, тобто співвідношення кількостей Rта S-конфігурацій залишається практично незмінним, або утворюється енантіомерне співвідношення, вказане нижче. Одержане енантіомерне співвідношення сполуки формули VIII може становити щонайменше 88 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 %, відповідно до варіанта, якому віддається більша перевага, щонайменше 95 %, 96 %, 97 %, 98 % або 99 % енантіомерного співвідношення сполуки формули VII. Термін "виконання реакції в одну стадію" має вказане вище значення. Схема реакції перетворення сполуки формули VII у сполуку формули VIII є узагальненою схемою О-метилування відповідно до цього винаходу для перетворення сполуки формули І у сполуку формули II, як описано вище. Якщо сполука формули 1 2 3 4 VII має R-конфігурацію, R - Н, R - Н, R - Н та R Rx, то сполука формули VIII відповідає сполуці формули II та може бути використана для одержання лакозаміду, наприклад, за описаними вище реакційними стадіями процесу. Використовуючи як вихідні реагенти сполуки формули II або формули VII, можна одержати лакозамід будь-яким способом, придатним для введення у молекулу Nбензиламідогрупи та N-ацетильної групи. Тому відповідно до одного з конкретних варіантів сполу4 ка формули VII має R-конфігурацію, a R - Rx. Найбільша перевага віддається варіанту, в якому 4 1 2 3 R - Rx, R - Н, R - Н, R - Н та сполука формули VII має R-конфігурацію. О-метилування сполуки формули VII відповідно до цього винаходу можна здійснити шляхом додання до сполуки формули VII метилувального реагенту у присутності металоорганічної сполуки, 17 зокрема, літійорганічної сполуки за поданим вище визначенням. Придатні метилувальні реагенти визначені вище. Відповідно до альтернативного варіанта, селективне О-метилування спиртової групи можна здійснити за допомогою міжфазного каталізу, як описано вище. Конкретні варіанти О-метилування сполуки формули VII відповідають описаним вище конкретним варіантам здійснення способу одержання лакозаміду, який включає О-метилування сполуки формули І, зокрема, конкретним варіантам, що стосуються міжфазового каталізу, каталізаторів фазового перенесення, зокрема, визначених формулою IV, формулою V та формулою VI, системи для реакції з фазовим перенесенням та її компонентів, металоорганічних сполук, умов виконання реакції з фазовим перенесенням, подальших стадій та умов реакцій одержання лакозаміду, в тому числі одержання N-бензиламіду, відщеплення груп захисту N та N-ацетилювання тощо. Вихід на стадії метилування сполуки формули VII відповідно до цього винаходу із застосуванням металоорганічної сполуки може становити щонайменше 85 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 %. При застосуванні РТС вихід на стадії метилування сполуки формули VII може становити щонайменше 85 %, відповідно до варіанта, якому віддається перевага, щонайменше 90 %, відповідно до варіанта, якому віддається більша перевага, щонайменше 91 %, 92 %, 93 %, 94 %, 95 % або 96 %. Оскільки при O-метилуванні похідних D- або/та L-серину способом відповідно до цього винаходу практично не мають місця ні утворення метилового складного ефіру, ні значна рацемізація продукту, спосіб одержання сполуки формули VIII шляхом метилування сполуки формули VII забезпечує підвищений вихід та підвищену енантіомерну чистоту одержаного продукту. Винахід додатково ілюструється Фіг. 1 (яка включає альтернативну стадію 1а та альтернативну стадію 1b) та поданими нижче Прикладами. Приклад 1. Одержання (R)-2-N-Вос-аміно-3метоксипропюнової кислоти (С936) із застосуванням бутиллітію (стадія 1а) Розчин N-Boc-D-серину (22 г, 0,107 моль) у безводному тетрагідрофурані (352 мл) охолоджували до температури нижче -10 °C в атмосфері азоту. До цього розчину додавали за допомогою сухої завантажувальної лійки 15 % (мас.) розчин нбутиллітію в гексані (134 мл, 0,216 моль), підтримуючи температуру нижче 10 °C. Одержану суспензію витримували протягом 1 год. при 0-5 °C. Додавали диметилсульфат (12,1 мл, 0,128 моль), підтримуючи температуру 0-5 °C, і витримували реакційну суміш протягом 9 год. при 0-5 °C. Гасили реакційну суміш доданням води (110 мл), підлуговували до рН 10-13 додаванням 30 % розчину гідроксиду натрію (3 мл), і випарювали тетрагідрофуран та гексан у вакуумі. Залишок промивали толуолом (44 мл), після чого підкислювали до рН
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis scheme for lacosamide
Автори англійськоюRiedner Jens, Dunne Gavin
Назва патенту російськоюСхема синтеза лакозамида
Автори російськоюРиднер Енс, Данн Гевин
МПК / Мітки
МПК: C07C 273/18, C07C 275/10, C07C 231/00, C07C 275/16
Мітки: синтезу, схема, лакозаміду
Код посилання
<a href="https://ua.patents.su/11-95600-skhema-sintezu-lakozamidu.html" target="_blank" rel="follow" title="База патентів України">Схема синтезу лакозаміду</a>
Попередній патент: Флавоноїдні сполуки та їх використання
Випадковий патент: Спосіб моделювання двобічної обширної резекції легень












