Спосіб синтезу 9a-гідроксистероїдів
Номер патенту: 98151
Опубліковано: 25.04.2012
Автори: Кьонцьоль Кальман, Тегдеш Аніко, Балог Габор, Ердейі Шандор, Олас Каталін, Ганчош Валеріа, Хантош Габор
Формула / Реферат
1. Спосіб вибіркового синтезу сполук загальної формули (І)
 , (I)
, (I)
де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, шляхом біоконверсії сполук загальної формули (II)
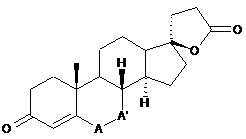 , (II)
, (II)
де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, який відрізняється тим, що застосовують штам бактерії Nocardia farcinica, що депоновано під номером NCAIM (Р) - В 001342, як гідроксилювальний мікроорганізм у біоконверсії.
2. Спосіб за п. 1, який відрізняється тим, що одержують біоконверсію, більшу за 80 %.
Текст
Реферат: Даний винахід стосується вибіркового синтезу 9α-гідроксистероїдних похідних загальної формули (І) O O H OH A' H , (I) де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, шляхом біоконверсії сполук загальної формули (II) O A O O H O A A' H , (II) де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, шляхом застосування штаму бактерії Nocardia farcinica, що депоновано під номером NCAIM (Р) - В 001342, як гідроксилювального мікроорганізму в біоконверсії. UA 98151 C2 (12) UA 98151 C2 UA 98151 C2 Даний винахід стосується нового вибіркового синтезу 9-гідрокси-стероїдних похідних загальної формули (І), 5 10 15 20 25 30 35 40 де -А-А'- означає -СН2-СН2- або -СН=СН- групу - шляхом біоконверсії сполук загальної формули (II), де -А-А'- означає -СН2-СН2- або -СН=СН- групу. Відомо, що 9-гідрокси-стероїди широко застосовують у терапії, як, наприклад, 9-гідрокси похідні стероїдів прегнану мають глюкокортикоїцну активність, а також 9-гідрокси похідні стероїдів андростану застосовують як активні інгредієнти протиандрогенових та протиестрогенових лікарських засобів. Ці 9-гідрокси-стероїди, які не мають замісника в положенні 11, можуть легко дегідратуватися відомими хімічними методами, а таким чином одержані 9(11)-дегідро-стероїди є важливими проміжними сполуками в синтезі сполук, що мають високу біологічну активність. Такі сполуки являють собою, наприклад, гідрокортизон (хімічна назва: 11,17,21-тригідрокси-прегн-4ен-3,20-діон) та преднізолон (хімічна назва: 11,17,21-тригідрокси-прегн-1,4-дієн-3,20-діон), що мають протизапальну активність, або еплеренон (хімічна назва: гамма-лактон 9,11-епокси17-гідрокси-3-оксо-прегна-4-ен-7,21-дикарбонової кислоти), причому останній має широкий профіль призначень; наприклад він зменшує ризик смертності, спричиненої проблемами серця та кровоносних судин, як бета-блокатор, також він застосовується для лікування високого кров'яного тиску та як діуретик. 4 Члени -3-кето-прегнанового сімейства були вперше гідроксильовані в 9-положенні Hanze та колегами в 1958 році за використання штамів нитчастих грибків Cunninghamella та Helicostylum (див.: патент US 3,038,913). У 1960 році Sih та колеги описали 9-гідроксилювання стероїдів за використання мікроорганізмів, що мають ферментну активність Δ'-дегідрогенази за 1 наявності інгібітору Δ -дегідрогенази (див.: патент US 3,065,146). Два роки по тому Sebek здійснили 9-гідроксилювання стероїдів за використання штаму Ascochyta linecola (див.: патент US 3,116,220). У вищезгаданому патенті Sih та колеги також перелічили мікобактерійні штами як мікроорганізми, що мають стероїдні ферменти 9-гідроксилази (див.: патент US 3,065,146). Відомо, що в 1977 році Frederick та колеги виробили новий мікобактерійний штам шляхом мутагенної обробки, який тільки частково розкладав досліджувані стеринові субстрати, і, відтак, були зібрані 9-гідрокси похідні (див.: патент US 4,029,549). Wovcha застосовували той самий штам - Mycobacterium fortuitum NRRL В-8119 штам - для синтезу нових 9-гідрокси похідних (див.: патент US 4,035,236). Wovcha та колеги вивчали роль штаму Mycobacterium fortuitum ATCC 6842 у розкладі стероїдного каркасу. Вони виявили, що ключовим етапом у розкладі на вуглекислий газ та воду 1 є подальше функціонування ферментів Δ -дегідрогенази та 9-гідроксилази. Два етапи конверсії можуть бути взаємно мінятися, тобто обидва етапи реакції можуть виконуватися 1 ферментами два-на-два (групою ферментів); наприклад, один з них, фермент -дегідрогенази, 1 перетворює вихідний матеріал, а інші Δ - дегідрують 9-гідрокси похідну. У своїх 1 UA 98151 C2 5 10 15 20 25 30 35 40 45 50 55 експериментах вони припустили, що можуть бути індуковані вищезазначені ферменти; та за допомогою застосування різних індукторів кількість та склад утворених продуктів значно варіюють [Biochimica et Biophysica Acta 574,471-479(1979)]. У 1981 році Marsheck та колеги здійснили 9а-гідроксилювання стероїдних сполук шляхом використання нового мутантного штаму Nocardia canicruria таким шляхом, що не було 1 необхідним застосовувати інгібітор ферменту Δ -дегідрогенази. У вищевказаних прикладах змальовано синтез 9а-гідрокси-кетолактону (хімічна назва: гамма-лактон 9, 17-дигідрокси-3оксо-17-прегна-4-ен-21 -карбонової кислоти), починаючи з кетолактону (хімічна назва: гамма3 лактон 17-гідрокси-3-оксо-17-прегна-4-ен-21-карбонової кислоти); із застосуванням 0,5 г/дм концентрації кетолактонового субстрату, було одержано бажаний гідроксильований продукт при 30% конверсії (див.: патент US 4,397,947). Серед інших, Mutafov та колеги вивчали індуктивність стероїдного ферменту 9гідроксилази із застосуванням штаму Rhodococcus sp., та виявили, що 9-гідрокси-4-андростен3,17-діон, утворений як продукт, був дуже слабким індуктором, оскільки при використанні його як індуктору швидкість реакції була половинна та кількість утвореного 9-гідрокси продукту складала чверть від тієї, що одержувалася при використанні як індуктору 4-андростен-3,17діону [Process Biochemistry 32(7), 585-589 (1997)]. Brzostek та колеги вивчали розпад стероїдного каркасу на генному рівні та виявили, що 1 блокування ферментної активності -дегідрогенази, потрібної для синтезу 9-гідрокси 1 стероїдних похідних, є важким, оскільки наявні не тільки різні типи ферментів Δ -дегідрогенази, 1 але також геном містить у деяких випадках п'ять генів Δ -дегідрогенази [Microbiology 151, 23932402 (2005)]. Відомо, що мікробіологічний етап здійснюють, окрім етапів хімічної реакції, при синтезі еплеренону, серед інших здійснювали гідроксилювання важливої проміжної сполуки, канренону (хімічна назва: гамма-лактон 17-гідрокси-3-оксо-17-прегна-4,6-дієн-21-карбонової кислоти), з мікроорганізмами (Diplodia, Aspergillus, Absidia sp.) (див.: заявки US № 2004/087562 та № 2004/097475 та подальшу міжнародну заявку РСТ № 2005/000865). Інший синтез еплеренону можуть здійснювати шляхом 9-гідроксилювання канренону. 9гідрокси-канренон (хімічна назва: гамма-лактон 9,17-дигідрокси-3-оксо-17-прегна-4,6-дієн-21 карбонової кислоти) було вперше синтезовано Ng та колегами шляхом мікробіологічного гідроксилювання (див.: міжнародна заявка РСТ № 97/21720 та угорський патент № 222,453) та описано в Прикладі 17 у вищезазначених патентах. 9-гідрокси-канренон як продукт було вперше описано в патентній формулі в 1998 у патенті Ng та колегами (див.: міжнародна заявка РСТ № 98/25948; або пізніше US 7,129,345). Міжнародна пошукова та екзаменаційна установа виявила 18 незалежних винаходів у міжнародних заявках РСТ № 97/21720 та 98/25948, отже, вони запропонували винахіднику подати селекційні патентні заявки. В результаті цього було подано більше, ніж 100 патентних заявок, декілька з яких містять Приклад 17 вищезгаданого патенту WO 97/21720 (див.: РСТ № 2005/239761). У вищезазначеному Прикладі 17 подано скринінговані дані 83 мікроорганізмів, які потенційно мають стероїдну 9-гідроксилювальну ферментну активність та дають ТШХ, ВЕРХ/УФ та РХ/МС дані продуктів, одержаних під час біоконверсії канренону. З поданої там таблиці можна тільки побачити, чи може 9-гідрокси-канренон бути виявлений шляхом вищезазначених аналітичних методів у можливих продуктах чи ні. В цій таблиці наявна мікобактерія Mycobacterium fortuitum ATCC 6842 штам, але немає аналітичних даних, поданих у відповідних стовпчиках. Здатність цього штаму до біоконверсії відома з літератури [публікації, починаючи з 1936, Acta Med. Rio de Janeiro 1,1], відтак, можна припустити, що мав місце розпад канренону (див. патенти US № 4,029,549 та 4,035,236). Це припущення підтверджується публікацією, яка була підготовлена в 2003 році мікробіологами, винахідниками вищезазначеної патентної родини. Публікація містить ту саму таблицю, але штам Mycobacterium fortuitum у цій таблиці є варіантом вищезазначеного, розвинутий для 9-гідроксилювання стероїдів: реєстраційний № NRRL В-8119 [J. Nat. Prod. 66, 15 350-356 (2003)]. В цьому випадку, відповідно до авторів Mycobacterium fortuitum NRRL В-8119 не продукував гідрокси або дегідрогенований продукт, а також не мав місця метаболізм. У вищезгаданому Прикладі 17 представлено 3 типи штамів Nocardia, а саме: штами Nocardia aurentis, Nocardia cancicruria та Nocardia соіаіііпл. Відповідно до вимірювань V ТШХ та ВЕРХ продукти конверсії двох штамів подібні до 9-гідрокси-канренону, але утворення 9гідрокси-канренону було представлено РХ/МС аналізом. 2 UA 98151 C2 5 10 15 20 25 30 35 40 45 50 55 60 Єдиний мікробіологічний синтез 9-гідрокси-канренону, де подані числові дані, представлений у вищезазначеній публікації: штам Corynespora cassiicola ATCC 16718 3 застосовували в аеробному бродінні, здійснюваному в колбі, із застосуванням 0,1 г/дм концентрації субстрату канренону бажаний гідроксильований продукт одержували при 30% конверсії [J. Nat. Prod. 66, 350-356 (2003)]. Як можна побачити з вищеподаних публікацій, не представлено такого мікробіологічного синтезу 9-гідрокси похідних канренону або кетолактону, який був би промислово придатним. Метою нашого винаходу є, відтак, розробити промислово придатний мікробіологічний процес гідроксилювання стероїду загальної формули (II), де -А-А'-означає -СН2-СН2- чи СН=СН- групу, як субстрату в положенні 9 без значного розпаду або утворення побічного продукту. В наших початкових експериментах було доведено, що мікобактерійні штами найбільш придатні для мікробіологічного синтезу 9-гідрокси-канренону. Здатність до конверсії 38 мікобактерійних та Nocardia штамів була скринінгована з використанням кетолактону та канренону як субстрату. З-поміж цих штамів були такі, що розкладали стерин дикого типу, наприклад Mycobacterium fortuitum ATCC 6842, чи частково руйнуючий каркас Mycobacterium fortuitum NRRL B-8129; а також декілька штамів, чітко розроблених для 9-гідроксилювання: Mycobacterium fortuitum NRRL В-8119, Mycobacterium sp. NCAIM 1072, Mycobacterium sp. NCAIM 324. Під час скринінгу ми виявили 3 штами, які - відповідно до ТШХ аналізу - виробляли визначувану кількість 9-гідрокси похідної: Mycobacterium fortuitum NCAIM 00327, Mycobacterium fortuitum NCAIM 00323 та Nocardia sp. RG 1369. Всі три штами можуть конвертувати сполуку загальної формули (II), де -А-А'-означає -СН2СН2- групу, на 9-гідрокси похідну. Проте ми виявили, що тільки штам Nocardia sp. RG 1369 здатний конвертувати сполуку загальної формули (II), де -А-А'-означає -СН=СН- групу, на 9гідрокси похідну. Для поліпшення цієї здатності до конверсії ми здійснили експерименти у струшуваних колбах, використовуючи глюкозу, сахарозу або гліцерин як джерело вуглецю, переважно 5-25 3 3 г/дм гліцерин, більш переважно 15 г/дм гліцерин, а також застосовуючи дріжджовий екстракт, рослинний пептон або солодовий екстракт як джерело азоту, переважним є використання 3 дріжджового екстракту, рослинного пептону та солодового екстракту разом у 1-10 г/дм 3 концентрації, більш переважно в 5-5 г/дм концентрації, в даному випадку застосовуючи амоній, фосфат, калій, магній та залізо в їхніх відповідних сполуках. Температура культивації складала 28-35°С, переважно 32°С. Коли було культивовано штам Nocardia sp. RG 1369, як зазначено 3 вище, та субстрат канренону було додано в 4 г/дм концентрації, ми виявили, що значна кількість стероїду розкладалася за кілька годин, хоча 9-гідрокси-канреноновий продукт все ще міг бути виділений, але через 24 години додання субстрату спостерігався загальний розпад стероїдного каркасу. В наших подальших експериментах ми намагалися зсунути реакцію в напрямку утворення 9а-гідрокси-канренону шляхом застосування вибіркового індуктору. З-поміж відомих індукторів активними були AD (хімічна назва: 4-андростен-3,17-діон) та 10,11-дигідрокси-леводіон (хімічна назва: 13-етил-10,11-дигідрокси-4-гонен-3,17-діон). Коли як індуктор застосовували 10,11дигідрокси-леводіон, розпад мав місце на 6-10 годин пізніше, ніж у випадку AD. 10,11дигідрокси-леводіоновий індуктор розчиняли в суміші метанол-вода, переважно в 3:1 суміші, за підвищеної температури, переважно при 50°С, та фільтрували для одержання стерильного розчину. Його додавали до культури наприкінці лаг-періоду у віці 10-24 годин, переважно у віці 3 3 18 годин, у 0,01-0,5 г/дм концентрації, переважно у 0,05 г/дм концентрації. Відповідно до наших експериментів розпад може бути затримано шляхом додання інгібіторів 1 ферменту Δ -дегідрогенази, як-от антибіотики хлорамфеніколу, окситетрацикліну та стрептоміцину, а також хінонів, наприклад гідрохінон, нафтохінон та нінгідрин. Ми отримали найкращі результати, коли застосовували стрептоміцин; час розпаду складав на 3-7 годин довше. В наших експериментах антибіотик додавали через 2-8 годин після введення, 3 3 переважно через 6 годин, у 2-10 мг/дм , переважно в 6 мг/дм кінцевій концентрації. Після аналізу результатів наших експериментів ми виявили, що маємо спробувати виробити штам, починаючи зі штаму Nocardia sp. RG 1369 шляхом мутагенної обробки та відбору, що може бути застосований у промисловому процесі для синтезу сполуки загальної формули (І), де -А-А'- означає -СН2-СН2- чи -СН=СН- групу. З-поміж можливих мутагенних обробок вибрали опромінення УФ світлом при довжині хвилі 254 нм. Під час мутагенної обробки культуру Nocardia sp. RG 1369, яку суспендовали у фізіологічному сольовому розчині та тримали за асептичних умов, обробляли відомим методом, 3 UA 98151 C2 5 10 застосовуючи лампу типу Mineralight UVGL-58 15-23 хв. - час опромінення вибирали на підставі попередньо виміряної кривої смертності. Точні культури, які були одержані відомими методами, було скринінговано (відсортовано) та несподівано було виявлено, що мав місце один ізолят, який був здатний конвертувати сполуку загальної формули (II), де -А-А'- означає -СН2-СН2- чи -СН=СН-групу, на сполуку загальної формули (І), де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, без значного розпаду. Таким чином одержаний бактерійний мутант Nocardia sp. Fla (RG 4451) був здатний здійснити вищу за 80% конверсію. Після рРНК секвенування бактерію було ідентифіковано як Nocardia farcinica NCAIM (Ρ) - Β001342 та депоновано для цілей патентної процедури згідно з Будапештським договором. Відповідно до вищезазначених фактів винахід відноситься до способу вибіркового синтезу сполуки загальної формули (І), де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, шляхом біоконверсії сполуки загальної 15 20 25 30 формули (II), де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, що включає застосування штаму бактерії Nocardia farcinica, деп. № якого NCAIM (Р) - В 001342, як гідроксилювального мікроорганізму в біоконверсії. Морфологічні характеристики нового мутантного штаму Nocardia farcinica NCAIM (Ρ) - В 001342 показують невелику різницю з такими початкового штаму Nocardia sp. RG 1369. Ця 3 різниця є найбільш очевидною на поверхні агару YTA (композиція якого становить: 10 г/дм 3 3 3 трипказеїну; 1 г/дм дріжджового екстракту; 5 г/дм хлориду натрію; 0,25 г/дм гептагідрату 3 3 сульфату магнію; 0,07 г/дм дигідрату хлориду кальцію; 20 г/дм агар-агару): початковий штам Nocardia sp. RG 1369 продукує помаранчевий пігмент та його поверхня рівна, блискуча, більшість із розробленої культури може бути знайдена нижче поверхні агару, а не вище її. На противагу цьому, поверхня культур нового мутантного штаму Nocardia farcinica NCAIM (Ρ) - В 001342 не є рівною, але зі зморшками та тільки невелика їх частина може бути знайдена нижче поверхні агару. Ідентифікацію бактерійного штаму здійснювали частковим аналізом послідовності 16S рРНК гену. >RG1(Nocardia sp. Fla (RG 4451) fullseqed2: 4 UA 98151 C2 5 10 15 20 25 30 Одержана послідовність (1396 bp) охоплює 91% цілого гену (1527 bp). Видова ідентифікація досліджуваного штаму може бути визначена на основі NCBI BLAST hits шляхом застосування генотаксономічного методу: правильним видовим визначенням штаму RG 4451 є Nocardia farcinica. Його місце в систематиці живих організмів: Nocardia farcinica Trevisan 1889 [3] Клітинні організми; Бактерії; Актинобактерії; Актинобактерії; Актинобактериди; Актиноміцетали; Коринебактерії; Нокардії; Нокардія; Nocardia farcinica. Точні дані застосованої ідентифікації NCBI BLAST [2]: Доступність: http://www.ncbi.nlm.nih.gov/blast/. Версія: BLASTN 2.2.16 (Бер-25-2007) База даних: Всі GenBank+EMBL+DDBJ+PDB послідовності, але не EST, STS, GSS, зразки навколишнього середовища або фаза 0, 1 чи 2 HTGS послідовності); 5,284,371 послідовності; 20,692,750,832 повні листи, Алгоритм: мегабласт. 16S rRNS генна послідовність штамів, що належать до видів Nocardia farcinica, ідентична або дуже подібна одна до одної. Подібність також значна в підродах, але сімейства підроду гену Коринебактерій (див. Нокардії, Мікобактерії) дуже різні. Важлива та чітко спостережувана різниця між двома штамами є здатністю до конверсії в синтезі сполуки загальної формули (І), де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, яка є новим мутантним штамом Nocardia farcinica NCAIM (Ρ) - В 001342, що утримує 9гідроксилювальну активність, але руйнування стероїдного каркасу пригнічено. Тому - за попередньо визначених експериментальних умов - у зв'язку з пригніченим руйнуванням кількість 9-гідрокси продукту є вищою, він може бути виділеним: це може бути використано в синтезі промислового масштабу. Діаграма на Фігурі 1 показує характеристичний зразок стероїдної конверсії Nocardia sp. RG 1369 материнського штаму за попередньо заданих умов ферментації із застосуванням субстрату канренону. Діаграма на Фігурі 2 показує здатність до конверсії Nocardia farcinica NCAIM (Ρ) - В 001342 штаму за тих самих умов. Винахід ілюстровано наступними не обмежуючими прикладами. Приклад 1 Культуру Nocardia farcinica NCAIM (Ρ) - В 001342 утримують на наступних скошених агарах: Інокульовану культуру інкубували при 32°С протягом 4 днів, тоді її витримували при +4-10°С протягом подальших 30 днів для ініціювання проліферації. Вегетативну культуру утворювали 3 шляхом перенесення суспензії поверхневої культури в 100 см стерилізованого культурального 3 середовища наступної композиції в 500 см колбу: 5 UA 98151 C2 5 10 Культуру струшували при 32°С протягом 48 год. з 200 rpm, тоді 10% від неї застосовували 3 для інокулювання 100 см стерилізованого культурального середовища наступної композиції в 3 500 см колбі: Культуру струшували при 32°С протягом 72 год. з 200 rpm, тоді 10% від неї застосовували 3 для інокулювання 100 см стерилізованого культурального середовища наступної композиції в 3 500 см колби: 6 UA 98151 C2 5 10 15 20 25 30 Культуру струшували при 32°С протягом 72 год. з 200 rpm, тоді у віці 18 год. було спричинено утворення ферменту 9-гідроксилази шляхом додавання 5 мг 10,11-дигідроксилеводіону, розчиненого в 3:1 суміші метанол-вода. Через 6 годин введення до культури додавали 0,4 г субстрату кетолактону (хімічна назва: гамма-лактон 17-гідрокси-3-оксо-17прегна-4-ен-21 -карбонової кислоти), розчиненого в диметилформаміді. Через подальші 16 годин культуру екстрагували хлороформом, органічний шар концентрували, залишок рекристалізували з етилацетату, фільтрували та висушували. Таким чином одержаного кристалічного матеріалу було 456 мг. Відповідно до вимірювання ВЕРХ він містив 74,3% продукту, тобто 339 мг (що означає 84,7% виходу) 9-гідрокси-кетолактону (хімічна назва: гамма-лактон 9, 17-дигідрокси-3-оксо-17-прегна-4-ен-21-карбонової кислоти). Таким чином одержаний продукт характеризували ЯМР вимірюванням. Типові хімічні зсуви являють собою наступне: 1 H ЯМР {500 МГц, MMCO-d6(TMS), (ppm)}: 0.87 (3Н,с,18-Ме); 1.20 & 1.67 (2Н,м & м,Н-12); 1.25 (3Н,с,19-Ме); 1.32 & 1.54 (2Н,м & м,Н-15); 1.43 & 1.48 (2Н,м & м,Н-7); 1.47 & 1.67 (2Н,м & м,Н-11); 1.58 & 2.33 (2Н,м & м,Н-1); 1.65 (1Н,м,Н-9); 1.86 & 2.05 (2Н,м & м,Н-16); 1.90 (1Н,м,Н-8); 1.92 & 2.37 (2Н,м & м,Н-20); 2.17 & 2.38 (2Н,м & м,Н-2); 2.20 & 2.43 (2Н,м & м,Н-6); 2.40 & 2.54 (2Н,м & м,Н-21); 4.18 (1Н,с,ОН); 5.65 (1Н,м,Н-4). 13 С ЯМР {125 МГц, ДМСО-d6TMS), S(ppm)}: 13.6 (С-18); 19.4 (С-19); 22.3 (С-15); 24.3 (С-7); 25.8 (С-11); 26.5 (С-12); 27.9 (С-1); 28.8 (С-21); 30.5 (С-20); 31.3 (С-6); 33.8 (С-2); 34.8 (С-16); 37.4 (С-8); 42.0 (С-14); 44.0 (С-10); 44.9 (С-13); 75.1 (С-9); 95.3 (С-17); 124.9 (С-4); 170.6 (С-5); 176.3 (С-22); 197.9 (С-3). Приклад 2 Експеримент здійснювали, як описано в Прикладі 1, але головну фазу одержували в лабораторному біореакторі. Інокулум струшували при 32°С протягом 72 год. з 200 rpm, тоді вміст 5 колб застосовували 3 для інокулювання 5 дм стерилізованого культурального середовища головної фази наступної 3 композиції в 9 дм струшуваному біореакторі: 7 UA 98151 C2 3 5 10 15 20 Культуру перемішували при 32°С зі швидкістю 300 л/хв. та швидкістю аерації 200 дм /год. У віці 18 годин починалося утворення ферменту 9а-гідроксилази в культурі шляхом додання 250 мг 10,11-дигідрокси-леводіону, розчиненого в 3:1 суміші метанол-вода. Через 6 годин уведення до культури додавали 5 г субстрату канренону (хімічна назва: гамма-лактон 17-гідрокси-3-оксо17-прегна-4,6-дієн-21-карбонової кислоти), розчиненого в етанолі. Біоконверсію здійснювали в тому самому біоконверторі при 30°С, перемішуючи зі швидкістю 300 л/хв. та швидкістю аерації 3 200 дм /год. Через наступних 16 год. культуру екстрагували з хлороформом, органічний шар концентрували, залишок рекристалізували з етилацетату, фільтрували та висушували. Таким чином одержаний кристалічний матеріал складав 5,66 г. Відповідно до ВЕРХ вимірювання він містив 72,4% продукту, тобто 4,1 г (що означає 82% виходу) 9-гідрокси-кантенону (хімічна назва: гамма-лактон 9, 17-дигідрокси-3-оксо-17-прегна-4,6-дієн-21-карбонової кислоти). Таким чином одержаний продукт характеризували ЯМР вимірюванням. Типові хімічні зсуви являють собою такі: 1 Н ЯМР {500 МГц, MMCO-d6(TMS), (ppm)}: 0.92 (3Н,с,18-Ме); 1.15 (3Н,с,19-Ме); 1.22 & 1.75 (2Н,м & м,Н-12); 1.48 & 1.67 (2Н,м & м,Н-11); 1.48 & 1.77 (2Н,м & м,Н-15); 1.64 & 2.25 (2Н,м & м,Н-1); 1.92 & 2.10 (2Н,м & м,Н-16); 1.94 & 2.36 (2Н,м & м,Н-20); 1.97 (1Н,м,Н-8); 2.26 & 2.54 (2Н,м & м,Н-2); 2.42 & 2.57 (2Н,м & м,Н-21); 2.50 (1Н,м,Н-9); 4.13 (1Н,с,ОН); 5.65 (1Н,шир,Н-4); 5.89 (1Н,дд,Н-7); 6.18 (1Н,дд,Н-6). 13 С ЯМР {125 МГц, flMCO-d6(TMS), (ppm)}: 13.3 (С-18); 18.8 (С-19); 21.5 (С-15); 25.2 (С-11); 26.2 (С-12); 26.7 (С-1); 28.6 (С-21); 30.4 (С-20); 33.3 (С-2); 34.7 (С-16); 39.2 (С-8); 40.6 (С-14); 42.0 (С-10); 45.5 (С-13); 74.1 (С-9); 94.9 (С-17); 124.6 (С-4); 127.9 (С-6); 136.2 (С-7); 162.5 (С-5); 176.2 (С-22); 198.1 (С-3). ФОРМУЛА ВИНАХОДУ 25 1. Спосіб вибіркового синтезу сполук загальної формули (І) O O H OH O A A' H , (I) де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, шляхом біоконверсії сполук загальної формули (II) O O H 30 O A A' H , (II) де -А-А'- означає -СН2-СН2- чи -СН=СН- групу, який відрізняється тим, що застосовують штам бактерії Nocardia farcinica, що депоновано під номером NCAIM (Р) - В 001342, як гідроксилювальний мікроорганізм у біоконверсії. 2. Спосіб за п. 1, який відрізняється тим, що одержують біоконверсію, більшу за 80 %. 8 UA 98151 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis of 9a-hydroxy-steroid derivatives
Автори англійськоюOlasz, Katalin, Tegdes, Aniko, Gancsos, Valeria, Hantos, Gabor, Koncol, Kalman, Balogh Gabor, Erdelyi, Sandor
Назва патенту російськоюСпособ синтеза 9a-гидроксистероидов
Автори російськоюОлас Каталин, Тегдеш Анико, Ганчош Валериа, Хантош Габор, Кьонцьоль Кальман, Балог Габор, Эрдейи Шандор
МПК / Мітки
МПК: C07J 21/00
Мітки: синтезу, спосіб, 9a-гідроксистероїдів
Код посилання
<a href="https://ua.patents.su/11-98151-sposib-sintezu-9a-gidroksisterodiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу 9a-гідроксистероїдів</a>
Попередній патент: Магнітофотонний кристал мікрорезонаторного типу
Наступний патент: Спосіб посилення антиноціцептивного ефекту електромагнітного екранування
Випадковий патент: Спосіб формування анастомозу












