Спосіб синтезу (7-метокси-3,4-дигідронафталеніл)ацетонітрилу і його застосування у синтезі агомелатину
Формула / Реферат
1. Спосіб промислового синтезу сполуки формули (І)
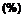 (I),
(I),
який відрізняється тим, що 7-метокси-1-тетралон формули (IV):
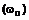 (IV)
(IV)
піддають реакції з ціанооцтовою кислотою формули (V):
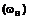 (V)
(V)
в умовах, коли воду, що утворилась, видаляють, у присутності каталітичної кількості сполуки формули (VI):
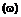 (VI),
(VI),
де R і R', які можуть бути однаковими або відрізнятись, кожний являє собою лінійну або розгалужену (С3-С10)алкільну групу, незаміщену або заміщену арильну групу, або незаміщену або заміщену лінійну або розгалужену арил (С1-С6)алкільну групу,
з одержанням сполуки формули (І) після фільтрування і промивання розчином гідроксиду натрію, сполуку формули (І) виділяють у формі твердої речовини після перекристалізації,
де:
- арил, як повинно розумітись, означає фенільну, нафтильну або біфенільну групу,
- термін "заміщений", що визначає терміни "арил" і "арилалкіл", означає, що ароматична частина цих груп може бути заміщена від 1 до 3 однаковими або різними групами, вибираними з лінійного або розгалуженого (С1-С6)алкілу, гідрокси і лінійного або розгалуженого (С1-С6)алкокси.
2. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що реакцію проводять при нагріванні зі зворотним холодильником толуолу.
3. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що використовують каталізатор формули (VIa):
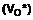 (VIa),
(VIa),
де R'a являє собою фенільну групу, незаміщену або заміщену однією або більше лінійною або розгалуженою (С1-С6)алкільними групами, n являє собою 0 або 1, і Ra являє собою лінійну (С3-С10)алкільну групу.
4. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що R являє собою гексильну групу.
5. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що R' являє собою бензильну групу.
6. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що каталізатор, який використовуються, являє собою бензиламоній гептаноат формули (VII):
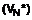 (VII).
(VII).
7. Сполука формули (І), яка являє собою (7-метокси-3,4-дигідро-1-нафталеніл)ацетонітрил, для застосування як проміжної сполуки в синтезі агомелатину.
8. Спосіб синтезу агомелатину, починаючи зі сполуки формули (І), який відрізняється тим, що сполуку формули (І) одержують способом синтезу за будь-яким з пп. 1-6 і піддають ароматизації з наступним відновленням, і потім піддають зв'язуванню з оцтовим ангідридом.
Текст
1. Спосіб промислового синтезу сполуки формули (І) C2 2 (13) 1 3 76649 4 для застосування як проміжної сполуки в синтезі сполуку формули (І) одержують способом синтезу агомелатину. за будь-яким з пп. 1-6 і піддають ароматизації з 8. Спосіб синтезу агомелатину, починаючи зі спонаступним відновленням, і потім піддають зв'язулуки формули (І), який відрізняється тим, що ванню з оцтовим ангідридом. Даний винахід відноситься до способу промислового синтезу (7-метокси-3,4-дигідро-1нафталеніл)ацетонітрилу, і його застосування у промисловому виробництві агомелатину, або М-[2(7-метокси-1-нафтил)етил]ацетаміду. Більш конкретно, даний винахід відноситься до способу промислового синтезу сполуки формули (І): CN MeO (I) Сполука формули (І), одержана відповідно до способу даного винаходу, є корисною в синтезі агомелатину, або М-[2-(7-метокси-1нафтил)етил]ацетаміду, формули (II): NHCOMe MeO (II) Агомелатин, або М-[2-(7-метокси-1нафтил)етил]ацетамід, володіє цінними фармакологічними властивостями. Дійсно, він має подвійну особливість існування, з одного боку, він є агоністом рецепторів мелатонінергічної системи і, з іншого боку, антагоністом 5-НТзс рецептора. Такі властивості надають активність в центральній нервовій системі і, більш конкретно, у лікуванні суворої депресії, сезонних емоційних розладів, розладів сну, серцево-судинних патологій, патологій травного тракту, безсоння і втоми, яка виникає через порушення добового ритму організму, розладів апетиту і ожиріння. Агомелатин, його одержання і терапевтичне застосування були розкриті в Описі Європейської патентної заявки ЕР 0 447 285. Беручи до уваги фармацевтичне значення цієї сполуки, важливим було спромогтись одержати її ефективним промисловим способом синтезу, який є легко перенесеним у промислові масштаби і дає агомелатин з хорошим виходом і відмінною чистотою. Опис патентної заявки ЕР 0 447 285 розкриває одержання агомелатину за вісім стадій, починаючи з 7-метокси-І-тетралону, даючи середній вихід менше ніж 30%. Цей спосіб включає дію етил бромацетату, з наступними ароматизацією і омиленням, для одержання відповідної кислоти, яку потім перетворюють в ацетамід і згодом дегідрують для одержання (7-метокси-1-нафтил)ацетонітрилу, з наступним відновленням, а потім конденсацією ацетил хло риду. Перенесення у промислові масштаби швидко демонструвало труднощі здійснення способу, що викликаються, головним чином, проблемами відтворюваності першої стадії, що складає дію етил бромацетату на 7-метокси-І-тетралон відповідно до реакції Реформатскі, даючи етил (7-метокси3,4-дигідро-1 (2Н)нафталеніліден)етаноат. Крім того, наступна стадія ароматизації етил (7-метокси-3,4-дигідро-1(2Н)нафталеніліден)етаноату часто була незавершеною і в результаті давала, після омилення, суміші продуктів, які важко очищувати. Заявник в даний момент розробив новий спосіб промислового синтезу, який в результаті дає, відтворюваним чином і без необхідності важкого очищення, агомелатин чистоти, сумісної з його використанням як фармацевтичне активного інгредієнта. Альтернатива до складностей, які зустрічаються у способі, розкритому в описі патентної заявки ЕР 0 447 285, була одержана безпосереднім конденсуванням ціано сполуки з 7-метокси-Ітетралоном. Крім того необхідним було, щоб одержана конденсована сполука могла бути легко піддана ароматизації для одержання (7-метокси-1 -нафтил)ацетонітрилу. Очевидно, що (7-метокси-3,4-дигідро-1нафталеніл)ацетонітрил буде являти собою ідеальну проміжну сполуку синтезу, що відповідає вимогам для прямого синтезу з 7-метокси-Ітетралону, і буде відмінним субстратом для стадії ароматизації. Реакції для прямої конденсації тетралонів з ацетонітрилу або сполук ацетонітрилу описані в літературі. Зокрема, опис патентної заявки US 3 992 403 розкриває конденсацію ціанометил фосфонату з 6-фтор-І-тетралоном, і опис патентної заявки US 3 931 188 розкриває конденсацію ацетонітрилу з тетралоном, який веде до проміжної ціано сполуки, яка безпосередньо залучена у наступній реакції. Застосована до 7-метокси-І-тетралону, конденсація ацетонітрилу дає суміш ізомерів, в яких "екзо" складає більшу частину і "ендо" - незначну частину, відповідно до Фігури 1: Фігура 1 CN O MeO MeO CH3CN CN MeO + таку суміш, що потребує наступних сильнодіючих умов ароматизації, які не сумісні з промисловими вимогами з метою проведення синтезу агомелатину. Заявник в даний момент розробив новий спосіб промислового синтезу, який дозволяє одержа 5 76649 6 ти (7-метокси-3,4-дигідро-1температуру кипіння вище або яка дорівнює темнафтиленіл)ацетонітрил з можливістю відтворення пературі кипіння води, і навіть більш переважно і без необхідності у важкому очищенні, особливо той, що утворює азеотроп з водою, такий як, навільного від "екзо" домішки, формули (III): приклад, ксилол, толуол, анізол, етилбензол, тетрахлоретилен, циклогексен або мезитилен. CN Переважно, реакцію проводять при нагріванні зі зворотним холодильником толуолу або ксилолу MeO і, більш конкретно, при нагріванні зі зворотним холодильником толуолу. (III) Переважно одна з груп R або R' залученого каталізатора являє собою лінійну або розгалужену домішка якого не може бути піддана наступній (С3-С10)алкільну групу, а інша являє собою арильароматизації в робочих умовах, які сумісні з прону або арилалкільну групу. Більш конкретно, перемисловими вимогами з метою проведення синтезу важним каталізатором є каталізатор формули агомелатину. (Via): Більш конкретно, даний винахід відноситься -O + до способу промислового синтезу сполуки формуR (CH2)n ли (І): R`a NH3 (VI) CN O де R'a являє собою фенільну групу, незаміщеMeO ну або заміщену однією або більше лінійною або розгалуженою (С1-С6)алкільними групами, n являє (I) собою О або 1, і Ra являє собою лінійну (С3С10)алкільну групу. який відрізняється тим, що 7-метокси-1 Переважно, R'a являє собою незаміщену або тетралон формули (IV): заміщену фенільну групу, більш конкретно незаO міщену фенільну групу. Переважна група Ra являє собою гексильну MeO групу. Переважним значенням n є 1. (IV) Переважним каталізатором, який використовується у способі за даним винаходом, є бензилапіддають реакції з ціанооцтовою кислотою фомоній гептаноат формули (VII): рмули (V): HO CN (V) O в умовах, коли воду, що утворилась, видаляють, у присутності каталітичної кількості сполуки формули (VI): + -O R R` NH3 (VI) O де R і R', які можуть бути однаковими або відрізнятись, кожний являє собою лінійну або розгалужену (С3-С10)алкільну групу, незаміщену або заміщену арильну групу, або незаміщену або заміщену лінійну або розгалужену арил (С1С6)алкільну групу, для одержання сполуки формули (І) після фільтрування і промивання розчином гідроксиду натрію, сполуку формули (І) якої виділяють у формі твердої речовини після перекристалізації, де: - арил, як повинно розумітись, означає фенільну, нафтильну або біфенільну групу, - термін "заміщений", що визначає терміни "арил" і "арилалкіл", означає, що ароматична частина цих груп може бути заміщена від 1 до 3 однаковими або різними групами, вибираними з лінійного або розгалуженого (С1-С6)алкілу, гідрокси і лінійного або розгалуженого (С1-С6)алкокси. Більш конкретно, воду, яка утворюється під час реакції, видаляють дистиляцією. Переважно використовують реакційний розчинник, що має + NH3 -O CH3 O (VII) Переважно, сполуку формули (VI) одержують після фільтрування і промивання мінеральним або органічним основним розчином, таким як NaOH, КОН, Са(ОН)2, Sr(OH)2 або NH4OH, і більш конкретно розчином гідроксиду натрію. Цей спосіб представляє конкретний інтерес з наступних причин: - він дозволяє одержати "ендо" сполуку формули (VI), виключно, у промислових масштабах. Цей результат зовсім дивує, зважаючи на літературу, яка має відношення до такого типу реакції, яка найбільш часто повідомляє про одержання "екзо"/"ендо" сумішей (Tetrahedron, 1966, 22, 30213026). Результат є таким завдяки використанню сполуки формули (VI) як каталізатора реакції замість амоній ацетатів, які в даний момент використовуються в таких реакціях (Bull. Soc. Chim. Fr, 1949, 884-890), - ступінь одержаного перетворення є дуже високою, перевищуючи 97%, на відміну від того, що могло б спостерігатись при використанні оцтової кислоти, для якої ступінь не перевищує 75%. Сполука формули (І), одержана таким чином, є новою і корисною як проміжна сполука у синтезі агомелатину, в якому її піддають ароматизації, з наступним відновленням і потім піддають зв'язуванню з оцтовим ангідридом. Приклади, вказані нижче, ілюструють винахід, але не обмежують його жодним чином. Приклад 1: (7-Метокси-3,4-дигідро-1 7 76649 8 нафталеніл)ацетонітрил нафталеніл)ацетонітрил В 670-літровий реактор вміщують 85,0 кг 7В 670-літровий реактор вміщують 85,0 кг 7метокси-І-тетралону, 60,3 кг ціанооцтової кислоти і метокси-І-тетралону, 60,3 кг ціанооцтової кислоти і 15,6 кг гептанової кислоти в толуолі у присутності 15,6 кг гептанової кислоти в толуолі у присутності 12,7 кг бензиламіну. Суміш нагрівають зі зворот11,0 кг аніліну. Суміш нагрівають зі зворотним хоним холодильником. Коли весь вихідний субстрат лодильником. Коли весь вихідний субстрат зникає, зникає, розчин охолоджують і фільтрують. Одеррозчин охолоджують і фільтрують. Одержаний жаний осад промивають толуолом і потім одержаосад промивають толуолом і потім одержаний фіний фільтрат промивають 2N розчином гідроксиду льтрат промивають 2N розчином гідроксиду натрію натрію і потім водою до нейтрального стану. Після і потім водою до нейтрального стану. Після видавидалення розчинника випаровуванням, одержану лення розчинника випаровуванням, одержану тветверду речовину перекристалізовують з суміші рду речовину перекристалізовують з суміші етаетанол/вода (80/20), для одержання вказаного у нол/вода (80/20), для одержання вказаного у заголовку продукту з виходом 90% і хімічною чисзаголовку продукту з виходом 87% і хімічною чистотою, яка перевищує 99%. тотою, яка перевищує 99%. Точка плавлення: 48-50°С. Точка плавлення: 48-50°С. Приклад 2: (7-Метокси-3,4-дигідро-1 Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for synthesis of (7-methoxy-3,4-dihydronaphtalenyl) and use thereof in the synthesis of agomelatin
Автори англійськоюSouvie Jean-Claude, Isaac GONZALES BLANKO
Назва патенту російськоюСпособ синтеза (7-метокси-3,4-дигидронафталенил)ацетонитрила и его применение в синтезе агомелатина
Автори російськоюСувье Жан-Клод
МПК / Мітки
МПК: A61P 3/04, A61P 25/00, C07C 13/00
Мітки: спосіб, синтезу, застосування, 7-метокси-3,4-дигідронафталеніл)ацетонітрилу, агомелатину, синтезі
Код посилання
<a href="https://ua.patents.su/4-76649-sposib-sintezu-7-metoksi-34-digidronaftalenilacetonitrilu-i-jjogo-zastosuvannya-u-sintezi-agomelatinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу (7-метокси-3,4-дигідронафталеніл)ацетонітрилу і його застосування у синтезі агомелатину</a>
Попередній патент: Спосіб підвищення механічної стійкості термокаталітичного датчика горючих газів
Наступний патент: Спосіб очищення парогенератора реактора, охолоджуваного водою під тиском
Випадковий патент: Кліть для гарячого або холодного прокатування металевої стрічки та спосіб регулювання проковзування прокатуваної в ній стрічки








