Спосіб стимуляції імунної відповіді, композиція, що містить імуностимулюючу нуклеїнову кислоту, спосіб лікування раку та спосіб лікування або профілактики алергії або астми
Формула / Реферат
1.Спосіб стимуляції імунної відповіді, що включає в себе введення збагаченої піримідином імуностимулюючої нуклеїнової кислоти суб'єкту, відмінному від гризунів, у кількості, ефективній для індукції імунної відповіді у суб'єкта, відмінного від гризунів, в якому нуклеїнова кислота являє собою тимідин (Т)-збагачену нуклеїнову кислоту, яка містить більше 60% Т і містить динуклеотид CpG.
2.Спосіб за п.1, де Т-збагачена імуностимулююча нуклеїнова кислота являє собою полі-Т-нуклеїнову кислоту, що містить 5'ТТТТ3'.
3.Спосіб за п.2, де полі-Т-нуклеїнова кислота містить
5'Х1Х2ТТТТХ3Х43',
де Х1, Х2, Х3 і Х4 являють собою нуклеотиди.
4.Спосіб за п.3, де Х1Х2 являє собою ТТ.
5.Спосіб за п.3, де Х3Х4 являє собою ТТ.
6.Спосіб за п.3, де Х1Х2 вибраний з групи, що складається з ТА, TG, ТС, AT, АА, AG, АС, СТ, СС, СА, GT, GG, GA і GC.
7.Спосіб за п.3, де Х3Х4 вибраний з групи, що складається з ТА, TG, ТС, AT, АА, AG, АС, СТ, СС, СА, GT, GG, GA і GC.
8.Спосіб за п.1, де Т-збагачена імуностимулююча нуклеїнова кислота має нуклеотидний склад, який більше ніж на 80% складається з Т.
9.Спосіб за п.1, який додатково включає в себе експозицію суб’єкта з антигеном і в якому імунна відповідь являє собою специфічну відносно антигену імунну відповідь.
10.Спосіб за п.1, де у суб'єкта є астма або існує небезпека розвитку астми, і спосіб є способом лікування або профілактики астми у суб'єкта.
11.Спосіб за п.1, де у суб'єкта є алергія або існує небезпека розвитку алергії, і спосіб є способом лікування або профілактики алергії.
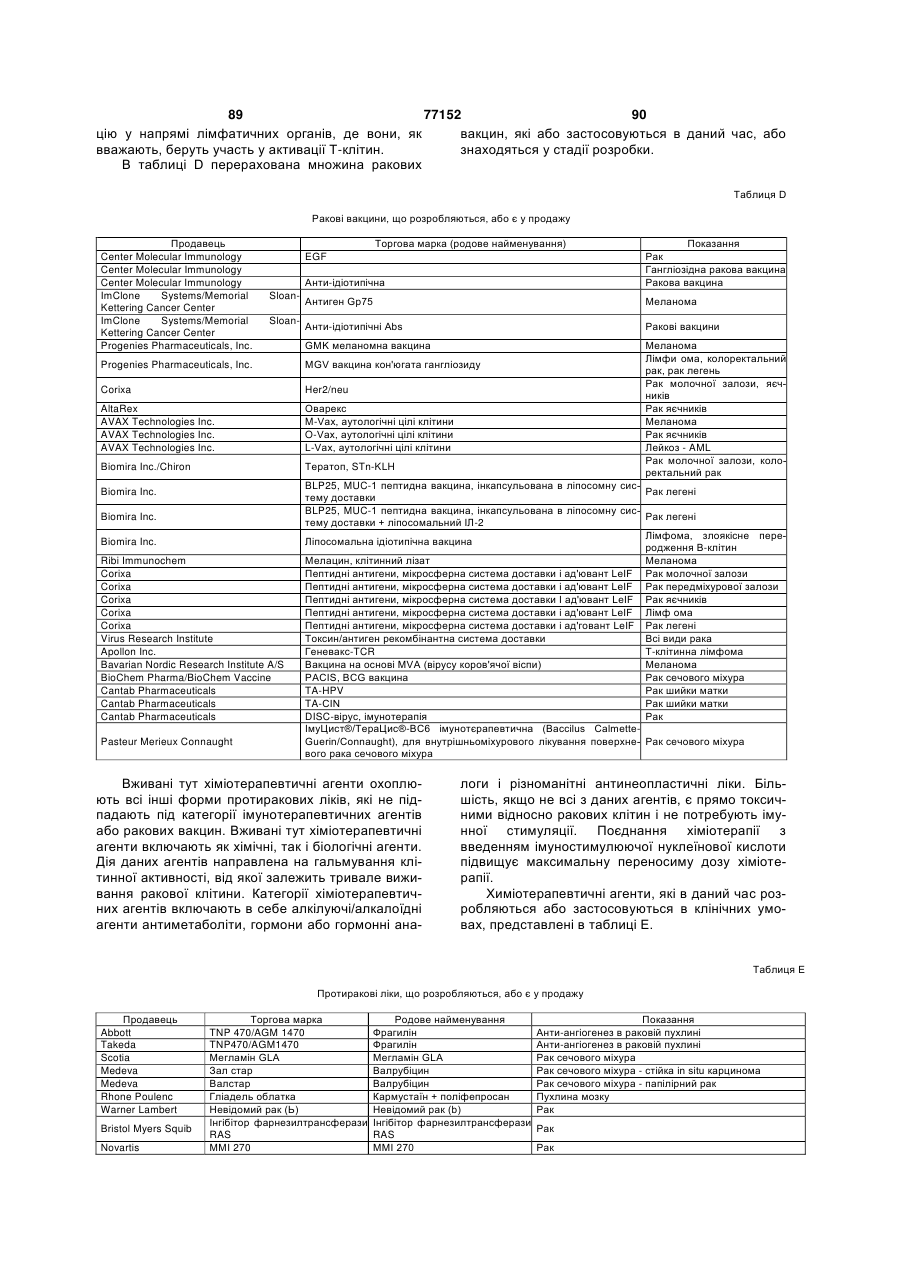
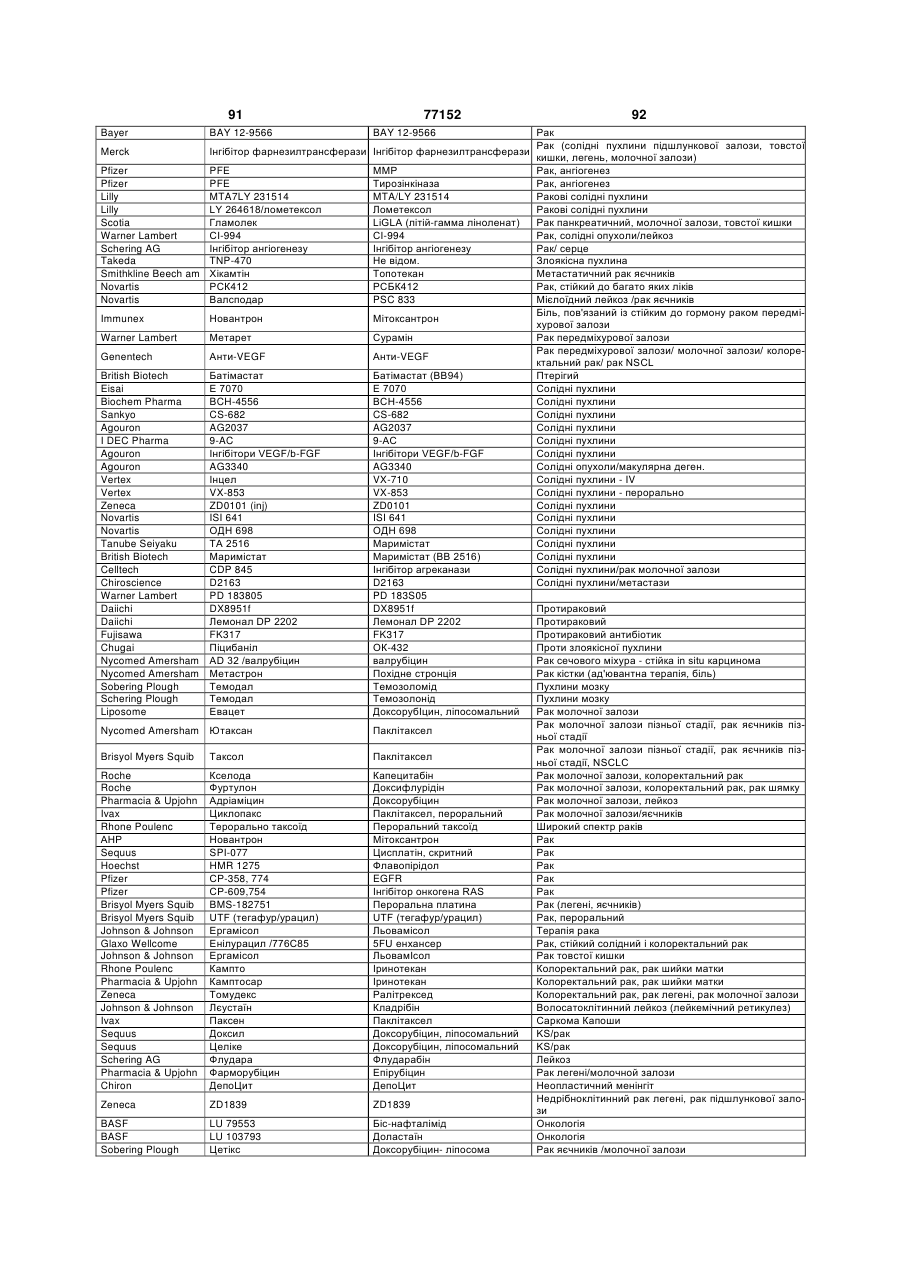
12.Спосіб за п.1, де у суб'єкта є рак, і спосіб є способом лікування раку.
13.Спосіб за п.1, де імуностимулююча нуклеїнова кислота додатково включає в себе TG-мотив.
14.Композиція, що містить олігонуклеотид, який має нуклеїнову кислоту з послідовністю TCG TCG TTT TGA CGT TTT GTC GTT (SEQ ID NO: 343).
15.Спосіб лікування або профілактики алергії або астми, який включає в себе введення композиції за п.14 суб'єкту, відмінному від гризунів, який має в цьому потребу, в кількості, ефективній для лікування або профілактики алергії або астми.
16. Спосіб лікування раку, що включає введення потребуючому цього суб'єкту імуностимулюючого олігонуклеотиду, який має нуклеотидну послідовність SEQ ID NO: 246 (5' TCG TCG TTT TGT CGT TTT GTC GTT 3'), карбоплатину і паклітакселу у кількості, ефективній для лікування раку.
17. Спосіб за п.16, який відрізняється тим, що рак являє собою недрібноклітинний рак легень.
Текст
1.Спосіб стимуляції імунної відповіді, що включає в себе введення збагаченої піримідином імуностимулюючої нуклеїнової кислоти суб'єкту, відмінному від гризунів, у кількості, ефективній для індукції імунної відповіді у суб'єкта, відмінного від гризунів, в якому нуклеїнова кислота являє собою тимідин (Т)-збагачену нуклеїнову кислоту, яка містить більше 60% Т і містить динуклеотид CpG. 2. Спосіб за п.1, де Т-збагачена імуностимулююча нуклеїнова кислота являє собою полі-Т-нуклеїнову кислоту, що містить 5'ТТТТ3'. 3.Спосіб за п.2, де полі-Т-нуклеїнова кислота містить 5'Х1Х2ТТТТХ3Х43', де Х1, Х2, Х3 і Х4 являють собою нуклеотиди. 4. Спосіб за п.3, де Х1Х2 являє собою ТТ. 5. Спосіб за п.3, де Х3Х4 являє собою ТТ. 6. Спосіб за п.3, де Х1Х2 вибраний з групи, що 2 (19) 1 3 Бактеріальна ДНК, але не ДНК хребетних, володіє імуностимулюючими ефектами на мононуклеарні клітини периферичної крові (РВМС) in vitro (Krieg et al., 1995). Бактеріальна ДІЖ, але не ДНК хребетних, характеризується імуностимулюючими ефектами відносно активації В-клітин і клітинприродних кілерів [Tokunaga, Т., et al., 1988, Jpn. J. Cancer Res. 79:682-686; Tokunaga, Т., et al., 1984, JNCI 72:955-962; Messina, J.P., et al., 1991, Jimmunol. 147:1759-1764; і в огляді Krieg, 1998, In: Applied Oligonucleotide Technology, C.A. Stein and A.M. Krieg, (Eds.), Jone Wiley and Sons, Inc., New York, NY, pp.431-448]. Зараз ясно, що дані імуностимулюючі ефекти бактеріальної ДНК є результатом присутності неметильованих CpGдинуклеотидів в особливих контекстах основ (мотиви CpG), які звичайні для бактеріальної ДНК, але метильовані і недостатньо представлені (зменшення CpG від 1/50 до 1/60) в ДНК хребетних [Krieg et al, 1995 Nature 374:546-549; Krieg, 1999 Biochim. Biophys. Acta 93321:1-10]. Імуностимулюючі ефекти бактеріальної ДНК можуть бути змодельовані за допомогою синтетичних олігодезоксинуклеотидів (ОДН), що містять дані CpG-мотиви. Представляється вірогідним, що швидка активація імунної системи у відповідь на CpG-ДНК може розвиватися як один з компонентів природних імунних захисних механізмів, які дізнаються структурні характеристики, специфічні для молекул мікробів. ОДН CpG володіють сильними стимулюючими ефектами відносно лейкоцитів людини і миші, індукуючи проліферацію майже всіх (>95%) В-клітин, і збільшують секрецію імуноглобулінів (Ig); секрецію цитокінів; лізисну активність клітин-природніх кілерів (NK) і секрецію IFN- , і активацію дендритних клітин (DC) і інших антиген-являючих клітин відносно експресії костимулюючих молекул і секреції цитокінів, особливо Th1-подібних цитокінів, які важливі для підтримки розвитку Th1-подібних відповідей Т-клітин. Активація В-клітин під дією CpG-ДНК є незалежною від Т-клітин і антигеннеспецифічною. Проте активація В-клітин низькими концентраціями CpG-ДНК характеризується вираженим синергізмом з сигналами, що передаються через антигенні рецептори В-клітин, у відношенні як проліферації В-клітин, так і секреції Ig (Krieg et al., 1995). Даний виражений синергізм між сигнальними шляхами В-клітин, тригером яких є антигенний рецептор В-клітин, і CpG-ДНК сприяє розвитку антигенспецифічних імунних відповідей. На додаток до їх прямих ефектів на В-клітини, CpGДНК також прямо активують моноцити, макрофаги і дендритні клітини відносно секреції цитокінів, включаючи високі рівні ІЛ-12 [Klinman et al., 1996; Halpern et al., 1996; Cowdery et al., 1996]. Дані цитокіни стимулюють клітини-природні кілери (NK) для секреції інтерферону гамма (IFN- ) і збільшують їх лізисну активність [Klinman et al., 1996, вище; Cowdery et al., 1996, вище; Yamamota et al., 1992; Ballas et al., 1996]. Загалом CpG-ДНК індукує Th1-подібний характер продукції цитокінів з переважанням ІЛ-12 і IFN- і з невеликою секрецією Тh2-цитокінів [Klinman et al., 1996]. Сильні прямі ефекти (незалежні від Т-клітин) CpG-ДНК на Вклітини, також як індукція цитокінів, які можуть ха 77152 4 рактеризуватися непрямими ефектами на Вклітини через Т-хелперні шляхи, припускає використання CpG-ДНК у формі ОДН як ад'юванта вакцини. (Дивися патентну заявку РСТ, публікація No.: WO98/40100.) Дані імуностимулюючі ефекти природного фосфодіефірного остову CpG ОДН високоспецифічні для CpG, так що ефекти практично зникають, якщо мотив CpG метильований, змінений на GpC або знищений або змінений іншим шляхом (Krieg et al., 1995 Nature 374:546-549; Hartmarm et al, 1999 Proc. Natl. Acad. Sci USA 96:9305-10). Фосфодіефірні CpG ОДН можуть бути вміщені в пухирці з ліпідів, галуна або в пухирці інших типів з властивостями запасання або поліпшеного захоплення клітинами для збільшення імуностимулюючих ефектів [Yamamoto et al., 1994 Microbiol. Immunol. 38:831-836; Gramzinski et al., 1998 Моl. Med. 4:109118]. В ранніх дослідженнях передбачалося, що імуностимулюючий мотив CpG відповідає формулі пурин-пурин-СрG-піримідин-піримідин [Krieg et al, 1995 Nature 374:546-549; Pisetsky, 1996 J. Immunol. 156:421-423; Hacker et al., 1998 EMBO J. 17:62306240; Lipford et al, 1998 Trends in Microbiol. 6:496500]. Проте зараз ясно, що лімфоцити миші цілком добре відповідають на фосфодіефірні CpGмотиви, які не відповідають даній "формулі" [Yi et al., 1998 J. Immunol. 160:5898-5906] і те ж саме справедливо для В-клітин людини і дендритних клітин [Hartmann et al, 1999 Proc. Natl. Acad. Sci USA 96:9305-10; Liang, 1996 J. Clin. Invest. 98:1119-1129]. Декілька дослідників у минулому вивчали, чи може вміст нуклеотидів в ОДН діяти незалежно від послідовності ОДН. Цікаво, що було знайдено, що антисмислові ОДН звичайно збагатили GG, ССС, СС, САС і CG послідовностями, в той же час маючи знижену частоту нуклеотидних послідовностей ТТ або ТСС у порівнянні з очікуваним, якщо використовування основ було випадковим [Smetsers et al., 1996 Antisense Nucleic Acid Drug Develop. 6:6367]. Це збільшує можливість того, що представлені в більшій кількості послідовності можуть містити переважні елементи, направлені на мішень у вигляді антисмислових олігонуклеотидів, і навпаки. Одна з причин уникати застосування тимідинзбагачених ОДН для експериментів за антисмисловими послідовностями полягає в тому, що руйнування ОДН нуклеазами, присутніми в клітинах, веде до вивільнення вільного тимідину, який конкурує з 3Н-тимідином, який часто застосовують в експериментах для оцінки клітинної проліферації [Matson et al., 1992 Antisense Research and Development 2:325-330]. Даний винахід відноситься частково до збагачених піридином (Ру-збагачених) і в деяких здійсненнях до збагачених тимідином (Т) імуностимулюючих нуклеїнових кислот, для яких не потрібна присутність CpG-мотиву. Даний винахід також відноситься частково до відкриття того, що нуклеїнові кислоти, які містять TG-динуклеотидний мотив, також є імуностимулюючими. Винахід частково заснований на несподіваних даних про те, що послідовності нуклеїнових кислот, які не містять CpG 5 77152 6 мотиви, є імуностимулюючими. При аналізі імуносщонайменше 4, щонайменше 5, щонайменше 6 тимулюючих властивостей багато яких послідовщонайменше 7, щонайменше 8 або щонайменше 9 ностей нуклеїнових кислот було відкрито, що дані стичних Т-нуклеотидних залишку. В інших здійспослідовності можуть бути Ру-збагаченими наприненнях множина полі-Т-мотивів представляє соклад, Т-збагаченими, або вони можуть містити TGбою щонайменше 3 мотиви і з даних щонайменше мотиви. Було також відкрито, що дані послідовнос3 мотивів кожний включає щонайменше 3 стичні Тті переважно активують імунні клітини тварин, віднуклеотидних залишки або множина полі-Тмінних від гризунів. Ру-збагачені і TGмотивів представляє собою щонайменше 4 мотиви послідовності володіють тільки мінімальними імуі з даних щонайменше 4 мотивів, кожний включає ностимулюючими властивостями відносно імунних щонайменше 3 стичні Т-нуклеотидних залишки. клітин гризунів у порівнянні з імунними клітинами В деяких випадках Т-збагачена імуностимутварин, відмінних від гризунів. Таким чином можлююча нуклеїнова кислота може бути вільною від ливо, відповідно до способів винаходу, індукувати полі-Т-мотивів але може переважно включати нукімунну відповідь у суб'єкта, що не є гризуном, леотидний склад з більше, ніж 25% Т. В інших шляхом введення Ру-збагачених або таких, що здійсненнях Т-збагачені імуностимулюючі нуклеїмістять TG-мотиви, імуностимулюючих нуклеїнонові кислоти мають полі-Т-мотиви і також включавих кислот. Ру-збагачені або такі, що містять TGють нуклеотидний склад з більше, ніж 25% Т. В мотиви, імуностимулюючі нуклеїнові кислоти згідпереважних здійсненнях Т-збагачена імуностимуно з винаходом можуть - необов'язково - включати лююча нуклеїнова кислота включає нуклеотидний CpG-мотиви. Ці дані мають важливе значення для склад з більше, ніж 35% Т, більше, ніж 40% Т, бірозвитку клінічного застосування імуностимулююльше, ніж 50% Т, більше, ніж 60% Т, більше, ніж чих, що містять CpG і не містять CpG, нуклеїнових 80% Τ або більше, ніж 90% Т-нуклеотидних заликислот. шків. У важливих здійсненнях нуклеїнова кислота В одному варіанті винаходу пропонується фамає щонайменше 50% Т. рмацевтична композиція, що містить ефективну Т-збагачені і імуностимулюючі TG-нуклеїнові кількість для стимуляції імунної відповіді виділених кислоти можуть мати будь-яку довжину, більшу, Ру-збагачених або таких, що містять TG-мотиви, ніж 7 нуклеотидів, але в деяких здійсненнях моімуностимулюючих нуклеїнових кислот і фармацежуть мати між 8 і 100 нуклеотидними залишками в втично прийнятний носій. В інших варіантах винадовжину. У переважних здійсненнях Т-збагачена ходу пропонується композиція предмету винаходу, імуностимулююча нуклеїнова кислота включає що включає виділену Ру-збагачену або таку, що щонайменше 20 нуклеотидів, щонайменше 24 нукмістить TG-мотиви, імуностимулюючу нуклеїнову леотиди, щонайменше 27 нуклеотидів або щонайкислоту. В інших здійсненнях імуностимулююча менше 30 нуклеотидів. В переважних здійсненнях нуклеїнова кислота може бути Т-збагаченою. Ще в імуностимулююча TG-нуклеїнова кислота в доводному аспекті імуностимулююча нуклеїнова кисжину складає між 15 і 25 нуклеотидами. Тлота може бути Т-збагаченою і також мати щозбагачена і імуностимулюючі TG-нуклеїнові кислонайменше один TG-мотив. ти можуть бути односпіральними і двоспіральниПереважно Ру-збагачена нуклеїнова кислота ми. представляє собою Т-збагачену нуклеїнову кислоВ одному переважному здійсненні імуностимуту. В деяких здійсненнях Т-збагачена нуклеїнова лююча нуклеїнова кислота має Т-збагачену обкислота представляє собою полі-Т-нуклеїнову кисласть, розташовану в середині її довжини (тобто лоту, що включає 5'ТТТТ3'. Ще в одному здійсненприблизно рівна кількість нуклеотидів прилягає до ні полі-Т-нуклеїнова кислота включає в себе Т-збагаченої області з 5' і 3' кінців). 5'Х1Х2ТТТТХ3Х43', де Х1, Х2, Х3 і Х4 є нуклеотидаТ-збагачену нуклеїнову кислоту в деяких здійми. В деяких здійсненнях Х1Х2 представляють сосненнях вибирають з групи, що складається з SEQ бою ТТ та/або Х3Х4 є ТТ. В інших здійсненнях Х1Х2 ID NO: 59-63, 73-75, 142, 215, 226, 241, 267-269, вибирають з групи, що складається з ТА, TG, ТС, 282, 301, 304, 330, 342, 358, 370-372, 393, 433, AT, АА, AG, АС, СТ, СС, СА} CG, GT, GG, GA і GC; 471, 479, 486, 491, 497, 503, 556-558, 567, 694, та/або Х3Х4 вибирають з групи, що складається з 793-794, 797, 833, 852, 861, 867, 868, 882, 886, ТА, TG, ТС, AT, АА, AG, АС, СТ, СС, СА, CG, GT, 905, 907, 908 і 910-913. В інших здійсненнях ТGG, GA і GC. збагачені нуклеїнові кислоти є послідовністю, вибТ-збагачена імуностимулююча нуклеїнова кисраною з групи, що складається з SEQ ID NO: 64, лота може мати тільки один полі-Т-мотив або вона 98, 112, 146, 185, 204, 208, 214, 224, 233, 244, 246, може мати множину полі-Т-мотивів нуклеїнової 247, 258, 262, 263, 265, 270-273, 300, 305, 316, кислоти. В деяких здійсненнях Т-збагачена імунос317, 343, 344, 350, 352, 354, 374, 376, 392, 407, тимулююча нуклеїнова кислота включає щонай411-413, 429-432, 434, 435, 443, 474, 475, 498-501, менше 2, щонайменше 3, щонайменше 4, щонай518, 687, 692, 693, 804, 862, 883,884, 888, 890 і менше 5, щонайменше 6, щонайменше 7 або 891. щонайменше 8 Т-мотивів. В інших здійсненнях В інших здійсненнях Ру-збагачена імуностимувона включає щонайменше 2, щонайменше 3, щолююча нуклеїнова кислота представляє собою Снайменше 4, щонайменше 5, щонайменше 6, щозбагачену нуклеїнову кислоту. Імуностимулююча найменше 7 або щонайменше 8 CpG-мотивів. В С-збагачена нуклеїнова кислота представляє сопереважних здійсненнях множина CpG-мотивів і бою нуклеїнову кислоту, що містить щонайменше полі-Т-мотивів розсіяно. одну, і переважно щонайменше 2 полі-С-області, Ще в одному здійсненні щонайменше одне з або містить 50% або більше С-нуклеотидів. множин полі-Т-мотивів містить щонайменше 3, Ру-збагачені та імуностимулюючі TG 7 77152 8 нуклеїнові кислоти можуть включати один або бівибрані з групи, що складається з ТТ, ТС, ТА і TG. льше CpG-мотивів. Мотиви можуть бути метильоВ іншому здійсненні Х1Х2 представляють собою вані або неметильовані. В інших здійсненнях РуGA або GT, а Х3Х4 є ТТ. Ще в одному здійсненні Х1 збагачені та імуностимулюючі TG-нуклеїнові кисабо Х2, або обидва є пуринами, а Х3 або Х4 або лоти вільні від одного або більше CpGобидва є піримідинами, або Х1Х2 є GpA, a Х3 або динуклеотидів. Х4, або обидва вони є піримідинами. В одному В інших здійсненнях Ру-збагачені та імуностиздійсненні Х2 є Т, а Х3 є піримідином. мулюючі TG-нуклеїнові кислоти також включають В одному здійсненні 5'Х1Х2ТСХ3Х43' послідовполі-А, полі-G та/або полі-С мотиви. Ще в одному ність TG-нуклеїнової кислоти або TG-нуклеїнова здійсненні Ру-збагачена або імуностимулююча TGкислота повної довжини, або її деякий фрагмент нуклеїнова кислота вільна від двох полі-Спредставляють собою непаліндромну послідовпослідовностей з щонайменше 3 суміжних Сність, а в інших здійсненнях - паліндромну послінуклеотидних залишків або вільна від двох полі-Адовність. послідовностей з щонайменше 3 стичних АВ деяких переважних здійсненнях TGнуклеотидних залишків. В інших здійсненнях Рунуклеїнова кислота є також Т-збагаченою. збагачена або імуностимулююча TG-нуклеїнова Ру-збагачені та імуностимулюючі TGкислота має нуклеотидний склад із понад 25% С нуклеїнові кислоти, що в деяких здійсненнях маабо більше, ніж 25% А. Ще в одному здійсненні Рують нуклеотидний остов, який включає щонаймезбагачена або імуностимулююча TG-нуклеїнова нше одну модифікацію остову, таку як фосфортіокислота вільна від полі-С-послідовностей, полі-Сатна модифікація. Нуклеотидний остов може бути послідовностей або полі-А-послідовностей. гібридним або, переважно нуклеотидний остов є Полі-С нуклеїнову кислоту в деяких здійсненповністю модифікованим. В одному переважному нях вибирають з групи, що складається з SEQ ID здійсненні імуностимулююча нуклеїнова кислота NO: 5, 6, 73, 215, 267-269, 276, 282, 288, 297-299, має полі-Т-мотив і фосфортіоатний остов. 355, 359, 386, 387, 444 476, 531, 557-559, 733, 768, В іншому варіанти винахід є композицією іму795, 796, 914-925, 928-931, 933-936 і 938. В інших ностимулюючої нуклеїнової кислоти у формі Руздійсненнях полі-G нуклеїнова кислота включає збагаченої або імуностимулюючої TG-нуклеїнової послідовність, вибрану з групи, що складається з кислоти і антигена, де нуклеїнова кислота є вільSEQ ID NO: 67, 80-82, 141, 147, 148, 173, 178, 183, ною від неметильованих CpG-мотивів. 185, 214, 224, 264, 265, 315, 329, 434, 435, 475, Інша композиція згідно з винаходом представ519, 521-524, 526, 527, 535, 554, 565, 609, 628, ляє собою Ру-збагачену або імуностимулюючу TG660, 661, 662, 725, 767, 825, 856, 857, 876, 892, нуклеїнову кислоту і протимікробний агент, де Ру909, 926, 927, 932 і 937. збагачена або TG-нуклеїнова кислота є вільною Відповідно до іншого варіанту винаходу імуновід неметильованих CpG-мотивів. Переважно простимулюючі нуклеїнові кислоти можуть бути витимікробний агент вибирають з групи, що складазначені як такі, володіючі TG-мотивом, їх тут позється з противірусного агента, антипаразитарного начають як імуностимулюючі TG-нуклеїнові агента, антибактеріального агента і протигрибкокислоти. TG-нуклеїнова кислота в одному здійсвого агента. ненні містить щонайменше один TG-динуклеотид, Композиція пристрою з постійним вивільненщо має послідовність, що включає щонайменше ням, що включає Ру-збагачену та/або імуностимунаступну формулу: 5'N1X1TGX2N23'. В схожих здійлюючу TG-нуклеїнову кислоту, де кислота Русненнях Ν1 є послідовністю нуклеїнової кислоти, збагачена та/або TG-нуклеїнова є вільною від нещо складається з кількості нуклеотидів, що колиметильованих CpG-мотивів, пропонується відповівається в діапазоні від (11-Ν2) до (21-Ν2) і Ν2 є подно до іншого варіанту винаходу. слідовністю нуклеїнової кислоти, що складається з Винахід також включає харчові добавки Рукількості нуклеотидів, що коливається в діапазоні збагаченої або імуностимулюючої TG-нуклеїнової від(11-Ν1) до (21-N1), В переважному здійсненні Х2 кислоти і пристрій для доставки, вибраний з групи, є тимідин. що складається з капсули, пілюлі і під'язикової В інших здійсненнях TG-нуклеїнова кислота таблетки, де Ру-збагачена або TG-нуклеїнова кисмає щонайменше наступну формулу: лота є вільною від неметильованих CpG-мотивів. 5'X1X2TGX3X43'. Ще в одному здійсненні TGПовинно бути зрозуміло, що коли корисно нуклеїнова кислота включає наступну послідоввводити Ру-збагачений, наприклад, полі-Т, Тність: 5'N1Φ1Φ2ΤCΦ3Φ4Ν23'. В схожому здійсненні Ν1 збагачений, С-збагачений або TG-олігонуклеотид і є послідовністю нуклеїнової кислоти, що складаCpG-олігонуклеотид, може бути також бажаним ється з кількості нуклеотидів, що коливається в сумісне введення Ру-збагаченого або TGдіапазоні від (9-Ν2) до (19-Ν2) і Ν2 є послідовністю олігонуклеотиду разом з фізично окремим CpG, нуклеїнової кислоти, що складається з кількості Ру-збагаченим або TG-олігонуклеотидом. В протинуклеотидів, що коливається в діапазоні від(9-Ν1) лежному варіанти CpG, Ру-збагачений або TGдо (19-Ν1). В одному переважному здійсненні Х3 є мотив може бути присутній в одній і тій же нуклеїтимідин. Х1Х2 є нуклеотиди, які можуть бути вибновой кислоті у вигляді прилеглого Ру-збагаченого рані з групи, що складається з GT, GG, GA, АА, AT, або TG-олігонуклеотиду. Ще в одному здійсненні AG, СТ, СА, CG, ТА і ТТ, а Х3Х4 є нуклеотиди, які всі або деякі поєднання Ру-збагаченої, TG- і CpGможуть бути вибрані з групи, що складається з ТТ, нуклеїнових кислот можна вводити разом або як СТ, AT, AG, CG, ТС, АС, СС, ТА, АА і СА. В деяких окремі нуклеїнові кислоти, або в одній і тій же мопереважних здійсненнях Х3 є тимідин. У важливих лекулі нуклеїнової кислоти. Під сумісним введенздійсненнях Х3Х4 є нуклеотиди, які можуть бути ням мається на увазі, що нуклеїнові кислоти бу 9 77152 10 дуть вводитися достатньо близько за часом одна Винахід відноситься до інших аспектів імуносдо іншої для досягнення з'єднаної корисної дії тимулюючих олігонуклеотидів, які мають химерні обох олігонуклеотидів, переважно більшої, ніж остови і які не вимагають присутності CpG-мотиву. корисна дія, що досягається введенням кожного з Винахід частково заснований на відкритті того, що олігонуклеотидів окремо в тій же дозі. послідовності нуклеїнових кислот, які не містили CpG-олігонуклеотиди мають в цілому формулу CpG-мотивів, були імуностимулюючими і що ті, які 5'X1X2CGX3X43', де Х1, Φ2, Х3 і Х4 є нуклеотиди і де мають химерні остови, володіють несподівано збіщонайменше С з CpG неметильований. Переважні льшеними імуностимулюючими властивостями. CpG-олігонуклеотиди складають 8-100 нуклеотидів Таким чином, винахід в одному варіанти віднов довжину і мають модифіковані остови. Конкретні ситься до складу олігонуклеотиду, що має формуструктури детально описані в опублікованих заявлу: 5'Y1N1ZN2Y23', де Y1 і Y2 незалежно один від ках РСТ, заявках США і цитованих тут посиланнях, одного є молекулами нуклеїнових кислот, що мавідкриття яких включені тут повністю. В одному ють від 1 до 10 нуклеотидів, де Y1 включає щоздійсненні CpG-олігонуклеотид вільний від полі-Т і найменше один модифікований міжнуклеотидний TG-мотивів і не є Т-збагаченим. зв'язок, Y2 включає щонайменше один модифікоВ інших здійсненнях CpG-олігонуклеотид має ваний міжнуклеотидний зв'язок і де Ν1 і N2 є молепослідовність, вибрану з групи, що складається з кулами нуклеїнових кислот, які незалежно один від SEQ ID NO: 1, 3, 4, 14-16, 18-24, 28, 29, 33-46, 49, одного мають від 0 до 5 нуклеотидів, але де N1ZN2 50, 52-56, 58, 64-67, 69, 71, 72, 76-87, 90, 91, 93, має щонайменше 6 нуклеотидів в сумі, і де нукле94, 96, 98, 102-124, 126-128, 131-133, 136-141, 146отиди Ν1ΖΝ2 мають фосфодіефірний остов, і де Ζ 150, 152-153, 155-171, 173-178, 180-186, 188-198, представляє собою імуностимулюючий мотив нук201, 203-214, 216-220, 223, 224, 227-240, 242-256, леїнової кислоти, але не включає CG. В одному 258, 260-265, 270-273, 275, 277-281, 286-287, 292, здійсненні Ζ є послідовністю нуклеїнової кислоти, 295-296, 300, 302, 305-307, 309-312, 314-317, 320вибраною з групи, що складається з ТТТТ, TG, і 327, 329, 335, 337-341, 343-352, 354, 357, 361-365, послідовності, в якій щонайменше 50% основ пос367-369, 373-376, 378-385, 388-392, 394, 395, 399, лідовності є Ts. 401-404, 406-426, 429-433, 434-437, 439, 441-443, В деяких здійсненнях Υ1 та/або Y2 мають від 3 445, 447, 448, 450, 453-456, 460-464, 466-469, 472до 8 нуклеотидів. В інших здійсненнях Y1 та/або Y2 475, 477, 478, 480, 483-485, 488, 489, 492, 493, включають щонайменше три Gs, щонайменше 495-502, 504-505, 507-509, 511, 513-529, 532-541, чотири Gs, щонайменше сім Gs або всі Gs. В ін543-555, 564-566, 568-576, 578, 580, 599, 601-605, ших здійсненнях Υ1 та/або Y2 вибирають з групи, 607-611, 613-615, 617, 619-622, 625-646, 648-650, що складається з TCGTCG, TCGTCGT і 653-664, 666-697, 699-706, 708, 709, 711-716, 718TCGTCGTT (SEQ ID N0:1145). Ще в одному здійс732, 736, 737, 739-744, 746, 747, 749-761, 763, 766ненні Υ1 та/або Υ2 включають щонайменше одну, 767, 769, 772-779, 781-783, 785-786, 7900792, 798дві, три, чотири або п'ять полі-Α, полі-Т або полі-С799, 804-808, 810, 815, 817, 818, 820-832, 835-846, послідовності. 849-850, 855-859, 862, 865, 872, 874-877, 879-881, Центральні нуклеотиди (Ν1ΖΝ2) формули 883-885, 888-904 і 909-913. Υ1N1ΖΝ2Y2 мають фосфодіефірні міжнуклеотидні В іншому здійсненні Ру-збагачений або TGзв'язки, Υ1 і Υ2 мають щонайменше один модифіолігонуклеотид вільний від CpG-мотивів. Дане кований міжнуклеотидний зв'язок. В деяких здійсздійснення винаходу також включає фармацевтиненнях Υ1 та/або Υ2 мають щонайменше два мочні композиції і набори, які містять як CpGдифіковані міжнуклеотидні зв'язки. В інших олігонуклеотид (який може бути вільний від полі-Т здійсненнях Υ1 та/або Υ2 мають, від двох до п'яти і TG-мотивів і не є Т-збагаченим), так і Румодифікованих міжнуклеотидних зв'язків. Ще в збагачений та/або TG-олігонуклеотид, фізично одному здійсненні Υ1 має два модифіковані міжнуокремий від CpG-олігонуклеотиду. Фармакологічні клеотидні зв'язки, і Υ2 має п'ять модифікованих препарати знаходяться в ефективних кількостях і міжнуклеотидних зв'язків або Υ1 має п'ять модифізвичайно включають фармацевтично прийнятні кованих міжнуклеотидних зв'язків і Y2 має два моносії, всі як тут детально пояснюється для Рудифіковані міжнуклеотидні зв'язки. Модифікований збагачених і TG-олігонуклеотидів. Набори вклюміжнуклеотидний зв'язок в деяких здійсненнях чають щонайменше один контейнер, що містить представляє собою фосфортіоатний модифіковаолігонуклеотид, який є Ру-збагаченим або TGний зв'язок, фосфордитіоатний, модифікований олігонуклеотид (або деякі їх поєднання). Той же зв'язок або п-етокси-модифікований зв'язок. контейнер або - в інших здійсненнях - другий конЧастини формули Υ1Ν1ΖΝ2Υ2 можуть необов'ятейнер може містити олігонуклеотид з CpGзково формувати паліндром. Таким чином, в демотивом, який може бути вільний від Руяких здійсненнях нуклеотиди Ν1ΖΝ2 утворюють збагаченого та/або TG-мотивів. Набір також міспаліндром. В деяких здійсненнях паліндром не тить інструкції для введення олігонуклеотидів супредставляє собою прямий повтор. Ще в одних б'єкту. Набори також можуть включати контейнер, здійсненнях нуклеотиди Ν1ΖΝ2 не утворюють паліщо містить розчинник або розріджувач. ндром. В цілому, як тут повністю цитується, CpGВідповідно до інших здійснень ΝχΖΝ2 мають олігонуклеотид, фізично відокремлений від Рупослідовність нуклеотидів, вибрану з групи, що збагаченого або TG-олігонуклеотиду, може бути складається з застосований разом з Ру-збагаченим або TGолігонуклеотидами в способах, композиціях і продуктах, описаних вище. 11 77152 12 їнова кислота, що має неметильований CGдинуклеотид TG-динуклеотид або Ру-збагачену послідовність, має повністю фосфодіефірний остов, і в інших здійсненнях імуностимулююча нуклеїнова кислота, що має неметильований CGдинуклеотид, TG-динуклеотид або Ру-збагачену послідовність має модифікований остов, який необов'язково може мати міжнуклеотидні зв'язки, вибрані з групи, що складається з фосфортіоату, фосфордитіоату і п-етокси. В одному здійсненні імуностимулююча нуклеїнова кислота, що має неметильований CGдинуклеотид, має формулу, що включає 5'XiX2CGX3X431, де Хь Х2, Х3 і Х4 є нуклеотиди. В інших здійсненнях послідовність імуностимулюючої нуклеїнової кислоти включає щонайменше наступну формулу: 5'ТСNTX1Х2СGХ3Х43', де N представляє собою послідовність нуклеїнової кислоти, що складається приблизно з 0-25 нуклеотидів, де щонайменше один нуклеотид має модифікований міжнуклеотидний зв'язок і де нуклеїнова кислота має менше, ніж або рівно 100 нуклеотидів. Відповідно до деяких здійснень Х1Х2 є нуклеотиди, вибрані з групи, що складається з GT, GG, GA і АА, а Х3Х4 є нуклеотиди, ,вибрані з групи, що складаєтьКомпозиція може необов'язково включати в ся з ТТ, СТ або GT. В переважному здійсненні себе фармацевтичний носій та/або може бути Х1Х2 є GA, а Х3Х4 є ТТ. складена у вигляді пристрою для доставки. В деВ іншому здійсненні послідовність імуностимуяких здійсненнях пристрій для доставки вибирають люючої нуклеїнової кислоти, що має неметильоз групи, що складається з катіонних ліпідів, прониваний CG-динуклеотид, включає щонайменше каючих в клітину білків, і пристроїв з постійним одну з наступних послідовностей: вивільненням. В одному переважному здійсненні пристрій з постійним вивільненням представляє собою біодеградований полімер. В іншому здійсненні пристрій з постійним вивільненням є мікрочастинкою. В іншому варіанти у винаході пропонується композиція імуностимулюючого олігонуклеотиду, що має формулу Υ1Ν1ΖΝ2Υ2, і антигена. Інша композиція згідно з винаходом представляє собою імуностимулюючий олігонуклеотид, що має формулу Υ1Ν1ΖΝ2Υ2, і протимікробний терапевтичний агент. Переважно протимікробний терапевтичний агент вибирають з групи, що складається з противірусного агента, антипаразитарного агента, антибактеріального агента або протигрибкового агента. Композиція пристрою для постійного вивільнення, що включає імуностимулюючий олігонуклеотид, що має формулу Υ1Ν1ΖΝ2Υ2, пропонується відповідно до іншого варіанту винаходу. Винахід також включає харчові добавки імуностимулюючого олігонуклеотиду, що має формулу Υ1N1ΖN2Υ2, в пристрої для доставки, вибраний з групи складається з капсули, під'язикової таблетки і пілюлі. В іншому варіанти композиції, описані вище, також включають імуностимулюючу нуклеїнову кислоту, що має неметильований CGдинуклеотид, TG-нуклеотид або Ру-збагачену посВ іншому здійсненні імуностимулююча нуклеїлідовність де імуностимулююча нуклеїнова кислонова кислота, що має Ру-збагачену або TGта, що має неметильований CG-динуклеотид, TGпослідовність, представляє собою нуклеїнову кисдинуклеотид або Ру-збагачену послідовність, має лоту, описану вище. послідовність, відмінну від олігонуклеотиду, що В іншому здійсненні винахід відноситься до включає в себе 5'Y1Ν1ΖΝ2Υ23'. фармацевтичних композицій і наборів, які містять В деяких здійсненнях імуностимулююча нуклеяк олігонуклеотид, що має формулу Υ1N1ΖN2Υ2, так 13 77152 14 і CpG-олігонуклеотид (який необов'язково може їнові кислоти можуть бути застосовані для перебути вільний від полі-Т і TG-мотивів і не бути Румикання імунної відповіді з Th2 на Тh1. Рузбагачений), Ру-збагачений та/або TGзбагаченІ і TG-нуклеїнові кислоти можна також олігонуклеотид, фізично окремі від олігонуклеотизастосовувати для активації імунної клітини, такої ду, що має формулу Υ1Ν1ΖΝ2Υ2. Фармацевтичні як лейкоцит, дендритна клітина і клітина NK. Актипрепарати знаходяться в ефективних кількостях і вація може бути проведена in vivo, in vitro або ex звичайно включають фармацевтично прийнятні vivo, тобто шляхом виділення імунної клітини у носії, і все це тут детально пояснюється. Набори суб'єкта, контакти імунної клітини з ефективною включають щонайменше один контейнер, що міскількістю Ру-збагаченої або імуностимулюючої TGтить олігонуклеотид, який має формулу нуклеїнової кислоти для активації імунної клітини і Υ1Ν1ΖΝ2Υ2. Той же контейнер або - в інших здійсповторного введення активованої імунної клітини неннях - другий контейнер може містити олігонуксуб'єкту. В деяких здійсненнях дендритна клітина леотид з CpG-мотивом, який необов'язково може експресує раковий антиген. Дендритна клітина бути вільний від Ру-збагаченого та/або TGможе бути експонована з раковим антигеном ex мотивів, та/або Ру-збагачений або TGvivo. олігонуклеотид (або деяке їх поєднання). Набір Імунна відповідь, що викликається Рутакож містить інструкції для введення олігонуклеозбагаченими або TG-нуклеїновими кислотами мотидів суб'єкту. Набори також можуть включати же також приводити до індукції продукції цитокінів, контейнер, що містить розчинник або розріджувач. наприклад, продукції ІЛ-6, ІЛ-12, ІЛ-18 TNF, IFN- і В цілому, як тут повністю цитується, олігонукIFN- . леотид, що має формулу Υ1Ν1ΖΝ2Υ2, який фізично Ще в одному здійсненні Ру-збагачені і TGвідокремлений від CpG, Ру-збагаченого або TGнуклеїнові кислоти корисні для лікування рака. Руолігонуклеотиду, може бути застосований разом з збагачені і TG-нуклеїнові кислоти відповідно до CpG, Ру-збагаченим або TG-олігонуклеотидами в інших варіантив винаходу корисні також у профіописаних тут способах, композиціях і продуктах. лактиці рака (наприклад, зниженні ризику розвитку В іншому варіанти винахід відноситься до фарака) у суб'єкта з ризиком розвитку рака. Рак може рмацевтичної композиції, що включає щонайменбути вибраний з групи, що складається з рака жоше два олігонуклеотиди згідно з винаходом, де вчних шляхів, рака молочної залози, рака шийки щонайменше два олігонуклеотиди мають відмінні матки, хоріокарциноми, рака прямої кишки, рака один від одного послідовності, і фармацевтично ендометрію, рака шямку, внутрішньоепітеліальних прийнятний носій. неоплазій, лейкозу, рака печінки, рака легень (наВідповідно до іншого варіанту винаходу проприклад, дрібноклітинного і недрібноклітинного), понується склад вакцини. Вакцина включає будьмеланоми, нейробластом, рака ротової порожнияку з композицій в поєднанні з антигеном. ни, рака яєчників, рака підшлункової залози, рака Відповідно до іншого варіанту винаходу пропростати, ректального рака, сарком, рака щитовипонується спосіб стимуляції імунної відповіді. Сподної залози і рака нирок, також як i інших карцином сіб включає в себе введення TG-нуклеїнової кисі сарком. В деяких важливих здійсненнях рак вилоти, Ру-збагаченої або імуностимулюючої, бирають з групи, що складається з рака кісток, суб'єкту, що не є гризуном, в кількості, ефективній мозку і рака ЦНС, рака сполучної тканини, рака для індукції імунної відповіді у суб'єкта, що не є стравоходу, рака очей, лімфоми Ходжкіна, рака гризуном. Переважно Ру-збагачену або імуностигортані, рака ротової порожнини, рака шкіри і рака мулюючу TG-нуклеїнову кислоту вводять перорасім'яників. льно, місцево, в пристрої з постійним вивільненРу-збагачені і TG-нуклеїнові кислоти можна ням, на слизову поверхню, системно, також застосовувати для збільшення відповіді рапарентерально або внутрішньом'язово. Коли Рукових клітин на терапію рака (наприклад, протиразбагачену або імуностимулюючу TG-нуклеїнову кову терапію), необов'язково коли Ру-збагачену і кислоту вводять на слизову поверхню, вона поімуностимулюючу TG-нуклеїнову кислоту вводять винна бути доставлена в кількості, ефективній для в поєднанні з протираковою терапією. Протиракоіндукції імунної відповіді у слизовій або системної ва терапія може бути хіміотерапією, вакцинацією імунної відповіді. В переважних здійсненнях сли(наприклад, активована in vitro вакцина дендритзову поверхню вибирають з групи, що складається них клітин або вакцина ракового антигену) або з поверхні ротової порожнини, носової порожнини, терапією на основі антитіл. Даний останній варіант ректальної, вагінальної поверхні і поверхні очної терапії може також включати введення антитіла, порожнини. специфічного для антигену клітинної поверхні, В деяких здійсненнях спосіб включає введення наприклад, ракової клітини, коли імунна відповідь суб'єкту антигена, коли імунна відповідь є антигенвиявляється у вигляді антиген-залежної клітинної специфічною імунною відповіддю. Антиген може цитотоксичності (ADCC). В одному здійсненні анкодуватися вектором нуклеїнової кислоти, який титіло може бути вибране з групи, що складається може доставлятися суб'єкту. В деяких здійсненнях з рубитаксину, герцепіну, квадрамету, панорексу, антиген вибирають з групи, що складається з пухUDEC-Y2B8, ВЕС2, С225, онколиму, SMART M195, линного антигена, вірусного антигена, бактеріальATRAGEN, оварексу, Bexxar, LDP-03, іоr t6, MDXного антигена, паразитарного антигена і пептидно210, MDX-11, MDX-22, OV103, 3622W94, антиго антигена. VEGF, зенапаксу, MDX-220, MDX-447, Ру-збагачені і імуностимулюючі TG-нуклеїнові MELIMMUNE-2, MELIMMUNE-1, СЕАСIDЕ, претаркислоти здатні викликати широкий спектр імунної гету, NovoMAb-G2, TNT, Gliomab-H, GNI-250, EMDвідповіді. Наприклад, дані імуностимулюючі нукле72000, LymphoCide, CMA 676, монофарму-С, 4В5, 15 77152 16 ior egf.rS, ior c5, BABS, anti-FLK-2, MDX-260, ANA DDD), мітоксантрону НСl, октреотиду, плікаміцину, Ab, SMART 1D10 Ab, SMART ABL 364 Ab і прокарбазину НСl, стрептозоцину, тамоксифену, ImmuRAIT-CEA. цитрату, тіогуаніну, тІотепу, вінбластину сульфату, Таким чином, відповідно до деяких варіантів амсакрину (m-AMSA), азацитидину, ертропоетину, винаходу, суб'єкту, який страждає раком або має гексаметилмеламіну (НММ), інтерлейкіну 2, міторизик розвитку рака, вводять імуностимулюючу гуазону (метил-GAG; метилгліоксаль-біснуклеїнову кислоту і проводять протиракову терагуанілгідразону; MGBG), пентостатину пію. В деяких здійсненнях протиракову терапію (2'дезоксикоформіцину), семустину (метил-CCNU), вибирають з групи, що складається з хіміотерапетеніпозиду (VM-26) і віндезину сульфату, але цим втичного агента, імунотерапевтичного агента і не обмежується. протиракової вакцини. Хіміотерапевтичний агент Імунотерапевтичний агент може бути вибраможе бути вибраний з групи, що складається з ний з групи, що складається з рибутаксину, герцеметотрексату, вінкристину, адріаміцину, цисплатиптину, квадрамету, панорексу, IDEC-Y2B8, ВЕС2, ну, що не містять цукор хлоретилнітрозосечовин, С225, онколиму, SMART M195, ATRAGEN, оварек5-фторурацилу, мітоміцину С, блеоміцину, доксосу, Bexxar, LDP-03, ior t6, MDX-210, MDX-11, MDXрубицину. дакарбазину, таксолу, фрагіліну, мегла22, OV103, 3622W94, анти-VEGF, зенапаксу, MDXміну GLA, валрубіцину, кармустаїну і поліферпоза220, MDX-447, MFLIMMUNE-2, MELIMMUNE-1, ну, ММІ270, BAY 12-9566, RAS інгібітору CEACIDE, претаргету, NovoMAb-G2, TNT, Gliomabфамезилтрансферази, інгібітору фамезилтрансH, GNI-250, EMD-72000, лімфоциду, СМА 676, моферази, ММР, MTA/LY231514, нофарму-С, 4В5, ior egf.r3, ior c5, BABS, aнти-FLKLУ264618/лометексолу, гламолеку, СІ-994, TNP2, MDX-260, ANA Ab, SMART 1D10 Ab, SMART ABL 470, гікамтину/топотекану, РКС412, валспода364 Ab і ImmuRAIT-CEA, але яка цим не обмежуру/РSС833 новантрону/мітроксантрону, метареється. ту/сураміну, батимастату, Е7070, ВСН-4556, CSПротиракова вакцина може бути вибрана з 682, 9-АС AG3340, AG3433, інцела/VХ-710, VXгрупи, що складається з EGF, антиідіотипічних 853, ZD0101, ISI641, ОДН 698, ТА протиракових вакцин, антигена Gp75, меланомної 2516/мармістату, ВВ2516/мармктату, CDP 845, вакцини GMK, вакцини кон'югата MGV гангліозиду, D2163, PD183805, DX8951f лемоналу, DP 2202, FK Her2/neu, оварексу, M-Vax, O-Vax, L-Vax, STn-KHL 317, піцибанілу/ОК-432, AD 32/валрубіцину, метастератопу, BLP25 (MUC-1), ліпосомальної ідіотипічтрону/похідного стронцію, темодалу/темозоломіду, ної вакцини, мелацину, вакцин пептидних антигеевацету/ліпосомального доксорубіцину, ювтаксанів, вакцин токсинів/антигенів, вакцини на основі ну/плацлитакселу, таксолу/паклітакселу, кселоаMVA, PACIS, вакцини BCG, TA-HPV, TA-CIN, DISCду/капецитабіну, фуртулону/доксифлуридину, циювірусу і ImmuCyst/TheraCys, але яка цим не обмеіопаксу/перорального паклітакселу перорального жується. таксоїду, SPU-077/цисплатину, HMR Ще в одному здійсненні способів, направлених 1275/флавопіридолу, СР-358 (774)/EGFR, CP-609 на профілактику або лікування рака, суб'єкту може (754)/інгібітору онкогена RAS, BMSдодатково введений інтерферон- . 182751/пероральної платини В інших варіантах винахід відноситься до споЦРТ(тегафуру/урацилу), ергамізолу/левамізолу, собів профілактики захворювання у суб'єкта. Споеніурацилу/776С85/5Fu підсилювача, кампсіб включає регулярне введення суб'єкту Руто/левамізолу, камптозару/іринотекану, тумодекзбагаченої або імуностимулюючої TG-нуклеїнової су/ралітрекседу, леустатину/кладрибіну, паксеккислоти для підтримки відповіді імунної системи су/паклітакселу, доксилу/ліпосомального для профілактики захворювання у суб'єкта. Прикдоксорубіцину, целіксу/ліпосомального доксорубілади захворювань або станів, яким прагнуть запоцину, флудару/флударабіну, фармарубіцибігти із застосуванням способів профілактики згідну/епірубіцину, депоциту, ZD1839, LU но з винаходом, включають мікробні інфекції 79553/біснафталіміду, LU 103793/доластаїну, це(наприклад, захворювання, що передаються статиксу/ліпосомального доксорубіцину, гемзатевим шляхом) і анафілактичний шок від харчової ру/гемцитабіну, ZD 0473/анормеду, YM 116 кульок алергії. йоду, інгібіторів CDK4 і CDK2, інгібіторів PARP, В інших варіантах у винаході пропонується 04809/дексифозаміду, іфесу/меснексу/іфозаміду, спосіб індукції природної імунної відповіді шляхом вумону/теніпозиду, параплатину, карбоплатину, введення суб'єкту Ру-збагаченої або імуностимуплантинолу/цисплатину, вепезиду/етопозиду, ZD люючої TG-нуклеїнової кислоти в кількості, ефек9331, таксотеру/доцетакселу, проліків гуанінарабітивній для активації природної імунної відповіді. нозиду, аналога таксану, нітрозосечовин, алкілуюВідповідно до іншого варіанту винаходу прочих агентів, таких як мелфелан і циклофосфамід, понується спосіб лікування або профілактики віруаміноглутетиміду, аспарагінази, бусульфану, карсної або ретровірусної інфекції. Спосіб включає боплатину, хлоромбуцилу, цитарабіну NCl, дактивведення суб'єкту, схильному до ризику вірусної номіцину, даунорубіцину НСl, натрієвої солі естабо ретровірусної інфекції або страждаючому від рамустинфосфату, етопозиду (VP16-213), неї, ефективної кількості будь-якої з композицій флоксуридину, фторурацилу (5-FU), флутаміду, згідно з винаходом для лікування або профілактигідроксисечовини (гідроксикарбаміду), іфосфаміду, ки вірусної або ретровірусної інфекції. В деяких інтерферону альфа-2а, альфа-2b, леупроліду ацездійсненнях вірусне захворювання викликається тату (аналога LHRH-рилізинг фактора), ломустину вірусом гепатиту, ВІЛ, гепатиту В, гепатиту С, віру(CCNU), мехлоретаміну НСl (гірчичного азоту), сом герпесу або папіломавірусом. меркаптопурину, месни, міто тану (орто-пара'Відповідно до іншого варіанту винаходу про 17 77152 18 понується спосіб лікування або профілактики бакзику розвитку рака. У важливих здійсненнях імунотеріальної інфекції. Спосіб включає введення сустимулюючу нуклеїнову кислоту вибирають з груб'єкту, схильному до ризику захворювання бактепи, що складається з Т-збагаченої нуклеїнової киріальною інфекцією або страждаючому від неї, слоти, TG-нуклеїнової кислоти і С-збагаченої ефективної кількості будь-якої з композицій згідно нуклеїнової кислоти. з винаходом для лікування або профілактики бакУ винаході додатково пропонується набір, що теріальної інфекції. В одному здійсненні бактеріавключає перший контейнер, що містить імуностильна інфекція обумовлюється внутрішньоклітинмулюючу нуклеїнову кислоту і щонайменше ще ними бактеріями. один контейнер (наприклад, другий контейнер), що В іншому варіанти винаходу пропонується містить агент протиракової терапії, і інструкцію по спосіб лікування або профілактики паразитарної застосуванню. В одному здійсненні набір додаткоінфекції за допомогою введення суб'єкту, що має во включає інтерферон- , який може бути включеризик або страждаючому від паразитарної інфекний окремо ще в один контейнер (наприклад, треції, ефективної кількості будь-якої з композицій тій контейнер). У важливому здійсненні набір згідно з винаходом для лікування або профілактивключає пухирці з постійним вивільненням, що ки паразитарної інфекції. В одному здійсненні памістять імуностимулюючу нуклеїнову кислоту, і разитарна інфекція обумовлюється паразитом не щонайменше один контейнер, що містить агент гельмінтом. протиракової терапії, і інструкцію по режиму ввеВ деяких здійсненнях суб'єкт є людиною, а в дення агента протиракової терапії. Імуностимулюінших здійсненнях суб'єкт є хребетним, що не є юча нуклеїнова кислота може бути вибрана з грулюдиною, вибраним з групи, що складається з пи, що складається з Ру-збагаченої нуклеїнової собаки, кішки, коня, корови, свині, кози, риби, мавкислоти, TG-нуклеїнової кислоти і CpG нуклеїнової пи, курчати і вівці. кислоти, де CpG нуклеїнова кислота має послідовЩе в одному варіанти у винаході пропонується ність нуклеотидів, що включає SEQ ID NO: 246. спосіб лікування або профілактики астми за допоУ винаході додатково пропонується спосіб могою введення суб'єкту, що має ризик або стражпрофілактики або лікування астми або алергії, що даючому від астми, ефективної кількості будь-якої включає введення імуностимулюючої нуклеїнової з композицій згідно з винаходом для лікування або кислоти і ліків для лікування астми/алергії в кільпрофілактики астми. В одному здійсненні астма є кості, ефективній для лікування або запобігання алергічною астмою. астми або алергії. У важливих здійсненнях імуносВ іншому варіанти винахід відноситься до спотимулюючу нуклеїнову кислоту вибирають з групи, собу лікування або профілактики алергії. Спосіб що складається з Т-збагаченої нуклеїнової кисловключає введення суб'єкту, що має ризик або ти, TG-нуклеїнової кислоти і С-збагаченої нуклеїстраждаючому від алергії, ефективної кількості нової кислоти. будь-якої з композицій згідно з винаходом для ліВ одному здійсненні імуностимулююча нуклеїкування або профілактики алергії. нова кислота представляє собою Т-збагачену нукВідповідно до іншого варіанту винаходу, пролеїнову кислоту. Вздійсненнях, що відносяться до понується спосіб лікування або профілактики імуцього, Т-збагачена нуклеїнова кислота має послінодефіциту. Спосіб включає введення суб'єкту, що довність нуклеотидів, вибрану з групи, що складамає ризик або страждаючому від імунодефіциту, ється з SEQ ID NO: 59-63, 73-75, 142, 215, 226, ефективної кількості будь-якої з композицій згідно 241, 267-269, 282, 301, 304, 330, 342, 358, 370-372, з винаходом для лікування або профілактики іму393, 433, 471, 479, 486, 491, 497, 503, 556-558, нодефіциту. 567, 694, 793-794, 797, 833, 852, 861, 867, 868, В іншому варіанти винахід відноситься до спо882, 886, 905, 907, 908 і 910-913. В інших здійссобу індукції Тh1 імунної відповіді за допомогою неннях Т-збагачені нуклеїнові кислоти мають посвведення суб'єкту будь-якої з композицій згідно з лідовність, вибрану з групи, що складається з SEQ винаходом в ефективній кількості для індукції Тh1 ID NO: 64, 98, 112, 146, 185, 204, 208, 214, 224, імунної відповіді. 233, 244, 246, 247, 258, 262, 263, 265, 270-273, В одному здійсненні способи згідно з винахо300, 305, 316, 317, 343, 344, 350, 352, 354, 374, дом включають введення олігонуклеотиду, що має 376, 392, 407, 411-413, 429-432, 434, 435, 443, 474, формулу 5'Υ1Ν1ΖΝ2Υ23', і імуностимулюючої нукле475, 498-501, 518, 687, 692, 693, 804, 862, 883, 884 їнової кислоти, що має неметильований CG888, 890 і 891. динуклеотид, TG-динуклеотид або Т-збагачену В додатковому здійсненні, що відноситься до послідовність. У здійсненні олігонуклеотид, що цього, Т-збагачена нуклеїнова кислота не є TGвключає 5'Υ1Ν1ΖΝ2Υ23', вводять окремо від імуноснуклеїновою кислотою. Ще в одному здійсненні Ттимулюючої нуклеїнової кислоти. В деяких здійсзбагачена нуклеїнова кислота не є CpG нуклеїноненнях олігонуклеотид, що включає 5'Υ1Ν1ΖΝ2Υ23', вою кислотою. і імуностимулюючу нуклеїнову кислоту вводять по В одному здійсненні імуностимулююча нуклеїчерзі по тижню, а в інших здійсненнях олігонуклеонова кислота представляє собою TG нуклеїнову тид, що включає 5'Υ1Ν1ΖΝ2Υ23' і імуностимулюючу кислоту. В додатковому, що відноситься до цього, нуклеїнову кислоту, вводять по черзі по два тижні. здійсненні TG-нуклеїнова кислота не є ТВ іншому варіанти у винаході пропонується збагаченою нуклеїновою кислотою. В іншому здійкомпозиція, що включає імуностимулюючу нуклеїсненні, що відноситься до цього, TG-нуклеїнова нову кислоту і агент протиракової терапії, в складі кислота не є CpG нуклеїновою кислотою. з фармацевтично прийнятним носієм і в ефективВ одному здійсненні імуностимулююча нуклеїній кількості для лікування рака або зниження ринова кислота представляє собою CpG нуклеїнову 19 77152 20 кислоту, де CpG нуклеїнова кислота має послідовкислоти. В іншому важливому здійсненні набір ність нуклеотидів, що включає SEQ ID NO: 246. включає пухирці з постійним вивільненням, що В іншому здійсненні ліки проти астми/алергії є містять імуностимулюючу нуклеїнову кислоту, і ліками, вибраними з групи, що складається з інгібіщонайменше один контейнер, що містить ліки протору PDE-4, бронходилататора/бета-2 агоніста, ти астми/алергії, і Інструкції по режиму введення ліки для відкриття К+ каналів, антагоніста VLA-4, ліків проти астми/алергії. Ліки проти астми/алергії антагоніста нейрокініну, інгібітору синтезу ТХА2, можуть бути вибрані з групи ліків проти астксантаніну, антагоніста арахідонової кислоти, інгіми/алергії, описаних у вищевикладених способах, бітору 5-ліпоксигенази, антагоніста рецептора направлених на профілактику або лікування асттромбоксину А2, антагоніста тромбоксану А2, інгіми/алергії. бітору 5-ліпокс-активаторного білка і інгібітору Ще в одному варіанти у винаході пропонується протеази, але не обмежується цим. В деяких важкомпозиція, що включає імуностимулюючу нуклеїливих здійсненнях ліки проти астми/алергії преднову кислоту і ліки проти астми/алергії в складі з ставляють собою бронходилататор/бета-2 агоніст, фармацевтично прийнятним носієм, в кількості, вибраний з групи, що складається з сальметеролу, ефективній для профілактики або лікування імунсальбутамолу, тербуталіну, 02522/формотеролу, ної відповіді, пов'язаної з експозицією з посередфенотеролу і орципрєналіну. ником астми або алергії. Імуностимулююча нуклеїВ іншому здійсненні ліки проти астми/алергії є нова кислота може бути вибрана з групи ліками, вибраними з групи, що складається з антиімуностимулюючих нуклеїнових кислот, описаних у гістамінних препаратів і індукторів простагландивикладених вище способах і композиціях. У важнів. В одному здійсненні антигістамін вибирають з ливих здійсненнях імуностимулюючу нуклеїнову групи складається з лоратидину, цетиризину, баккислоту вибирають з групи, що складається з Тлізину, аналогів цетеризину, фексофенадину, тезбагаченої нуклеїнової кислоти, TG-нуклеїнової рфенадину, деслоратадину, норастемізолу епінаскислоти і С-збагаченої нуклеїнової кислоти. Ліки тину, ебастину, астемізолу, левокабастину, проти астми/алергії можуть бути вибрані з групи азеластину, траніласту, терфенадину, мізоластиліків проти астми і ліків проти алергії, описаних у ну, бетатастину, CS 560 і HSR 609. В іншому здійвикладених вище способах і композиціях. сненні індуктор простагландинів є S-5751. Ще в одному варіанти у винаході пропонується Ще в одному здійсненні ліки проти асткомпозиція, що включає імуностимулюючу нуклеїми/алергії вибирають з групи, що складається із нову кислоту, вибрану з групи, що складається з стероїдів і імуномодуляторів. Іммуномодулятори SEQ ID NO: 95-136, SEQ ID NO: 138-152, SEQ ID можуть бути вибрані з групи, що складається з NO: 154-222, SEQ ID NO: 224-245, SEQ ID NO: протизапальних агентів, антагоністів лейкотриєнів, 247-261, SEQ ID NO: 263-299, SEQ ID NO: 301, мутеїнів ІЛ-4, розчинних рецепторів ІЛ-4, імуносупSEQ ID NO: 303-4109, SEQ ID NO: 414-420, SEQ ID ресантив, анти-ІЛ-4-антитіл, антагоністів ІЛ-4, анNO: 424, SEQ ID NO: 426-947, SEQ ID NO: 959ти-ІЛ-5-антитіл, розчинних рецепторів ІЛ-13-Fc 1022, SEQ ID NO: 1024-1093, і фармацевтично гібридних білків, анти-ІЛ-9 антитіл, CCR3 антагоніприйнятний носій. Переважно імуностимулююча стів, CCR5 антагоністів, VLA-4 інгібіторів і негативнуклеїнова кислота присутня в композиції в ефекних регуляторів IgE, але яка не обмежується цим. тивній кількості. В одному здійсненні імуностимуВ одному здійсненні негативним регулятором IgE є лююча нуклеїнова кислота присутня в ефективній анти-IgE. кількості для індукції імунної відповіді. В іншому В іншому здійсненні стероїди вибирають з груздійсненні імуностимулююча нуклеїнова кислота пи складається з беклометазону, флутиказону, присутня в ефективній кількості для профілактики трамцинолону, будесоніду і будесоніду. Ще в одабо лікування рака. Ще в одному здійсненні імуноному здійсненні імуносупресор є вакциною толестимулююча нуклеїнова кислота присутня в ефекрантного пептиду. тивній кількості для профілактики або лікування В одному здійсненні імуно стимулюючу нуклеїастми/алергії. У винаході також пропонуються нанову кислоту вводять одночасно з ліками проти бори, що включають композиції будь-яких описаастми/алергії. В іншому здійсненні суб'єкт є суб'єкних вище імуностимулюючих нуклеїнових кислот і том з порушенням імунної системи. інструкції по їх застосуванню. Імуностимулюючі нуклеїнові кислоти для ввеВ іншому варіанти винахід включає композидення суб'єкту в розкритих тут способах, що відноцію імуностимулюючої нуклеїнової кислоти, що сяться до профілактики і лікування астми/алергії, є складається по суті із 3'М1ТСGТСGТТМ23', де щотакими, як описано для інших методичних аспектів найменше один з С не метильований, де М1 предвинаходу. ставляє собою нуклеїнову кислоту, що має щоВ іншому варіанти у винаході пропонується найменше один нуклеотид, де М2 представляє набір, що включає перший контейнер, що містить собою нуклеїнову кислоту, що має від 0 до 50 нукімуностимулюючу нуклеїнову кислоту, і щонаймелеотидів, і де імуностимулююча нуклеїнова кислонше інший контейнер (наприклад, другий контейта має менше 100 нуклеотидів. нер), що містить ліки проти астми/алергії, і інструкЩе в одному варіанти винахід відноситься до ції по застосуванню. Імуностимулююча нуклеїнова фармацевтичної композиції імуностимулюючої кислота, використовувана в наборі, є описаною нуклеїнової кислоти, що включає: 5'TCGTCGTT3', тут. У важливих здійсненнях імуностимулюючу де щонайменше один із С не метильований, де нуклеїнову кислоту вибирають з групи, що складаімуностимулююча нуклеїнова кислота має менше ється з Т-збагаченої нуклеїнової кислоти, TG100 нуклеотидів і фосфодіефірний остов, і принуклеїнової кислоти і С-збагаченої нуклеїнової строї для постійного вивільнення. В деяких здійс 21 77152 22 неннях пристрій для постійного вивільнення є мікмогою ОДН, що не містять CpG. Опосередкований рочастинкою. В інших здійсненнях композиція NK лізис клітин-мішеней К-562 виміряли після інвключає антиген. кубації РВМС протягом ночі з 6мкг/мл ОДН 2006 Кожне з обмежень винаходу може охоплювати (SEQ ID NO: 246), 2194 (SEQ ID NO: 911) і 5126 різні аспекти винаходу. Отже, очікується, що кожне (SEQ ID NO: 1058). з обмежень винаходу, включаючи будь-який елеФіг.9 є гістограмою, що показує, що NKTмент або поєднання елементів, може бути вклюклітини можуть бути активовані ОДН, що не місчено в кожний варіант винаходу. тять CpG. PBMC одного репрезентативного доноФіг.1А є гістограмою експресії CD86 (вісь В) ра інкубували в присутності 6мкг/мл ОДН: 2006 CD19+ клітинами після експозиції даних клітин з (SEQ ID NO: 246), 2117 (SEQ ID NO: 358), 2137 олігонуклєотидами, представленими на осі X, в (SEQ ID NO: 886), 2183 (SEQ ID NO: 433) і 2194 концентрації 0,15мкг/мл. (SEQ ID NO: 911) і 5126 (SEQ ID NO: 1058) протяФіг.1В є таблицею з даними з Фіг.1А. гом 24 годин і активацію NKT-клітин виміряли за Фіг.1С є гістограмою експресії CD86 (вісь В) допомогою проточної цитометрії після фарбування CD 19+ клітинами після експозиції даних клітин з клітин mAb проти CD3 (маркер Т-клітин), CD56 олігонуклєотидами, представленими на осі X, в (маркер NK-клітин) і CD69 (маркер ранньої актиконцентрації 0,30мкг/мл. вації). Фіг.1D є таблицею з даними з Фіг.1С. Фіг.10 є гістограмою, що описує стимуляцію Фіг.2 є графіком порівняння здатності ОДН моноцитів різними ОДН, що містять CpG і не міс2137, ОДН 2177, ОДН 2200 і ОДН 2202 до стимутять CpG. PBMC інкубували у присутності 6мкг/мл ляції проліферації В-клітин при концентраціях в 2006 (SEQ ID NO: 246), 2117 (SEQ ID NO: 358), діапазоні від 0,2мкг/мл до 20мкг/мл. 2137 (SEQ ID NO: 886), 2178 (SEQ ID NO: 428), Фіг.3 є графіком порівняння здатності ОДН 2183 (SEQ ID NO: 433), 2194 (SEQ ID NO: 911), 2188, ОДН 2189, ОДН 2190 і ОДН 2182 до стиму5126 (SEQ ID NO: 1058) і 5163 (SEQ ID NO: 1095) і ляції проліферації В-клітин при концентраціях в фарбували на CD14 (маркер моноцитів) і CD80 діапазоні від 0,2мкг/мл до 20мкг/мл. (маркер активації, В7-1). Експресію виміряли за Фіг.4 є гістограмою, що описує дозозалежну допомогою проточної цитометрії. активацію В-клітин, що викликається ОДН, що не Фіг.11 є гістограмою, що описує секреції TNFct містять CpG. PBMC крові донора інкубувала з вкапри культивуванні клітин людини з ОДН, що не заними концентраціями ОДН 2006 (SEQ ID NO: містять CpG. PBMC культивували протягом 24 246), 2117 (SEQ ID NO: 358), 2137 (SEQ ID NO: годин з або без 6мкг/мл вказаних ОДН або з 886), 5126 (SEQ ID NO: 1058) і 5162 (SEQ ID NO: 1мкг/мл LPS як позитивного контролю і ΤΝΡ ви1094) і фарбували mAb проти CD 19 (маркер Вміряли за допомогою ТІФА. клітин) і CD86 (маркер активованих В-клітин, В7-2). Фіг.12 є гістограмою, що показує, що секреція Експресію виміряли за допомогою проточної циІЛ-6 після культивування з ОДН, що не містять тометрії. CpG, має той же характер, що і TNF . PBMC кульФіг.5 є гістограмою, що описує стимуляцію Втивували вказаними ОДН (1,0мкг/мл), і ІЛ-6 виміклітин різноманітним набором ОДН, що не містять ряли в супернатантах за допомогою ТІФА. CpG. PBMC крові одного репрезентативного доноВ одному варіанти винахід включає дані про ра стимулювала 0,4мкг/мл, 1,0мкг/мл або те, що піримідин (Ру)-збагачені і, переважно тимі10,0мкг/мл наступних ОДН: 2006 (SEQ ID NO: 246), дин (Т)-збагачені нуклеїнові кислоти, так само як 2196 (SEQ ID NO: 913), 2194 (SEQ ID NO: 911), нуклеїнові кислоти, які містять TG-динуклеотидні 5162 (SEQ ID NO: 1094) і 5163 (SEQ ID NO: 1095), мотиви, ефективні в опосередкуванні імуностиму5168 (SEQ ID NO: 1096) і 5169 (SEQ ID NO: 1097), і люючих ефектів. На попередньому рівні техніки експресію маркера активації CD86 (В7-2) на СD19було відомо, що нуклеїнові кислоти, що містять позитивних В-клітинах виміряли за допомогою CpG, є терапевтичними і профілактичними компопроточної цитометрії. зиціями, які стимулюють імунну систему для лікуФіг.6 є гістограмою, що описує активацію Ввання рака, інфекційних захворювань, алергії, асклітин, що викликається ОДН 1982 і 2041, що не тми і інших порушень, і допомагають захистити містять CpG. PBMC інкубували з вказаними концепроти інфекцій, що викликаються умовнонтраціями ОДН 2006 (SEQ ID NO: 246), 1982 (SEQ патогенними мікроорганізмами, після хіміотерапії ID NO: 225) і 2041 (SEQ ГО NO.: 282), і активацію рака. Сильні, але збалансовані, клітинна і гумораВ-клітин (експресію маркера активації CD86) вимільна імунні відповіді, які виникають завдяки стиряли проточною цитометрією. муляції CpG, відображають індивідуальну природФіг.7 є гістограмою, що описує NK-клітини, акну захисну систему організму проти тивовані ОДН, що не містять CpG. PBMC інкубувахвороботворних патогенів і ракових клітин. Посліли з 6мкг/мл наступних ОДН: ОДН 2006 (SEQ ID довності CpG, хоча відносно рідкісні в ДНК людиNO: 246), 2117 (SEQ ID NO: 358), 2137 (SEQ ID ни, звичайно виявляються в ДНК інфекційних орNO: 886), 2183 (SEQ ID NO: 433), 2194 (SEQ ID ганізмів, таких як бактерії. Імунна система людини, NO: 911) і 5126 (SEQ ID NO: 1058) і фарбували очевидно, розвивалася у напрямі пізнавання посmAb проти CDS (маркер Т-клітин), CD56 (маркер лідовностей CpG як ранньої застережливої ознаки ΝΕί-клітин) і CD69 (маркер ранньої активації). Ексінфекції і ініціації негайної і сильної імунної відпопресію CD69 на CD56 позитивних NK-клітинах вивіді проти хвороботворних патогенів без розвитку міряли за допомогою проточної цитометрії. несприятливих реакцій, часто спостережуваних Фіг.8 є гістограмою, що показує, що опосередвідносно інших імуностимулюючих агентів. Таким кована NK цитотоксичність збільшується за допочином, нуклеїнові кислоти, що містять CpG, на 23 77152 24 основі природного імунного захисного механізму, послідовність, В даних Т-збагачених нуклеїнових можуть бути використані як унікальний і природний кислотах Т-нуклеотидні залишки можуть бути відошлях імунної терапії. Модулюючі ефекти нуклеїнокремлені один від одного іншими типами нуклеових кислот, що містять CpG, на імунну систему тидних залишків, тобто G, С і А. В деяких здійсбули розкриті заявниками даної патентної заявки і неннях Т-збагачені нуклеїнові кислоти мають детально описані в разом поданих патентних заянуклеотидний склад з більше 35%, 40%, 50%, 60%, вках таких як [патентні заявки США, серійні Nos: 70%, 80%, 90% і 99% Т-нуклеотидних залишків і 08/386063, зареєстрована 02/07/95 (і відноситься кожний цілий % між ними. Переважно Т-збагаченІ до цього патент РСТ US95/01570); 08/738652, зануклеїнові кислоти мають щонайменше одну поліреєстрована 10/30/96; 08/960774, зареєстрована Т-послідовність і нуклеотидний склад з більше, ніж 10/30/97 (і відноситься до цього патент 25% Т-нуклеотидних залишків. PCT/US97/19791, WO 98/18810); 09/191170, зареєВідповідно до винаходу було відкрито, що стрована 11/13/98; 09/030701, зареєстрована вміст Τ в ОДН має істотну дію на імуностимулюю02/25/98 (і відноситься до цього патент чий ефект ОДН і що Т-збагачені ОДН можуть актиPCT/US98/03678; 09/082649, зареєстрована вувати багато які типи клітин імунної системи лю05/20/98 (і відноситься до цього патент дини у відсутності яких-небудь CpG-мотивів. PCTVUS98/10408) ; 09/325193, зареєстрована Олігонуклеотид, що має 3'полі-Т-область і 2 5'CGs, 06/03/99 (і відноситься до цього патент наприклад, ОДН 2181 (SEQ ID NO:431), володіє PCT/US98/04703); 09/286098, зареєстрована високою імуностимулюючою активністю. Олігонук04/02/99 (і відноситься до цього патент леотид схожої довжини, ОДН 2116 (SEQ ID PCT/US99/07335); 09/306281, зареєстрована NO:357), який містить два CG-динуклеотиди на 5і05/06/99 (і відноситься до цього патент кінці і полі-С область на 3'-кінці, також був імуносPCT/US99/09863)]. Повний зміст кожного з даних тимулюючим, але у меншій мірі, ніж Т-збагачений патентів і патентних заявок включено тут як посиолігонуклеотид, при застосуванні стандартних екслання. периментальних умов. Таким чином, хоча С і Τ Дані даного винаходу застосовні до всіх опимають майже ідентичні структури, їх вплив на імусаних вище застосувань нуклеїнових кислот, що нні властивості ОДН різні. Вони обидва здатні інмістять CpG, також як до будь-якого іншого відодукувати імунну відповідь, але різною мірою. Тамого застосування нуклеїнових кислот, що містять ким чином, як Т-збагачені, так і С-збагачені CpG. В одному варіанти винахід пов'язаний з відколігонуклеотиди корисні відповідно до винаходу, риттям того, що Ру-збагачені і, переважно, Тале Т-збагачені олігонуклеотиди є переважними. збагачені і TG-нуклеїнові кислоти мають схожі з Більш того, якщо вміст Τ в ОДН знизили шляхом CpG-олігонуклеотидами імуностимулюючі властивключення інших основ, таких як G, А або С, то вості, незалежно від присутності CpG-мотиву. Таімуностимулюючі ефекти знижені (ОДН #2188 ким чином, винахід корисний для будь-якого спо(SEQ ID NO:905), 2190 (SEQ ID NO:907), 2191 собу стимуляції імунної системи з застосуванням (SEQ ID NO:908) і 2193 (SEQ ID NO:910). Ру-збагачених і TG-нуклеїнових кислот. НесподіС-збагачена нуклеїнова кислота є молекулою вано було також відкрито, відповідно до винаходу, нуклеїнової кислоти, яка має щонайменше одну що химерні олігонуклеотиди, в яких відсутній CpGабо переважно щонайменше дві полі-С області, мотив, є імуностимулюючими і мають багато з тих або яка складається щонайменше з 50% С нуклеже профілактичних і терапевтичних активностей, отидів. Полі-С область має щонайменше чотири С що і CpG-олігонуклеотиди. залишки в ряд. Таким чином, полі-С область охопРу-збагачена нуклеїнова кислота представляє люється формулою 5'СССС3'. В деяких здійсненсобою Т-збагачену або С-збагачену імуностимунях переважно, щоб полі-С область мала формулу люючу нуклеїнову кислоту. В деяких здійсненнях 5'СССССС3'. Інші С-збагачені нуклеїнові кислоти Т-збагачені нуклеїнові кислоти переважні. Твідповідно до винаходу мають нуклеотидний склад збагачена нуклеїнова кислота представляє собою з більше 50% С-нуклеотидних залишків, але не нуклеїнову кислоту, яка включає щонайменше одобов'язково включають полі-С-послідовність. В ну полі-Т-послідовність та/або яка має композицію даних С-збагачених нуклеїнових кислотах Снуклеотидів з більше, ніж 25% Т-нуклеотидних нуклеотидні залишки можуть бути відокремлені залишків. Нуклеїнова кислота, що має полі-Тодин від одного іншими типами нуклеотидних запослідовність, включає щонайменше чотири Τ в лишків, тобто G, Τ і А. В деяких здійсненнях Сряд, такий як 5'ТТТТ3'. Переважно Т-збагачена збагачені нуклеїнові кислоти мають нуклеотидний нуклеїнова кислота включає більше однієї полі-Тсклад з більше 60%. 70%, 80%, 90% і 99% Спослідовності. В переважних здійсненнях Тнуклеотидних залишків і кожний цілий % між ними. збагачена нуклеїнова кислота може мати 2, 3, 4 і Переважно С-збагачені нуклеїнові кислоти мають т.д. полі-Т-послідовностей, таких як олігонуклеощонайменше одну полі-С-послідовність і нуклеотид #2006 (SEQ ID NO:246). Один з Т-збагачених тидний склад з більше, ніж 50% С-нуклеотидних олігонуклеотидів з найбільш сильними імуностизалишків і в деяких здійсненнях є також Тмулюючими властивостям представляє собою збагаченими. нуклеїнову кислоту, що складається повністю з ТЯк показано в прикладах, декілька ОДН, що нуклеотидних залишків, наприклад, олігонуклеотид раніше вважалися не володіючими імуностимулю#2183 (SEQ ID NO:433). Інші Т-збагачені нуклеїнові ючими властивостями, включаючи два ОДН SEQ кислоти відповідно до винаходу мають нуклеотидID NO:225 і SEQ ID NO:282, раніше описані як не ний склад з більше, ніж 25% Т-нуклеотидних заволодіючі імуностимулюючими властивостями і лишків, але необов'язково включають полі-Тзастосовувалися головним чином як контрольні 25 77152 26 ОДН (Takahashi, T et al 2000. J. Immunol. цію, яка цікавить. 164:4458), як знайдено, є імуностимулюючими. В інших здійсненнях TG-нуклеїнова кислота Експерименти авторів винаходу показали, що дані представлена щонайменше формулою: ОДН можуть стимулювати В-клітини, хоча при 5'N1X1X2TGX3X4N23' більш високих концентраціях у порівнянні з CpG де Х1, Х2, Х3 і Х4 є нуклеотидами. В деяких ОДН (Фіг.6). Довгий полі-Т ОДН (30 членів) індукуздійсненнях Х1X2 є нуклеотиди, які вибрані з групи, вав, щонайменше в деяких експериментах, актищо складається з; GpT, GpG, GpA, АрА, АрТ, ApG, вацію В-клітин, порівнянну по силі з одними з найCpT, CpA, ТрА і ТрТ; а Х3Х4 являють собою нуклебільш сильних CpG-олігонуклеотидних активаторів отиди, які вибрані з групи, що складається з ТрТ, В-клітин. За допомогою даних експериментів виCpT, ApT, ApG, TpC, ApC, CpG, ТрА, Ара і СрА; N є явлені також несподівані дані про те, що навіть будь-який нуклеотид, N1 і N2 є послідовностями полі-С ОДН можуть вести до стимуляції В-клітин. нуклеїнових кислот, складеними з будь-якого чисІммуностімуляция за допомогою даних ОДН, ла нуклеотидів, за умови, що загальна сума N1 і N2 проте, не обмежується В-клітинами людини. Різні знаходиться в діапазоні від 9 до 19. В деяких здійекспериментальні тести ясно продемонстрували, сненнях Х1Х2 являють собою GpA або GpT, a X3X4 що додатково моноцити, NK-клітини і навіть NKT є ТрТ. клітини можуть бути проактивовані за допомогою В інших здійсненнях Х1 або Х2, або обидва є таких, що не містять CpG ОДН (Фіг.7-10). На відміпуринами, а Х3 або Х4, або обидва є піримідинами, ну від полі-Т і полі-С-послідовностей, імуностимуабо Х1Х2є GpA, а Х3 або Х4, або обидва, є піриміляція за допомогою полі-А-послідовностей (щодинами. В одному переважному здійсненні Х3Х4 є найменше, для моноцитів і NK-клітин) не була нуклеотиди, вибрані з групи, що складається з: досягнута. Цікаво, що було знайдено, що введення ТрТ, ТрС і ТрА. CpG-мотиву в SEQ ID NO: 225 збільшувало імуноІмуностимулююча нуклеїнова кислота може стимулюючу активність, тоді як елонгація із застобути будь-якого розміру (тобто довжини), за умосуванням полі-Т подовження не збільшувала імуви, що має щонайменше 4 нуклеотиду. У важливих ностимуляцію. Це припускає, що CpG- і Тздійсненнях імуностимулюючі нуклеїнові кислоти збагачені ОДН можуть діяти за допомогою різних мають довжину в діапазоні між 6 і 100. Ще в одних механізмів або шляхів. Можливо також, що ввездійсненнях довжина ув'язнена в діапазоні між 8 і дення полі-Т-мотиву в різні позиції SEQ ID NO: 225 35 нуклеотидів. Переважно, щоб TGможе вести до змін імуностимулюючих властиолігонуклеотиди коливалися за розміром від 15 до востей. 25 нуклеотидів. Вживаний тут термін "TG-нуклеїнова кислота" Розмір (тобто число нуклеотидних залишків за або "імуностимулююча TG-нуклеїнова кислота" довжиною нуклеїнової кислоти) імуностимулюючої представляє собою нуклеїнову кислоту, що міснуклеїнової кислоти може також вносити внесок в тить щонайменше один TpG-динуклеотид (тимістимулюючу активність нуклеїнової кислоти. Недин-гуанін динуклеотидну послідовність, тобто сподівано було відкрито, що навіть для імуности"TG-ДНК" або ДНК, що містить 5-тимідин, за яким мулюючих нуклеїнових кислот з високою імуносслідує 3'-гуанозин, зв'язані фосфатним зв'язком), тимулюючою активністю довжина нуклеїнової яка активує компонент імунної системи. кислоти впливає на ступінь імунної стимуляції, яка В одному здійсненні у винаході пропонується може бути досягнута. Було показано, що збільTG-нуклеїнова кислота, представлена щонайменшення довжини Т-збагаченої нуклеїнової кислоти ше формулою: до 24 нуклеотидів викликає збільшення імунної 5'N1X1TGX2N23' стимуляції. Експерименти, представлені в прикладе Х1 і Х2 є нуклеотидами і N є будь-який нукдах демонструють, що коли довжина Т-збагаченої леотид, Ν1 і N2 є послідовностями нуклеїнових нуклеїнової кислоти зростає з 18 до 27 нуклеотикислот, складеними з будь-якого числа N, проподів, здатність нуклеїнової кислоти стимулювати нованими так, що загальна сума Ν1 і N2 знаходитьімунну відповідь значно збільшується (порівняйте ся в діапазоні від 11 до 21. Як прикладу, якщо N1 ОДН #2194, 2183, 2195 і 2196, які знижуються в дорівнює 5, то Ν1 може складати 6 (приводячи до розмірі від 27 до 18 нуклеотидів). Збільшення довзагальної довжини олігонуклеотиду, що становить жини нуклеїнової кислоти до 30 нуклеотидів має 15 нуклеотидів). TG може бути локалізований в істотний внесок в біологічні властивості нуклеїнобудь-якому місці за довжиною нуклеотиду, вклювої кислоти, але збільшення довжини вище 30 нучаючи 5'-кінець, центр і 3'кінець. Таким чином, N1 клеотидів, мабуть, додатково не впливає на імуноможе складати від нуля до 21 включно, за умови, стимулюючий ефект (наприклад, порівняйте ОДН з що N2 вибирають, відповідно, щоб одержати суму 2179 до 2006). N2 і N1, яка дорівнює від 11 до 21 включно. Схоже Було показано, що TG-нуклеїнові кислоти з діN2 може складати від нуля до 21 включно, за умоапазоном довжини від 15 до 25 нуклеотидів мови, що загальна сума Ν1 і Ν2 дорівнює 11 до 21 жуть проявляти посилені імуностимулюючі власвключно. В деяких здійсненнях X1 є аденін, гуанін тивості. Таким чином, у винаході пропонується або тимідин, і Х2 представляє собою цитозин, адеолігонуклеотид, який має 15-27 нуклеотидів в довнін або тимідин. В одному переважному здійсненні жину (тобто олігонуклеотид завдовжки в 15, 16, 17, Х2 є тимідин. В інших здійсненнях X1 представляє 18, 19, 20, 21, 22, 23, 24, 25, 26 або 27 нуклеотисобою цитозин і Х2 є гуанін. В інших здійсненнях, дів), який може бути Т-збагаченою нуклеїновою як тут обговорюється, нуклеїнова кислота може кислотою або може бути як Т-збагаченою, так і TGохоплювати інші мотиви, пропоновані так, щоб нуклеїновою кислотою. В одному здійсненні оліговони були достатньо довгі, щоб виконувати функнуклеотид не представляє собою ні Т-збагачену 27 77152 28 нуклеїнову кислоту, ні TG-нуклеїнову кислоту. В мірі фосфортіоатний, то включення даних посліінших здійсненнях олігонуклеотид не має CGдовностей може мати більший вплив на біологічну мотиву. У винаході схоже пропонуються олігонукактивність або кінетику біологічної активності, вилеотиди, які мають в довжину 15-27 нуклеотидів, кликаючи зниження потенціалу Т-збагачених та олігонуклеотиди, які мають в довжину 18-25 нукімуностимулюючих TG-нуклеїнових кислот. леотидів, олігонуклеотиди, які мають в довжину Хоча показано, що С-збагачені нуклеїнові кис20-23 нуклеотиди, і олігонуклеотиди, які мають в лоти володіють імуностимулюючими властивостядовжину 23-25 нуклеотидів. Будь-яке із згаданих ми, введення полі-С-послідовностей в Т-збагачену вище здійснень, що відносяться до олігонуклеотинуклеїнову кислоту так, щоб понизити відносну дів завдовжки в 15-27 нуклеотидів, також віднопропорцію Т-нуклеотидів у нуклеїновій кислоті моситься до олігонуклеотидів з даними різними довже вносити негативний внесок в нуклеїнову кисложинами. Винахід додатково охоплює застосування ту. Хоча автори винаходу не зв'язані передбачубудь-якого з даних вказаних вище нуклеотидів в ваним механізмом, передбачається, що імунна цитованих тут способах. система розробила механізми для розрізнення Хоча максимальний рівень імунної стимуляції нуклеїнових кислот, що мають різні нуклеотидні досягається з деякими Т-збагаченими нуклеїновивластивості, можливо в результаті різної посадки ми кислотами, коли нуклеїнова кислота має в довзв'язуючих білків, які впізнають різні послідовності, жину 24-30 нуклеотидних залишків, також як з деабо специфічно зв'язуючих білків, які впізнають всі якими TG-нуклеїновими кислотами, довжина яких імуностимулюючі послідовності, але зв'язуються з знаходиться в діапазоні від 15 до 25 нуклеотидів ними з різною спорідненістю. В цілому нуклеїнові більш короткі або більш довгі імуностимулюючі кислоти, що включають неметильовані CpGнуклеїнові кислоти також можуть бути застосовані мотиви, є в найбільшому ступені імуностимулюювідповідно до способів винаходу. Для прискорення чими, за ними слідують Т-збагачені нуклеїнові кисзахоплення клітинами імуностимулюючих нуклеїлоти, TG-нуклеїнові кислоти і С-збагачені нуклеїнових кислот переважна мінімальна довжина з 6 нові кислоти. Дане узагальнення, проте, має нуклеїнових залишків. Нуклеїнові кислоти будьбагато виключень. Наприклад, істотно Т-збагачена якого розміру більше б нуклеотидів (навіть завдонуклеїнова кислота, подібна SEQ ID NO: 886, є вжки більше багато з т.п.н.) здатні індукувати імунбільшою мірою імуностимулюючою в деяких тесну відповідь відповідно до винаходу, якщо присуттах, ніж деякі CpG нуклеїнові кислоти, що містять ня достатня кількість імуностимулюючих мотивів, (наприклад, фосфортіоатна CpG нуклеїнова кисоскільки більш крупні нуклеїнові кислоти деградулота, що містить єдині CpG-мотив). ють усередині клітини. Переважно імуностимулюБуло також відкрито, що додавання полі-Α ючі нуклеїнові кислоти складають в довжину діапахвоста до імуностимулюючої нуклеїнової кислоти зон між 8 і 100 нуклеотидами, а в деяких може збільшувати активність нуклеїнової кислоти. здійсненнях імуностимулюючі нуклеїнові кислоти, Було відкрито, що, коли сильну імуностимулюючу що містять Т-збагачені ділянки, складають в довCpG нуклеїнову кислоту (SEQ ID NO: 246) модифіжину між 24 і 40 нуклеотидами та імуностимулюючі кували шляхом додавання полі-А-хвоста (ААААнуклеїнові кислоти, що містять TG, складають в АА) або полі-Т-хвоста (ТТТТТТ), одержані олігонудовжину між 15 і 25 нуклеотидами. клеотиди збільшували свою імуностимулюючу В одному здійсненні Т-збагачена нуклеїнова активність. Здатність полі-Α і полі-Т-хвоста збількислота представлена щонайменше формулою: шувати імуностимулюючі властивості олігонуклео5'Х1Х2ТТТТХ3Х43', тиду дуже схожі. SEQ ID NO:246 представляє соде Х1, Х2, Х3 і Х4 є нуклеотидами. В одному бою Т-збагачений олігонуклеотид. Ймовірно, що здійсненні Х1Х2 є ТТ та/або Х3Х4 є ТТ. В іншому якщо полі-Α- і полі-Т-хвости додають до нуклеїноздійсненні Х1Х2 є одним будь-який з наступних вої кислоти, яка не є Т- збагаченою, це повинне нуклеотидів ТА, TG, TC, AT, АА, AG, АС, СТ, СС, внести більший внесок в імуностимулюючу здатСА, GT, GG, GA і GC; а Х3Х4 є один будь-який з ність нуклеїнової кислоти. Оскільки полі-Т-хвіст наступних нуклеотидів ТА, TG, ТС, AT, АА, AG, АС, додавали до нуклеїнової кислоти, яка вже була СТ, СС, СА, GT, GG, GA і GC. високо Т-збагаченою, імуностимулюючі властивосВ деяких здійсненнях переважно, щоб імуності додавання полі-Т в деякій мірі, але не повністю тимулюючі нуклеїнові кислоти не містили полі-С розмиваються. Дані результати мають важливе (СССС) або полі-Α (АААА). В інших здійсненнях значення для застосування полі-А-областей. Тапереважно, щоб імуностимулююча нуклеїнова киким чином, в деяких здійсненнях імуностимулюючі слота включала полі-С, полі-А, полі-G (GGGG) або нуклеїнові кислоти включають полі-Α область, а в множинні GG. Особливо полі-G або множинні GG інших здійсненнях вони не включають її. мотиви надають істотні ефекти на деякі імуностиДеякі з імуностимулюючих нуклеїнових кислот мулюючі нуклеїнові кислоти. Ефект таких, що не згідно з винаходом включають один або більше містять Т-послідовностей частково залежить від CG-мотивів. Присутність CG-мотивів в імуностистатусу остову нуклеїнової кислоти. Наприклад, мулюючих нуклеїнових кислотах також робить якщо нуклеїнова кислота має фосфодіефірний вплив на біологічну активність нуклеїнових кислот. остов або химерний остов, включення даних посЯкщо сумарна довжина імуностимулюючої нуклеїлідовностей в нуклеїнову кислоту повинне надаванової кислоти складає 20 нуклеотидних залишків ти тільки мінімальний, якщо взагалі який-небудь, або менше, то CpG-мотиви важливі для визначенефект на біологічну активність нуклеїнової кислоня імунного ефекту нуклеїнової кислоти, і метилюти. Якщо остов повністю фосфортіоатний (або з вання даних мотивів знижує силу імуностимулююіншою фосфатною модифікацією) або в значній чих ефектів нуклеїнової кислоти. Якщо довжину 29 77152 30 імуностимулюючої нуклеїнової кислоти збільшують 820-832, 835-846, 849-850, 855-859, 862, 865, 872, до 24, то імуностимулюючі ефекти нуклеїнової 874-877, 879-881, 883-885, 888-904 і 909-913. кислоти стають менш залежними від CpG-мотивів і В деяких здійсненнях винаходу імуностимуне знищуються більш шляхом метилювання CpGлюючі нуклеїнові кислоти включають CpGмотивІв або шляхом їх інверсії в GCдинуклеотиди, і в інших здійсненнях імуностимудинуклеотиди, що дає представлені тут інші імунолюючі нуклеїнові кислоти вільні від CpGстимулюючі властивості. динуклеотидів. CpG-динуклеотиди можуть бути Наприклад, ОДН 2006 (SEQ ID NO:246) предметильовані або неметильовані. Нуклеїнова кисставляє собою сильну імуностимулюючу Тлота, що містить щонайменше один неметильовазбагачену нуклеїнову кислоту з 24 нуклеотидних ний CpG-динуклеотид, є молекулою нуклеїнової залишків в довжину з чотирма CpG- динуклеотикислоти, яка містить неметильовану цитозиндами. Проте ОДН 2117 (SEQ ID NO:358), в якому гуанін динуклеотидну послідовність (тобто "CpGCpG-мотиви метильовані, також є сильним імуносДНК" або ДНК, що містить неметильований 5'тимулюючим олігонуклеотидом. ОДН 2137 (SEQ ID цитозин, за яким слідує 3'-гуанозін, зв'язані фосNO:886), в якому CpG-мотиви ОДН 2006 інвертофатним зв'язком), і активує імунну систему. Нуклевані до GpC і який в результаті володіє шістьма їнова кислота, що містить щонайменше один меTG-динуклеотидами, також є імуностимулюючим тильований CpG-динуклеотид, є нуклеїновою олігонуклеотидом. Імуностимулюючі ефекти нуклекислотою, яка містить метильовану цитозин-гуанін їнових кислот, таких як ОДН 2117 і 2137, регулюдинуклеотидну послідовність (тобто метильований ються з допомогою за змістом в них Τ і TG. Кожна 5'-цитозин, за яким слідує 3'-гуанозін, зв'язані фоз даних трьох нуклеїнових кислот є Т- збагаченою і сфатним зв'язком). ОДН 2137 додатково TG-збагаченою. Якщо вміст в Приклади Т-збагачених нуклеїнових кислот, які них Τ понизити шляхом введення інших основ, вільні від CpG нуклеїнових кислот, включають, не таких як А (ОДН 2117 (SEQ ID NO:358)), або якщо обмежуючись представленими в таблиці А послівміст в них TG знизити за рахунок заміни TG на довності, такі як SEQ ID NO: 59-63, 73-75, 142, 215, AG, то імуностимулюючі ефекти в деякій мірі зни226, 241, 267-269, 282, 301, 304, 330, 342, 358, жуються. В іншому прикладі нуклеїнова кислота з 370-372, 393, 433, 471, 479, 486, 491, 497, 503, 24 нуклеотидами в довжину, в якій всі з положень 556-558, 567, 694, 793-794, 797, 833, 852, 861, 867, рандомізовані, має тільки помірний імуностиму868, 882, 886, 905, 907, 908 і 910-913. Приклади Тлюючий ефект (ОДН 2182 (SEQ ID NO:432)). Подізбагачених нуклеїнових кислот, які включають CpG бно цьому, нуклеїнова кислота з 24 нуклеотидами нуклеїнові кислоти, включають, але не обмежув довжину з іншими складами нуклеотидів має ються представленими в таблиці А такими як SEQ імуностимулюючі ефекти, що розрізняються, заID NO:64, 98, 112, 146, 185, 204, 208, 214, 224, 233, лежно від вмісту в них Τ (ОДН 2188 (SEQ ID 244, 246, 247, 258, 262, 263, 265, 270-273, 300 305, NO:905), 2189 (SEQ ID NO:906), 2190 (SEQ ID 316, 317, 343, 344, 350, 352, 354, 374, 376, 392, NO:907), 2191 (SEQ ID NO:908), 2193 (SEQ ID 407, 411-413, 429-432, 434, 435, 443, 474, 475, 498NO:910), 2183 (SEQ ID NO:433) і 2178 (SEQ ID 501, 518, 687, 692, 693, 804, 862, 883, 884, 888, 890 NO:428)). ОДН 2190, який містить TGT мотиви, є і 891. більш імуностимулюючим, ніж ОДН 2202, який Імуностимулюючі нуклеїнові кислоти можуть містить TGG мотиви. Таким чином, в деяких здійсбути односпіральними і двоспіральними. Звичайно неннях TGT мотиви є переважними. Ще в одних двоспіральні молекули більш стабільні in vivo, тоді здійсненнях важливе число TG-мотивів, оскільки як односпіральні молекули мають підвищену імунзбільшення числа TG-мотивів веде до збільшення ну активність. Таким чином, в деяких варіантах імунної стимуляції. Деякі переважні TG-нуклеїнові винаходу переважно, щоб нуклеїнова кислота букислоти містять щонайменше три TG-мотиви. ла односпіральною, а в інших варіантах переважПриклади CpG нуклеїнових кислот включають, но, щоб нуклеїнова кислота була двоспіральною. але не обмежуючись цим, перераховані в таблиці Вживаний тут термін Т-збагачена нуклеїнова А послідовності, такі як SEQ ID NO:1, 3, 4, 14-16, кислота і TG-нуклеїнова кислота відноситься до 18-24, 28, 29, 33-46, 49, 50, 52-56, 58, 64-67, 69, 71, імуностимулюючої Т-збагаченої нуклеїнової кисло72, 76-87, 90, 91, 93, 94, 96, 98, 102-124, 126-128, ти і до імуностимулюючої TG-нуклеїнової кислоти, 131-133, 136-141, 146-150, 152-153, 155-171, 173відповідно, якщо не вказано інакше. Т-збагаченІ 178, 180-186, 188-198, 201, 203-214, 216-220, 223, послідовності нуклеїнової кислоти винаходу є ти224, 227-240, 242-256, 258, 260-265, 270-273, 275, ми, які детально описані вище, також як нуклеїнові 277-281, 286-287, 292, 295-296, 300, 302, 305-307, кислоти, представлені в таблиці А, які мають що309-312, 314-317, 320-327, 329, 335, 337-341, 343найменше один полі-Т-мотив та/або які мають 352, 354, 357, 361-365, 367-369, 373-376, 378-385, склад з більше, ніж 25% або переважно 35% Т388-392, 394, 395, 399, 401-404, 406-426, 429-433, нуклеотидних залишків. С-збагачені нуклеїнові 434-437, 439, 441-443, 445, 447, 448, 450, 453-456, кислоти винаходу є тими, які мають щонайменше 460-464, 466-469, 472-475, 477, 478, 480, 483-485, одну і переважно дві полі-С області. TG-нуклеїнові 488, 489, 492, 493, 495-502, 504-505, 507-509, 511, кислоти згідно з винаходом є тими, які детально 513-529, 532-541, 543-555, 564-566, 568-576, 578, описані вище, також як специфічні нуклеїнові кис580, 599, 601-605, 607-611, 613-615, 617, 619-622, лоти представлені в таблиці А, які мають щонай625-646, 648-650, 653-664, 666-697, 699-706, 708, менше один TG-мотив. 709, 711-716, 718-732, 736, 737, 739-744, 746, 747, Нуклеїнові кислоти згідно з винаходом можуть, 749-761, 763, 766-767, 769, 772-779, 781-783, 785але необов'язково, також включати полі-G мотив. 786, 7900792, 798-799, 804-808, 810, 815, 817, 818, Полі-G вміщуючі нуклеїнові кислоти також є імуно 31 77152 32 стимулюючими. В різних посиланнях, [включаючи терогенними за складом остову, включаючи у зв'яPisetsky and Reich, 1993 Моl. Biol. Reports, 18:217зку з цим будь-яку можливу комбінацію полімерних 221; Krieger and Herz, 1994, Ann. Rev. Biochem., одиниць, сполучених разом у вигляді пептид63:601-637; Macaya et al. 1993, PNAS, 90:3745нуклеїнових кислот (які мають амінокислотний 3749; Wyatt et al., 1994, PNAS, 91:1356-1360; остов з нуклеотидними основами). В деяких здійсRando and Hogan, 1998, In Applied Antisense неннях нуклеїнові кислоти є гомогенними за склаOligonucleotide Technology, ed. Kneg and Stein, дом остову. Нуклеїнові кислоти також включають а p.335-352; and Kimura et al., 1994, J Biochem. 116, себе заміщені пурини і піримідини, такі як С-5 про991-994], також описані імуностимулюючі властипін-модифіковані основи (Wagner et al., Nature вості полі-G нуклеїнових кислот. Biotechnology 14:840-844, 1996). Пуріни і піримідиПолі-G нуклеїнові кислоти переважно предни включають, але не обмежуються цим, аденін, ставляють собою нуклеїнові кислоти, що мають цитозин, гуанін, тимідин, 5-метилцитозин, 2наступні формули: 5'Х1Х2СССХ3Х43' амінопурин, 2-аміно-6-хлорпурин, 2,6де Х1, Х2, Х3 і Х4 є нуклеотиди. В переважних діамінопурин, гіпоксантин та інші існуючі і не існуздійсненнях щонайменше один з Х3 і Х4 є G. В інючі в природі нуклеотидні основи, заміщені і незаших здійсненнях обидва Х3 і Х4 є G. Ще в одному міщені частини ароматизму. Інші такі модифікації здійсненні, переважна формула являє собою добре відомі фахівцям в даній області. 5'GGGNGGG3' або 5'GGGNGGGNGGG3', де N Для застосування в даному винаході нуклеїноскладає між 0 і 20 нуклеотидами. В інших здійсві кислоти згідно з винаходом можуть бути синтененнях полі-С-нуклеїнові кислоти вільні від немезовані de novo із застосуванням будь-якого числа тильованих CG-динуклеотидів, такі, наприклад, як процедур, добре відомих фахівцям в даній обласнуклеїнові кислоти, перераховані нижче, як SEQ ID ті. Наприклад, b- ціаноетилфосфорамідитний споNO:5, 6, 73, 215, 267-269, 276, 282, 288, 297-299, сіб [Beaucage, S.L., and Caruthers, M.H., Tet. Let. 355, 359, 386, 387, 444, 476, 531, 557-559, 733, 22:1859, 1981]; нуклеозид Н-фосфонатний спосіб 768, 795, 796, 914-925, 928-931, 933-936 і 938. В [Garegg et al., Tet Let. 27:4051-4054 1986; Froehler інших здійсненнях полі-G нуклеїнові кислоти вклюet al., Nucl. Acid. Res. 14:5399-5407, 1986; Garegg чають щонайменше один неметильований CGet al., Tet. Let. 27:4055-4058, 1986, Gaffhey et al. динуклеотид, такі, наприклад, як нуклеїнові кислоTet. Let. 29:2619-2622, 1988]. Дані хімічні способи ти, перераховані вище, як SEQ ID NO:67, 80-82, можуть бути виконані за допомогою множиш авто141, 147, 148, 173, 178, 183, 185, 214, 224, 264, матичних синтезаторів нуклеїнових кислот, пропо265, 315, 329, 434, 435, 475, 519, 521-524, 526, нованих на ринку. Дані нуклеїнові кислоти позна527, 535, 554, 565, 609, 628, 660, 661, 662, 725, чаються як синтетичні нуклеїнові кислоти. В 767, 825, 856, 857, 876, 892, 909, 926, 927, 932 і протилежному варіанти Т-збагачені та/або TG937. динуклеотиди можуть бути одержані у великому Терміни "нуклеїнова кислота" і "олігонуклеомасштабі в плазмідах [дивися Sambrook, Т., et al., тид" застосовуються взаємозамінно для позначен"Molecular Cloning: Laboratory Manual", Cold Spring ня множинних нуклеотидів (тобто молекул, що Harbor laboratory Press New York, 1989] і розділені включають цукор (наприклад, рибозу або дезоксина менші фрагменти або введені цілком. Нуклеїрибозу), пов'язаний з фосфатною групою і замінюнові кислоти можуть бути одержані з існуючих пованою органічною основою, яка представляє сослідовностей нуклеїнових кислот (наприклад, гебою або заміняє піримідин (наприклад, цитозин номної або кДНК) із застосуванням відомих (С), тимідин (Т) або урацил (U) або заміняє пурин способів, таких як застосування ферментів рест(наприклад, аденін (А) або гуанін (G)). Вживані тут рикції екзонуклеаз або ендонуклеаз. Нуклеїнові терміни відносяться до олігорибонуклеотидів, такислоти, одержані у такий спосіб, позначаються як кож як до олігодезоксинуклеотидів. Терміни повиділені нуклеїнові кислоти. Виділена нуклеїнова винні також включати полінуклєозиди (тобто полікислота звичайно означає нуклеїнову кислоту, яка нуклеотид мінус фосфат) і будь-яку іншу органічну відокремлена від компонентів, з якими вона звиоснову, що містить полімер. Молекули нуклеїнових чайно зв'язана в природі. Наприклад, виділеною кислот можуть бути одержані з існуючих джерел нуклеїновою кислотою може бути кислота, яка нуклеїнових кислот (наприклад, геномної або виділена з клітини, з ядра, з мітохондрію або хрокДНК), але переважні синтетичні (наприклад, одематину. Терміни Ру-збагачені нуклеїнові кислоти і ржувані шляхом синтезу нуклеїнових кислот). TG-нуклеїнові кислоти охоплюють як синтетичні, Терміни нуклеїнова кислота і олігонуклеотид так і виділені Ру-збагачені нуклеїнові кислоти і TGохоплюють також нуклеїнові кислоти або олігонукнуклеїнові кислоти. леотиди із заміщеннями або модифікаціями, такиДля застосування Іn vivo Ру-збагачені і TGми як в основах та/або цукру. Наприклад, вони нуклеїнові кислоти можуть необов'язково бути відвключають нуклеїнові кислоти, що мають остов носно стійкими до деградації (наприклад, стабіліцукрів, які ковалентно приєднані до органічних зованими). "Стабілізована молекула нуклеїнової груп з низькою молекулярною масою, які відрізнякислоти" повинна означати молекулу нуклеїнової ються від гідроксильної групи в 3' положенні і відкислоти, яка відносно стійка до деградації in vivo різняються від фосфатної групи в 5' положенні. (наприклад, під дією екзо- і ендонуклеаз). СтабіліМодифіковані таким чином нуклеїнові кислоти мозація може бути функцією довжини або вторинної жуть включати 2'-О-алкіловану рибозну групу. Крім структури. Нуклеїнові кислоти, які складають в того, модифіковані нуклеїнові кислоти можуть довжину від десятків до тисяч т.п.о. є відносно включати цукор, такі як арабіноза, замість рибози. стійкими до деградації in vivo. У разі більш коротТаким чином, нуклеїнові кислоти можуть бути геких нуклеїнових кислот вторинну структуру можна 33 77152 34 стабілізувати і збільшити їх ефективність. Наприта/або Υ2 мають від 3 до 8 нуклеотидів. клад, якщо 3'-кінець нуклеїнової кислоти комплеΝ1 і Ν2 є молекулами нуклеїнових кислот, що ментарний її вищележачій області, так що він момають від 0 до 5 нуклеотидів, і мають таку довжиже заломитися і утворити тип стовбурної петлевої ну, щоб Ν1ΖΝ2 мав щонайменше 6 нуклеотидів в структури, то нуклеїнова кислота стає стабілізовасумі. Нуклеотиди Ν1ΖΝ2 мають фосфодіефірний ною, і отже, проявляє велику активність. остов і не включають нуклеїнові кислоти, що маВ протилежному варіанти стабілізація нуклеїють модифікований остов. нової кислоти може бути досягнута шляхом моди2 є мотивом імуностимулюючої нуклеїнової кифікацій фосфатного остову. Переважні стабілізослоти, але не включає CG. Наприклад, Ζ може вані нуклеїнові кислоти теперішнього часу згідно з бути нуклеїновою кислотою з Т-збагаченою послівинаходом мають модифікований остов. Показано, довністю, наприклад, включаючій ТТТТ мотив або що модифікація остову нуклеїнової кислоти забезпослідовність, в якій щонайменше 50% основ поспечує збільшену активність Ру-збагачених і TGлідовності є Т, або Ζ може бути TG-послідовністю. нуклеїнових кислот при введенні in vivo. Дані стаЦентральні нуклеотиди (Ν1ΖΝ2) формули білізовані структури є переважними, оскільки РуY1N2ZN2Y2 мають фосфодіефірні міжнуклеотидні збагачені і TG молекули винаходу мають щонайзв'язки, Υ1 і Υ2 мають щонайменше один, але моменше частково модифікований остов. Ружуть мати більше одного або навіть можуть мати збагачені і TG конструкти, що мають фосфортіоатвсі модифіковані міжнуклеотидні зв'язки. В перені зв'язки, забезпечують максимальну активність і важних здійсненнях Υ1 та/або Υ2 мають щонаймезахищають нуклеїнові кислоти від деградації під нше два або від двох до п'яти модифікованих міждією екзо- і ендонуклеаз. Інші модифіковані нукленуклеотидних зв'язків, або Y1 має два їнові кислоти включають фосфодіефірмодифіковані міжнуклеотидн зв'язки і Y2 має п'ять модифіковані нуклеїнові кислоти, поєднання фосмодифікованих міжнуклеотидних зв'язків або Υ1 фодіефірної і фосфортіоатної нуклеїнової кислоти, має п'ять модифікованих міжнуклеотидних зв'язків метилфосфонат, метилфосфортіоат, фосфордитіі Υ2 має два модифіковані міжнуклеотидні зв'язки. оат, п-етокси і їх поєднання. Кожне з даних поєдМодифіковані міжнуклеотидні зв'язки в деяких нань і їх конкретні ефекти на імунні клітини обгоздійсненнях представляють собою фосфортіоатні ворюються більш детально відносно CpG модифіковані зв'язки, фосфордитІоатні модифіконуклеїнових кислот в опублікованих [патентних вані зв'язки або п-етокси модифіковані зв'язки. заявках РСТ PCT/US95/01570 (WO 96/02555) і Модифіковані остови, такі як фосфортіоати, PCT/US97/19791 (WO 98/8810), заявляючих пріоможуть бути синтезовані із застосуванням автомаритет патентів США серійні Nos. 08/386063 і тичних способів з використанням або фосфорамі08/960774, зареєстрованих 7 лютого 1995p. і 30 дату, або Н-фосфонату як хімічних реагентів. жовтня 1997р.] відповідно, повний зміст яких Арил- і алкілфосфонати можуть бути одержані, включений тут як посилання. Передбачається, що наприклад, як описано [в патенті США №4469863]; дані модифіковані нуклеїнові кислоти можуть проі алкілфосфотриефіри (в яких заряджена киснева являти велику стимулюючу активність, обумовлечастина алкілована, як описано [в патенті США ну збільшеною стійкістю до нуклеаз, збільшеним №5023243 і в європейському патенті №092574]) захопленням клітинами, збільшеним зв'язуванням можуть бути одержані за допомогою автоматичноз білками та/або зміненою внутрішньоклітинною го твердофазного синтезу із застосуванням наявлокалізацією. них у продажу реактивів. Описані способи для Композиції згідно з винаходом можуть необостворення інших модифікацій остову ДНК і замів'язково бути химерними олігонуклеотидами. Хищень [Uhlmann, Ε. and Peyman., Chem. Rev. мерні олігонуклеотиди є олігонуклеотиди, що ма90:544, 1990; Goodchild, J., Bioconjugate Chem. ють формулу: 5'Y1Ν1ΖΝ2Υ23'. Υ1 і Υ2 є молекулами 1:165, 1990]. нуклеїнової кислоти, що мають від 1 до 10 нуклеоІнші стабілізовані нуклеїнові кислоти включатидів. Υ1 і Y2, кожний включає щонайменше один ють аналоги ДНК, такі як алкіл- і арилфосфатні (в модифікований міжнуклеотидний зв'язок. Оскільки яких заряджений кисень фосфонату заміщений щонайменше 2 нуклеотиди з химерних олігонуклеалкільною або арильною групою), фосфодіефірні і отидів включають модифікації остову, дані нуклеїалкілфосфотриефірні, в яких заряджена киснева нові кислоти є прикладом одного типу "стабілізочастина алкілована. Нуклеїнові кислоти, які місваних імуностимулюючих нуклеїнових кислот". тять діол, такий як тетраетиленгліколь або гексаеВідносно химерних олігонуклеотидів Υ1 і Y2 ротиленгліколь, або на одному, або на обох кінцях, зглядаються як незалежні один від одного. Це також, як показано, є по суті стійкими до деградації означає, що кожний з Υ1 і Υ2 може або не може під дією нуклеаз. мати різні послідовності і відмінні один від одного У разі, коли Ру-збагачена або TG-нуклеїнова зв'язки остову в тій же самій молекулі. Послідовкислота вводиться в поєднанні з антигеном, який ності варіюють, але в деяких випадках Υ1 і Υ2 макодується у векторі нуклеїнової кислоти, переважють полі-G-послідовність. Полі-С-послідовність но, щоб остов Ру-збагаченої або TG-нуклеїнової означає ту, що має щонайменше 3 G в ряді. В інкислоти являв собою химерну комбінацію фосфоших здійсненнях полі-С-послідовність означає ту, діефіру і фосфортіоату (або іншу модифікацію що має щонайменше 4, 5, 6, 7 або 8 G в ряді. В фосфату). Можна зіткнутися з проблемою захопінших здійсненнях Υ1 і Υ2 можуть являти собою лення клітиною плазмідного вектора у присутності TCGTCG, TCGTCGT або TCGTCGTT (SEQ ID повністю фосфортіоатної нуклеїнової кислоти. NO:1145). Y1 і Y2 можуть також мати полі-С, полі-Т Тоді, коли суб'єкту доставляються як вектор, так і або полі-А-послідовність. В деяких здійсненнях Y1 нуклеїнова кислота, переважно, щоб нуклеїнова 35 77152 кислота мала химерний остов або мала фосфортіоатний остов, але щоб плазміда була пов'язана з носієм, який доставляє її прямо в клітину, щоб уникнути в результаті цього необхідності захоплення клітинами. Такі носії відомі в даній області техніки і включають, наприклад, ліпосоми і генні гармати. Описані тут нуклеїнові кислоти, також як контрольні нуклеїнові кислоти, представлені нижче в таблиці А. 36 37 77152 38 39 77152 40 41 77152 42 43 77152 44 45 77152 46 В той час, як ефекти CpG у мишей добре охарактеризовані, інформація відносно систем людини обмежена. CpG-фосфортіоатні олігонуклеотиди з сильною стимулюючою активністю в системах миші проявляють меншу активність на людині і імунних клітинах інших тварин, що не є гризунами. В прикладах описана розробка CpG-мотиву людини з сильною активністю і характеристика його ефектів і механізмів дії на первинні В-клітини людини. ДНК, що містять даний pG мотив, сильно стимулювали первинні В-клітини людини відносно проліферації, продукції МЛ-6 і експресії збільшених рівнів CD86, CD40, CD54 і МНС II. Вони збільшували ДНК-зв'язуючу активність транскрипційних факторів NFkB і АРІ, також як фосфор плювання активованих стресом протеїнкіназ JNK і р38 і транскрипційного фактора ATF-2. Шляхи передачі сигналу у В-клітинах, активованих CpG-ДНК, відрізнялися від тих, які активуються через рецептор Вклітин, який активував ERK і іншу ізоформу JNK, але не активував р38 і ATF-2. В цілому дані про ініційовану CpG-ДНК передачу сигналу співпадають з такими, одержаними на мишах [Hacker Η., et al., 1998. Embo J 17:6230, Yi. K., and Krieg. M. 1998. J Immunol 161:4493]. Переважний мотив для тварин, що не є гризунами, є 5'-TCGTCGTT-3'. Заміна основ в найбільш сильному 8-членному CpG-мотиві (5'-TCGTCGTT3') знижувало активність олігонуклеотиду. Тімідіни в 5'- і 3і- положеннях даного мотиву були більш важливими, ніж тимідин в центральному положенні. Аденін або гуанозин в центральному положенні викликали зниження активності. Слід зазначити, що дослідження авторів показують, що одного CpG-мотиву у фосфодіефірному олігонуклеотиді (2080) достатньо для одержання максимального ефекту і що додаткові CpG-мотиви (2059) додатково не збільшують активність. Олігонуклеотид з 8-членним мотивом 5'TCGTCGTT3' (2080), що містить два CpG-динуклеотиди, проявляв в дослідженнях найбільшу активність. Заміщення основ, що примикають до двох CpGдинуклеотидів (5'положення, центральне положення, 3'положення), знижувало активність даної послідовності. Обидва CpG-динуклеотиди з 8членним CpG-мотивом були потрібні для оптимальної активності (2108, 2106). Метилювання цитидину в CpG-динуклеотидах (2095) знищувало активність 2080, тоді як метилювання цитидину (2094), не відноситься до цього, не впливало. Додавання двох CpG-мотивів в послідовність 2080 приводило в 2059 до додаткового збільшення активності фосфодіефірного олігонуклеотиду. Послідовність 2080 з фосфортіоатним остовом (2116) проявила меншу активність, що припускає, що додаткові CpG-мотиви переважні для сильного фосфортіоатного олігонуклеотиду. Відповідно до винаходу, було відкрито, що імуностимулюючі нуклеїнові кислоти охоплюють сильні імуностимулюючі ефекти на клітини людини, такі як NK-клітини, В-клітини і DC in vitro. Показано, що вживані тут тести in vitro передбачають 47 77152 48 ефективність in vivo у вигляді ад'юванта вакцини у чна імунна відповідь проти антигена пухлини. хребетних, що не є гризунами (приклад 12), що На додаток до застосування імуностимулююприпускає, що імуностимулюючі нуклеїнові кислочих нуклеїнових кислот для профілактичного лікути є ефективними терапевтичними агентами для вання винахід також охоплює застосування імуновакцинації людини, імунотерапії рака, імунотерапії стимулюючих нуклеїнових кислот для лікування астми, загального збільшення імунної функції, збісуб'єкта, що має інфекцію, алергію, астму або рак. льшення виявлення клітин гематопоезу після Суб'єкт, що має інфекцію, є суб'єктом, який зуопромінювання або хіміотерапії і для інших застострічався з інфекційним патогеном і має гострий сувань імуномодуляції. або хронічний рівень патогену в організмі, який Таким чином, імуностимулюючі нуклеїнові кисвизначається. Імуностимулюючі нуклеїнові кислоти лоти корисні в деяких варіантах винаходу як проможуть бути використані з антигеном для підвифілактичної вакцини для лікування суб'єкта при щення антигенспецифічної системної відповіді або ризику розвитку інфекції у інфікованого організму імунної відповіді слизової, що здатне понизити або рака, при якому ідентифікований специфічний рівень або знищити інфекційний патоген. Вживараковий антиген, або алергії або астми, при яких ний тут термін "інфекційне захворювання" є захвоалерген схильності до астми відомий. Імуностимурюванням, що виникає в результаті присутності в люючі нуклеїнові кислоти можуть бути також викоорганізмі чужорідного організму. Особливо важлиристані без антигену або алергену для більш корово розробити стратегії ефективної вакцинації і літкого захисту від інфекції, алергії або рака, і в кування для захисту слизових поверхонь організданому випадку повторні дози повинні створити му, які є первинними воротами інфекції. більш тривалий захист. Вживаний тут термін - суСуб'єкт, що має алергію, є суб'єктом, який має б'єкт, що має ризик - відноситься до суб'єкта, який алергічну реакцію або ризик її розвитку у відповідь має який-небудь ризик зіткнення з інфекцією, що на алерген. Алергія означає придбану гіперчутливикликається патогеном або раком, або алергевість до речовини (алергену). Алергічні стани ном, або ризик розвитку рака. Наприклад, суб'єкт, включають, але не обмежуються цим, екзему, що має ризик, може бути суб'єктом, який планує алергічний риніт або гострий риніт, сінну лихоманподорож в зону, в якій знайдений конкретний тип ку, кон'юнктивіт, бронхіальну астму, кропив'янку інфекційного агента, або це може бути суб'єкт, (висип) і харчові алергії, а також інші атопічні стаякий через свій спосіб життя або медичні процедуни. ри контактує з рідинами тіла, які містять інфекційні В даний час алергічні захворювання звичайно організми, або прямо з організмом, або навіть лікують шляхом введення малих доз антигена, за будь-який суб'єкт, що живе в тій області, де іденякими слідує подальше дозування антигена, що тифікований інфекційний організм або алерген. збільшується. Вважається, що дана процедура "Суб'єкт, що має ризик розвитку інфекції", також викликає толерантність до алергену, що запобігає означає загальні популяції, для яких медична подальшим алергічним реакціям. Дані способи, установа рекомендує вакцинацію антигеном конкпроте, можуть зайняти декілька років для досягретного інфекційного організму. Якщо антиген є нення ефективності і пов'язані з ризиком побічних алергеном, у суб'єкта розвиваються алергічні відефектів, таких як анафілактичний шок. Способи повіді на даний конкретний антиген, і суб'єкт може згідно з винаходом позбавлені таких проблем. бути схильний до дії антигену, тобто якщо настав Алергії звичайно викликаються генерацією ансезон цвітіння, суб'єкт має ризик експозиції з антититіл IgE проти нешкідливих алергенів. Цитокіни, геном пилку. "Суб'єкт, що має ризик розвитку алеякі індукуються в результаті системного введення ргії або астми", відноситься також до суб'єктів, які або введення в слизові імуностимулюючих нуклеївідомі як такі, що мають алергію або астму, але не нових кислот, належать переважно до класу, що мають активної форми хвороби протягом лікуванназивається Тh1 (прикладами є ІЛ-12 і IFN- ), і ня імуностимулюючою нуклеїновою кислотою, тавони індукують як гуморальну, так і клітинну імунні кож як до суб'єктів, які розглядаються як такі, що відповіді. Типи антитіл, пов'язані з Тh1-відповіддю, мають ризик розвитку даних захворювань через звичайно володіють більшою захисною активністю, генетичні фактори або фактори навколишнього оскільки вони мають високу здібність до нейтралісередовища. зації і опсонізації. Інший основний тип імунної відСуб'єкт, що має ризик розвитку рака, є одним з повіді, яка пов'язана з продукцією цитокінів - ІЛ-4, тих, хто має високу вірогідність розвитку рака. Це ІЛ-5 і ІЛ-10, називають Th2-типом імунної відповіді. поняття відноситься до суб'єктів, які, наприклад, Тh2-відповіді залучають переважно антитіла, і це мають генетичні дефекти, наявність яких, як покамає менший захисний ефект проти інфекцій, і дезано, корелює з підвищеною вірогідністю розвитку які Тh2-ізотипи (наприклад, IgE) пов'язані з алергірака, і до суб'єктів, які стикаються з агентами, що єю. В цілому передбачається, що алергічні захвовикликають рак, такими як тютюн, азбест або інші рювання опосередковуютсья Тh2-типом імунних хімічні токсини, або до суб'єктів, які раніше лікувавідповідей, тоді як Тh1-відповіді забезпечують лися від рака і знаходяться в стані безперечної найкращий захист від інфекції, хоча надмірні Th1ремісії. Коли суб'єкта, що має ризик розвитку рака, відповіді пов'язані з аутоіммунним захворюванням. лікують антигеном, специфічним для типу рака, Ґрунтуючись на здатності імуностимулюючих нуквідносно якого у суб'єкта є ризик розвитку, і імунолеїнових кислот зсувати імунну відповідь у суб'єкстимулюючою нуклеїновою кислотою, суб'єкт може та з Th2 (яка пов'язана з продукцією IgE антитіл і набути здатність знищувати ракові клітини у міру їх алергією) на Th1-відповідь (яка є захисною проти виникнення. Якщо у суб'єкта почала утворюватися алергічних реакцій), суб'єкту для лікування або пухлина, у суб'єкта повинна розвинутися специфіпрофілактики алергії може бути введена ефектив 49 77152 50 на доза імуностимулюючої нуклеїнової кислоти ються цим, лімфосаркому, остеосаркому, пухлини для індукції імунної відповіді. молочних залоз, мастоцитому, пухлину мозку, меТаким чином, імуностимулюючі нуклеїнові кисланому, аденосквамозну, карциному, карциноїдну лоти мають істотну терапевтичну застосовність пухлину мозку, пухлину бронхіальної залози, бропри лікуванні алергічних і неалергічних станів, танхіолярну аденокарциному, фіброму, міксохондких як астма. Рівень Тh2-цитокінів, особливо ІЛ-4 і рому саркому легень, нейросаркому, остеому, паІЛ-5, збільшений в дихальних шляхах суб'єктів з пілому, ретинобластому, саркому Евінга, пухлину астмою. Дані цитокіни спріяють розвитку основних Вілма, лімфому Беркітта, мікрогліому, нейробласваріантив астматичної запальної відповіді, вклютому, остеокластому, неоплазії рота, фібросаркочаючи перемикання на IgE ізотип, хемотаксис еому, остеосаркому і рабдоміосаркому. Інші неоплазинофілів і активацію зростання огрядних клітин. зії у собак включають сквамозноклітинну карциному геніталій, пухлину, що передається Тh1-цитокіни, особливо IFN- і ІЛ-12, можуть пригвенерично, пухлину сім'яників, семіному, пухлину лушувати утворення Тh2-клонів і продукцію Тh2клітин Сертолі, гемангіоперіцитому, гістіоцитому, цитокінів. Астма відноситься до стану респіраторхлорому (гранулоцитну саркому), папілому рогівки, ної системи, що характеризується запаленням, сквамозноклітинну карциному рогівки, гемангіосарзвуженням дихальних шляхів і збільшеною реакцікому, плевральну мезотеліому, базальноклітинну єю дихальних шляхів на агенти, що вдихаються. пухлину,тимому, пухлину шямку, карциному надАстма часто, хоча не виключно, пов'язана з атопіниркових, папіломатоз рота, гемангіоендотеліому і чними або алергічними синдромами. цистаденому. Додаткові злоякісні утворення, що Суб'єкт, що має рак, представляє собою судіагностуються у собак, включають фолікулярну б'єкт, який має ракові клітини, які визначаються. лімфому, лімфосаркому кишечнику, фібросаркому Раки або пухлини включають, але не обмежуються і сквамозноклітинну карциному легень. Відомо, що цим, рак жовчних шляхів; рак мозку; рак молочної у тхора, навіть більш популярної домашньої твазалози; рак шийки матки; хоріокарциному; рак товрини, розвивається інсулінома, лімфома, саркома, стої кишки; рак ендометрію; рак стравоходу; рак нейрома, пухлина островкового апарату підшлуншямку; внутрішньоепітеліальні неоплазії; лімфоми; кової залози, лімфома шямку MALT і аденокарцирак печінки; рак легень (наприклад, дрібноклітиннома шямку. ний і не дрібноклітинний); меланому; нейробласНеоплазії, що розвиваються у сільськогоспотоми; рак рота; рак яєчників; рак підшлункової задарської худоби, включають лейкоз, гемангіоперілози; рак простати; рак прямої кишки; саркоми; рак цитому і неоплазію ока биків (у великої рогатої шкіри; рак сім'яників; рак щитовидної залози і рак худоби); препуціальну фібросаркому, виразкову нирок, також як інші карциноми і саркоми. В односквамозноклітинну карциному, препуціальну карму здійсненні рак представляє собою лейкемічний циному, неоплазії сполучної тканини і мастоциторетикулез, хронічний мієлоїдний лейкоз, лейкоз му (у коней); гепатоклітинну карциному (у свині); шкірних Т-клітин, множинну мієлому, фолікулярну лімфому і аденоматоз легень (у вівці); саркому лімфому, злоякісну меланому, сквамозноклітинну легень, лімфому, саркому Рауса, ретикулендотекарциному, рак клітин нирки, рак простати, рак ліоз, фібросаркому, нефробластому, В-клітинну клітин сечового міхура або рак прямої кишки. лімфому і лімфоїдний лейкоз (у видів овець); реСуб'єкт, відповідно до винаходу, є суб'єктом, тинобластому, неоплазію печінки, лімфосаркому що не є гризуном. Суб'єкт, що не є гризуном, пови(лімфобластну саркому), плазмацитоїдний лейкоз і нен позначати людину або хребетну тварину, насаркому плавального міхура (у риб), сирнистий приклад, може бути, але не обмежуючись ними лімфаденіт (CLA): хронічне інфекційне, заразне собакою, кішкою, конем, коровою, свинею, вівцею, захворювання овець і кіз, що викликається бактекозою, курчам, приматом, наприклад, мавпою, і рією Corynebacterium pseudotuberculosis, і заразну рибою (види, що розводяться у воді), наприклад, пухлину легень овець, що викликається jaagsiekte. лосось, але конкретно виключаючи гризунів, таких Суб'єкт піддається дії антигена. Вживаний тут як криси і миші. термін "піддається дії" відноситься або до активної Таким чином, винахід може бути також застостадії контакту суб'єкта з антигеном, або пасивне сований для лікування рака і пухлин у суб'єктів, що експонування суб'єкту антигена in vivo. Способи не є людиною. Рак є однією з лідируючих причин активного експонування антигена суб'єкту добре смерті домашніх тварин (тобто кішок і собак). Рак відомі фахівцям в даній області техніки. В цілому, звичайно вражає старих тварин, які, у разі домашантиген вводять прямо суб'єкту будь-яким спосоніх тварин, стають інтегрованими в сім'ю. Сорок бом, таким як внутрішньовенне, внутрішньом'язоп'ять % собак старше 10 років, ймовірно, стають ве, пероральне, трансдермальне введення, ввежертвами хвороби. Найбільш звичайні можливості дення у слизову, інтраназальне, лікування включають хірургію, хіміотерапію і радівнутрішньотрахеальне або підшкірне введення. аційну терапію. Інші можливості лікування, які були Антиген може бути введений системно або місцезастосовані з деяким успіхом, включають лазерну во. Способи введення антигена і імуностимулюютерапію, кріотерапію, гіпертермію та імунотерапію. чої нуклеїнової кислоти описані більш детально Вибір терапії залежить від типу рака і ступеня рознижче. Суб'єкт пасивно експонується з антигеном, повсюдження. Крім випадків, коли малігнієзоване наприклад, при вході в організм чужорідного патозростання обмежене дискретною областю органігена або при розвитку пухлинної клітини, що ексзму, важко видалити тільки пухлинну тканину без пресує чужорідний антиген на своїй поверхні. впливу також на нормальні клітини. Способи, у яких суб'єкт пасивно експонується Злоякісні порушення, що звичайно діагностуз антигеном, можуть особливо залежати від тимються у собак і кішок, включають, але не обмежу 51 77152 52 часового режиму введення імуностимулюючої нук1 (що також позначається як HTLV-III, LAV або леїнової кислоти. Наприклад, у разі суб'єкта з риHTLV-III/LAV, або HIV-III; й інші ізоляти, такі як HIVзиком розвитку рака або інфекційного захворюLP; Picornaviridae (наприклад, поліовіруси, вірус вання, або алергічної або астматичної відповіді, гепатиту А; ентеровіруси; віруси Coxsackie людисуб'єкту можна вводити імуностимулюючу нуклеїни, риновіруси, еховіруси); Calciviridae (наприклад, нову кислоту регулярно, коли ризик найбільший, штами, які викликають гастроентеріт); Togaviridae тобто протягом алергенного сезону або після зу(наприклад, віруси енцефаліту коней, віруси корострічі з агентом, що викликає рак. Додатково імувої краснухи); Flaviridae (наприклад, віруси денге, ностимулюючу нуклеїнову кислоту можна вводити віруси енцефаліту, віруси жовтої лихоманки); мандрівникам перед їх подорожжю закордон, де Coronoviridae (наприклад, коронавіруси); вони ризикують зустрітися з інфекційними агентаRhabdoviradae (наприклад, віруси везикулярного ми. Таким же чином імуностимулююча нуклеїнова стоматиту, віруси сказу); Coronaviridae (наприклад, кислота може бути введена солдатам або цивількоронавіруси); Rhabdoviradae (наприклад, віруси ним при ризику зустрічі з біологічною зброєю для везикулярного стоматиту, віруси сказу); Filoviridae індукції системної імунної відповіді або відповіді (наприклад, віруси лихоманки ебола); слизової на антиген, коли, і якщо, суб'єкт з ним Paramyxoviridae (наприклад, віруси парагрипу, зустрінеться. віруси свинки, вірус кору вірус дихального синциВживаний тут термін "антиген" є молекулою, тію); Orthomyxoviridae (наприклад, віруси грипу); що викликає імунну відповідь. Антигени включаBungaviridae (наприклад, віруси Hantaan, віруси ють, але не обмежуються цим, клітини, клітинні bunga, флебовіруси і віруси Nairo); Arena viridae екстракти, білки, поліпептиди, пептиди, полісаха(віруси геморагічної лихоманки); Reoviridae (нариди, полісахаридні кон'югати, пептидні і непептиприклад, реовіруси, орбивіруси і ротавіруси); дні мiметики полісахаридів та інші молекули, неBimaviridae; Hepadnaviridae (вірус гепатиту В); великі молекули, ліпіди, гліколіпіди, вуглеводи, Parvoviridae (парвовіруси); Papovaviridae (віруси віруси і екстракти вірусів, а також багатоклітинні папіломи, віруси поліоми); Adenoviridae (більшість організми, такі як паразити і алергени. Термін анаденовірусів); Herpesviridae (вірус простого герпетиген в широкому сенсі включає будь-який тип са (HSV) 1 і 2, вірус вітряної віспи, цитомегаловімолекули, який признається імунною системою рус (CMV), вірус герпеса; Poxviridae (віруси віспи, хазяїна як чужорідний. Антигени включають, але віруси коров'ячої віспи, поксвіруси); і Iridoviridae не обмежуються цим, ракові антигени, мікробні (наприклад, вірус африканської лихоманки свиантигени і алергени. ней); і некласифіковані віруси (наприклад, агенти, Вживаний тут термін "раковий антиген" є спощо викликають губчастий енцефаліт, агент гепатилукою, такою як пептид або білок, яка пов'язана з ту дельта (як передбачається, що є вірусомповерхнею пухлинної або ракової клітини і яка сателітом гепатиту В), агенти гепатиту не-А, не-В здатна викликати імунну відповідь при експресії на (клас 1= передається через внутрішні органи; клас поверхні антиген-являючої клітини разом з моле2= передається парентерально (тобто гепатиту С); кулою МНС. Ракові антигени можуть бути одержані віруси Norwalk і відносяться до них віруси, а також з ракових клітин або шляхом одержання сирих астровіруси). екстрактів пухлинних клітин, [наприклад, як описаУ хребетних тварин антигенами служать як но Cohen, et al., 1994, Cancer Research, 54:1055], грампозитивні, так і грамнегативні бактерії. Такі шляхом часткового очищення антигенів, рекомбігрампозитивні бактерії включають, але не обменантним способом, або за допомогою синтезу de жуються цим, види Pasteurella, види Staphylococci і novo відомих антигенів. Ракові антигени включавиди Streptococcus. Грамнегативні бактерії вклюють, але не обмежуються цим, антигени, що ексчають, але не обмежуються цим, Eschenchia coli, пресуються рекомбінантно, їх імуногенну частину види Pseudomonas і види Salmonella. Конкретні або цілу пухлину або ракову пухлину. Такі антигеприклади інфекційних бактерій включають, але не ни можуть бути виділені або одержані за допомообмежуються цим, Helicobacter pylons, Borelia гою рекомбінантних способів або будь-яких інших burgdorferi, Legionella pneumophilia, Mycobacteria способів, відомих в даній області техніки. sps (наприклад, Μ. tuberculosis, Μ. avium, Μ. Вживаний тут термін "мікробний антиген" є анintracellulare, Μ. kansan, Μ. gordonae), тигеном мікроорганізму і включає, але не обмежуStaphylococcus aureus, Neisseria gonorrhoeae, ється цим, віруси, бактерії, паразити і гриби. Такі Neisseria meningitidis, Listeria monocytogenes, антигени включають інтактний мікроорганізм, а Streptococcus pyogenes (Streptococcus групи A), також природні ізоляти і їх фрагменти або похідні, Streptococcus agalactiae (Streptococcus групи В), а також синтетичні сполуки, які ідентичні або схожі Streptococcus (група viridans), Streptococcus з антигенами природного мікроорганізму і індукуfaecalis, Streptococcus bovis, Streptococcus (анаеють імунну відповідь, специфічну для даного мікробні види), Streptococcus pneumoniae, патогенна роорганізму. Сполука схожа з антигеном природCampylobacter sp., Enterococcus sp., Haemophilus ного мікроорганізму, якщо вона індукує імунну mfluenzae Bacillus antracis, corynebacteriura відповідь (гуморальну та/або клітинну) до антигену diphtheriae, corynebacterium sp., Erysipelothrix природного мікроорганізму. Такі антигени звичайrhusiopathiae, Clostridium perfringers, Clostridium но застосовують в даній області техніки, і вони tetani, Enterobacter aerogenes, Klebsiella добре відомі фахівцям в даній області. pneumoniae, Pasturella multocida, Bacteroides sp., Приклади вірусів, які знайдені у людини, вклюFusobacterium nucleatum, Streptobacillus чають, але не обмежуються цим, Retroviridae (наmoniliformis, Treponema palladium, Treponema приклад, віруси імунодефіциту людини, такі як ВІЛpertenue, Leptospira, Rickettsia і Actinomyces israelli. 53 77152 54 Приклади грибів включають Cryptococcus 1). Складні ретровіруси включають підгрупи ленneoformans, Histoplasma capsulatum, Coccidioides тивірусів, вірусів лейкозу Т-клітин і спінюючих віруimmitis, Blastomyces dermatitidis, Chlamydia сів. Лентівіруси включають ВІЛ-1, але також вклюtrachomatis, Candida albicans. чають ВІЛ-2, SIV, вірус Visna, вірус імунодефіциту Інші інфекційні організми (тобто найпростіші) котячих (FIV) і вірус інфекційної анемії кінських включають Plasmodium spp., такі як Plasmodium (EIAV). Віруси лейкозу Т-клітин включають HTLV-1, falciparum, Plasmodium malariae, Plasmodium ovale HTLV-II, вірус Т-клітинного лейкозу мавпячих і Plasmodium vivax, також Toxoplasma gondii. Пара(STLV) і вірус лейкозу корів (BLV). зити крові-кісток та/або тканин включають Спінюючі віруси включають спінюючий вірус Plasmodium spp., Babesia microti, Babesia людини (HFV), спінюючий вірус мавпячих (SFV) і divergens, Leishmania tropica, Leishmania spp., спінюючий вірус корів (BFV). Leishmania braziliensis, Leishmania donovani, Приклади інших РНК-ових вірусів, які є антигеTrypanosoma gambiense і Trypanosoma rhodesiense нами в хребетних тварин, включають в себе, але (африканська сонна хвороба), Trypanosoma cruzi не обмежуються цим, члени сімейства Reoviridae, (хвороба Chagas') і Toxoplasma gondii. включаючи рід Orthoreovirus (множинні серологічні Інші мікроорганізми, що відносяться до медитипи ретровірусів як ссавців, так і птахів), рід цини, детально описані в літературі, наприклад, Orbivirus (вірус Bluetongue, вірус Eugenangee, відивись C.G.A Thomas, Medical Microbiology, рус Kemerovo, вірус хвороби африканських коней і BailHere Tindall, Great Britain 1983, повний зміст вірус колорадської кліщової лихоманки), рід якої включений тут як посилання. Rotavirus (ротавірус людини, вірус діареї телят Хоча багато з мікробних агентів, описаних виНебраски, ротавірус мавпячих, ротавірус корів або ще, відносяться до захворювань людини, винахід овець, ротавірус птахів); сімейство Picornaviridae, також корисний для лікування інших хребетних, що включаючи рід Enterovirus (поліовірус, вірус А і В не є людиною. Хребетні, що не є людиною, також Коксаки, кишкові цитопатичні сирітські віруси люможуть піддаватися інфекції, якій можна запобігти дини (ECHO), вірус гепатиту А, ентеровіруси мавабо вилікувати розкритими тут імуностимулюючипячих, віруси енцефаломиєліту мишей, поліовірус ми нуклеїновими кислотами. Наприклад, на додаmuris, ентеровіруси корів, ентеровіруси свиней, рід ток до лікування інфекційних захворювань людини Cardiovirus (вірус енцефаломіокардиту (ЕМС), меспособи винаходу корисні для лікування інфекцій в нговірус), рід Rhinovirus (риновіруси людини, що тварин. включають в себе щонайменше 113 підтипів, інші Вживані тут терміни "лікувати", "підданий лікуриновіруси), рід Apthovirus (захворювання рота і ніг ванню", "лікування" при застосуванні відносно ін(FMDV); сімейство Calviviridae, включаючи вірус фекційного захворювання, означають профілактивезикулярного висипу свиней, вірус морського лечне лікування, яке збільшує стійкість суб'єкта ва San Miguel, пікорнавірус котячих і вірус Norwalk; (суб'єкта, що має ризик інфекції) до інфекції, що сімейство Togaviridae, включаючи рід Alphavirus викликається патогеном або, іншими словами, (вірус східного кінського енцефаліту, вірус лісів знижує вірогідність того, що суб'єкт стане інфікоSemliki, вірус Sindbis, вірус Chikungunya, вірус ваним патогеном, а також лікування після того, як O'Nyong-Nyong, вірус річки Ross, вірус венесуельсуб'єкт (суб'єкт, який інфікований) стає інфіковаського кінського енцефаліту, вірус західного кінсьним, для того, щоб боротися з інфекцією, наприкого енцефаліту), рід Flavirjus (вірус жовтої лихоклад, знижувати або знищувати інфекцію або заманки, що переноситься москітами, вірус денге, побігати її посиленню. вірус японського енцефаліту, вірус енцефаліту St. Багато вакцин для лікування хребетних, що не Louis, вірус енцефаліту Murray Valley, вірус West є людиною, розкрито Benett, К. Compendium Nile, вірус Kunjin, вірус, що переноситься центраVeterinary Products, 3rd ed. North American льно-європейським кліщем, вірус, що переноситьCompendiums, Inc., 1995. Як обговорювалося вися далекосхідним кліщем, вірус лісу Kyasanur, віще, антигени включають інфекційні мікроби, такі як рус Louping III, вірус Powassan, вірус омської вірус, паразит, бактерії і гриби і їх фрагменти, які геморагічної лихоманки), рід Rubivirus (вірус коропоходять з природних або синтетичних джерел. вої краснухи), рід Pestivirus (вірус хвороби слизоІнфекційні віруси хребетних, які є так і не є людивих, вірус холери свиней, вірус прикордонного ною, включають ретровіруси, РНК-ові віруси і ДНКстану), сімейство Bunyaviridae, включаючи рід ові віруси. Дана група ретровірусів включає як Bunyvirus (Bunyamwera і віруси, що відносяться до прості ретровіруси, так і складні ретровіруси. Пронього, група вірусів каліфорнійського енцефаліту), сті ретровіруси включають підгрупу ретровірусів рід Phlebovirus (сицилійський вірус лихоманки, що типу В, ретровірусів типу С і ретровірусів типу D. переноситься піщаною мухою, вірус лихоманки Прикладом ретровірусу типу В є вірус пухлини рифтової долини), рід Nairovirus (вірус геморагічмолочної залози миші (MMTV). Ретровіруси типу С ної лихоманки Crimean-Congo, вірус хвороби включають підгрупи групи типу С (включаючи вірус овець в Найробі) і рід Uukuvirus (Uukuniemi і вірусаркоми Рауса (RVS), вірус лейкозу птахів (ALV) і си, що відносяться до цього); сімейство вірус мієлобластозу птахів (AMV)) і групу В типу С Orthomyxoviridae, включаючи рід вірусу грипу (ві(включаючи вірус лейкозу котячих (FeLV), вірус рус грипу типу А, багато підтипіу людини); вірус лейкозу людиноподібної мавпи - гібона (GALV), грипу свиней і віруси грипу овець і коней; вірус вірус некрозу селезінки (SNV), вірус ретикулоенгрипу типу В (багато підгипіу людини) і грипу типу дотеліозу (RV) і вірус саркоми мавпячих (SSV)). С (можливо окремий рід); сімейство Ретровіруси типу D включають вірус мавпи MasonParamyxoviridae, включаючи рід Paramyxovirus Pfizer (MPMV) і ретровірус мавпячих типу 1 (SRV(вірус парагрипу типу 1, вірус Сендай, вірус гемад 55 77152 56 сорбції, віруси парагрипу типів з 2 по 5, вірус хвоКожний з вказаних вище переліків є ілюстрароби Ньюкасла, вірус свинки), рід Morbillivirus (вітивним і не розглядається як лімітуючий. На додарус кору, вірус підгострого склерозуючого паненток до застосування імуностимулюючих нуклеїноцефаліту, вірус собачої чуми, вірус чуми рогатої вих кислот для індукції антиген-специфічної худоби), рід Pneumovirus (вірус дихального синциімунної відповіді у людини способи перевалених тію (RSV), вірус дихального синцитію корів і вірус здійснень особливо добре підходять для лікування пневмонії); сімейство Rhabdoviridae, включаючи птахів, таких як кури, курчата, індички, качки, гусарід Vesiculovirus (VSV), вірус Chandipura, вірус ки, перепели і фазани. Птахи є першорядними Flanders-Hart Park), рід Lyssavirus (вірус сказу), мішенями для багато яких типів інфекцій. рабдовіруси риб і два вірогідних рабдовіруси (вірус Птахи, що вилупилися, піддаються дії патоМарбурга і вірус Ебола); сімейство Arenaviridae, генних організмів незабаром після народження. включаючи вірус лімфоцитного хоріоменінгіту Хоча дані птахи спочатку захищені від патогенів (LCM), комплекс вірусів Tacaribe і ласавірус; сіантитілами, одержаними від матері, даний захист мейство Coronoviridae, включаючи вірус інфекційє тільки тимчасовим, і власна незріла імунна сисного бронхіту (IBV), вірус гепатиту, коронавірус тема птахів повинна почати захищати птаха від кишечнику людини і вірус інфекційного перитоніту патогенів. Часто є бажаним запобігання інфекції у котячих (коронавірус котячих). молодих птахів, коли вони найбільш сприйнятливі. Приклади ДНК-ових вірусів, які є антигенами у Бажаним є також запобігання інфекції у старих хребетних тварин, включають, але не обмежуютьптахів. Особливо, коли птахи утримуються в зася цим, сімейство Poxviridae, включаючи рід критих приміщеннях, що веде до швидкого розпоOrthopoxvirus (віспа велика, віспа мала, pox всюдження захворювання. Таким чином, бажано Vaccinia мавп, віспа корів, віспа буйволів, віспа вводити імуностимулюючу нуклеїнову кислоту і кроликів, Ectomelia), рід Leporipoxvirus (міксома, ад'ювант згідно винаходу, що не є нуклеїновою фіброма), рід Avipoxvirus (віспа домашнього птаха, кислотою, птахам для збільшення антигенспециінші поксвіруси птахів), рід Capripoxvirus (віспа фічної імунної відповіді, коли антиген присутній. овець, віспа кіз), рід Suipoxvirus (віспа свиней), рід Прикладом звичайної інфекції в курчат є вірус Parapoxvirus (вірус інфекційного postular дерматиінфекційної анемії курчат (CIAV), CIAV першим був ту, псевдовіспа корів, вірус папулезного стоматиту виділений в Японії в 1979 році при дослідженні корів); сімейство Iridoviridae (вірус африканської перерв вакцинації при хворобі Marek'a (Yuasa et лихоманки свиней, віруси жаб 2 і 3, вірус лімфоциal., 1979, Avian Dis. 23:366-385). З того часу CIAV сти риб); сімейство Herpesviridae, включаючи вірубув знайдений у домашньому птаху, що продаєтьси герпеса альфа (простого герпеса типів 1 і 2, ся, у всіх країнах, головних виробниках домашньооперізувальної вітряної віспи, вірус аборту коней, го птаха (van Bulow et al., 1991, pp.690-699) in вірус герпеса коней 2 і 3, вірус псевдосказу, вірус Diseases Poultry, 9th edition, Iowa State University інфекційного кератокон'юнктивіту корів, вірус інфеPress). кційного ринотрахеїту корів, вірус ринотрахеїту Інфікування CIAV приводить до клінічного закотячих, вірус інфекційного ларинготрахеїту), вірухворювання, що характеризується анемією, гемоси герпеса-бета (цитомегаловірус людини і циторагією і імуносупресією у молодих схильних курмегаловіруси свиней і мавп); віруси герпеса-гамма чат. Характерним для інфекції CIAV є також (вірус Епштейна-Барра (EBV), вірус хвороби атрофія тимусу і кісткового мозку і супутні пошкоMarek'a, герпес saimiri, вірус герпеса ateles, вірус дження у CIAV-інфікованих курчат. Зниження лімгерпеса sylvilagus, вірус герпеса морських свинок, фоцитів в тимусі і іноді у фабрицієвій сумці веде вірус пухлини Lucke); сімейство Adenoviridae, до імуносупресії і збільшення схильності до втовключаючи рід Mastadenovirrus (підгрупи людини ринних вірусних, бактеріальних або грибкових інА, В, С, D, Ε і незгруповані; аденовіруси мавпячих фекцій, які потім ускладнюють перебіг хвороби. (щонайменше, 23 серотипи), вірус інфекційного Іммуносупресія може викликати загострення загепатиту собачих і аденовіруси великої рогатої хворювання після інфікування одним або більше худоби, свиней, овець, жаб і багато яких інших вірусами хвороби Marek'a (MDV), вірусом інфеквидів, рід Aviadenovirus (аденовіруси птахів) і неційного бурситу, вірусом ретикулоендотеліозу, піддатливі культивуванню аденовіруси; сімейство аденовірусом або рєовірусом. Було знайдено, що Papoviridae, включаючи рід Papillomavirus (віруси патогенез MDV посилюється під дією CIAV папіломи людини, віруси папіломи корів, вірус па(DeBoer et ah, 1989, p.28In Proceedings Western піломи кроликів Shope і віруси різних патогенних Poultry Diseases Conferece Tempe, Ariz.). Більш папілом інших видів), рід Polyomavirus (вірус політого, було показано, що CIAV поглиблюєознаки оми, вакуолізуючий агент мавпячих (SV-40), вакуінфекційного бурситу (Rosenberger et al., 1989, олізуючий агент кролячих (RKV), К-вірус, ВК-вірус, Avian Dis. 33:707-713). У курчат розвивається вікоJC-вірус і інші віруси поліоми приматів, такі як віва стійкість до експериментально індукованого рус лімфотрофічної папіломи); сімейство захворювання, обумовленого САА. Вона по суті Parvoviridae, включаючи рід адено-асоційованих закінчується до 2-х тижневого віку, але старі птахи вірусів, рід Parvovirus (вірус панлейкопенії котячих, є все ще чутливими до інфекції (Yuasa, N. et al., парвовірус корів, парвовірус собачих, вірус хворо1979 вище; Yuasa, N. et al., Arian Diseases 24, 202би алеутських нірок і т.д.). Нарешті, ДНК-ові віруси 209, 1980). Проте якщо курчат двічі інфікувати можуть включати віруси, які не потрапляють у вкаСАА і імуносупресорним агентом (IBDV, MDV і зані вище сімейства, такі як віруси хвороби Кuru і т.п.), вікова стійкість проти захворювання знижуCreutzfeldt-Jacob і хронічні інфекційні нейропатичні ється (Yuasa, N. et al., 1979 і 1980 вище; Bulow von агенти (Китайський вірус). V. et al., J. Veterinary Medicine 33, 93-116, 1986). 57 77152 58 Характеристики CIAV, які можуть посилити перевключають вірус герпеса-1 коней (EHV-1), повсюддачу хвороби, включають високу стійкість до інакний патоген у коней. EHV-1 пов'язаний з епідеміятивації у навколишньому середовищі і деяких звими викиднів, захворюванням дихальних шляхів і чайних дезинфікуючих агентів. Економічний вплив порушеннями центральної нервової системи. Перінфекції CIAV на виробництво птаха ясний з того винна інфекція верхніх дихальних шляхів молодих факту, що від 10% до 30% інфікованих птахів при коней веде до гарячкового стану, який продовжуспалахах захворювання вмирає. ється протягом періоду від 8 до 10 днів. ІмунологіВакцинація птахів, також як інших хребетних чно зрілі кобили можуть повторно інфікуватися тварин, може бути здійснена у будь-якому віці. через дихальні шляхи без явного вияву хвороби, Звичайно вакцинації проводять до віку 12 тижнів у так що викидень звичайно наступає без застережразі живих мікроорганізмів і між 14-18 тижнями у них обставин. Неврологічний синдром пов'язаний разі інактивованого мікроорганізму або іншого типу із захворюванням дихальних шляхів або викиднем вакцини. У разі вакцинації в яйце вакцинацію можі може вражати тварин будь-якої статі у будьна проводити в останню четверть ембріонального якому віці, що веде до втрати координації, слабкорозвитку. Вакцина може бути введена підшкірно, сті і паралічу задньої частини тіла [Telford, Ε.. R. et за допомогою спрею, перорально, у навколоочний al., Virology 189, 304-316, 1992]. Інші EHV включапростір, внутрішньотрахеально, інтраназально або ють EHV-2 або цитомегаловірус коней, EHV-3, за допомогою описаних тут способів доставки чевірус коїтального висипу, і EHV-4, раніше класифірез інші слизові. Таким чином, імуностимулюючі кований як підтип 2EHV-1. нуклеїнові кислоти згідно з винаходом можна ввоВівці і кози можуть інфікуватися множиною недити птахам і іншим хребетним, що не є людиною, безпечних мікроорганізмів, включаючи visnaіз застосуванням звичайних схем вакцинації, і анmaedi. тиген може бути введений після відповідного періПримати, такі як мавпи і макаки, можуть інфіоду часу, як тут описано. куватися вірусом імунодефіциту мавпячих. ВакциВелика рогата худоба і худоба також схильна ни з інактивованих клітин з вірусом і безклітинні інфекції. Захворювання, які вражають даних твавакцини вірусу імунодефіциту мавпячих, як знайрин, можуть викликати важку економічну втрату, дено, в змозі створити захист у макак [Stott et al особливо у разі великої рогатої худоби. Способи (1990) Lancet 36:1538-1541; Desrosiers et al. PNAS згідно з винаходом можуть бути застосовані для USA (1989) 86:6353-6357; Murphey-Corb et al. захисту від інфекції худоби, такої як корови, коні, (1989) Science 246:1293-1297; and Carlson et al. свині, вівці і кози. (1990) AIDS Res. Human Retroviruses 6:1239-1246]. Корови можуть інфікуватися вірусами корів. Вакцина рекомбінантного ВІЛ gp 120, як знайдено, Вірус діареї корів (BVDV) є вірусом з позитивним створює захист у шимпанзе [Berman et al. (1990) ланцюгом РНК і невеликою оболонкою і класифіNature 345:622-625]. кується як такий, що відноситься разом з вірусом Кішки, як домашні, так і дикі, сприйнятливі до холери свиней (HOCV) і вірусом суміжного стану інфікування множиною мікроорганізмів. Наприовець (BDV) до роду пестивірусів. Хоча пестивіруклад, інфекційний перитоніт котячих є захворюси раніше класифікувалися як такі, що відносяться ванням, яке виникає як у домашніх, так і у диких до сімейства Togaviridae, в деяких дослідженнях кішок, таких як леви, леопарди, гепарди і ягуари. пропонується змінити їх класифікацію і віднести до Коли бажано запобігти інфекції даним або іншими сімейства Flaviviridae разом з групами флавівірусу типами патогенних організмів у кішок, можуть бути і вірусу гепатиту С (HCV) (Francki, et al., 1991). застосовані способи винаходу для вакцинації кіBVDV, який є важливим патогеном великої рошок для захисту їх від інфекції. гатої худоби, може бути розділений на основі анаДомашні кішки можуть інфікуватися декільколізу клітинної культури на цитопатогенний (СР) і ма ретровірусами, включаючи, але не обмежуюнецитопатогенний (NCP) біотипи. Біотип NCP чись цим, вірус лейкозу котячих (FeLV), вірус сарбільш широко поширений, хоча обидва біотипи коми котячих (FeSV), ендогенний тип можуть бути знайдені у великої рогатої худоби. конкорнавірусу (RD-114) і синцитій-створюючого Якщо вагітна корова стає інфікованою штамом вірусу котячих (FeSFV). Серед них найбільш істотNCP, корова може народити постійно інфікованого ним патогеном є FeLV, що викликає різноманітні і специфічно імунотолерантного теляти, яке буде симптоми, включаючи лімфоретикулярну і мієлоїпоширювати вірус протягом свого життя. Постійно дну неоплазію, анемії, порушення, які опосередкоінфікована велика рогата худоба може стати жервуються імунною системою і синдром імунодефітвою хвороби слизових і потім обидва біотипи моциту, який схожий з синдромом надбаного жуть бути виділені у тварини. Клінічні прояви моімунодефіциту людини (СНІД). Нещодавно знайжуть включати викидня, тератогенез і проблеми з дено, що особливий мутант FeLV з дефектом репдихальними шляхами, захворювання слизових і лікації, що позначається як FeLV-AIDS, більш тісно легку діарею. Крім того, описана важка тромбоципов'язаний з імуносупресивними властивостями. топенія, пов'язана з епідемією стада, яка може Відкриття Т-лімфотропного лентивірусу котяприводити до смерті тварини, і штами, пов'язані з чих (що позначається також як вірус імунодефіциданим захворюванням, очевидно більш вірулентні, ту котячих) було вперше продемонстровано ніж класичні BVDV. [Pedersen et al. (1987) Science 235:790-793]. ХараВіруси герпеса коней (EHV) включають групу ктеристики FIV [описані Yamamoto et al. (1988) різних за антигенами біологічних агентів, які виLeukemia, December Supplement 2:204S-215S; кликають множина інфекцій в коней від субклінічYamaraoto et al. (1988) Am. J. Vet. Res. 49:1246них форм до смертельних захворювань. Вони 1258; і Ackley et al. (1990) J. Virol. 64:5652-5655]. 59 77152 60 Клонування і аналіз послідовностей FIV [описаний вляють собою Gasterophilus spp.,; Eimeria leuckarti, Olmsted et al. (1989) Proc. Natl. Acad. Sci. USA Giardia spp.; Tritrichomonas equi; Babesia spp. 86:2448-2452 і 86:4355-4360]. (BBC), Theileria equi; Trypanosoma spp., Klossiella Інфекційний перитоніт котячих (FIP) представequi; Sarcocystis spp. ляє собою спорадичне захворювання, що непеГоловні паразити, що інфікують свиней, предредбачувано вражає домашніх і диких Felidae. He ставляють собою Eimeria bebliecki, Eimeria scabra, дивлячись на те, що FIP є в першу чергу захворюIsospora suis, Giardia spp.; Balantidium coli; ванням домашніх кішок, він діагностований у левів, Entamoeba histolytica; Toxoplasma gondii і леопардів, гепардів і ягуарів. Більш дрібні дикі кішSarcocystis spp., і Trichinella spiralis. ки, які страждають від FIV, включають рись і стеГоловні паразити молочної і м'ясної великої пову рись, піщану кішку і манула. У домашніх кішок рогатої худоби включають Eimeria spp. захворювання виникає переважно у молодих тваCryptosporidium sp. Giardia spp.; Toxoplasma gondii; рин, хоча схильні кішки всіх віків. Максимум випадBabesia bovis (RBC), Babesia bigemina (RBC), ків припадає на вік від 6 до 12 місяців. Зниження Trypanosoma spp. (плазма), Theileria spp. (RBC); випадків помічено у віці від 5 до 13 років, потім Theileria parva (лімфоцити); Tritrichomonas foetus; і слідує збільшення випадків у кішок у віці від 14 до Sarcocystis spp. 15 років. Головні паразити хижаків включають Вірусні, бактеріальні і паразитарні захворюTrichomonas gallinae; Coccidia (Eimeria spp.); вання у плавникових риб, молюсків або інших водPlasmodium relictum, Leucocytozoon danilewskyi них форм життя складають серйозну проблему (сови), Haemoproteus spp., Trypanosoma spp.; для промисловості, переробляючої водні організHistomonas; Cryptosporidium meleagridis, ми. Через високу густину тварин у садінняхCryptosporidium baileyi, Giardia, Eimeria; водоймищах або відгороджених зонах морського Toxoplasma. фермерського господарства, інфекційні захворюТипові паразити, що інфікують овець і кіз, вання можуть вражати велику частину стада, навключають Eimeria spp., Cryptosporidium sp., приклад, легко вражати плавникових риб, молюсGiardia sp.; Toxoplasma gondii; Babesia spp. (RBC), ків або інші водні форми. Профілактика Trypanosoma spp. (плазма), Theileria spp. (RBC); і захворювання є більш бажаним засобом лікування Sarcocystis spp. риб, ніж втручання в той час, коли хвороба вже Типові паразитарні інфекції домашнього птаха почалася. Вакцинація риб є тільки способом провключають кокцидіоз, що викликається Eimeria філактики, який може створити тривалий імунний acervulina, E. Necatrix E. tenella, Isospora spp. і захист. Вакцинації на основі нуклеїнових кислот Eimeria truncata; гістомоніаз, що викликається описуються [в патенті США №5780448], виданому Histomonas meleagndis і Histomonas gallinarum; на ім'я Davis. трихомоніаз, що викликається Thichomonas Імунна система риб має багато характеристик, gallinae; і гексамітіаз, що викликається Hexamita схожих з імунною системою ссавців, таких як приmeleagndis. Домашній птах може бути також інфісутність В-клітин, Т-клітин, лімфокінів, комплеменкований Emeria maxima, Emeria meleagndis, ту і імуноглобулінів. Риби мають підкласи лімфоEimeria adenoeides, Eimeria meleagnmitis, цитів, роль яких здається у багатьох відношеннях Cryptospondium, Eimeria brunetti, Emeria схожою з такою В- і Т-клітин ссавців. Вакцини моadenoeides, Leucocytozoon spp., Plasmodium spp., жуть бути введені шляхом занурення (в них) або Hemoproteus meleagndis, Toxoplasma gondii і перорально. Sarcocystis. Водні промислові види включають, але не обСпособи згідно з винаходом можуть бути тамежуються цим, плавникових риб, молюсків і інкож застосовані до лікування та/або профілактики ших водних тварин. Плавникові риби включають паразитарних інфекцій у собак, кішок, птахів, риб і риб-хребетних, які можуть бути костистими або тхорів. Типові паразити птахів включають хрящовими рибами, таких, наприклад, як лососеві, Trichomonas gallinae; Eimeria spp., Isospora spp., короп, сомові, жовтохвіст, морський лящ і морсьGiardia; Cryptosporldlum; Sarcocystis spp., кий окунь. Лососеві є сімейством плавникових риб, Toxoplasma gondn, яке включає форель (включаючи райдужну фоHaemoproteus/Parahaemoproteus, Plasmodium spp., рель), лосося і арктичну струмкову форель. ПрикLeucocytozoon/Akiba, Atoxoplasma, Trypanosoma лади молюсків включають, але не обмежуються spp. Типові паразити, що інфікують собак, вклюцим, морського молюска, омара, креветку, краба і чають Tnchinella spiralis; Isopora spp., Sarcocystis устрицю. Інші водні промислові види, але не обspp., Cryptospondium spp., Hammondia spp., Giardia межуються цим, вугра, кальмара і восьминогів. duodenalis (собачі); Balantidium coli, Entamoeba Поліпептиди вірусних патогенів водних промиhistolytica; Hepatozoon cams; Toxoplasma gondn, слових видів включають, але не обмежуються цим, Trypanosoma cruzi; Babesia cams; Leishmania глікопротеїн (G) або нуклеопротеїн (N) вірусу віруamastigotes; Neospora caninum. сного геморагічного сепсису (VHSV); G або N білки Типові паразити, що інфікують види котячих, вірусу інфекційного геморагічного некрозу (IHNV); включають в себе Isospora spp., Toxoplasma VP1S VP2, VP3 або N структурні білки вірусу інфеgondu, Sarcocystis spp., Hammondia hammondi; кційного панкреатичного некрозу (IPNV); G білок Besnoitia spp., Giardia spp.; Entamoeba histolytica; весняної віремії коропа (SVC); і пов'язаний з мемHepatozoon cams, Cytauxzoon sp., Cytauxzoon sp., браною білок, білок оболонки або капсідний білок Cytauxzoon sp. (ерітроцити, RE клітини). глікопротеїну вірусу канальних сомів (CCV). Типові паразити, що інфікують риб, включають Типові паразити, що інфікують коней, предстаHexamita spp., Eimeria spp.; Cryptobia spp., Nosema
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for stimulation of immune response using nucleic acid-containing immunostimulating compositions, method for treatment of cancer and method for treatment or prophylaxis of allergy or asthma
Автори англійськоюKrieg Arthur M., Vollmer Joerg
Назва патенту російськоюСпособ стимуляции иммунного ответа, композиция, содержащая иммуностимулирующую нуклеиновую кислоту, способ лечения рака и способ лечения или профилактики аллергии или астмы
Автори російськоюКриг Артур М., Фолльмер Йорг
МПК / Мітки
МПК: A61P 37/04, A61P 35/00, A61K 39/39, A61P 37/08, A61K 31/7088
Мітки: кислоту, раку, імунної, нуклеїнову, композиція, астми, алергії, спосіб, стимуляції, відповіді, містить, лікування, імуностимулюючу, профілактики
Код посилання
<a href="https://ua.patents.su/114-77152-sposib-stimulyaci-imunno-vidpovidi-kompoziciya-shho-mistit-imunostimulyuyuchu-nuklenovu-kislotu-sposib-likuvannya-raku-ta-sposib-likuvannya-abo-profilaktiki-alergi-abo-astmi.html" target="_blank" rel="follow" title="База патентів України">Спосіб стимуляції імунної відповіді, композиція, що містить імуностимулюючу нуклеїнову кислоту, спосіб лікування раку та спосіб лікування або профілактики алергії або астми</a>