Лікарський препарат, що містить мірамістин
Формула / Реферат
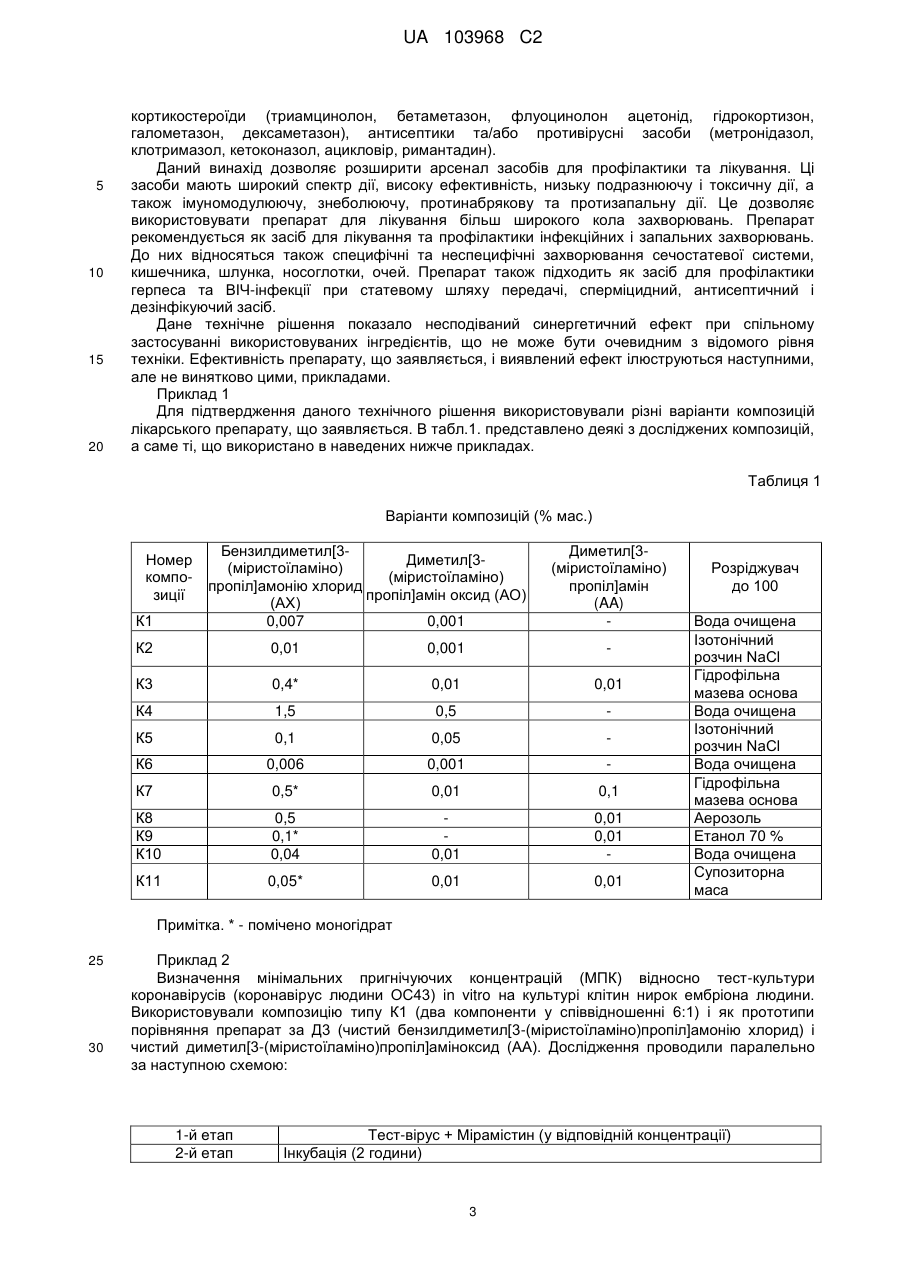
1. Лікарський препарат, що включає бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратованому вигляді, який відрізняється тим, що додатково містить диметил[3-(міристоїламіно)пропіл]аміноксид та/або диметил[3-(міристоїламіно)пропіл]амін у прийнятному фармацевтичному розріджувачі при наступному співвідношення компонентів (% мас.):
бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратній формі
0,008-5,0
диметил[3-(міристоїламіно)пропіл]аміноксид і/або диметил[3-(міристоїламіно)пропіл]амін
0,00005-1,0
прийнятний фармацевтичний розріджувач
до 100.
2. Лікарський препарат за п. 1, який відрізняється тим, що має наступне співвідношення компонентів (% мас.):
бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратній формі
0,008-2,0
диметил[3-(міристоїламіно)пропіл]аміноксид і/або диметил[3-(міристоїламіно)пропіл]амін
0,00005-0,01
прийнятний фармацевтичний розріджувач
до 100.
3. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить місцевий анестетик з ряду гідрохлоридів: лідокаїн, бупівакаїн, піромекаїн, тримекаїн у кількості (% мас.): 0,1-5,0.
4. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить хлорид натрію у кількості (% мас.): 0,6-1,0.
5. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить протинабрякові засоби з ряду: ксилометазолін, оксиметазолін, нафазолін, фенілефрин, фенілпропаноламін, псевдоефедрин у кількості (% мас.): 0,01-2,0.
6. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить кортикостероїди з ряду: триамцинолон, бетаметазон, флуоцинолон ацетонід, гідрокортизон, галометазон, дексаметазон у кількості (% мас.): 0,1-3,0.
7. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить антисептики та/або противірусні засоби з ряду: метронідазол, клотримазол, кетоконазол, ацикловір, римантадин у кількості (% мас.): 0,01-5,0.
8. Лікарський препарат за будь-яким з пп. 1-7, який відрізняється тим, що як фармацевтичний розріджувач містить спирт і/або воду.
9. Лікарський препарат за будь-яким з пп. 1-7, який відрізняється тим, що як фармацевтичний розріджувач містить будь-яку рідку, гелеподібну, мазеву, мийну або тверду основу рослинного, тваринного або синтетичного походження.
Текст
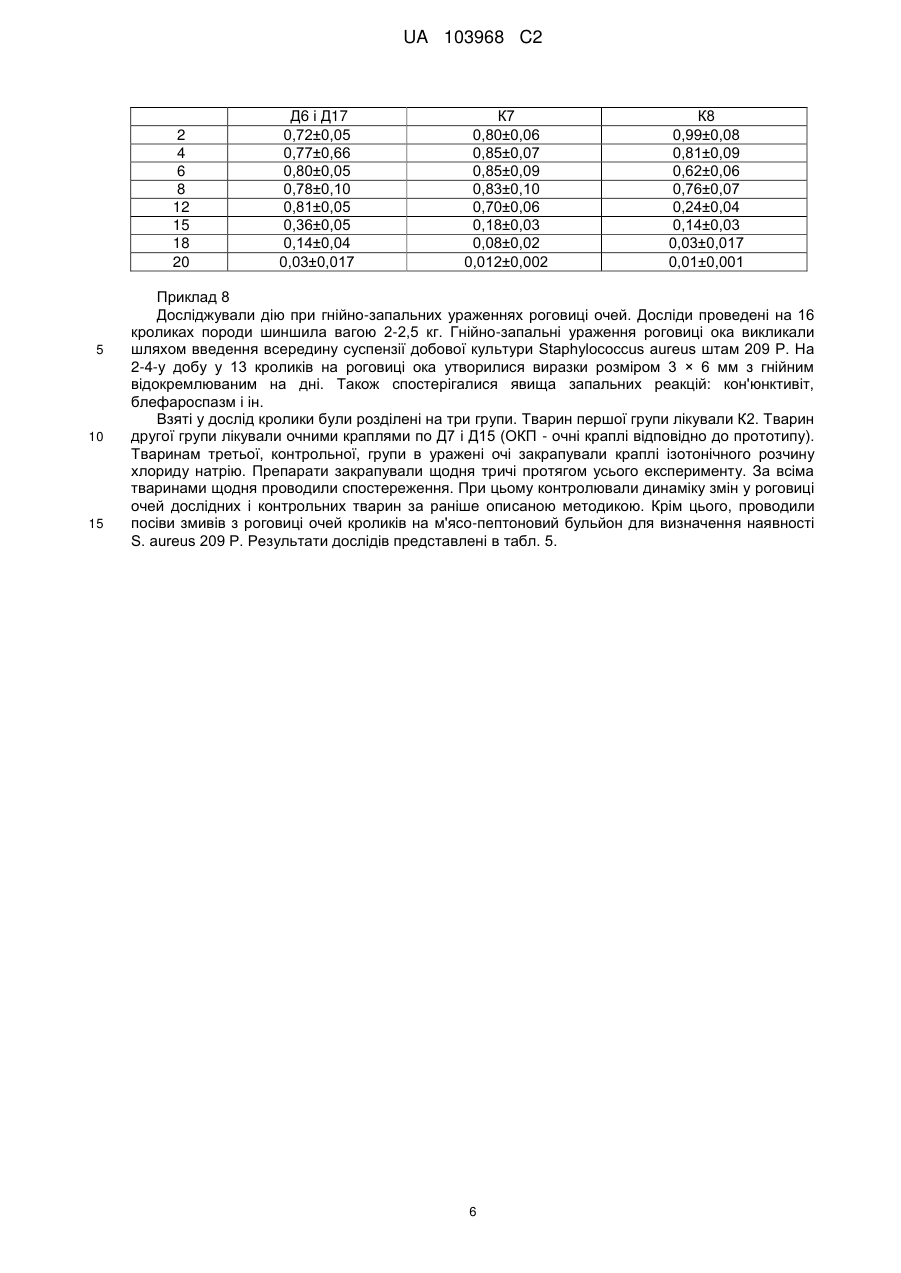
Реферат: Лікарський препарат включає бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратній формі і додатково містить диметил[3(міристоїламіно)пропіл]аміноксид і/або диметил[3-(міристоїламіно)пропіл]амін у прийнятному фармацевтичному розріджувачі. UA 103968 C2 (12) UA 103968 C2 UA 103968 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід належить до галузі медицини та фармацевтичної промисловості. Він може бути використаний в створенні, виробництві та застосуванні лікувальних і профілактичних препаратів для людини і тварин. Синтез і використання четвертинних амонієвих солей, що містять одночасно амідну групу, вперше описані в патенті США 2459062 (Д1). Зокрема, у Прикладі 1 описано синтез міристамідопропілдиметилбензиламонію хлориду реакцією міристамідопропілдиметиламіну з бензилхлоридом у бензолі. В цьому патенті показана активність отриманого продукту відносно одного стандартного штаму Staf. Описаний винахідниками продукт являє собою при кімнатній температурі напівтверду речовину з температурою плавлення 54 °C (стовпчик 3, рядки 69-70). При цьому у Прикладі 1 не наводяться ніякі інші дослідження, що підтверджують структуру виділеного продукту. Однак проведені при роботі над винаходом дослідження з виділення чистого придатного препарату для медичного застосування показують, що міристамідопропілдиметилбензиламонію хлорид при кімнатній температурі являє собою кристалічний продукт з температурою плавлення вище 90 °C. Таким чином, можна припустити, що винахідники виділили суміш основного продукту із залишковими кількостями з бензилхлориду та розчинника (бензолу) і дослідили їхню активність. Але використання такого продукту в медичних цілях неможливо через високу токсичність бензилхлориду та бензолу. Відповідно до рядка 62, стовпчика 3, вихідний міристамідопропілдиметиламін також є твердою речовиною, що підтверджується і нашими дослідженнями. І тому отриманий у Прикладі 1 продукт не може бути сумішшю вихідного амідоаміну та кінцевої сполуки. Крім того, присутність залишкових кількостей вихідного амідоаміну неможливо, оскільки у Прикладі 1 бензилхлорид використовується в реакції в достатній кількості. Ще слід зазначити, що чистий міристамідопропілдиметилбензиламонію хлорид не дає у воді розчин з концентрацією вище 20 %, а вихідний міристамідопропілдиметиламін у воді взагалі не розчиняється і висаджується водою з розчинів в інших розчинниках. Це також підтверджує, що кінцевий продукт за Прикладом 1 не може містити домішки міристамідопропілдиметиламіну, тому що у рядках 73-74, стовпчика 3, вказується на одержання прозорих 25 % водних розчинів. Відомий цілий ряд лікарських препаратів на основі бензилдиметил[3(міристоїламіно)пропіл]амонію хлориду у вигляді моногідрату або в негідратній формі. Ці лікарські препарати призначені для лікування та профілактики певних видів захворювань (SU 1796185 (Д2), ЕР 1634590 (Д3), WO 93/00892 (Д4), RU 2157214 (Д5), UA 67795 (Д6), UA 64800 (Д7), RU 2161961 (Д8), RU 2188005 (Д13), RU 2184534 (Д14), RU 2164135 (Д15), RU 2177314 (16), RU 2185157 (Д17), RU 2185156 (Д18), RU 2173142 (Д19), UA 30143 (Д20). До недоліків цих лікарських препаратів відноситься або дуже обмежений спектр дії відповідного розчину, або недостатня ефективність при використанні за іншим призначенням, або більш низька ефективність у порівнянні з пропонованим технічним рішенням. Деякі конкретні, але не обмежені ними, порівняльні дані наведені в прикладах даного опису. Інші пропозиції передбачають використання третинних амінів у біологічно активних композиціях. Ці аміни містять амідну групу, включаючи диметил[3-(міристоїламіно)пропіл]аміну (міристамідопропілдиметиламіну) (наприклад, WO 2007/136558) (Д10). Такі сполуки в композиції з полігексаметиленбігуанідином використовують у багатокомпонентних композиціях для дезінфекції різних поверхонь. Але при таких концентраціях їх не можна застосовувати як лікарські препарати через високу токсичність. В US 2004/0058924 (Д9) показана можливість застосовувати амідоаміни в композиціях для лікування чисто грибкової інфекції очей, а також у випадку її комбінації з Acanthamoeba. В US 2004/0033208 (Д21) запропоновано застосовувати амідоаміни в композиції з антибіотиками для лікування та профілактики грибкових захворювань очей і носа. Але ці композиції мало ефективні при бактеріальних інфекціях і не можуть застосовуватися для лікування внутрішніх органів або в якості, наприклад, сперміцидних препаратів. В WO95/08266 (Д22) амідоаміни такого типу запропоновано використовувати в офтальмологічних композиціях для очищення контактних лінз. Але ці композиції не можна використовувати для лікування самих очей або, наприклад, вух, горла, або використовувати при внутрішньопорожнинних операціях або як засіб профілактики венеричних захворювань через багатокомпонентність і високу концентрацію компонентів. Застосування окисів амінів такого типу описане в US 4093711 (Д11). В цьому патенті 1 % водні розчини різних амідоамінів, зокрема диметиламінопропіл міристамід N-оксиду, пропонується використовувати в композиціях для гігієнічної обробки зубів, щоб полегшити процес видалення та запобігання утворенню зубного каменю. 1 UA 103968 C2 5 10 15 20 25 Використовуваний окис амідоаміну в цьому випадку виконує функцію розм'якшувача та емульгатора зубного нальоту і не є лікарським засобом. Фармацевтичні композиції, в яких використовуються окиси амідоамінів, а також одночасно четвертинна амонієва сіль і третинний амідоамін і/або окис цього аміну, в доступних літературних джерелах ми не зустріли. Найбільш близькими до технічного рішення, що заявляється, є розкритий у Євразійському патенті 005132 (Д23) лікарський препарат. Він включає четвертинну амонієву сполуку бензилдиметил[3-(міристоїламіно)-пропіл]амонію хлорид (міристамідопропілдиметилбензиламонію хлорид) у вигляді моногідрату. Як фармацевтичний розріджувач цей лікарський препарат містить воду і/або спирт для рідких форм. Для інших форм приймання лікарського засобу він містить будь-яку основу рослинного, тваринного та синтетичного походження. Препарат має добру антимікробну та протигрибкову ефективність. Антибактеріальна дія лікарського препарату під час дослідів "in vitro" була досить високою. Однак при застосуванні різних композицій для профілактики та лікування "in vivo" активність під дією високого білкового навантаження значно знижується. З іншого боку, значне підвищення концентрації призводить до посилення подразнюючої дії. Крім того, цей лікарський препарат не можна ефективно комбінувати з деякими основами та препаратами іншої дії, оскільки утворюються комплекси, які випадають в осад. Як лікарський препарат для лікування та профілактики захворювань різної етіології у людини і тварин пропонується наступна композиція: бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратній формі з диметил[3-(міристоїламіно)пропіл]аміноксидом і/або диметил[3(міристоїламіно)пропіл]аміном у підходящому фармацевтичному розріджувачі. При цьому для зовнішнього застосування найбільшу ефективність при припустимій токсичності демонструє сполука при наступному співвідношенні компонентів (% мас.): бензилдиметил[3(міристоїламіно)пропіл]амонію 0,008-5,0 хлорид у вигляді моногідрату або в негідратній формі диметил[3(міристоїламіно)пропіл]амін оксид і/або 0,00005-1,0 диметил[3(міристоїламіно)пропіл]амін прийнятний фармацевтичний До 100 розріджувач Найменшу подразнюючу дію і токсичність для людини і тварин при достатній ефективності має сполука для застосування на слизових оболонках або при внутрішньопорожнинному застосуванні при співвідношенні компонентів (% мас.): 30 бензилдиметил[3(міристоїламіно)пропіл]амонію 0,008-2,0 хлорид у вигляді моногідрату або в негідратній формі диметил[3(міристоїламіно)пропіл]амін 0,00005оксид і/або 0,01 диметил[3(міристоїламіно)пропіл]амін прийнятний фармацевтичний до 100. розріджувач 35 Як фармацевтичний розріджувач запропоновано використовувати воду і/або спирт, а також будь-яку рідку, гелеподібну, мазеву, миючу або тверду рослинну, тваринну або синтетичну основу залежно від способу введення або місця застосування. Крім того, запропоновано цілий ряд комбінацій цього лікарського препарату з препаратами іншої дії. До лікарських препаратів іншої дії відносяться, наприклад, місцеві анестетики (лідокаїн, бупівакаїн, піромекаїн, тримекаїн), хлорид натрію, протинабрякові засоби (ксилометазолін, оксиметазолін, нафазолін, фенілефрин, фенілпропаноламін, псевдоефедрин), 2 UA 103968 C2 5 10 15 20 кортикостероїди (триамцинолон, бетаметазон, флуоцинолон ацетонід, гідрокортизон, галометазон, дексаметазон), антисептики та/або противірусні засоби (метронідазол, клотримазол, кетоконазол, ацикловір, римантадин). Даний винахід дозволяє розширити арсенал засобів для профілактики та лікування. Ці засоби мають широкий спектр дії, високу ефективність, низьку подразнюючу і токсичну дії, а також імуномодулюючу, знеболюючу, протинабрякову та протизапальну дії. Це дозволяє використовувати препарат для лікування більш широкого кола захворювань. Препарат рекомендується як засіб для лікування та профілактики інфекційнихі запальних захворювань. До них відносяться також специфічні та неспецифічні захворювання сечостатевої системи, кишечника, шлунка, носоглотки, очей. Препарат також підходить як засіб для профілактики герпеса та ВІЧ-інфекції при статевому шляху передачі, сперміцидний, антисептичний і дезінфікуючий засіб. Дане технічне рішення показало несподіваний синергетичний ефект при спільному застосуванні використовуваних інгредієнтів, що не може бути очевидним з відомого рівня техніки. Ефективність препарату, що заявляється, і виявлений ефект ілюструються наступними, але не винятково цими, прикладами. Приклад 1 Для підтвердження даного технічного рішення використовували різні варіанти композицій лікарського препарату, що заявляється. В табл.1. представлено деякі з досліджених композицій, а саме ті, що використано в наведених нижче прикладах. Таблиця 1 Варіанти композицій (% мас.) Номер композиції К1 Бензилдиметил[3Диметил[3(міристоїламіно) (міристоїламіно) пропіл]амонію хлорид пропіл]амін оксид (AO) (АХ) 0,007 0,001 Диметил[3(міристоїламіно) пропіл]амін (AA) К2 0,01 0,001 К3 0,4* 0,01 0,01 К4 1,5 0,5 К5 0,1 0,05 К6 0,006 0,001 К7 0,5* 0,01 0,1 К8 К9 К10 0,5 0,1* 0,04 0,01 0,01 0,01 К11 0,05* 0,01 0,01 Розріджувач до 100 Вода очищена Ізотонічний розчин NaCl Гідрофільна мазева основа Вода очищена Ізотонічний розчин NaCl Вода очищена Гідрофільна мазева основа Аерозоль Етанол 70 % Вода очищена Супозиторна маса Примітка. * - помічено моногідрат 25 30 Приклад 2 Визначення мінімальних пригнічуючих концентрацій (МПК) відносно тест-культури коронавірусів (коронавірус людини ОС43) in vitro на культурі клітин нирок ембріона людини. Використовували композицію типу К1 (два компоненти у співвідношенні 6:1) і як прототипи порівняння препарат за Д3 (чистий бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид) і чистий диметил[3-(міристоїламіно)пропіл]аміноксид (AA). Дослідження проводили паралельно за наступною схемою: 1-й етап 2-й етап Тест-вірус + Мірамістин (у відповідній концентрації) Інкубація (2 години) 3 UA 103968 C2 3-й етап 4-й етап 5-й етап 6-й етап Додавання до суміші нейтралізатора (наприклад, 25 % ЕСК – ембріональної сироватки корів) та інкубація суміші 10 – 20 хв Зараження чутливих культур клітин (наприклад - нирок ембріона людини) Інкубація (5-8 діб) Урахування результатів за феноменом гемадсорбції та ЦПД цитопатичною дією – симпластоутворення Було проведено по три серії дослідів у чотирьох розведеннях препаратів, після чого обчислені їхні МПК відносно коронавірусів. Результати дослідів представлені в табл. 2. Таблиця 2 МПК заявленого препарату та інших антисептиків відносно коронавірусу людини ОС43 in vitro Антисептики К1 Д3 (АХ) AO МПК (%) 0,007±0,002 0,01±0,005 0,1±0,05 5 10 15 20 25 30 Як видно з даних, представлених у табл. 2, К1 перевершує за ефектом інактивації коронавірусів обидва інгредієнти окремо і виявляє синергетичний ефект. Приклад 3 Місцева подразнююча дія заявленого препарату на шкіру та на кон'юнктиву очей і слизові оболонки піхви вивчали на морських свинках і кроликах. Місцева подразнююча дія на слизові уретри та сечовий міхур досліджували на собаках. Отримані дані показали, що аплікації композиції К4 і К9 на шкіру протягом 40 діб не викликали ані візуальних, ані гістологічних змін. Збільшення сумарної концентрації інгредієнтів у препараті до 5,0 % призводило до 30 дня аплікацій до невеликої сухості шкіри та незначної атрофії епідермісу. В той же час у Д8, Д20 і Д23 розчини чистого АХ уже в концентраціях вище 1 % (мас.) викликали подразнення шкіри. А більш високі концентрації (2-3 % мас.), починаючи з 10-15 дня викликали більш значні зміни шкіри. При використанні 0,01 % розчину чистого AA в 70 % спирті подразнення шкіри проявлялися вже на 10 день аплікацій. Розчин композиції, що заявляється (К5), в ізотонічному розчині натрію хлориду закрапували в очі кроликів і морських свинок протягом 10 днів у сумарній концентрації інгредієнтів 0,15 % (мас.). Він не викликав подразнюючої дії на слизові (оцінка за шкалою Драйзе = 0, оцінка за класифікацією Огура = група А). В той же час концентрація препарату по Д23 вище 0,05 % викликала подразнення на кон'юнктиві ока (за шкалою Драйзе 8-10 балів, за класифікацією Огура = група В). По 20 мл 0,05 %-го розчину заявленої сполуки ЗК (К10) у воді інстилювали протягом 10 днів 4 рази на добу в уретру самців-собак. Після цієї інстиляції не спостерігали яких-небудь змін у поведінці тварин. Аналіз сечі, крові та гістологічні дослідження слизової уретри, сечового міхура та інших органів собак не виявили відхилень від норми. Не виявлено також морфологічних і гістологічних змін з боку слизової піхви тварин-самок при інстилюванні К7 і К8 (мазі та аерозолю). В той же час Д4, Д8 і Д23 викликають подразнення вже при концентраціях у 2-5 разів нижче. Тобто спостерігається явний синергетичний ефект. 35 Приклад 4 40 Вивчання сперміцидної дії проводили за методикою, рекомендованою ВОЗ. Для цього сперматозоїди людей змішували з різними концентраціями заявленого препарату. У мікроскопі контролювали їхню рухливість. Також досліджували інші показники (рН, редукція метиленового синього, тест контакту з цервікальним слизом, рівень фруктози та ін.). Всього було досліджено 17 сперміїв чоловіків у віці 18-23 років. Результати дослідів показали, що оптимальною концентрацією заявленого препарату, що припиняє рухливість сперматозоїдів протягом 20 с, є 4 UA 103968 C2 5 10 15 20 25 сумарна концентрація 0,02 %. Більш високі концентрації препарату призводять не тільки до миттєвого знерухомлення сперматозоїдів, але і до їхнього лізису. Приклад 5 Профілактичну дію заявленого препарату при венеричних захворюваннях вивчали на моделі експериментального сифілісу на кроликах. Досліди проведені на 56 кроликах породи шиншила. Кроликів заражали свіжоприготовленою суспензією блідих трепонем (штами Ніколса та ЦКВІ-8) нашкірним способом. Через 30, 60, 120, 180 і 240 хв після зараження обробляли шкіру зараженої ділянки К6 або Д23. Кроликів контрольної групи обробляли дистильованою водою. Всі тварини перебували на клініко-серологічному контролі 6-12 міс. Для контролю використовували реакцію Вассермана (РВ), РІБТ і РІФ, які ставили з 1,5 міс. після зараження кожні 2-3 міс. Також були використані методи пасирування лімфатичних вузлів і повторного зараження в шкіру мошонки суспензією трепонем аналогічного штаму. Результати дослідів показали, що обробка піддослідних кроликів К6, як і Д23, у період від 30 хв до 2,5 годин з моменту зараження приводить до 100 % захисту тварин від сифілісу. В той же час для Д23 концентрація нижче 0,01 % не дає 100 % результату навіть через 30 хв після зараження. Приклад 6 Лікувальну дію на моделях гнійних ран і перитоніту у експериментальних тварин (пацюки, кролики, морські свинки, собаки – усього більше 100 тварин) проводили відповідно до загальноприйнятих методик, використовуючи бактеріологічні, морфологічні, гістологічні та імунологічні методи дослідження. Отримані дані показали високу терапевтичну активність заявленої композиції, застосовуваної у вигляді водного розчину, мазі та аерозолю при гнійно-запальних захворюваннях і перитоніті у експериментальних тварин. Заявлена композиція виявилася більш ефективним препаратом при лікуванні гнійних ран у порівнянні з прототипом і чистими інгредієнтами (табл. 3). Таблиця 3 Результати дії заявленої композиції на загоєння гнійних ран у експериментальних тварин (пацюки, морські свинки, кролики) у порівнянні з прототипом і чистими інгредієнтами (у днях) Групи тварин 7,2±1,1 20,0±3,5 Лікування Д23 Лікування К7 Лікування К8 Лікування К10 0,1 % водний АО 0,1 % аерозоль АА 35 Повне загоєння Контроль (обробка ран дистильованою водою) 30 Початок регенерації 3,5±0,7 2,3±0,3 2,1±0,3 2,2±0,3 6,1±1,1 5,2±1,3 12,7±1,3 9,4±0,9 9,2±0,9 9,3±0,9 18,0±3,5 17,0±3,1 Приклад 7 Досліджували лікувальну дію заявленого препарату на моделях опіків у мишей. У мишей на депільованій дорсальній поверхні спини викликали контактний термічний опік за допомогою стандартного пристрою. Лікування починали через 24 години після опіку маззю та аерозолем (К7 і К8). Для порівняння застосовували Д6 і Д17 за прототипом. Отримані результати представлені в табл. 4. Як видно з даних табл. 4, достовірне зниження площі ран при лікуванні К7 і К8 починається після 8-ї доби. Це на 4 доби раніше, ніж у Д6 і Д17. Можна стверджувати, що це скорочення відбувається за рахунок синергетичного ефекту. Таблиця 4 Результати планіметрії опікових ран, лікованих маззю та аерозолем 40 Доба Площа опікових ран, см. кв. 5 UA 103968 C2 2 4 6 8 12 15 18 20 5 10 15 Д6 і Д17 0,72±0,05 0,77±0,66 0,80±0,05 0,78±0,10 0,81±0,05 0,36±0,05 0,14±0,04 0,03±0,017 К7 0,80±0,06 0,85±0,07 0,85±0,09 0,83±0,10 0,70±0,06 0,18±0,03 0,08±0,02 0,012±0,002 К8 0,99±0,08 0,81±0,09 0,62±0,06 0,76±0,07 0,24±0,04 0,14±0,03 0,03±0,017 0,01±0,001 Приклад 8 Досліджували дію при гнійно-запальних ураженнях роговиці очей. Досліди проведені на 16 кроликах породи шиншила вагою 2-2,5 кг. Гнійно-запальні ураження роговиці ока викликали шляхом введення всередину суспензії добової культури Staphylococcus aureus штам 209 Р. На 2-4-у добу у 13 кроликів на роговиці ока утворилися виразки розміром 3 × 6 мм з гнійним відокремлюваним на дні. Також спостерігалися явища запальних реакцій: кон'юнктивіт, блефароспазм і ін. Взяті у дослід кролики були розділені на три групи. Тварин першої групи лікували К2. Тварин другої групи лікували очними краплями по Д7 і Д15 (ОКП - очні краплі відповідно до прототипу). Тваринам третьої, контрольної, групи в уражені очі закрапували краплі ізотонічного розчину хлориду натрію. Препарати закрапували щодня тричі протягом усього експерименту. За всіма тваринами щодня проводили спостереження. При цьому контролювали динаміку змін у роговиці очей дослідних і контрольних тварин за раніше описаною методикою. Крім цього, проводили посіви змивів з роговиці очей кроликів на м'ясо-пептоновий бульйон для визначення наявності S. aureus 209 P. Результати дослідів представлені в табл. 5. 6 UA 103968 C2 5 10 15 20 Примітка: 1 група тварин, що одержувала К2; 2 група тварин, що одержувала ОКП; 3 контрольна група тварин. (**) – У дужках кількість оглянутих очей. Наведені дані свідчать, що гнійні виділення та виявлення S. aureus повністю припинилися на 4 добу у всіх тварин, лікованих К2, і на 6 добу – лікованих ОКП. В той же час серед нелікованих тварин гнійні виділення спостерігалися протягом усього періоду експерименту. Розсмоктування гнійного інфільтрату швидше почалося та завершилося у всіх тварин, лікованих К2, на 3 добу, а ОКП – на 5 добу від початку лікування. У тварин, лікованих К2 і ОКП, час початку та завершення розсмоктування гнійного інфільтрату склав відповідно 4 і 10 діб від початку лікування. Епітелізація роговиці очей настала у всіх тварин до 10 і 16 дня від початку лікування К2 і ОКП, відповідно. Таким чином, з наведених вище даних можна зробити висновок, що К2 є високоефективним засобом при лікуванні гнійно-запальних уражень роговиці очей. При цьому терапевтичний ефект К2 вище, ніж у ОКП (очних крапель за прототипом), що випускаються промисловістю (торговельна марка "Окомістин"). Приклад 9 Вивчали протизапальну дію. При цьому використовували раціональний склад комбінованої мазі для зовнішнього лікування алергодерматозів, що містить 7 UA 103968 C2 5 К3+0,025 % бетаметазону. Аналогічний склад з прототипом не дає однорідної консистенції і не може бути використаний як лікарський препарат. Тому протизапальну дію досліджували на моделі аеросильного набряку у пацюків. При цьому її порівнювали з дією широко застосовуваної для цієї мети мазі "Лоринден З" і контролем (неліковані). Було встановлено, що вираженість набряку у пацюків, лікованих К3, в 2,67 раза менше, ніж у контрольних тварин, і в 1,14 раза менше, ніж для препарату порівняння. Результати дослідів представлені в табл.6 Таблиця 6 Протизапальні властивості мазей Мазь Мазь на основі заявленого препарату Мазь "Лоринден З» Контроль (неліковані) 10 15 20 25 30 35 40 Кількість пацюків Приріст маси стоп пацюків, г Інгібуючий ефект, % 12 0,124±0,03 62,4 12 12 0,141±0,01 0,331±0,02 57,0 — Як видно з даних, представлених у табл. 6, мазь на основі заявленого препарату має виражену протизапальну дію. Вона знижує аеросильний набряк в середньому на 62,4 %, і за ефективностю дії трохи перевершує аналог – мазь "Лоринден З". Приклад 10 Досліджували антисептичні властивості супозиторної маси. Антибактеріальну активність К11 вивчали у порівнянні з активністю інгредієнтів у дослідах in vitro методом дифузії в щільні живильні середовища. При проведенні експериментальних досліджень як тест-мікроорганізми були обрані: Грампозитивні коки (Staphylococcus aureus ATCC 6538) Дріжджоподібні гриби (Candida albicans ATCC 885-653) Для вивчення антибактеріальної дії як тест-культуру використовували еталонний штам Staphylococcus aureus ATCC 6538, отриманий в Інституті мікробіології та вірусології Д.К. Заболотного (Україна). Для вивчення антифунгальної дії як тест-культуру використовували еталонний штам Candida albicans ATCC 885-653, отриманий там же. Перед проведенням випробувань перевіряли чистоту кожної культури та її типові властивості за морфологічними та культуральними ознаками. Для визначення антимікробної активності методом дифузії в агар, живильні середовища розплавляли, охолоджували до температури 45 °C і контамінували суспензіями тест-культур. 7 Мікробне навантаження становило приблизно 1 × 10 КУО/мл. По 20 мл контамінованого мікроорганізмами середовища розливали в чашки Петрі і залишали до затвердіння середовища. В шарі живильного агару готували лунки діаметром 8 мм. Досліджуваний препарат К11 розплавляли при температурі 60 °C і вносили по 0,1 мл у попередньо підготовлені лунки. Для порівняння готували супозиторії з 0,07 % Д20 (Д23) або 0,07 % AO або 0,07 % AA. Для порівняння досліджували водні розчини субстанції мірамістин (Д23) в концентраціях, що відповідали препаратам, які випробували. Посіви інкубували в термостатах протягом 24 годин при температурі 35 °C. Після закінчення інкубації вимірювали діаметр зон відсутності росту мікроорганізмів навколо лунки з препаратом, з точністю до 0,1 мм. Кожний дослід проводили, повторюючи по 3 рази. Результати антимікробної активності досліджуваних препаратів, яку визначали in vitro методом дифузії, представлені в таблиці 7. 45 8 UA 103968 C2 Таблиця 7 Супозиторії Найменування препарату Мірамістин, водний 0,07 % Супозиторії Д23 АА К11 АО Діаметр зон затримки росту, мм Staphylococcus aureus – 5,6 4,3 14,3 1,2 Candida albicans – 6,1 5,2 13,2 2,1 Субстанція (Мірамістин) Діаметр зон затримки росту, мм Staphylococcus Candida aureus albicans 9,6 9,0 З табл. 7 також очевидний синергетичний ефект заявленої композиції. ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 1. Лікарський препарат, що включає бензилдиметил[3-(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратованому вигляді, який відрізняється тим, що додатково містить диметил[3-(міристоїламіно)пропіл]аміноксид та/або диметил[3(міристоїламіно)пропіл]амін у прийнятному фармацевтичному розріджувачі при наступному співвідношенні компонентів (% мас.): бензилдиметил[3(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратній формі 0,008-5,0 диметил[3(міристоїламіно)пропіл]аміноксид і/або диметил[3(міристоїламіно)пропіл]амін 0,00005-1,0 прийнятний фармацевтичний розріджувач до 100. 2. Лікарський препарат за п. 1, який відрізняється тим, що має наступне співвідношення компонентів (% мас.): бензилдиметил[3(міристоїламіно)пропіл]амонію хлорид у вигляді моногідрату або в негідратній формі 0,008-2,0 диметил[3(міристоїламіно)пропіл]аміноксид і/або диметил[3(міристоїламіно)пропіл]амін 0,00005-0,01 прийнятний фармацевтичний розріджувач до 100. 3. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить місцевий анестетик з ряду гідрохлоридів: лідокаїн, бупівакаїн, піромекаїн, тримекаїн у кількості (% мас.): 0,1-5,0. 4. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить хлорид натрію у кількості (% мас.): 0,6-1,0. 5. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить протинабрякові засоби з ряду: ксилометазолін, оксиметазолін, нафазолін, фенілефрин, фенілпропаноламін, псевдоефедрин у кількості (% мас.): 0,01-2,0. 6. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить кортикостероїди з ряду: триамцинолон, бетаметазон, флуоцинолон ацетонід, гідрокортизон, галометазон, дексаметазон у кількості (% мас.): 0,1-3,0. 7. Лікарський препарат за п. 1 або 2, який відрізняється тим, що додатково містить антисептики та/або противірусні засоби з ряду: метронідазол, клотримазол, кетоконазол, ацикловір, римантадин у кількості (% мас.): 0,01-5,0. 9 UA 103968 C2 5 8. Лікарський препарат за будь-яким з пп. 1-7, який відрізняється тим, що як фармацевтичний розріджувач містить спирт і/або воду. 9. Лікарський препарат за будь-яким з пп. 1-7, який відрізняється тим, що як фармацевтичний розріджувач містить будь-яку рідку, гелеподібну, мазеву, мийну або тверду основу рослинного, тваринного або синтетичного походження. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical comprising myramistin
Автори англійськоюRudko, Adolina
Автори російськоюРудко Адолина
МПК / Мітки
МПК: A61P 31/00, A61K 31/16, A61K 31/14
Мітки: мірамістин, містить, лікарський, препарат
Код посилання
<a href="https://ua.patents.su/12-103968-likarskijj-preparat-shho-mistit-miramistin.html" target="_blank" rel="follow" title="База патентів України">Лікарський препарат, що містить мірамістин</a>
Попередній патент: Спосіб визначення характеристики відносного рівномірного звуження конструкційного титанового сплаву
Наступний патент: Система оцукрення замісу за одностадійною схемою
Випадковий патент: Спосіб діагностики мітохондропатій