18-метил-19-нор-17-прегн-4-ен-21,17-карболактони, а також лікарський препарат, який їх містить
Номер патенту: 90496
Опубліковано: 11.05.2010
Автори: Больманн Рольф, Мун Ханс-Петер, Біттлер Дітер, Фрітцемайєр Карл-Хайнріх, Фурманн Ульріке, Борден (раніше Курц) Штеффен, Кюнцер Херманн, Есперлінг Петер, Прелле Катя
Формула / Реферат
1. 18-Метил-19-нор-17-прегн-4-ен-21,17-карболактони загальної формули І
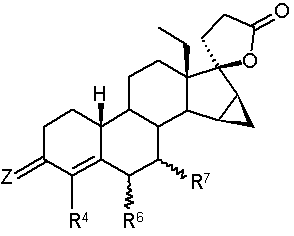 , Формула І
, Формула І
у якій
Z являє собою атом кисню, два атоми водню, угруповання =NOR або =NNHSO2R, причому R означає атом водню або алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю,
R4 означає атом водню, атом галогену, метильну або трифторметильну групу,
R6 і/або R7 можуть знаходитися в α- або β-положенні й незалежно один від іншого означають алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, або
R6 означає атом водню й R7 означає розташовану в α- або β-положенні алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, або
R6 і R7, кожний, означають один атом водню, або
R6 і R7 разом означають розташовану в α- або β-положенні метиленову групу або додатковий зв'язок.
2. Сполуки загальної формули І за п. 1, у якій Z означає атом кисню.
3. Сполуки загальної формули І за п. 1, у якій Z означає угруповання =NOR або =NNHSO2R і R означає атома водню.
4. Сполуки загальної формули І за п. 1, у якій R4 являє собою атом водню.
5. Сполуки загальної формули І за п. 1, у якій R4 являє собою атом хлору.
6. Сполуки загальної формули І за п. 1, у якій R6 означає атом водню й R7 означає метильну групу.
7. Сполуки загальної формули І за п. 1, у якій R6 означає атом водню й R7 означає пропільну групу.
8. Сполуки загальної формули І за п. 1, у якій R6 і R7 разом означають метиленову групу.
9. Сполуки загальної формули І за п. 1, у якій R6 і R7 разом означають подвійний зв'язок.
10. Сполуки загальної формули І за п. 1, а саме
18-метил-15![]() ,16
,16![]() -метилен-3-оксо-19-нор-17-прегна-4,6-дієн-21,17-карболактон,
-метилен-3-оксо-19-нор-17-прегна-4,6-дієн-21,17-карболактон,
18-метил-6![]() ,7
,7![]() -15
-15![]() ,16
,16![]() -диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
18-метил-6![]() ,7
,7![]() -15
-15![]() ,16
,16![]() -диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7![]() ,18-диметил-15
,18-диметил-15![]() ,16
,16![]() -метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7![]() ,18-диметил-15
,18-диметил-15![]() ,16
,16![]() -метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
3-гідроксиламіно-18-метил-6![]() ,7
,7![]() -15
-15![]() ,16
,16![]() -диметилен-19-нор-17-прегн-4-ен-21,17-карболактон,
-диметилен-19-нор-17-прегн-4-ен-21,17-карболактон,
4-хлор-18-метил-6![]() ,7
,7![]() -15
-15![]() ,16
,16![]() -диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7![]() -етил-18-метил-15
-етил-18-метил-15![]() ,16
,16![]() -метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7![]() -етил-18-метил-15
-етил-18-метил-15![]() ,16
,16![]() -метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
18-метил-15![]() ,16
,16![]() -метилен-3-оксо-7
-метилен-3-оксо-7![]() -пропіл-19-нор-17-прегн-4-ен-21,17-карболактон,
-пропіл-19-нор-17-прегн-4-ен-21,17-карболактон,
18-метил-15![]() ,16
,16![]() -метилен-3-оксо-7
-метилен-3-оксо-7![]() -пропіл-19-нор-17-прегн-4-ен-21,17-карболактон.
-пропіл-19-нор-17-прегн-4-ен-21,17-карболактон.
11. Лікарський препарат, який містить щонайменше одну сполуку за п. 1, а також фармацевтично прийнятний носій.
12. Лікарський препарат за п. 11, який додатково містить щонайменше один естроген.
13. Лікарський препарат за п. 12, який містить етинілестрадіол.
14. Лікарський препарат за п. 12, який містить натуральний естроген.
15. Лікарський препарат за п. 14, який містить естрадіол.
16. Лікарський препарат за п. 14, який містить естрадіолвалерат.
17. Лікарський препарат за п. 14, який містить щонайменше один кон'югований естроген.
Текст
1. 18-Метил-19-нор-17-прегн-4-ен-21,17карболактони загальної формули І C2 2 (19) 1 3 90496 4 7 ,18-диметил-15 ,16 -метилен-3-оксо-19-нор17-прегн-4-ен-21,17-карболактон, 3-гідроксиламіно-18-метил-6 ,7 -15 ,16 диметилен-19-нор-17-прегн-4-ен-21,17карболактон, 4-хлор-18-метил-6 ,7 -15 ,16 -диметилен-3оксо-19-нор-17-прегн-4-ен-21,17-карболактон, 7 -етил-18-метил-15 ,16 -метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон, 7 -етил-18-метил-15 ,16 -метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон, 18-метил-15 ,16 -метилен-3-оксо-7 -пропіл-19нор-17-прегн-4-ен-21,17-карболактон, 18-метил-15 ,16 -метилен-3-оксо-7 -пропіл-19нор-17-прегн-4-ен-21,17-карболактон. 11. Лікарський препарат, який містить щонайменше одну сполуку за п. 1, а також фармацевтично прийнятний носій. 12. Лікарський препарат за п. 11, який додатково містить щонайменше один естроген. 13. Лікарський препарат за п. 12, який містить етинілестрадіол. 14. Лікарський препарат за п. 12, який містить натуральний естроген. 15. Лікарський препарат за п. 14, який містить естрадіол. 16. Лікарський препарат за п. 14, який містить естрадіолвалерат. 17. Лікарський препарат за п. 14, який містить щонайменше один кон'югований естроген. Даний винахід відноситься до 18-метил-19нор-17-прегн-4-ен-21,17-карболактонів загальної формули І н-пропільна або н-бутильна група, відповідно ізопропільна, ізо- або трет-бутильна група. R4 переважно являє собою атом водню. Як атом галогену R4 придатні атом фтору, хлору, брому або йоду; переважно хлор. У випадку, коли R6 і/або R7 означає алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, є придатними метильна, етильна, н-пропільна або нбутильна група й відповідно ізо-пропільна, ізо- або трет-бутильна група. R6 і R7 переважно означають атом водню й метильну групу або разом являють собою метиленову групу або подвійний зв'язок. Відповідно до винаходу особливо переважними є сполуки зазначені нижче: 18-метил-15β,16β-метилен-3-оксо-19-нор-17прегна-4,6-дієн-21,17-карболактон 18-метил-6α,7α-15β,16β-диметилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон 18-метил-6β,7β-15β,16β-диметилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон 7α,18-диметил-15β,16β-метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон 7β,18-диметил-15β,16β-метилен-3-οκсο-19нор-17-прегн-4-ен-21,17-карболактон 3-гідроксиламіно-18-метил-6β,7β-15β,16βдиметилен-19-нор-17-прегн-4-ен-21,17карболактон 4-хлор-18-метил-6β,7β-15β,16β-диметилен-3оксо-19-нор-17-прегн-4-ен-21,17-карболактон 7α-етил-18-метил-15β,16β-метилен-3-οκсο-19нор-17-прегн-4-ен-21,17-карболактон 7β-етил-18-метил-15β,16β-метилен-3-οκсο-19нор-17-прегн-4-ен-21,17-карболактон 18-мeтил-15β,16β-мeтилeн-3-oкco-7α-пpoпiл19-нop-17-пpeгн-4-eн-21,17-карболактон 18-метил-15β,16β-метилен-3-οκсο-7β-пропіл19-нор-17-прегн-4-ен-21,17-карболактон. Дроспіренон (6β,7β-15β,16β-диметилен-3οκсο-17-прегн-4-ен-21,17β-карболактон) є новим гестагеном, який міститься, наприклад, у засобі для пероральної контрацепції YASMIN® і в препа у якій Ζ являє собою атом кисню, два атоми водню, угруповання =NOR або =NNHSO2R, причому R означає атом водню або алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, R4 означає атом водню, атом галогену, метильну або трифторметильну групу, R6 і/або R7 може знаходитися в α або β положенні й незалежно один від іншого означає алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, або R6 означає атом водню й R7 означає розташовану в α або β положенні алкільну групу із прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю або R6 і R7 кожний означають один атом водню або R6 і R7 разом означають розташовану α або β положенні метиленову групу або додатковий зв'язок. Ζ переважно означає атом кисню. У випадку, коли Ζ означає угруповання =NOR або =NNHSO2R, то R переважно означає атом водню. Як алкільна група з прямим або розгалуженим ланцюгом, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, придатними є метильна, етильна, 5 раті ANGELIQ® для лікування постменопаузальних розладів (обидва препарати компанії SCHERING AG). На основі його порівняно незначної спорідненості до рецептора гестагену і його досить високої дози для пригнічення овуляції дроспіренон в YASMIN® міститься у відносно високій добовій дозі, що становить 3мг. Дроспіренон відрізняється тим, що додатково до гестагенної дії, він має антагоністичну дію щодо альдостерону (антимінералокортикоїдну), а також антіандрогенну дію. Ці обидві властивості надають дроспіренону в його фармакологічному профілі велику схожість з натуральним гестагеном прогестероном, однак останній на відміну від дроспіренону не має достатньої біодоступності при пероральному введенні. Тому задачею даного винаходу є надати сполуки, які повинні мати більш сильне зв'язування з рецептором гестагену, ніж дроспіренон і в такий спосіб мати більш високу гестагенну ефективність, ніж дроспіренон. В остаточному підсумку, це повинне проявлятися в більш низькій добовій дозі й приводити до більш низької витрати речовини в активній сполуці. Ця задача вирішується за допомогою описаних у даному винаході 18-метил-19-нор-17-прегн4-ен-21,17-карболактонів загальної формули І. Сполуки загальної формули І (і, зокрема, сполука 3b, див. експериментальну частину) необхідно розглядати як структурні ізомери дроспіренону. Нові сполуки в тесті зв'язування гестагенного рецептора при застосуванні цитозоля з гомогенату матки кролика й ЗН-прогестерону, як порівняльна речовина, відрізняються більш високою спорідненістю до рецептора гестагену, ніж дроспіренон і порівнянною спорідненістю до мінералокортикоїдного рецептору з гомогенату печінки щура. При цьому є несподіваним, що зв'язування з рецептором гестагену виявляється в п'ять разів сильнішим, ніж зв'язування з дроспіреноном. Несподівано було виявлено, що сполуки відповідно до винаходу відрізняються сильною гестагенною дією й є дуже ефективними в дослідженні по збереженню вагітності в щурів після підшкірного введення. Проведення дослідження збереження вагітності у щурів: У вагітних самок-щурів відторгнення жовтого тіла (Corpora lutea) або кастрація викликають викидень. За допомогою екзогенного уведення прогестинів (гестагенів) у комбінації з прийнятною дозою естрогену, вдається підтримати вагітність. 90496 6 Дослідження збереження вагітності у оваріектомованих щурів служить для визначення периферичної гестагенної дії сполуки. Вночі в період проеструсу щури паруються. Ранком наступного дня парування контролюють шляхом дослідження вагінального мазка. При цьому наявність сперматозоїдів розцінюється як перший день вагітності, що починається. На восьмий день вагітності тварин, що знаходяться під ефірною анестезією, піддавали оваріектомії. Лікування за допомогою тестованої сполуки й екзогенного естрогену (естрон, 5мкг/кг/доба) здійснювали підшкірно щодня з 8 по 15-й день або по 21-й день вагітності. Перше застосування на 8-й день виконували за 2 години до видалення яєчників. Інтактні контрольні тварини одержували тільки наповнювач. Оцінювання: Наприкінці дослідження (15-й або 21-й день) тварин умертвляють за допомогою подачі СО2 і підраховують живі плоди (плоди з серцем, що б'ється) і імплантаційні місця (що попередньо розсмокталися й мертві плоди, включаючи аутолізи й атрофічні плаценти) в обох рогах матки. Крім того, на 22-й день плоди можуть бути досліджені на наявність можливих пороків розвитку. У матці без плодів або без імплантаційних місць визначають кількість місць нідації за допомогою фарбування 10%-м розчином сульфіду амонію. Відсоток збереження вагітності розраховується як частка із числа живих плодів і загальної кількості місць нідації (як тих, що розсмокталися й мертвих плодів, так і місць нідації). При цьому для тестованої речовини 18-метил-6α,7α-15β,16β-диметилен-3-оксо19-нор-17-прегн-4-ен-21,17-карболактон (сполука За, див. експериментальну частину) була визначена доза, що підтримує вагітність (ED50), яка складає 120мкг/кг/доба. Для дроспіренона це значення становить 3,5мг/кг/доба. Відповідно до винаходу сполуки загальної формули І мають дуже сильну гестагенну дію при одночасному слабкому зв'язуванні з андрогенним рецептором (дисоціація). Крім того, було виявлено, що сполуки відповідно до винаходу мають затримуючу калій, натрійуретичну (антимінералокортикоїдну) дію у адреналектомованих щурів. Виходячи з їх гестагенної ефективності нові сполуки загальної формули І можуть використатися самостійно або в комбінації з естрогеном у лікарських препаратах для контрацепції. Внаслідок їх сприятливого діючого профілю сполуки відповідно до винаходу є особливо придатними для лікування передменструальних розладів, таких як головні болі, депресивні розлади, затримка води й мастодинія. У препаратах для контрацепції дозування сполук відповідно до винаходу повинно становити від 0,01 до 5мг, переважно від 0,01 до 2мг на добу. Добова доза для лікування передменструальних розладів становить приблизно від 0,1 до 20мг. У контрацептивних препаратах гестагенні та естрогенні діючі компоненти переважно застосовуються спільно перорально. Переважно добова доза вводиться однократно. 7 90496 8 У якості естрогенів придатні синтетичні естрогени, переважно етинілестрадіол, а також і местранол. Естроген вводиться в добовій дозі, що відповідає від 0,01 до 0,04мг етинілестрадіолу. Нові сполуки загальної формули І можуть також використатися у лікарських препаратах для лікування перед-, пері- і постменопаузальних розладів, а також у препаратах для гормонозамісної терапії (ГЗТ). У таких препаратах у якості естрогенів у першу чергу підходять натуральні естрогени, насамперед, естрадіол або його складний ефір, наприклад, естрадіолвалерат або також кон'юговані естрогени (CEEs = Conjugated Equine Estrogens), такі, що містяться, наприклад, у препараті PREMARIN ®. Приготування лікарських препаратів на основі нових сполук здійснюють відповідно до відомого способу, при якому діючу речовину використають, при необхідності, в комбінації з естрогеном, з використовуваними в галенових препаратах носіями, розріджувачами, при необхідності покращувачами смаку й т.д., і переводять у бажану форму застосування. Для кращого перорального застосування підходять, зокрема, таблетки, драже, капсули, пігулки, суспензії або розчини. Для парентерального застосування особливо придатні масляні розчини, такі, наприклад, як розчини в кунжутній олії, в рициновій олії та в олії з насіння бавовнику. Для підвищення розчинності можуть використатися розчинники, такі, наприклад, як бензилбензоат або бензиловий спирт. Також речовини відповідно до винаходу можливо вводити в трансдермальні системи й у такий спосіб застосовувати їх крізьшкірно. Нові сполуки загальної формули І відповідно до винаходу одержують як описано нижче. Як вихідну сполуку для нових 18-метил-6,7-15,16диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17карболактонів відповідно до схеми 1 використають, наприклад, сполуку 1 (DE 3 402 329). Введення ∆6-подвійного зв'язку здійснюють, наприклад, за допомогою бромування 3,5дієнаміну або за допомогою модифікованого бромування простого дієнолового ефіру, а також наступного відділення бромистого водню (див. наприклад, В.J. Friend, J.A. Edwards, Organic Reactions in Steroid Chemistry, Nostrand Reinhold Company 1972, cc.265-374). Бромування простого дієнолового ефіру може відбуватися, наприклад, аналогічно до вказівок J.A. Zderic, Humberto Caprio, A. Bowers und Carl Djerassi in Steroids 1, 233 (1963). Відокремлюють бромистий водень шляхом нагрівання 6-бром сполуки з основними реактивами, такими як, наприклад, LiBr або Li2CO3 в апротонних розчинниках типу диметилформаміду при температурі від 50 до 120°С або ж нагріванням 6-бром сполук у розчиннику, такому як колідин або лутидин з одержанням сполуки 2 (приклад 1). Потім сполуку 2 за допомогою метиленування ∆6-подвійного зв'язку відомим способом піддають взаємодії, наприклад, з метилідом диметилсульфоксонію (див. наприклад DE-A 11 83 500, DE-A 29 22 500, ЕР-А 0 019 690, US-A 4,291, 029; Е. J. Corey und M. Chaykovsky, J.Am. Chem. Soc. 84, 867 (1962)) з одержанням сполуки 3, причому одержу ють суміш α- і β-ізомерів (сполуки 3α/3β) (співвідношення залежить від використаних субстратів і становить приблизно 1:1), що може бути розділена, наприклад, хроматографією на окремі ізомери. Введення замісника R4 можуть здійснювати, наприклад, використовуючи в якості вихідної сполуку формули 3, шляхом епоксидування ∆4подвійного зв'язку з перекисом водню при лужних умовах і взаємодією утвореного епоксиду в прийнятному розчиннику з кислотою загальної формули H-R4, причому -R4 являє собою атом галогену або псевдогалогену, або піддають взаємодії з каталітичними кількостями мінеральної кислоти й при необхідності отримані 4-бром сполуки загальної формули І (причому R4 = бром) піддають взаємодії з 2,2-дифтор-2-(фторсульфоніл) складним метиловим ефіром оцтової кислоти в диметилформаміді в присутності йодиду міді (І). 9 Введення 6-метиленової групи можна здійснити, наприклад, використовуючи в якості вихідного похідне 3-аміно-3,5-дієну шляхом взаємодії з формаліном у спиртовому розчині з утворенням 6αгідроксиметильної групи й наступним кислотним відділенням води, наприклад, соляною кислотою в діоксані/воді. Відщеплення води також можна здійснити таким чином, що спочатку гідроксильна група обмінюється на кращу групу, яка уходить, а потім відщеплюється. Як групи, що відщеплюються, придатні, наприклад, мезилат, тозилат або бензоат (див. DE-A 34 02 3 291, ЕР А 0 150 157, US-А 4 584 288; К. Nickisch et al., J. Med. Chem. 34, 2 464 (1991)). Наступна можливість одержання сполук 6метилену складається в безпосередній взаємодії 4(5) ненасичених 3-кетонів з ацеталями формальдегіду в присутності ацетату натрію з, наприклад, оксихлоридом фосфору або пентахлоридом фосфору в прийнятних розчинниках, таких як хлороформ (див. наприклад, К. Annen, Η. Hofmeister, H. Laurent und R. Wiechert, Synthesis 34 (1982)). Сполуки 6-метилену можуть використатися для одержання сполук загальної формули 1, у яких R6 означає метил і R6 і R7 разом утворюють додатковий зв'язок. До того ж можна, наприклад, застосувати спосіб, описаний D. Burn et al. в Tetrahedron 21, 1 619 (1965), у якому ізомеризація подвійного зв'язку досягається нагріванням сполук 6-метилену в етанолі за допомогою 5% каталізатора палладій на вугіллі, що попередньо обробляють або воднем, або нагріванням з невеликою кількістю циклогексену. Також ізомеризацію можна здійснити з каталізатором, який не пройшов попередню обробку, якщо до реакційної суміші додають невелику кількість циклогексену. Появу незначних частин гідрованих продуктів можна усунути додаванням надлишку ацетату натрію. Однак одержання похідних 6-метил-4,6-дієн-3ону можна також здійснювати і безпосередньо (див. К. Annen, Η. Hofmeister, H. Laurent und R. Wiechert, Lieb. Ann. 712 (1983)). Сполуки, у яких R6 являє собою α-метил, можуть бути отримані зі сполук 6-метилену за допомогою гідрування при придатних умовах. Найкращі результати (селективне гідрування екзометиленової функціональної групи) досягаються трансфер-гідруванням (Е.А. Brande, R.P. Linstead und P.W.D. Mitchell, J. Chem. Soc. 3 578 (1954)). Якщо похідні 6-метилену нагрівають у прийнятному розчиннику, такому як, наприклад, етанол, у присутності гідридного донора, наприклад, циклогексену, то одержують похідні ба-метилу з дуже гарним виходом. Незначні частини 6α-метилу сполуки можуть бути піддані ізомеризації в кислому середовищі (див., наприклад, D. Burn, D. N. Kirk і V. Petrow, Tetrahedron 1 619 (1965)). Також можливо цілеспрямоване одержання 6р-алкільних сполук. Для цього 4(5)-ненасичені 3кетони, піддають взаємодії, наприклад, з етиленгліколем, триметилортоформіатом у дихлорметані в присутності каталітичної кількості кислоти, (наприклад, п-толуолсульфонової кислоти) до одержання відповідних 3-кеталей. Під час даної кеталі 90496 10 зації подвійний зв'язок ізомеризується в положення 5(6). Селективне епоксидування цього 5(6)подвійного зв'язку здійснюють, наприклад, із застосуванням органічних перокислот, наприклад, мхлорпероксибензойної кислоти, у прийнятному розчиннику, такому як дихлорметан. Альтернативно до цього епоксидування можуть здійснювати також за допомогою перекису водню в присутності, наприклад гексахлорацетону або 3нітротрифторацетонфенону. Потім утворені 5,6ссепоксиди можуть розкриватися аксіально при застосуванні відповідних галогенидів алкілмагнію або сполук алкіллітію. Таким чином, одержують 5α-гідрокси-бр алкільні сполуки. Розщеплення 3кетозахисної групи може відбуватися з одержанням 5α-гідрокси функціональної групи обробкою при м'яких умовах у кислому середовищі (оцтова кислота або 4н. соляна кислота при 0°С). Основне відщеплення 5α-гідрокси функціональної групи, наприклад, розведеним водяним розчином гідроксиду натрію одержують сполуки 3-кето-4-ену з 6алкільної групою в β положенні. Альтернативно до цього за допомогою розщеплення кеталю при більш сильних умовах (водна соляна кислота або інша сильна кислота) одержують відповідні 6αалкільні сполуки. Отримані сполуки загальної формули І, у яких Ζ означає атом кисню, при бажанні можуть бути переведені за допомогою взаємодії з гідроксиламіногідрохлоридом у присутності третинного аміну при температурі від -20 до +40°С у їх відповідні оксими (загальна формула І з Ζ у значенні =ΝΟΗ, причому гідроксигрупа може бути розташованою син- або анти-). Прийнятними третинними основами є, наприклад, триметиламін, триетиламін, піридин, Ν,Ν-диметиламінопіридин, 1,5-діазабіцикло [4.3.0]нон-5-ен (DBN) і 1,5діазабіцикло[5.4.0]ундец-5-ен (DBU), причому кращим є піридин. Це відбувається аналогічно описаному в заявці WO 98/24801 для одержання відповідних 3-оксііміно похідних дроспіренону. Видалення 3-оксо групи для одержання кінцевого продукту загальної формули І з Ζ у значенні двох атомів водню можна здійснити, наприклад, згідно з наведеними в DE-A 28 05 490 вказівкам за допомогою відновлювального розщеплення тіокеталю 3-кетосполуки. Наступні приклади наведені для більш докладного пояснення винаходу: Приклад 1 18-метил-15β,16β-метилен-3-оксо-19-нор-17прегна-4,6-дієн-21,17-карболактон До розчину 11,0г 18-метил-15β,16β-метилен-3оксо-19-нор-17-прегн-4-ен-21,17-карболактону (DE3402329) в 110мл діоксану додають 11мл складного триетилового ефіру о-мурашиної кислоти, а також 11мл діоксану/сірчаної кислоти (12+0,42). Одержують 14,4г 3-етокси-18-метил15β,16β-метилен-19-нор-17-прегна-3,5-дієн-21,17карболактону як неочищений продукт. Його розчиняють в 380мл ацетону, змішують з 2,3мл піридину, 10,3г ацетату натрію, 28 мл води, а також 7,6г N-бромсукциніміду, і перемішують протягом 0,5 години при температурі крижаної бані. Потім підмішують у крижану воду, осад відфільтровують, 11 промивають водою, осад ресуспендують у дихлорметані, промивають водою, висушують над сульфатом натрію й конденсують у вакуумі. Одержують 17г 6-бром-18-метил-3-оксо-15β,16βметилен-19-нор-17-прегн-4-ен-21,17-карболактону як неочищений продукт. Його розчиняють в 170мл диметилформаміду, перемішують з 6,65г броміду літію, а також 7,87г карбонату літію протягом однієї години при 100°С. Потім підмішують у крижану воду, осад відфільтровують, промивають водою, осад ресуспендують у дихлорметані, промивають водою, висушують над сульфатом натрію й конденсують у вакуумі. Після здійснення хроматографії на силікагелі з гексаном/ацетоном одержують 6,5г 18-метил-15β,16β-метилен-3-оксо-19-нор-17прегна-4,6-дієн-21,17-карболактону (сполука 2 у схемі 1) з температурою плавлення 187°С. Приклад 2 18-метил-6α,7α-15β,16β-диметилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон Розчин 5,8г 18-метил-15β,16β-метилен-3-оксо19-нор-17-прегна-4,6-дієн-21,17-карболактону змішують в 200мл диметилсульфокиду з 9,06г йодиду триметилсульфоксонію й 1,613г гідриду натрію (55%-на суспензія в маслі), і перемішують протягом 20 годин в атмосфері аргону при кімнатній температурі. Потім підмішують у крижану воду, поміщають у слабко кисле середовище, осад відфільтровують, промивають водою, осад ресуспендують у дихлорметані, промивають водою, висушують над сульфатом натрію й конденсують у вакуумі, і хроматографують на силікагелі з гексаном/ацетоном. Після перекристалізації фракції III з 2-пропанолу/ацетону одержують 0,8г 18-метил6α,7α-15β,16β-диметилен-3-оксо-19-нор-17-прегн4-ен-21,17-карболактоу (сполука 3а) у вигляді кристалів з температурою плавлення 262°С. [α]D=+89,7° (метанол, с=10,15мг/мл). Приклад 3 18-метил-6β,7β-15β,16β-диметилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон Відповідно до методу із приклада 2 після здійснення хроматографії одержують як фракцію IV 0,9г 18-метил-6β,7β-15β,16β-диметилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболакгону (сполука 3b) у вигляді твердої речовини з температурою плавлення 189-190°С. [α]D=-121,4° (хлороформ, с=10,7мг/мл) і [α]D=+137,9° (метанол, с=10,63мг/мл). Приклад 4 7α,18-диметил-15β,16β-метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон У розчин 0,4г 18-метил-15β,16β-метилен-3оксо-19-нор-17-прегна-4,6-дієн-21,17-карболактону в 7мл тетрагідофурану додають при кімнатній температурі 12мг хлориду міді І і перемішують протягом 10 хвилин до охолодження до -15°С, змішують із 75мг хлориду алюмінію, при цій температурі перемішують 30 хвилин, змішують по краплях з 0,8мл розчину метилмагнійброміду (3Μ у простому диетиловому ефірі), і перемішують протягом однієї години при -10°С. До сполуки домішують реакційну суміш при -10°С з 4н. соляною кислотою, перемішують 1,5 години при кімнатній температурі, додають у воду, три рази екстрагують складним ети 90496 12 ловим ефіром оцтової кислоти, висушують над сульфатом натрію, конденсують у вакуумі, і хроматографують на силікагелі з гексаном/складним етиловим ефіром оцтової кислоти. Після перекристалізації фракції І одержують 182мг 7α,18диметил-15β,16β-метилен-3-оксо-19-нор-17-прегн4-ен-21,17-карболактону у вигляді кристалів з температурою плавлення 250°С. [α]D=53,1+/-0,3° (хлороформ, с=10,3мг/мл). Приклад 5 7β,18-диметил-15β,16β-метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон Відповідно до методу із приклада 4 після здійснення хроматографії одержують як фракцію II 36мг 7β,18-диметил-15β,16β-метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон у вигляді твердої речовини з температурою плавлення 226°С. [α]D=9,0+/-0,5° (хлороформ, с=10,2мг/мл). Приклад 6 7β-етил-18-метил-15β,16β-метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон У розчин 0,5г 18-метил-15β,16β-метилен-3оксо-19-нор-17-прегна-4,6-дієн-21,17-карболактону в 10мл тетрагідрофурану додають при кімнатній температурі 15мг хлориду міді І і перемішують протягом 10 хвилин до охолодження до -15°С, змішують з 93мг хлориду алюмінію, при цій температурі перемішують 30 хвилин, змішують по краплях з 1,0мл розчину етилмагнійброміду (3Μ у простому диетиловому ефірі), і перемішують протягом однієї години при -10°С. До сполуки домішують реакційну суміш при -10°С з 3мл 2н. соляної кислоти, перемішують 0,5 години при кімнатній температурі, додають у воду, три рази екстрагують складним етиловим ефіром оцтової кислоти, висушують над сульфатом натрію, конденсують у вакуумі, і хроматографують на силікагелі з гексаном/складним етиловим ефіром оцтової кислоти. Після перекристалізації фракції І одержують 180мг 7α-етил-18-метил-15β,16β-метилен-3-оксо-19-нор17-прегн-4-ен-21,17-карболактону у вигляді кристалів з температурою плавлення 205-208°С. [α]D=+34,4+/-0,3° (хлороформ, с=10,3мг/мл) Приклад 7 7β-етил-18-метил-15β,16β-метилен-3-оксо-19нор-17-прегн-4-ен-21,17-карболактон Відповідно до методу із приклада 6 після здійснення хроматографії одержують як фракцію II 110мг 7β-етил-18-метил-15β,16β-метилен-3-оксо19-нор-17-прегн-4-ен-21,17-карболактон у вигляді твердої речовини з температурою плавлення 169171°С. [α]D=+30,8+/-0,5° (хлороформ, с=10,1мг/мл). Приклад 8 18-метил-15β,16β-метилен-3-оксо-7α-пропіл19-нор-17-прегн-4-ен-21,17-карболактон У розчин 0,5г 18-метил-15β,16β-метилен-3оксо-19-нор-17-прегна-4,6-дієн-21,17-карболактону в 10мл тетрагідрофурану додають при кімнатній температурі 15мг хлориду міді І і перемішують протягом 10 хвилин до охолодження до -15°С, змішують із 93мг хлориду алюмінію, при цій температурі перемішують 30 хвилин, змішують по краплях з 1,5мл розчину пропілмагнійброміду (2Μ у тетрагідрофурану), і перемішують протягом однієї години при -10°С. До сполуки домішують реак 13 90496 ційну суміш при -10°С з 3мл 2н. соляної кислоти, перемішують 0,5 години при кімнатній температурі, додають у воду, три рази екстрагують складним етиловим ефіром оцтової кислоти, висушують над сульфатом натрію, конденсують у вакуумі, і хроматографують на силікагелі з гексаном/складним етиловим ефіром оцтової кислоти. Після перекристалізації фракції І одержують 177мг 18-метил15β,16β-метилен-3-оксо-7α-пропіл-19-нор-17прегн-4-ен-21,17-карболактону у вигляді кристалів з температурою плавлення 167,5°С. [α]D=+31,2+/0,3° (хлороформ, с=10,1мг/мл). Комп’ютерна верстка А. Рябко 14 Приклад 9 18-метил-15β,16β-метилен-3-оксо-7β-пропіп19-нор-17-прегн-4-ен-21,17-карболактон Відповідно до методу із приклада 8 після здійснення хроматографії одержують як фракцію IІ 105мг 18-метил-15β,16β-метилен-3-оксо-7βпропіл-19-нор-17-прегн-4-ен-21,17-карболактону у вигляді твердої речовини з температурою плавлення 90,9°С. [α]D=+27,4+/-0,4° (хлороформ, с=10,3мг/мл). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською18-methyl-19-nor-17-pregn-4-en-21,17-carbolactones and pharmaceutical preparations comprising the same
Автори англійськоюBohlmann Rolf, Bittler Dieter, Kuenzer Hermann, Esperling Peter, Muhn Hans-Peter, Fritzemeier Karl-Heinrich, Fuhrmann Ulrike, Prelle Katja, Borden (Frueher Kurz) Steffen
Назва патенту російською18-метил-19-нор-17-прегн-4-эн-21,17-карболактоны, а также лекарственный препарат, который их содержит
Автори російськоюБольманн Рольф, Биттлер Дитер, Кюнцер Херманн, Эсперлинг Петер, Мун Ханс-Петер, Фритцемайер Карл-Хайнрих, Фурманн Ульрике, Прелле Катя, Борден (раньше Курц) Штеффен
МПК / Мітки
МПК: C07J 53/00, A61P 5/34, A61K 31/585
Мітки: лікарський, також, препарат, містить, 18-метил-19-нор-17-прегн-4-ен-21,17-карболактони
Код посилання
<a href="https://ua.patents.su/7-90496-18-metil-19-nor-17-pregn-4-en-2117-karbolaktoni-a-takozh-likarskijj-preparat-yakijj-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">18-метил-19-нор-17-прегн-4-ен-21,17-карболактони, а також лікарський препарат, який їх містить</a>
Попередній патент: Рангове прогнозування на основі пропускної здатності в мімо-схемі
Наступний патент: Інтегрована система цифрового вибіркового виклику
Випадковий патент: Спосіб кодування і передавання інформації із захистом та пристрій для його реалізації











