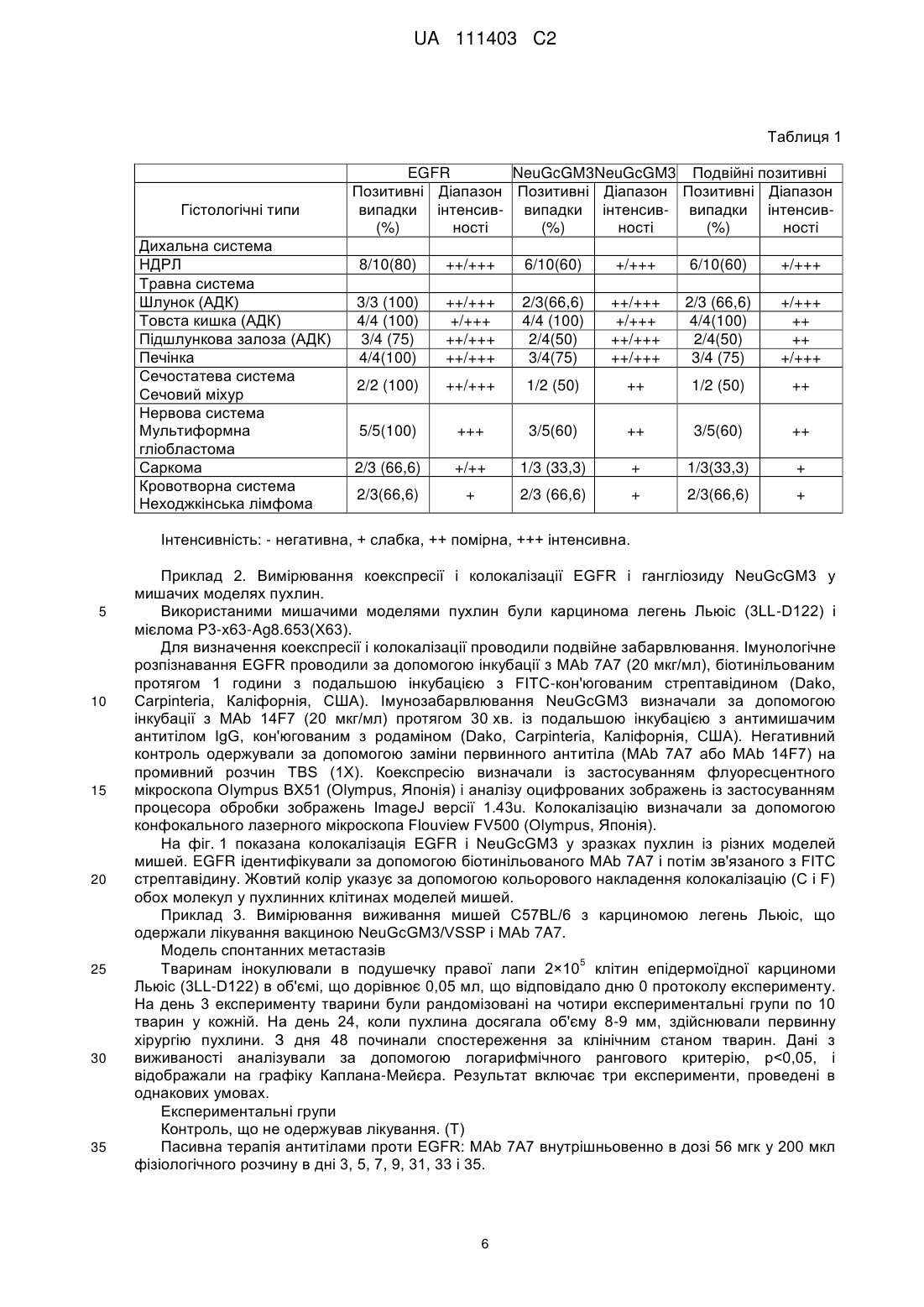
Фармацевтичні композиції для лікування пухлин, експресуючих egfr і n-гліколілгангліозид gm3 (neugсgm3)
Номер патенту: 111403
Опубліковано: 25.04.2016
Автори: Бланко Сантана Рансес, Лєон Монсон Калєт, Карр Перес Адріана, Барросо Альварес Марія дель Кармен, Монтеро Касіміро Хосе Енріке, Масіас Абраам Ампаро Емілія, Гонсалес Паломо Адіс
Формула / Реферат
1. Композиція для лікування злоякісного новоутворення, яка містить моноклональне антитіло проти рецептора епідермального фактора росту (EGFR) і вакцину проти N-гліколілгангліозиду GM3 (NeuGcGM3).
2. Композиція за п. 1, у якій сполука проти рецептора EGF являє собою гуманізоване моноклональне антитіло німотузумаб.
3. Композиція за п. 1, в якій вакцина має NeuGcGM3/частинки дуже малого розміру (VSSP) як активний інгредієнт.
4. Композиція за п. 1, у якій вакцина являє собою антиідіотипову вакцину ракотумомаб, ад'ювовану оксидом алюмінію.
5. Композиція за п. 1, де злоякісне новоутворення являє собою пухлину, яка коекспресує мішені EGFR і гангліозид NeuGcGM3.
6. Композиція за п. 5, де злоякісне новоутворення являє собою злоякісне новоутворення, вибране із групи, яка містить пухлини легень, молочної залози, травної системи, сечостатевої системи і саркоми, які походять із нейроектодермальної тканини і лімфопроліферативних захворювань.
7. Композиція за п. 2, в якій дозування антитіла проти EGFR лежить у діапазоні приблизно від 100 до 400 мг.
8. Композиція за п. 3, де доза вакцини NeuGcGM3/VSSP лежить у діапазоні приблизно від 0,1 до 2 мг.
9. Композиція за п. 4, де доза антиідіотипової вакцини лежить у діапазоні приблизно від 0,1 до 2 мг.
Текст
Реферат: Даний винахід стосується композиції для лікування злоякісного новоутворення, яка містить моноклональне антитіло проти рецептора епідермального фактора росту (EGFR) і вакцину проти N-гліколілгангліозиду GM3 (NeuGcGM3). UA 111403 C2 (12) UA 111403 C2 UA 111403 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується галузі медицини людини, зокрема, лікування пухлин, які надекспресують EGFR і N-гліколілгангліозид (NeuGcGM3). ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Рецептор епідермального фактора росту (EGFR) є однією з молекулярних мішеней, найбільш використовуваних у сучасній клінічній оцінці. Ця молекула надекспресується в різних епітеліальних тканинах людини (Yarden, Y., and Sliwkowski M. X., Nat. Rev. Mol. Cell Biol. 2001, 2:127-137). Для інгібування функції рецептора EGF у терапії найчастіше використовуються два методи лікування: нейтралізація моноклональних антитіл (МАb) і застосування молекул низькомолекулярних речовин, які інгібують активність тирозинкінази (TKI, інгібітор тирозинкінази) (Ciardiello, F., and Tortora G., N. Engl. J. Med. 2008, 358:1160-1174). Хоча також було показано, що вакцина з позаклітинним доменом EGFR при використанні частинок дуже малого розміру (VSSP) як ад'юванту давала антиметастатичний ефект на моделі карциноми легень Льюіс у миші (Sаnсhеz Ramirez B., et al, Int. J. Cancer. 2006, 119:2190-2199). Лікування моноклональними антитілами проти EGFR сприяє регресії пухлини за допомогою переривання онкогенних сигналів і індукції уродженого механізму імунної відповіді, опосередковуваного рецептором Fc (Martinelli, E., et al, Clin. Exp. Immunol. 2009, 158:1-9). Було отримано кілька моноклональних антитіл людини проти EGFR, зокрема: цетуксимаб (Garrett CR, and Eng C., Expert Opin Biol Ther. 2011; 11:7, 937-49) і німотузумаб (Mateo C, Immunotechnology 1997; 3:71-81). Був описаний протипухлинний ефект німотузумабу в терапії різних пухлин, які надекспресують EGFR (Crombet T, et al, Cancer Biol Therapy. 2006, 5:375-379), або в комбінації з іншими методами лікування (Crombet T, et al, J Clin Oncol. 2004, 22:1646-1654; Zhao KL, et al, Invest New Drugs. 2011. Попередня публікація на сайті 8 вересня). З іншого боку, МАb 7A7, продуковані проти EGFR миші, продемонстрували протипухлинний ефект, опосередковуваний Т-клітинами, у лікуванні карциноми легень Льюіс (Garrido G., et al, Cancer Immunol Immunother. 2007, 56:1701-1710). Ще однією з найбільш вивчених мішеней є гангліозиди, які являють собою глікосфінголіпіди, що у своїй структурі включають сіалову кислоту. Ці молекули присутні в нормальних тканинах і надекспресуються в пухлинних тканинах (Zhang S, et al. Int J Cancer 73:42-49, 1997). Існує дві форми сіалової кислоти: N-ацетильована і N-гліколільована, остання описана як присутня в пухлинах людини (Malykh Y N., et al, Biochimie. 2001, 83:7 623-634) як у гангліозидах (Kawai T. et al, 1991 Cancer. Res. (51) 1242-1246), так і в N-гліколільованих глікопротеїнах (Devine P.L., et al, Cancer Research, 1991, 51:21, 5826-5836). З цієї причини ці молекули були ідентифіковані в багатьох злоякісних пухлинах, що робить їх привабливими мішенями для лікування злоякісного новоутворення. Зокрема, гангліозид NeuGcGM3 специфічно розпізнається МАb 14F7 (Carr A. et al, Hybridoma, 2000, 19:3, 241-247). Цей гангліозид був ідентифікований у різних пухлинах різними способами (Blanco R., et al, ISRN Pathology. 2011, Article ID 953803, 10 pag., Marquina et al, Cancer Research. 1996, 56:22, 5165-5171). Була описана активна імунотерапія проти NeuGcGM3 у пухлинах з використанням молекулярної вакцини NeuGcGM3/VSSP (Estevez F., et al, Vaccine. 1999, 18:190-197), яка продемонструвала свою імуногенність і свою безпеку в пацієнтів із раком молочної залози на пізній стадії (Carr A., et al, JCO. 2003, 21:1015-1021). Крім того, на доклінічній стадії було показано, що її потужна протипухлинна дія (протиметастатична) опосередкована механізмом клітинної відповіді клітин NK і CD8+ (Labrada M., et al, Expert Opin. Biol. Ther. 2010, 10:2, 153162). У той же час, протипухлинна дія була викликана в пацієнтів з недрібноклітинним раком легень, імунізованих антиідиотиповою вакциною (антиідиотипове моноклональне антитіло 1E10, ракотумомаб, що імітує N-гліколільовані гангліозиди (Alfonso S., et al, Canser Biology & Therapy. 2007, 6:12, 1847-1852). Опубліковані результати з цією вакциною демонструють її імуногенність і безпеку (Alfonso M., et al, Journal of Immunology. 2002, 168:2523-2529). EGFR у мембранних мікродоменах відіграє істотну роль у попередженні росту пухлинних клітин. Було показано, що гангліозид GM3 інгібує EGFR-залежну проліферацію в найрізноманітніших клітинних лініях як in vivo, так і in vitro. GM3 інгібує кіназну активність EGFR (автофосфорилування EGFR). Гангліозид GM3 інгібує автофосфорилування кіназного домену EGFR. GM3 має потенційну здатність алостерично регулювати структурний перехід із неактивної форми до сигналізації за допомогою димеру EGFR для того, щоб запобігати автофосфорилуванню внутрішньоклітинного кіназного домену в сайті зв'язування ліганду (Coskun U., et al, PNAS. 2011, 108:22, 9044-9048). Зміни в складі гангліозидів у мембрані відіграють важливу роль у регуляції передачі сигналу за допомогою EGFR (Zurita AR., et al, Biochem. J. 2001, 35:465-472). 1 UA 111403 C2 5 10 15 20 25 30 35 40 45 50 55 60 Обнадійливі результати очікуються при одночасному або чергованому медичному застосуванні методів протипухлинного лікування (Takeda K. et al, Cancer Sci., 2007; 98:9, 12971302). Але не всі схеми застосування методів протипухлинного лікування дають на практиці позитивні і синергетичні результати. У клінічному дослідженні фази III метастатичного колоректального раку, у якому використовували МАb антитіла проти EGFR (цетуксимаб) і МАb проти фактора росту ендотелію судин (бевацизумаб) поряд із прийомом потужних хіміотерапевтичних препаратів, спостерігали погіршення еволюції злоякісного новоутворення, що також приводило до серйозних побічних ефектів, порівняно з пацієнтами, які одержували тільки бевацизумаб і хіміотерапію (Tol J., et al, N Engl J Med. 2009; 360:6563-72). Успішна реалізація лікування різними методами в пацієнта є результатом специфічних функціональних залежностей між вибраними мішенями для цих методів лікування, локалізації пухлини, а також характеру методів лікування, застосовуваних у кожному випадку (антитіла, вакцини або інші). В даний час у літературі є свідчення структурного і функціонального взаємовідношення між гангліозидами і EGFR у пухлинних клітинах. Проте, практичне використання цього взаємовідношення в успішному застосуванні методів лікування в того самого пацієнта, спрямованих проти мішеней EGFR і гангліозидів, не розглядалося ні в клінічних, ні в доклінічних дослідженнях. Новизна даного винаходу полягає в зробленій уперше доклінічній і клінічній демонстрації синергетичного зусилля протипухлинної активності, яка виникає при застосуванні препаратів антитіл проти EGFR і анти-NeuGcGM3 вакцин, у пухлинах, коекспресуючих дані мішені. ОПИС ВИНАХОДУ Даний винахід стосується фармацевтичних композицій проти злоякісних захворювань, спрямованим конкретно на мішені EGFR і N-гліколілгангліозид GM3 з метою посилення терапевтичного ефекту, який здійснюється застосуванням препаратів проти цих мішеней окремо. В одному з варіантів здійснення даний винахід включає вакцини, які націлені на Nгліколіл-GM3, і антитіла проти EGFR. В іншому варіанті здійснення даний винахід включає вакцини, які націлені на N-гліколіл-GM3, і вакцини, які націлені на EGFR. В інших варіантах здійснення даного винаходу вакцина проти гангліозидної мішені включає вакцини, такі, як: вакцина NeuGcGM3/VSSP і/або антиідиотипова вакцина (МАb ракотумомаб, ад'ювоване оксидом алюмінію). В іншому варіанті здійснення даний винахід включає застосування препаратів з антитілами проти EGFR, таких, як МАb німотузумаб і/або вакцина EGFR. В іншому варіанті здійснення даний винахід стосується композиції, що включає сполуку проти рецептора EGF і сполуку проти гангліозиду NeuGcGM3, для використання в лікуванні злоякісного новоутворення. В іншому аспекті даний винахід стосується фармацевтичної композиції, що включає будьяку сполуку, описану вище, у суміші з фармацевтично прийнятним наповнювачем. Сполуки даного винаходу можуть бути використані як лікарські засоби і можуть бути використані для одержання лікарських засобів, зокрема лікарських засобів для лікування таких станів, як злоякісне новоутворення. В іншому варіанті здійснення терапевтичні композиції даного винаходу можуть бути використані для лікування злоякісного новоутворення, зокрема, пухлин людини різної локалізації. Переважно, терапевтичні композиції за даним винаходом використовують для лікування таких пухлин, які одночасно експресують EGFR і N-гліколільований варіант гангліозидів. Найбільш переважно використовують для лікування пухлин легень, молочної залози, травної системи, сечостатевої системи і саркоми, які походять від нейроектодермальної тканини і лімфопроліферативних захворювань. Може бути отримана будь-яка придатна композиція сполуки, описаної вище, для введення за допомогою способів, відомих у даній галузі техніки. Вибір корисних наповнювачів або носіїв може бути досягнутий без зайвого експериментування на основі передбачуваного шляху введення і фізичних властивостей сполуки, що вводиться. Може бути використаний будь-який придатний шлях уведення відповідно до критерію лікаря, що лікує пацієнта, включаючи, але без обмеження: парентеральний, внутрішньовенний, внутрішньом'язовий, трансдермальний, місцевий і підшкірний. Одержання придатних композицій для кожного шляху уведення відоме в даній галузі техніки. Композиція кожної речовини часто включає розріджувач і, у деяких випадках, ад'юванти, буфери, консерванти і т. п. Ці сполуки можуть бути також введені у вигляді композицій ліпосом або мікроемульсій. Для ін'єкції можуть бути отримані препарати в звичайних формах, таких, як: рідкі розчини або суспензії або тверді форми, придатні для розчинення або суспендування в рідині перед 2 UA 111403 C2 5 10 15 20 25 30 35 40 45 50 55 ін'єкцією. Придатні наповнювачі включають, наприклад, воду, фізіологічний розчин, декстрозу й аналогічні сполуки. Сполуки даного винаходу можна використовувати окремо або в поєднанні з іншим терапевтичним засобом. У конкретних варіантах здійснення даний винахід стосується комбінації зі звичайною хіміотерапією і/або випромінюванням, використовуваними для типу пухлини, що піддається лікуванню. В іншому варіанті здійснення даний винахід також стосується одночасного, зі зрушенням за часом або чергованого застосування методів лікування, спрямованих проти мішеней EGFR і Nгліколілгангліозиду GM3, для лікування злоякісного новоутворення. Сполуку проти EGFR і сполуку(и) проти мішені N-гліколілгангліозид GM3 вводять окремо, навіть у різний час і з різними частотами. Обидві сполуки можуть бути введені будь-яким відомим шляхом, таким, як: підшкірний, внутрішньовенний, внутрішньошкірний, внутрішньом'язовий або внутрішньочеревний і тому подібні. У багатьох варіантах здійснення щонайменше один і, необов'язково, два терапевтичні засоби можуть бути введені парентерально. Коли сполука або композиція даного винаходу використовуються в поєднанні з іншим протираковим засобом, даний винахід пропонує, наприклад, одночасне, зі зрушенням за часом або черговане лікування. Таким чином, сполуку(и) даного винаходу можна вводити одночасно в окремих фармацевтичних композиціях, причому сполуку даного винаходу можна вводити до або після іншого протиракового засобу з різницею, що становить секунди, хвилини, години, дні або тижні. Даний винахід пропонує способи попередження і/або інгібування росту пухлини, що включають уведення комбінації сполук, описаних у даному документі, індивіду, який потребує цього, у кількості, ефективній для попередження або зменшення проліферації пухлини. У деяких варіантах здійснення проліферація пухлини пов'язана з пухлиною в різних клінічних стадіях за умови, що пухлини коекспресують EGFR і N-гліколіл-GM3. У конкретному варіанті здійснення даний винахід стосується пухлин легень, молочної залози, травної системи, сечостатевої системи і саркоми, що походять від нейроектодермальної тканини і лімфопроліферативних захворювань. Даний винахід також включає способи лікування злоякісного новоутворення в індивіда, який потребує такого лікування, що включають способи: введення індивіду терапевтично ефективної кількості сполуки проти EGFR, використовуваної для лікування такого захворювання, і введення індивіду вакцини NeuGcGM3 або антиідиотипової вакцини в кількості, ефективній для посилення бажаного ефекту. Поліпшення відповідно до даного винаходу стосується часткової або повної регресії або стабілізації клінічних симптомів захворювання. В іншому варіанті здійснення даного винаходу поліпшення означає зменшення розміру пухлини і/або індукування підвищеної виживаності в індивіда. У визначеному варіанті здійснення даний винахід включає спосіб, що включає першу фазу індукування і другу фазу підтримки. У конкретному варіанті здійснення фаза індукування включає введення пацієнту вакцини з анти-EGFR у дозі в діапазоні від приблизно 0,1 до 2 мг протягом періоду часу, що становить приблизно від 7 до 14 днів, протягом приблизно від 8 до 14 тижнів. Протягом цього періоду пацієнтам проводять антигангліозидну NeuGcGM3 терапію, яка включає вакцину NeuGcGM3 або антиідиотипову вакцину в дозі в діапазоні від приблизно 0,1 до 2 мг, з інтервалами, що становлять приблизно від 7 до 14 днів. Даний винахід включає спосіб, який включає введення пацієнту пасивної терапії за допомогою антитіл проти EGFR у дозі в діапазоні від приблизно 100 до 400 мг протягом часового інтервалу від приблизно 6 до 10 тижнів. В іншому варіанті здійснення терапія антитілами проти EGFR включає уведення вакцини проти EGFR у дозах, що лежать у діапазоні від приблизно 0,1 до 2 мг, з часовими інтервалами, що становлять приблизно від 7 до 14 днів. Протягом цього періоду пацієнти повинні додатково одержувати вакцину NeuGcGM3 або антиідиотипову вакцину в дозах у діапазоні від приблизно 0,1 до 2 мг із часовими інтервалами, що становлять приблизно від 7 до 14 днів. В іншому варіанті здійснення друга фаза способу лікування даного винаходу включає схему лікування, розроблену для введення як підтримувальної терапії, у той час, як не спостерігається токсичність і/або клінічні симптоми захворювання. У підтримувальній фазі вакцини переважно вводять у дозах, описаних вище, і з часовими інтервалами, що становлять приблизно від 1 до 3 місяців. В іншому варіанті здійснення введення при пасивній терапії здійснюють з інтервалом від приблизно 14 днів до 3 місяців. Проведення терапії за схемою можна здійснювати протягом періоду часу від приблизно 1 року до 5 років. 3 UA 111403 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення терапевтичний засіб, спрямований на EGFR, і вакцину NeuGcGM3 або антиідиотипову вакцину вводять одночасно. Терапевтичний засіб, спрямований на EGFR, і вакцину NeuGcGM3 або антиідиотипову вакцину іноді застосовують до індивіда в той самий час. У деяких варіантах здійснення антигангліозидну NeuGcGM3 терапію можна вводити за допомогою підшкірних, внутрішньовенних, внутрішньошкірних, внутрішньом'язових або внутрішньочеревних ін'єкцій, у той час, як терапію антитілами проти EGFR можна проводити підшкірно, внутрішньовенно або внутрішньом'язово. В інших варіантах здійснення ділянку уведення визначають за наявністю аферентних лімфатичних вузлів. В іншому варіанті здійснення під час застосування терапій фіксують деякі біохімічні і візуалізаційні параметри пацієнтів. Клітинний і гуморальний імунітет переважно аналізують із використанням крові пацієнтів. Аналізи крові виконуються з частотою в діапазоні від щотижневої до кожні шість місяців. "Коекспресія", як використовується в даному винаході, означає, що обидві мішені експресуються, але можуть мати або не мати близьке структурне споріднення; робочим критерієм для цього визначення є визначення експресії EGFR і N-гліколільованого гангліозиду (NeuGcGM3) за допомогою подвійного забарвлювання з використанням флуоресцентного мікроскопа і процесора, що здатний до накладення зображень. "Колокалізація", як використовується в даному винаході, стосується близькості обох мішеней у структурі; робочим критерієм для цього визначення є визначення експресії EGFR і Nгліколільованого гангліозиду (NeuGcGM3) за допомогою подвійного забарвлювання з використанням конфокального мікроскопа. У ще одному варіанті здійснення даний винахід стосується застосування сполуки проти EGFR і сполуки проти гангліозиду NeuGcGM3 для одержання лікарського засобу для уповільнення росту пухлини в пацієнта відповідно до режиму лікування, що включає: (a) спочатку введення пацієнту лікарського засобу, який включає сполуку проти рецептора EGF, і (b) потім уведення тому ж пацієнту лікарського засобу, який включає сполуку проти гангліозиду NeuGcGM3. Уведення можна здійснювати в зазначеному порядку або в зворотному порядку, тобто спочатку введення пацієнту лікарського засобу, який включає сполуку проти гангліозиду NeuGcGM3, і потім уведення тому ж пацієнту лікарського засобу, який включає сполуку проти рецептора EGF. У конкретному варіанті здійснення даний винахід включає набір реагентів для лікування пухлин, які коекспресують мішені EGFR і гангліозид NeuGcGM3; згаданий набір включає одночасне, зі зрушенням за часом або черговане введення сполуки проти EGFR і іншої сполуки проти гангліозиду NeuGcGM3. Визначення коекспресії EGFR і N-гліколільованого гангліозиду (NeuGcGM3) у пухлинах людини різної локалізації Вимірювання експресії терапевтичних мішеней EGFR і NeuGcGM3 у пухлинах можна здійснювати за допомогою будь-якого зі способів, описаних для таких цілей у даній галузі техніки. Таке вимірювання здійснюють у пухлинах різної локалізації і походження, на зразках пухлин, раніше зафіксованих у формаліні, або на зрізах свіжих тканин. У переважному варіанті здійснення детектування здійснюють із використанням імунологічних методів розпізнавання варіантів EGFR і N-гліколільованого GM3. Зокрема, можна використовувати окремо імуногістохімію і мікроскопію світлого поля для імунологічного розпізнавання обох молекул, або імунофлуоресценцію і флуоресцентну мікроскопію для визначення коекспресії, або імунофлуоресценцію і конфокальну мікроскопію для визначення колокалізації. У переважних варіантах здійснення даного винаходу EGFR можна детектувати за допомогою МАb ior egf/R3m (5-20 мкг/мл), описаного в ЕР 0586002B1, а NeuGcGM3 можна детектувати за допомогою МАb 14F7 (5-25 мкг/мл), описаного в US 6429295 або ЕР 0972782B1. В одному варіанті здійснення даного винаходу для імунологічного розпізнавання за однією з двох молекул (просте забарвлювання) як систему детектування можна використовувати Dako, R LSAB Peroxidase System, DAB (Dako, Carpinteria, Каліфорнія, США). З огляду на, що EGFR знаходиться на цитоплазматичній мембрані пухлинних клітин, у той час, як N-гліколіл-GM3 знаходиться в мембрані й у цитоплазмі, імунологічне розпізнавання розглядається як позитивне, коли інтенсивність реакції становить 20 % позитивних результатів або більше. У переважному варіанті здійснення коекспресію обох молекул можна детектувати із застосуванням методу подвійного забарвлювання й аналізувати за допомогою флуоресцентної 4 UA 111403 C2 5 10 15 20 25 30 35 40 45 50 мікроскопії тільки в тих зразках пухлини, де імунологічне розпізнавання раніше виявилося позитивним для обох молекул окремо. При цьому колокалізацію обох молекул можна детектувати із застосуванням методу подвійного забарвлювання й аналізувати за допомогою конфокальної флуоресцентної мікроскопії. У переважному варіанті здійснення імунологічне розпізнавання EGFR здійснюють за допомогою інкубації з МАb Ior egf/R3m (5-20 мкг/мл) протягом 1 години, за тим йде антитіло IgG, кон'юговане з родаміном (Dako, Carpinteria, Каліфорнія, США). В іншому переважному варіанті здійснення імунодетекцію NeuGcGM3 здійснюють з використанням біотинільованого МАb 14F7 (5-20 мкг/мл), 30 хв. За чим йде FITCкон'югований стрептавідин (Dako, Carpinteria, Каліфорнія, США). Наступні приклади ілюструють переважний варіант здійснення даного винаходу і, отже, служать для його ілюстрації, але вони ні в якому разі не повинні розглядатися як обмеження. КОРОТКИЙ ОПИС ФІГУР Фіг. 1. EGFR колокалізується з гангліозидом NeuGcGM3 у різних пухлинах мишей. Колокалізація (С і F) EGFR і гангліозиду NeuGcGM3 у легеневих метастазах, індукованих у епідермоїдній карциномі Льюіс (A-C) і мієломі P3-X63-Ag.8653 миші (D-F). Фіг. 2. Терапія антитілами проти EGFR (МАb 7A7) у комбінації з антигангліозидною вакциною NeuGcGM3 (NeuGcGM3/VSSP) синергічно підвищує виживаність мишей C57BL/6 із карциномою легені Льюіс. Фіг. 3. Об'єктивна відповідь на пасивну терапію проти EGFR (німотузумаб) і антигангліозидну вакцину NeuGcGM3 (ракотумомаб/оксид алюмінію) у пацієнта з недрібноклітинною карциномою легень. Фіг. 4. Несподівана клінічна відповідь на терапії антитілами проти EGFR (німотузумаб) у комбінації з гангліозидною вакциною NeuGcGM3 (NeuGcGM3/VSSP) у пацієнта з ретроперитонеально-перипанкреатичною гемангіоперицитомою. ПРИКЛАДИ Приклад 1. Вимірювання коекспресії EGFR і гангліозиду NeuGcGM3 у різних пухлинах людини. Зразки пухлини фіксували в нейтральному забуференому формаліні й обробляли методом включення парафіну, що відомий фахівцям у даній галузі техніки. Отримані зрізи тканин, які мають товщину 5 мікронів, витримували при 60 °C протягом 30 хв., депарафінували і регідратували, послідовно зменшуючи кількість спирту, витримували в дистильованій воді протягом 10 хвилин і промивали TBS протягом 5 хвилин. Реакційну здатність загального білка тканини блокували за допомогою комерційно доступного розчину (Dako, Carpinteria, Каліфорнія, США) протягом 30 хв. EGFR імунодетектували з використанням ior egf/R3m (20 мкг/мл) протягом 1 години. Імунологічне розпізнавання NeuGcGM3 проводили з використанням 14F7 (МАb 20 мкг/мл) протягом 30 хв. Після реакції первинних антитіл в обох випадках використовували систему виявлення Dako, LSABR Peroxidase System, DAB (Dako, Carpinteria, Каліфорнія, США). Зрізи тканин обезводнювали і використовували контраст гематоксилін Майєра (Dako, Carpinteria, Каліфорнія, США). Негативний контроль одержували за допомогою заміни первинного антитіла (МАb Ior egf/R3m або МАb 14F7) на промивний розчин TBS (1x), а карциному проток молочної залози використовували як позитивний контроль. За імунологічним розпізнаванням EGFR розташований на цитоплазматичній мембрані пухлинних клітин, а гангліозид NeuGcGM3 детектували в цитоплазмі і/або в цитоплазматичній мембрані клітин. Подвійне забарвлювання: EGFR детектували за допомогою МАb Ior egf/R3m (анти-EGFR) і потім інкубували з FITC-кон'югованим стрептавідином (Dako, Carpinteria, Каліфорнія, США). NeuGcGM3 детектували за допомогою біотинільованого МАb 14F7 і потім за допомогою антимишачого антитіла IgG, кон'югованого з родаміном (Dako, Carpinteria, Каліфорнія, США). Коекспресія обох молекул у пухлинних клітинах зазначена на зображеннях жовтим. Зрізи тканин оцифровували й аналізували за допомогою камери, підключеної до флуоресцентного мікроскопа Olympus BX51 (Olympus, Японія). Для аналізу оцифрованих зображень використовували процесор обробки зображень ImageJ версії 1.43u. У таблиці 1 наведені пухлини з різних локалізацій, у яких коекспресуються EGFR і гангліозид NeuGcGM3. 55 5 UA 111403 C2 Таблиця 1 Гістологічні типи Дихальна система НДРЛ Травна система Шлунок (АДК) Товста кишка (АДК) Підшлункова залоза (АДК) Печінка Сечостатева система Сечовий міхур Нервова система Мультиформна гліобластома Саркома Кровотворна система Неходжкінська лімфома EGFR NeuGcGM3NeuGcGM3 Подвійні позитивні Позитивні Діапазон Позитивні Діапазон Позитивні Діапазон випадки інтенсив- випадки інтенсив- випадки інтенсив(%) ності (%) ності (%) ності 8/10(80) ++/+++ 6/10(60) +/+++ 6/10(60) +/+++ 3/3 (100) 4/4 (100) 3/4 (75) 4/4(100) ++/+++ +/+++ ++/+++ ++/+++ 2/3(66,6) 4/4 (100) 2/4(50) 3/4(75) ++/+++ +/+++ ++/+++ ++/+++ 2/3 (66,6) 4/4(100) 2/4(50) 3/4 (75) +/+++ ++ ++ +/+++ 2/2 (100) ++/+++ 1/2 (50) ++ 1/2 (50) ++ 5/5(100) +++ 3/5(60) ++ 3/5(60) ++ 2/3 (66,6) +/++ 1/3 (33,3) + 1/3(33,3) + 2/3(66,6) + 2/3 (66,6) + 2/3(66,6) + Інтенсивність: - негативна, + слабка, ++ помірна, +++ інтенсивна. 5 10 15 20 25 30 35 Приклад 2. Вимірювання коекспресії і колокалізації EGFR і гангліозиду NeuGcGM3 у мишачих моделях пухлин. Використаними мишачими моделями пухлин були карцинома легень Льюіс (3LL-D122) і мієлома Р3-х63-Ag8.653(Х63). Для визначення коекспресії і колокалізації проводили подвійне забарвлювання. Імунологічне розпізнавання EGFR проводили за допомогою інкубації з МАb 7A7 (20 мкг/мл), біотинільованим протягом 1 години з подальшою інкубацією з FITC-кон'югованим стрептавідином (Dako, Carpinteria, Каліфорнія, США). Імунозабарвлювання NeuGcGM3 визначали за допомогою інкубації з МАb 14F7 (20 мкг/мл) протягом 30 хв. із подальшою інкубацією з антимишачим антитілом IgG, кон'югованим з родаміном (Dako, Carpinteria, Каліфорнія, США). Негативний контроль одержували за допомогою заміни первинного антитіла (МАb 7A7 або МАb 14F7) на промивний розчин TBS (1X). Коекспресію визначали із застосуванням флуоресцентного мікроскопа Olympus BX51 (Olympus, Японія) і аналізу оцифрованих зображень із застосуванням процесора обробки зображень ImageJ версії 1.43u. Колокалізацію визначали за допомогою конфокального лазерного мікроскопа Flouview FV500 (Olympus, Японія). На фіг. 1 показана колокалізація EGFR і NeuGcGM3 у зразках пухлин із різних моделей мишей. EGFR ідентифікували за допомогою біотинільованого МАb 7A7 і потім зв'язаного з FITC стрептавідину. Жовтий колір указує за допомогою кольорового накладення колокалізацію (C і F) обох молекул у пухлинних клітинах моделей мишей. Приклад 3. Вимірювання виживання мишей C57BL/6 з карциномою легень Льюіс, що одержали лікування вакциною NeuGcGM3/VSSP і МАb 7A7. Модель спонтанних метастазів 5 Тваринам інокулювали в подушечку правої лапи 2×10 клітин епідермоїдної карциноми Льюіс (3LL-D122) в об'ємі, що дорівнює 0,05 мл, що відповідало дню 0 протоколу експерименту. На день 3 експерименту тварини були рандомізовані на чотири експериментальні групи по 10 тварин у кожній. На день 24, коли пухлина досягала об'єму 8-9 мм, здійснювали первинну хірургію пухлини. З дня 48 починали спостереження за клінічним станом тварин. Дані з виживаності аналізували за допомогою логарифмічного рангового критерію, р
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition for treatment of malignant tumours that express egfr and n-glycolyl gm3 ganglioside targets
Автори англійськоюGonzalez Palomo, Adys, Carr Perez, Adriana, Leon Monzon, Kalet, Blanco Santana, Rances, Barroso Alvarez, Maria del Carmen, Macias Abraham, Amparo, Emilia, Montero Casimiro, Jose Enruque
Назва патенту російськоюФармацевтические композиции для лечения опухолей, экспрессирующих egfr и n-гликолилганглиозид gm3 (neugcgm3)
Автори російськоюГонсалэс Паломо Адис, Карр Пэрэс Адриана, Леон Монсон Калет, Бланко Сантана Рансэс, Барросо Альварэс Мария дэль Кармэн, Масиас Абраам Ампаро Эмилия, Монтэро Касимиро Хосэ Энрике
МПК / Мітки
МПК: A61K 39/395, A61P 35/00
Мітки: композиції, n-гліколілгангліозид, лікування, експресуючих, neugсgm3, фармацевтичні, пухлин
Код посилання
<a href="https://ua.patents.su/12-111403-farmacevtichni-kompozici-dlya-likuvannya-pukhlin-ekspresuyuchikh-egfr-i-n-glikolilgangliozid-gm3-neugsgm3.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичні композиції для лікування пухлин, експресуючих egfr і n-гліколілгангліозид gm3 (neugсgm3)</a>
Попередній патент: Затягнутий вручну гідравлічний фітинг
Наступний патент: Спосіб очищення стічних вод
Випадковий патент: Спосіб визначення сироваткових імуноглобулінів g, a, m людини