Спосіб одержання бензопіранон-beta-d-тіоксилозидів
Номер патенту: 13476
Опубліковано: 25.04.1997
Автори: Сот Самрет, Франсуа Беламі, Патріс Рено, Веронік Барберус, Жан Міллє
Формула / Реферат
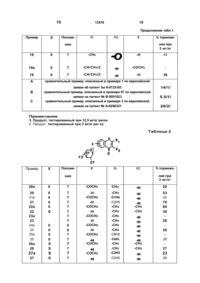
Способ получения бензопиранон-b-D-тиоксилозидов общей формулы
где один из R или R1 атом кислорода, соединенный двойной связью с циклическим углеродом, а другой группа R1,
- символ = двойная связь с группой СО, представленной одним из R или R1;
X - атом серы или кислорода, R1 и R2 одинаковые или разные, каждый, атом водорода, группа алкил С1-С4 атом галогена, трифторметил, фенил, причем вместе взятые R1 и R2 могут образовывать с группой бензолиранон, с которой они связаны, группу 7,8,9,10-тетрагидродибензо(b,d)пиран-6-он.
Y - атом водорода или алифатический ацил С2-С5, отличающийся тем, что: проводят взаимодействие соединения общей формулы
где X, R, R1 и R2 определены выше с галогенидом ацилтиоксилозина общей формулы:
где Гал означает атом галогена, например, хлор или бром, a Y алифатическая группа ацила С2-С5, в инертном растворителе, из расчета 1моль соединения II на 0,6-1,2моля соединения III, в присутствии акцептора кислоты или кислоты Льюиса, и, если необходимо, подвергают полученное, таким образом соединение формулы І, в котором Y алифатическая группа ацил С2-С5, реакции дезацилирования при температуре от 0°C до температуры кипения с обратным холодильником реакционной среды, в низшем спирте С1-С4 (таком как метанол в присутствии металлического алкоголята, таком как метилат магния или метилат натрия), для получения соединения формулы I, где Y - водород.
Приоритет по признакам:
от 22.09.89г - R атом кислорода
от 16.03.90г. - R1 атом кислорода.
Текст
Способ получения бензопиранон-/? -Dтиоксилозидов общей формулы Y - атом водорода или алифатический ацил С2-С5, о т л и ч а ю щ и й с я тем, что: проводят взаимодействие соединения общей формулы 00 где X, R, R1 и R2 определены выше с галогенидом ацилтиоксилозина общей формулы: Гея С> YO OY (Ш) 0) 1 где один из R или R атом кислорода, соединенный двойной связью с циклическим углеродом, а другой группа R1, - символ — двойная связь с группой СО, представленной одним из R или R ; X - атом серы или кислорода, R1 и R2 одинаковые или разные, каждый, атом водорода, группа алкил С1-С4 атом галогена, трифторметил, фенил, причем вместе взятые R1 и R2 могут образовывать с группой бензолиранон, с которой они связз-ны, группу 7,8,9,10-тетрагидродибензо(Ь,с!)пиран-6-он. где Гал означает атом галогена, например, хлор или бром, a Y алифатическая группа ацила С2-С5, в инертном растворителе, из расчета 1 моль соединения II на 0,6-1,2 моля соединения 111, в присутствии акцептора кислоты или кислоты Льюиса, и, если необходимо, подвергают полученное, таким образом соединение формулы І, в котором Y алифатическая группа ацил С2-С5, реакции дезацилирования при температуре от 0°С до температуры кипения с обратным холодильником реакционной среды, в низшем спирте С1-С4 (таком как метанол в присутствии металлического алкоголята, таком как метилат магния или метилат натрия), для получения соединения формулы I, где Y - водород. Приоритет по признакам: от 22.09.89 г - R 1 атом кислорода от 16.03.90 г. - R атом кислорода со О 13476 Изобретение относится к способу получения новых производных бензопиранон/З-О-ксилозидов общей формулы (I) где один из R или Ri - атом кислорода, соединенный двойной связью с циклическим углеводородом, а другой - группа Ri символ гигдвойная связь с группой СО, представленной одним из R или Ri, X - атом серы или кислорода, Ri и R2 - одинаковые или разные, каждый - атом водорода, группа алкил С1-С4, атом галогена, трифторметил, фенил, причем вместе взятые Ri и R2 могут образовывать с группой бензопиранон, с которой они связаны, группу 7,8,9,10-тетрагидродибензо(Ь,й)пиран-6-он, Y - атом водорода или алифатический ацил С2-С5, обладающих активностью при лечении болезней, связанных с нарушением кровообращения. В настоящее время описаны производные бензоил-озидов и а -оксибензил-фенилозидов в качестве лекарств от язвы, от тромбоза и в качестве средств для подачи кислорода к мозгу [1]. По европейской заявке на патент № А0133103 известны также бензиолфенил-оксиды, полезные в качестве гипохолестеринемических и гиполипидемических лекарств, причем некоторые из этих соединений, в частности, продукт по примеру 1, обладает, кроме того, противотромбозным эффектом. Наконец, по европейской заявке Ьк ANt 029032Т, известны производные бензоилфенил-тиоксилозидов, а -оксибен зилфенилтиоксилозидов и бензил-фенил-тиоксилозидов, предложенные в качестве противотромбозных лекарств. Цель изобретения - получение новых производных из ряда бензопиранон-^-D-тиоксилозидов, обладающих ценными фармакологическими свойствами. Приготовление \. Получение 4-этил-2-оксо-2Н-1-бензопиран-7-ил-2,3,4-ипм-0-ацетил-5-тио-/? -D-ксилопиранозида (пример 1а). Суспензию 2,28 г(12,10 моль)-4'этил-7окси-1-бензопиран-2-она, 4,7 г (13,2 • 10'3 моль) бромида 2,3,4-три-0-ацетил-5-тио-/9-Г> ксилопиранозила и молекулярного сита 0,4 нм в 126 мл толуола и 120 мл ацетонитрила выдерживают при перемешивании в присутствии 3,28 г (24 • 10 моль) хлорида цинка и 4,2 (14 • 10 моль) имидазолата серебра, в укрытии от света, в инертной атмосфере. 5 После нагревания при 55°С в течение 24 ч реакционную смесь фильтруют на целите (диатомовая двуокись кремния для фильтрования) в этилацетате. Фильтрат промывают посредством раствора хлористоводородной 10 кислоты 1 н., раствора едкого натра 1 н., затем насыщенного раствора хлорида натрия, высушивают на сульфате магния, а растворители выпаривают при пониженном давлении. После очистки путем хроматогра15 фии на силикагеле с вымыванием посредством смеси этилацетат (толуол) 1 /б (объем) и осаждения в эфире, получают 0,93 г (выход 17%) заданного продукта. Т.пл. 189°С. 20 [ а]р 20 - -73,8° (С - 0,25, СНІз/.СНСІз). Действуя аналогичным образом, получают следующие продукты 4-метил-2-оксо-2Н1-бензопиран-6-ил-2,3,4-три-0-ацетил-5-тио/З-й-ксилопиранозид (пример 2а). 25 Точка плавления - 179-184°С. [ ofc20 - -47,9° (С - 0,33, СНСІ2) 4-трифторметил-2-оксо-2Н-1-бензопиран-7-ил-2,3, 4-три-0-а цетил-5-тио-/3-Р-кси л оп и ра ноэи д (пример За). 30 Т.пл.»184°С. [ «Ь20 - +29,2° (С - 0,55,СНС(з) 4-метил2-оксо-2Н-1-бензопиран-8-ил-2,3,4-три-0-ацетил-5-тио-$-О-ксилопиранозид (пример 4а). 35 т.пл. - 220-223°С. [ ab23 - -121,9° (С - 0,21, СНСіз) 2-оксо4-пропил-2Н-1-бензопиран-7-ил-2,3,4-триО-ацетил-5-тио-^З-D-оксилопиранозид (пример 5а). 40 Т.пл. 165-167°С. 20 [ а]о - 71,2° (С - 0,11, СНСІз) 4-метил2-оксо-2Н-1-бензопиран-5-ил-2,3,4-три-0-ацетил-5-тио- yS-D-ксилопиранозид (пример 6а). 45 Т.пл. - 167°С. [ аЬ22 - -81°С (С = 0,15, СНСІз) 4-метил2-оксо-2Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-тио- /2-О-ксилопиранозид (пример ел 50 1ба )« Т.пл. - 193°С. 20 [a]D - -72 (С - 0,5, СНСІз) 3-хлорЧ-ме-тил2-оксо-2Н-1-бензопиран-7-ил-2,3,4-три -Оацетил-5-тио- ^-О-ксилопиранозид (при-мер 17а). 55 Т.пл.«227°С. [аЪ20 - -50,7° (С - 0,27, СНСІз) 4-метил-2оксо-2Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-тио- ^-D-ксилопиранозид (пример 18 а). 13476 Т.пл.-210°С. [ еф27'5 --56,5° (С - 0,1; СНСІз) 4-(1-метилэтил)-2-оксо-2Н-1-бензопиран-7-ил-2,3, 4-три-0-ацетил-5- тио-^-О-ксилопиранозид (пример 19а). 5 Т.пл.» 144-145°С [а Ь30 - -26.4°(О0,1; СНзОН) 2-метил-4оксо-4Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-тио-/? -D-ксилопиранозид (пример 20а). Ю Т.пл. - 188°С. [ а]о23 " -77,4 (С - 0,47, СНСІз) 2-этил-2оксо-4Н-1-6ензопиран-7-ил-2,3,4-три-0-ацетил-5-тио-/? -D-ксилопиранозид (пример 21а). 15 Т.пл. - 150-151°С. [ а]о 2 - -64° (С - 0,54, СНСІз) 2,3-диметил-4-оксо-4Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-тио-/? -D-ксилопиранозид (при мер 22а). 20 Т.пл. - 203-205°С. [а Ь21 «-65° (С - 0,6, СНСІз) 2-метил-4оксо-4Н-1-бензопиран-6-ил-2,3,4-три-0-ацетил-5-тио- /J-D-ксилопиранозид (пример 24а). 25 Т.пл.-168-180°С. [ «]о25 - -81,9° (С - 0,86, СНСІз) 4-ОКСО-2фенил-4Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-тио-/? -D-ксилопиранозид (пример 30 25а). Т.пл. = 215°С. [ G ]D24 - -62° (С - 0,51, СНСІз) З-бром-2метил-4-оксо-4Н-1-бензопиран-7-ил-2,3,4три-0-ацетил-5-тио-/£-О-ксилопиранозид (пример 28а). 35 Т.пл. - 192-194°С. 21 [аЬ - -54°С (С - 0,54, СНСІз). Приготовление II. Получение 4-метил-2-оксо-2Н-1-бензолиран-5-ил-2,3,4-три-0-ацетил-1,5-дитио- р- *® D-ксилопиранозида (пример 7а). Суспензию 420 мг (2,2.10"3 моль) 5-меркапто-4-метил-2Н-1-бензопиран-2-она, 970 мг (2,7.10-3 моль) бромида 2,3,4-три-О-аце-тил-5тио-О-ксилопиранозила, 550 мг 4 5 (2,2.10 моль) цианида ртути и молекулярного сита 0,4 нм в 50 мл нитромета и 50 мл бензола выдерживают, при перемешивании, при 45° в инертной атмосфере в тече-ниє 24 ч. Реакционную смесь фильтруют на ** целите R а этилацетате. Фильтрат промывают посредством раствора хлористоводородной кислоты 1, раствора едкого натра 1, затем насыщенным раствором хлорида натрия, высушивают на сульфате магния и вы- 55 паривают при пониженном давлзнии. После очистки путем хроматографии на силикагеле с вымыванием посредством смеси этилацетат/толуол 1 /5 (объем) с последующим осаж 6 дением в эфире получают 250 мг (выход: 25% заданного продукта). Т.пл.-187°С. [аЪ --84,5°(С -0,11, СНСІз). Действуя аналогичным способом, получают следующие продукты: 4-метил-2-оксо-1Н-1-бензопиран-8-ил-2, 3,4-три-0-ацетил-5-дитио-^М>ксилопиранозид (пример 9а). Т.пл. - 205°С. [ah - +86,25 (С - 0,3, СНСІз) 4-метил2-оксо-2Н-1-бензопиран-6-ил-2,3,4-три-0-ацетил-5-дитио-/3-О-ксилопиранозид (пример 10а). Т.пл. - 139-140°С. [а Ь23 - -66,13° (С - 0,3, СНСІз) 7,8,9,10тетрагидро-6-оксо-6Н-дибензо-(Ь,сі)пиран-Зил-2 3,4-три-0-ацетил-1,5-дитио- /J-D-ксилопиранозид (пример 15В). Т.пл. - 191°С. [ а]о 23 - +14,5° (С - 0,3, СНСІз) 2-метил2-оксо-4Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-дитио-/$-0-ксилопиранозид (пример 23а). Т.пл.-171°С. [ а]о21 - +54,3° (С - 0,14, СНСІз) 2,3-диметил-4-оксо-4Н-1-бензопиран-7-ил-2,3,4три-О-ацетил-5-дитио-^ -D-ксилопиранозид (пример 26а). Т.пл. - 169-173°С. [ afc30 - +55,5° (С - 0,38, СНСІз) 2-этил-4оксо-4Н-1-бензопиран-7-ил-2,3,4-три-0-ацетил-5-дитио-/? -D-ксилопиранозид (пример 27а). Т .пл.-85-90° С. [ ah 20 - +58° (С - 0,5; СНСІз). Приготовление III. Получение 4-метил-2-оксо-2Н-1-бензопиран-7-ил-2,3,4^три-0-ацетил-5-дитио- fi-Oксилопиранозид (пример 8а). 3 Смесь 8 г (41,6 • 10" моль) 7-меркапто4-метил-2Н-1-бензо пиран-2-о на, 17, 7 (50 • 10 моль) бромида 2,3,4-три-0-ацетил-5тио-/3 -D-ксилопиранозила и 3,4 г (42,10*3 моль) оксида цинка в 180 мл толуола и 150 мл ацетонитрила нагревают в течение 12 часов при 45°С. После фильтрования не целите и промывки полученного осадка посредством этилацетата, органическую фазу промывают раствором хлористоводородной кислоты 1 н. затем раствором едкого натра 1 н. и, наконец, насыщенный раствором хлорида натрия. Полученную органическую фазу высушивают на сульфате магния и выпаривают при пониженном давлении. После осаждения путем добавления этилового эфира, получают 14,2 г/выход: 73% желтого порошка. Т.пл. - 168°С. 13476 [ab22 - 46.4° (С - 0,7, СНСІз). Действуя аналогичным образом, получают следующие продукты: 4-трифторметил-2-оксо-2 Н-1 -бензопи-ран7-ил-2,3,4-три-0-ацетил-1,5-дитио- /3-D- 5 ксилопиранозид (пример 11а). Т.пл.=184°С. [ а]о23 - +80,25° (С - 0,5, СНСІз) З-хлор-4метил-2-оксо-2Н-1-бензопиран-7-ил-2,3,4-триО-ацетил-5-дитио-/? -D-ксилолиранозид 10 (пример 12а). Т.пл. « 160-162°С. [а Ь23 - +70,2° (С - 0,5, СНСІз) 4-метил-2оксо-2Н-1-бензопиран-7-ил-2,3,4-три-0-а-цети л-5-дитио-^З -D-ксилопиранозид (пример 15 13а). Т.пл. - 153°С. [ ab23 - +28,11 ° (С - 0,5, СНСІз) 2-оксо-4пропил-2Н-1-бензопиран-7-ил-2,3,4-три-0ацетил-5-дитио- /J-D-ксилопиранозид (при- 20 мер 14а). Т.пл. - 137°С. [a]D23-31.17° (С «0.5, СНСІз). Приготовление IV. Получение 4-этил-2-оксо-2Н-11-бензо- 25 пиран-7-ил-5-тио-$ -D-ксилопиранозида (пример 1). В раствор 0,45 г (0,97.10 моль) 4-этил2~оксо-2Н-1-бензопиран-7- ил-2,3,4-три-0ацетил-5-тио-/? -D-ксилопиранозида в 5 мл 30 метанола добавляют 60 ил метилата натрия (8 вес. %) Na в метаноле. По истечении 24 ч, при перемешивании при температуре окружающей среды реакционную смесь нейтрализуют путем добавлений смолы Амбердит 35 IP 12ОН+, растворяют с тетра гидрофура ном, фильтруют, обрабатывают животным углем. Растворители выпаривают при пониженном давлении, затем, после лиофилизации, получают 0,285 г (выход: 87%) заданного про- *® дукта. Т.пл - 192°С. [а]о - -69° (С - 0,21, диметилсульфон сид). Действуя аналогичным образом, получа- **э ют следующие продукты: 4-метил-2-оксо-2Н-1-бензопиран-6-ілл5-тио-^-D-ксилопиранозид (пример 2). Т.пл.- 109-113°С. [ab20 - -63,3° (С - 0,24, диметилсульфок- 5° сид) 4-трифторметил-2-оксо-2Н-1 -бензопиран-7-ил-5-тио- /J-D-ксилопиранозид (пример 3). Т.пл.-210-213°С. - +34,1°(С - 0,5, СНзОН)4-метил- 55 пиранозид (пример 4). Т.пл. - 120-125°С. 8 [ «Ь20 - -16° (С - 0,12 диметилсул ьфоксид) 2-оксо-4-пропил-2Н-1-бензопиран-7ил-5-тио-$ -D-ксилопиранозид (пример 5). Т.пл.-192°С. [а b - -61,3° (К - 0,15 диметилсул ьфоксид) 4-метил-2-оксо-2 Н-1-бензопиран-2-ил5-тио-^-D-ксилопиранозид (пример 6). Т.пл.-184-188°С. [ab23 - -85,2° (С - 0,11, диметилсул ьфоксид) 4-метил-2-оксо-2Н-1-бензопиран-5-ил1,5-дитио- ^-D-ксилопиранозид (пример 7). Т.пл.-203°С. 22 «+28,3°(С-0.12,СНзОН)4-метил2-оксо-2Н-1-бензопиран-7-ил-1,5-дитио- fiD-ксилопиранозид (пример 8). Т.пл -216°С. [ а)о - -19,4° (С « 0,3 диметилсульфоксид 4-метил-2-оксо-2Н-1-бензопиран-8-ил1,5-дитио-/5-О-ксилопиранозид (пример 9). Т.пл - 178°С. [а ]D - -61,5° (С - 0,2, ди метил сульфоксид) 4-метил-2-оксо-2 Н-1 -бензопиран-6-ил1,5-дитио-уЗ -D-ксилопиранозид (пример 10). Т.пл. - 182°С. [а Ь20 * + 6,9° (С - 0,6 тетрагидрофураи 4-трифторметил-2-оксо-2Н-1-бензопиран-7-ИЛ-1.5-ДИТИО- ^D-ксилопиранозид (пример Т.пл, - 178-180°С. [ ab25 - +40,8° (С - 0,26, СНзОН) 3-хлор4-метил-2-оксо-2Н-1-бензопиран-7-ил-1,5дитио-^D-ксилопиранозид (пример 12). Т.пл.-230°С. * +32,7° (С - 0,3 диметилсульфоксид 4-метил-2-оксо-2Н-1-бензопиран-7-ил1,5-дитио-Д-О-ксилопиранозид (пример 13). Т.пл.-184°С. [ ab25 « +0,6° (С - 0,3 тетрагидрофуран) 2-оксо-4-пропил-2Н-1-бензопиран-7-ил-1,5 дитио- ^-D-ксилопиранозид (пример 14). Т.пл. - 176-178°С. С ab25 e +3,0° (С - 0,3, тетрагидрофуран) 7,8,9,10-тетрагидро-6-оксо-6Н-дибензо(Ь^) пиран-З-ил-1,5-дитио- ^-D-ксилопираноэид (пример 15). Т.пл.-182-183°С. - +20,6° (С - 0,3, диметилсульфоксид) 4-метил-2-оксо-2 Н-1 -бензопиран-7-ил5-ТИО-/9 -D-ксилопиранозид (пример 16). Т.пл.-190-206°С. [а b - -72° (С - 0,5, диметилсульфоксид) 3-ХЛОР-4-МЄТИЛ-2-ОКСО-2Н-1-6ЄНЗОПИ ран-7-ил-5-тио-^ -D-ксилопиранозид (пример 17). Т.пл.-208-210°С. [ab20 " -22,9° (С - 0,24, диметилсульфоксид) 4-метил-2-оксо-3-фенил-2 Н-1 -бензопиран-7-ил-5-тио-^О-ксилопиранозид (пример 18). 9 Т.лл. - 188-200°С. --69,2°(С - 0.12, СНзОН) 4Ч1-метилэтил)-2-оксо-2Н-1 -бензопиран-7-ил-6-тио-ДОксилопиранозид (пример 19). Т.пл.«186-190°С. 5 22 —74,33 (О 0,14, СНзОН)2-метилр ранозид (пример 20). Т.пл. - 193-195бС. 22 [afc --92° (С-0,5, метанол) 2-этил-4- 10 окссМН-і-бензопиран-Т-ил-б-тио^-О-ксилопираноэид (пример 21). Т . п л. - 1 3 (М З Г С. [а]о21 -84° (С - 0,54; метанол) 2.3-диме^ 15 лопиранозид Т.пл (пример 22). ° .« 177-194°С. [а}о « -88,6 (С - 0,45; тетрагидрофуран) 2-метил-4-оксо-4Н-1 бензопиран-7-ил-1,5-дитио-^ -Dксилопиранозид (пример 23). 20 Т.пл. - 194-196°С. [ ajo - +19,1° (С - 0,2, диметилсульфоксид) 2-метил-4-оксо-4Н-1-бензопиран-6Чіл5-тио-/?-D-ксилопиранозид (пример 24). . - Т.пл. - 108°С (разложение: 200240°С). 25 -107,7* (С - 0,8; метанол) 4-оксолопиранозид (пример 25). Т.пл^-222°С. - -90° (С 0,5, тетрагидрофуран) 2,3диметил-4-оксо-4Н-1-бенэопиран-7-ил-1,5дитио-/? -D-ксилопиранозид (пример 26). Т.пл.«204-208°С. [ ajo - +28,3° (С - 0,35, метанол) 2-этил-4-оксо4Н-1-бензопиран-7-ия-1,5-дитио- /?• Dксилопиранозид (пример 27). Т.пл. - 155°С. 20 -+26,2°(С-0,53, метанол) 3-бромР -D-ксилопиранозид (пример 28). Т.пл. - 135-138°С. 10 13476 *° [ аЬ21 " ^3° (С - 0,5, диметилсульфок-сид). Приготовление V. .. Получение диметилтиокарбамат 044-ме-тил2-оксо-1 Н-1-бензопиран-5-ила). В суспензию 1 г (5,7 • 10 моль) 5-окси-4метил-2Н-1-бензопиран-2-она в 10 мл воды и 10 мл ацетона добавляют, в инертной 5Q атмосфере, 410 мг (7,3 • 10 моль) гидрооки- w си калия. По истечении 10*минут при температуре окружающей среды, добавляют, при 0°С, 770 мг 6,2 ' 10 моль/хлорида диметилтиокарбамоила в 10 мл ацетона. Вы держи ва- -ют при перемешивании в течение 2 ч при температуре окружающей среды, затем, после выпаривания ацетона, осаждают производное в воде. Получают 1,35 г (выход 90%) заданного продукта. Т.пл. -166-168°С. Действуя аналогичным образом, получают продукты, указанные в нижеприведенных таблицах 3 и 4. Приготовление VI. Получение диметилтиокарбамата S-(4метил-2-оксо-2 Н-1 -бензопиран-5-ил а). Раствор 3,7 г (14 • 10 моль) диметилтиокарбамата 0-(4-метил-2-оксо-2 Н-1 -бен зопиран-5-ила) в 50 мл 1,2,3,4-тетрагидронафталина выдерживают при 220°С в течение 14 ч. После охлаждения, заданный продукт осаждают эфиром. Полученные кристаллы промывают циклогексаном и получают 2,95 г (выход 80%) заданного продукта. Т.пл. - 129°С. Действуя аналогичным образом, получают продукты, указанные в нижеприведенных таблицах 5 м 6. Приготовление VII. Получение сложного метилового эфира 3-{2-окси-6-диметиламинокарбонилтио/фенил)-2-бугеновой кислоты. В раствор 2 г (7,6 - 10 моль) диметилтиокарбамата в-(4-метил-2-оксо-2 Н -1 -бе нзопиран-5-ила) • 20 мл метанола добавляют в инертной атмосфере 4,4 мл метилата натрия С8 вес/об. Ыа) в метаноле. После 4 часов выдерживания при температуре окружающей среды, реакционную смесь гидролизуют на смеси лед/хлористоводородная кислота и фильтруют образовавшийся осадок. Получают 1,7 г (выход, 76%) заданного продукта. Т.пя. 152 С. Приготовление VIII. Получение 7-меркапто-4-метил-4-2Н-1бензопиран-2-она. В раствор 1 г (3,4 * 10 моль) метилового эфира 3-(2-вкси-6)диметшіаминокарбонилтио(фенил}-2-бутеновой кислоты в 10 мл безводного диметилформамида добавляют, при 6tf°C 4 мл метилата натрия (8 вес./об. Na в метаноле). После 6 ч при 60°С, реакционную среду гидролиэуют на смеси хлористоводородная кислота/лед. Получают 0,550 г (выход: 85%) заданного продукта. Т.пл. - 136°С. Приготовление IX. Получение 7-меркапто-4-метил-2Н-1бензопиран-2-она. В атмосфере азота 26,3 г (0,1 моль) диметилтиокарбамата Б-(4-метил-2-оксо-2 Н-1бензопиран-7-ила) переводят в суспензию с 300 мл метанола. При температуре окружающей среды добавляют Т, 2 моль метанола. При температуре окружающей среды добавляют Т, 2 моль метилата натрия (8%-ный раствор вес./об.) в метаноле и нагревают 11 13476 при 45°С в течение 4 ч. Контролируют удаление исходного продукта по хроматографии на тонком слое, вымывая смесью этйлацетат/толуол 1/4 (объем). После охлаждения реакционную среду гидролизуют на смеси 5 лед/концентрированная хлористоводородная кислота, а после 30 мин перемешивания, полученный осадок фильтруют, затем промывают водой. После высушивания на Р2О5 получают 19,2 г (выход 100%) заданного про- 10 дукта. Т.лл,-132°С. Действуя аналогичным образом, получа ют продукты, указанные в нижеприведен ных таблицах 7 и 8. 15 Приготовление X. Получение 2-этил-7-{1 -оксопропокси)-3(1-о/оксопропил)-4Н-1-бензопиран-4-она. В течение 20 ч в инертной атмосфере при температуре 170°С выдерживают рас- 20 твор5г(32,2 • 10" 3моль)-1-(2.4-дигидроксифенил)этзнонаи4г(48,8 * 10 моль)ацетата натрия в 40 мл ангидрида пропановой кислоты. Реакционную смесь гидролизуют в присутствии бикарбоната натрия и экстр аги- 25 руют продукт посредством этилацетата, затем промывают водой. Полученную органическую фдзу высушивают на сульфате магния. Растворитель выпаривают при пониженном давлении. После добавления то- 30 луола, оставшиеся растворители снова выпаривают при пониженном давлении. После очистки посредством хроматографии на силикагеле с вымыванием посредством смеси гексан/этилацетат 6/1 (объем), получают 35 2 г (выход: 20%) заданного продукта. 6 Т.пл. - 84 С. Приготовление XI. Получение 2-этил-7-окси-4Н-1-бензопиран-она. 40 В течение 9 ч при температуре 150°С 3 выдерживаютсуспензию6,5г(21,5 * 10 моль) 2этил-7-(1 -оксопропокси)-3-{1 -оксопро- пил)-4Н-1бензопиран-4-она и 5 г (47 • 10"3 моль) карбоната натрия в 65 мл воды. Реакцион- 45 ную смесь гидролизуют посредством раствора хлористоводородной кислоты 1, экстрагируют продукт посредством этилацетата. После очистки путем хроматографии на силикагеле посредством смеси эфир/дих- 50 лорметан 1 /2 (объем) получают 2,45 г (выход: 61 %) заданного продукта. Т.пл.«189°С. Пример получения ХМ. Получение 7-ацетил-3-бром-2-метил-4Н- 55 1 -бензопиран-4-она. В раствор 8,8 г (5,40 • 10"3 моль) 7-ацетил-2-метил-4Н-1-бензопиран-4-она в 80 мл 12 уксусной кислоты добавляют, при 60°С в инертной атмосфере, 77,5 мл 10%-ного раствора брома в уксусной кислоте. Реакционную смесь выдерживают 2 ч при 60°С, затем оставляют на 12 ч. Осадок концентрируют при пониженном давлении, затем нейтрализуют посредством насыщенного раствора бикарбоната натрия. Экстрагируют посредством этилацетата. Органическую фазу промывают водой до нейтрального рН, высушивают на сульфате магния и концентрируют досуха. После хроматографии на силикагеле с вымыванием посредством смеси дихлор метан/метанол 12/1 (объем), получают 2,3 г (выход 19%) заданного продукта. Т.пл. - 124°С. Приготовление XIII. Получение 3-бром-7окси-2-метил-4Н-1бензопиран-4-она. В суспензию 2,3 г (7,7 • 10"3 моль) 7-ацетил-3-бром-2-метил-4Н-1-бензопиран-4-она в 40 мл метанола добавляют 2,2 мл метилата натрия (8 % вес. /об. Na в метаноле) в инертной атмосфере. По истечении 30 мин, реакционную смесь гидролизуют ледяным раствором хлористоводородной кислоты. Образовавшийся осадок фильтруют, затем промывают до нейтрального рН. Таким образом, получают 1,9 г (выход 96 %) заданного продукта. Т.пл. - 305-310°С (разложение). В нижеприведенных табл. 1 и 2 указано определенное число соединений согласно изобретению. Противотромбозная активность продуктов, согласно изобретению, была выявлена следующему протоколу тромбоза вены: Выполняют веностаз при гиперкоагуляции по технологии, описанной авторами Well lep и др. (I Applied Phys. 1959, стр. 943946). Использованным гиперкоагулирующим агентом является, как по технологии, описанной авторами НА, РМА и др. (Thrombasis and Haemostasis 43(2), 1980, с. 118) раствор активированного фактора Х(Ха). поставляемого фирмой Flow Labor (71 Knat на 12,5 мл физиологического раствора). Исследования проводились на самцах крыс рода весом 250-280 г, распределенных по группам по 10 животных в каждой. Темп Тестируемые продукты вводятся через рот в суспензии в PEI400. Тромбоз наводится через 4 ч после этой обработки, а образовавшийся тромбоз отбирается и взвешивается. Результаты, полученные при дозе 3 мг/кг, приводятся в табл. 1 и 2. Соединения, полученные согласно изобретению, являются слаботоксичными. 13 14 13476 Т аблица 1 О .0 Пример X Положе R1 R2 Y ние % торможе ния при 3 мг/кг 1а 0 7 -СН2СН3 -Н 1 0 0 0 0 0 0 0 0 0 0 0 7 -СН2СН3 -СНз -СНз -СГз -СҐз -СНз -СНз -/СН2/2-СН3 -/СН2/2-СН3 -СНз -СНз -СНз -СНз -СНз -СНз -СНз -СНз -СНз -СНз -Н 2а 2 За 3 4а 4 5а 5 6а 6 7а 7 8а 8 9а 9 10а 10 11а 6 7 7 8 8 7 7 5 5 5 5 7 7 8 8 6 6 7 7 7 7 7 11 12а 12 13а 13 14а 14 15а 15 16а 6 7 7 7 7 СГз СГз -СНз -СНз -СНг-СНз -СНг-СНз -/СН2/2-СН3 /СНг/2-СНз 16 17а 17 0 0 0 0 7 7 7 -СН2-СН2-СН2-СН2 -СН2-СН2-СН2-СН2 -СНз -СНз -СНз -СНз 18а 0 7 СНз 7 7 -н -н , -и -н -н -н -н -н -н -н -н -н -н -н -н -н -н -н -н -н -СОСНз 65 -н -н 87 53 81 47 80 51 52 46 26 42 38 65 46 31 32 37 36 32 65 58 54 25 43 23 31 63 63 67 64 СОСНз 20 -СОСНз -н -СОСНз -н СОСНз -н -СОСНз -н СОСНз -н -СОСНз -н СОСНз -н СОСНз -н СОСНз -н СОСНз -н -CI -CI СОСНз -н -н -н -н -н -н СОСНз -CI -CI -н -н СОСНз -н СОСНз -н СОСНз -н СОСНз 15 16 13476 Продолжение табл.1 Пример X Положе Ri R2 % торможе Y ния при 3 мг/кг ние 18 0 7 -СНз 19а 0 7 -СН/СНз/2 19 0 7 -СН/СНз/2 А В С -о -н -н -Н 43 -СОСНз -Н 36 сравнительный пример, описанный в примере 1 по европейской заявке нб патент Ък А-0133103 сравнительный пример, описанный в примере 97 по европейской заявке на патент № В-0051023 сравнительный пример, описанный в примере 3 по европейской заявке на патент № А-0290321 14/1/ 5,5/1/ 20/2/ Примечание. 1 Продукт, тестированный при 12,5 мг/кг peros . 2. Продукт, тестированный при 3 мг/кг per os Таблица 2 Пример X Положе Y Ri R2 ния при 3 мг/кг ние 20а 0 7 20 0 0 0 0 7 7 7 7 7 7 7 6 6 7 7 21а 21 22а 22 23а 23 0 -СОСНз СНз -Н -СНз -СгНв -С2Н5 -СНз -СНз -СНз -СНз -СНз -СНз -СбН5 -СвН5 -СНз -СНз -С2Н5 -С2Н5 -СОСНз -Н -СОСНз -Н -СОСНз -Н -СОСНз 26а 26 0 0 0 0 S S 27а S 7 -СОСНз 27 S 7 -н 24а 24 25а 25 % торможе -Н -СОСНз -н 7 -СОСНз 7 -н -н -н -н -н -СНз -СНз -н -н -н -н -н -н -СНз -СНз -н -н 20 53 42 70 66 36 26 36 28 27 23 26 17 18 13476 Продолжение табл.2 Пример 0 0 28а 28 А В С Y Ri R2 % торможения при 3 мг/кг -СОСНз Н -СНз СНз -В В 25 49 X Положение 7 7 сравнительный пример, описанный в примере 1 по европейской заявке на патент № А-0133103 сравнительный пример, описанный в примере 97 по европейской заявке на патент № В-0051023 сравнительный пример, описанный в примере 3 по европейской заявке на патент № А-0290321 14/1/ 5,5/1/ 20/2/ Примечание. 1. Продукт, тестированный при 12,5 мг/кг per os 2. Продукт, тестированный при 3 мг/кг per os Таблица 3 Положение Ri R2 Точка плавления (°С) 5 -СНз Н 166-168 7 8 -СНз -СНз -СНз СГз СНз -СНг-СНз -Н -Н -Н -Н 216 194 164 160 -а -н -н 184,5 158-160 118-120 159-160 6 7 7 7 7 7/ 1/ -СН2-СН2-СН3 -СН2-СН2-СН2-СН2 П р и м е ч а н и е. (1) диглетилтиокарбамит-0-{7,8,9,10-тетрагидро-6-оксо-6Н-дибензо)в, (пиран-3-ил). 19 13476 20 Таблица 4 Положение Ri R2 Точка плавления (°С) 7 7 7 -СНз -СНз -СНг-СНз -Н СНз Н 137 160 140 Таблица 5 Положение Ri R2 Точка плавления (°С) 5 -СНз -Н 129 7 8 6 7 7 7 -СНз -СНз -СНз -CF3 -СНз -СНг-СНз -Н -Н 154 154 137 138 229 124 99-100 132 7 -СНг-СНг-СНз і -/I / -Н -Н -CI -Н -Н -СН2-СН2-СН2-СН2 П р и м е ч а н и е. (1) диметилтиокарбамат-{7,8,9,10-тетрагидро-б-оксо-6-дибензо)в, (пиран-3-ил). 21 22 13476 Таблица 6 Положение Ri R2 Точка плавления (°С) 7 7 7 -СНз -СНз -СН2-СНЗ -Н СНз Н 164 138 116 Таблица 7 Положение Ri R2 Точка плавления (°С) 7 -СНз -Н 136 7 8 6 7 7 7 -СНз -СНз -СНз -СГз -СНз -СНг-СНз -СН2-СН2-СН3 -Н -Н -Н -Н -CI -Н 132 114-115 138-140 115 153 152 88-89 139 7 7/1/ -Н СН2-СН2-СН2-СН2 П р и м е ч а н и е. (1) 7,8,9,10-тетрагидро-3-меркапто-6Н-дибензо)в, пиран-6-он. Таблица 8 Положение Ri R2 Точка плавления (°С) 7 7 7 -СНз -СНз -СНг-СНз -Н СНз Н 120 122 74 134 76 Упорядник Замовлення 4120 Техред М.Мергентал Коректор М.Керецман Тираж Підписне Державне патентне відомство України, 254655, ГСП, Київ-53, Львівська пл., 8 Відкрите акціонерне товариство "Патент", м. Ужгород, вул.Гагаріна, 101
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/70, C07D 311/14, A61K 31/7048, C07H 17/07, C07D 311/08, C07D 311/80, C07H 17/075, C07D 311/18, A61P 7/02, C07D 311/12, C07H 17/04, C07H 17/065, C07D 311/16, C07H 5/00, C07D 311/22, C07D 311/86, A61K 31/7042
Мітки: одержання, бензопіранон-beta-d-тіоксилозидів, спосіб
Код посилання
<a href="https://ua.patents.su/12-13476-sposib-oderzhannya-benzopiranon-beta-d-tioksilozidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання бензопіранон-beta-d-тіоксилозидів</a>
Попередній патент: Контактний теплообмінник
Наступний патент: Спосіб вирощування ентомофагів
Випадковий патент: Протектор для ведучої бурильної труби