Спосіб виробництва медикаменту для профілактики або лікування людей або тварин, які уражені ендотоксемією, фармацевтична композиція, вільна від білків та пептидів (варіанти)
Номер патенту: 46739
Опубліковано: 17.06.2002
Автори: ГОРДОН Брюс Р., ЛІВАЙН Деніел М., ПАРКЕР Томас С., САЛ Стюарт Д., РУБІН Альберт Л.
Формула / Реферат
1. Способ производства медикамента для профилактики или лечения людей или животных, страдающих эндотоксемией, отличающийся тем, что готовят фармакологическую композицию, которая содержит холановую кислоту или соль холановой кислоты, фосфолипид и нейтральный липид.
2. Способ по п. 1, отличающийся тем, что композиция содержит не больше чем приблизительно 80% массы нейтрального липида.
3. Способ по п.1 или 2, отличающийся тем, что композиция содержит не более чем 70% массы нейтрального липида.
4. Способ по одному из пп. 1-3, отличающийся тем, что композиция содержит не более чем приблизительно 50% массы нейтрального липида.
5. Способ по одному из пп. 1-4, отличающийся тем, что композиция содержит от 3 до приблизительно 50% массы нейтрального липида относительно общей массы липида в композиции.
6. Фармацевтическая композиция, лишенная белков и пептидов, которая пригодна для внутривенного использования, при этом композиция содержит холановую кислоту или соль холановой кислоты, фосфолипид и нейтральный липид, причем содержание нейтрального липида составляет приблизительно 3-50% от общей массы липида.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что холановая кислота или соль холановой кислоты является желчной кислотой или солью желчной кислоты.
8. Фармацевтическая композиция по одному из пп.6-7, отличающаяся тем, что фосфолипидом является фосфатидилхолин.
9. Фармацевтическая композиция по любому из пп. 6-8, отличающаяся тем, что фосфолипидом является сфинголипид.
10. Фармацевтическая композиция по любому из пп. 6-9, отличающаяся тем, что нейтральным липидом является триглицерид.
11. Фармацевтическая композиция по любому из пп. 6-9, отличающаяся тем, что нейтральным липидом является сложный эфир холестерина.
12. Фармацевтическая композиция по любому из пп. 7-11, отличающаяся тем, что соль желчной кислоты выбирают из холата натрия, дезоксихолата натрия и хенодезоксихолата натрия.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что соль желчной кислоты является холатом натрия.
14. Фармацевтическая композиция по любому из пп. 6-8, 10 и 13, отличающаяся тем, что содержит фосфатидилхолин, триглицерид и холат натрия.
15. Фармацевтическая композиция по п. 14, отличающаяся тем, что соотношение мас фосфатидилхолин:триглицерид составляет 93:7.
16. Фармацевтическая композиция по п.14, отличающаяся тем, что общее соотношение масс холата натрия, фосфатидилхолина и триглицерида составляет 13,1:81,2:5,7 соответственно.
17. Фармацевтическая композиция по любому из пп.6-16, отличающаяся тем, что ее используют при производстве медикамента для профилактики и лечения людей или животных, страдающих от эндотоксемии.
18. Фармацевтическая композиция, лишенная белка и пептида, которая является эмульсией, содержащая желчную кислоту/соль желчной кислоты, фосфолипид и нейтральный липид, при этом композиция содержит приблизительно 5-30 мас.% желчной кислоты/соли желчной кислоты, приблизительно 3-50 мас.% нейтрального липида и приблизительно 10-95 мас.% фосфолипида.
19. Фармацевтическая композиция по п.18, отличающаяся тем, что содержит приблизительно 10-15 мас.% желчной кислоты/соли желчной кислоты, приблизительно 5-10 мас.% нейтрального липида, а баланс композиции создан фосфолипидом.
20. Фармацевтическая композиция по любому из пп. 18 или 19, отличающаяся тем, что пригодна для внутривенного использования.
21. Фармацевтическая композиция по любому из пп. 18-20, отличающаяся тем, что фосфолипидом является фосфатидилхолин.
22. Фармацевтическая композиция по любому из пп. 18-20, отличающася тем, что фосфолипидом является сфинголипид.
23. Фармацевтическая композиция по любому из пп. 18-22, отличающаяся тем, что нейтральным липидом является триглицерид.
24. Фармацевтическая композиция по любому из пп. 18-22, отличающаяся тем, что нейтральным липидом является сложный эфир холестерина.
25. Фармацевтическая композиция по любому из пп. 18-24, отличающаяся тем, что соль желчной кислоты выбирают из холата натрия, дезоксихолата натрия и хенодезоксихолата натрия.
26. Фармацевтическая композиция по п.25, отличающаяся тем, что соль желчной кислоты является холатом натрия.
27. Фармацевтическая композиция по любому из пп. 18-21, 23 и 26, отличающаяся тем, что содержит фосфатидилхолин, триглицерид и холат натрия.
28. Фармацевтическая композиция по п.27, отличающаяся тем, что соотношение масс фосфатидилхолин:триглицерид составляет 93:7.
29. Фармацевтическая композиция по п.27, отличающаяся тем, что общее соотношение масс холата натрия, фосфатидилхолина и триглицерида составляет 13,1:81,2:5,7 соответственно.
30. Фармацевтическая композиция по любому из пп.18-29, отличающаяся тем, что ее используют при производстве медикамента для профилактики и лечения людей или животных, страдающих от эндотоксемии.
Текст
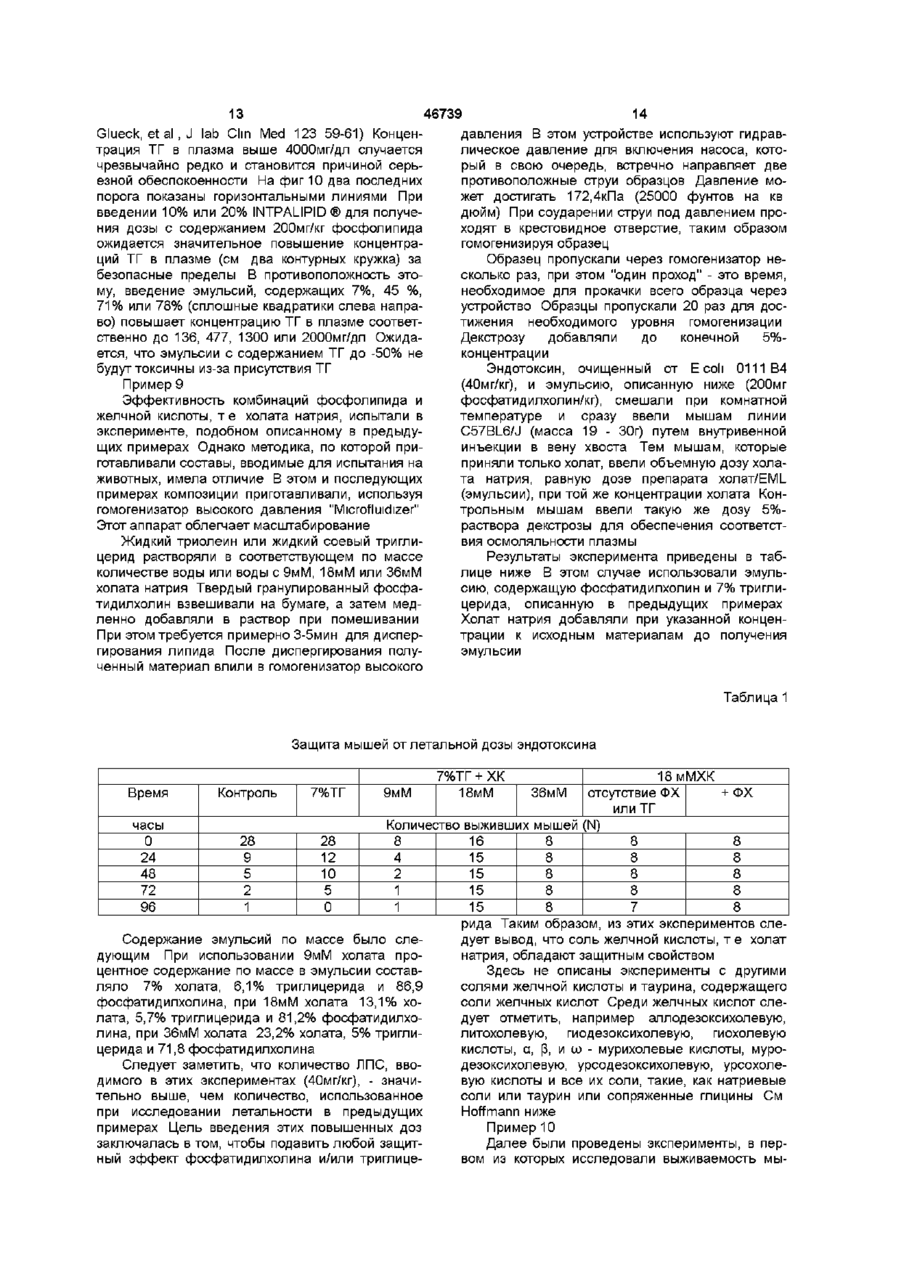
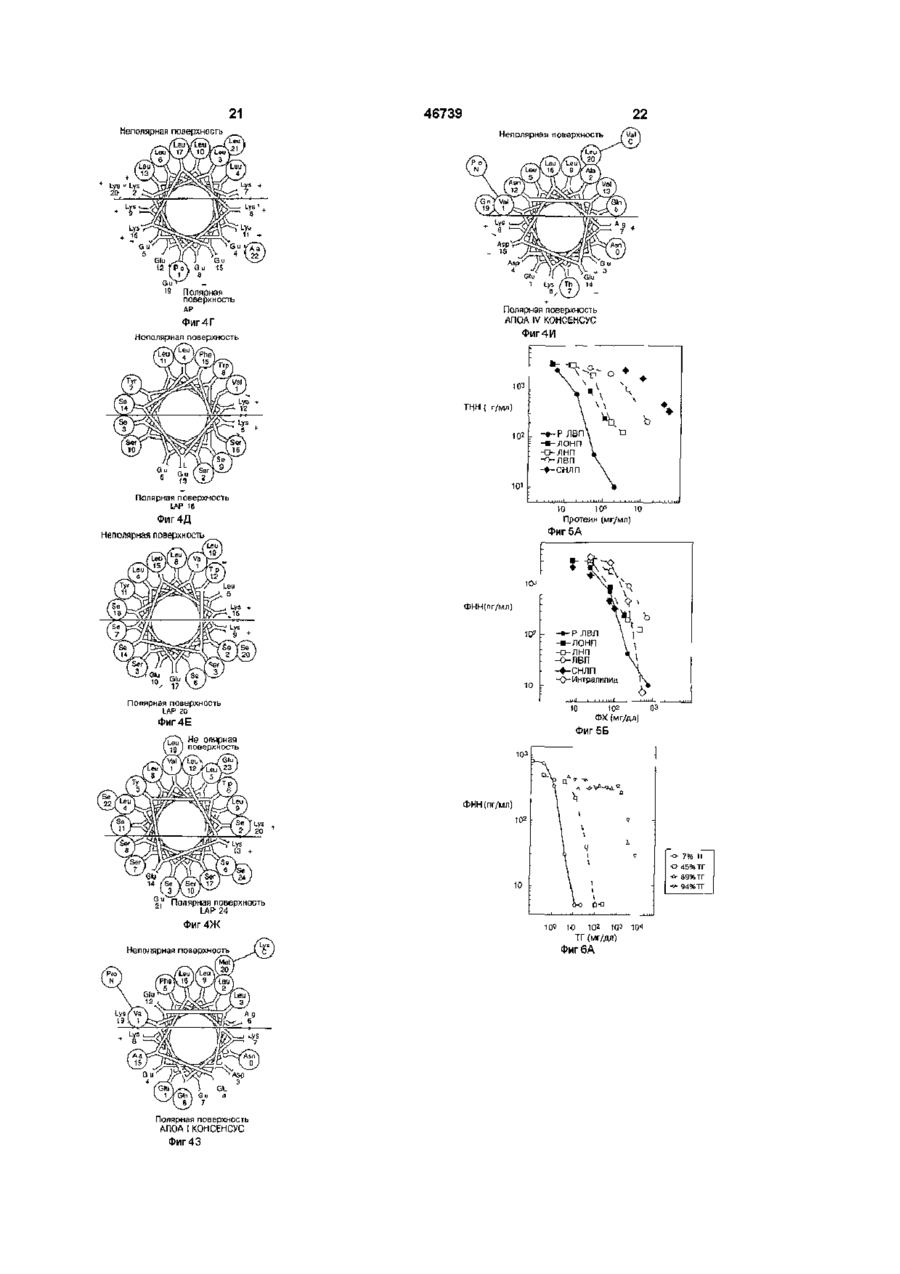
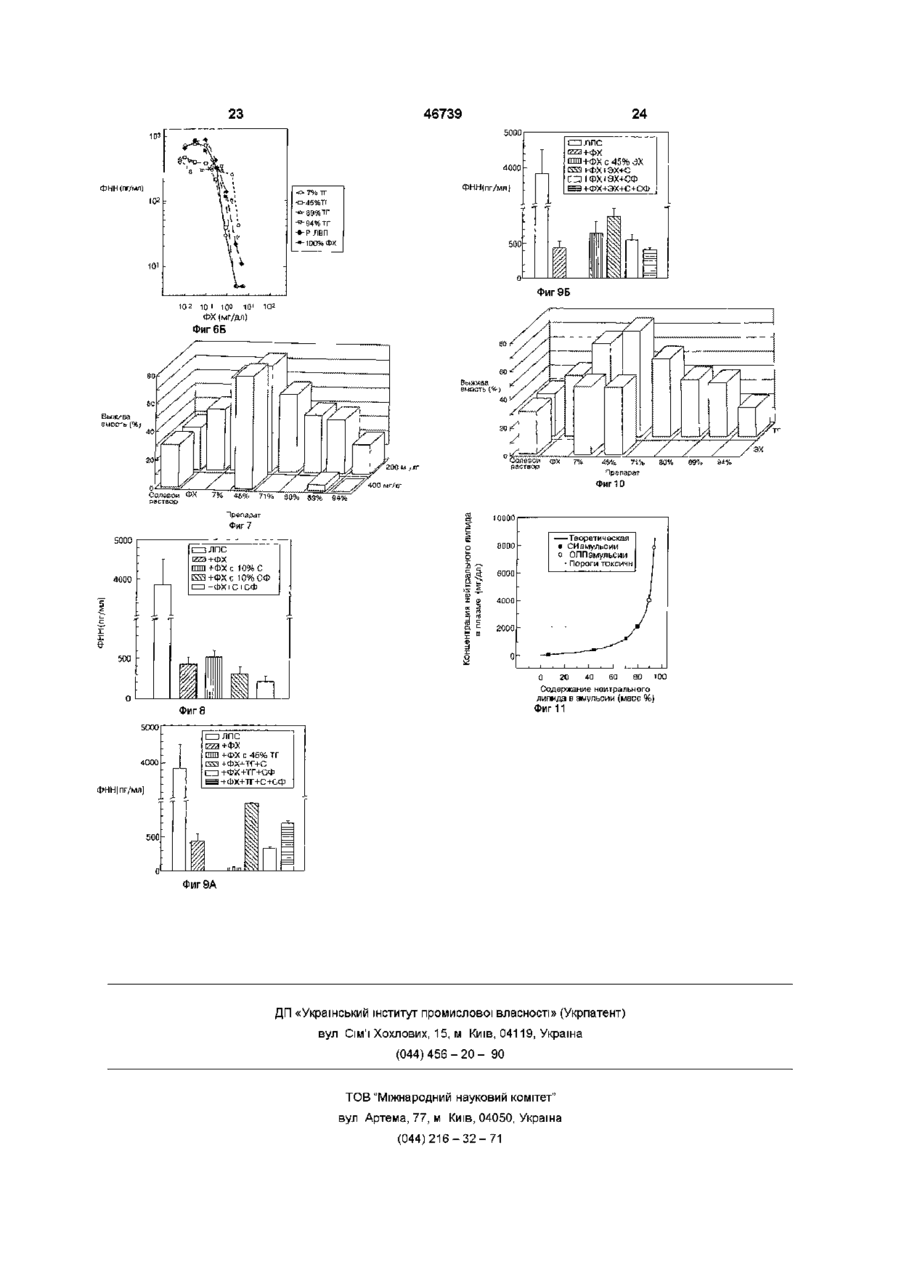
1 Способ производства медикамента для профилактики или лечения людей или животных, страдающих эндотоксемией, отличающийся тем, что готовят фармакологическую композицию, которая содержит холановую кислоту или соль холановой кислоты, фосфолипид и нейтральный липид 2 Способ по п 1, отличающийся тем, что композиция содержит не больше чем приблизительно 80% массы нейтрального липида 3 Способ по п 1 или 2, отличающийся тем, что композиция содержит не более чем 70% массы нейтрального липида 4 Способ по одному из пп 1-3, отличающийся тем, что композиция содержит не более чем приблизительно 50% массы нейтрального липида 5 Способ по одному из пп 1-4, отличающийся тем, что композиция содержит от 3 до приблизительно 50% массы нейтрального липида относительно общей массы липида в композиции 6 Фармацевтическая композиция, лишенная белков и пептидов, которая пригодна для внутривенного использования, при этом композиция содержит холановую кислоту или соль холановой кислоты, фосфолипид и нейтральный липид, причем содержание нейтрального липида составляет приблизительно 3-50% от общей массы липида 7 Фармацевтическая композиция по п 6, отли чающаяся тем, что холановая кислота или соль холановой кислоты является желчной кислотой или солью желчной кислоты 8 Фармацевтическая композиция по одному из пп 6-7, отличающаяся тем, что фосфолипидом является фосфатидилхолин 9 Фармацевтическая композиция по любому из пп 6-8, отличающаяся тем, что фосфолипидом является сфинголипид 10 Фармацевтическая композиция по любому из пп 6-9, отличающаяся тем, что нейтральным липидом является триглицерид 11 Фармацевтическая композиция по любому из пп 6-9, отличающаяся тем, что нейтральным липидом является сложный эфир холестерина 12 Фармацевтическая композиция по любому из пп 7-11, отличающаяся тем, что соль желчной кислоты выбирают из холата натрия, дезоксихолата натрия и хенодезоксихолата натрия 13 Фармацевтическая композиция по п 12, отличающаяся тем, что соль желчной кислоты является холатом натрия 14 Фармацевтическая композиция по любому из пп 6-8, 10 и 13, отличающаяся тем, что содержит фосфатидилхолин, триглицерид и холат натрия 15 Фармацевтическая композиция по п 14, отличающаяся тем, что соотношение мае фосфатидилхолин триглицерид составляет 93 7 16 Фармацевтическая композиция по п 14, отличающаяся тем, что общее соотношение масс холата натрия, фосфатидилхолина и триглицерида составляет 13,1 81,2 5,7 соответственно 17 Фармацевтическая композиция по любому из ппб-16, отличающаяся тем, что ее используют при производстве медикамента для профилактики и лечения людей или животных, страдающих от эндотоксемии 18 Фармацевтическая композиция, лишенная белка и пептида, которая является эмульсией, содержащая желчную кислоту/соль желчной кислоты, фосфолипид и нейтральный липид, при этом композиция содержит приблизительно 5-30 мае % желчной кислоты/соли желчной кислоты, приблизительно 3-50 мае % нейтрального липида и приблизительно 10-95 мае % фосфолипида 19 Фармацевтическая композиция по п 18, отли О го (О З 46739 чающаяся тем, что содержит приблизительно 10лата натрия и хенодезоксихолата натрия 15 мае % желчной кислоты/соли желчной кислоты, 26 Фармацевтическая композиция по п 25, отлиприблизительно 5-10 мае % нейтрального липида, чающаяся тем, что соль желчной кислоты являета баланс композиции создан фосфолипидом ся холатом натрия 27 Фармацевтическая композиция по любому из 20 Фармацевтическая композиция по любому из пп 18-21, 23 и 26, отличающаяся тем, что содерпп 18 или 19, отличающаяся тем, что пригодна жит фосфатидилхолин, триглицерид и холат надля внутривенного использования трия 21 Фармацевтическая композиция по любому из 28 Фармацевтическая композиция по п 27, отлипп 18-20, отличающаяся тем, что фосфолипидом чающаяся тем, что соотношение масс фосфатиявляется фосфатидилхолин дилхолин триглицерид составляет 93 7 22 Фармацевтическая композиция по любому из 29 Фармацевтическая композиция по п 27, отлипп 18-20, отличающася тем, что фосфолипидом чающаяся тем, что общее соотношение масс хоявляется сфинголипид лата натрия, фосфатидилхолина и триглицерида 23 Фармацевтическая композиция по любому из составляет 13,1 81,2 5,7 соответственно пп 18-22, отличающаяся тем, что нейтральным 30 Фармацевтическая композиция по любому из липидом является триглицерид пп 18-29, отличающаяся тем, что ее используют 24 Фармацевтическая композиция по любому из при производстве медикамента для профилактики пп 18-22, отличающаяся тем, что нейтральным и лечения людей или животных, страдающих от липидом является сложный эфир холестерина эндотоксемии 25 Фармацевтическая композиция по любому из пп 18-24, отличающаяся тем, что соль желчной кислоты выбирают из холата натрия, дезоксихо Эта заявка - частичное продолжение заявки № 08/288 568, поданной 10 августа 1994 г, которая является частичным продолжением заявки PCT/US93/07453, поданной 9 августа 1993 г, которая является частичным продолжением заявки США № 07/928930, поданной 12 августа 1992 г, по которой выдан патент США № 5 344 822 Все эти заявки и патенты использованы в этом описании путем ссылок Изобретение относится к лечению эндотоксемии, вызываемой эндотоксинами, в частности, к лечению при отравлениях эндотоксинами введением в организм различных составов, которые нейтрализуют и/или удаляют эндотоксины из организма, а также для профилактики с использованием этих составов Обычная сыворотка содержит некоторое количество частиц липопротеидов, которые различаются плотностью, а именно, хиломикроны, ЛОНП (липопротеид очень низкой плотности), ЛНП (липопротеид низкой плотности), и ЛВП (липопротеид высокой плотности) Они содержат свободный этерифи-цированный холестерин, триглицериды, фосфолипиды, некоторые другие второстепенные липидные компоненты, и белок ЛОНП переносит энергию, в форме триглицеридов, к клеткам тела для накопления и использования При поступлении в клетки триглицеридов ЛОНП превращается в ЛНП ЛНП переносит холестерин и другие растворимые липидами материалы в клетки тела, а ЛВП переносит избыточные или неспособные растворяться липидами материалы в печень для выведения из организма Обычно эти липопротеиды находятся в равновесии, обеспечивая собственно доставку и удаление растворимых липидами материалов Иногда очень низкий уровень ЛВП может стать причиной многих заболеваний, а также может приводить к вторичным осложнениям при других заболеваниях В нормальных условиях, природный ЛВП - это твердая частица, поверхность которой покрыта моно слоем фосфолипида, окружающим гидрофобную сердцевину Аполипротеиды А-І и А-ІІ прикрепляются к поверхности частицы ЛВП в результате взаимодействия гидрофобной поверхности их альфа спиральных доменов При возникновении или выделении эта частица имеет дискообразную форму и способна принимать свободный холестерин в свой бислой Холестерин этерифицируется лецитинхолестеролацилтрансферазой (ЛХАТ) и перемещается в центр диска Движение сложного эфира холестерина к центру происходит из-за пространственной ограниченности и низкого коэффициента растворимости внутри бислоя По мере того, как холестерин этерифицируется и движется к центру, частица ЛВП "раздувается", приобретая сферическую форму Эфир холестерина и другие водонерастворимые липиды, которые накапливаются в "раздутой сердцевине" ЛВП затем выводятся печенью В публикации Anantharamaiah, in Segrest et al, Meth Enzymol 128 627-647 (1986) описан ряд пептидов, образующих "спиральные колеса", как результат взаимодействия аминокислот в пептиде Такие спиральные колеса в своей конфигурации имеют неполярную и полярную поверхности В общем из этого источника следует, что пептиды могут замещать апопротеины в этих частицах В публикации Jonas et al , Meth Enzym 128A 553-582 (1986) показано получение большого разнообразия реконструированных частиц, подобных ЛВП Для получения апо-ЛВП белков выделяют и делипидируют ЛВП стандартными методами (см работы Hatch et al , Adv up Res 6 1-68 (1968), Scanu et al , Anal Biochem 44d 576-588 (1971)) Апопротеины фракционируют и реконструируют фосфолипидом с холестерином или без него, 46739 ка Следует указать, что молекулы ЛПС используя диализ против моющего средства характеризуются структурой типа липида А и чаВ публикации Matz etal, J Biol Chem 257(8) стью полисахарида Эта часть может отличаться 4535-4540 (1982), описана мицелла фосфатидилдеталями у различных молекул ЛПС, но она сохолина с аполипопротеидом А-1 Приведены разхраняет общую структурную основу эндотоксинов личные соотношения двух компонентов и выскаБыло бы неверно говорить, что молекула ЛПС зано предположение, что описанный метод может одинаковая у всех бактерий (см Raetz, выше) быть использован для получения других мицелл Обычно специалисты называют различные молеТакже высказано предположение, что мицеллы кулы ЛПС "эндотоксинами", и этот термин будет можно использовать в качестве субстрата, катаприменяться далее для обозначения молекул лизируемого ферментом, или модели для молекуЛПС лы ЛВП Однако, не рассмотрено применение мицелл для удаления холестерина и не дано никаких В патенте США № 5 128 318, описание к котопредложений использовать их в диагностике или рому использовано путем ссылки, указано, что терапии реконструированные частицы, содержащие как аполипопротеид, ассоциированный с ЛВП, так и В публикации Williams et al , Biochem & Biлипид, способный связывать эндотоксин для его ophys Acta 875 183-194 (1986), касаются фосфоинактивации, можно использовать как эффективлипидных липосом, вводимых в плазму, которая ные материалы для ослабления токсичности, выпоглощает апобелки и холестерин Описаны липозванной эндотоксинами сомы, которые сами поглощают апобелки in vivo, a также холестерин, и высказано предположение, В предшествующих заявках, которые упомянучто поглощение холестерина усиливается в тех ты в разделе "Родственные заявки" и использовафосфолипидных липосомах, которые взаимодейны в настоящем описании путем ссылки, было ствовали и поглотили апобелки указано, что для подавления токсичности, вызванной эндотоксинами, можно использовать и другие В работе Williams et al , Persp Biol & Med материалы В частности, было обнаружено, что 27(3) 417-431 (1984) рассматривают, лецитиноаполипопротеиды не требуются в реконструировые липосомы как средство удаления холестериванных частицах, и что реконструированная часна В статье обобщены предшествующие работы и тица может содержать пептид и липид, где пептид показано, что липосомы, которые содержат апоне является аполипопротеидом белки, удаляют холестерин из клеток in vitro более эффективно, чем липосомы, которые не содержат Изобретателями было также обнаружено, что их Авторы не рассматривают использование in с токсичностью, вызванной эндотоксинами, можно vivo апобелка, содержащего липосомы или мибороться последовательным введением аполипоцеллы, и советуют проявлять осторожность при протеида или пептида, а затем липида Последоработе in vivo с липосомами вательно введенные компоненты образуют реконструированную частицу, и становятся активными в Важно отметить, что между частицами согласвыведении эндотоксинов но настоящему изобретению и липосомами и мицеллами, описанными ранее, имеется четкая и Было также обнаружено, что по меньшей мере значительная разница Последние имеют бислойнекоторые пациенты обладают естественными ную структуру липидсодержащих молекул, которая уровнями аполипопротеида, которые выше норокружает внутреннее водное центральное промальных и позволяют проводить эффективную странство Однако структура липосом не допускатерапию эндотоксемии введением реконструироет заполнение внутреннего пространства компованных частиц, не содержащих аполипопротеид нентами, растворимыми липидами, а любое или пептид, но содержащих описанный липид молекулярное поглощение компонентов, раствоКроме того, изобретение, раскрытое в этих римых липидами, ограничено пространством межзаявках, предполагает использование реконструиду двумя липидными слоями В результате этого рованных частиц и упомянутых компонентов для объем, где возможно поглощение и выделение профилактики токсикации, вызванной эндотокситаких материалов как холестерин и других раствонами, путем введения профилактически эффекримых липидами материалов значительно меньтивного их количества субъектам профилактики К ше, чем объем для частиц согласно изобретению, таким субъектам относятся инфицированные пакоторый увеличивается подобно воздушному шациенты или выздоравливающие после хирургичеру, заполняясь отобранным материалом ской операции Эти пациенты иногда имеют очень низкие уровни ЛВП плазмы крови, снижающиеся Эндотоксиновый бактериально-токсический до 20 % нормальных уровней В этих случаях жешок - это состояние, часто с летальным исходом, лательна ранняя профилактика с использованием провоцируемое выделением липополисахарида ЛВП для компенсации этих понижений (ЛПС) из наружной мембраны большинства грамотрицательных бактерий (например, Eschenchia Было неожиданно обнаружено, что фосфолиcoli Salmonella tymphimunum) Структура бактерипиды можно использовать отдельно или в комбиального ЛПС довольно хорошо объяснена, а нации с дополнительными материалами, такими единственная молекула, названная липид А, свякак нейтральные липиды, холаты и т п , в качестве зана с ацильными цепями через свою глюкозамиэффективного средства для ослабления и/или новую цепь (см Raetz, Ann Pev Biochem 59 129предотвращения эндотоксемии В частности, 170(1990)) предпочитают использовать фосфатидилхолины (далее ФХ) как отдельно, так и в комбинации с Молекула липида А служит мембранным фикдругими фосфолипидами, такими как сфинголисатором структуры липополисахарида (ЛПС), копиды, в композициях, которые по существу своторый участвует в развитии эндотоксинового шо 8 На фиг 10 представлено сравнение результатов, полученных от введения эмульсий, содержащих эфир холестерина и триглицерид, в модели мышей m vivo На фиг 11 показана диаграмма теоретического количество триглицеридов, выделяемых в кровь после введения различных ТГ-содержащих составов, с порогами токсичности Аббревиатура "ОПП" означает "общее парентеральное питание", а "СИ" - составы согласно изобретению Подробное описание примеров воплощения изобретение Пример 1 Для определения уровня выживаемости мышей, зараженных эндотоксинами S tymphimunum, беспородным самцам мыши линии Swiss-Webster вводили солевой раствор (20 мышей), реконструированные частицы ЛВП (40 мышей), или реконструированный пептид 18А (20 мышей) путем инъекции в вену хвоста Вводимые материалы приготовили следующим образом а частицы ЛВП Частицы приготовили из апо-Ни-ЛВП (85% AI, 15% A-II и апо С), реконструированного яичным фосфатидилхолином (2 1 по массе), очищенным на 95 % диализом, против моющего средства согласно известному методу, описанному в публикации Matz et al , J Biol Chem 257 4535-4540 (1982) и в патенте США № 5 128 318, описание которого использовано путем ссылки б пептидные частицы Пептид 18А имеет следующую аминокислотную последовательность Asp-Trp-Leu-Lys-AlaPhe-Tyr-Asp-Lys-Val-Ala-Gly-Lys-Leu-Lys-Glu-AlaPhe Образцы пептидов смешали и реконструировали чистым яичным фосфатидилхолином (2 1 по массе) 95% очистки по вышеуказанному методу (Matz et al , J Biol Chem 257 4535-4540 (1982) и патент США № 5 128 318), также используя диализ против моющего средства Полученные в результате частицы идентичны описанным в пат США № 5 128 318, за исключением того, что вместо апо-ЛВП (Matz et al , J Biol Chem 257 45354540 (1982) и ссылки на патентную литературу) присутствовал пептидный компонент В течение 15мин после введения реконструированного материала мышам ввели ЛПС Salmonella, внутрибрюшинно 10мг/кг массы тела Критерием оценки была выживаемость На фиг 3 представлены результаты эксперимента, где показатели почти в 4 раза выше, чем в контрольной группе с использованием солевого раствора Синтетический пептид почти также эффективен, как и реконструированные частицы, содержащие апоЛВП Пример 2 Факторы, которые влияют на стимуляцию ФНН-а посредством ЛПС при сохранении целостности взаимодействия белков плазмы, и клеточных элементов крови, могут быть соответствующим образом исследованы in vitro на системе цельной крови человека Такую систему использовали для определения того, какие из липопротеидных компонентов важны при нейтрализации ЛПС 46739 бодны от пептидов и белков, например, аполипопротеинов или производные от них пептидов Нейтральные липиды, такие как моно-, ди-, и триглицериды, можно смешивать с фосфолипидами, пока общее количество естественных липидов не станет ниже определенного массового содержания в процентах при использовании этих составов в виде шариков для внутривенного введения При других способах введения, например, внутривенно путем непрерывного вливания, процентное отношение по массе не так важно, но желательно Особенно предпочтительные примеры воплощения изобретения предполагают применение эмульсий, в которых желчную кислоту или ее соль используют вместе с фосфолипидом или нейтральным липидом Показана эффективность желчных кислот и их солей - холатов, при лечении эндотоксемии Эти желчные кислоты могут быть использованы отдельно или в комбинации с одним или более фосфолипидом, и/или нейтральным липидом, таким как фосфатидилхолин и/или триглицерид Более подробно изобретение описано далее Краткое описание иллюстраций На фиг 1 показано, как образуются реконструированные частицы, содержащие апо А-1, фосфолипид и холат На фиг 2 показано как реконструированные частицы поглощают молекулы ЛПС На фигЗ представлены эксперименты, в которых пептид согласно изобретению использовали при изучении снижения токсичности, вызванной эндотоксинами у модели мыши На фиг 4, относящейся к уровню техники, показано образование спиральных колес различными пептидами См Anantharamaiah выше На фиг5А и 5Б показаны результаты, полученные при испытании различных составов в модели, где нейтрализацию эндотоксина определяли, выявляя выделение ФНН в модель цельной крови человека На фиг 5А показано значение белка, а на фиг5Б - фосфолипида Испытанные составы включали природные липопротеиды (ЛОНП, ЛНП, ЛВП), реконструированный ЛВП (РЛВП) и составы INTPALIPID ®, а также эмульсии, содержащие фосфолипид и белок На фигбА и 6Б показано сравнительное значение триглицерида (нейтрального липида) и фосфатидилхолина, фосфолипида в той же модели На фиг 7 представлена информация о токсичности при введении различных ФХ и ФХЛТ композиций в модель мыши, используя модель, зараженную ЛПС Е coli с летальным исходом 55% На фиг 8 приведены данные, сравнимые с данными, полученными выше, при испытании модели цельной крови человека, но при использовании фосфолипида с неэтерифицированным холестерином, сфингомиелином или смесью последних вместо триглицеридов На фигЭА и 9Б показаны результаты, сравнимые с показанными на фиг 5А и 5Б, причем в этом случае фосфолипид, неэтерифицированный холестерин и/или сфингомиелин смешивают с триглицеридами или этерифицированным холестерином в качестве нейтрального липида 46739 10 ные составов испытуемых материалов На фиг5А и 5Б представлены результаты Данные представлены в виде графиков зависимости количества произведенного ФНН-а от концентрации добавленного белка (фиг 5А) и фосфолипида (фиг5Б) Чтобы показать широкий диапазон использованных концентраций, использовали логарифмическую шкалу, где 10° соответствуют 1 мг/мл Все инкубированные системы цельной крови содержали Юнг/мл Е coh 0111 В4 ЛПС, дополненные одним из составов, в качестве экспликации к фиг 5А и 5Б То, что эффективность материалов различна в случае нанесения на график содержания белка (фиг5А) и подобна при нанесении содержания фосфолипида (фиг5Б), говорит о том, что фосфолипид является важным компонентом Это подтвердил и тот факт, что не содержащая белка липидная эмульсия более эффективна, чем природный ЛВП, но менее эффективна, чем Р-ЛВП Белок оказывается не столь важен для нейтрализации В таблице 1 приведены сравнительные дан Испытывали следующие материалы реконструированный высокоплотный липопротеид (Р-ЛВП), природные липопротеиды (ЛОНП, ЛНП, ЛВП) плазмы крови, сыворотку с недостатком липопротеидов (СНЛП) и насыщенную триглицеридом эмульсию 20% INTPALIPID ® (смесь триглицеридов и фосфолипидов) Кровь собирали в гепаринизированную пробирку, разбавляли сбалансированным солевым раствором Хэнка (далее ССРХ) или заливали испытуемый материал, растворенный в ССРХ Полученный материал разлили в пробирки Штарштедта (250мкл/пробирка) Л ПС растворили в апирогенном солевом растворе, содержащем 10 мМ ГЕПЕСбуфера и добавили (2,5мкл) до конечной концентрации Юнг/мл После инкубации в течение 4-х часов при 37°С пробирки охладили до 4°С, после чего центрифугировали при 10000 х g в течение 5 минут Надосадочную жидкость слили и с помощью известного ферментного иммуносорбентного анализа (ELISA) определяли ФНН-а Состав природных липопротеидов и реконструированного ЛВП Класс ЛОНП ЛНП ЛВП Р-ЛВП СНЛП Интралипид Липопротеид Плотность (г/мл)
ДивитисяДодаткова інформація
Автори англійськоюParker Thomas S.
Автори російськоюПаркер Томас С.
МПК / Мітки
МПК: A61P 31/04, A61K 31/225, A61K 31/56, A61K 31/23, A61K 31/685
Мітки: білків, композиція, лікування, спосіб, медикаменту, вільна, пептидів, варіанти, ендотоксемією, виробництва, уражені, профілактики, тварин, фармацевтична, людей
Код посилання
<a href="https://ua.patents.su/12-46739-sposib-virobnictva-medikamentu-dlya-profilaktiki-abo-likuvannya-lyudejj-abo-tvarin-yaki-urazheni-endotoksemiehyu-farmacevtichna-kompoziciya-vilna-vid-bilkiv-ta-peptidiv-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб виробництва медикаменту для профілактики або лікування людей або тварин, які уражені ендотоксемією, фармацевтична композиція, вільна від білків та пептидів (варіанти)</a>
Попередній патент: Установка для пресування виробів із порошкових матеріалів
Наступний патент: Спосіб одержання спиртів
Випадковий патент: Розточувальна оправка