Спосіб отримання n-ацетил-(l)-4-ціанофенілаланіну аc-(l)-phe(4-cn)-oн і n-ацетил-(l)-п-амідинфенілаланін-циклогексилгліцин-b-(3-n-метилпіридин)-аланіну аc-(l)-pаph-сhg-palme(3)-nн2
Формула / Реферат
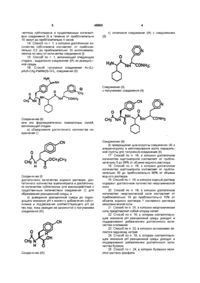
1. Способ получения N-ацетил-(L)-4-цианофенилаланина, соединения (IA):
,
Соединение (IA)
включающий стадии:
а) объединения достаточного количества соединения (I):
,
Соединение (I)
достаточного количества водного раствора, достаточного количества ацетонитрила и достаточного количества cубтилизина для взаимодействия с существенным количеством соединения (I) для образования реакционной среды; и
b) доведения рН реакционной среды до соответствующего значения рН к моменту добавления cубтилизина и поддержания соответствующего pH до тех пор, пока реакция не завершится с получением cоединения (IA).
2. Способ по п. 1, в котором достаточное количество ацетонитрила составляет от приблизительно 5 до 95% от объема реакционной среды.
3. Способ по п. 1, в котором достаточное количество ацетонитрила составляет от приблизительно 50 до приблизительно 60% от объема водного раствора.
4. Способ по п. 1, в котором водный раствор содержит достаточное количество неорганической соли.
5. Способ по п. 4, в котором достаточное количество неорганической соли составляет от приблизительно 10 до приблизительно 15% в расчете на объем водного раствора 1 молярного раствора неорганической соли.
6. Способ по п. 5, в котором неорганическая соль представляет собой хлорид калия.
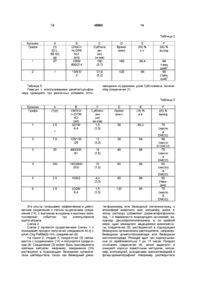
7. Способ по п. 1, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества основания.
8. Способ по п. 7, в котором основанием является гидроксид натрия.
9. Способ по п. 1, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества буфера.
10. Способ по п. 9, в котором буфером является раствор фосфата.
11. Способ по п. 1, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 5 до примерно 9.
12. Способ по п. 1, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 6,5 до примерно 7,5.
13. Способ по п. 1, далее включающий перемешивание реакционной среды до тех пор, пока не завершится реакция между достаточным количеством субтилизина и существенным количеством соединения (I) в течение от приблизительно 15 минут до приблизительно 4 часов.
14. Способ по п. 1, в котором достаточное количество субтилизина составляет от приблизительно 0,5 до приблизительно 10 миллиэквивалентов по весу от количества соединения (I).
15. Способ по п. 1, включающий следующую стадию - выделение соединения (IA) из реакционной среды.
16. Способ получения соединения Ac-(L)-pAph-Chg-PalMe(3)-NH2, cоединения (II)
Соединение (II)
или его фармацевтически приемлемых солей, включающий стадии:
а) объединения достаточного количества соединения (I):
,
Соединение (I)
достаточного количества водного раствора, достаточного количества ацетонитрила и достаточного количества cубтилизина для взаимодействия с существенным количеством соединения (I) для образования реакционной среды; и
b) доведения реакционной среды до подходящего значения рН к моменту добавления cубтилизина и поддержания соответствующего рН до тех пор, пока реакция не закончится с получением cоединения (IA)
;
Соединение (IА)
с) сочетания соединения (IА) с соединением (3):
Соединение (3)
с получением соединения (4):
;
Соединение (4)
d) превращения цианогруппы соединения (4) в амидиногруппу и метилирования азота пиридильной группы для получения соединения (II).
17. Способ по п. 16, в котором достаточное количество ацетонитрила составляет от приблизительно 5 до 95% от объема водного раствора.
18. Способ по п. 16, в котором достаточное количество ацетонитрила составляет от приблизительно 50 до приблизительно 60% от объема водного раствора.
19. Способ по п. 16, в котором водный раствор содержит достаточное количество неорганической соли.
20. Способ по п. 19, в котором достаточное количество неорганической соли составляет от приблизительно 10 до приблизительно 15% от объема водного раствора 1 молярного раствора неорганической соли.
21. Способ по п. 20, в котором неорганическая соль представляет собой хлорид калия.
22. Способ по п. 16, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества основания.
23. Способ по п. 22, в котором основанием является гидроксид натрия.
24. Способ по п. 16, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества буфера.
25. Способ по п. 24, в котором буфером является раствор фосфата.
26. Способ по п. 16, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 5 до примерно 9.
27. Способ по п. 16, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 6,5 до примерно 7,5.
28. Способ по п. 16, включающий также перемешивание реакционной среды до тех пор, пока не завершится реакция между достаточным количеством субтилизина и существенным количеством соединения (І) в течение от приблизительно 15 минут до приблизительно 4 часов.
29. Способ по п. 16, в котором достаточное количество субтилизина составляет от приблизительно 0,5 до приблизительно 10 миллиэквивалентов по весу от количества соединения (I).
30. Способ по п. 16, включающий также стадию выделения соединения (ІА) из реакционной среды.
Текст
1 Способ получения І\І-ацетил-(І_)-4-цианофенилаланина, соединения (IA) Соединение (IA) включающий стадии а) объединения достаточного количества соединения (I) Соединение (I) достаточного количества водного раствора, достаточного количества ацетонитрила и достаточного количества субтилизина для взаимодействия с существенным количеством соединения (I) для образования реакционной среды, и Ь) доведения рН реакционной среды до соответствующего значения рН к моменту добавления субтилизина и поддержания соответствующего рН до тех пор, пока реакция не завершится с получением соединения (IA) 2 Способ по п 1, в котором достаточное количество ацетонитрила составляет от приблизительно 5 до 95% от объема реакционной среды 3 Способ по п 1, в котором достаточное количество ацетонитрила составляет от приблизительно 50 до приблизительно 60% от объема водного раствора 4 Способ по п 1, в котором водный раствор содержит достаточное количество неорганической соли 5 Способ по п 4, в котором достаточное количество неорганической соли составляет от приблизительно 10 до приблизительно 15% в расчете на объем водного раствора 1 молярного раствора неорганической соли 6 Способ по п 5, в котором неорганическая соль представляет собой хлорид калия 7 Способ по п 1, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества основания 8 Способ по п 7, в котором основанием является гидроксид натрия 9 Способ по п 1, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества буфера 10 Способ по п 9, в котором буфером является раствор фосфата 11 Способ по п 1, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 5 до примерно 9 12 Способ по п 1, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 6,5 до примерно 7,5 13 Способ по п 1, далее включающий перемешивание реакционной среды до тех пор, пока не завершится реакция между достаточным коли О го 00 48993 чеством субтилизина и существенным количеством соединения (І) в течение от приблизительно 15 минут до приблизительно 4 часов 14 Способ по п 1, в котором достаточное количество субтилизина составляет от приблизительно 0,5 до приблизительно 10 миллиэквивалентов по весу от количества соединения (I) 15 Способ по п 1, включающий следующую стадию - выделение соединения (IA) из реакционной среды 16 Способ получения соединения Ac-(L)pAph-Chg-PalMe(3)-NH2, соединения (II) с) сочетания соединения (IA) с соединением (3) Соединение (3) с получением соединения (4) Соединение (II) или его фармацевтически приемлемых солей, включающий стадии а) объединения достаточного количества соединения (I) Соединение (I) достаточного количества водного раствора, достаточного количества ацетонитрила и достаточного количества субтилизина для взаимодействия с существенным количеством соединения (I) для образования реакционной среды, и Ь) доведения реакционной среды до подходящего значения рН к моменту добавления субтилизина и поддержания соответствующего рН до тех пор, пока реакция не закончится с получением соединения (IA) Соединение (IA) Соединение (4) d) превращения цианогруппы соединения (4) в амидиногруппу и метилирования азота пиридильной группы для получения соединения (II) 17 Способ по п 16, в котором достаточное количество ацетонитрила составляет от приблизительно 5 до 95% от объема водного раствора 18 Способ по п 16, в котором достаточное количество ацетонитрила составляет от приблизительно 50 до приблизительно 60% от объема водного раствора 19 Способ по п 16, в котором водный раствор содержит достаточное количество неорганической соли 20 Способ по п 19, в котором достаточное количество неорганической соли составляет от приблизительно 10 до приблизительно 15% от объема водного раствора 1 молярного раствора неорганической соли 21 Способ по п 20, в котором неорганическая соль представляет собой хлорид калия 22 Способ по п 16, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества основания 23 Способ по п 22, в котором основанием является гидроксид натрия 24 Способ по п 16, в котором соответствующее значение рН реакционной среды доводят и поддерживают добавлением достаточного количества буфера 25 Способ по п 24, в котором буфером является раствор фосфата 48993 26 Способ по п 16, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 5 до примерно 9 27 Способ по п 16, в котором соответствующее значение рН реакционной среды устанавливают и поддерживают в интервале от примерно 6,5 до примерно 7,5 28 Способ по п 16, включающий также перемешивание реакционной среды до тех пор, пока не завершится реакция между достаточным коли чеством субтилизина и существенным количеством соединения (І) в течение от приблизительно 15 минут до приблизительно 4 часов 29 Способ по п 16, в котором достаточное количество субтилизина составляет от приблизительно 0,5 до приблизительно 10 миллиэквивалентов по весу от количества соединения (I) 30 Способ по п 16, включающий также стадию выделения соединения (IA) из реакционной среды Настоящее изобретение относится к новому способу получения ІЧ-ацетил-(І_)-4-цианофенилаланина разделением рацемата этилового эфира І\І-ацетил-(О, І_)-4-цианофенилаланина и к новому способу получения стереоизомера Ac-(L)pAph-Chg-Pal Me(3)-NH2 с использованием в качестве промежуточного соединения І\І-ацетил-(І_)-4цианофенилаланина Уровень, предшествующий изобретению Рацемические соединения І\І-ацетил-(О, І_)-4цианофенилаланин и Ac-(L)-pAph-Chg-Pal Me(3)NH2 раскрыты и описаны в заявке 08/428404, поданной 25 апреля 1995г, которая является частичным продолжением заявки США № 08/233054, поданной 26 апреля 1994г, которая упоминается здесь в качестве ссылки Конечный продукт Ac-(L)pAph-Chg-Pal Me(3)-NH2 используется как ингибитор фактора Ха Для разработки лекарств желательно получение стереоизомеров вместо рацематов, т к стереоизомеры могут обладать большими преимуществами по сравнению с рацематами, например, в плане повышенной эффективности меньшего числа побочных эффектов, более низких уровней или отсутствия токсичности и т д Иногда эти преимущества стереоизомера по сравнению с рацематом не известны до последних стадий разработки или даже до тех пор, пока лекарство не будет выпущено в продажу Государственные структуры, которые утверждают выпуск лекарств на рынок, также предпочитают лекарственные средства, содержащие стереоизомеры, а не его рацемат Поэтому желательна разработка способа получения стереоизомера соединения Ac-(L)pAph-Chg-Pal Me(3)-NH2 Ключевым промежуточным соединением для получения этого стереоизомера является стереоизомер 1\1-ацетил-(1_)-4цианофенилаланин помощью ферментов, в частности, гидролаз или эстераз, применяется при разделении аминокислот, как описано в Chemistry and Biochemistry of the Ammo Acids, Chapman and Hall, New York, 1984, Chap 10 pp 338-353, в Applications of Biochemical Systems in Organic Chemistry, Part I J В Jones, С J Sih, и D Perlman, Wiley, New York, 1976, Chap 4 pp 107-401, а также в Chemistry of the Ammo Acids, vol 1 Wiley, New York, 1961, Chap 9 pp 728-750 Даже после того, как способ выбран, специалисту необходимо провести широкую экспериментальную работу, чтобы подобрать нужный растворитель, сорастворитель (если требуется), температуру, продолжительность и другие условия для обеспечения эффективного и действенного разделения рацемата, что обусловило бы легкое выделение целевого соединения, высокие выходы, значительный избыток энантиомера и не слишком трудоемкий способ осуществления процесса Настоящее изобретение позволяет решить эти проблемы по разделению ^ацетил(О,І_)-4цианофенилаланина, L-изомер которого затем используется как промежуточное соединение в процессе получения Ac-(L)-pAph-Chg-Pal Me(3)NH2, Соединения (II) Для того, чтобы разделить рацемат, необходимо выбрать один из множества методов, известных для этой цели Некоторые примеры образования диастереоизомеров с последующими кристаллизацией или дифференцированной абсорбцией (хроматографией) (как описано в «Епantiomers, Racemates and Resolutions, J Jacques, A Collet and SHWilen, Wiley (1981)), хроматографическим разделением в хиральной стационарно фазе, кинетическим разделением и ферментативным разделением Известно, что разделение с Краткое описание изобретения Изобретением предлагается способ получения ^ацетил-(І_)-4-цианофенилаланина, соединения (IA) включающий стадии а) объединения достаточного количества Соединения (I) 48993 с) взаимодействия соединения (1А) с соединением (3) И б достаточного количества водного раствора, достаточного количества ацетонитрила и достаточного количества Субтилизина 1ля взаимодействия с существенным количеством соединения (I) для создания реакционной среды, и Ь) доведения рН реакционной среды до соответствующего значения рН в момент добавления Субтилизина и поддержания і соответствующего рН до тех пор, пока реакция не закончится с получением соединения (ІА) Изобретение также касается способа получения соединения Ac-(L)-pAph-Chg-Pal Me(3)-NH2, Соединения (II) с получением соединения (4) 0 f ' О о или его фармацевтически приемлемых солей, включающий стадии а) объединения достаточного количества Соединения (I) ОСН 2 СН 3 d) превращения цианогруппы соединения (4) в амидиногруппу и метилирования азота в пиридильной группе с получением соединения (II) Подробное описание предпочтительных вариантов Следующие термины имеют значения, раскрытые ниже а) термин «Ас» или «ацетил» относится к функциональному фрагменту формулы О Ь) термин «амидино» относится к функциональному фрагменту формулы н 6 достаточного количества водного раствора, достаточного количества Субтилизина для взаимодействия с существенным количеством соединения (I) для создания реакционной среды, и Ь) доведения рН реакционной среды до соответствующего значения рН в момент добавления Субтилизина и поддержания соответствующего рН до тех пор, пока реакция не закончится с получением Соединения (1А) —ч. H N с) термин «пиридил» относится к функциональному фрагменту формулы Стереоизомеры - общее название всех изомеров, которые отличаются друг от друга только расположением атомов в пространстве Они включают изомеры соединений с более, чем одним хиральным центром, которые не являются 10 48993 зеркальными отражениями друг друга (диастереомеры или диастереоизомеры) Термин «энантиомер» относится к двум стереоизомерам, которые представляют собой не совпадающие при наложении зеркальные отражения друг друга Термин «хиральный центр» относится к атому углерода, к которому присоединены четыре различные группы Номенклатура L/D или R/S используется в соответствии с IUPAC-IUB Joint Commission on Biochemical Nomenclature, Eur J Biochem , 138 9-37 (1984) Хиральное вещество может либо содержать равные количества R- и Sизомеров (или L- и D- изомеров), при этом оно называется «рацемическим» или «рацематом», либо оно может не содержать равных количеств R и S (или L- и D-изомеров) и тогда оно называется «оптически активным» или «нерацемическим» Термин «разделение» означает разделение рацемической смеси на ее оптически активные компоненты Термин «энантиомерный избыток» или «эй» означает процент, на который, один энантиомер, Е1, находится в избытке в смеси двух энантиомеров (Е1 + Е2) так что те природные аминокислоты, которые, как правило, не входят в состав белков Аббревиатуры аминокислот, аминокислотных аналогов, подпадающих под объем данной характеристики, приводятся в Таблице 1 ТАБЛИЦА 1 Аминокислота Алании Фенилаланин п-цианофенилаланин п-амидинофенилаланин циклогексил глицин Р-(3-пиридил)-аланин Р-(3-М-метилпиридиния)аланин Схема 1 Разделение Соединения (1) Схема 1 Разделение этилового эфира NАцетил-(О,І_)-4-цианофенилаланина означает связь, которая направлена вперед от плоскости листа Значок означает связь, которая направлена назад (обратно) от плоскости листа Термин «фармацевтически приемлемые соли» включает такие соли присоединения кислот, которые получены взаимодействием с кислотами, например, соляной, бромистоводородной, серной, азотной или фосфорной кислотами и такими органическими карбоновыми кислотами, как уксусная, трифторуксусная, пропионовая, гликолевая, малеиновая, щавелевая, лимонная, салициловая, 2ацетилоксибензойная кислоты, или органическими сульфокислотами, например, метансульфокислотой, 4-толуолсульфокислотой и нафталинсульфокислотой Конечно, и другие кислоты, хорошо известные в фармацевтической области, могут быть также использованы В используемом здесь значении под термином «аминокислота» подразумеваются аминокислоты природного происхождения, которые считываются с генетического кода и являются основными составными частями белков Подразумевается, что «аминокислота» также включает, если иное не указано особо, и (1_)-аминокислоты и (D)аминокислоты, химически модифицированные аминокислоты, например, аналоги аминокислот, соон стадий А р—NC (Е1 - Е2) 100% = эй (Е1 + Е2) Термин (+) означает плюс энантиомер, (-) означает минус энантиомер Значок Обозначение Ala Phe Phe(4-CN) pAphe Chg Pal PalMe(3) и. соединение I NA Hc >—* * Mil 1 OA) ' ЫС-ч, -*упмы сн3 н о Соединение (5) Стадия С метилирование 5СН 3 Соединение (6) Соединение (II) 16 48993 17 ратным холодильником в течение 3 - 4 часов и оставляют на ночь Выливают смесь на лед (2 л), отфильтровывают осадок, промывают водой и сушат в лиофилизаторе Рекристаллизуют из метанола с получением 4-цианобензилацетамидомалоната в виде белых кристаллов (61 г, 91%) Стадия В Этиловый эфир N-(D, І_)-ацетил-4цианофенилаланина, Ac-(D, L) Phe(4-CN)-OEt COOEt -і НАс В этаноле (0,6 л) суспендируют 4-цианобензил диэтилацетамидомалрнат (41,97г, 0,126 моль) Добавляют гидроксид натрия (6М) со следующими интервалами 10мл (60 ммоль) в 0 минут, 10мл (60 ммоль) через 30 минут, 5мл (30 ммоль) через 3 часа Перемешивают реакционную смесь с добавлением гидроксида натрия (6М), пока не исчезнет исходное вещество (ТСХ, этилацетат, Rf = 0,63) Раствор разбавляют водой -(100мл) и доводят рН до 3 добавлением концентрированной соляной кислоты Этанол выпаривают и полутвердый продукт подвергают лиофилизации в течение ночи с получением ІЧ-ацетил-4-цианобензил моноэтилацетамидомалонат Полученный таким образом ІЧ-ацетил-4цианобензил моноэтилацетамидомалонат суспендируют в безводном диоксане (0,5 л) и нагревают при кипячении с обратным холодильником в течение 2,5 - 3 часов Диоксан отгоняют, твердый осадок суспендируют в этилацетате < (250мл) и экстрагируют насыщенным водным раствором бикарбоната натрия (Зх), водой, соляной кислотой (0,5М) и раствором соли (рассолом) Этилацетатный раствор сушат над сульфатом магния, фильтруют и выпаривают Продукт рекристаллизуют из смеси этил ацетат/гексан с получением 28,95 (88%) этилового эфира N-(L, О)-ацетил-4цианофенилаланина Пример 2 Ферментативное разделение Ac-(D, L)Phe (4CN)-OEt (6 4, D L) и получение (Ь)-Ы-ацетил-4цианофенилаланина, Ac-(L)Phe(4-CN)-OH соон К раствору AC-(D, L)Phe (4-CN)-OEt (6 4, D L, 67г) в ацетонитриле (1 л) добавляют раствор хлорида калия (1М, 241мл) и воду (600мл) рН раствора доводят от 7,3 до 6,9 и добавляют раствор Субтилизина Carlsberg (50мг) в водном растворе хлорида калия (8мл, 0,1 М), рН раствора поддерживают подтитровыванием гидроксидом натрия (1М) Спустя 1 час добавляют раствор субтилизина (50мг) в водном растворе хлорида калия (8мл, 0,1 М) и поддерживают рН раствора, прикалывая гидроксид натрия (1М) Спустя 2,5 часа до 18 бавляют раствор бикарбоната натрия (800мл) и экстрагируют этилацетатом (4 х-800мл) Этилацетатный раствор сушат над сульфатом магния и смесь отфильтровывают Фильтрат концентрируют с получением Ac-(D)Phe(4-CN)-OEt в твердом виде (38г, 95%, 90% 3%) Водный слой подкисляют концентрированной соляной кислотой (56мл) до рН 1 Экстрагируют водный слой этилацетатом (4 х 800мл) Органический слой высушивают над сульфатом магния и смесь отфильтровывают Фильтрат концентрируют и получают Ac-(l_)-Phe(4CN)-OH в твердом виде (21 г, 88%) Т пл 124126°С 99,4% эй Пример 3 |\|-Ацетил-(1_)-п-амидинофенилаланин, pAph-(L)-Chg-(1,1 -Ра1 Me(3)-NH2 Ac-(L) Стадия А 1Ч-1:-бутилоксикарбонил-(1_)-р-(3пиридил)-аланинамид, Boc-(L)-Pal-NH2 ONH2 Boc-N-H Суспендируют Boc-(L)-Pal-OH (1,34г, 5ммоль) в метиленхлориде (50мл) и охлаждают до -15°С Добавляют диизопропилэтиламин (963мкл, 5,5ммоль) и изобутилхлорформиат (715мкл, 5,5ммоль) Смесь перемешивают 15 мин при 15°С Через раствор пропускают сильный ток безводного аммиака (над твердым гидроксидом натрия) в течение около 3 минут Смесь перемешивают 10 мин при -15°С и 20 мин при комнатной температуре Выпаривают метиленхлорид, добавляют етилацетат (70мл) и промывают насыщенным водным раствором бикарбоната натрия Сушат над сульфатом магния и выпаривают Кристаллизуют из смеси этил ацетат/гексан и получают Boc-(L)-Pal-NH2 (0,98г, 75%) Стадия В (І_)-р-(3-пиридил)-аланин амид гидрохлорид H-(L)-Pal-NH2 • 2HCI DNHj 2 на 19 Суспендируют Boc-(L)-Pal-NH2 (0,98г) в метиленхлориде (15мл) при легком нагревании и добавляют раствор соляной кислоты (4 М, 10мл) в диоксане Спустя 30 мин выпаривают метиленхлорид и диоксан Твердый остаток растворяют в метаноле, осаждают добавлением эфира и отфильтровывают продукт, получая H-(L)-Pal-NH2 • 2HCI (0,86г, 98%) Стадия С г\І-трет-бутилоксикарбонил-(І_)циклогексилглицин-(1_)-р-(3-пиридил)аланин амид Boc-(L)-Chg-(L)-Pal-NH2 48993 20 ОН (0,84г, З.бммоль) диизопропилэтиламин (Юммоль) и дифенилфосфорилазид (803мкл, З.бммоль) в диметилформамиде (30мл) Выпаривают диметилформамид, осаждают эфиром, фильтруют и промывают эфиром до получения Ac-(L)-Phe(4-CN)-(L)-Chg-(L)-Pal-NH2 (1,282г, 82%) Стадия F І\І-Ацетил-(І_)-п-тиоамидфенилаланин-(І_)-циклогексилглицин-(І_)-р-(3-пиридил)аланин амид Ас-(І_)-Рпе(4-тиамид)-(І_)-Спд-(І_)-РаІNH2 В течение ночи в диметилформамиде (15мл) перемешивают H-(L)-Pal-NH2 • 2HCI (432мг, 1,82ммоль), Boc-(L)-Chg-OH (609мг, 2,37ммоль, 1,3 эквивалента), дициклогексилкарбодиимид (494мг, 2,4ммоль), гидроксибензотриазол (324мг, 2,4ммоль) и диизопропилэтиламин (4ммоль) в ДМФА (15мл) Диметилформамид выпаривают, добавляют етилацетат и оставляют смесь при комнатной температуре на 1 час Отфильтровывают образовавшуюся диизопропилкарбодиимидциклогексилмочевину, экстрагируют раствор насыщенным раствором бикарбоната натрия (Зх), сушат над сульфатом магния и выпаривают Кристаллизуют при добавлении гексана с получением Boc-(L)-Chg-(L)-Pal-NH2 (598мг, 81%) Стадия D (І_)-циклогексилглицин-(І_)-р-(3пиридил)-аланин-амида гидрохлорид H-(L)-Chg(L)-Pal-NH2«2HCI Суспендируют Boc-(L)-Chg-(L)-Pal-NH2 (1,27г, 3,12ммоль) в метиленхлориде (50мл) и добавляют соляную кислоту (10мл, 4М в диоксане) Спустя 30 мин выпаривают диоксан и метиленхлорид, растворяют твердый остаток в метаноле и осаждают продукт добавлением эфира (200мл), отфильтровывают, получая H-(L)-Chg-(L)-Pal-NH2 • 2HCI (1,12г, 95%) Стадия Е г\І-Ацетил-п-цианофенилаланин-(І_)циклогексилглицин-(І_)-р-(3-пиридил)-аланин-амид Ac-(L)-Phe(4-CN)-(L)-Chg-(L)-Pal-NH2 Перемешивают в течение ночи H-(L)-Chg-(L)Pal-NH2 • 2HCI (1,13г, Зммоль), Ac-(L)-Phe(4-CH) О В диметилсульфоксиде (20 - 40мл) растворяют Ac-(L)-Phe(4-CN)-(L)-CHg-(L)-Pal-NH2 (1,18г, 2,28ммоль) и добавляют пиридин (40мл) и триэтиламин (14мл) Через раствор при комнатной температуре в течение 30 мин пропускают сероводород Раствор выдерживают при комнатной температуре в течение ночи, выпаривают до малого объема и осаждают продукт диэтиловым эфиром Помещают в холодильник на несколько часов, отфильтровывают, промывают диэтиловым эфиром и высушивают в вакууме до получения Ac-(L)-Phe(4-THoaMHfl)-(L)-Chg-(L)-Pal-NH2 (1,26г) в виде твердого желтого продукта Стадия G Иодистоводородная соль N-Ацетилп-метилтиоамидат-фенилаланинциклогексилглицин-(І_)-р-(3-метилпиридиний)аланина Ас-(І_)-Рпе(4-метил тиоамидат)-(І_)-Спд(L) -Pal (Me) -NH2 • 2HI SCH3 48993 21 Суспендируют Ac-(l_)-Phe (4-тиоамид)-(І_)Chg(L)-Pal-NH2 (1,2г) в диметилсульфоксиде (10 20мл) и ацетоне (80мл) Добавляют метилиодид (14мл, 50 эквив) Оставляют реакционную смесь на ночь при комнатной температуре, выпаривают ацетон и избыток метилиодида Осаждают диэтиловым эфиром (0,5 -1,1) После выдержки при 4°С в течение нескольких часов декантируют или отфильтровывают диэтиловый эфир и полутвердый продукт, оставшийся на стенках, промывают диэтиловым эфиром и этилацетатом Продукт высушивают в вакууме и получают Ac-(l_)-Phe (4метилтиоамидат)-(І_)-Сгід(І_)-РаІ(Ме)-І\ІН2 • 2НІ Стадия Н Соль І\І-Ацетил-(І_)-п-ацетамидофенил-аланин-циклогексилглицин-(І_)-р-(3-г\І-метилпиридиниум)-аланин-амида трифторуксусной кислоты Растворяют Ас-(І_)-Рпе(4-метилтиоамидат)-(І_)Chg-(1,)-Pal(Me)-NH2 • 2HI (1,31 г) в метаноле (50мл) Добавляют ацетат аммония (0,8г) Нагревают смесь до 55°С в течение 3 часов, выпаривают, растворяют в смеси ацетонитрил/вода (0,1% три фтору ксусная кислота) (1 1), фильтруют и подвергают лиофилизации с получением Ac(L)-pAphe(L)-Chg-(L)-PalMe-NH2 • TFA (1,22г) CF3COO Настоящее изобретение относится к получению промежуточного соединения (1А)- производного І\І-ацетил-І_-фенилаланин, используемому в процессе получения Ac-(L)-pAph-Chg-PalMe(3)NH2, соединения (II) Последнее соединение пригодно для ингибирования белков свертывания крови и особенно для ингибирования ферментного фактора свертывания крови «Ха», как более полно описано в Заявке US 08/428404, поданной 25 апреля 1995 года, которая упоминается здесь в качестве ссылки В используемом здесь смысле выражение «активность фактора Ха» означает способность фактора Ха, самого по себе или в совокупности с субъединицами, известными как протромбиназный комплекс, катализировать превращение протромбина в тромбин Относительно «активности фактора Ха» термин «ингибирование» подразумевает как прямое, так и косвенное ингибирование активности фактора Ха Прямое ингибирование активности фактора Ха может быть, например, осуществлено связыванием фактора Ха с пептидом или с протромбиназой таким образом, что предотвращается связывание протромбина с активным сайтом протромбиназного комплекса В данном здесь смысле термин «специфич 22 ный» при использовании относительно ингибирования активности фактора Ха подразумевает, что соединение ингибирует активность фактора Ха без значительного ингибирования активности других специфичных протеаз (при использовании одной и той же концентрации ингибитора) К таким иным специфичным протеазам относятся, например, такие, которые включены в каскадный процесс коагуляции, например, тромбин, плазмин, трипсин и эластаза Несмотря на то, что при определенных болезненных состояниях образование кровяных тромбов внутри системы кровообращения является само по себе источником заболеваемости, абсолютно подавлять систему свертывания крови нежелательно, т к может возникнуть угрожающее жизни кровотечение Процесс свертывания крови является сложным, комплексным, включающим постепенно распространяющуюся серию энзимно-активируемых реакций, в которых проферменты плазмы последовательно активируются при ограниченном протеолизе Упрощенно каскадный процесс свертывания крови делят на два направления «внутреннее» и «внешнее» Эти направления сводятся к активации фактора X с последующей выработкой тромбина, действующего на протяжении всего «общего течения процесса» Эти данные наводят на мысль о том, что «внутреннее» течение процесса играет важную роль в поддержании уровня и повышении образования фибрина, тогда как «внешнее» направление является решающим в плане начальной фазы коагуляции крови Сейчас в целом признается, что свертывание крови физически инициируется образованием комплекса тканевый фактор/фактор УПа Однажды образовавшийся этот комплекс быстро вызывает коагуляцию путем активирования факторов IX и X Вновь образованный Ха затем формирует комплекс (один к одному) с фактором VIIA и фосфолипидами Этот, так называемый протромбиназный комплекс ответственен за превращение растворимого фибриногена в нерастворимый фибрин По мере того, как со временем развивается активность комплекса, фактор УПалжаневый фактор (внешний путь) протеазой Kumtz-типа подавляется ингибиторный белок, TFPI, который при образовании комплекса с фактором Ха, может непосредственно ингибировать протеолитическую активность комплекса фактор УПалжаневый фактор Для того, чтобы поддерживать процесс коагуляции в присутствии ингибированной «внешней» системы, дополнительное количество фактора Ха вырабатывается за счет тромбин-медиированной активности «внутреннего» пути Таким образом, тромбин играет двойственную «автокаталитическую» роль, опосредованную его собственной выработкой и превращением фибриногера в фибрин Автокаталитическая природа выработки тромбина есть важная гарантия безопасности от неконтролируемых кровотечений Это обеспечивает тот факт, что при однажды заданном пороговом уровне протромбиназы, коагуляция крови пройдет полностью, результатом чего будет, например, 23 48993 прекращение кровотечения Таким образом, чрезвычайно желательной является разработка средств, которые ингибируют коагуляцию при отсутствии прямого ингибирования тромбина Соединение Ac-pAph-Chg-PalMe(3)-NH2 является пептидным аналогом, синтезированным спо 24 собом, согласно изобретению, и представляет собой полезный ингибитор активности фактора Ха без существенного подавления активности других протеаз, участвующих в процессе свертывания крови ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for production of n-acetyl-(l)-4-cyanophenylalanine ac-(l)-phe(4-cn)-oh i n-acetyl-(l)-p-amidinephenylalanine-cyclohexylglycine-b-(3-n-methylpyridine)-alanine ac-(l)-aph-chg-palme(3)-nh2
Назва патенту російськоюСпособ получения n-ацетил-(l)-4-цианофенилаланина аc-(l)-phe(4-cn)-oн и n-ацетил-(l)-п-амидинфенилаланин-циклогексилглицин-b-(3-n-метилпиридин)-аланина аc-(l)-pаph-сhg-palme(3)-nн2
МПК / Мітки
МПК: C12P 13/22, C12P 41/00, C12P 21/02, C12P 13/02, C07K 5/09
Мітки: n-ацетил-(l)-п-амідинфенілаланін-циклогексилгліцин-b-(3-n-метилпіридин)-аланіну, аc-(l)-phe(4-cn)-oн, аc-(l)-pаph-сhg-palme(3)-nн2, n-ацетил-(l)-4-ціанофенілаланіну, спосіб, отримання
Код посилання
<a href="https://ua.patents.su/12-48993-sposib-otrimannya-n-acetil-l-4-cianofenilalaninu-ac-l-phe4-cn-on-i-n-acetil-l-p-amidinfenilalanin-ciklogeksilglicin-b-3-n-metilpiridin-alaninu-ac-l-paph-shg-palme3-nn2.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання n-ацетил-(l)-4-ціанофенілаланіну аc-(l)-phe(4-cn)-oн і n-ацетил-(l)-п-амідинфенілаланін-циклогексилгліцин-b-(3-n-метилпіридин)-аланіну аc-(l)-pаph-сhg-palme(3)-nн2</a>
Попередній патент: Спосіб вимірювання теплової енергії і пристрій для його здійснення
Наступний патент: Спосіб вимірювання споживаного тепла і пристрій для його здійснення
Випадковий патент: Спосіб системного моніторингу стану торфовищ у реальному часі