Спосіб одержання альдегідів, які використовують при синтезі сполук, цінних як антифолати
Номер патенту: 53742
Опубліковано: 17.02.2003
Автори: К'єлл Дуглас Петтон, Барнетт Чарлз Джексон, Слаттері Брайан Дж.
Формула / Реферат
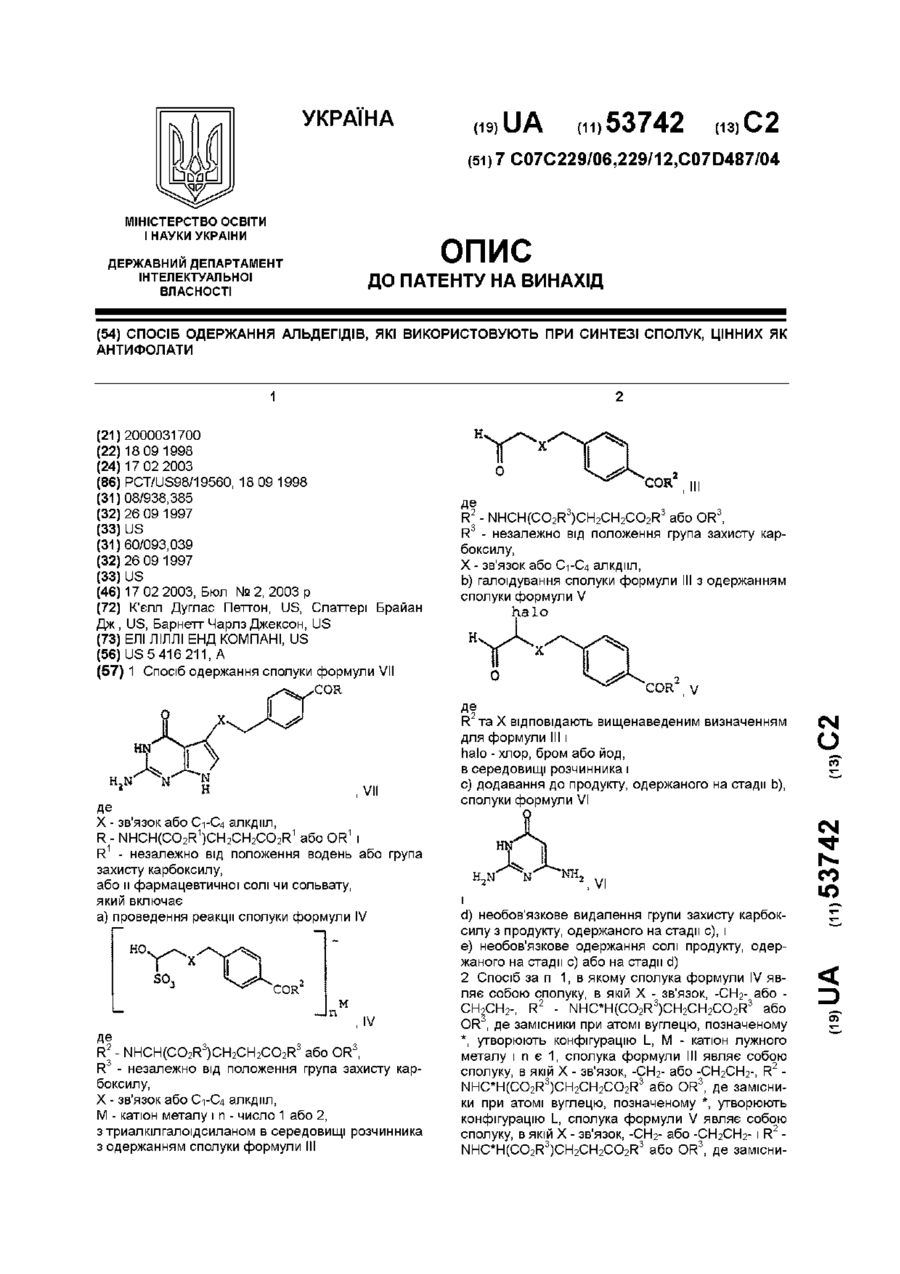
1. Спосіб одержання сполуки формули VII
, VII
де
Х - зв'язок або С1-С4 алкдііл,
R - NHCH(CO2R1)CH2CH2CO2R1 або OR1 і
R1 - незалежно від положення водень або група захисту карбоксилу,
або її фармацевтичної солі чи сольвату,
який включає:
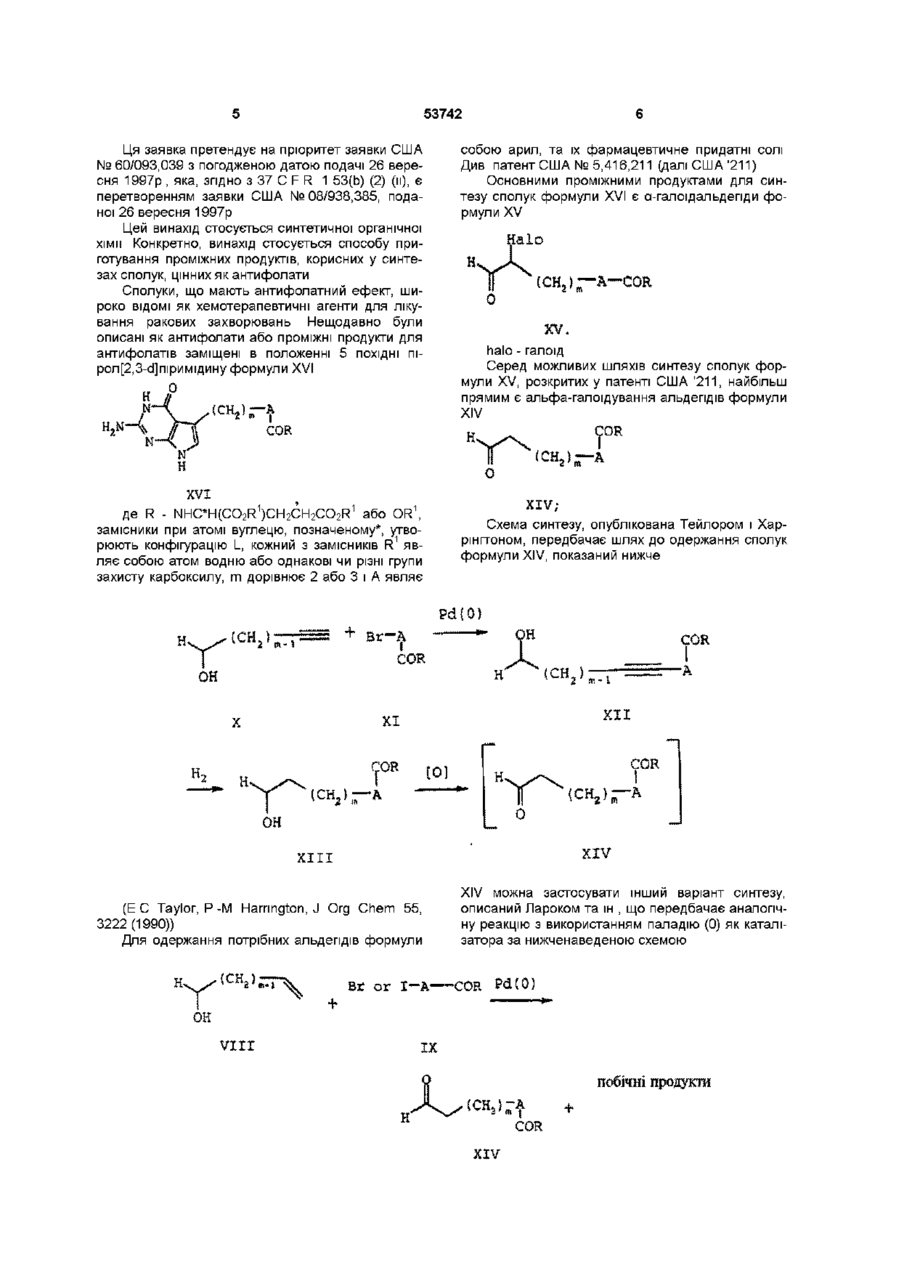
а) проведення реакції сполуки формули IV
, IV
де
R2 - NHCH(CO2R3)CH2CH2CO2R3 або OR3,
R3 - незалежно від положення група захисту карбоксилу,
Х - зв'язок або С1-С4 алкдііл,
М - катіон металу і
n - число 1 або 2,
з триалкілгалоїдсиланом в середовищі розчинника з одержанням сполуки формули III
, ІІІ
де
R2 - NНСH(СО2R3)СН2СН2СО2R3 або OR3,
R3 - незалежно від положення група захисту карбоксилу,
Х - зв'язок або С1-С4 алкдііл,
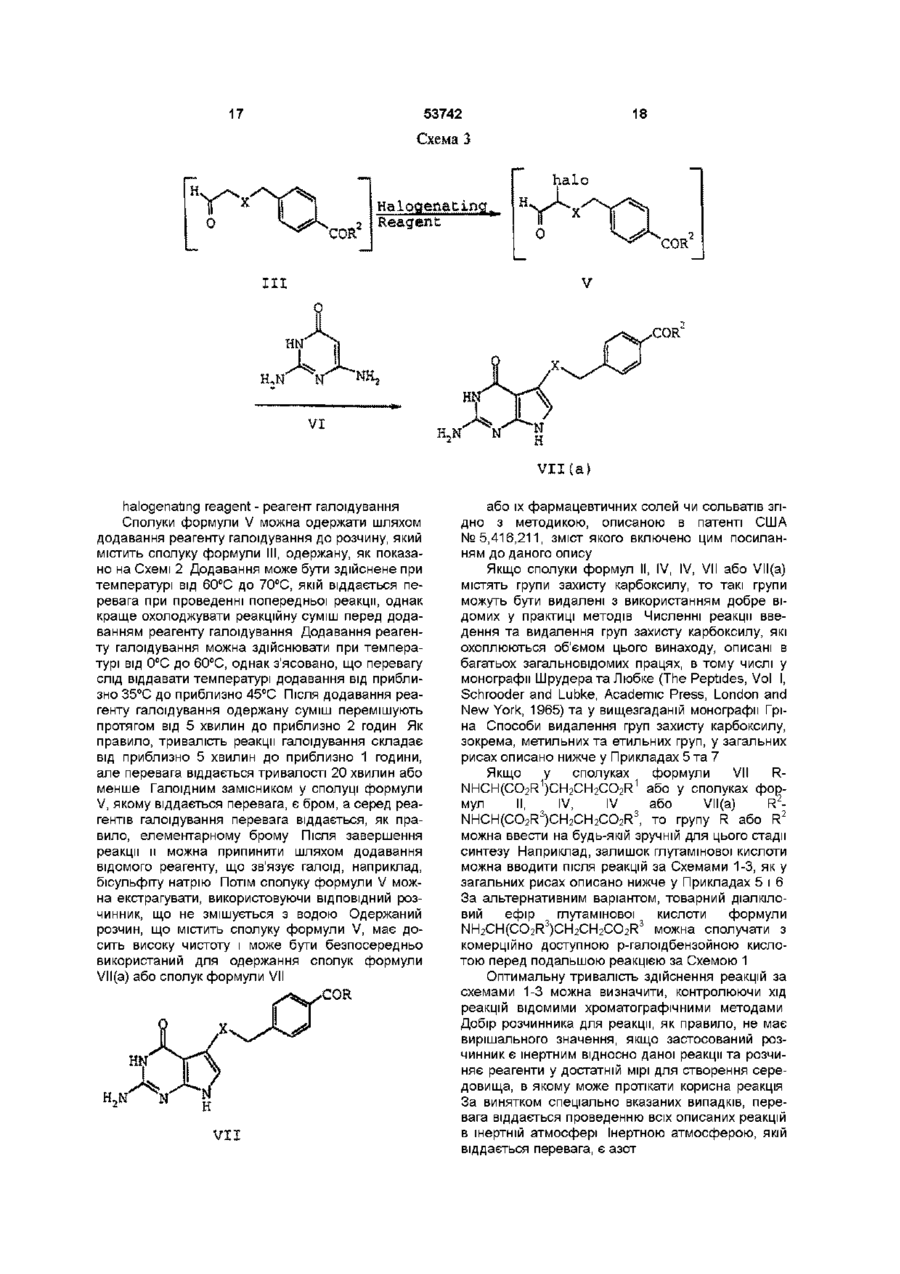
b) галоїдування сполуки формули III з одержанням сполуки формули V
, V
де
R2 та Х відповідають вищенаведеним визначенням для формули III і
halo - хлор, бром або йод,
в середовищі розчинника і
с) додавання до продукту, одержаного на стадії b), сполуки формули VI
, VI
і
d) необов'язкове видалення групи захисту карбоксилу з продукту, одержаного на стадії с), і
e) необов'язкове одержання солі продукту, одержаного на стадії с) або на стадії d).
2. Спосіб за п. 1, в якому сполука формули IV являє собою сполуку, в якій Х - зв'язок, -СН2- або -CH2СН2-, R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L, М - катіон лужного металу і n є 1; сполука формули III являє собою сполуку, в якій Х - зв'язок, -СН2- або -СН2СН2-, R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L; сполука формули V являє собою сполуку, в якій Х - зв'язок, -СН2- або -СН2СН2- і R2 - NHС*H(СО2R3)СН2СН2СО2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L і сполука формули VII являє собою сполуку, в якій R - NHCH(CO2R1)CH2CH2CO2R1.
3. Спосіб одержання сполуки формули III
, III
де
R2 - NHCH(СО2R3)СН2СН2СО2R3 або OR3,
R3 - незалежно від положення група захисту карбоксилу і
Х - зв'язок або С1-С4 алкдііл,
який включає:
проведення реакції сполуки формули IV
, IV
де
Х та R2 відповідають вищенаведеним визначенням у формулі III,
М - катіон металу і
n - число 1 або 2,
з триалкілгалоїдсиланом у середовищі розчинника.
4. Спосіб за п. 3, в якому сполука формули IV являє собою сполуку, в якій Х - зв'язок, -СН2- або -СН2СН2- і R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L.
5. Спосіб за п. 4, де Х - -СН2-.
6. Спосіб за п. 3, в якому сполука формули IV являє собою сполуку, в якій М - катіон лужного металу, n=1 і R2 - NHС*H(СО2R3)СН2СН2СО2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L.
7. Спосіб за п. 6, де лужним металом є натрій.
8. Спосіб за п. 3, в якому розчинником є ацетонітрил, триалкілгалоїдсиланом є триметилхлорсилан і реакцію проводять при температурі від 50°С до 70°С.
9. Спосіб за п. 8, в якому сполука формули IV являє собою сполуку, в якій М - натрій, n=1, Х - -CH2- і R2 - NНС*H(СО2R3)СН2СН2СО2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L.
10. Спосіб одержання сполуки формули IV
, IV
де
М - катіон металу,
n - число 1 або 2,
R2 - NHCH(CO2R3)CH2CH2CO2R3 або OR3,
R3 - незалежно від положення група захисту карбоксилу і
Х - зв'язок або С1-С4 алкдііл,
який включає:
проведення реакції сполуки формули III
, III
де
R2 та Х відповідають вищенаведеним визначенням у формулі IV,
з сполукою формули М(НSO3-)n, у якій
М відповідає вищезазначеному визначенню у формулі IV і
n - число 1 або 2;
у середовищі розчинника.
11. Спосіб за п. 10, в якому сполука формули III являє собою сполуку, в якій Х - зв'язок, -СН2- або -СН2СН2- і R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L.
12. Спосіб за п. 11, де Х - -СН2-.
13. Спосіб за п. 12, в якому сполука формули М(НSO3-)n являє собою сполуку, в якій М - катіон лужного металу, n=1 і реакцію проводять при температурі від 35°С до 50°С.
14. Спосіб за п. 13, де лужним металом є натрій.
15. Спосіб за п. 10, в якому розчинником є суміш етилацетату, етанолу 3А і води.
16. Спосіб за п. 10, який включає додатково:
проведення реакції сполуки формули І
, I
де
R4 - водень або С1-С4 алкіл і
X' - зв'язок або С1-С4 алкдііл,
з умовою, що коли X' - не зв'язок, то атом вуглецю в альфа-положенні до спиртової групи являє собою групу -СН2-,
з сполукою формули II
, IІ
де
R2 відповідає вищенаведеному визначенню у формулі IV і
Lg – група, що відходить,
у середовищі розчинника, у присутності паладієвого каталізатора та каталізатора фазового переносу і необов'язково у присутності хлориду катіону металу, для одержання сполуки формули III.
17. Спосіб за п. 1 або 2, в якому стадію галоїдування здійснюють при температурі від 35°С до 45°С.
18. Спосіб за п. 17, в якому сполука формули VII є сполукою, де R - NHCH(CO2R1)СH2СН2СО2R1.
19. Спосіб за п. 18, в якому сполука формули V являє собою сполуку, де Х - -СН2-.
20. Спосіб за п. 19, в якому здійснюють стадію d), передбачену п. 1 і сполука формули VII являє собою сіль, одержану приєднанням гідроксиду натрію.
Текст
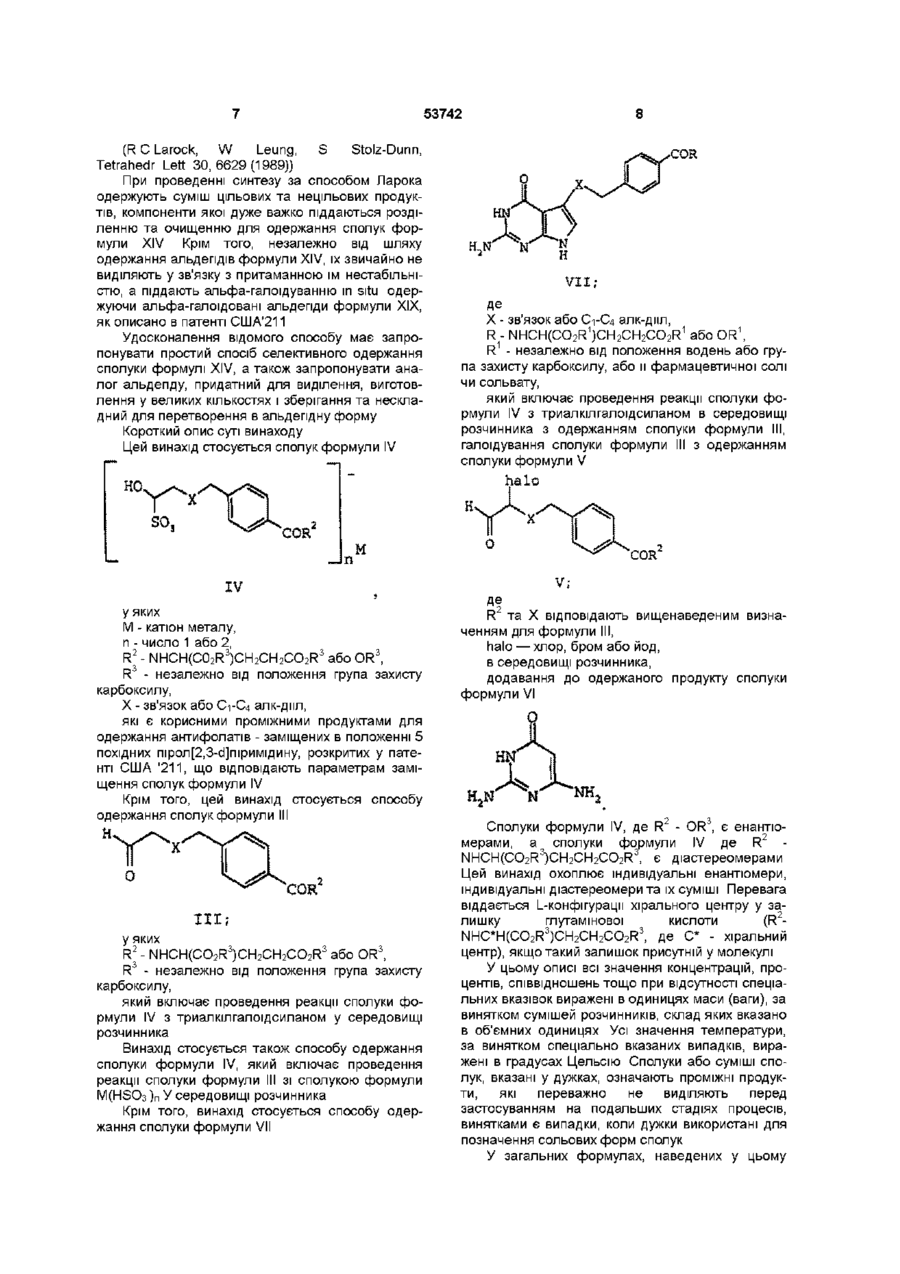
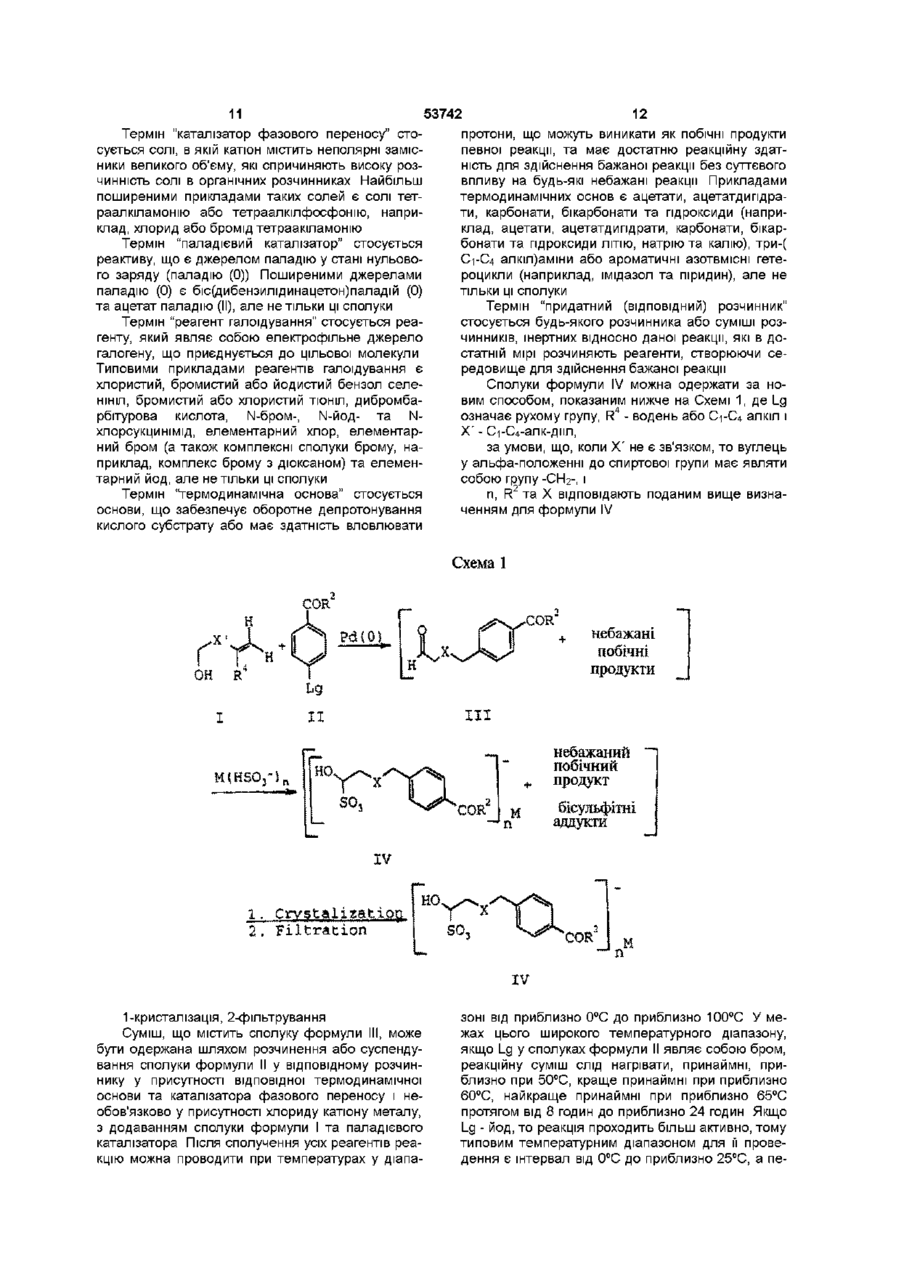
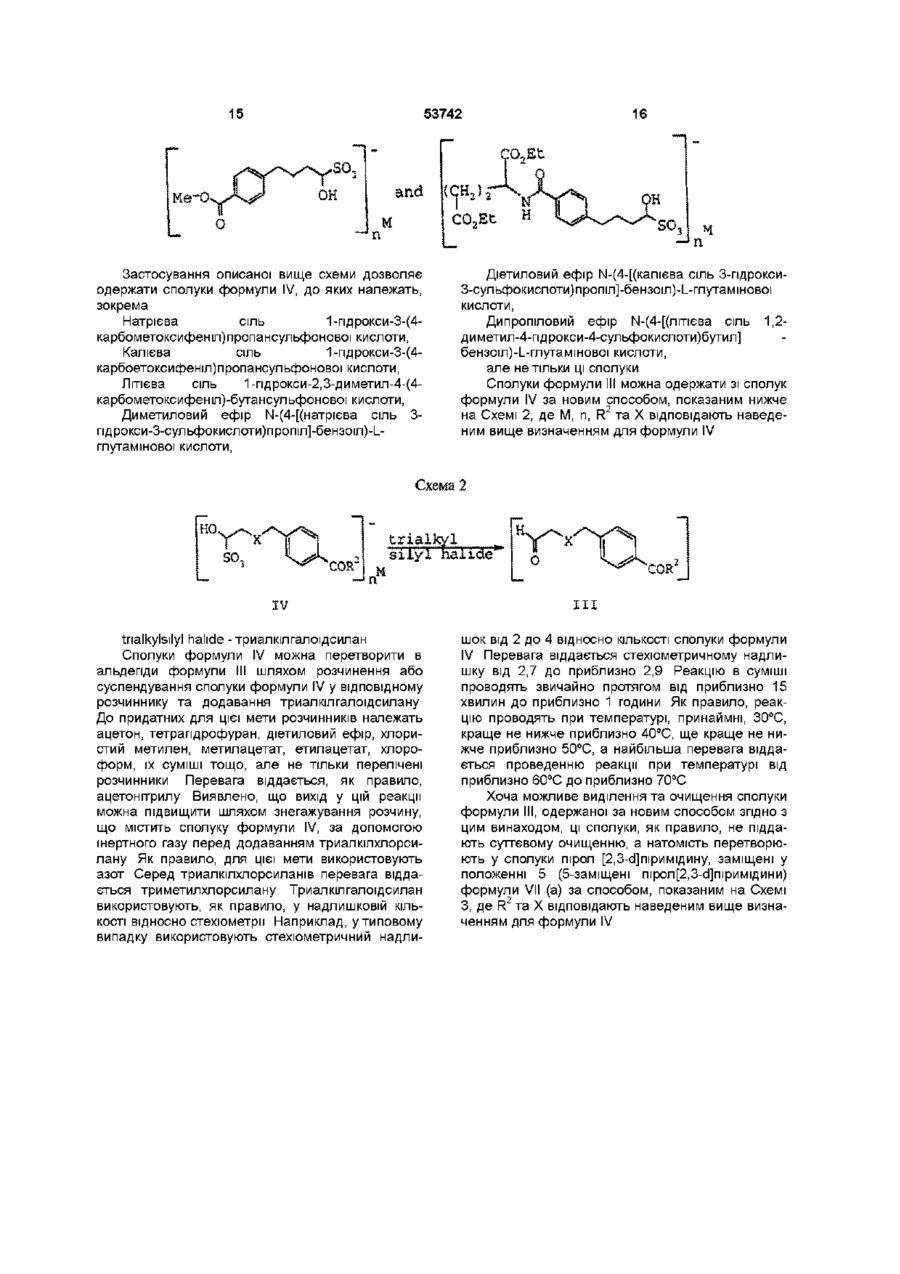
УКРАЇНА МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ UA (11)53742 (із) С2 (51) 7 C07C229/06,229/12,C07D487/04 ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) СПОСІБ ОДЕРЖАННЯ АЛЬДЕГІДІВ, ЯКІ ВИКОРИСТОВУЮТЬ ПРИ СИНТЕЗІ СПОЛУК, ЦІННИХ ЯК АНТИФОЛАТИ (21)2000031700 ( 2 2 ) 1 8 09 1998 ( 2 4 ) 1 7 02 2003 (86) PCT/US98/19560, 18 09 1998 (31)08/938,385 ( 3 2 ) 2 6 09 1997 (33) US (31)60/093,039 ( 3 2 ) 2 6 09 1997 (33) US (46) 17 02 2003, Бюл № 2, 2003 р (72) К'єлл Дуглас Петтон, US, Слаттері Брайан Дж , US, Барнетт Чарлз Джексон, US (73) ЕЛІ ЛІЛЛІ ЕНД КОМПАНІ, US (56) US 5 416 211, А ( 5 7 ) 1 Спосіб одержання сполуки формули VII COR ,C0R , VII Де X - зв'язок або С1-С4 алкдмл, R - NHCH(CO2R 1 )CH 2 CH2CO 2 R 1 або OR 1 і R1 - незалежно від положення водень або група захисту карбоксилу, або и фармацевтичної солі чи сольвату, який включає а) проведення реакції сполуки формули IV SO COR м Де R2 - NHCH(CO2R 3 )CH 2 CH2CO 2 R 3 або OR 3 , R3 - незалежно від положення група захисту карбоксилу, X - зв'язок або С1-С4 алкдмл, Ь) галоїдування сполуки формули III з одержанням сполуки формули V halo IV Де R2 - NHCH(CO2R 3 )CH 2 CH2CO 2 R 3 або OR 3 , R3 - незалежно від положення група захисту карбоксилу, X - зв'язок або С1-С4 алкдмл, М - катіон металу і п - число 1 або 2, з триалкілгалоідсиланом в середовищі розчинника з одержанням сполуки формули III t v Де R та X відповідають вищенаведеним визначенням для формули III і halo - хлор, бром або йод, в середовищі розчинника і с) додавання до продукту, одержаного на стадії Ь), сполуки формули VI О 1 со Ю d) необов'язкове видалення групи захисту карбоксилу з продукту, одержаного на стадії с), і є) необов'язкове одержання солі продукту, одержаного на стадії с) або на стадії d) 2 Спосіб за п 1, в якому сполука формули IV являє собою сполуку, в якій X - зв'язок, -СН2- або СН 2 СН 2 -, R 2 - NHC*H(CO2R 3 )CH 2 CH2CO 2 R 3 або OR 3 , де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L, М - катіон лужного металу і п є 1, сполука формули III являє собою сполуку, в якій X - зв'язок, -СН2- або -СН2СН2-, R2 NHC*H(CO2R 3 )CH 2 CH2CO 2 R 3 або OR 3 , де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L, сполука формули V являє собою сполуку, в якій X - зв'язок, -СН2- або -СН2СН2- і R2 NHC*H(CO2R 3 )CH 2 CH2CO 2 R 3 або OR 3 , де замісни 53742 проведення реакції сполуки формули ки при атомі вуглецю, позначеному *, утворюють Н. конфігурацію L і сполука формули VII являє собою сполуку, в якій R - NHCH(CO2R )CH2CH2CO2R1 З Спосіб одержання сполуки формули III О COR" Де R2 - NHCH(CO2R3)CH2CH2CO2R3 або OR3, R3 - незалежно від положення група захисту карбоксилу і X - зв'язок або С1-С4 алкдмл, який включає проведення реакції сполуки формули IV SO COR n IV Хта R відповідають вищенаведеним визначенням у формулі III, М - катіон металу і п - число 1 або 2, 3 триалкілгалоідсиланом у середовищі розчинника 4 Спосіб за п 3, в якому сполука формули IV являє собою сполуку, в якій X - зв'язок, -СН2- або СН2СН2- і R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L 5 Спосіб за п 4, деХ--СН 2 6 Спосіб за п 3, в якому сполука формули IV являє собою сполуку, в якій М - катіон лужного металу, п=1 і R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L 7 Спосіб за п 6, де лужним металом є натрій 8 Спосіб за п 3, в якому розчинником є ацетонітрил, триалкілгалоідсиланом є триметилхлорсилан і реакцію проводять при температурі від 50°С до 70°С 9 Спосіб за п 8, в якому сполука формули IV являє собою сполуку, в якій М - натрій, п=1, X - -СН2і R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR3, де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L 10 Спосіб одержання сполуки формули IV so COR" IV Де М - катіон металу, п- число 1 або 2 R2 - NHCH(CO2R3)CH2CH2CO2R3 або OR3, R3 - незалежно від положення група захисту карбоксилу і X - зв'язок або С1-С4 алкдмл, який включає R та X відповідають вищенаведеним визначенням у формулі IV, з сполукою формули M(HSO3 )n, У якій М відповідає вищезазначеному визначенню у формулі IV і п - число 1 або 2, у середовищі розчинника 11 Спосіб за п 10, в якому сполука формули III являє собою сполуку, в якій X - зв'язок, -СН2- або СЬЬСНг і R2 - NHC*H(CO2R3)CH2CH2CO2R3 або OR , де замісники при атомі вуглецю, позначеному *, утворюють конфігурацію L 12 Спосіб за п 11,деХ--СН 2 13 Спосіб за п 12, в якому сполука формули М(НЗОз)п являє собою сполуку, в якій М - катіон лужного металу, п=1 і реакцію проводять при температурі від 35°С до 50°С 14 Спосіб за п 13, де лужним металом є натрій 15 Спосіб за п 10, в якому розчинником є суміш етилацетату, етанолу ЗА і води 16 Спосіб за п 10, який включає додатково проведення реакції сполуки формули І ОН R4 ? R - водень або С1-С4 алкіл і Xі - зв'язок або С1-С4 алкдмл, з умовою, що коли Xі - не зв'язок, то атом вуглецю в альфа-положенні до спиртової групи являє собою групу -СН2-, з сполукою формули II \ COR2 Де R відповідає вищенаведеному визначенню у формулі IV і Lg - група, що відходить, у середовищі розчинника, у присутності паладієвого каталізатора та каталізатора фазового переносу і необов'язково у присутності хлориду катіону металу, для одержання сполуки формули 17 Спосіб за п 1 або 2, в якому стадію галоїдування здійснюють при температурі від 35°С до 45°С 18 Спосіб за п 17, в якому сполука формули VII є сполукою, де R - NHCH(CO2R1)CH2CH2CO2R1 19 Спосіб за п 18, в якому сполука формули V являє собою сполуку, де X - -СН220 Спосіб за п 19, в якому здійснюють стадію d), передбачену п 1 і сполука формули VII являє собою сіль, одержану приєднанням гідроксиду натрію 53742 Ця заявка претендує на пріоритет заявки США № 60/093,039 з погодженою датою подачі 26 вересня 1997р , яка, згідно з 37 С F R 1 53(b) (2) (м), є перетворенням заявки США № 08/938,385, поданої 26 вересня 1997р Цей винахід стосується синтетичної органічної хімії Конкретно, винахід стосується способу приготування проміжних продуктів, корисних у синтезах сполук, цінних як антифолати Сполуки, що мають антифолатний ефект, широко ВІДОМІ як хемотерапевтичні агенти для лікування ракових захворювань Нещодавно були описані як антифолати або проміжні продукти для антифолатів заміщені в положенні 5 ПОХІДНІ ПІрол[2,3-сі]піримідину формули XVI собою арил, та їх фармацевтичне придатні солі Див патент США №5,416,211 (далі США'211) Основними проміжними продуктами для синтезу сполук формули XVI є а-галоідальдепди формули XV (сн2);—А—соя XV. halo - галоїд Серед можливих шляхів синтезу сполук формули XV, розкритих у патенті США '211, найбільш прямим є альфа-галоідування альдегідів формули XIV COR О SCH2) -A COR Н (СН. с 2'ffi in 0 XVX де R - NHC*H(CO2R1)CH2CH2CO2R1 або OR1, замісники при атомі вуглецю, позначеному*, утворюють конфігурацію L, кожний з замісників R1 являє собою атом водню або однакові чи різні групи захисту карбоксилу, m дорівнює 2 або 3 і А являє -А XIV; Схема синтезу, опублікована Тейлором і Харрінгтоном, передбачає шлях до одержання сполук формули XIV, показаний нижче РсНО) Вг-А COR Н ОН COR (СН XII XI Н2 _ сон f* Н [О] C0R н ІСНа>— А ( С Н , ) Г -А о ОН XV X XIII (Е С Taylor, Р -М Harrington, J Org Chem 55, 3222(1990)) Для одержання потрібних альдегідів формули Вг o r 1-А XIV можна застосувати інший варіант синтезу, описаний Лароком та ш , що передбачає аналогічну реакцію з використанням паладію (0) як каталізатора за нижченаведеною схемою COR + ОН •А 2 ' т -1 Pd(0) * VIII побічні продукти н CR O XIV 53742 (R С Larock, W Leung, S Stolz-Dunn, Tetrahedr Lett 30,6629(1989)) При проведенні синтезу за способом Ларока одержують суміш цільових та нецільових продуктів, компоненти якої дуже важко піддаються розділенню та очищенню для одержання сполук формули XIV Крім того, незалежно від шляху одержання альдегідів формули XIV, їх звичайно не виділяють у зв'язку з притаманною їм нестабільністю, а піддають альфа-галоідуванню in situ одержуючи альфа-галоідовані альдегіди формули XIX, як описано в патенті США'211 Удосконалення відомого способу має запропонувати простий спосіб селективного одержання сполуки формулі XIV, а також запропонувати аналог альдегіду, придатний для виділення, виготовлення у великих кількостях і зберігання та нескладний для перетворення в альдегідну форму Короткий опис суті винаходу Цей винахід стосується сполук формули IV COR VII X - зв'язок або С1-С4 алк-дмл, 1 1 1 R - NHCH(CO2R )CH2CH2CO2R або OR , 1 R - незалежно від положення водень або група захисту карбоксилу, або и фармацевтичної солі чи сольвату, який включає проведення реакції сполуки формули IV з триалкілгалоідсиланом в середовищі розчинника з одержанням сполуки формули III, галоїдування сполуки формули III з одержанням сполуки формули V halo СОЕ _Jn М V; IV у яких М - катіон металу, п - число 1 або 2, R2 - NHCH(C02R3)CH2CH2CO2R3 або OR3, R3 - незалежно від положення група захисту карбоксилу, X - зв'язок або С1-С4 алк-дмл, які є корисними проміжними продуктами для одержання антифолатів - заміщених в положенні 5 похідних пірол[2,3-сі]піримідину, розкритих у патенті США '211, що відповідають параметрам заміщення сполук формули IV Крім того, цей винахід стосується способу одержання сполук формули III Н. О COR COR III; у яких R2 - NHCH(CO2R3)CH2CH2CO2R3 або OR3, R3 - незалежно від положення група захисту карбоксилу, який включає проведення реакції сполуки формули IV з триалкілгалоідсиланом у середовищі розчинника Винахід стосується також способу одержання сполуки формули IV, який включає проведення реакції сполуки формули III зі сполукою формули M(HSO3 )п У середовищі розчинника Крім того, винахід стосується способу одержання сполуки формули VII R та X відповідають вищенаведеним визначенням для формули III, halo — хлор, бром або йод, в середовищі розчинника, додавання до одержаного продукту сполуки формули VI Сполуки формули IV, де R2 - OR3, є енантюмерами, а сполуки формули IV де R2 NHCH(CO2R3)CH2CH2CO2R3, є діастереомерами Цей винахід охоплює індивідуальні енантюмери, індивідуальні діастереомери та їх суміші Перевага віддається L-конфігурацм хірального центру у залишку глутамшової кислоти (R2NHC*H(CO2R3)CH2CH2CO2R3, де С* - хіральний центр), якщо такий залишок присутній у молекулі У цьому описі всі значення концентрацій, процентів, співвідношень тощо при відсутності спеціальних вказівок виражені в одиницях маси (ваги), за винятком сумішей розчинників, склад яких вказано в об'ємних одиницях Усі значення температури, за винятком спеціально вказаних випадків, виражені в градусах Цельсію Сполуки або суміші сполук, вказані у дужках, означають проміжні продукти, які переважно не виділяють перед застосуванням на подальших стадіях процесів, винятками є випадки, коли дужки використані для позначення сольових форм сполук У загальних формулах, наведених у цьому 53742 описі, ХІМІЧНІ терміни загального характеру вжито у звичайних загальновідомих значеннях Наприклад, термін "алкіл" стосується насиченого одновалентного вуглеводневого радикалу нормальної або розгалуженої будови, що містить вказану КІЛЬКІСТЬ вуглецевих атомів, і охоплює метил, етил, пропіл, ізопропіл, п-бутил, втор-бутил, трет-бутил (але не тільки ці групи), а також охоплює вищі гомологи та ізомери вказаних груп Термін "С1-С4 алк-дмл" стосується насиченого двовалентного вуглеводневого радикалу нормальної будови, що містить від 1 атому до 4 атомів вуглецю, в якому будь-який вуглецевий атом у ланцюгу може бути незалежно заміщений одним С1-С4 алкілом Наприклад, означення "С1-С4 алкдмл" охоплює радикал 1,2-диметилпроп-1,3-дмл, але не охоплює 1,1-диметилпроп-1,3-дил Іншими прикладами таких радикалів можуть бути -СН2-, СН2СН2-, -СН2(СН2)СН2-, метилет-1,2-дмл, СН2(СН2)2СН2- та бут-1,3-дмл, але не тільки ці групи Перевага віддається С1-С4 алк-дмлам, які не несуть замісників, а найбільша перевага віддається радикалам -СН2-та -СН2СН2Термін "С2-Сє алкеніл" стосується одноненасиченого одновалентного вуглеводневого радикалу, що містить від 2 атомів до 6 атомів вуглецю і може мати розгалужену або нормальну будову вуглеводневого ланцюга Прикладами таких радикалів можуть бути етиленіл, пропіленіл, аліл, бутиленіл і пентиленіл, але не тільки ці групи Термін "С1-С4 алкокси(група" стосується метокси-, етокси,- пропокси-, ізопропокси-, бутокси-, втор-бутокси- та трет-бутоксигруп Термін "галоїд" або "галоген" стосується хлору, брому або йоду Терміни "заміщений бензил", "заміщений бензпдрил" і "заміщений тритил" стосуються ВІДПОВІДНО бензильної, бензпдрильної та тритильної (трифенілметильної) груп, що мають від 1 замісника до 5 замісників, які незалежно один від одного являють собою нітрогрупу, С1-С4 алкоксигрупу, С-і-Сє алкіл або гідрокси- С-і-Сб алкіл Ці замісники можуть знаходитися тільки у стерично припустимих положеннях, так що радикал в цілому залишається ХІМІЧНО стабільним Терміни "заміщений С-і-Сє алкіл" та "заміщений С2-Сє алкеніл" стосуються ВІДПОВІДНО С-І-СЄ алкілу та С2-Сє алкенілу, що мають від 1 замісника до З замісників, які незалежно один від одного являють собою галоїд, феніл, три(Сі-Сє алкіл)силіл або заміщену фенілсульфогрупу Терміни "заміщений феніл" та "заміщений фенілсульфоніл" стосуються ВІДПОВІДНО фенілу та фенілсульфогрупи, в яких фенільний фрагмент заміщений у пара-положенні С-і-Сє алкілом, нітрогрупою або галоїдом Термін "рухома група" стосується одновалентного замісника у молекулі, здатного до нуклеофільного заміщення Типовими прикладами рухомих груп є сульфонати, наприклад, феніл-, заміщений феніл-, С-і-Сб алкіл- та С-і-Сє перфторалкілсульфонати, галоїди та солі діазонію, наприклад, галоїдні солі діазонію, але не тільки вказані групи Термін "група захисту карбоксилу" у значенні, вживаному в цьому описі, означає групу, яка, як правило, відсутня у кінцевих терапевтичних сполу 10 ках, але яку умисно вводять на певній стадії процесу синтезу для захисту групи, яка у противному разі могла б вступати в реакцію при ХІМІЧНИХ процесах, а пізніше відщеплюють Прикладами таких груп захисту карбоксилу є С-і-Сє алкіл, заміщений С-і-Сб алкіл, С2-Сє алкеніл, заміщений С2-Сє алкеніл, бензил, заміщений бензил, бензпдрил, заміщений бензпдрил, тритил, заміщений тритил, триалкілсиліл, ароїл, наприклад, фенацил, та ІНШІ групи Конкретний різновид уживаної групи захисту карбоксилу не має вирішального значення за умови, що захищена карбоксильна група залишається стабільною в умовах наступної реакції (реакцій), що протікає(-ють) за участю інших положень у молекулі, і може бути видалена на ВІДПОВІДНІЙ стадії без впливу на ІНШІ фрагменти молекули Для захисту карбоксилу у сполуках згідно з цим винаходом можна застосувати також групи захисту карбоксилу, аналогічні тим, що використовують у процесах одержання пеніциліну, цефалоспорину та пептидів Інші приклади таких груп можна знайти у монографіях Хаслама (Е Haslam, "Protective Groups in Organic Chemistry", J G W McOmie, Ed, Plenum Press, New York, N Y , 1981, Chapter 5) та Гріна (TW Greene, "Protective Groups in Organic Synthesis", 2 n d Ed , John Wiley & Sons, New York, N Y , 1991, Chapter 5) Якщо R1 або R3 є групою захисту карбоксилу, то перевага віддається використанню для захисту С1-С4 алкілу Найбільша перевага віддається використанню для захисту метилу та етилу Термін "триалкілсиліл" стосується одновалентного силільного радикалу, який містить три незалежних один від одного замісника у вигляді С-і-Сє алкільних груп Термін "триалкілгалоідсилан" стосується сполуки формули (С-і-Сб алкіл)з-3і-галоід, де С-і-Сє алкіли можуть бути однаковими або різними До триалкілгалоідсиланів належать, наприклад, триметил-, триетил,- трипропілхлор-, бром- та йодсилани, але не тільки ці сполуки Термін "катіон металу" стосується катіону лужного або лужноземельного металу Лужні метали утворюють однозаряджені катіони, наприклад, І_і+1, Na+1, К+1, а лужноземельні метали - двохзаряджені катіони, наприклад, Мд +2 або Са+2, однак сумарний заряд на сполуках формули IV, на сполуках формули М(НЗОз)п або на хлоридах катіонів металів дорівнює нулю Таким чином, якщо М - метал першої групи, то молярне співвідношення між катіоном і аніоном є 1 1, а коли М - катіон металу другої групи, то молярне співвідношення складає 1 2 Термін "фармацевтична сіль" у значенні, вживаному в цьому описі, стосується солей, одержуваних шляхом реакції сполук згідно з цим винаходом з мінеральною або органічною кислотою (наприклад, хлористоводневою, бромистоводневою, йодистоводневою або р-толуолсульфоновою кислотою) або з неорганічною основою (наприклад, гідроксидом, карбонатом або бікарбонатом натрію, калію, ЛІТІЮ або магнію) Такі солі ВІДОМІ ПІД назвами солей кислот та солей основ Подальші приклади фармацевтичних солей та способи їх одержання можна знайти у статті Берджа, Б і т і та Монкхауза (S М Berge, L D Bighley, D С Monkhouse, J Pharm Sci 66, 1 1977) 12 11 53742 Термін "каталізатор фазового переносу" стопротони, що можуть виникати як побічні продукти сується солі, в якій катіон містить неполярні заміспевної реакції, та має достатню реакційну здатники великого об'єму, які спричиняють високу розність для здійснення бажаної реакції без суттєвого чинність солі в органічних розчинниках Найбільш впливу на будь-які небажані реакції Прикладами поширеними прикладами таких солей є солі теттермодинамічних основ є ацетати, ацетатдипдрараалкіламонію або тетраалкілфосфонію, наприти, карбонати, бікарбонати та гідроксиди (наприклад, хлорид або бромід тетраакіламонію клад, ацетати, ацетатдипдрати, карбонати, бікарбонати та гідроксиди ЛІТІЮ, натрію та калію), три-( Термін "паладієвий каталізатор" стосується С1-С4 алкіл)амши або ароматичні азотвмісні гетереактиву, що є джерелом паладію у стані нульовороцикли (наприклад, імідазол та піридин), але не го заряду (паладію (0)) Поширеними джерелами тільки ці сполуки паладію (0) є біс(дибензилідинацетон)паладій (0) та ацетат паладію (II), але не тільки ці сполуки Термін "придатний (ВІДПОВІДНИЙ) розчинник" стосується будь-якого розчинника або суміші розТермін "реагент галоїдування" стосується реачинників, інертних відносно даної реакції, які в догенту, який являє собою електрофільне джерело статній мірі розчиняють реагенти, створюючи сегалогену, що приєднується до цільової молекули редовище для здійснення бажаної реакції Типовими прикладами реагентів галоїдування є хлористий, бромистий або йодистий бензол селеСполуки формули IV можна одержати за ноНІНІЛ, бромистий або хлористий ТІОНІЛ, дибромбавим способом, показаним нижче на Схемі 1, де Lg рбітурова кислота, N-бром-, N-йод- та Nозначає рухому групу, R4 - водень або С1-С4 алкіл і хлорсукцинімід, елементарний хлор, елементарX' - Сі-С4-алк-дмл, ний бром (а також комплексні сполуки брому, наза умови, що, коли X' не є зв'язком, то вуглець приклад, комплекс брому з діоксаном) та елемену альфа-положенні до спиртової групи має являти тарний йод, але не тільки ці сполуки собою групу -СН2-, і Термін "термодинамічна основа" стосується n, R2 та X відповідають поданим вище визнаоснови, що забезпечує оборотне депротонування ченням для формули IV кислого субстрату або має здатність вловлювати Схема 1 COR" небажані побічні продукти небажаний — побічний продукт бісульфітні аддукти -»п 1. 2. Filtration COR" n М XV 1-кристалізація, 2-фільтрування Суміш, що містить сполуку формули III, може бути одержана шляхом розчинення або суспендування сполуки формули II у відповідному розчиннику у присутності відповідної термодинамічної основи та каталізатора фазового переносу і необов'язково у присутності хлориду катіону металу, з додаванням сполуки формули І та паладієвого каталізатора Після сполучення усіх реагентів реакцію можна проводити при температурах у діапа зоні від приблизно 0°С до приблизно 100°С У межах цього широкого температурного діапазону, якщо Lg у сполуках формули II являє собою бром, реакційну суміш слід нагрівати, принаймні, приблизно при 50°С, краще принаймні при приблизно 60°С, найкраще принаймні при приблизно 65°С протягом від 8 годин до приблизно 24 годин Якщо Lg - йод, то реакція проходить більш активно, тому типовим температурним діапазоном для її проведення є інтервал від 0°С до приблизно 25°С, а пе 14 13 53742 ревага віддається температурі приміщення Реакшляхом фільтрування До придатних для екстракцію проводять переважно протягом від 8 годин до ції розчинників належать хлористий метилен, хлоприблизно 10 годин роформ, метилацетат, чотирихлористий вуглець, їх суміші тощо, але не тільки ці речовини Як праПридатними для цієї реакції розчинниками є вило, розчинником, якому віддається перевага, є диметил сульфоксид, тетрапдрофуран, N,N'етилацетат диметилімідазол, діетиловий ефір, диметоксиетан, діоксан, ацетонітрил, їх суміші тощо, але не тільки До відфільтрованого органічного екстракту, ці речовини Як правило, термодинамічною осноодержаного, як вказано вище (суміші, що містить вою, якій віддається перевага, є ацетат лужного сполуку формули III та побічні продукти), можна металу, а особлива перевага віддається ацетату додати бісульфіт металу формули М(НЗОз)п Як ЛІТІЮ Проте у випадку, коли Lg - бром, основою, комбіновані розчинники для цієї реакції вживають, якій віддається перевага, є ацетатдипдрат ЛІТІЮ як правило, нижчий спирт, переважно етанол, деСеред розчинників перевага, як правило, відданатурований 5% метанолу (етанол ЗА) або етанол, ється диметилформаміду або диметилацетаміду денатурований 0,5% толуолу (етанол 2В-3), і воду Серед каталізаторів фазового переносу перевага Перевага віддається додаванню етанолу в об'ємі, віддається, як правило, броміду тетрабути л амоприблизно рівному об'єму присутнього спочатку нію Паладієвим каталізатором, якому віддається етилацетату, а об'єм води у суміші пропорційний перевага, є в загальному випадку ацетат паладію об'єму денатурованого етанолу, переважно у від(II) Доцільно застосовувати хлорид лужного метаношенні приблизно 1 5 До придатних бісульфітів лу з метою досягнення максимального виходу ціметалів належать бісульфіт натрію NaHSO3, бісульового продукту формули III, хоч ця умова не є льфіт калію KHSO3, бісульфіт ЛІТІЮ L1HSO3 та бісуобов'язковою Серед хлоридів металів перевага льфіт магнію MgfHSOsh, але не тільки ці сполуки віддається хлориду ЛІТІЮ Перевага віддається Перевага віддається бісульфіту натрію КІЛЬКІСТЬ 4 сполукам формули І, у яких R -водень і X' - зв'явикористовуваного бісульфіту металу, як правило, зок, -СН2- або -СН2СН2- Серед сполук формули II складає від приблизно 0,85 еквіваленту до приперевага віддається тим, у яких Lg - бром, йод або близно 1,2 еквіваленту відносно КІЛЬКОСТІ сполуки трифторметилсульфонілоксигрупа Найбільша формули III Перевага віддається, як правило, КІперевага серед Lg віддається йоду Серед сполук ЛЬКОСТІ бісульфіту металу від приблизно 0,9 еквіформули І найбільша перевага віддається 3валенту до 1,1 еквіваленту, а найбільша перевага бутенолу - КІЛЬКОСТІ від приблизно 0,95 еквіваленту до приблизно 1,0 еквіваленту Реакцію можна проводити Як правило, реагенти, яким віддається перевапротягом від 2 годин до приблизно 15 годин в темга, вживають у кількостях, вказаних нижче (відноспературному діапазоні від температури приміщенно КІЛЬКОСТІ сполуки формули II) ня до приблизно 55°С Перевага віддається тритермодинамічна основа - від 1,0 еквіваленту валості проведення реакції від приблизно 2 годин до приблизно 3,0 еквіваленту, краще від приблиздо приблизно 5 годин при температурі в межах від но 1,05 еквіваленту до приблизно 1 .Зеквіваленту, приблизно 35°С до приблизно 50°С хлорид катіону металу - від 0 еквіваленту до приблизно 4 еквіваленту, краще від приблизно 2,8 Після завершення реакції утворюються в різеквіваленту до приблизно 3,2 еквіваленту, них кількостях різні солі сульфонових кислот з катіонамиметалів КІЛЬКІСТЬ та склад таких солей каталізатор фазового переносу - від 0 еквівазалежать від способу попереднього очищення суленту до приблизно 3,0 еквіваленту, краще від 0,4 міші, що містила сполуку формули III Основним еквіваленту до приблизно 0,6 еквіваленту, компонентом є сіль сульфокислоти з катіоном мепаладієвий каталізатор - від 0,015 еквіваленту талу, позначена у Схемі 1 як сполука формули IV до приблизно 0,1 еквіваленту, краще від приблизЯк правило, основний компонент - сполука форно 0,02 еквіваленту до приблизно 0,03 еквіваленмули IV - випадає в осад самочинно, однак у виту, падках, коли спонтанна кристалізація не має міссполука формули І - від 1,0 еквіваленту до ця, можна викликати кристалізацію основного приблизно 2,0 еквіваленту, краще від приблизно компоненту шляхом ретельного регулювання об'1,1 еквіваленту до приблизно 1,3 еквіваленту ємів розчинників Як правило, з метою викликання В результаті реакції, розглянутої вище, утвокристалізації основного компонента - солі сульфорюється суміш продуктів, яка містить сполуку фокислоти з катіоном металу - збільшують КІЛЬКІСТЬ рмули III Цю сполуку можна виділити з суміші, етилацетату відносно КІЛЬКОСТІ етанолу й води проте перевага віддається проведенню подальшої Цей спосіб регулювання об'ємів розчинників добре реакції згідно зі Схемою 1 Суттєве очищення сповідомий обізнаним фахівцям Осаджену сіль форлук формули III або відділення її від небажаних мули IV сульфокислоти з катіоном металу побічних продуктів перед переробкою на новій основний компонент - можна ВІДДІЛИТИ фільтрустадії процесу не є необхідною Перевага віддаванням ється нескладним процесам очищення, а саме, екстракції розчинником, що не змішується з водою, Перевага віддається сполукам формули IV, з наступним відділенням паладієвого каталізатора наведеним нижче 53742 15 16 and —Ті Застосування описаної вище схеми дозволяє одержати сполуки формули IV, до яких належать, зокрема Натрієва сіль 1 -пдрокси-3-(4карбометоксифеніл)пропансульфоновоі кислоти, Калієва сіль 1 -пдрокси-3-(4карбоетоксифеніл)пропансульфоновоі кислоти, Літієва сіль 1-пдрокси-2,3-диметил-4-(4карбометоксифеніл)-бутансульфоновоі кислоти, Диметиловий ефір ІЧ-(4-[(натрієва сіль 3пдрокси-3-сульфокислоти)пропіл]-бензоіл)-І_глутамшової кислоти, Діетиловий ефір ІЧ-(4-[(калієва сіль 3-пдрокси3-сульфокислоти)пропіл]-бензоіл)-І_-глутамшовоі кислоти, Дипропіловий ефір І\І-(4-[(лтєва сіль 1,2диметил-4-пдрокси-4-сульфокислоти)бутил] бензоіл)-І_-глутамшовоі кислоти, але не тільки ці сполуки Сполуки формули III можна одержати зі сполук формули IV за новим способом, показаним нижче на Схемі 2, де М, n, R2 та X відповідають наведеним вище визначенням для формули IV Схема 2 COR trialkyl s i l y l halide" IV tnalkylsilyl hahde -триалкілгалоідсилан Сполуки формули IV можна перетворити в альдегіди формули III шляхом розчинення або суспендування сполуки формули IV у відповідному розчиннику та додавання триалкілгалоідсилану До придатних для цієї мети розчинників належать ацетон, тетрапдрофуран, діетиловий ефір, хлористий метилен, метилацетат, етилацетат, хлороформ, їх суміші тощо, але не тільки перелічені розчинники Перевага віддається, як правило, ацетонітрилу Виявлено, що вихід у цій реакції можна підвищити шляхом знегажування розчину, що містить сполуку формули IV, за допомогою інертного газу перед додаванням триалкілхлорсилану Як правило, для цієї мети використовують азот Серед триалкілхлорсиланів перевага віддається триметилхлорсилану Триалкілгалоідсилан використовують, як правило, у надлишковій КІЛЬКОСТІ ВІДНОСНО стехіометрії Наприклад, у типовому випадку використовують стехіометричний надли COR" III шок від 2 до 4 відносно КІЛЬКОСТІ сполуки формули IV Перевага віддається стехіометричному надлишку від 2,7 до приблизно 2,9 Реакцію в суміші проводять звичайно протягом від приблизно 15 хвилин до приблизно 1 години Як правило, реакцію проводять при температурі, принаймні, 30°С, краще не нижче приблизно 40°С, ще краще не нижче приблизно 50°С, а найбільша перевага віддається проведенню реакції при температурі від приблизно 60°С до приблизно 70°С Хоча можливе виділення та очищення сполуки формули III, одержаної за новим способом згідно з цим винаходом, ці сполуки, як правило, не піддають суттєвому очищенню, а натомість перетворюють у сполуки пірол [2,3-сі]піримідину, заміщені у положенні 5 (5-заміщені пірол[2,3-сі]піримідини) формули VII (а) за способом, показаним на Схемі З, де R2 та X відповідають наведеним вище визначенням для формули IV 17 18 53742 Схема З halo COR Halogenatincr Reagent III 0 COR V •O" C R" VI halogenatmg reagent - реагент галоїдування Сполуки формули V можна одержати шляхом додавання реагенту галоїдування до розчину, який містить сполуку формули III, одержану, як показано на Схемі 2 Додавання може бути здійснене при температурі від 60°С до 70°С, якій віддається перевага при проведенні попередньої реакції, однак краще охолоджувати реакційну суміш перед додаванням реагенту галоїдування Додавання реагенту галоїдування можна здійснювати при температурі від 0°С до 60°С, однак з'ясовано, що перевагу слід віддавати температурі додавання від приблизно 35°С до приблизно 45°С Після додавання реагенту галоїдування одержану суміш перемішують протягом від 5 хвилин до приблизно 2 годин Як правило, тривалість реакції галоїдування складає від приблизно 5 хвилин до приблизно 1 години, але перевага віддається тривалості 20 хвилин або менше Галоїдним замісником у сполуці формули V, якому віддається перевага, є бром, а серед реагентів галоїдування перевага віддається, як правило, елементарному брому Після завершення реакції и можна припинити шляхом додавання відомого реагенту, що зв'язує галоїд, наприклад, бісульфіту натрію Потім сполуку формули V можна екстрагувати, використовуючи ВІДПОВІДНИЙ розчинник, що не змішується з водою Одержаний розчин, що містить сполуку формули V, має досить високу чистоту і може бути безпосередньо використаний для одержання сполук формули Vll(a) або сполук формули VII ,CQR H,N VII або їх фармацевтичних солей чи сольватів згідно з методикою, описаною в патенті США №5,416,211, зміст якого включено цим посиланням до даного опису Якщо сполуки формул II, IV, IV, VII або Vll(a) містять групи захисту карбоксилу, то такі групи можуть бути видалені з використанням добре відомих у практиці методів Численні реакції введення та видалення груп захисту карбоксилу, які охоплюються об'ємом цього винаходу, описані в багатьох загальновідомих працях, в тому числі у монографії Шрудерата Любке (The Peptides, Vol I, Schrooder and Lubke, Academic Press, London and New York, 1965) та у вищезгаданій монографії Гріна Способи видалення груп захисту карбоксилу, зокрема, метильнихта етильних груп, у загальних рисах описано нижче у Прикладах 5 та 7 Якщо у сполуках формули VII RNHCH(CO2R1)CH2CH2CO2R1 або у сполуках формул II, IV, IV або VII (a) R23 3 2 NHCH(CO2R )CH2CH2CO2R , то групу R або R можна ввести на будь-якій зручній для цього стадії синтезу Наприклад, залишок глутамшової кислоти можна вводити після реакцій за Схемами 1-3, як у загальних рисах описано нижче у Прикладах 5 і 6 За альтернативним варіантом, товарний діалкіловий ефір глутамшової кислоти формули NH2CH(CO2R3)CH2CH2CO2R3 можна сполучати з комерційно доступною р-галоідбензойною кислотою перед подальшою реакцією за Схемою 1 Оптимальну тривалість здійснення реакцій за схемами 1-3 можна визначити, контролюючи хід реакцій відомими хроматографічними методами Добір розчинника для реакції, як правило, не має вирішального значення, якщо застосований розчинник є інертним відносно даної реакції та розчиняє реагенти у достатній мірі для створення середовища, в якому може протікати корисна реакція За винятком спеціально вказаних випадків, перевага віддається проведенню всіх описаних реакцій в інертній атмосфері Інертною атмосферою, якій віддається перевага, є азот 19 53742 Спосіб одержання нових сполук формули IV, показаний на Схемі 1, значно спрощує очищення сполук формули III, одержаних шляхом приєднання алкенолу до галоїдного арилу Спосіб, показаний на Схемі 2, являє собою раніше невідомий спосіб одержання альдегідів із солей сульфокислот з катіонами металів Очікується, що це перетворення має загальний характер і може бути широко використане в галузі процесів синтезу У даному конкретному випадку це перетворення забезпечує селективне й успішне одержання сполук формули III Крім того, сполуки формули IV, які в контексті цього винаходу можна розглядати як аналоги альдегідів, являють собою стабільні, як правило, кристалічні речовини, зручні для виробництва у значних кількостях, очищення та зберігання Таким чином, як правило, результатом застосування загального способу згідно з цим винаходом є спрощення промислових процесів, для яких необхідні альдегіди формули III Наведені нижче приклади мають тільки ілюстративний характер і не призначені для будь-якого обмеження об'єму винаходу Терміни та скорочення, використані в описах прикладів, вжито в їх звичайних значеннях, за винятком спеціально вказаних випадків Наприклад, позначення "°С", "н (N)", "ммоль", "r", "d", "мл", "М"", "ВРХ (HPLC)", "1Н-ЯМР (NMR)", "13С-ЯМР (NMR)" та "об (тої)" означають ВІДПОВІДНО градуси Цельсію, нормальність, мілімоль або МІЛІМОЛІ, грам або грами, густину, мілілітр або мілілітри, молярність, високоефективну рідинну хроматографію, протонний ядерномагнітний резонанс, ядерно-магнітний резонанс на вуглеці-13 і КІЛЬКІСТЬ у мілілітрах на грам вихідного матеріалу Крім того, в описах інфрачервоних спектрів зазначено тільки максимуми, що мають значення у конкретних випадках, а не всі виявлені максимуми Приклади Приклад 1 4-(4-карбометоксифеніл)бутаналь Смолу Deloxan® THP типу 2, використану в цьому прикладі, попередньо обробляли шляхом змішування и з ізопропіловим спиртом (2,0об, 20мл) та промивання етилацетатом (4,0об , 40мл) Потім суспензію смоли в органічній фазі фільтрували та використовували, як описано нижче Метиловий ефір 4-бромбензойноі кислоти (60,0г, 279,00ммоль), ацетатдипдрат ЛІТІЮ (31,31Г, 306,90ммоль), хлорид ЛІТІЮ (35,48Г, 837ММОЛЬ) І хлорид тетрабутиламонію (41,22г, 131,49ммоль) додавали до диметилформаміду (698мл) Одержаний розчин знегажували шляхом продування азотом Додавали З-бутен-1-ол (24,19г, 28,81мл, 334,81 ммоль) та ацетат паладію (1,57г, 6,98ммоль) і нагрівали реакційну суміш при 65°С при перемішуванні протягом приблизно 10 годин Завершення реакції контролювали по витрачанню вихідного матеріалу (залишилося менше 0,4% метилового ефіру 4-бромбензойноі кислоти), визначаючи його методом високоефективної рідинної хроматографії (зворотна фаза, елюент - 60% ацетонітрилу у 2,5%-ному буферному розчині оцтової кислоти) Охолоджували реакційну суміш до 25°С-30°С і додавали воду (700мл) та етилацетат (700мл) Перемішували суміш протягом 10 хвилин 20 і залишали для розділення шарів ВІДДІЛЯЛИ органічний шар, а водну фазу екстрагували ще ДВІЧІ етилацетатом (720мл) Етилацетатні екстракти об'єднували з початковим органічним шаром і промивали об'єднані розчини розсолом (350мл) Органічний розчин фільтрували для видалення елементарного паладію і суспендували у фільтраті смолу Deloxan® THP типу II (3,0г сухої маси) протягом 45 хвилин Сполуку, вказану в заголовку, одержано у вигляді розчину в етилацетаті з виходом приблизно 87% Незначну КІЛЬКІСТЬ етилацетатного розчину концентрували для ідентифікації продукту Дані аналізу 1 Н ЯМР (de-DMSO) 5 9,65 (t, J=1,5Гц, 1Н), 7,86 (d, J=8,5I~4, 2Н), 7,32 (d, J=8,5I~4, 2H), 3,82 (s, ЗН), 2,63 (t, J=7,7I~4, 2H), 2,43 (td, J=7,4, 1,5Гц, 2Н), 1,82 (m, 2H) 13 C ЯМР (de-DMSO) 5 203,1, 166,2, 147,4, 129,3, 128,7, 127,4, 51,9, 42,4, 34,3, 23,0 Приклад 2 Натрієва сіль 1 -пдрокси-4-(4карбометоксифеніл)-бутансульфоновоі кислоти Етилацетатні екстракти, одержані, як описано у Прикладі 1, концентрували до 3,боб (8,7мл) у вакуумі при приблизно 37°С, додавали спирт сорту ЗА (3 об'єми, 7,2мл) і воду (0,63 об'єму, 1,51мл), а потім бісульфіт натрію (1,04г, Ю.ОЗммоль) Реакційну суміш перемішували протягом приблизно 8 годин Через 10 хвилин починалася кристалізація сульфонової кислоти Завершення реакції визначали за результатами 1Н-ЯМР аналізу фільтрату реакційної суміші Одержану суспензію білого кольору фільтрували і одержували зазначену в заголовку сполуку (2,78г, 8,98ммоль) у вигляді білої кристалічної речовини з виходом приблизно 80% Продукт промивали на фільтрі етанолом (1,8 об'єму) і сушили у вакуумі при 40°С Ізомерних домішок при 1Н-ЯМР аналізі не виявлено Дані аналізу 1 Н ЯМР (de-DMSO) 5 7,86 (d, и=8,27Гц, 2Н), 7,32 (d, и=8,27Гц, 2Н), 5,33 (d, и=2,ЗГц, 1Н), 3,84 (ш, 1Н), 3,81 (s, ЗН), 2,63 (m, 2H), 1,75 (m, 1H), 1,73 (m, 1H), 1,61 (m, 1H), 1,48 (m, 1H) 13 С ЯМР (de-DMSO) 5 166,2, 148,3, 129,2, 128,7, 127,1, 82,7, 51,9, 35,1, 31,2, 27,2 ІЧ (в таблетках КВг) 3237 29 62 2930 2889 1726 с м 1 Приклад З 1 -Гідрокси-2-бром-4-(4карбометоксифеніл)бутаналь У круглодонну колбу МІСТКІСТЮ 50мл, обладнану магнітною мішалкою, завантажували аддукт бісульфіту натрію з метиловим ефіром 4-(4оксобутил)-бензойноі кислоти (3,10г, Юммоль), ацетонітрил (14мл) та триметилхлорсилан (3,6мл, 28ммоль) Пропускали через суміш газоподібний азот протягом 5 хвилин, а потім суміш нагрівали на бані з температурою 60°С в атмосфері азоту протягом години При цьому суміш набувала світло-жовтого кольору Потім суміш охолоджували до 5°С і додавали бром (0,5мл, 9,7ммоль) Коричневий колір брому знебарвлювався протягом 1 хвилини Розчин був світло-жовтого кольору, а видимі тверді частки виглядали безбарвними Видаляли охолоджувальну баню і перемішували суміш ще 53742 22 21 протягом 2 годин Додавали воду (14мл) та бісуза допомогою 6N хлористоводневої кислоти льфіт натрію (0,14г) для зв'язування залишкового (48,5мл) ВІДДІЛЯЛИ осад фільтруванням і промиброму і перемішували масу протягом 1 години вали його ЗОмл суміші води зі спиртом сорту ЗА Розподіляли одержану суміш між хлористим мети(1 1) Тверду речовину сушили у вакуумі при 50°С леном (14мл) і додатковими 7мл води ВІДДІЛЯЛИ Одержано 10,84г сполуки, вказаної в заголовку органічну фазу і концентрували у ротаційному виДані аналізу 1 парному апараті до кінцевого об'єму 26мл Ці 26мл Н ЯМР (de-DMSO) 5 10,66 (br s, 1H), 10,33 (br розчину містили сполуку, вказану в заголовку, яку s, 1H), 7,83 (d, 2H), 7,30 (d, 2H), 6,31 (s, 1H), 6,17 перед подальшою реакцією, описаною у Прикладі (br s 2H), 2,97 (m, 2H), 2,85 (m, 2H) ІЗ 4, не піддавали виділенню та очищенню Незначну С ЯМР (de-DMSO) 5 167,6, 159,5, 152,4, КІЛЬКІСТЬ розчину в хлористому метилені концент151,4, 147,9, 129,4, 128,6, 128,4, 117,7, 113,6,98,8, рували для ідентифікації продукту 36,4,28,0 Дані аналізу Приклад 6 1 р-Толуолсульфокисла сіль діетилового ефіру Н ЯМР (CDCI3) 5 9,40 (d, 1H), 7,95 (d, 2H), Н-{4-[2-(2-амшо-4,7-дипдро-4-оксо-1Н-пірол[2,37,26 (d, 2Н), 4,15 (ddd, 1Н), 3,88 (s, ЗН), 2,89 (m, d]mpHMiflHH-5-in)eTHn]-6eH3oin}-L-myTaMiHOBOi кис1Н), 2,79 (m, 1H), 2,35 (m, 1H), 2,21 (m, 1H) 13 лоти С ЯМР (CDCI3) 5 191,4, 166,8, 145,1, 129,9, 128,5, 128,5, 54,4, 52,0, 32,7, 32,6 У колбу МІСТКІСТЮ 50мл, обладнану механічною мішалкою, термометром і пристроєм для подачі Приклад 4 азоту, завантажували 1,93г (з поправкою на реМетиловий ефір 4-[2-(2-амшо-4,7-дипдро-4зультат випробування) 4-[2-(2-амшо-4,7-дипдро-4оксо-1 Н-пірол[2,3^]-піримідин-5-іл)етил] бензойної оксо-1Н-пірол[2,3^]піримідин-5-іл)етил]-бензойноі кислоти кислоти (2,5г, ефективність 77%) і 13,5мл диметиДо 26мл органічного розчину, одержаного, як лформаміду Суспензію перемішували протягом описано у прикладі 3, який містить 1-пдрокси-215 хвилин і додавали 1,94г N-метилморфолшу (2,9 бром-3-(4-карбометоксифеніл)бутаналь, додавали еквіваленту) Охолоджували суміш до 5°С у водно2,4-діаміно-6-пдроксипіримідин (1,26г, Юммоль), льодовій бані і додавали хлордиметокситриазин ацетат натрію (1,68г, 20ммоль) і воду (23мл) Про(1,46г, 1,28екв) одною порцією Суміш перемішупускали через суміш газоподібний азот протягом 5 вали протягом 40 хвилин, а потім додавали діетихвилин Нагрівали суміш протягом 2 годин при ловий ефір L-глутамшовоі кислоти (1,99г, 40°С в атмосфері азоту Охолоджували масу до 1,28екв) Давали суміші нагрітися до температури температури приміщення і фільтрували Одержаприміщення Хід реакції контролювали за допомоний осад промивали 23мл суміші ацетонітрилу з гою високоефективної рідинної хроматографії водою (1 1) Після висушування одержано 1,47г (зворотна фаза, градієнтне елюювання від 20% до світло-жовтих голчастих кристалів Згідно з дани46% ацетонітрилу в буферному 0,5%-ному розчині ми аналізу, загальний вихід процесу за Прикладаоцтової кислоти) Реакція завершувалася за 1 гоми 3 і 4 склав 45% Рівень чистоти продукту 94,8% дину при температурі 23°С Переносили реакційну за даними високоефективної рідинної хроматогмасу в колбу Ерленмейєра МІСТКІСТЮ 250МЛ, куди рафії (зворотна фаза, градієнтне елюювання від заздалегідь завантажували Збмл деюнізованої 50% до 30% метанолу у 20мМ буферному розчині води і 18мл хлористого метилену Перемішували дипдрофосфату калію або дипдрофосфату амосуміш протягом 15 хвилин і залишали для роздінію) лення шарів Шар хлористого метилену концентДані аналізу рували від маси 46г до 13г у ротаційному випар1 Н ЯМР (de-DMSO) 5 10,66 (s, 1Н), 10,23 (s, ному апараті під зниженим тиском при температурі 1Н), 7,84 (d, 2Н), 7,32 (d, 2Н), 6,31 (s, 1Н), 6,08 (s, у бані 45°С Концентрат розбавляли спиртом сорту 2Н), 3,80 (s, ЗН), 2,98 (dd, 2H), 2,86 (dd, 2H) ЗА до об'єму 55мл і знову концентрували до маси 13 С ЯМР (de-DMSO) 5 166,3, 159,4, 152,3, 10г для видалення хлористого метилену Концен151,3, 148,4, 129,2, 128,7, 127,1, 117,6, 113,6, 98,8, трат розбавляли спиртом сорту ЗА до загального 52,0, 36,3, 27,9 об'єму 60мл і нагрівали одержаний розчин до 70Приклад 5 75°С Додавали до маси на протязі 30-90 хвилин 4-[2-(2-амшо-4,7-дипдро-4-оксо-1Н-пірол[2,3/ьтолуолсульфонову кислоту (3,16г, 2,57екв), розd]пlpимlдин-5-lл)eтил]-бeнзoйнa кислота чинену в 55мл спирту ЗА Одержану суспензію Завантажували у колбу 13,0г метилового ефінагрівали зі зворотним холодильником протягом ру 4-[2-(2-амшо-4,7-дипдро-4-оксо-1Н-пірол[2,3години Охолоджували масу до температури приd]пlpимlдин-5-lл)eтил]бeнзoйнol кислоти і 150мл міщення і фільтрували через лійку Бюхнера діаме2N водного розчину гідроксиду натрію При перетром 7см Вологий осад промивали на фільтрі мішуванні нагрівали масу при 40°С Хід реакції 25мл етанолу і сушили у вакуумі при 50°С протяконтролювали за допомогою високоефективної гом ночі Одержано 3,66г сполуки, названої в загорідинної хроматографії (зворотна фаза, градієнтне ловку Ефективність 95% елюювання від 50% до 30% метанолу у 20мМ буферному розчині дипдрофосфату калію або дипдДані аналізу 1 рофосфату амонію) До розчину додавали спирт Н ЯМР (de-DMSO) 5 11,59 (br s, 1Н), 11,40 (s, сорту ЗА (230мл) і вводили кристалізаційний заро1Н), 8,66 (d, 1Н), 7,88 (br s, 1H), 7,79 (d, 2H), 7,58 док аутентичної 4-[2-(2-амшо-4,7-дипдро-4-оксо(d, 2H), 7,29 (d, 2H), 7,16 (d, 2H), 6,52 (s, 1H), 4,42 1Н-пірол[2,3^]піримідин-5-іл)етил]бензойноі кис(m, 1H), 4,09 (q, 2H), 4,03 (q, 2H), 2,94 (m, 2H), 2,89 лоти (одержаної за методикою, описаною в патенті (m, 2H), 2,43 (m, 2H), 2,28 (s, ЗН), 2,08 (m, 1H), 2,02 США № 5,416,211) Встановлювали рН розчину 4,4 (m, 1H), 1,17 (t, ЗН), 1,14 (t, ЗН) 23 53742 13 С ЯМР (de-DMSO) 5 172,3, 171,9, 166,7, 157,2, 150,6, 145,8, 144,4, 138,6, 138,3, 131,3, 128,4, 128,3, 127,5, 125,6, 119,2, 115,4, 99,1, 60,6 60,0, 52,0, 35,8, 30,2, 27,2, 25,8, 20,8, 14,1, 14,1 Приклад 7 г\|-{4-[2-(2-амшо-4,7-дипдро-4-оксо-1Нпірол[2,3^]піримідин-5-іл)етил]-бензоіл}-І_глутамшова кислота До 1,00г р-толуолсульфокислої солі діетилового ефіру г\І-{4-[2-(2-аміно-4,7-дипдро-4-оксо-1Нпірол[2,3-с1]піримідин-5-іл)етил]-бензоіл}-І_глутамшової кислоти додавали у колбі Ерленмейєра МІСТКІСТЮ 50мл 1N водний розчин гідроксиду натрію (6,7мл) і одержану суміш перемішували до повного розчинення твердої фази (приблизно 20 хвилин) Розчин мав світло-зелений колір Додавали до маси 6-7мл деюнізованої води і встановлювали рН 2,8-3,1 за допомогою розбавленої хлористоводневої кислоти Одержану суспензію нагрівали приблизно до 70°С для утворення більших частинок твердої фази Відфільтровували суспензію і одержували сполуку, вказану в заголовку, у вигляді твердої речовини Приклад 8 Динатрієва сіль г\І-{4-[2-(2-амшо-4,7-дипдро-4оксо-1Н-пірол[2,3-сі]-піримідин-5-іл)етил]-бензоіл}L-глутамшовоі кислоти г\І-{4-[2-(2-аміно-4,7-дипдро-4-оксо-1Нпірол[2,3-с!]піримідин-5-іл)етил]-бензоіл}-І_глутамшову кислоту, одержану, як описано у прикладі 7, розчиняли в 3,8мл води і 2,2мл 1-н розчину гідроксиду натрію Встановлювали рН суміші 7,5-8,5 за допомогою розбавленої хлористоводневої кислоти і 1N розчину гідроксиду натрію Розчин нагрівали до 70°С і додавали 40мл спирту сорту ЗА Залишали масу для охолодження до температури приміщення, при цьому утворювалася густа суспензія Осад ВІДДІЛЯЛИ фільтруванням і промивали етанольно-водною сумішшю (4 1) Сушили у вакуумній сушильній шафі при 50°С Одержано 640мг сполуки, вказаної в заголовку, у вигляді твердої речовини Дані аналізу 1 H-nmr (300МГц, DMSO-d6/D20) 5 7,67 (d, и=7,8Гц, 2Н), 7,22 (d, J=7,8I~4, 2Н), 6,30 (s, 1H), 4,09 (m, 1H), 2,88 (m, 2H), 2,83 (m, 2H), 2,05-1,71 (m, 4H) 13 С ЯМР (75МГц, DMSO-d6/D20) 5 179,9, 176,9, 167,1, 160,8, 152,9, 151,7, 146,7, 132,6, 129,4, 127,9, 118,7, 115,2, 99,5, 56,1, 36,8, 35,3, 30,1, 28,4 Приклад 9 Натрієва сіль 1 -пдрокси-4-[І_-І\І-(1,3дикарбоетоксипропіл)бенз-4амід]бутансульфоновоі кислоти Змішували І_-І\І-1,3-(дикарбоетоксипропіл)-4йодбензамід (10,00г, 23,1ммоль), хлорид ЛІТІЮ (2,937г, 69,3ммоль), ацетат ЛІТІЮ 24 ретельно продували азотом Додавали З-бутен-1ол (1,998г, 27,7ммоль) і ацетат паладію (II) (0,130г, 0,577ммоль) Суміш нагрівали при 60°С в атмосфері азоту протягом 24 годин Після цього високоефективна рідинна хроматографія (зворотна фаза, елюювання 60% ацетонітрилу в 2,5%-йому буферному розчині оцтової кислоти) посвідчила завершення реакції Реакційну масу розподіляли між етилацетатом (58мл) і водою (58мл) Розділяли шари Водний шар ДВІЧІ екстрагували етилацетатом (по 58мл) Органічні розчини об'єднували і промивали розсолом (ЗОмл) Одержаний органічний розчин концентрували до об'єму 25мл Додавали етилацетат (15мл), воду (3,25мл) і бісульфіт натрію (0,636г, 6,11ммоль) Перемішували масу протягом 16 годин при 25°С Додавали ацетон (75мл) Осаджений продукт ВІДДІЛЯЛИ фільтруванням і сушили у вакуумній шафі Одержано 1,59г сполуки, вказаної в заголовку Вихід 48,6% Приклад 10 Діетиловий ефір г\І-{4-[2-(2-амшо-4,7-дипдро-4оксо-1Н-пірол[2,3^]піримідин-5-іл)етил]-бензоіл}L-глутамшовоі кислоти У круглодонну колбу МІСТКІСТЮ 25мл, обладнану магнітною мішалкою, завантажували натрієву сіль 1 -пдрокси-4-[І_-І\І-(1,3дикарбоетоксипропіл)бенз-4амід]бутансульфоновоі кислоти (0,922г, 2,0ммоль), ацетонітрил (5мл) та триметилхлорсилан (0,72мл) Продували суміш азотом протягом 5 хвилин, а потім нагрівали при 60°С протягом 1 години Встановлювали температуру маси 40°С і додавали бром (98мкл, 1,9ммоль) 1Н-ЯМР посвідчив повне перетворення в проміжний продукт - альфабромпохідну Реакційну суміш охолоджували до температури приміщення і промивали 1%-ним водним розчином бісульфіту натрію (2,5мл) Органічну фазу випаровували, одержуючи масло Додавали до масла 2,4-діаміно-6-пдроксипіримідин (ЗООмг, 2,4ммоль), ацетат натрію (500мг), воду (5мл) та ацетонітрил (5мл) Нагрівали суміш протягом 6 годин при 40°С ВІДДІЛЯЛИ верхній органічний шар і концентрували його, одержуючи масло (450мг) 1Н-ЯМР та високоефективна рідинна хроматографія (зворотна фаза, елюювання з градієнтом від 20% до 46% ацетонітрилу в 0,5%-ному буферному розчині оцтової кислоти) підтвердили, що масло складається переважно зі сполуки, вказаної в заголовку Вище наведено детальний опис винаходу, в тому числі варіантів його здійснення, яким віддається перевага Мається на увазі, що обізнані фахівці після ознайомлення з цим описом можуть запропонувати численні модифікації та/або вдосконалення, які не виходять за межі об'єму винаходу, визначеного пунктами формули винаходу (2,592Г, 25,4ммоль), хлорид тетрабутиламонію (3,412г, 11,55ммоль) і диметилформамід (57,7мл) Суміш ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюA process and intermediate products useful for antifolates preparing
Автори англійськоюKjell, Douglas, Patton, Barnett Charles Jackson
Назва патенту російськоюСпособ и промежуточные продукты, полезные для изготовления антифолатов
Автори російськоюБарнетт Чарлз Джексон
МПК / Мітки
МПК: C07D 487/04, C07C 67/317, C07C 323/56, C07C 323/60, C07C 309/00, C07C 231/00, C07C 69/76, A61K 31/519, C07C 235/84, C07C 67/313, A61P 35/00, C07C 69/767
Мітки: синтезі, одержання, антифолати, альдегідів, сполук, використовують, цінних, спосіб
Код посилання
<a href="https://ua.patents.su/12-53742-sposib-oderzhannya-aldegidiv-yaki-vikoristovuyut-pri-sintezi-spoluk-cinnikh-yak-antifolati.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання альдегідів, які використовують при синтезі сполук, цінних як антифолати</a>
Попередній патент: Оптико-електронна система огляду та цілевказування
Наступний патент: Полімерна композиція для захисту від рентгенівського випромінювання
Випадковий патент: Спосіб керування головною водовідливною установкою вугільної шахти