Спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів
Номер патенту: 85835
Опубліковано: 10.12.2013
Автори: Годована Олеся Іванівна, Стойка Ростислав Степанович, Заіченко Олександр Сергійович, Ключівська Ольга Юріївна
Формула / Реферат
1. Спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів, що включає нарощування клітинної біомаси для тестування кістковопластичних матеріалів, який відрізняється тим, що у передопераційному періоді для проведення бактеріоскопії з пародонтальних карманів пацієнта беруть мазки для оцінки дозозалежної чутливості наявної мікрофлори до антибіотиків, проводять біопсію, нарощують клітинну біомасу та визначають ex vivo індивідуальну біосумісність ясенного експлантанта до кістковопластичних матеріалів.
2. Спосіб за п. 1, який відрізняється тим, що біопсію проводять в ділянці міжзубного сосочка молярів розміром 2-4 мм3
3. Спосіб за п. 1, який відрізняється тим, що клітинну масу нарощують 2-3 тижні.
4. Спосіб за п. 1, який відрізняється тим, що тривалість тестування становить в середньому від 1 до 1,5 місяця.
5. Спосіб за п. 1, який відрізняється тим, що тестування проводять паралельно з етапом передопераційної підготовки пацієнта.
Текст
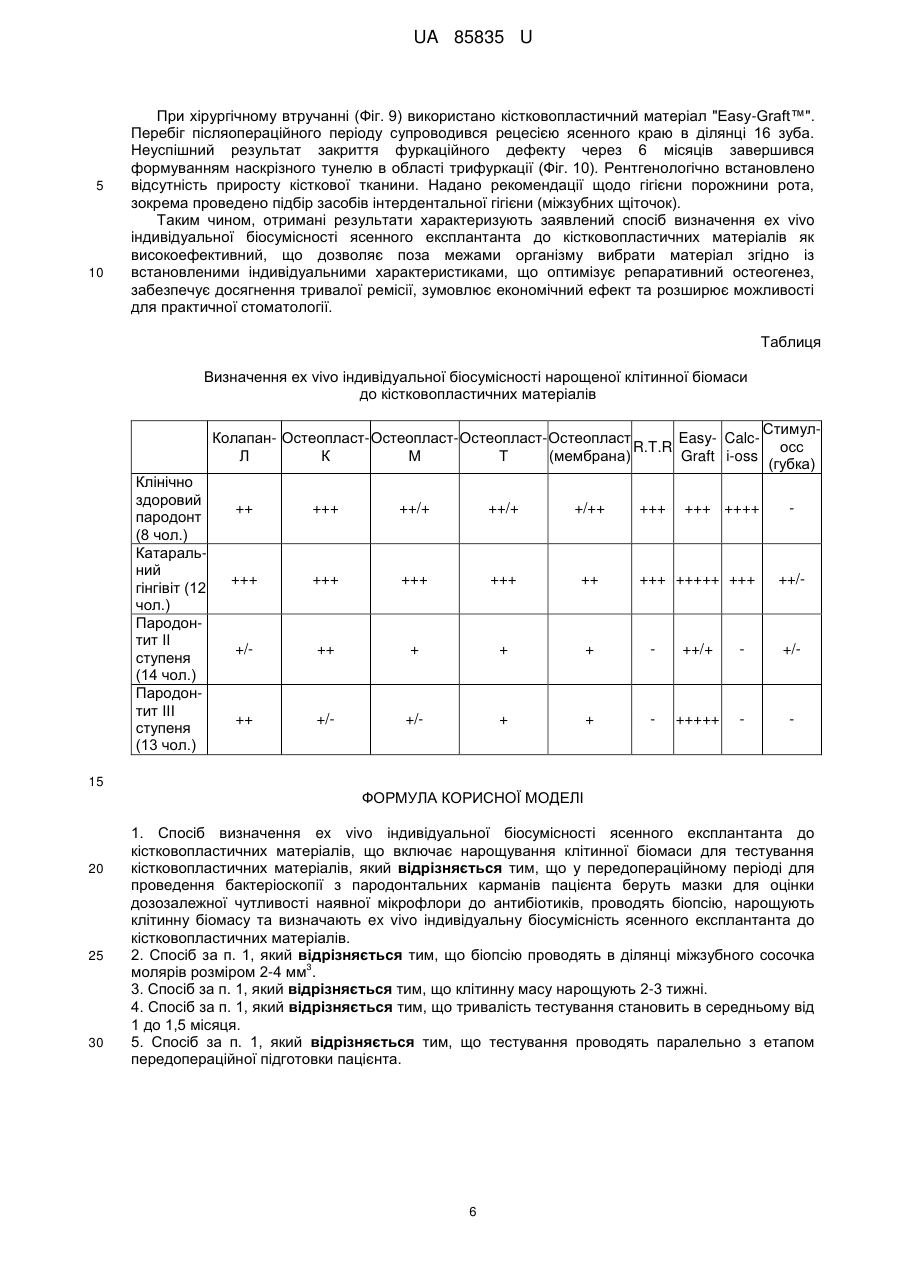
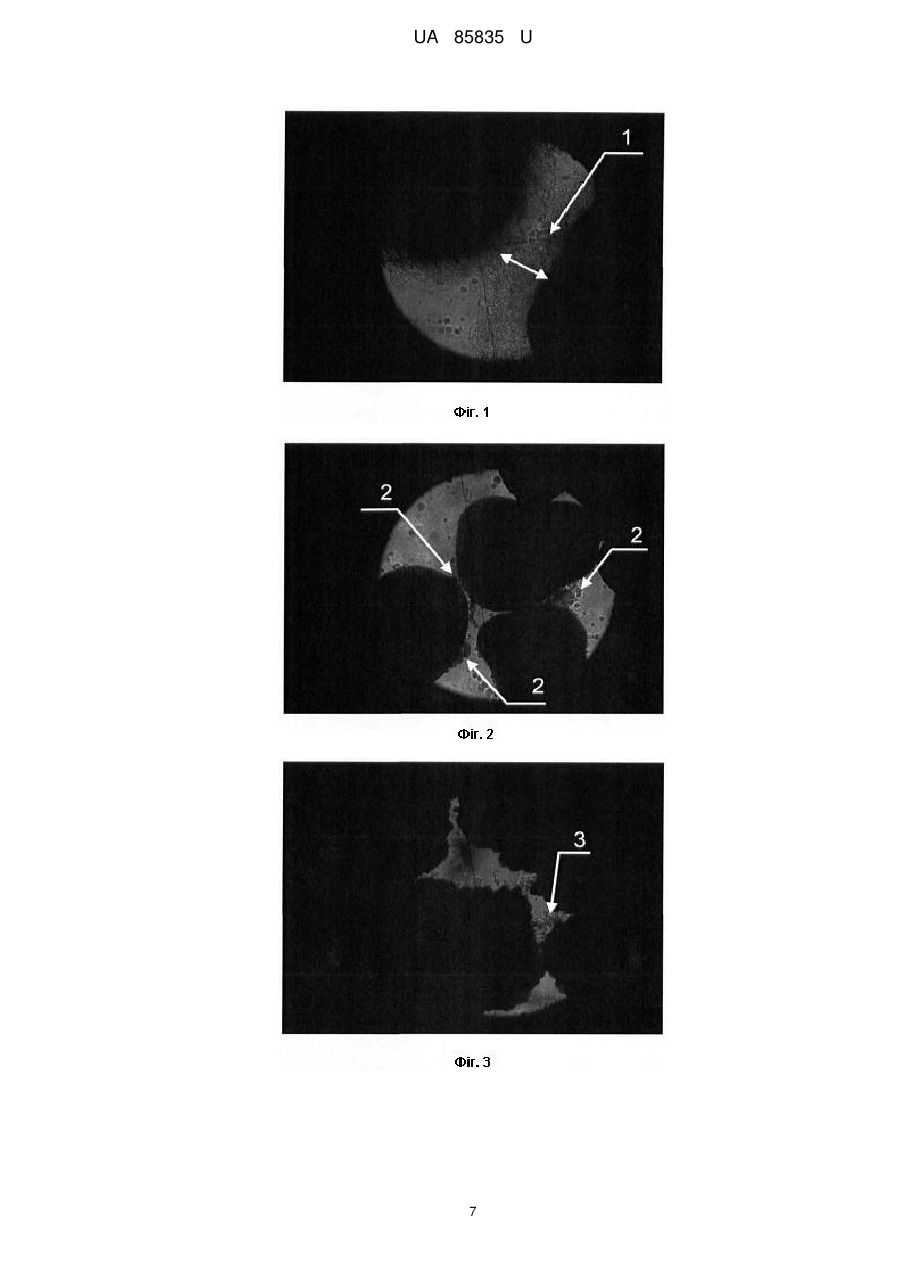
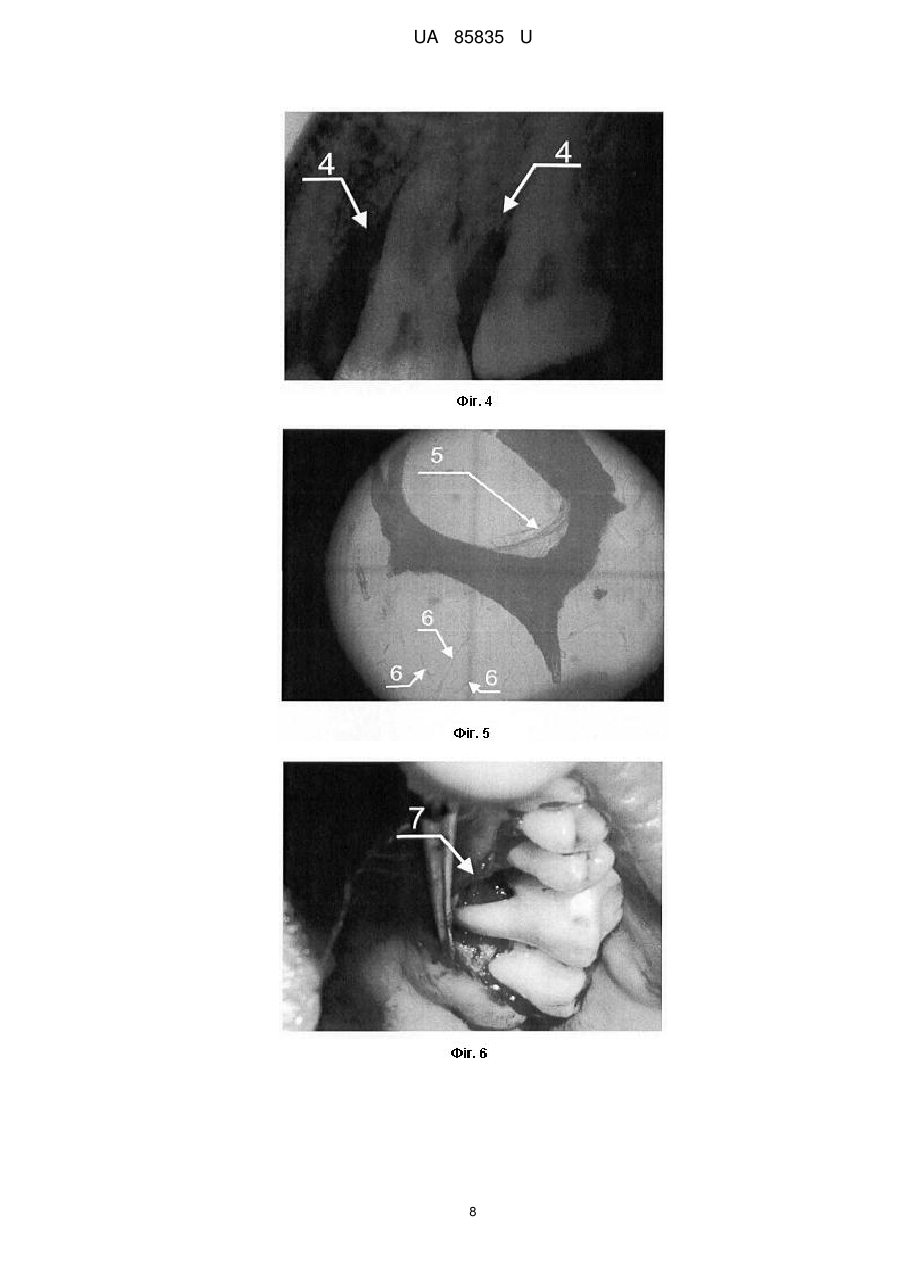
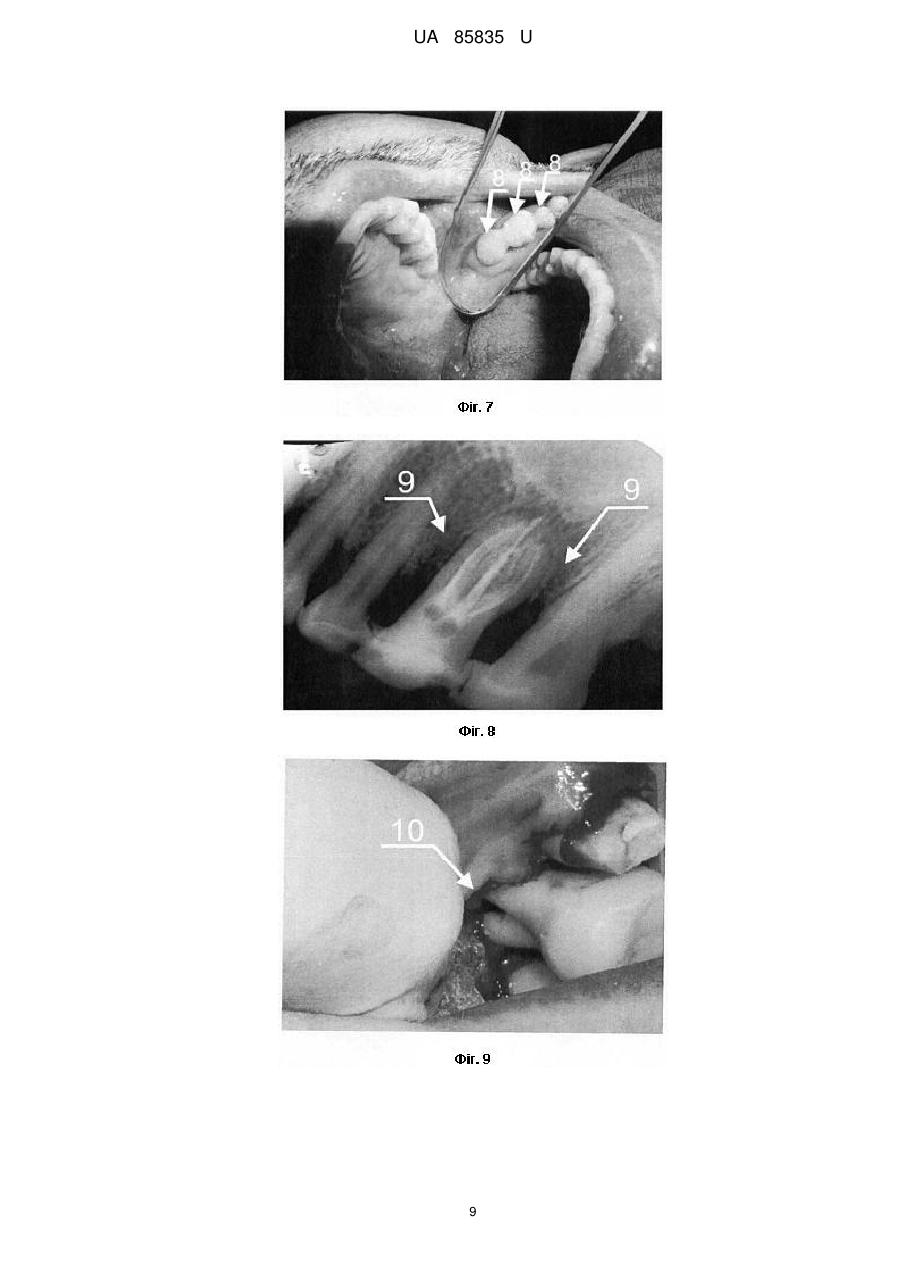
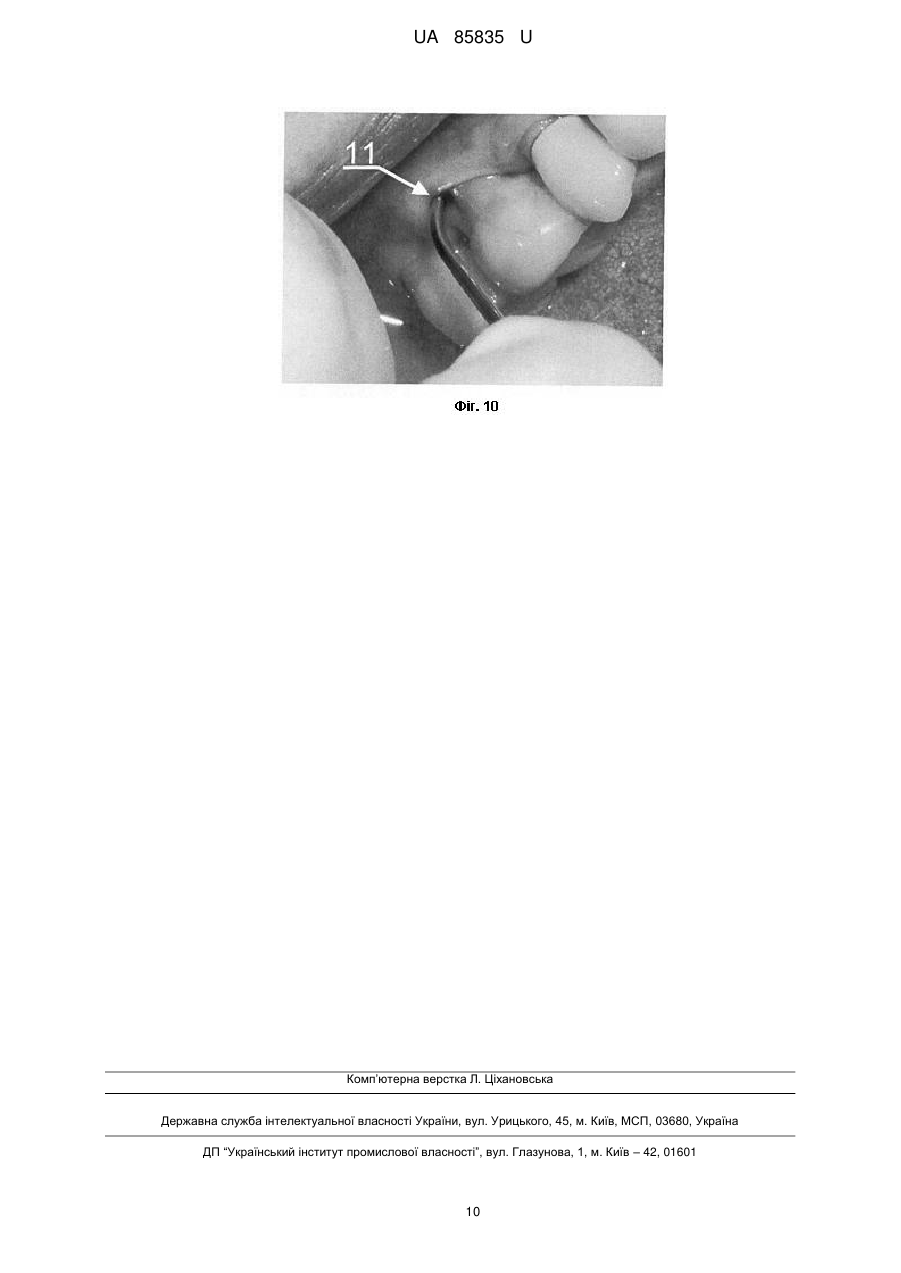
Реферат: Спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів включає нарощування клітинної біомаси для тестування кістковопластичних матеріалів. У передопераційному періоді для проведення бактеріоскопії з пародонтальних карманів пацієнта беруть мазки для оцінки дозозалежної чутливості наявної мікрофлори до антибіотиків, проводять біопсію, нарощують клітинну біомасу та визначають ex vivo індивідуальну біосумісність ясенного експлантанта до кістковопластичних матеріалів. UA 85835 U (12) UA 85835 U UA 85835 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі медицини, зокрема стоматології та клітинної біології, і може бути використана для оптимізації результатів хірургічного лікування генералізованого пародонтиту ІІ-ІII ступеня важкості, у практиці щелепно-лицевої хірургії для закриття дефектів різного походження та в імплантології. При тестуванні кістковопластичних матеріалів, які передбачені для використання в практиці хірургічної пародонтології, щелепно-лицевої хірургії та імплантології, важливе значення має можливий негативний їх вплив на організм пацієнта, відсутність адаптації до кісткового ложа, несприятливий перебіг післяопераційного періоду, порушення процесів репаративного остеогенезу, що завершується невдалими результатами лікування. У цьому контексті ключову роль відіграють дослідження здатності таких матеріалів викликати загибель або трансформацію клітин тканин [Monchau F. In vitro studies of human and rat osteoclast activity on hydroxyapatite, βtricalcium phosphate, calcium carbonate / F. Monchau, A. Lefevre, M. Descamps [et al.] // Biomolecular Eng. - 2002. - № 19. - P. 143-152; Корж Н.А. Имплантационные материалы и остеогенез. Роль индукции и кондукции в остеогенезе / Н.А. Корж, В.А. Радченко, Л.А. Кладченко, С.В. Малышкина // Ортопедия, травматология и протезирование. - 2006. - №2. - С. 150-157, Albrektsson Т. Osteoinduction, osteoconduction, osteointegration / Т. Albrektsson, С. Johansson // Eur. Spine J. - 2001. - № 10. - P. 96-101]. Ефективним підходом у вирішенні цієї проблеми є дослідження з використанням культури постійних клітинних ліній та первинних культур, отриманих з біопсійних матеріалів in vitro. Дія кістковопластичних матеріалів у культурі клітин є чутливим експрес-методом біоіндикації. Цей скринінг дозволяє в короткий термін зробити висновок щодо наявності або відсутності цитотоксичного впливу досліджуваних матеріалів на клітини конкретного пацієнта, а також біосумісності матеріалу і опосередковано - через визначення адгезії - встановити наявність та вираженість остеогенних властивостей. Дослідження з використанням культури клітин характеризуються високою чутливістю та відтворюваністю, а також надійністю контролю за якістю проведення експериментів. Для вивчення кістковопластичних матеріалів in vitro використовують первинні культури, бо постійні клітинні лінії генетично та метаболічно відрізняються від клітин організму і демонструють більшу стійкість до різних несприятливих чинників. У випадку дослідження матеріалів, які in vivo контактують з такими біологічними тканинами як ясна, кісткова тканина альвеолярного відростка, кістковий мозок, доцільно використовувати культуру клітин сполучної тканини - фібробластів, клітин кісткового мозку, мезенхімальних клітин, пре- та остеобластів [Воложин А. Мультипотентные клетки жировой ткани: перспективы использования в челюстнолицевой хирургии / А. Воложин, Е. Киселева, Т. Калашникова [и др.] // Кафедра. - 2007. - № 6(3). - С. 20-25; Anselme К. Osteoblast adhesion on biomaterials // Biomaterials. - 2000. - № 21. - P. 667681; Грудянов А.И., Григорьян A.C., Ерохин А.И. Использование культуры фибробластов человека в хирургическом лечении воспалительных заболеваний пародонта // Пародонтология. - 2003. - № 2 (27). - С. 13-17]. Тому на цьому етапі досліджень джерелом клітин може бути фрагмент ясен, який в умовах культивування in vitro здатний до росту клітин фібробластичного диферону. Крім того, використання культури фібробластів доцільне ще й з тих міркувань, що у разі проведення токсикологічного дослідження кістковопластичних матеріалів реакція організму на їхню дію опосередковується через систему сполучної тканини, основними структурними елементами якої є фібробластоподібні клітини. Тканинна інженерія, що передбачає роботу з мезенхімальними стовбуровими клітинами, фібробластами та остеобластами з метою оптимізації репаративного остеогенезу, на сьогодні має багато обмежень щодо використання у клінічній хірургічній практиці. Відомим є спосіб дослідження цитологічних особливостей остеобластів, культивованих за присутності біоматеріалів з різною поверхнею [Потапчук A.M. Цитологічні особливості остеобластів, культивованих у присутності біоматеріалів з різною поверхнею / A.M. Потапчук, В.В. Русин, Й.П. Шаркань [та ін.] // Новини стоматології. - 2010. - № 1 (62). - С. 33-37]. У роботі досліджено проліферативну активність культивованих клітин (остеобластів, вилучених з кісток черепа 4-денних щурів), їх адгезію на поверхні зразків (титан і цирконій у чистому вигляді та з модифікованою поверхнею). Кращі результати були характерні для цирконію, а за структурою поверхні - для зразків з поверхнею, модифікованою імпульсним лазером Nd-YAG. Авторами стверджено, що усі досліджувані зразки були біосумісними і не спричиняли токсичної дії. Відомий спосіб експериментального вивчення динаміки процесів репаративної регенерації шляхом закриття кісткового дефекту в ділянці кута нижньої щелепи остеопластичним матеріалом Гапкол з нанесеними на нього стромальними клітинами жирової тканини кролика алогенного і аутологічного походження [Воложин А.И. Использование мезенхимальных стволових клеток для активизации репаративных процессов костной ткани челюсти в 1 UA 85835 U 5 10 15 20 25 30 35 40 45 50 55 60 эксперименте /А.И. Воложин, А.Ю. Васильев, Н.Н. Мальгинов [и др.] // Стоматология. - 2010. № 1. - С. 10-14]. Ці клітини виділяли з фрагментів жирової тканини, взятих у паховій ділянці кролика. Висновки, зроблені авторами цієї роботи, свідчать про те, що аутологічні стромальні клітини жирової тканини, які були диференційовані в остеогенному напрямку, інтенсивніше сприяли регенеративному остеогенезу на моделі дефекту кута нижньої щелепи, ніж клітини алогенного походження. Специфіка роботи з клітинами, диференційованими у фібробласти, визначається наступним: 1) псевдонормальні нетрансформовані фібробласти не можна доводити до стану конфлюенту in vitro тому, що при перевищенні певної густини клітин відбувається їх спонтанна трансформація; 2) фібробласти заселяють поверхню лише після досягнення ними високої густини (стан конфлюенту). Найближчим аналогом запропонованого винаходу є спосіб визначення in vitro остеоінтегративних властивостей кістковопластичних матеріалів, що включає нарощування клітинної біомаси для тестування кістково-пластичних матеріалів за допомогою культивування клітинного тест-об'єкту, який розташовують на поверхні матеріалу, передбаченого для випробовування (поліамід-12 з вуглеволокном, поліамід-12 з вуглеволокном і гідроксіапатитом, поліамід-12 з вуглеволокном, гідроксіапатитом і полівінілпіролідоном, поліметилметакрилат з гідроксіапатитом, надвисокомолекулярний поліетилен і гідроксіапатит, надвисокомолекулярний поліетилен і гідроксіапатит, модифікований поліакриловою кислотою) [Патент РФ № 2259851, МПК A61L27/00; опубл. 10.09.2005. Бюл. № 25]. Як тест-об'єкт у цьому способі використано мезенхімальні стовбурові клітини, виділені з кісткового мозку щура. Визначали цитотоксичність зразків, оцінюючи життєздатність клітин, після чого визначали ефективність прикріплення клітин до поверхні зразків шляхом заселення клітин на поверхні зразка з наступним (через 120 хв.) промиванням зразка культуральним середовищем і стандартним підрахунком клітин, що залишилися на зразку. Опісля визначали вплив зразків на інтенсивність проліферації мезенхімальних стовбурових клітин за кількістю вирощених на поверхні зразка клітин на 7 і 14 добу та проводили їхній стандартний підрахунок. Індукували остеогенне диференціювання та оцінювали його за наявністю мінералізації, а також за допомогою гістохімічного забарвлення на лужну фосфатазу. Дослідження проводили на кроликах, яким робили підсадку в штучно створений дефект у ділянці нижньої щелепи. Дефект закривали імплантатом, який фіксували титановими шурупами. Рану ушивали, а забір фрагментів нижньої щелепи робили через 1, 3 і 6 місяців і вивчали методом СЕМ (сканувальна електронна мікроскопія). Показано, що в експериментальній групі тварин ознаки інтеграції імплантатів з кістковими структурами щелепи виражені краще, ніж у контрольній групі: на поверхні заселених клітинами імплантатів формується більша кількість кісткових трабекул, ніж на поверхні імплантатів без клітин. При цьому на поверхні трабекул виявляються диференційовані остеобласти, а в кісткових лагунах - остеоцити. Більшість таких трабекул безпосередньо пов'язана з кістковими структурами прилеглої нижньої щелепи. Серед окремих недоліків цього дослідження є тривалий термін спостереження, поєднання щурячих клітин з тканинами кролика, а також відсутність можливості проведення такої роботи у клінічних умовах, зумовлена високим ризиком трансформації культивованих клітин. Загальним недоліком усіх вищезазначених робіт є відсутність попереднього моделювання патологічного стану (запальних явищ, остеопоротичного процесу тощо), що не дозволяє оцінити потенціал тест-зразків за умов, наближених до клінічних. В основу корисної моделі поставлена задача розробити спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів, що використовуються у практиці пародонтальної хірургії, який забезпечив би визначення потенційних переваг і ризиків використання тих чи інших кістковопластичних матеріалів в умовах патологічного процесу, причому за межами організму. Поставлена задача вирішується тим, що у способі визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів, що включає нарощування клітинної біомаси для тестування кістковопластичних матеріалів, згідно з винаходом, у передопераційному періоді, для проведення бактеріоскопії, з пародонтальних карманів пацієнта беруть мазки для оцінки дозозалежної чутливості наявної мікрофлори до 3 антибіотиків, проводять біопсію в ділянці міжзубного сосочка молярів розміром 2-4 мм , нарощують клітинну біомасу 2-3 тижні та визначають ех vivo індивідуальну біосумісність ясенного експлантанта до кістковопластичних матеріалів. Тривалість тестування становить в середньому від 1 до 1,5 місяця, і воно проводиться паралельно з етапом передопераційної підготовки пацієнта. 2 UA 85835 U 5 10 15 20 25 30 35 40 45 50 55 60 Особливістю первинної клітинної культури є здатність до проліферації за умов росту в 3 суспензії, що підвищує можливості заселення "великих" фрагментів (більше 1-5 мм ) тестованих зразків. Новим у вирішенні поставленої задачі є те, що запропонований спосіб вперше на клітинному рівні передбачає проведення за межами організму безпечного тестування індивідуальної чутливості тканин операційного ложа до різних матеріалів у максимально короткі терміни, що вкладаються у межі передопераційної підготовки. Визначення потенційних переваг і ризиків використання тих чи інших кістковопластичних матеріалів не пов'язане із будь-якою загрозою щодо асептики і антисептики, а також із розвитком аутоімунних реакцій. Це надає можливість ефективніше застосувати сертифіковані в Україні матеріали, які дозволені до використання в хірургічній пародонтологічній практиці й не потребують етапу попереднього доклінічного дослідження. Корисна модель, що заявляється забезпечує дієвість діагностично-прогностичного підходу для оцінки ризиків використання різних кістковопластичних матеріалів при хірургічному лікуванні хронічного генералізованого пародонтиту. Корисна модель дозволяє включити заявлений спосіб у перелік критеріїв індивідуального вибору кістковопластичного матеріалу для окремих пацієнтів з метою оптимізації репаративного остеогенезу. Корисна модель ілюструється фотографіями проведеного дослідження. На Фіг. 1 TM>> представлено кістковопластичний матеріал "Easy-Graft , де 1 - клітинна біомаса із товщиною наростання 100-150 мкн. На Фіг. 2 представлено кістковопластичний матеріал "Calc-i-oss™", де 2 - агломерати клітин, закріплені на поверхні гранул із незначним приростом біомаси. На Фіг. 3 кістковопластичний матеріал "R.T.R", де 3 - агломерати клітин біомаси (аморфна група клітин); надмірна рельєфність поверхні гранул цього матеріалу зумовлює складність простеження реальної кількості нарощеної біомаси. На Фіг. 4 - прицільна рентгенограма хворого К., 50 років, де 4 - локальний пародонтит III ступеня важкості в ділянці 26 зуба. На Фіг. 5 кістковопластичний матеріал "Остеопласт-К®" і первинна культура фібробластів через 3-4 доби з моменту посіву (хворий К., 50 років), де 5 - агломерат фібробластоподібних клітин, які формують колонію, що має здатність до проведення контракції (стягування) елементів, на яких закріпилися клітини, де 6 - поодинокі клітини із фібробластоподібною морфологією. На Фіг. 6 етап клаптевої операції, де 7 - відкидання слизово-окісного клаптя у ділянці фуркаційного дефекту III ступеня 26 зуба (хворий К., 50 років). На Фіг. 7 - вигляд пародонтальної шини в ділянці 25, 26, 27 зубів (позиція 8) у стані тривалої ремісії (хворий К., 50 років). На Фіг. 8 прицільна рентгенограма 25, 26, 27 зубів (хворий К., 50 років), де 9 - стабілізація (збільшення) висоти міжальвеолярних перегородок, відсутність остеопоротичних явищ, посилення кісткового рисунку. На Фіг. 9 - етап клаптевої операції, де 10 - відкидання слизово-окісного клаптя в ділянці 16 зуба з фуркаційним дефектом III ступеня (хвора Т., 48 років). На Фіг. 10 - через 6 міс. після клаптевої операції, де 11 - зондування (зонд Nabers "Hu-Friedy") наскрізного дефекту в ділянці трифуркації 16 зуба (хвора. Т., 48 років). Спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів, що використовуються в пародонтальній хірургії здійснювали таким чином. Після встановлення діагнозу і визначення потреби у проведенні клаптевої операції з елементами кісткової пластики у пацієнта беруть мазки із пародонтальних карманів для оцінки дозозалежної чутливості наявної мікрофлори до антибіотиків (бактеріоскопія, що передбачає призначення за показаннями курсу відповідної схеми антибіотикотерапії у рамках передопераційної підготовки пацієнта). Наступним етапом є біопсія. Після проведення інфільтраційного знечулення (Septanest 3 "Septodont", Франція), скальпелем видаляють фрагмент міжзубного сосочка розміром 2-4 мм у ділянці молярів, який вносять у стерильну пробірку Епендорф з додаванням 1 мл культурального середовища Дульбекко у модифікації Ігла (DMEM) або середовища RPMI-1640 (Sigma Chem. Co., США), що також містить 50 мг/мл гентаміцину ("Дарниця", Україна) та 20 мг/мл ципрофлоксацину ("Новофарм-Біосинтез", Україна) на 2-4 год. З моменту забору до моменту закладання в СО2-інкубатор (IG150, Jouan, Франція) зразок перебуває при температурі не нижче 15 °C. 3 Проводять нарощування матеріалу пацієнта (фрагмент ясен розміром 2-4 мм ), взятого у процесі передопераційної підготовки до клаптевої операції, до необхідної кількості (умовно 6 приблизно 0,1-1*10 клітин на один зразок тестованого матеріалу і на одну чашку Петрі (робочий об'єм - 1 мл культурального середовища, діаметр дна - 16 мм). Тривалість цього етапу становить, в середньому, 3 тижні (для пацієнтів старше 25 років) і тестування індивідуальної біосумісності до наступних кістковопластичних матеріалів: 3 UA 85835 U 5 10 15 20 25 30 35 40 45 50 55 60 1) "Колапан-Л®" ("Интермедапатит", РФ) синтетичний гідроксиапатит і склеральний колаген із додаванням лінкоміцину гідрохлориду; 2) "Остеопласт®" (НПК "Витаформ-Р", РФ) - серія матеріалів на основі тваринного колагену, насиченого сульфатованими глікозаміногліканами; використано крихту "Остеопласт®-К", тверді і м'які блоки "Остеопласт®-Т" та "Остеопласт®-М", а також мембрану; 3) "R.T.R" (Septodont, Франція) - синтетичний остеокондуктивний матеріал високого ступеня очищення із β-трикальційфосфатною кристалічною структурою; 4) "Easy-Graft™" (DS Dental, Швейцарія) синтетичний остеокондуктивний матеріал на основі чистої фази β-трикальційфосфату з полілактойдом і Поліглюкойдом (ПЛГК); 5) "Calc-i-oss™" (DS Dental, Швейцарія) - синтетичний остеокондуктивний матеріал на основі чистої фази β-трикальційфосфату); 6) "Стимул-Осс" (ВАТ Лужський завод "Белкозин", РФ) - губка стоматологічна на основі колагену, 2 % хлоргексидину біглюконату і гідроксіапатиту. При малій кількості одержаної біомаси кількість клітинного матеріалу для засіву на один тестований зразок може становити від 100 тисяч клітин (тривалість дослідної експозиції при цьому буде 20-30 діб). За наявності біомаси більше від необхідної кількості можна засівати до 1 мільйона клітин на один зразок тестованого матеріалу і на одну чашку Петрі (тривалість дослідної експозиції при цьому буде 10-15 діб). 3 Клапоть розділяють на фрагменти розміром приблизно 0,5 мм і вносять в чашки Петрі з 1 мл культурального середовища, що містять 50 мкг/мл гентаміцину, для нарощування біомаси до необхідної кількості. Через 14-15 діб оцінюють кількість і стан приросту клітинної біомаси, після чого за показаннями продовжують час нарощування або закладають дослід-тестування. Неприкріплену біомасу (клітинна суспензія) відбирають з чашок Петрі, де вона наростає, окремі порції (аліквоти) об'єднують і перемішують, загальний об'єм доводять із розрахунку приблизно 500 клітин 1 мл і висівають на чашки Петрі, у яких розміщені зразки тестованих матеріалів у кількостях 1 мл культурального середовища з клітинами на точку. Чашки інкубують при 37 °C у СО2-інкубаторі (IG150, Jouan, Франція) із 5 % СО2 та 100 % вологості у газовій фазі. Час нарощування біомаси та дослідної експозиції в середньому становить 15-20 діб. Для оцінки стану клітин застосовують барвники - акридин оранжевий (АО, Sigma Chem. Co., США) та трипановий синій (ТС, Reanal, Угорщина). Перегляд піддослідних клітинних культур та оцінку стану (трансформованих і незмінених, живих, апоптичних і мертвих) клітин здійснюють на світловому інвертованому мікроскопі Біолам-Р (ЛОМО, Санкт-Петербург, РФ) при збільшенні приблизно 150-200 разів та на люмінесцентному мікроскопі Мик Мед-2(12) (ЛОМО, СанктПетербург, РФ) при збільшенні приблизно 200 разів з хвилями збудження 360-440 нм та емісії 480-700 нм. За цих умов клітини відрізняються за контурами чи формою цитоплазми, морфологією ядер, топологією кольорових речовин у клітині. Фотографування препаратів проводять на вказаних вище мікроскопах на цифровому фотоапараті Canon PowerShot A630 (Canon, Японія). При розпрацюванні запропонованого способу використовували матеріал, взятий у пацієнтів, якими були донори-добровольці з клінічно нормальним станом пародонта (8 чол.), пацієнти з явищами катарального гінгівіту (12 чол.) і пацієнти з хронічним генералізованим пародонтитом ІІ-ІII ступеня важкості, що потребували хірургічного лікування (27 чол.). Результати дослідження дозволили виявити такі особливості. Клітинна культура, що була взята у клінічно здорових людей, а також у пацієнтів із катаральним гінгівітом, який розцінюється як зворотній процес та супроводжується помірно вираженим запальним процесом без порушення цілісності кругової зв'язки, виявляла високу спорідненість майже до усіх тестованих кістковопластичних матеріалів (Фіг. 1, 2, 3). При хронічному генералізованому пародонтиті ІІ-ІII ступеня важкості така спорідненість проявлялась дуже слабко і тільки до одиничних тестованих кістковопластичих матеріалів, найчастіше до "Easy-Graft™" та матеріалів серії "Остеопласт®" (дані представлені в Таблиці). Ефективність заявленого способу підтверджується конкретними прикладами його здійснення. Задіяно 27 пацієнтів із хронічним генералізованим пародонтитом ІІ-ІII ступеня важкості без виражених соматичних захворювань, віком від 23 до 50 років. 12 хворих увійшли в основну групу, а 15 - у контрольну. Усі пацієнти скаржилися на самовільну кровоточивість ясен та під час чищення зубів, неприємний присмак і запах у роті, больові відчуття у яснах, рухомість зубів. При обстеженні виявляли недоліки індивідуальної гігієни порожнини рота, оцінювали стан слизової оболонки альвеолярних відростків верхньої і нижньої щелеп, наявність та глибину пародонтальних карманів, реєстрували індекс гігієни порожнини рота Гріна-Вермільона (OHI-S), 4 UA 85835 U 5 10 15 20 25 30 35 40 45 50 55 папілярно-маргінально-альвеолярний індекс (РМА), пародонтальний індекс (РІ) у модифікації Рассела, індекс кровоточивості ясенних сосочків (РВІ). Для диференційної діагностики гінгівіту із пародонтитом проводили ортопантомографію і при необхідності - серію прицільних знімків. Усім пацієнтам призначали комплексне лікування, що включало навчання індивідуальній гігієні порожнини рота, підбір гігієнічних засобів, проведення професійної гігієни, застосування місцевих протизапальних середників. При пародонтиті II та IIІ ступеня важкості за показаннями проводили клаптеві операції з кістковою пластикою та обов'язковим призначенням засобів остеотропної терапії. Застосовували шинування і раціональне шинуюче протезування. В основній групі у комплексне лікування включили заявлений спосіб після інформування хворих про суть методу та їхньої письмової згоди. У контрольній групі обмежилися лише загальноприйнятими методами діагностики та лікування, у тому числі хірургічного. Контрольне обстеження усіх хворих проводили через 6, 12 місяців і через 3 роки. В основній групі лікування пародонтиту ІІ-ІII ступеня важкості відзначалося більш позитивною динамікою. У післяопераційному періоді застосування заявленого способу дозволило одержати кращі результати у вигляді відсутності обтяженого перебігу загоєння післяопераційної рани, зменшення глибини кісткових карманів, відсутності виражених рецесій (множинних чи одиничних). На рентгенограмах проглядалося зниження остеопоротичних процесів, ущільнення кортикальної пластинки, трабекулярна кісткова тканина мала чітко виражений рисунок із щільними кістковими перекладинами. У всі терміни спостереження тривалість ремісії в основній групі у 4 рази перевищувала показники контрольної групи. У пацієнтів контрольної групи одержані результати свідчили про відсутність стійкої ремісії. Клінічно процес супроводжувався рецесією ясенного краю різного ступеня важкості, оголення шийок зубів супроводжувалось явищами гіперестезії. У терміни спостереження після проведеного лікування рентгенологічно підтверджена відсутність чіткого рисунка трабекулярної кістки та приросту кісткової тканини. Клінічний приклад 1. Хворий К., 50 років, звернувся зі скаргами на періодичну кровоточивість з ясен при чищенні зубів і під час прийому їжі, неприємний запах та присмак гною в порожнині рота. Об'єктивно: у порожнині рота слизова оболонка ясен гіперемована з ціанотичним відтінком, ясенні сосочки збільшені, пародонтальні кармани глибиною 6-7 мм з гнійним вмістом. У ділянці 26 зуба глибина пародонтального кармана становила 9-11 мм. Рентгенологічно простежувалась деструкція кісткової тканини змішаного типу із переважанням горизонтальної втрати кістки, в ділянці 26 зуба - вертикальна кісткова кишеня (двостінна). Діагноз: хронічний генералізований пародонтит II ступеня важкості та локальний пародонтит III ступеня в ділянці 26 зуба з фуркаційним дефектом III ступеня (Фіг. 4). Взяття мазків із пародонтальних карманів для бактеріоскопічного дослідження дозволило виявити кокову мікрофлору з морфологічними елементами кандидоподібних грибів, що утруднило подальше дослідження. Етап передопераційної підготовки передбачав проведення професійної гігієни, що включало зняття над- і під'ясенних відкладень, за показаннями призначено курс антибіотикотерапії (ципрофлоксацин та метронідазол курсом 7 днів). Проведена депульпація 26 зуба для запобігання реінфекції. Наступним етапом роботи було взяття фрагмента ясен і, згідно із запропонованим способом, нарощування клітинної біомаси для визначення сумісності до кістковопластичних матеріалів. Проведене дослідження дозволило встановити високу чутливість клітин до "Остеопласт-К®" та "Остеопласт-М®" (Фіг. 5). Після проведеної клаптевої операції (Фіг. 6), підсадки зазначених матеріалів серії "Остеопласт®", шинування 25, 26, 27 зубів за допомогою скловолоконної балки і фотополімерного матеріалу "Charisma" отримали сприятливий перебіг процесу загоєння у післяопераційні терміни. Спостереження через три роки дозволило констатувати тривалу ремісію: відсутність запального процесу, пародонтальних карманів та рухомості зубів, ясна блідо-рожевого кольору щільної консистенції (Фіг. 7), на рентгенограмі в ділянці 25, 26, і 27 зубів простежувалась відсутність остеопоротичних процесів та посилення рельєфності кісткового рисунку (Фіг. 8). Клінічний приклад 2. Хвора Т. 48 років, звернулася зі скаргами на періодичну кровоточивість і гноєтечу з ясен. Об'єктивно: у порожнині рота слизова оболонка ясен гіперемована з ціанотичним відтінком, пародонтальні кармани глибиною 6-7 мм з гнійним вмістом. У ділянці 16 зуба глибина пародонтального кармана становила 8-11 мм. Рентгенологічно простежувалась 1 деструкція кісткової тканини на /2 довжини коренів і більше. Діагноз: хронічний генералізований пародонтит II ступеня важкості. У ділянці 16 зуба-локальний пародонтит III ступеня важкості з фуркаційним дефектом III ступеня. 5 UA 85835 U 5 10 При хірургічному втручанні (Фіг. 9) використано кістковопластичний матеріал "Easy-Graft™". Перебіг післяопераційного періоду супроводився рецесією ясенного краю в ділянці 16 зуба. Неуспішний результат закриття фуркаційного дефекту через 6 місяців завершився формуванням наскрізного тунелю в області трифуркації (Фіг. 10). Рентгенологічно встановлено відсутність приросту кісткової тканини. Надано рекомендації щодо гігієни порожнини рота, зокрема проведено підбір засобів інтердентальної гігієни (міжзубних щіточок). Таким чином, отримані результати характеризують заявлений спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів як високоефективний, що дозволяє поза межами організму вибрати матеріал згідно із встановленими індивідуальними характеристиками, що оптимізує репаративний остеогенез, забезпечує досягнення тривалої ремісії, зумовлює економічний ефект та розширює можливості для практичної стоматології. Таблиця Визначення ex vivo індивідуальної біосумісності нарощеної клітинної біомаси до кістковопластичних матеріалів Колапан- Остеопласт- Остеопласт- Остеопласт- Остеопласт Easy- CalcR.T.R Л К М Т (мембрана) Graft i-oss Клінічно здоровий пародонт (8 чол.) Катаральний гінгівіт (12 чол.) Пародонтит II ступеня (14 чол.) Пародонтит III ступеня (13 чол.) +++ +++ ++++ Стимулосс (губка) ++ +++ ++/+ ++/+ +/++ +++ +++ +++ +++ ++ +/ ++ + + + ++/+ +/ ++ +/ +/ + + +++++ +++ +++++ +++ ++/ 15 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 25 30 1. Спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів, що включає нарощування клітинної біомаси для тестування кістковопластичних матеріалів, який відрізняється тим, що у передопераційному періоді для проведення бактеріоскопії з пародонтальних карманів пацієнта беруть мазки для оцінки дозозалежної чутливості наявної мікрофлори до антибіотиків, проводять біопсію, нарощують клітинну біомасу та визначають ex vivo індивідуальну біосумісність ясенного експлантанта до кістковопластичних матеріалів. 2. Спосіб за п. 1, який відрізняється тим, що біопсію проводять в ділянці міжзубного сосочка 3 молярів розміром 2-4 мм . 3. Спосіб за п. 1, який відрізняється тим, що клітинну масу нарощують 2-3 тижні. 4. Спосіб за п. 1, який відрізняється тим, що тривалість тестування становить в середньому від 1 до 1,5 місяця. 5. Спосіб за п. 1, який відрізняється тим, що тестування проводять паралельно з етапом передопераційної підготовки пацієнта. 6 UA 85835 U 7 UA 85835 U 8 UA 85835 U 9 UA 85835 U Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61C 13/00, G01N 33/00
Мітки: кістковопластичних, визначення, експлантанта, матеріалів, спосіб, індивідуальної, біосумісності, ясенного
Код посилання
<a href="https://ua.patents.su/12-85835-sposib-viznachennya-ex-vivo-individualno-biosumisnosti-yasennogo-eksplantanta-do-kistkovoplastichnikh-materialiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення ex vivo індивідуальної біосумісності ясенного експлантанта до кістковопластичних матеріалів</a>