Нова кристалічна форма похідного піридазино[4,5-b]індолу
Формула / Реферат
1. Кристалічна форма сполуки Формули (А):
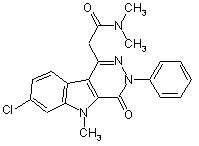 ,
,
яку визначають як Форму ІІ, яка характеризується рентгенівською дифрактограмою, що містить пік при величині кутів 2-тета, що приблизно становить 5,71 градус, 11,47 і 9,97 градусів.
2. Кристалічна форма за п. 1, рентгенівська дифрактограма якої додатково характеризується піками при величинах кутів 2-тета, що становлять приблизно 19,21; 18,43; 15,95 і 11,97 градусів.
3. Кристалічна форма за п. 1, яка по суті вільна від будь-якого іншого поліморфа.
4. Фармацевтична композиція, що містить кристалічну форму за п. 1 і один або декілька фармацевтично прийнятних наповнювачів.
5. Спосіб лікування або запобігання захворюванню або порушенню, пов'язаному з порушенням функцій периферичних бензодіазепінових рецепторів, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
6. Спосіб лікування або запобігання захворюванню або порушенню, пов'язаному з порушенням функцій периферичних бензодіазепінових рецепторів, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
7. Спосіб лікування або запобігання нейродегенеративному захворюванню, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
8. Спосіб лікування або запобігання нейродегенеративному захворюванню, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
9. Спосіб лікування або запобігання невропатії, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
10. Спосіб лікування або запобігання невропатії, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
11. Спосіб лікування або запобігання раку або пухлинам, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
12. Спосіб лікування або запобігання раку або пухлинам, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
13. Спосіб лікування або запобігання стресовому станові в ділянці шкіри, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
14. Спосіб лікування або запобігання стресовому станові в ділянці шкіри, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
15. Спосіб лікування або запобігання ревматоїдному артриту, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
16. С'посіб лікування або запобігання ревматоїдному артриту, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
17. Спосіб лікування або запобігання серцевому захворюванню або порушенню серцевої діяльності, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1.
18. Спосіб лікування або запобігання серцевому захворюванню або порушенню серцевої діяльності, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4.
19. Спосіб одержання кристалічної форми за п. 1, що включає стадії змішування 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-ацетаміду з нижчим спиртом з утворенням суміші з концентрацією, що складає від приблизно 1 мг/мл до приблизно 4 мг/мл, нагрівання суміші до температури в інтервалі від приблизно 45 °С до приблизно 60 °С, фільтрування суміші і випарювання нижчого спирту з фільтрату за допомогою потоку інертного газу з утворенням твердої речовини.
20. Спосіб одержання кристалічної форми за п. 1, що включає стадії розчинення 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-ацетаміду в дихлорметані з утворенням розчину з концентрацією від приблизно 30 мг/мл до приблизно 50 мг/мл; додавання розчину до етанолу при об'ємному співвідношенні щодо кількості дихлорметану від приблизно 1:3 до приблизно1:4; концентрування розчину за допомогою зниження об' єму за допомогою потоку інертного газу на приблизно 10 % - приблизно 40 % до кристалізації твердої речовини і подальшого відділення твердої речовини.
21. Спосіб одержання кристалічної форми за п. 1, що включає стадії розчинення 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-ацетаміду в дихлорметані з утворенням розчину з концентрацією від приблизно 20 мг/мл до приблизно 50 мг/мл, додавання розчину до гексанів для того, щоб викликати осадження твердої речовини, і відділення твердої речовини.
Текст
1. Кристалічна форма сполуки Формули (А): O CH3 N 2 (19) 1 3 91716 4 ванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4. 13. Спосіб лікування або запобігання стресовому станові в ділянці шкіри, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1. 14. Спосіб лікування або запобігання стресовому станові в ділянці шкіри, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4. 15. Спосіб лікування або запобігання ревматоїдному артриту, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1. 16. С'посіб лікування або запобігання ревматоїдному артриту, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4. 17. Спосіб лікування або запобігання серцевому захворюванню або порушенню серцевої діяльності, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної форми за п. 1. 18. Спосіб лікування або запобігання серцевому захворюванню або порушенню серцевої діяльності, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості фармацевтичної композиції за п. 4. 19. Спосіб одержання кристалічної форми за п. 1, що включає стадії змішування 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду з нижчим спиртом з утворенням суміші з концентрацією, що складає від приблизно 1 мг/мл до приблизно 4 мг/мл, нагрівання суміші до температури в інтервалі від приблизно 45 °С до приблизно 60 °С, фільтрування суміші і випарювання нижчого спирту з фільтрату за допомогою потоку інертного газу з утворенням твердої речовини. 20. Спосіб одержання кристалічної форми за п. 1, що включає стадії розчинення 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду в дихлорметані з утворенням розчину з концентрацією від приблизно 30 мг/мл до приблизно 50 мг/мл; додавання розчину до етанолу при об'ємному співвідношенні щодо кількості дихлорметану від приблизно 1:3 до приблизно1:4; концентрування розчину за допомогою зниження об' єму за допомогою потоку інертного газу на приблизно 10 % - приблизно 40 % до кристалізації твердої речовини і подальшого відділення твердої речовини. 21. Спосіб одержання кристалічної форми за п. 1, що включає стадії розчинення 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду в дихлорметані з утворенням розчину з концентрацією від приблизно 20 мг/мл до приблизно 50 мг/мл, додавання розчину до гексанів для того, щоб викликати осадження твердої речовини, і відділення твердої речовини. Даний винахід стосується нової кристалічної форми, що надалі позначають в описі як кристалічну форму II 7-хлор-N,N,5-триметил-4-оксо-3феніл-3,5-дигідро-4Н-піридазино [4,5-b]індол-1ацетаміду. Даний винахід також стосується способів одержання такої кристалічної форми, і способів її використання для запобігання і лікування захворювань, пов'язаних із периферичними бензодіазепіновими рецепторами. 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід, що має структуру, яка відповідає формулі (А): 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро4Н-піридазино[4,5-b]індол-1-ацетаміду описані, наприклад, у патенті США No.6262045 і, зокрема, у патенті США No.6395729, які включені в повному обсязі у даний опис у вигляді посилання. Способи, описані в цих патентах, призводять до виділення 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро4Н-піридазино[4,5-b]індол-1-ацетаміду в одній певній кристалічній формі, що позначають в описі як форму І. Обмежена розчинність кристалічної Форми І 7хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро4Н-піридазино[4,5-b]індол-1-ацетаміду як у водних розчинах (звичайно менше, ніж 0,01мг/мл), так і неводних розчинниках препарату (звичайно менше, ніж 3мг/мл) робить скрутним введення хворому і зберігання препаратів, що містять зазначену сполуку. Попередні дослідження, які здійснювали зі стандартними препаратами, призводили до обмеженого всмоктування лікарського засобу. Тому, існує потреба в нових твердих формах 7-хлорΝ,Ν,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду і в нових способах їхнього одержання. Ми виявили, що сполука Формули (А) може знаходитися у вигляді двох кристалічних полімор (A) має високу спорідненість до периферичних бензодіазепінових рецепторів. Одержання, фізичні властивості та чудові фармакологічні властивості 5 фних модифікацій, кожна з яких має фізичні властивості, які чітко відрізняються. Ці дві кристалічні поліморфні форми, описані в даному описі винаходу, надалі позначають в описі як Форму І і Форму II. Відповідно, даний винахід стосується кристалічної поліморфної форми II 7-хлор-Ν,Ν,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду, яка показана Формулою (А), і композицій, що містять кристалічну Форму II. Даний винахід також стосується способів одержання кристалічної Форми II і способів її використання. На Фіг.1 наведено накладення трьох інфрачервоних спектрів кристалічної Форми II 7-хлорN,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду за даним винаходом, одержаних на ІЧ спектрометрі з перетворенням Фур'є (FTIR). На Фіг.2 порівнюють інфрачервоні спектри кристалічної Форми І 7-хлор-N,N,5-триметил-4оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5b]індол-1-ацетаміду і кристалічної Форми II 7-хлορΝ,Ν,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду, одержаних на ІЧ спектрометрі з перетворенням Фур'є (FTIR). Фіг.3 являє собою накладення термограм кристалічних форм І і II 7-хлор-N,N,5-триметил-4-оксо3-феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ацетаміду за винаходом, одержаних методом диференціальної скануючої калориметрії. Фіг.4 являє собою рентгенівську порошкову дифрактограму кристалічної форми II 7-хлорN,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду за даним винаходом. Фіг.5 являє собою рентгенівську порошкову дифрактограму кристалічної форми II 7-хлорN,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду за даним винаходом. Фіг.6 являє собою накладення рентгенівських порошкових дифрактограм кристалічної Форми І і кристалічної Форми II 7-хлор-N,N,5-триметил-4оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5b]індол-1-ацетаміду за даним винаходом. Фіг.7 являє собою накладення рентгенівських порошкових дифрактограм кристалічної Форми І і кристалічної Форми II 7-хлор-N,N,5-триметил-4оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5b]індол-1-ацетаміду за даним винаходом. На Фіг.8 показані результати тестування розчинності, де порівнюють розчинності/швидкості розчинення кристалічної Форми І і кристалічної Форми II 7-хлор-N,N,5-триметил-4-оксо-3-феніл3,5-дигідро-4Н-піридазино[4,5-b]індол-1-ацетаміду в суміші водний 0,25% лаурилсульфат натрію/0,01Μ фосфатний буфер (рН7). Фіг.9 являє собою накладення інфрачервоних спектрів кристалічної Форми II 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду за даним винаходом у напруженому стані і за відсутності напруження, одержаних на ІЧ спектрометрі з перетворенням Фур'є (FTIR). 91716 6 Визначення і скорочення Використовувані вище і по всьому опису винаходу нижченаведені скорочення, якщо не обумовлено інакше, потрібно розуміти як такі, що мають нижченаведене значення: А Ангстрем HPLC Високоефективна рідинна хроматографія ΝΜΡ N-метил-2-піролідинон RPM оборотів на хвилину Використовувані вище і по всьому опису винаходу нижченаведені скорочення, потрібно розуміти, якщо не обумовлено інакше, як такі, що мають нижченаведене значення: Термін "Форма І", що використовується в описі, призначений для опису кристалічної форми 7хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро4Н-піридазино[4,5-b]індол-1-ацетаміду, яку можна визначити, використовуючи описані в описі характеристики, які відрізняють її. Ілюстративні дані знаходяться на Фіг.2, 3 і/або 6. Термін "Форма ІІ", що використовується в описі, призначений для опису кристалічної форми 7хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро4Н-піридазино[4,5-b]індол-1-ацетаміду, яку можна визначити, використовуючи описані в описі характеристики, що відрізняють її. Ілюстративні дані знаходяться на Фіг.1, 2, 3, 4, 5 і/або 6. Здатність речовини знаходитися в декількох кристалічних формах називають поліморфізмом. Різні кристалічні форми певної речовини позначають як "поліморфні модифікації". Взагалі кажучи, на поліморфізм впливає здатність молекули речовини змінювати свою конформацію або вступати в різні міжмолекулярні або внутрішньомолекулярні взаємодії, зокрема, утворювати водневі зв'язки, що знаходить відображення в різному розташуванні атомів у кристалічних решітках різних поліморфних модифікацій. На протилежність цьому, загальна зовнішня форма речовини, відома як "морфологія", стосується зовнішньої конфігурації кристала і присутніх площин не стосуючись внутрішньої структури. Кристали можуть виявляти різну морфологію, базуючись на різних умовах, таких як, наприклад, швидкість збільшення, перемішування і присутність домішок. Різні поліморфні модифікації речовини можуть мати різні енергії кристалічної решітки. І, таким чином, у твердому стані вони можуть демонструвати різні фізичні властивості, такі як форму, щільність, точку плавлення, колір, стійкість, розчинність, швидкість розчинення і так далі. Це може, у свою чергу, впливати на стійкість, швидкість розчинення і/або біодоступність даного поліморфу і на його придатність для використання у ролі фармацевтичного препарату та у фармацевтичних композиціях. Кристалічна Форма II 7-хлор-N,N,5-триметил4-оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5b]індол-1-ацетаміду має ряд переваг перед Формою І. Наприклад, Форма II має кращу розчинність і вищу швидкість розчинення, ніж кристалічна Форма І. Широко відомо, що поліморфні форми, які мають велику розчинність і швидкість розчинення, звичайно є фізично менш стійкими, ніж поліморфи, 7 що мають менші розчинність і швидкості розчинення. Однак, кристалічна Форма II має дивну фізичну стійкість. Наприклад, Форма II не перетворюється в будь-яку іншу форму при зберіганні в нормальних умовах (кімнатна температура) або в нижченаведених напружених станах: при зберіганні протягом двох місяців у відкритому флаконі при відносній вологості 75% і при 50°С. Стійкість Форми II у таких умовах підтверджена даними 14 Фур'є-спектроскопії. Таким чином, даний винахід пропонує нову кристалічну форму 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду, яка має кращу розчинність, ніж відома раніше кристалічна форма І. У переважному аспекті, у винаході пропонують кристалічну Форму II 7-хлор-N,N,5-триметил-4оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5b]індол-1-ацетаміду, визначену в описі і, по суті, яка не містить будь-якої іншої поліморфної модифікації. У наступному переважному аспекті, кристалічна Форма II 7-хлop-N,N,5-триметил-4-оксо-3-феніл3,5-дигідро-4Н-піридазино[4,5-b]індол-1-ацетаміду, визначена в описі, по суті, вільна від домішок. Під терміном "по суті, вільна" мають на увазі, що кристалічна Форма II містить менше ніж 10%, переважно, менш ніж 5%, і, переважніше, менш ніж 2% будь-якої іншої поліморфної модифікації або домішки. Способи одержання кристалічної Форми II є наступним об'єктом даного винаходу. Кристалічна Форма II може бути одержана кристалізацією 7-хлор-N,N,5-триметил-4-оксо-3феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ацетаміду у відповідних умовах. За допомогою контролю умов кристалізації може бути одержана кристалічна Форма II, по суті, що не містить кристалічної Форми І. У більшості випадків, кристалічну Форму II можна одержати нагріванням 7-хлор-N,N,5-триметил4-оксо-3-феніл-3,5-дигідро-4Н-піридазино[4,5b]індол-1-ацетаміду в нижчому спирті, наприклад, метанолі або етанолі, при концентрації, що складає приблизно 1-4мг/мл, при достатній для розчинення температурі, наприклад, приблизно 45-60°С, відфільтровуванням будь-яких нерозчинних домішок, охолоджуванням фільтрату і потім випаровуванням розчинника потоком інертного газу, такого як азот, з утворенням твердої речовини. Альтернативно, кристалічну Форму II одержують за допомогою кристалізації 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду, розчиняючи сполуку в дихлорметані при концентрації, яка приблизно складає від 30мг/мл до приблизно 50мг/мл, додаючи розчин до етанолу, і концентруючи розчин шляхом зменшення об'єму на приблизно від 10%-40% за допомогою потоку інертного газу, такого як азот, щоб викликати осадження твердої речовини. Додатково, кристалічну Форму II одержують, розчиняючи 7-хлор-Ν,Ν,5-триметил-4-оксо-3феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ацетамід у дихлорметані при концентрації, приб 91716 8 лизно, від 20мг/мл до, приблизно, 50мг/мл, додаючи розчин до гексанів, щоб викликати осадження твердої речовини і відділяючи кристал шляхом фільтрування. Кристалічну Форму II також можна одержати, використовуючи іншу стандартну методику одержання кристалічних форм, відому фахівцям у даній галузі техніки, таку як кристалізація з надкритичного плинного середовища, наприклад, надкритичного двоокису вуглецю. Даний винахід також стосується фармацевтичної композиції, що містить кристалічну Форму II 7хлор-N,N,5-триметил-4-оксо-3-феніл-3,5-дигідро4Н-піридазино[4,5-b]індол-1-ацетаміду в комбінації з одним або декількома фармацевтично прийнятними наповнювачами. Переважні фармацевтичні композиції за винаходом включають у себе кристалічну Форму II 7-хлор-N,N,5-триметил-4-оксо-3феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ацетаміду, по суті, яка не містить кристалічну Форму І, у комбінації з одним або декількома фармацевтично прийнятними наповнювачами. У ще одному варіанті здійснення, даний винахід стосується лікарських форм, що містять описані в описі фармацевтичні композиції. Лікарські форми включають в себе, крім інших, лікарські форми, вибрані з групи, що складається з пілюль, капсул, каплет, таблеток, гранул, суспензій, мазей, лосьйонів, супозиторіїв і паст. Кожна доза повинна містити кількість лікарської речовини, розраховану таким чином, щоб зробити необхідний терапевтичний ефект. Як правило, фармацевтичні композиції будуть вводити в стандартних лікарських формах, що містять від, приблизно, 2мг до, приблизно, 2000мг лікарської речовини на масу композиції, із переважним інтервалом від приблизно 10мг до приблизно 1000мг. Фармацевтичні композиції за даним винаходом переважно, містять терапевтично ефективну кількість кристалічної лікарської речовини. Термін "терапевтично ефективна кількість", що використовується в описі, означає кількість лікарської речовини, присутньої у композиції, яка вводиться, що є достатньою для запобігання розвитку, або деякого полегшення, одного або декількох симптомів захворювання, яке піддають лікуванню. Аналогічно, "термін терапевтично ефективна кількість фармацевтичної композиції" означає кількість такої композиції, яка є достатньою для запобігання розвитку або деякого полегшення, одного або декількох симптомів захворювання, що піддають лікуванню. При встановленні ефективної кількості лікарського засобу або дози, лікуючий лікар враховує ряд факторів, які включають у себе, крім інших, вид ссавця, його розмір, вік і загальний стан здоров'я; конкретне захворювання, ступінь ураження хворобою або важкість захворювання, біологічну реакцію у відповідь даного пацієнта, шлях введення лікарського засобу, характеристики біодоступності введеного препарату, вибраний режим дозування, застосування супутнього медикаментозного лікування та інші привхідні обставини. Фармацевтичні композиції за даним винаходом містять один або декілька фармацевтично прийнятних наповнювачів, що звичайно викорис 9 товують у даній галузі. Такі наповнювачі можуть включати в себе одну або декілька наповнюючих речовин, розріджувачів, наприклад, мікрокристалічну целюлозу, лактозу, маніт, пептизований крохмаль і таке інше; дезінтегрувальних агентів, наприклад, натрійкрохмальгліколят, кросповідон, кроскармелоза-натрій і таке інше; мастильних речовин, наприклад, стеарат магнію, стеарилфумарат натрію і таке інше; підсолоджувачів, наприклад, сахарозу, сахарин і таке інше; ароматизуючих засобів, наприклад, перцеву м'яту, метилсаліцилат, цитрусову віддушку і таке інше; забарвлюючих речовин; консервантів; буферів; та інших наповнювачів, що залежать від шляху введення і стандартної форми лікарського засобу, що використовується. Як буде очевидно фахівцеві в даній галузі, фармацевтичні композиції за даним винаходом можуть бути введені разом з іншими терапевтичними і/або профілактичними засобами і/або лікарськими препаратами, які не є з ними терапевтично несумісними. Всі компоненти даних композицій повинні бути фармацевтично прийнятними. Термін "Фармацевтично прийнятний" компонент, що використовується в описі, позначає собою компонент, який є придатним для використання людьми і/або іншими тваринами за відсутності надмірних шкідливих побічних ефектів (таких як токсичність, подразнювальність і алергічні реакції), із розумно пропорційним співвідношенням користь, що приноситься/ризик. Композиції за даним винаходом, як правило, вводять звичайними шляхами, відомими в даній галузі техніки, пацієнтам, які, крім інших, є ссавцями, наприклад, людьми. Наприклад, композиції можуть бути введені пацієнтам орально, у вигляді, наприклад, твердої або м'якої желатинової капсули, таблетки, каплети, або суспензії; ректально або вагінально, наприклад у вигляді таблетки, супозиторію або вагінального супозиторію, пасти, мазі, лосьйону або суспензії; або локально, наприклад у вигляді пасти, мазі, лосьйону або суспензії. Даний винахід, крім того, стосується використання фармацевтичних композицій за винаходом у медицині. 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід має високу спорідненість до периферичних бензодіазепінових рецепторів. У цій якості він може бути використаний для запобігання або лікування периферичних невропатій різних типів, таких як невропатії, викликані травмою, або ішемічні невропатії, інфекційні невропатії, невропатії, пов'язані зі споживанням алкоголю або зі споживанням лікарських засобів, або спадкові невропатії, а також станів мотонейронів, таких як спінальні аміотрофії і бічний аміотрофічний склероз. 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід також можна використати для запобігання або лікування нейродегенеративних захворювань центральної нервової системи, як гострого типу, таких як цереброваскулярні розлади і черепні і мозкові травми, так і хронічного типу, такі як автоімунні захво 91716 10 рювання (розсіяний склероз), хвороба Альцгеймера, хвороба Паркінсона, а також будь-яке інше захворювання, при якому очікують на терапевтичний ефект при введенні нейротрофічних факторів. 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід також може бути використаний для запобігання або лікування гострої або хронічної ниркової недостатності, гломерулонефриту, діабетичної нефропатії, серцевої ішемії і серцевої недостатності, інфаркту міокарда, ішемії нижніх кінцівок, коронароспазму, стенокардії, патологічних станів, пов'язаних із серцевими клапанами, запальних серцевих захворювань, побічних ефектів, що викликаються кардіотоксичними лікарськими препаратами або наслідками серцевої хірургії, атеросклерозу і його тромбоемболічних ускладнень, рестенозу, відторгнення трансплантата, станів, пов'язаних із неправильною проліферацією або міграцією гладких міоцитів. 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід виявляє фармакологічну активність, модулюючи імунну відповідь при експериментальному ревматоїдному артриті у тварин, і тому також є застосовним для запобігання або лікуванню ревматоїдного артриту. Літературні дані показують, що периферичний бензодіазепіновий рецептор міг би грати фундаментальну роль при регулюванні клітинної проліферації і процесів канцерогенезу. У цілому та, у порівнянні з нормальними тканинами, для різних типів раку і пухлин спостерігають підвищену густину периферичних бензодіазепінових рецепторів. Тому, 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід також може бути використаний для запобігання або лікування пухлин і різних видів раку. Периферичні бензодіазепінові рецептори також знаходяться в шкірі. Внаслідок цього, 7-хлорN,N,5-триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетамід може бути використаний для профілактики або лікування стресових станів у ділянці шкіри. Вираз "стресовий стан у ділянці шкіри" розуміють як такий, що означає різні ситуації, які могли б викликати пошкодження, зокрема, в епідермісі, незалежно від агента, що викликає цей стрес. Цей агент, як, наприклад, хімічний або вільно-радикальний агент, може знаходитися всередині організму або поза ним, або ж це такий зовнішній агент, як ультрафіолетове випромінювання. Тому, даний винахід стосується способу лікування і/або запобігання захворюванням, пов'язаних із порушенням функцій периферичних бензодіазепінових рецепторів. Спосіб включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. В одному варіанті здійснення, даний винахід стосується способу лікування або запобігання нейродегенеративному захворюванню, який включає введення пацієнту, що потребує такого ліку 11 вання або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. Ще один варіант здійснення даного винаходу являє собою спосіб лікування або запобігання невропатії, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. У ще одному варіанті здійснення, даний винахід стосується способу лікування або запобігання раку або пухлинам, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. Ще один варіант здійснення винаходу являє собою спосіб лікування або запобігання шкірним стресам, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. Переважний варіант здійснення винаходу являє собою спосіб лікування або запобігання ревматоїдного артриту, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. Ще один переважний варіант здійснення винаходу являє собою спосіб лікування або запобігання серцевому захворюванню або порушенню серцевої діяльності, який включає введення пацієнту, що потребує такого лікування або запобігання захворюванню, терапевтично ефективної кількості кристалічної Форми II за винаходом або терапевтично ефективної кількості фармацевтичної композиції за даним винаходом. Предметом даного винаходу є використання кристалічної Форми II за винаходом при одержанні лікувальних продуктів для лікування захворювань, що залежать від периферичних бензодіазепінових рецепторів, таких як нейродегенеративні захворювання, невропатії, рак або пухлини, стресові стани в ділянці шкіри, ревматоїдний артрит або серцеві захворювання або порушення серцевої діяльності. Далі винахід буде проілюстрований на нижченаведених прикладах без обмеження, однак, обсягу винаходу. Вихідна речовина 7-хлор-N,N,5триметил-4-оксо-3-феніл-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-ацетаміду, яка є застосовною в описаних методиках, включає в себе, крім інших, 7-хлор-N,N,5-триметил-4-оксо-3феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ацетамід, що одержується за методиками, описаними в патенті СІЛА No.6395729. Згідно з процедурами, описаними в описі, як вихідний матеріал для одержання Форми II, може бути використана 91716 12 будь-яка форма 7-хлор-N,N,5-триметил-4-оксо-3феніл-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ацетаміду. У деяких прикладах, таких, які використовуються для промислового синтезу, може виявитися корисним вносити в процесі одержання кристал-затравку форми II. Приклад 1 Одержання кристалічної Форми І 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід (230г) розчиняли в N-метил-2-піролідоні (920мл) при 110°С. До розчину додавали теплий етанол (2,5л, 65°С), і тверду речовину відділяли шляхом фільтрування при 15°С і промивали етанолом. Інфрачервоні спектри кристалічної Форми І, що одержується, по суті, за цією методикою можна знайти на Фіг.2. Рентгенівську порошкову дифрактограму можна знайти на Фіг.6. Приклад 2 Одержання кристалічної Форми II Спосіб А 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід розчиняли в метанолі при концентрації 4мг/мл при, приблизно, 54°С. Розчин фільтрували гарячим, і розчинник видаляли випаровуванням, у потоці азоту, таким чином відділяючи тверду речовину. Мікроскопія гарячої фази показала феномен плавлення/перетворення при температурі, що складає приблизно 210°С. На Фіг.1 (спосіб А) наведений ІЧ спектр зразка, по суті, одержаного за цією методикою. Приклад 3 Одержання кристалічної Форми II Спосіб В 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід (1г) розчиняли при кімнатній температурі в 20мл дихлорметану (DCM). При кімнатній температурі цей розчин додавали до етанолу (70мл). Газоподібний азот використовували для концентрування розчину, з утворенням осаду, зменшуючи обсяг орієнтовно на 25%. Осад відділяли фільтруванням протягом, приблизно, 15-30 хвилин. На Фіг.1 (спосіб В) наведений ІЧ спектр зразка, по суті, одержаного за цією методикою. На Фіг.4 наведена XRPD (порошкова рентгенограма) зразка, по суті, одержаного за цією методикою. Приклад 4 Одержання кристалічної Форми II Спосіб С 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетамід (2,4г) розчиняли в дихлорметані (60мл) при кімнатній температурі, використовуючи лопатеву мішалку. Цей розчин повільно додавали до гексанів (400мл, хроматографічна ступінь чистоти) при кімнатній температурі і перемішуванні. Утворений осад негайно, фільтрували після, приблизно, 5 хвилин. На Фіг.1 (спосіб С) представлений ІЧ спектр зразка, по суті, одержаного за цією методикою. На Фіг.5 представлена порошкова рентгенограма (XRPD) зразка, по суті, що одержується за цією методикою. 13 Представлені на Фіг.1 ділянки ІЧ спектрів кристалічних продуктів, одержаних аналогічно до описаних в прикладах 2-4, є сумісними, що, вказує на те, що ці зразки стосуються однієї і тієї самої кристалічної форми. Досліди, описані нижче, здійснювали на кристалічних продуктах, що одержуються, по суті, за методиками, описаними в прикладах 1-4. Експериментальна частина Інфрачервона спектроскопія з Фур'єперетворенням (FTIR) ІЧ спектри одержували на системі Фур'єспектрометра марки Nicolet750 Magna. Для аналізу лікарську речовину подрібнювали разом із сухим бромідом калію (KВr) при концентрації 1мг лікарської речовини/200мг KВr, і при навантаженні в 10000 фунтів (lbs) пресували диск (200мг). Як випливає з FTIR спектрів (див. Фіг.2), Форма II 7-хлор-N,N,5-триметил-4-оксо-3-феніл-3,5дигідро-4Н-піридазино[4,5-b]індол-1-ацетаміду має піки розмірами 1656, 1643-1644, 1595, 1522, 1489, 1454, 1397, 1325 і 1282см-1. Зокрема, піки розміром близько 1656 і 1643-1644см-1 є характеристичними для Форми II. Порівняння ІЧ спектрів (Фіг.2) кристалічної Форми І і кристалічної Форми II показує дві різні структури. Зокрема, амідна ділянка в спектрі Форми II демонструє характеристичні піки, що однозначно визначаються близько приблизно 1643-1644см-1 і близько 1656см-1, які відсутні в спектрі Форми І. І додатково, смугу форми І приблизно близько -1 1307см не спостерігають у спектрі будь-якого із зразків форми II, описаних вище. Диференціальна скануюча калориметрія (ДСК) Скани ДСК одержували, використовуючи калориметр для диференціальної скануючої калориметрії марки Perkin Elmer DSK-7. Перед використанням систему калібрували за індієм і оловом. Зразки герметизували в алюмінієвих тиглях (затвори з маленьким крапковими отворами). ДСК термограму одержували при лінійній швидкості нагрівання, що становить 10°С на хвилину. ДСК скан для Форми І (Фіг.3, верхня крива) виявляє ендотермічний пік приблизно близько 228°С-23 5°С, який відповідає точці плавлення Форми І ДСК скан для Форми II (Фіг.3, нижня крива) виявляє перетворення (крива екзотермічного перетворення) у більш тугоплавку кристалічну форму на інтервалі температур 200°С-220°С, із подальшим ендотермічним плавленням, що відповідає точці плавлення Форми І. Форма ДСК термограми в ділянці температур, що відповідає процесу перетворення, ймовірно, залежить від швидкості нагрівання, розміру частинок і маси зразка. Рентгенівська порошкова дифрактометрія (XRPD) 91716 14 XRPD дифрактограми одержували на рентгенівському порошковому дифрактометрі марки Bruker D8® ADVANCE, використовуючи мідне випромінювання K-альфа. Прилад був обладнаний паралельно-променевою оптикою, а напругу і силу струму в трубці встановлювали на 40кВ і 40мА, відповідно. Дослідження зразків здійснювали при швидкості сканування 1,0 градус/хвилину при зміні кута 2-тета від 2 до 40 градусів. На Фіг.4 і Фіг.5 показані ідентичні XRPD дифрактограми, одержані для різних зразків форми II, а на Фіг.6 наведене порівняння XRPD дифрактограми форми II, і XRPD дифрактограми форми І. На дифрактограмі форми II виявляють оригінальну структуру, у порівнянні з формою І. На дифрактограмі форми II спостерігають характеристичний пік близько 5,71 градусів (2 тета), який, однак, відсутній на дифрактограмі форми І. Відсутність піка близько приблизно 10,79 градусів (Фіг.7), характеристичного піка для форми І, показує, що рівні, значущі для Форми І не виявлені на дифрактограмі форми II. Фахівець у даній галузі техніки зрозуміє, що положення піків можуть трохи залежати від висоти зразка. Таким чином, описані тут положення піків, залежать від зміни кута 2-тета на плюс або мінус (+/-) 0,15 градусів. Відносна інтенсивність може змінюватися, залежно від розміру і морфології кристала. У таблиці 1 наведені положення характеристичних піків, відстані d і відносна інтенсивність для порошкової рентгенівської дифрактограми кристалічної Форми II. Таблиця 1 Положення і відносні інтенсивності характеристичних піків на XRPD Форми II Кут Форма II Відносна інГрадуси 2θ Величина відстаней d тенсивність +/-0,15° 2θ (Ангстрем) (%) 19,21 4,6 9,3 18,43 4,8 14 15,95 5,6 7,3 11,97 7,4 8,2 11,47 7,7 23,8 9,97 8,9 18,2 5,71 15,5 100 Зокрема, піки (виражені в градусах 2-тета +/0,15 градусів 2-тета) близько 11,47; 9,97, і 5,71 є характеристичними для Форми II. У таблиці II наведені положення характеристичних піків, відстані d і відносна інтенсивність на порошковій рентгенівській дифрактограмі кристалічної Форми І. 15 91716 Таблиця 2 Положення і відносна інтенсивність характеристичних піків на XRPD Форми І Кут Форма І Відносна інГрадуси 2θ Величина відстаней d тенсивність +/-0,15° 2θ (Ангстрем) (%) 18,05 4,9 23,1 16,67 5,3 24,8 16,00 5,5 25,8 15,79 5,6 25,3 13,36 6,6 31,1 10,79 8,2 24,8 7,85 11,2 100 Тест на Розчинення Тести на розчинення кристалічної Форми І і кристалічної Форми II проводили, використовуючи ванну (що одержують від фірми Distek Inc.) для розчинення з перемішуванням лікарських засобів, при швидкості обертання мішалки 75об./хв. і спектрофотометр HP 8453 UV, на довжині хвилі 320нм. Були використані нижченаведені параметри: концентрація лікарської речовини становила 40мг/л середовища; середовищем, що розчиняє, була суміш 0,25% лаурилсульфат натрію/0,01М фосфатний буфер (рН7), температура дорівнювала 37°С і час відбирання проб становив 10 хвилин. Стан 16 дартні зразки одержували, розчиняючи матковий розчин у метанолі (0,25мг/мл) із середовищем, що розчиняє. Тестування результатів розчинення, наведене на Фіг.8, показує, що кристалічна Форма II має кращу розчинність/розчинення у водній суміші 0,25% лаурилсульфат натрію/фосфатний буфер. Тестування стійкості Зразки Форми II зберігали при 50°С/75% відносній вологості (відкритий скляний флакон), щоб встановити, чи будуть спостерігатися поліморфні зміни. Зразки аналізували через 2 місяці. Вологість випробувальної камери регулювали за допомогою насиченого водного розчину хлориду натрію. На FTIR спектрах (Фіг.9) зразка Форми II після знаходження протягом двох місяців при 50°С/75% відносній вологості (умови напруження) не спостерігають змін, які вказують на перетворення у форму І. У спектрі зразка, що знаходиться в умовах екстремального напруження, немає доказів перетворення в Форму І; характеристична смуга поглинання Форми І близько 1307см-1 (показана на Фіг.2) не з'являється. Ці результати вказують на те, що немає істотної відмінності між зразками, що знаходяться в умовах напруження, і ненапруженими (вихідними) зразками. 17 91716 18 19 91716 20 21 91716 22 23 Комп’ютерна верстка Т. Чепелева 91716 Підписне 24 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel crystalline form of a pyridazino [4 , 5-b] indole derivative
Автори англійськоюRocco William L., Higgins John D.
Назва патенту російськоюНовая кристаллическая форма производного пиридазино[4,5-b]индола
Автори російськоюРокко Уилльям Л., Хиггинс Джон Д.
МПК / Мітки
МПК: A61P 9/04, A61P 35/04, A61K 31/5025, A61P 25/02, A61P 25/28, C07D 487/04, A61P 11/06
Мітки: нова, кристалічна, форма, похідного, піридазино[4,5-b]індолу
Код посилання
<a href="https://ua.patents.su/12-91716-nova-kristalichna-forma-pokhidnogo-piridazino45-bindolu.html" target="_blank" rel="follow" title="База патентів України">Нова кристалічна форма похідного піридазино[4,5-b]індолу</a>
Попередній патент: Пристрій поштучної подачі насіння
Випадковий патент: Мікрокластерний маршрутизатор












