Композиція для одноразового інтраназального введення, яка містить віросоми грипу, утворені з реконструйованих оболонок зазначеного вірусу, застосування зазначених віросом, вакцина, яка містить зазначену компози
Номер патенту: 93236
Опубліковано: 25.01.2011
Автори: Керстен Александер Й., Шон Пітер Й., Наута Йозеф Й.П., ван Райнек Люссіус Дорін Х., Герез Лісія
Формула / Реферат
1. Композиція для одноразового інтраназального введення людині, здатна спричинювати системну та/або локальну імунну реакцію проти антигенів грипу - гемаглютиніну та/або нейрамінідази або їх похідних, яка містить віросоми грипу, утворені з реконструйованих оболонок зазначеного вірусу, у якій:
• оболонки вірусу повністю походять з частинок вірусу грипу,
• додаток ліпідів із зовнішніх джерел до реконструйованих віросом відсутній,
• віросоми являють собою гемаглютинін та/або нейрамінідазу грипу або їх похідні,
• доза гемаглютиніну на штам грипу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 30 мкг,
яка відрізняється тим, що позбавлена окремих ад'ювантів та/або імуностимуляторів.
2. Композиція за п. 1, у якій одноразове інтраназальне або інгаляційне введення вакцини також спроможне викликати цитотоксичну реакцію лімфоцитів.
3. Композиція за п. 1 або 2, у якій імунна реакція відповідає критеріям СНМР для вакцини проти грипу.
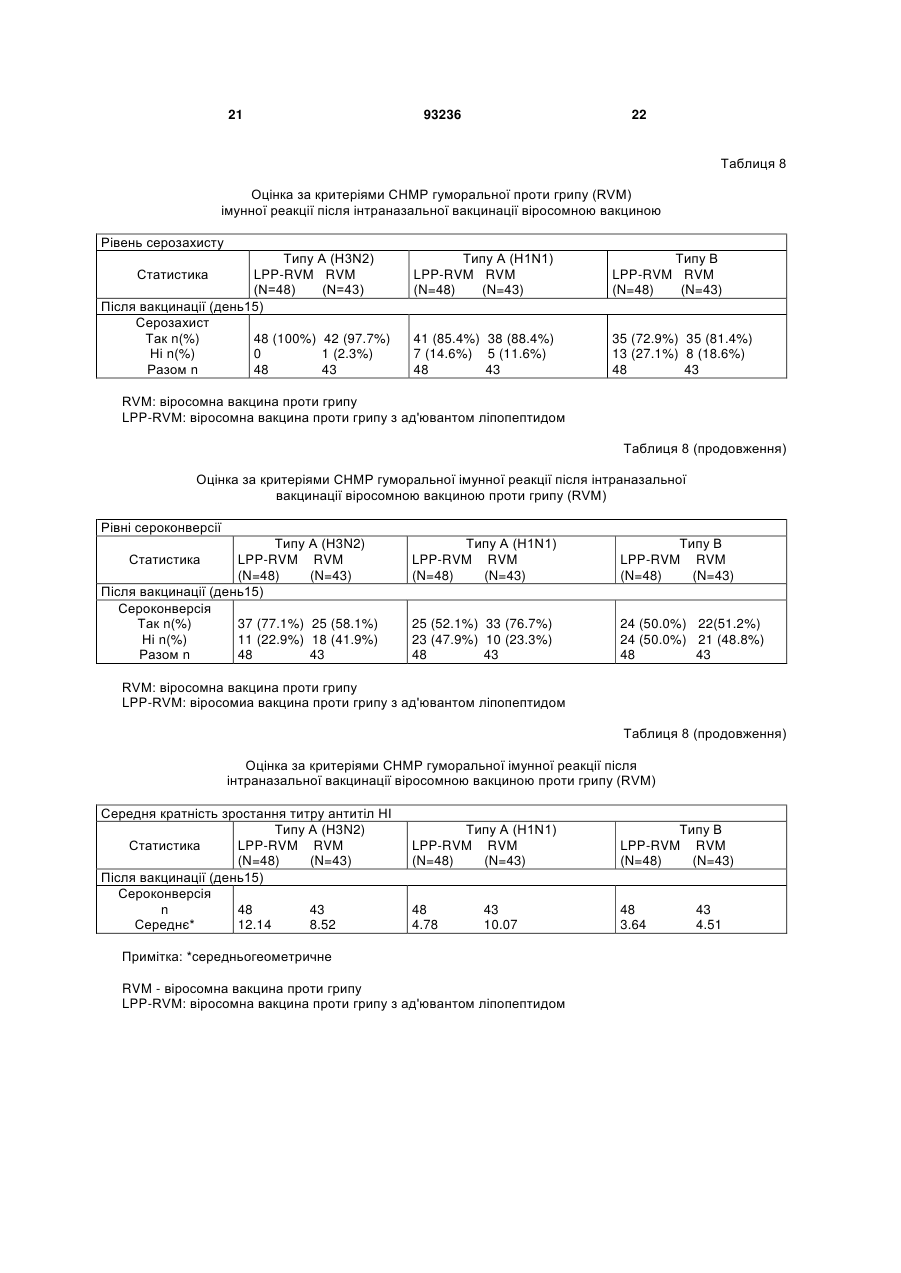
4. Композиція за п. 3, у якій імунна реакція забезпечує принаймні один з показників рівня серозахисту >70 % для дорослих та/або >60 % для літніх, рівня сероконверсії >40 % для дорослих та/або >30 % для літніх, середньої кратності зростання >2,5 для дорослих та/або >2,0 для літніх.
5. Композиція за будь-яким з пп. 1-4, у якій доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 25 мкг.
6. Композиція за будь-яким з пп. 1-4, у якій доза гемаглютиніну на штам вірусу з одиничній інтраназальній або інгаляційній дозі дорівнює або менша 20 мкг.
7. Композиція за будь-яким з пп. 1-4, у якій доза гемаглютініну на штам вірусу в одиничній інтраназальній або інгаляційній дозі менша або дорівнює 15 мкг.
8. Композиція за будь-яким з пп. 1-4, у якій доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі менша або дорівнює 10 мкг.
9. Композиція за будь-яким з пп. 1-4, у якій доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі менша або дорівнює 5 мкг.
10. Застосування віросом грипу, утворених з реконструйованих оболонок зазначених вірусів, для виготовлення композиції для одноразового інтраназального введення людині, здатної спричинювати системну та/або локальну імунну реакцію проти антигенів грипу - гемаглютиніну та/або нейрамінідази або їх похідних, яка містить віросоми грипу, утворені з реконструйованих оболонок зазначеного вірусу, у якій:
• оболонки вірусу повністю походять з частинок вірусу грипу,
• додаток ліпідів із зовнішніх джерел до реконструйованих віросом відсутній,
• віросоми являють собою гемаглютинін та/або нейрамінідазу грипу або їх похідні,
• доза гемаглютиніну на штам грипу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 30 мкг,
яка позбавлена окремих ад'ювантів та/або імуностимуляторів.
11. Застосування за п. 10, у якому одноразове інтраназальне або інгаляційне введення вакцини також спроможне викликати цитотоксичну реакцію лімфоцитів.
12. Застосування за п. 10 або 11, у якому імунна реакція відповідає критеріям СНМР для вакцини проти грипу.
13. Застосування за п. 12, у якому імунна реакція забезпечує один або більше з показників рівня серозахисту >70 % для дорослих та/або > 60 % для літніх, рівня сероконверсії > 40 % для дорослих та/або > 30 % для літніх, середньої кратності зростання > 2,5 для дорослих та/або > 2,0 для літніх.
14. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютініну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 25 мкг.
15. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 20 мкг.
16. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 15 мкг.
17. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 10 мкг.
18. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 5 мкг.
19. Застосування за будь-яким з пп. 10-18, у якому виготовлена композиція являє собою вакцину.
20. Вакцина, яка містить композицію за будь-яким з пп. 1-9.
21. Засіб для інтраназального або інгаляційного введення, який містить вакцину за п. 20 та механізм для приведення вакцини у форму аерозолю.
22. Засіб за п. 21, який містить дозу вакцини для одиничного інтраназального або інгаляційного введення.
23. Засіб за будь-яким з пп. 21, 22, який є одноразовим.
Текст
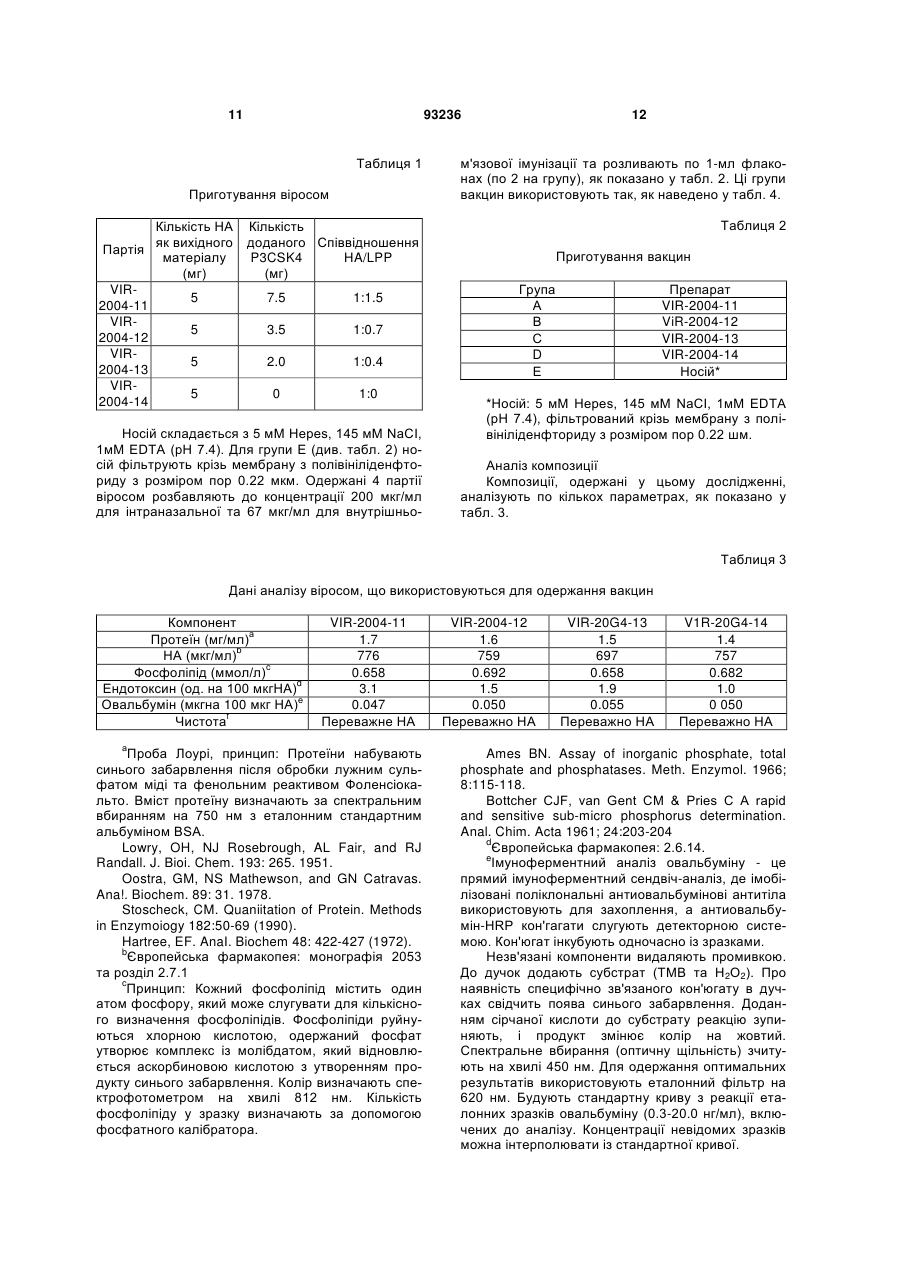
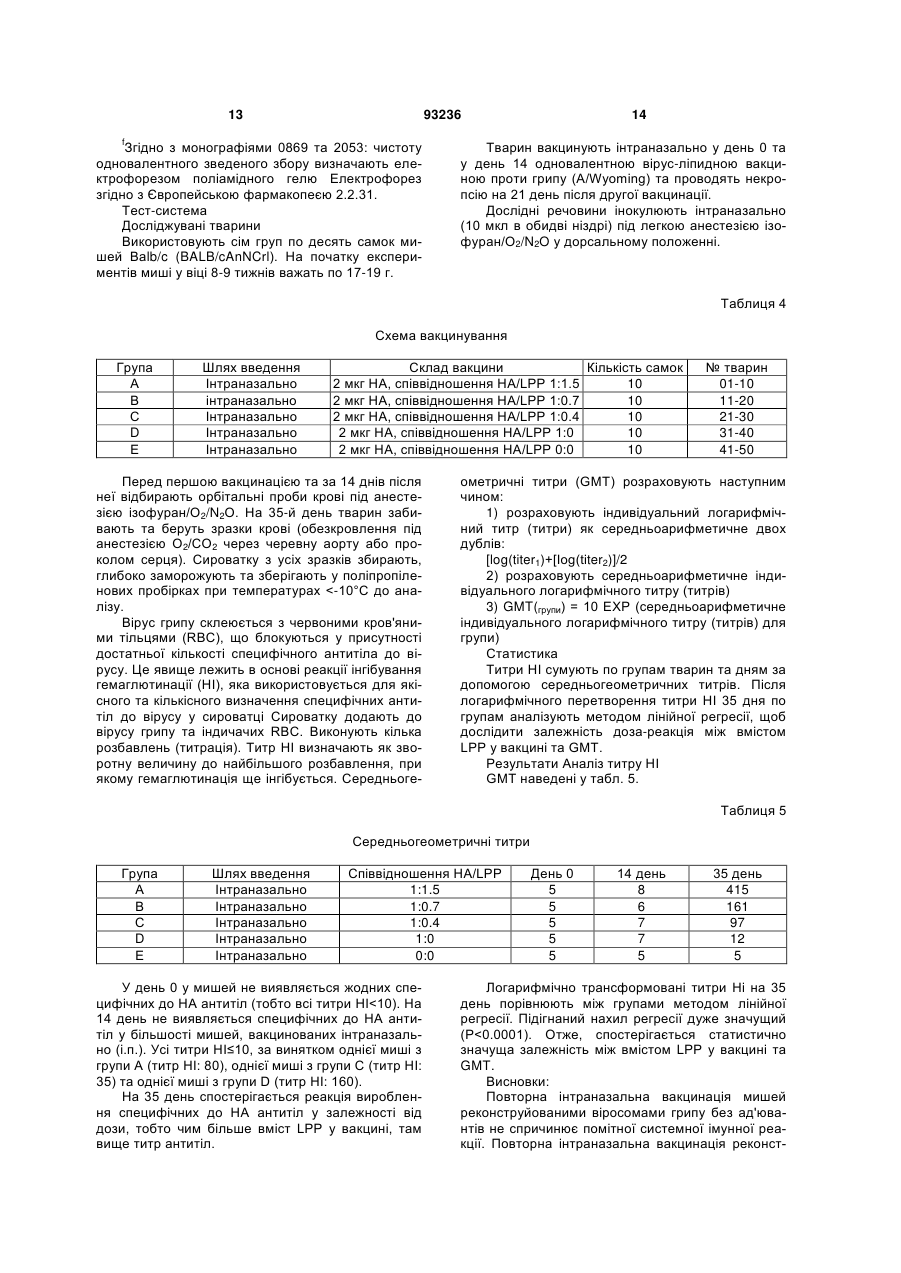
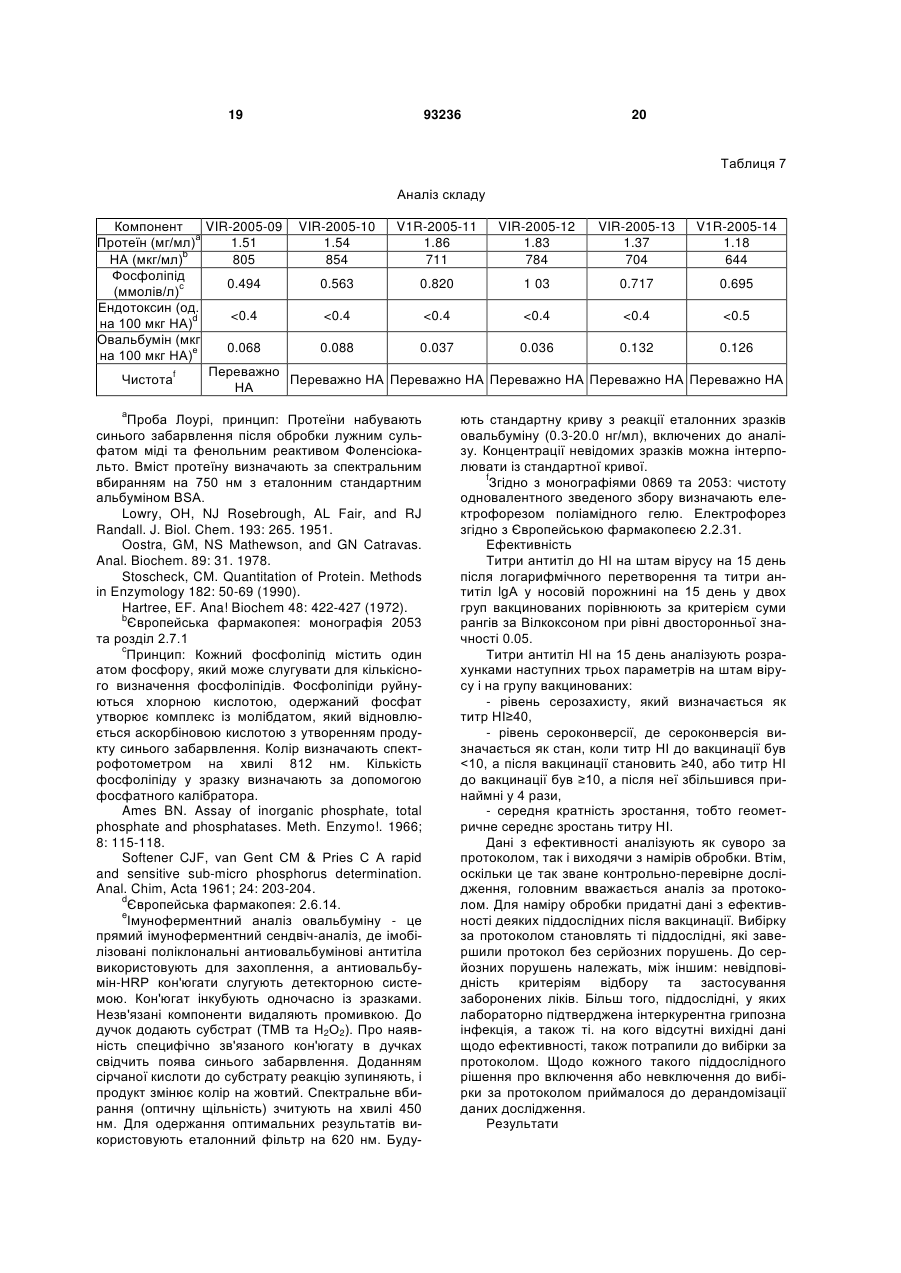
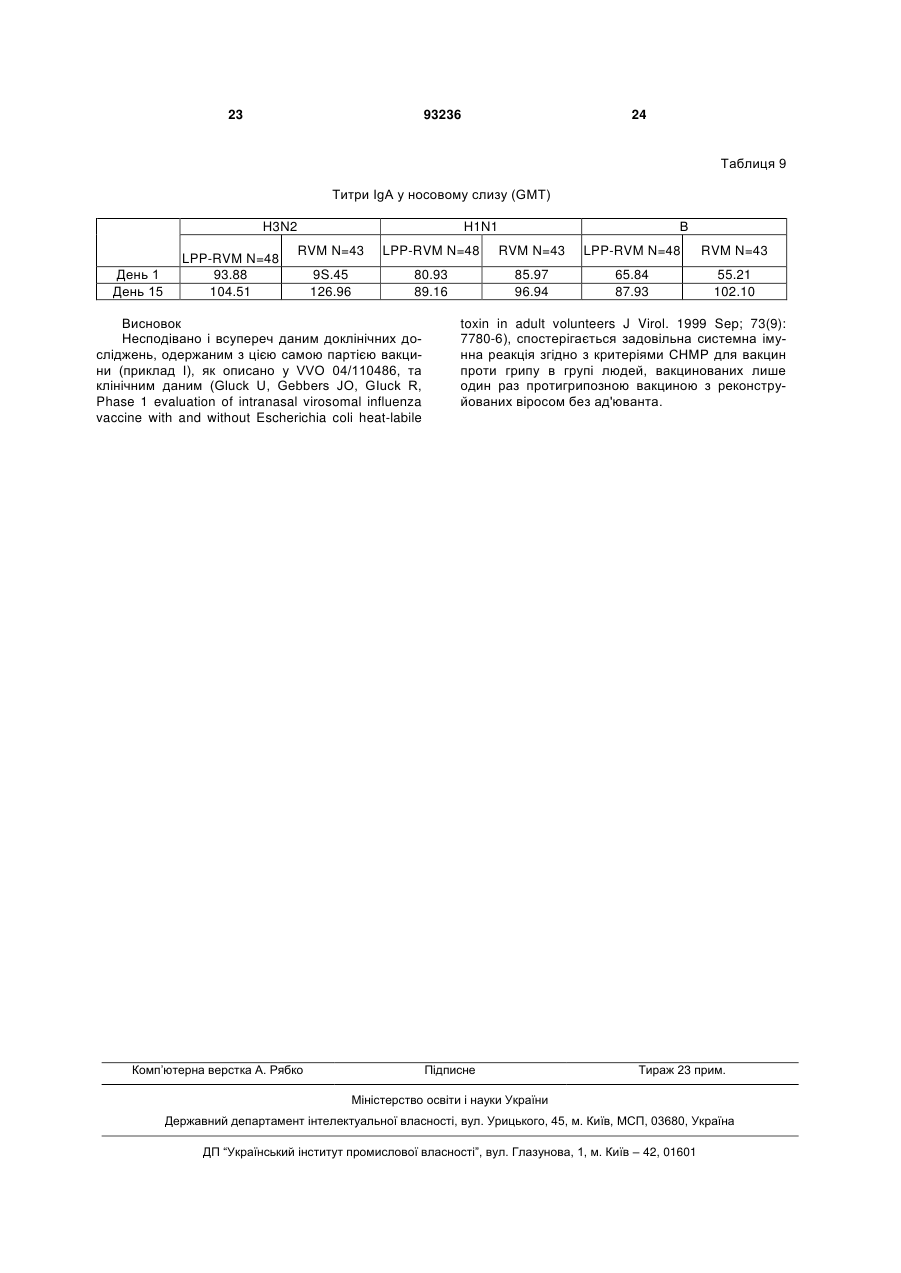
1. Композиція для одноразового інтраназального введення людині, здатна спричинювати системну та/або локальну імунну реакцію проти антигенів грипу - гемаглютиніну та/або нейрамінідази або їх похідних, яка містить віросоми грипу, утворені з реконструйованих оболонок зазначеного вірусу, у якій: • оболонки вірусу повністю походять з частинок вірусу грипу, • додаток ліпідів із зовнішніх джерел до реконструйованих віросом відсутній, • віросоми являють собою гемаглютинін та/або нейрамінідазу грипу або їх похідні, • доза гемаглютиніну на штам грипу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 30 мкг, яка відрізняється тим, що позбавлена окремих ад'ювантів та/або імуностимуляторів. 2. Композиція за п. 1, у якій одноразове інтраназальне або інгаляційне введення вакцини також 2 (19) 1 3 93236 4 • віросоми являють собою гемаглютинін та/або нейрамінідазу грипу або їх похідні, • доза гемаглютиніну на штам грипу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 30 мкг, яка позбавлена окремих ад'ювантів та/або імуностимуляторів. 11. Застосування за п. 10, у якому одноразове інтраназальне або інгаляційне введення вакцини також спроможне викликати цитотоксичну реакцію лімфоцитів. 12. Застосування за п. 10 або 11, у якому імунна реакція відповідає критеріям СНМР для вакцини проти грипу. 13. Застосування за п. 12, у якому імунна реакція забезпечує один або більше з показників рівня серозахисту >70 % для дорослих та/або > 60 % для літніх, рівня сероконверсії > 40 % для дорослих та/або > 30 % для літніх, середньої кратності зростання > 2,5 для дорослих та/або > 2,0 для літніх. 14. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 25 мкг. 15. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 20 мкг. 16. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 15 мкг. 17. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 10 мкг. 18. Застосування за будь-яким з пп. 10-13, у якому доза гемаглютиніну на штам вірусу в одиничній інтраназальній або інгаляційній дозі дорівнює або менша 5 мкг. 19. Застосування за будь-яким з пп. 10-18, у якому виготовлена композиція являє собою вакцину. 20. Вакцина, яка містить композицію за будь-яким з пп. 1-9. 21. Засіб для інтраназального або інгаляційного введення, який містить вакцину за п. 20 та механізм для приведення вакцини у форму аерозолю. 22. Засіб за п. 21, який містить дозу вакцини для одиничного інтраназального або інгаляційного введення. 23. Засіб за будь-яким з пп. 21, 22, який є одноразовим. Цей винахід стосується, наприклад, композицій для інактивованих вакцин проти грипу та шляхів введення, де одинична інтраназально або інгаляційно введена доза спричинює системну імунну реакцію, яка позитивно корелює з клінічним захистом. Випробувалися різні варіанти імунізації проти грипу назальним або орофарінгальним шляхом з використанням інактивованого антигену грипу як альтернатива підшкірній або внутрішньом'язовій імунізації шляхом уколу. Експериментальні моделі на тваринах свідчать на користь безукольних підходів. Концепції з використанням інактивованого антигену грипу (наприклад, хімічно інактивованих цілих частинок вірусу або підданих подальшій обробці компонентів вірусу - розщепленого вірусу або очищених поверхневих антигенів гемаглютинину (НА) та/або нейрамінідази (NA) для імунізації інтраназальним шляхом, випробувані на тваринах, передбачають або застосування ад'юванта чи імуностимулятора у сполученні з інактивованим антигеном грипу, або багаторазову вакцинацію. Ад'ювант - це буДь-яка речовина, яка у суміші з антигенами підсилює їх імуногенність. Що стосується людей, відомості про успішну імунізацію проти грипу інтраназальним шляхом є дуже нечисленні; (а) живі (адаптовані на холоду штами) вакцини проти грипу (FluMist™ фірми Medlmmune Vaccines Inc) (джерела 1, 2, 3), (b) вірус-ліпосомні вакцини проти грипу з ад'ювантом - термолабільна/ токсином E.coli (NasalFlu фірми Berna Biotech Ltd) (джерело 4) або (с) введення зеликих доз антигену з повторною вакцинацією (джерела 5, 10, 11). Хоча живі вакцини здатні викликати належну імунну реакцію, їх специфічна особливість - наяв ність живого вірусу - робить сумнівною їх безпечність і може спричинювати небажані бічні ефекти внаслідок неминучої реплікації вірусів у верхніх дихальних шляхах. Крім того, жорсткі вимоги до умов зберігання обмежують поширення цих продуктів. Безсумнівний зв'язок між інтраназальним введенням вакцини проти грипу з ад'ювантом термолабільним токсином Е.соІі та паралічем обличчя (периферійним паралічем лицьового нерву) вимусив відмовитися від вірус-ліпосомної вакцини проти грипу з ад'ювантом - термолабільним токсином (джерело 6). Ефективність вакцин проти грипу у даній популяції можна оцінювати, визначаючи параметри імуногенності на фоні кількості антитіл проти грипу, що виробляються після вакцинації. Ці параметри імуногенності, так звані критерії СНМР, використовуються при щорічному ліцензуванні інактивованих вакцин проти грипу (джерело 7). Станом на сьогодні немає даних про будь-яку успішну імунізацію людей проти грипу з дотриманням цих імунологічних вимог або критеріїв СНМР (джерело 7) при одноразовому інтраназальному введенні інактизованої вакцини без додання ад'юванта, тобто додаткового компоненту вакцини, який не одержаний з інфекційного агента, проти якого вакцина спрямована, а введений до її складу з метою підсилення імунної реакції на антиген. Отже, існує потреба у створенні композиції інактивованої вакцини проти грипу, здатної викликати задовільну системну реакцію після одноразового інтраназального введення, без вмісту ад'юванта та такої, що відповідала б критеріям СНМР (джерело 7) після такого одноразового введення. 5 Зазначені критерії СНМР визначаються наступним чином. У документі СНМР (Комітету з медичних продуктів для людського вжитку) Вказівки про узгодження вимог до вакцин проти грипу наводяться наступні серологічні параметри для оцінки імуногенності інактивованих вакцин проти грипу: - рівень серозахисту, який визначається як титр інгібування гемаглютинації (НІ) ≥ 40, - рівень сероконверсії, де сероконвєрсія визначається як стан, коли титр НІ до вакцинації був 70% > 60% рівень сероконверсії: > 40% > 30% середня кратність зростан> 2.5 > 2.0 ня: Винахід також стосується і дітей, у яких, як показано, імунологічна реакція подібна до дорослих (джерело 8), і літніх людей понад 60 років. Несподівано, всупереч даним про доклінічні дослідження на тваринах та даним клінічного досвіду щодо людей з літератури, нами було встановлено, що імунна реакція у людей після одноразового інтраназального введення інактивованої вакцини проти грипу, що являє собою реконструйовані оболонки клітин вірусу, відповідає усім трьом критеріям СНМР щодо ефективності вакцини проти грипу для вікової групи 18-60 років. Один прийом вакцини (інтраназальним, інгаляційним, оральним, підшкірним або внутрішньом'язовим шляхом) зазвичай є відомою схемою вакцинації, яка не враховує кількох повторних прийомів з інтервалами у кілька днів або тижнів; фахівці називають ці операції "приміювання" та "бустінг". Композиція для інтраназального або інгаляційного введення являє собою суміш однієї або кількох діючих речовин та наповнювачів, які забезпечують введення інтраназальним або інгаляційним шляхом. Цей винахід пропонує спосіб спричинення системної імунної реакції (циркулюючих імуноглобулінів або В-клітин, що виробляють антитіла), яка відповідає критеріям СНМР, переважно шляхом одного інтраназального або інгаляційного прийому вірус-ліпосомної вакцини проти грипу. Також пропонується спосіб спричинення локальної або слизової імунної реакції, що полягає у підвищенні рівня секреторних імуноглобулінів, відомих як ІgА, на поверхні слизових мембран, переважно шляхом одного інтраназального або інгаляційного прийому вірус-ліпосомної вакцини проти грипу. Спричинення специфічних реакцій IgG та ІgА після інтраназального введення пов'язане з активізацією лімфоїдної тканини у носовій порожнині (джерело 12). Ця тканина зветься носовою лімфоїдною тканиною 93236 6 (NALT) і є також відома як слизовий індуктивний сайт для клітинних імунних реакцій (джерело 13). Оскільки відомо, що віросоми здатні провокувати клітинні імунні реакції (джерела 14, 15), цей винахід також пропонує спосіб індукування специфічних цитотоксичних лімфоцитів (CTL). Віросоми - це ліпідні бішари, що містять вірусні глікопротеїни. Віросоми звичайно добувають екстракцією мембранних протеїнів та ліпідів з вірусів, які мають оболонку, за допомогою мийного засобу, після чого відновлюють характеристичні бішари видаленням цього засобу. Цей винахід також пропонує відновлені оболонки вірусу грипу (зокрема, відновлені без подальшого додання ліпідів і без додання імуномодулятора або імуностимулятора так званого ад'юванта) для застосування при вакцинації шляхом введення аерозолю до слизової оболонки носоглотки чи ротоглотки через одну або обидві ніздрі, щоб створити системний та локальний імунітет проти грипу. Можливе також одноразове введення шляхом інгаляції або нанесення на слизову оболонку ротової порожнини. Відновлені віросоми грипу можна виготовляти з інактивованого вірусу, який можна солюбілізувати недіалізуємим мийним засобом, котрий потім видаляють адсорбцією на гідрофобних гранулах. Препарат може являти собою очищену суспензію одного або кількох антигенів грипу, обраних зпоміж гемаглютинину (НА), нейрамінідази (NA), похідного гемаглютинину та похідного нейрамінідази. Протеїни вірусної мембрани гемаглютинин та нейрамінідазу можна відновити у мембрані, що складається з вірусних ліпідів з малим вмістом ендотоксину та овальбуміну (див. джерело 9). Похідні гемаглютинину та/або нейрамінідази - це молекули гемаглютинину та/або нейрамінідази з модифікованими послідовностями амінокислот та/або структурами. Наприклад, амінокислоти можна виключати з послідовностей, змінювати або додавати до них. Можна також змінювати схеми глікозилювання. Похідні зберігають здатність викликати імунну реакцію при потраплянні до організму реципієнта. Вірус грипу, з якого виробляють відновлені віросоми, можна вирощувати, наприклад, на курячих яйцях з зародками або у культурі клітин на адгезивних клітинах або клітинах у суспензії. Вірус може бути природним, або гібридним, або генетично модифікованим штамом. Це може, наприклад, бути будь-який штам підтипу А чи В вірусу грипу, в тому числі пандемічний. Винахід також пропонує вакцини. Під вакциною мається на увазі імуноактивний фармацевтичний препарат. У деяких варіантах вакцини можуть являти собою нешкідливі варіанти або похідні патогенних мікроорганізмів, які, наприклад, стимулюють імунну систему опиратися появі даного патогену. У деяких варінатах вакцина, наприклад, створює адаптивний імунітет при введенні до організму реципієнта. Вакцина може містити вбиту або послаблену форму патогену або компонент патогену, як от антигенний компонент патогену. Препарат вакцини може також містити фармацевтичний носій, пристосований до конкретного шляху введення вакцини, наприклад, інтраназального 7 або інгаляційного введення. Вакцина проти грипу може містити один або кілька неденатурованих антигенів грипу, здатних викликати специфічну імунну реакцію на грип. Цей винахід пропонує композицію, яка містить віросоми грипу, що являють собою відновлені оболонки зазначеного вірусу, призначену для інтраназального або інгаляційного введення. Також у зазначеній композиції віросоми містять антигени грипу - гемаглютинин та/або нейрамідазу або їх похідні. У зазначеній композиції вірусні оболонки цілком походять з частинок вірусу. Також у зазначеній композиції ліпіди із зовнішнього джерела до відновлених віросом не вводяться. Композиція також не містить жодних окремих ад'ювантів та/або імуностимуляторів. Зазначена композиція здатна викликати локальну імунну реакцію при одноразовому інтраназальному або інгаляційному введенні пацієнту. Крім того, зазначена композиція здатна викликати реакцію цитотоксичних лімфоцитів при одноразовому інтраназальному або інгаляційному введенні пацієнту. Здатність зазначеної композиції викликати системну імунну реакцію, та/або локальну імунну реакцію, та/або реакцію цитотоксичних лімфоцитів виявляється по відношенню до людей. При цьому імунна реакція спрямована проти антигенів грипу - гемаглютинину та/або нейрамідази або їх похідних. У переважному варіанті здійснення імунна реакція на зазначену композицію відповідає критеріям СНМР щодо вакцини проти грипу. Імунна реакція на зазначену композицію забезпечує рівень серозахисту > 70% для дорослих та/або > 60% для літніх, рівень сероконверсії > 40% для дорослих та/або > 30% для літніх та середню кратність зростання > 2.5 для дорослих та/або > 2.0 для літніх з одного, двох або всіх зазначених показників. В особливо переважному варіанті здійснення доза гемаглютинину на один штам вірусу при інтраназальному або інгаляційному введенні зазначеної композиції дорівнює або менша 30 мкг. Нарешті, композиція вакцини за винаходом містить фармацевтичний носій для інтраназального або інгаляційного введення. Винахід також передбачає застосування віросом грипу, що являють собою реконструйовані оболонки зазначеного вірусу, для виготовлення композиції для інтраназального або інгаляційного введення. При цьому віросоми грипу містять антигени грипу - гемаглютинин та/або нейрамінідазу або їх похідні. Також при цьому застосуванні оболонки вірусів цілком одержують з часток вірусів грипу. Також при цьому застосуванні до віросом грипу не додають жодних сторонніх ліпідів і не вводять до композиції ніяких окремих ад'ювантів та/або імуностимуляторів. Композицію за винаходом складають так, що одноразового інтраназального або інгаляційного введення вистачає, щоб спричинити системну імунну реакцію. Композицію за винаходом складають так, що одноразового інтраназального або інгаляційного введення вистачає, щоб спричинити локальну імунну реакцію. Також композицію за винаходом складають так, що одноразового інтраназального або інгаляційного введення вистачає, щоб спричинити реакцію цитотоксичних лімфоцитів. Об'єктом такого засто 93236 8 сування за винаходом є людина. При застосуванні композиція спричинює імунну реакцію, спрямовану проти антигенів грипу - гемаглютинину та/або нейрамінідази або їх похідних У переважному варіанті здійснення винаходу імунна реакція, спричинена композицією, відповідає критеріям СНМР для вакцини проти грипу, а саме забезпечує рівень серозахисту > 70% для дорослих та/або > 60% для літніх, рівень сероконверсії > 40% для дорослих та/або > 30% для літніх та середню кратність зростання > 2.5 для дорослих та/або > 2.0 для літніх. У найбільш переважному варіанті доза гемаглютинину на штам вірусу при інтраназальному або інгаляційному введенні дорівнює або менша за 30 мкг. Нарешті, при застосуванні згідно з винаходом вироблена композиція являє собою вакцину. Отже, в одному з варіантів здійснення винаходу композиція з віросом грипу складається з реконструйованих оболонок зазначеного вірусу, причому оболонки вірусів цілком одержані з часток вірусів грипу, а до віросом грипу не додано жодних сторонніх ліпідів, віросоми грипу містять антигени грипу - гемаглютинин та/або нейрамінідазу або їх похідні, а до композиції не введено ніяких окремих ад'ювантів та/або імуностимуляторів. Композиція призначена для інтраназального або інгаляційного введення й відрізняється тим, що одноразового інтраназального або інгаляційного введення людині вистачає, щоб спричинити системну та/або локальну імунну реакцію проти зазначених антигенів грипу таким чином, що системна реакція відповідає критеріям СНМР для вакцини проти грипу, а доза гемаглютинину на штам вірусу при інтраназальному або інгаляційному введенні менша або дорівнює 30 мкг. Згідно з іншим варіантом здійснення винаходу віросоми грипу, що являють собою реконструйовані оболонки зазначеного вірусу, застосовують для виготовлення композиції для інтраназального або інгаляційного введення, причому оболонки вірусів цілком одержані з часток вірусів грипу, до віросом грипу не додано жодних сторонніх ліпідів, віросоми грипу містять антигени грипу - гемаглютинин та/або нейрамінідазу або їх похідні, а до композиції не введено ніяких окремих ад'ювантів та/або імуностимуляторів. Застосування зазначених віросом грипу для виготовлення композиції для інтраназального або інгаляційного введення відрізняється тим, що одноразового інтраназального або інгаляційного введення людині вистачає, щоб спричинити системну та/або локальну імунну реакцію проти зазначених антигенів грипу таким чином, що системна реакція відповідає критеріям СНМР для вакцини проти грипу, а доза гемаглютинину на штам вірусу при інтраназальному або інгаляційному введенні менша або дорівнює 30 мкг. Згідно із ще одним здійснення винаходу запропонована вакцина, яка являє собою композицію віросом грипу, що являють собою реконструйовані оболонки зазначеного вірусу, причому оболонки вірусів цілком одержані з часток вірусів грипу, до реконструйованих віросом не додано жодних сторонніх ліпідів, віросоми грипу містять антигени грипу - гемаглютинин та/або нейрамінідазу або їх похідні, а до композиції не введено 9 ніяких окремих ад'ювантів та/або імуностимуляторів. Вакцина призначена для одноразового інтраназального або інгаляційного введення людині, причому доза гемаглютинину на штам вірусу при інтраназальному або інгаляційному введенні менша або дорівнює 30 мкг. Переважно зазначеного одноразового інтраназального або інгаляційного введення вистачає, щоб спричинити системну та/або локальну імунну реакцію у зазначеної людини. Цей винахід також передбачає засіб, який містить певну кількість зазначеної вакцини для одноразового інтраназального або інгаляційнсго введення. Доза гемаглютинину на штам вірусу при інтраназальному або інгаляційному введенні згідно з винаходом менша або дорівнює 25 мкг, 20 мкг, 15 мкг, 10 мкг або 5 мкг. Список літератури: 1. Maassab HF. Adaptation and growth characteristics of influenza virus at 25°C, Nature 213, 612-14 (1967) 2. Maassab HF, Bryant ML. The development of live attenuated cold-adapted influenza virus vaccine for humans. Rev. Med. Virol. 1999 Oct-Dec;9(4): 23744. 3. Keitel W, Piedra PA. Live cold-adapted, reassortant in influenza vaccines (USA). Іn: Textbook of Influenza. Nicholson KG, Webster RG, Hay AJ (Ed), Blackwel Science Oxford, UK, 373-390 (1998). 4. Gluck U, Gebbers JO, Gluck R, Phase 1 evaluation of intranasal virosomal influenza vaccine with and without Escherichia coli heat-labile toxin in adult volunteers. J Virol. 1999Sep;73(9): 7780-6. 5. Sarndal HH, Bakke H, Oftung F, HoІst J, Haugen IL, Korsvold GE, Kristoffersen AC, Krogh G, Nord K, Rappuoli R, Berstad ΑΚΗ, Haneberg B. Anon-Living Nasal Influenza Vaccine Can Induce Major Humoral and Cellular Immune Responses in Humans without the Need for Adjuvants. Human Vaccines 1:2, 85-90; March/April 2005. 6. Mutsch M, Zhou W, Rhodes P, Bopp M, Chen RT, Linder T, Spyr C, Steffen R. Use of the inactivated intranasal influenza vaccine and the risk of Bell's palsy in Switzerland. N Engl J Med. 2004 Feb 26;350(9): 896-903. 7. Note for Guidance on Harmonisation of Requirements for Influenza Vaccines. EMEA/CpMP/BWP/214/96. 8. Daubeney, P., Taylor, C.J., McGaw, J., Brown, E.M., Ghosal, S., Keeton, B.R., Palache, В., Kerstens. R. Immunogenicity and tolerabiuty of a trivalent influenza subunit vaccine (influvacR) in highrisk children aged 6 months to 4 years. BJCP 1997 March, 51(2): 87-90. 9. Stegmann, Т., Morselt, H.W.M., Booy, F.P., Van Breemen, J.F.L., Scherphof, G., Wilschut, J.Functional reconstitution of influenza viris envelopes. EMBO Journal 1987, 6(9): 2651-2659. 10. Treanor J, Nolan C, O'Brien D, Burt D, Lowell G, Linden J, Fries L. Intranasal administration of a proteosome-influenza vaccine is well-tolerated and induces serum and nasal secretion influenza 93236 10 antibodies in healthy human subjects. Vaccine 2006;24(3): 254-62. 11. Read R.C.,Naylor S.C.,Potter C.W.,Bond J.,Jabbal-Gili I.,Fisher A.,lllum L.,Jennings R. Effective nasal influenza vaccine delivery using chitosan. Vaccine 2005;23(35):4367-74 12. Kuper CF, Koornstra PJ, Hameleers DM, Biewenga J, Spit BJ, Duijvestein AM, van Breda Vriesman PJ, Sminia T. The role of nasopharyngeal lymphoid tissue. Immunol. Today 1992 13: 219-24. 13. Zuercher AW, Coffin SE, Thurnheer MC, Fundova P, Cebra JJ. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J.Immunol. 2002 168:1796-803 14. Huckriede A, Bungener L, Stegmann T, Daemen T, Medema J, Palache AM, Wilschut J. The virosome concept for influenza vaccines. Vaccine 2005 23 (SuppІ 1):S26-38. 15. Glück R, Burri KG, Metcaife I. Adjuvant and antigen delivery properties of virosornes. Curr. Drug Deliv. 2005 2:395-400 ПРИКЛАД 1 ВІРУС-ЛІПОСОМНА ВАКЦИНА У 8ТИЖНЕВИХ МИШЕЙ BALB/C; ПОРІВНЯННЯ ПРИ ІНТРАНАЗАЛЬНОМУ ВВЕДЕННІ РІЗНИХ СПІВВІДНОШЕНЬ HA/LPP RATIOS ПРИ СУБОПТИМАЛЬНИХ ДОЗАХ НА Групи по 10 серонегативних до грипу самок мишей Balb/c mice одержують інтраназально віпусліпосомну вакцину при співвідношеннях HA/LPP (ліпопептид) 1:1.5, 1:0.7, 1:0.4, 1:0 (тобто без ліпопептиду) при вмісті 2 мкг НА на дозу. Контрольна група з 10 самок мишей одержують 0 мкг НА/дозу (порожній носій інтраназально). Готують чотири препарати віросом з вмістом LPP. Інактивований вірус грипу у 30-40 % розчині сахарози осаджують на центрифузі. Вірус знову суспендують та солюбілізують у буфері, що містить мийний засіб октаетиленглікольмонододецилетер (OEG). Після того нуклеокапсид вірусу видаляють на ультрацентрифузі. Супернанант з вмістом OEG розділяють на 4 рівних обсяги та додають різні кількості ліпопептиду P3CSK4 у буфері з вмістом OEG (P3CSK4: Н-пальмитоїл-8-[2,3біс(пальмитоїлоксі)-(2RS)-пропил]-[R]-цистеїнил[S]-серил-[S]-лізил-[S]-лізил-[S]-лізил-[S]-лізин). Обсяг коригують буфером з вмістом OEG. OEG видаляють абсорбцією на гідрофобній смолі. Це призводить до утворення віросом з вмістом LPP, реконструйовані вірусні пухирці містять у мембранах НА та NA, а за бажанням також LPP. Після видалення OEG віросоми фільтрують крізь мембрану з полівініліденфторзду з розміром пор 0.22 мкм. Вихідним матеріалом слугує 20 мг НА з штаму грипу A/Wyoming/3/2003 X-147 (типу A/Fujian/411/200 (H3N2)) з вмістом 252 вакцинувальних доз ендотоксину/100 мкг НА. Після солюбілізації готують 4 партії, як показано у табл. 1. 11 93236 12 Таблиця 1 м'язової імунізації та розливають по 1-мл флаконах (по 2 на групу), як показано у табл. 2. Ці групи вакцин використовують так, як наведено у табл. 4. Кількість доданого Співвідношення P3CSK4 HA/LPP (мг) Таблиця 2 Приготування віросом Кількість НА як вихідного Партія матеріалу (мг) VIR5 2004-11 VIR5 2004-12 VIR5 2004-13 VIR5 2004-14 7.5 1:1.5 3.5 1:0.7 2.0 1:0.4 0 1:0 Носій складається з 5 мМ Hepes, 145 мМ NaCI, 1мМ EDTA (рН 7.4). Для групи Ε (див. табл. 2) носій фільтрують крізь мембрану з полівініліденфториду з розміром пор 0.22 мкм. Одержані 4 партії віросом розбавляють до концентрації 200 мкг/мл для інтраназальної та 67 мкг/мл для внутрішньо Приготування вакцин Група А В С D Ε Препарат VIR-2004-11 ViR-2004-12 VIR-2004-13 VIR-2004-14 Носій* *Носій: 5 мМ Hepes, 145 мМ NaCI, 1мМ EDTA (рН 7.4), фільтрований крізь мембрану з полівініліденфториду з розміром пор 0.22 шм. Аналіз композиції Композиції, одержані у цьому дослідженні, аналізують по кількох параметрах, як показано у табл. 3. Таблиця 3 Дані аналізу віросом, що використовуються для одержання вакцин Компонент Протеїн (мг/мл)а НА (мкг/мл)b Фосфоліпід (ммол/л)с Ендотоксин (од. на 100 мкгНА)d Овальбумін (мкгна 100 мкг НА)е Чистотаf VIR-2004-11 1.7 776 0.658 3.1 0.047 Переважне НА а Проба Лоурі, принцип: Протеїни набувають синього забарвлення після обробки лужним сульфатом міді та фенольним реактивом Фоленсіокальто. Вміст протеїну визначають за спектральним вбиранням на 750 нм з еталонним стандартним альбуміном BSA. Lowry, OH, NJ Rosebrough, AL Fair, and RJ Randall. J. Bioi. Chem. 193: 265. 1951. Oostra, GM, NS Mathewson, and GN Catravas. Ana!. Biochem. 89: 31. 1978. Stoscheck, CM. Quaniitation of Protein. Methods in Enzymoiogy 182:50-69 (1990). Hartree, EF. AnaI. Biochem 48: 422-427 (1972). b Європейська фармакопея: монографія 2053 та розділ 2.7.1 с Принцип: Кожний фосфоліпід містить один атом фосфору, який може слугувати для кількісного визначення фосфоліпідів. Фосфоліпіди руйнуються хлорною кислотою, одержаний фосфат утворює комплекс із молібдатом, який відновлюється аскорбиновою кислотою з утворенням продукту синього забарвлення. Колір визначають спектрофотометром на хвилі 812 нм. Кількість фосфоліпіду у зразку визначають за допомогою фосфатного калібратора. VIR-2004-12 1.6 759 0.692 1.5 0.050 Переважно НА VIR-20G4-13 1.5 697 0.658 1.9 0.055 Переважно НА V1R-20G4-14 1.4 757 0.682 1.0 0 050 Переважно НА Ames BN. Assay of inorganic phosphate, total phosphate and phosphatases. Meth. Enzymol. 1966; 8:115-118. Bottcher CJF, van Gent CM & Pries С A rapid and sensitive sub-micro phosphorus determination. Anal. Chim. Acta 1961; 24:203-204 d Європейська фармакопея: 2.6.14. e Імуноферментний аналіз овальбуміну - це прямий імуноферментний сендвіч-аналіз, де імобілізовані поліклональні антиовальбумінові антитіла використовують для захоплення, а антиовальбумін-HRP кон'гагати слугують детекторною системою. Кон'югат інкубують одночасно із зразками. Незв'язані компоненти видаляють промивкою. До дучок додають субстрат (ТМВ та Н2О2). Про наявність специфічно зв'язаного кон'югату в дучках свідчить поява синього забарвлення. Доданням сірчаної кислоти до субстрату реакцію зупиняють, і продукт змінює колір на жовтий. Спектральне вбирання (оптичну щільність) зчитують на хвилі 450 нм. Для одержання оптимальних результатів використовують еталонний фільтр на 620 нм. Будують стандартну криву з реакції еталонних зразків овальбуміну (0.3-20.0 нг/мл), включених до аналізу. Концентрації невідомих зразків можна інтерполювати із стандартної кривої. 13 93236 f Згідно з монографіями 0869 та 2053: чистоту одновалентного зведеного збору визначають електрофорезом поліамідного гелю Електрофорез згідно з Європейською фармакопеєю 2.2.31. Тест-система Досліджувані тварини Використовують сім груп по десять самок мишей Balb/c (BALB/cAnNCrl). На початку експериментів миші у віці 8-9 тижнів важать по 17-19 г. 14 Тварин вакцинують інтраназально у день 0 та у день 14 одновалентною вірус-ліпидною вакциною проти грипу (A/Wyoming) та проводять некропсію на 21 день після другої вакцинації. Дослідні речовини інокулюють інтраназально (10 мкл в обидві ніздрі) під легкою анестезією ізофуран/О2/N2O у дорсальному положенні. Таблиця 4 Схема вакцинування Група А В С D Ε Шлях введення Інтраназально інтраназально Інтраназально Інтраназально Інтраназально Склад вакцини Кількість самок 2 мкг НА, співвідношення HA/LPP 1:1.5 10 2 мкг НА, співвідношення HA/LPP 1:0.7 10 2 мкг НА, співвідношення HA/LPP 1:0.4 10 2 мкг НА, співвідношення HA/LPP 1:0 10 2 мкг НА, співвідношення HA/LPP 0:0 10 Перед першою вакцинацією та за 14 днів після неї відбирають орбітальні проби крові під анестезією ізофуран/О2/N2О. На 35-й день тварин забивають та беруть зразки крові (обезкровлення під анестезією О2/СО2 через черевну аорту або проколом серця). Сироватку з усіх зразків збирають, глибоко заморожують та зберігають у поліпропіленових пробірках при температурах
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for single intranasal administration comprising influenza virosomes formed of reconstituted envelopes of said virus, use of said virosomes, vaccine comprising said composition and agent for intranasal or inhalational administration
Автори англійськоюKersten Alexander J., Gerez Lisya, Schoen Pieter J., Nauta Jozef J.P., Van Rheineck Leyssius Dorine H.
Назва патенту російськоюКомпозиция для одноразового интраназального введения, которая содержит виросомы гриппа, образованные из реконструированных оболочек указанного вируса, применение указанных виросом, вакцина, которая содержит указанную композицию, и средство для интраназального или ингаляционного введения
Автори російськоюКерстен Александер Й., Герез Лисия, Шон Питер Й., Наута Йозеф Й.П., ван Райнек Люссиус Дорин X.
МПК / Мітки
МПК: A61P 31/16, A61K 39/145
Мітки: зазначених, компози, вірусу, грипу, віросоми, містить, утворені, зазначену, віросом, застосування, композиція, введення, вакцина, інтраназального, зазначеного, яка, оболонок, реконструйованих, одноразового
Код посилання
<a href="https://ua.patents.su/12-93236-kompoziciya-dlya-odnorazovogo-intranazalnogo-vvedennya-yaka-mistit-virosomi-gripu-utvoreni-z-rekonstrujjovanikh-obolonok-zaznachenogo-virusu-zastosuvannya-zaznachenikh-virosom-vakc.html" target="_blank" rel="follow" title="База патентів України">Композиція для одноразового інтраназального введення, яка містить віросоми грипу, утворені з реконструйованих оболонок зазначеного вірусу, застосування зазначених віросом, вакцина, яка містить зазначену компози</a>
Попередній патент: Пристрій концентрації енергії
Наступний патент: Гіпсокартон, склад гіпсової суспензії для нього, спосіб його виробництва та застосування крохмалю для виробництва гіпсокартону
Випадковий патент: Панель керування транспортним засобом