Препарат невірапіну пролонгованого вивільнення
Номер патенту: 97971
Опубліковано: 10.04.2012
Автори: Каппола Майкл Л., Сінкевіч Светлана, Сноу Гленн Чарлз, Чень Фен-Цзін
Формула / Реферат
1. Фармацевтична композиція у формі таблетки, яка:
включає 300 мг невірапіну в матриці пролонгованого вивільнення, що містить гіпромелозу у діапазоні між 20 і 25 мас. %, і яка при введенні людині натще у вигляді однієї дози характеризується
(1) середнім геометричним значенням Cmax, рівним від 1000 до 2300 нг/мл; і
(2) середнім геометричним значенням ППК0-∞, рівним від 73400 до 178100 год. (нг/мл); і
яка при введенні людині у вигляді декількох доз характеризується
(1) середнім геометричним значенням Cmax,ss, рівним від 2300 до 3700 нг/мл; і
(2) середнім геометричним значенням ППК0-24,ss, рівним від 45000 до 75000 год. (нг/мл);
яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год.;
яка характеризується значенням Cmax,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2, визначеним при введенні множини доз; і
яка має профіль розчинення in vitro, такий що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
2. Фармацевтична композиція за п. 1, що має профіль розчинення in vitro, такий що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
3. Фармацевтична композиція за п. 1, що має профіль розчинення in vitro, такий що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
4. Фармацевтична композиція у формі таблетки, яка:
включає 400 мг невірапіну в матриці пролонгованого вивільнення, що містить гіпромелозу у діапазоні між 20 і 25 мас. %, і яка при введенні людині натще у вигляді однієї дози характеризується
(1) середнім геометричним значенням Cmax, рівним від 1210 до 2740 нг/мл; і
(2) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 год. (нг/мл); та
яка при введенні людині у вигляді декількох доз характеризується
(1) середнім геометричним значенням Cmax,ss, рівним від 3100 до 4900 нг/мл; і
(2) середнім геометричним значенням ППК0-24,ss, рівним від 60000 до 99000 год. (нг/мл);
яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год;
яка характеризується значенням Cmax,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2, визначеним при введенні множини доз; і
яка має профіль розчинення in vitro, такий що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
5. Фармацевтична композиція за п. 4, що має профіль розчинення in vitro, такий що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
6. Фармацевтична композиція за п. 4, що має профіль розчинення in vitro, такий що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
7. Дозована форма у вигляді таблетки, в якій кожна таблетка містить:
(a) 400 мг безводного невірапіну;
(b) 270 мг гіпромелози 2208;
(c) 400 мг моногідрату лактози; і
(d) 10 мг стеарату магнію;
і кожну таблетку пресують при зусиллі, рівному 10-25 кН.
8. Дозована форма у вигляді таблетки за п. 7, яка при введенні людині натще у вигляді однієї дози характеризується
(1) середнім геометричним значенням Cmax, рівним від 1210 до 2740 нг/мл; і
(2) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 год. (нг/мл).
9. Дозована форма у вигляді таблетки за п. 8, яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год.
10. Дозована форма у вигляді таблетки за п. 7, що має профіль розчинення in vitro, такий що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
11. Дозована форма у вигляді таблетки за п. 7, що має профіль розчинення in vitro, такий що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
12. Дозована форма у вигляді таблетки за п. 7, що має профіль розчинення in vitro, такий що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
13. Дозована форма у вигляді таблетки, в якій кожна таблетка містить:
(a) 400 мг безводного невірапіну;
(b) 270 мг гіпромелози 2208;
(c) 400 мг моногідрату лактози; і
(d) 10 мг стеарату магнію;
і кожну таблетку пресують при зусиллі, рівному 10-25 кН;
яка при введенні людині натще у вигляді однієї дози характеризується
(1) середнім геометричним значенням Cmax, рівним від 1210 до 2740 нг/мл; і
(2) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 год. (нг/мл); і
яка має профіль розчинення in vitro, такий що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
14. Дозована форма у вигляді таблетки за п. 13, що має профіль розчинення in vitro, такий що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
15. Дозована форма у вигляді таблетки за п. 13, що має профіль розчинення in vitro, такий що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
16. Дозована форма у вигляді таблетки за п. 7, яка при введенні людині у вигляді декількох доз характеризується
(1) середнім геометричним значенням Cmax,ss, рівним від 3100 до 4900 нг/мл; і
(2) середнім геометричним значенням ППК0-24,ss, рівним від 60000 до 99000 год. (нг/мл);
яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год.;
яка характеризується значенням Cmax,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2, визначеним при введенні множини доз; і
яка має профіль розчинення in vitro, такий що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C.
Текст
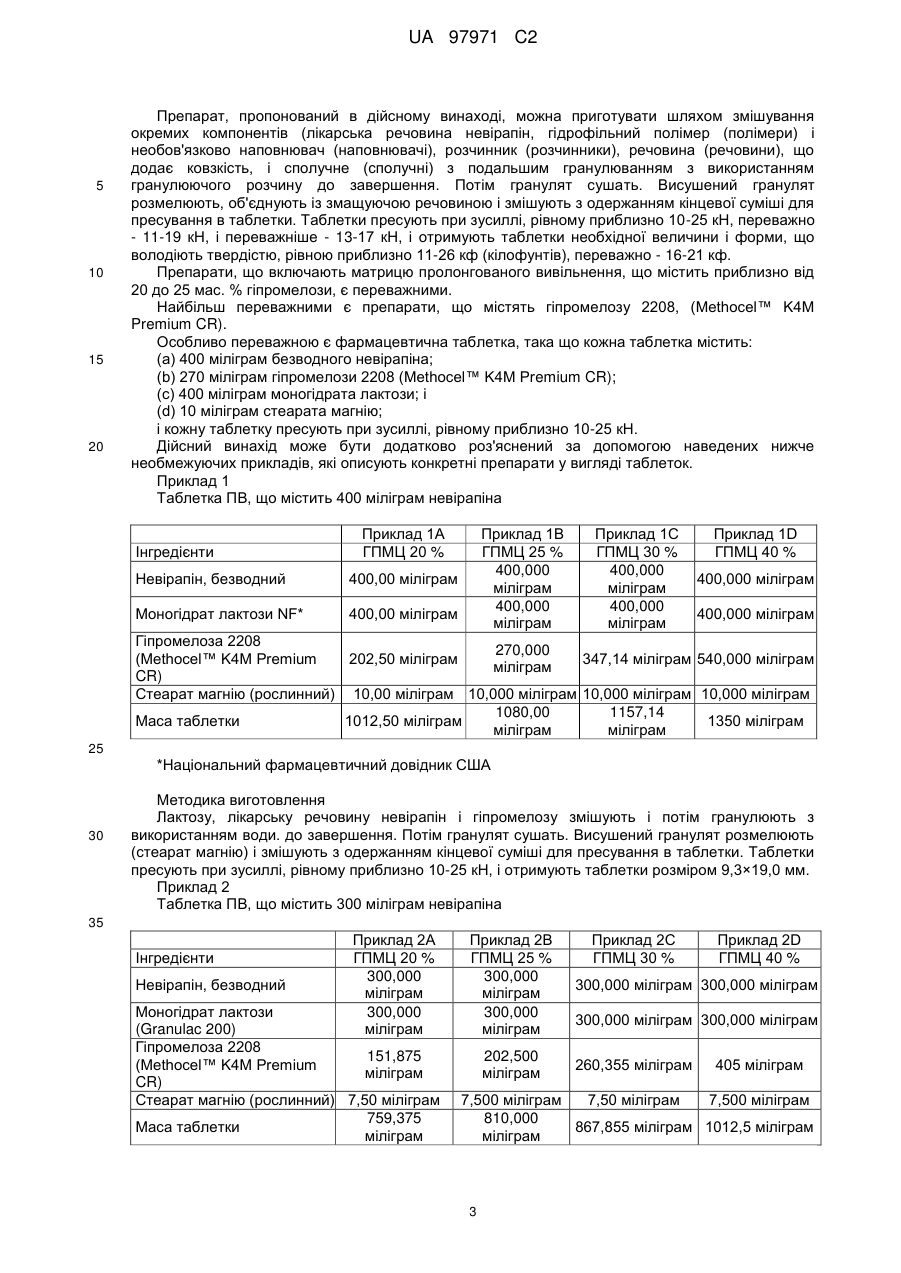
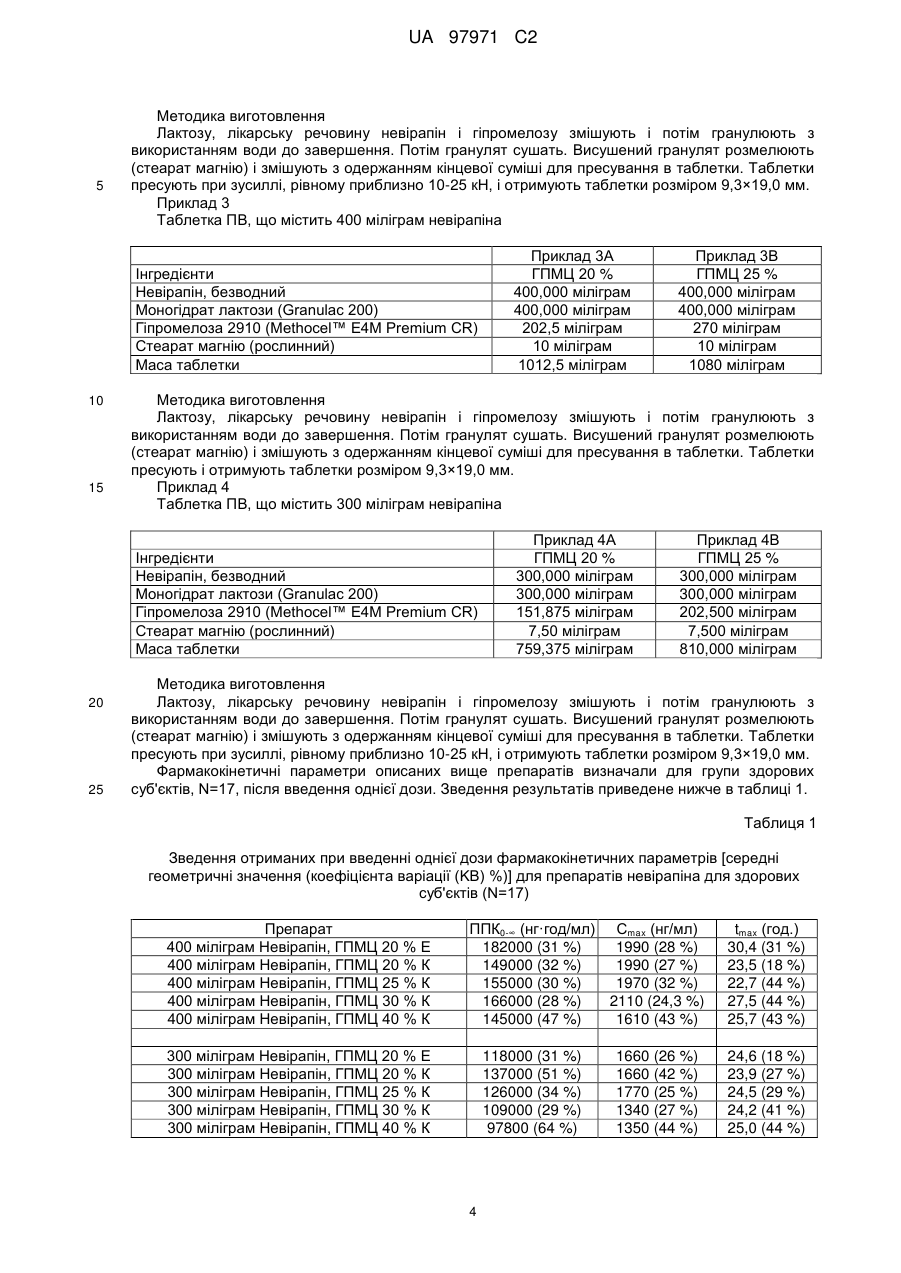
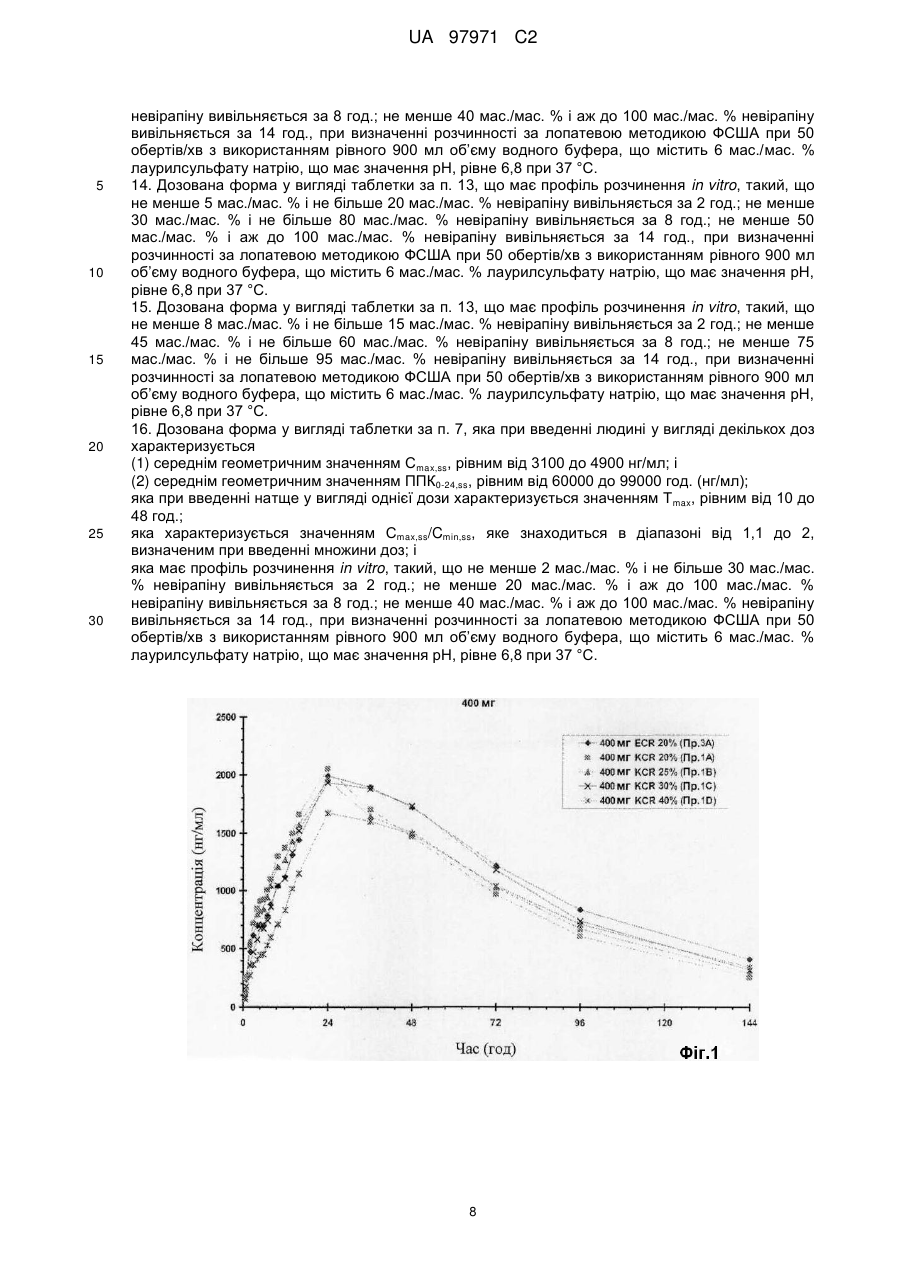
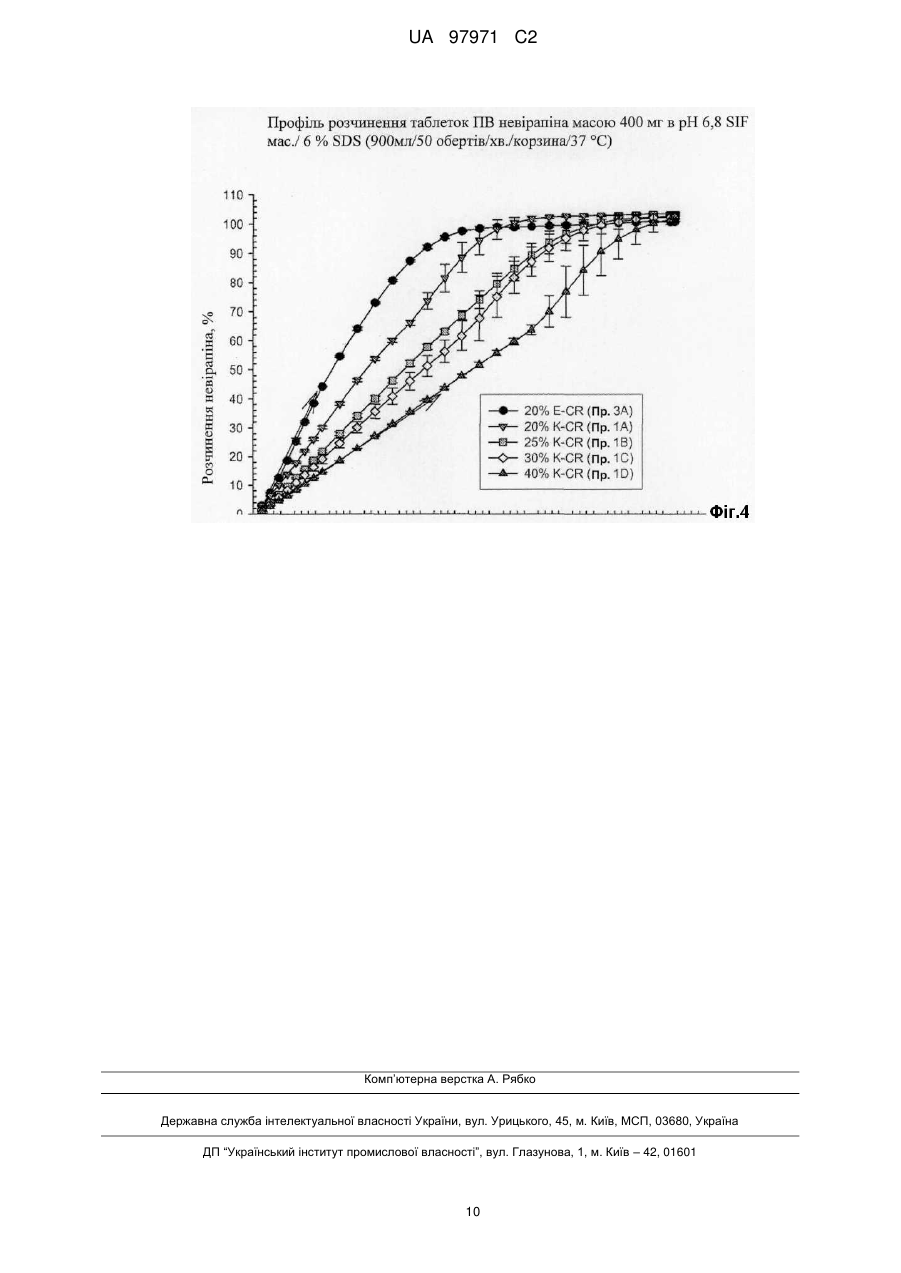
Реферат: У заявці описана фармацевтична композиція пролонгованого вивільнення, що містить невірапін. UA 97971 C2 (12) UA 97971 C2 UA 97971 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дійсний винахід відноситься до фармацевтичної композиції, що включає невірапін. Невірапін, або 11-циклопропіл-5,11-дигідро-4-метил-6Н-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6он, є відомим засобом лікування інфікування шляхом ВІЧ-1 (вірус імунодефіциту людини, тип 1), який діє шляхом специфічного інгібування зворотної транскриптази ВІЧ-1. Його синтез і застосування описані в різних публікаціях, включаючи, зокрема, патент U.S. 5366972 і Європейський патент 0429987 В1. Таблетки вірамун®, лікарського засобу, що містить невірапін, в багатьох країнах затверджені до застосування для лікування інфікування шляхом ВІЧ-1. Наявні в даний час в продажу таблетки вірамун® є препаратом негайного вивільнення (НВ), який призначений для введення двічі на добу для підтримки терапевтично сприятливого вмісту в крові активного інгредієнта, невірапіна. Для зручності пацієнтів і сприяння дотриманню належного режиму дозування давно необхідний доки відсутній препарат пролонгованого вивільнення (ПВ) невірапіна для перорального введення, який можна було б вводити лише один раз на добу при підтримці терапевтично сприятливого вмісту в крові активного інгредієнта. Спеціалісти в галузі фармацевтики, знайомі з невірапіном, повинні розуміти, що невірапін володіє фізико-хімічними характеристиками, які роблять сумнівною можливість приготування препарату ПВ. Точніше, слід розуміти, що препарат ПВ зазвичай призначений для поступового всмоктування при проходженні через кишечник, в якому значення рН є високим. Невірапін є слабкою основою і тому можна вважати, що він володіє низькою розчинністю в кишечнику. (Невірапін є лікарським засобом класу II відповідно до Біофармацевтичної класифікаційної системи.) З цієї причини розумно вважати, що препарат ПВ невірапіна може проходити через шлунково-кишковий тракт і виводитися без істотного розчинення і всмоктування невірапіна. Це робить препарат ПВ непридатним. Невірапін володіє щонайменше ще однією особливістю, яка робить незвично складним завдання приготування препарату ПВ: Для забезпечення безпеки, переносимості і ефективності вміст в плазмі ніколи не має бути меншим порогового значення, при якому пригнічується реплікація вірусу, і ніколи не повинен підвищуватися до значення, при якому виявляється токсичність або непереносимість. Для невірапіна відмінність між цими двома значеннями відносно невелика. Це означає, що значення Cmax,ss/Cmin,ss має бути близьким до 1. Безпека/переносимість і ефективності препарату негайного вивільнення досліджена раніше і в умовах стаціонарного стану після введення двічі на добу спостерігається досить пологий фармакокінетичний (ФК) профіль (Cmax,ss/Cmin,ss = приблизно 1,8). Будь-який препарат пролонгованого вивільнення (ПВ) повинен характеризуватися відношенням максимальне/мінімальне значення, яке, не дивлячись на введення ПВ один раз на добу, рівне або навіть менше, ніж відношення для препарату НВ після введення двічі на добу. Інакше, якщо відношення максимальне/мінімальне значення більше, ніж те, що спостерігається для НВ, препарат ПВ, ймовірно, буде непридатним з точки зору характеристики клінічний ризик/користь. З врахуванням, цих досить складних завдань в основу дійсного винаходу було покладено завдання розробки препарату ПВ невірапіна, призначеного для перорального введення. Дійсний винахід відноситься до препарату пролонгованого вивільнення (ПВ) невірапіна, який придатний для введення лише один раз на добу з підтримкою терапевтично сприятливого вмісту активного інгредієнта в крові. На Фіг.1 і 2 відповідно приведена залежність від часу концентрації невірапіна в плазмі крові, що утворилася при введенні здоровим суб'єктам однієї таблетки масою 400 або 300 міліграм дозованої форми пролонгованого вивільнення невірапіна, пропонованої в дійсному винаході. На Фіг.3 приведена залежність від часу стаціонарної концентрації невірапіна в плазмі крові, що утворилася при введенні один раз на добу здоровим суб'єктам таблетки масою 400 міліграм дозованої форми пролонгованого вивільнення невірапіна, пропонованої в дійсному винаході. На Фіг.4 приведений профіль розчинення препарату пролонгованого вивільнення, пропонованого в дійсному винаході. У своєму найширшому варіанті здійснення препарат пролонгованого вивільнення, пропонований в дійсному винаході, після введення натщесерце здоровому добровольцеві володіє типовим фармакокінетичним профілем, який для дозованої форми, що містить 300 міліграм невірапіна, характеризується наступними двома параметрами: (a) середнім геометричним значенням Сmах, рівним від 1000 до 2300 нг/мл; і (b) середнім геометричним значенням ППК0-∞ (ППК - площа під кривою), рівним від 73400 до 178100 нг·год/мл); і для дозованої форми, що містить 400 міліграм невірапіна, характеризується наступними двома параметрами: (а) середнім геометричним значенням Сmах, рівним від 1210 до 2740 нг/мл; і (b) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 нг·год/мл). 1 UA 97971 C2 5 10 15 20 25 30 35 40 45 50 55 Препарат пролонгованого вивільнення, пропонований в дійсному винаході, додатково характеризується середнім геометричним значенням Т mах, рівним від 10 до 48 год. (також після введення разової дози натщесерце). Препарат пролонгованого вивільнення, пропонований в дійсному винаході, додатково характеризується наступними параметрами ФК, що спостерігаються після введення, що повторюється один раз на добу в стаціонарному стані: Для дози, рівної 300 міліграм: (a) середнім геометричним значенням Cmax,ss, рівним від 2300 до 3700 нг/мл; і (b) середнім геометричним значенням ППК0-24h,ss, рівним від 45000 до 75000 нг·год/мл; і Для дози, рівної 400 міліграм: (a) середнім геометричним значенням Cmax,ss, рівним від 3100 до 4900 нг/мл; і (b) середнім геометричним значенням ППК0-24h,ss, рівним від 60000 до 99000 нг·год/мл. Вказані вище параметри ФК для випадку введення множини доз визначають натщесерце через 24 год. після того, як вміст лікарського засобу в плазмі досяг стаціонарного стану. Препарат пролонгованого вивільнення, пропонований в дійсному винаході, додатково характеризується дуже вузьким інтервалом значень відношення C max,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2 для доз, рівних і 300, і 400 міліграм, і вказаний параметр визначають в стаціонарному стані. Слід зазначити, що ці параметри ФК слід визначати за експериментальними даними, а не модельованими даними. Крім того, препарат пролонгованого вивільнення, пропонований в дійсному винаході, характеризується профілем розчинення in vitro, таким що не менше 2 мас./мас. % і не більше 30 мас/мас. % невірапіна вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас/мас. % невірапіна вивільняється за 8 год.; не менше 40 мас/мас. % і аж до 100 мас/мас. % невірапіна вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША (Фармакопея США) при 50 обертів/хв з використанням рівного 900 мл об'єму водного буфера, що містить 6 мас./мас. % лаурилсульфата натрію, що володіє значенням рН, рівним 6,8 при 37 °C. У переважних варіантах здійснення препарат пролонгованого вивільнення, пропонований в дійсному винаході, характеризується профілем розчинення in vitro, таким що не менше 5 мас/мас. % і не більше 20 мас/мас. % невірапіна вивільняється за 2 год.; не менше 30 мас/мас. % і не більше 80 мас./мас. % невірапіна вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас/мас. % невірапіна вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША (Фармакопея США) при 50 обертів/хв з використанням рівного 900 мл об'єму водного буфера, що містить 6 мас./мас. % лаурилсульфата натрію, що володіє значенням рН, рівним 6,8 при 37 °C. У переважніших варіантах здійснення препарат пролонгованого вивільнення, пропонований в дійсному винаході, характеризується профілем розчинення in vitro, таким що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіна вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас/мас. % невірапіна вивільняється за 8 год.; не менше 75 мас/мас. % і не більше 95 мас/мас. % невірапіна вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об'єму водного буфера, що містить 6 мас./мас. % лаурилсульфата натрію, що володіє значенням рН, рівним 6,8 при 37 °C. Фармацевтичну композицію, пропоновану в дійсному винаході, можна приготувати шляхом об'єднання невірапіна із звичайними носіями або інертними наповнювачами. Переважними варіантами здійснення дійсного винаходу є таблетки. Також переважними є варіанти здійснення дійсного винаходу, які включають матрицю пролонгованого вивільнення, яка містить гідрофільний полімер, який забезпечує регульоване вивільнення невірапіна. Гідрофільним полімером може бути, але не обмежується лише ними, гідроксипропілметилцелюлоза (ГПМЦ, також відома, як гіпромелоза), гідроксипропілцелюлоза (ГПЦ), гідроксіетилцелюлоза (ГЕЦ), ксантанова камедь, альгінат натрію, поліетиленоксид і зшиті гомополімери і сополімери акрилової кислоти. Також можна використовувати суміші вказаних вище гідрофільних полімерів. Переважним гідрофільним полімером є ГПМЦ (гіпромелоза), особливо гіпромелоза 2910 ФСША, гіпромелоза 2906 ФСША або гіпромелоза 2208 ФСША, або їх суміш. Препарат, пропонований в дійсному винаході, також необов'язково може містити інші звичайні інертні наповнювачі, такі як наповнювачі, розчинники, речовини, що додають ковзкість, і сполучні. 2 UA 97971 C2 5 10 15 20 Препарат, пропонований в дійсному винаході, можна приготувати шляхом змішування окремих компонентів (лікарська речовина невірапін, гідрофільний полімер (полімери) і необов'язково наповнювач (наповнювачі), розчинник (розчинники), речовина (речовини), що додає ковзкість, і сполучне (сполучні) з подальшим гранулюванням з використанням гранулюючого розчину до завершення. Потім гранулят сушать. Висушений гранулят розмелюють, об'єднують із змащуючою речовиною і змішують з одержанням кінцевої суміші для пресування в таблетки. Таблетки пресують при зусиллі, рівному приблизно 10-25 кН, переважно - 11-19 кН, і переважніше - 13-17 кН, і отримують таблетки необхідної величини і форми, що володіють твердістю, рівною приблизно 11-26 кф (кілофунтів), переважно - 16-21 кф. Препарати, що включають матрицю пролонгованого вивільнення, що містить приблизно від 20 до 25 мас. % гіпромелози, є переважними. Найбільш переважними є препарати, що містять гіпромелозу 2208, (Methocel™ K4M Premium CR). Особливо переважною є фармацевтична таблетка, така що кожна таблетка містить: (a) 400 міліграм безводного невірапіна; (b) 270 міліграм гіпромелози 2208 (Methocel™ K4M Premium CR); (c) 400 міліграм моногідрата лактози; і (d) 10 міліграм стеарата магнію; і кожну таблетку пресують при зусиллі, рівному приблизно 10-25 кН. Дійсний винахід може бути додатково роз'яснений за допомогою наведених нижче необмежуючих прикладів, які описують конкретні препарати у вигляді таблеток. Приклад 1 Таблетка ПВ, що містить 400 міліграм невірапіна Інгредієнти Приклад 1А ГПМЦ 20 % Невірапін, безводний 400,00 міліграм Моногідрат лактози NF* Приклад 1В ГПМЦ 25 % 400,000 міліграм 400,000 міліграм 400,00 міліграм Приклад 1С ГПМЦ 30 % 400,000 міліграм 400,000 міліграм Приклад 1D ГПМЦ 40 % 400,000 міліграм 400,000 міліграм Гіпромелоза 2208 270,000 (Methocel™ K4M Premium 202,50 міліграм 347,14 міліграм 540,000 міліграм міліграм CR) Стеарат магнію (рослинний) 10,00 міліграм 10,000 міліграм 10,000 міліграм 10,000 міліграм 1080,00 1157,14 Маса таблетки 1012,50 міліграм 1350 міліграм міліграм міліграм 25 *Національний фармацевтичний довідник США 30 Методика виготовлення Лактозу, лікарську речовину невірапін і гіпромелозу змішують і потім гранулюють з використанням води. до завершення. Потім гранулят сушать. Висушений гранулят розмелюють (стеарат магнію) і змішують з одержанням кінцевої суміші для пресування в таблетки. Таблетки пресують при зусиллі, рівному приблизно 10-25 кН, і отримують таблетки розміром 9,3×19,0 мм. Приклад 2 Таблетка ПВ, що містить 300 міліграм невірапіна 35 Інгредієнти Невірапін, безводний Приклад 2А ГПМЦ 20 % 300,000 міліграм 300,000 міліграм Моногідрат лактози (Granulac 200) Гіпромелоза 2208 151,875 (Methocel™ K4M Premium міліграм CR) Стеарат магнію (рослинний) 7,50 міліграм 759,375 Маса таблетки міліграм Приклад 2В ГПМЦ 25 % 300,000 міліграм 300,000 міліграм 202,500 міліграм Приклад 2С ГПМЦ 30 % Приклад 2D ГПМЦ 40 % 300,000 міліграм 300,000 міліграм 300,000 міліграм 300,000 міліграм 260,355 міліграм 405 міліграм 7,500 міліграм 7,50 міліграм 7,500 міліграм 810,000 867,855 міліграм 1012,5 міліграм міліграм 3 UA 97971 C2 5 Методика виготовлення Лактозу, лікарську речовину невірапін і гіпромелозу змішують і потім гранулюють з використанням води до завершення. Потім гранулят сушать. Висушений гранулят розмелюють (стеарат магнію) і змішують з одержанням кінцевої суміші для пресування в таблетки. Таблетки пресують при зусиллі, рівному приблизно 10-25 кН, і отримують таблетки розміром 9,3×19,0 мм. Приклад 3 Таблетка ПВ, що містить 400 міліграм невірапіна Інгредієнти Невірапін, безводний Моногідрат лактози (Granulac 200) Гіпромелоза 2910 (Methocel™ E4M Premium CR) Стеарат магнію (рослинний) Маса таблетки 10 15 25 Приклад 3В ГПМЦ 25 % 400,000 міліграм 400,000 міліграм 270 міліграм 10 міліграм 1080 міліграм Методика виготовлення Лактозу, лікарську речовину невірапін і гіпромелозу змішують і потім гранулюють з використанням води до завершення. Потім гранулят сушать. Висушений гранулят розмелюють (стеарат магнію) і змішують з одержанням кінцевої суміші для пресування в таблетки. Таблетки пресують і отримують таблетки розміром 9,3×19,0 мм. Приклад 4 Таблетка ПВ, що містить 300 міліграм невірапіна Інгредієнти Невірапін, безводний Моногідрат лактози (Granulac 200) Гіпромелоза 2910 (Methocel™ E4M Premium CR) Стеарат магнію (рослинний) Маса таблетки 20 Приклад 3А ГПМЦ 20 % 400,000 міліграм 400,000 міліграм 202,5 міліграм 10 міліграм 1012,5 міліграм Приклад 4А ГПМЦ 20 % 300,000 міліграм 300,000 міліграм 151,875 міліграм 7,50 міліграм 759,375 міліграм Приклад 4В ГПМЦ 25 % 300,000 міліграм 300,000 міліграм 202,500 міліграм 7,500 міліграм 810,000 міліграм Методика виготовлення Лактозу, лікарську речовину невірапін і гіпромелозу змішують і потім гранулюють з використанням води до завершення. Потім гранулят сушать. Висушений гранулят розмелюють (стеарат магнію) і змішують з одержанням кінцевої суміші для пресування в таблетки. Таблетки пресують при зусиллі, рівному приблизно 10-25 кН, і отримують таблетки розміром 9,3×19,0 мм. Фармакокінетичні параметри описаних вище препаратів визначали для групи здорових суб'єктів, N=17, після введення однієї дози. Зведення результатів приведене нижче в таблиці 1. Таблиця 1 Зведення отриманих при введенні однієї дози фармакокінетичних параметрів [середні геометричні значення (коефіцієнта варіації (KB) %)] для препаратів невірапіна для здорових суб'єктів (N=17) Препарат 400 міліграм Невірапін, ГПМЦ 20 % Е 400 міліграм Невірапін, ГПМЦ 20 % К 400 міліграм Невірапін, ГПМЦ 25 % К 400 міліграм Невірапін, ГПМЦ 30 % К 400 міліграм Невірапін, ГПМЦ 40 % К ППК0-∞ (нг·год/мл) Сmax (нг/мл) 182000 (31 %) 1990 (28 %) 149000 (32 %) 1990 (27 %) 155000 (30 %) 1970 (32 %) 166000 (28 %) 2110 (24,3 %) 145000 (47 %) 1610 (43 %) 300 міліграм Невірапін, ГПМЦ 20 % Е 300 міліграм Невірапін, ГПМЦ 20 % К 300 міліграм Невірапін, ГПМЦ 25 % К 300 міліграм Невірапін, ГПМЦ 30 % К 300 міліграм Невірапін, ГПМЦ 40 % К 118000 (31 %) 137000 (51 %) 126000 (34 %) 109000 (29 %) 97800 (64 %) 4 1660 (26 %) 1660 (42 %) 1770 (25 %) 1340 (27 %) 1350 (44 %) tmax (год.) 30,4 (31 %) 23,5 (18 %) 22,7 (44 %) 27,5 (44 %) 25,7 (43 %) 24,6 (18 %) 23,9 (27 %) 24,5 (29 %) 24,2 (41 %) 25,0 (44 %) UA 97971 C2 Продовження таблиці 1 400 міліграм Невірапін, НВ 200 міліграм Невірапін, НВ 5 210000 (22 %) 114000 (30 %) 3130 (12 %) 1740 (21 %) 4,31 (117 %) 2,17 (147 %) Фармакокінетичні параметри описаних вище препаратів також визначали після введення декількох доз (один раз на добу невірапін ПВ протягом 17 днів) для інфікованої шляхом ВІЧ групи пацієнтів, яких раніше лікували таблетками вірамун® негайного вивільнення. Зведення результатів приведене нижче в таблиці 2. Таблиця 2 Зведення отриманих в стаціонарному стані фармакокінетичних параметрів для таблеток негайного вивільнення (НВ) і 400 міліграм пролонгованого вивільнення (ПВ) для інфікованих шляхом ВІЧ пацієнтів Лікування HB (N=19) ПВ 25 % К (N=18) ПВ 20 % К (N=9) gMean gCV% gMean gCV% gMean gCV% tmax (год.) Сmах (нг/мл) Сmin (нг/мл) 1,8 130 4,3 134 5,8 92 5576 26 3911 26 3904 37 2976 31 2622 35 2609 45 ППК0-24 (год·нг/мл) 96137 26 75544 29 79308 38 gMean = середнє геометричні значення, gCV = середнє геометричні значення KB. Таблиця 3 Зведення отриманих в стаціонарному стані відібраних фармакокінетичних параметрів для таблеток 300 міліграм пролонгованого вивільнення (ПВ) для інфікованих шляхом ВІЧ пацієнтів ПВ 25 % К ПВ 20 % К Лікування gMean gMean tmax (год.) 4 5 Сmax (нг/мл) 3000 2930 Сmin (нг/мл) 1970 1960 ППК0-24 (год·нг/мл) 57000 59500 10 15 20 25 30 Розчинення Профілі розчинення для 5 препаратів, описаних в прикладах 1, 2, 3 і 4, приведені на Фіг.4. Приведена інформація по розчиненню отримана за описаними нижче методикамим. Методика дослідження розчинення Лопатева методика ФСША є лопатевою методикою, описаною, наприклад, в U.S. Pharmacopoeia XXII (1990). Апарат ФСША І (корзинчатий) при 50 обертів/хв в 900 мл середовища при 37 °C. Корзини (10 меш) вибирали так, щоб таблетки не прилипали до дна судини і тим самим не зводилася до мінімуму площа поверхні, доступна для розчину при дослідженні. Розчинення проводили з використанням циркуляційного нагрівача VanKel VK 750 D Heater/Circulator Model 65-3000, VanKel VK 7000 або установки для дослідження розчинення 7010 Dissolution Testing Station, і насоса VanKel Model 17-2200 (VanKel, Cary, NC). Кількість розчиненої лікарської речовини визначали в реальному масштабі часу за допомогою спектрофотометра для ультрафіолетової і видимої областей спектру Саrу 50 (Varian Australia Pty LTD) при довжині хвилі 330 нм відносно зовнішнього стандарту. Використовували розчинювальні середовища: 0,05 М фосфатний буфер (NaH 2PO4/NaOH або NaH2PO4/Na2HPO4/NaOH - всі виробництва фірми ЕМ Science, Darmstadt, Germany), що містить 6 % лаурилсульфата натрію (13 % лаурилсульфат натрію в деіонізованій воді, Anachemia Chemicals, Rouses Point, NY або лаурилсульфат натрію, Spectrum Chemical MFG. CORP.) і значення рН доводили до 6,8. Розчинення проводили з використанням корзин з неіржавіючої сталі 10 меш. параметри розчинення: - об'єм середовища: 900 мл 5 UA 97971 C2 5 - температура: 37,3 °C - швидкість обертання: 50 обертів/хв - відбір проб: через кожних 30 хв протягом перших 4 год, потім через кожну годину (4-24 год) - тривалість обертання: 15 хв при 250 обертів/хв - вбудовані фільтри: повнопотоковий фільтр з отворами розміром 10 мкм (VanKel, Cary, NC або Quality Lab Accessories L.L.S.). ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 40 45 50 55 1. Фармацевтична композиція у формі таблетки, яка: включає 300 мг невірапіну в матриці пролонгованого вивільнення, що містить гіпромелозу у діапазоні між 20 і 25 мас. %, і яка при введенні людині натще у вигляді однієї дози характеризується (1) середнім геометричним значенням Cmax, рівним від 1000 до 2300 нг/мл; і (2) середнім геометричним значенням ППК0-∞, рівним від 73400 до 178100 год. (нг/мл); і яка при введенні людині у вигляді декількох доз характеризується (1) середнім геометричним значенням Cmax,ss, рівним від 2300 до 3700 нг/мл; і (2) середнім геометричним значенням ППК0-24,ss, рівним від 45000 до 75000 год. (нг/мл); яка при введенні натще у вигляді однієї дози характеризується значенням T max, рівним від 10 до 48 год.; яка характеризується значенням Cmax,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2, визначеним при введенні множини доз; і яка має профіль розчинення in vitro, такий, що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 2. Фармацевтична композиція за п. 1, що має профіль розчинення in vitro, такий, що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 3. Фармацевтична композиція за п. 1, що має профіль розчинення in vitro, такий, що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 4. Фармацевтична композиція у формі таблетки, яка: включає 400 мг невірапіну в матриці пролонгованого вивільнення, що містить гіпромелозу у діапазоні між 20 і 25 мас. %, і яка при введенні людині натще у вигляді однієї дози характеризується (1) середнім геометричним значенням Cmax, рівним від 1210 до 2740 нг/мл; і (2) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 год. (нг/мл); та яка при введенні людині у вигляді декількох доз характеризується (1) середнім геометричним значенням Cmax,ss, рівним від 3100 до 4900 нг/мл; і (2) середнім геометричним значенням ППК0-24,ss, рівним від 60000 до 99000 год. (нг/мл); яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год; яка характеризується значенням Cmax,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2, визначеним при введенні множини доз; і яка має профіль розчинення in vitro, такий, що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 6 UA 97971 C2 5 10 15 20 25 30 35 40 45 50 55 60 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 5. Фармацевтична композиція за п. 4, що має профіль розчинення in vitro, такий, що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 6. Фармацевтична композиція за п. 4, що має профіль розчинення in vitro, такий, що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 7. Дозована форма у вигляді таблетки, в якій кожна таблетка містить: (a) 400 мг безводного невірапіну; (b) 270 мг гіпромелози 2208; (c) 400 мг моногідрату лактози; і (d) 10 мг стеарату магнію; і кожну таблетку пресують при зусиллі, рівному 10-25 кН. 8. Дозована форма у вигляді таблетки за п. 7, яка при введенні людині натще у вигляді однієї дози характеризується (1) середнім геометричним значенням Cmax, рівним від 1210 до 2740 нг/мл; і (2) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 год. (нг/мл). 9. Дозована форма у вигляді таблетки за п. 8, яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год. 10. Дозована форма у вигляді таблетки за п. 7, що має профіль розчинення in vitro, такий, що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 11. Дозована форма у вигляді таблетки за п. 7, що має профіль розчинення in vitro, такий, що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 12. Дозована форма у вигляді таблетки за п. 7, що має профіль розчинення in vitro, такий, що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 13. Дозована форма у вигляді таблетки, в якій кожна таблетка містить: (a) 400 мг безводного невірапіну; (b) 270 мг гіпромелози 2208; (c) 400 мг моногідрату лактози; і (d) 10 мг стеарату магнію; і кожну таблетку пресують при зусиллі, рівному 10-25 кН; яка при введенні людині натще у вигляді однієї дози характеризується (1) середнім геометричним значенням Cmax, рівним від 1210 до 2740 нг/мл; і (2) середнім геометричним значенням ППК0-∞, рівним від 109000 до 237000 год. (нг/мл); і яка має профіль розчинення in vitro, такий, що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % 7 UA 97971 C2 5 10 15 20 25 30 невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 14. Дозована форма у вигляді таблетки за п. 13, що має профіль розчинення in vitro, такий, що не менше 5 мас./мас. % і не більше 20 мас./мас. % невірапіну вивільняється за 2 год.; не менше 30 мас./мас. % і не більше 80 мас./мас. % невірапіну вивільняється за 8 год.; не менше 50 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 15. Дозована форма у вигляді таблетки за п. 13, що має профіль розчинення in vitro, такий, що не менше 8 мас./мас. % і не більше 15 мас./мас. % невірапіну вивільняється за 2 год.; не менше 45 мас./мас. % і не більше 60 мас./мас. % невірапіну вивільняється за 8 год.; не менше 75 мас./мас. % і не більше 95 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 16. Дозована форма у вигляді таблетки за п. 7, яка при введенні людині у вигляді декількох доз характеризується (1) середнім геометричним значенням Cmax,ss, рівним від 3100 до 4900 нг/мл; і (2) середнім геометричним значенням ППК0-24,ss, рівним від 60000 до 99000 год. (нг/мл); яка при введенні натще у вигляді однієї дози характеризується значенням Tmax, рівним від 10 до 48 год.; яка характеризується значенням Cmax,ss/Cmin,ss, яке знаходиться в діапазоні від 1,1 до 2, визначеним при введенні множини доз; і яка має профіль розчинення in vitro, такий, що не менше 2 мас./мас. % і не більше 30 мас./мас. % невірапіну вивільняється за 2 год.; не менше 20 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 8 год.; не менше 40 мас./мас. % і аж до 100 мас./мас. % невірапіну вивільняється за 14 год., при визначенні розчинності за лопатевою методикою ФСША при 50 обертів/хв з використанням рівного 900 мл об’єму водного буфера, що містить 6 мас./мас. % лаурилсульфату натрію, що має значення pH, рівне 6,8 при 37 °C. 8 UA 97971 C2 9 UA 97971 C2 Комп’ютерна верстка А. Рябко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Назва патенту англійськоюExtended release formulation of nevirapine
Автори англійськоюCappola, Michael, L., Sienkiewicz, Svetlana, Snow, Glenn, Charles, Chen, Feng-Jing
Назва патенту російськоюПрепарат невирапина пролонгированного высвобождения
Автори російськоюКаппола Майкл Л., Синкевич Светлана, Сноу Гленн Чарлз, Чень Фен-Цзин
МПК / Мітки
МПК: A61K 9/26, A61K 31/5513, A61P 31/12
Мітки: препарат, невірапіну, вивільнення, пролонгованого
Код посилання
<a href="https://ua.patents.su/12-97971-preparat-nevirapinu-prolongovanogo-vivilnennya.html" target="_blank" rel="follow" title="База патентів України">Препарат невірапіну пролонгованого вивільнення</a>
Попередній патент: Конструкційна панель
Наступний патент: Ферментативне знесмолювання масляної композиції з використанням суміші фосфоліпаз pla і plс
Випадковий патент: Спосіб зміцнення леза