Антимікробні сполуки, їх синтез і застосування для лікування інфекцій у ссавців
Формула / Реферат
1. Сполука формули І
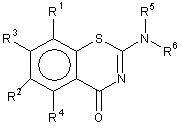 , (І)
, (І)
або її сіль,
у якій R1 і R2 незалежно одне від одного являють собою NO2, NR7R8, NHOR9, COOR9, CN, CONR10R11, CHO, F, Cl, Br, SO2NR12R13, нижчу алкоксильну групу, OCF3, моно-, ди- або трифторметил;
R3 і R4 незалежно одне від одного являють собою Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, який містить 1-3 ланки у ланцюзі, F, Сl, Вr, нижчу алкоксильну групу;
R5 являє собою Н, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-7 ланок у ланцюзі;
R6 являє собою радикал:
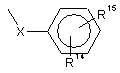 ,
,
у якому X являє собою насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, або
R5 і R6 разом являють собою бівалентні радикали, у яких n становить 1-4,
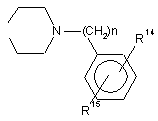 або
або 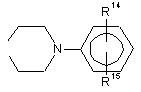 ,
,
R7-R13 незалежно одне від одного являють собою Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, феніл, бензил, або R7 і R8 разом, R10 і R11 разом, R12 і R13 разом являють собою лінійний або розгалужений аліфатичний бівалентний радикал, який містить 1-7 ланок у ланцюзі;
R14 і R15 незалежно одне від одного представляють, Н, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, F, Сl, Вr, NO2, NH2 або CF3.
2. Сполука формули І за п. 1, вибрана із групи, яка складається з:
A) 2-[4-(2-R14,5-R15-феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4Н-1,3-бензотіазин-4-ону, у якому R14 являє собою Н, a R15 являє собою F, Сl або Вr,
B) 2-[4-(3-R14,5-R15-феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у якому R14 являє собою Н, R15 являє собою F або Сl,
C) 2-[бензил(метил)аміно]-8-нітро-6-R2-4H-1,3-бензотіазин-4-ону, у якому R2 являє собою CF3, Cl або F,
D) 2-[бензил(R5)aмінo]-8-R1-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у якому R1 являє собою CF3, NO2, NHOH або NR7R8, a R5, R7 і R8 мають такі ж значення, які визначені в п. 1,
E) 6-R2-2-[метил(2-фенілетил)аміно]-8-нітро-4H-1,3-бензотіазин-4-ону, у якому R2 має таке ж значення, яке визначене в п. 1,
F) 6-трифторметил-2-[метил(2-фенілетіл)аміно]-8-R1-4H-1,3-бензотіазин-4-ону, у якому R1 має таке ж значення, яке визначене в п. 1,
G) 2-[4-(2-R14,6-R15-феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у якому R14 і R15 мають такі ж значення, які визначені в п. 1,
Н) 2-[бензил(R5)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у якому R5 має таке ж значення, яке визначене в п. 1,
І) 2-[бензил(R5)аміно]-8-нітро-6-R2-4H-1,3-бензотіазин-4-ону, у якому R2 і R5 мають такі ж значення, які визначені в п. 1,
J) 2-[бензил(R5)аміно]-8-нітро-6-хлоро-4H-1,3-бензотіазин-4-ону, у якому R5 має таке ж значення, яке визначене в п. 1,
K) 2-[бензил(R5)аміно]-8-нітро-6-фторо-4H-1,3-бензотіазин-4-ону, у якому R5 має таке ж значення, яке визначене в п. 1.
3. Сполука формули (І) за п. 1, вибрана із групи, яка складається з:
2-{метил[(1R)-1-фенілетил]аміно}-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
2-[4-(4-хлорфеніл)піперазин-1-іл]-6,8-динітро-4H-1,3-бензотіазин-4-ону,
2-[4-(5-хлор-2-метилфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
8-нітро-6-(трифторметил)-2-{4-[3-(трифторметил)феніл]піперазин-1-іл}-4H-1,3-бензотіазин-4-ону,
2-[бензил(етил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
2-[бензил(метил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
2-[4-(2-фторфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
2-(4-(бензилпіперазин-1-іл)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
2-(бензиламіно)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону,
2-[бензил(метил)аміно]-6-хлор-8-нітро-4H-1,3-бензотіазин-4-ону,
або її сіль.
4. Застосування сполуки формули (І) або її солі за будь-яким з пунктів 1-3 для одержання фармацевтичної композиції.
5. Застосування сполуки формули (І) або її солі за будь-яким з пунктів 1-3 для одержання лікарського засобу для терапевтичного або профілактичного лікування мікробної інфекції у ссавців.
6. Застосування за п. 5, де мікробною інфекцією ссавців є туберкульозна або гансеніозна інфекція.
7. Фармацевтична композиція, яка містить сполуку за будь-яким з пунктів 1-3.
8. Застосування сполуки за будь-яким з пунктів 1-3 або її солі у способі терапевтичного або профілактичного лікування мікробної інфекції у ссавців.
9. Застосування сполуки за будь-яким з пунктів 1-3 або її солі у способі терапевтичного або профілактичного лікування туберкульозної або гансеніозної інфекції у ссавців.
10. Спосіб одержання 2-NR5R6-4H-1,3-бензотіазин-4-онів формули І за п. 1, при якому проводять реакцію 2-хлорбензкарбоксамідів з 1,1-2,5-кратним надлишком солей металів алкілксантогенатів при температурі 20-100 °C у розчиннику та наступну обробку одержаного 2-алкокси-4Н-1,3-бензотіазин-4-ону аміном HNR5R6 у розчиннику при температурі 20-100 °C.
Текст
Реферат: Даний винахід стосується антимікробних сполук, їх синтезу і їх застосування для лікування інфекцій у ссавців. Даний винахід націлений на одержання сполук із активністю стосовно мікобактерій як потенційних лікарських засобів для лікування туберкульозу, для того, щоб подолати проблеми, які стосуються резистентності й непереносимості ліків. 1 2 Дане завдання вирішене за допомогою забезпечення сполук формули І, у якій R і R 7 8 9 9 10 11 незалежно одне від одного являють собою NO2, NR R , NHOR , COOR , CN, CONR R , CHO, 12 13 3 4 F, Cl, Br, SO2NR R , нижчу алкоксильну групу, OCF3, моно-, ди- або трифторметил; R і R незалежно одне від одного являють собою Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, який містить 1-3 ланки у ланцюзі, F, Сl, Вr, нижчу 5 алкоксильну групу; R являє собою Н, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-7 ланок у 6 ланцюзі; R являє собою радикал, у якому X являє собою насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який 5 6 містить 1-5 ланок у ланцюзі, або R і R разом являють собою бівалентні радикали, у яких n 7 13 становить 1-4; R -R незалежно одне від одного являють собою Н або насичений або UA 99300 C2 (12) UA 99300 C2 ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний 7 8 10 11 12 радикал, який містить 1-5 ланок у ланцюзі, феніл, бензил, або R і R разом, R і R разом, R 13 і R разом являють собою лінійний або розгалужений аліфатичний бівалентний радикал, який 14 15 містить 1-7 ланок у ланцюзі; R і R незалежно одне від одного представляють, Н, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, F, Cl, Br, NO2, NH2, CF3. UA 99300 C2 5 10 15 20 25 30 35 40 Даний винахід стосується нових бензотіазинових похідних і їх застосування, як антибактеріальних агентів у лікуванні інфекційних захворювань у ссавців (людей і тварин), викликаних бактеріями, особливо захворювань подібних до туберкульозу (ТБ) і гансеніозу, викликаних мікобактеріями. Тіазінон, його похідні і його застосування як антибактеріальних агентів, особливо проти мікобактерій (ТБ), розкрите для загального користування, наприклад в AR 242567 A1, AU 3704400 A1, CA 1322551 C1 або EP 0245901 B1. Як відомо, існує загрозливе всесвітнє збільшення туберкульозних інфекцій, пов'язаних з мікобактеріями, які виробили резистентність до доступних на даний момент терапіям (B.R.Bloom, J.L.Murray, Tuberculosis: commentary on a reemergent killer. Science 1992, 257, 10551064). Надзвичайно небезпечним є розвиток мультирезистентних (МР) мікобактерій. Існують мікобактерії, резистентні, щонайменше, до двох із самих активних лікарських засобів для лікування туберкульозу, ізоніазиду й рифампіцину, а також до стрептоміцину, піразинаміду й етамбутолу. Частка МР-ТБ у деяких країнах уже більше 20 %. Ситуація стала ще більш загрозливою з тих пір як торік у Південній Африці були діагностовані перші випадки ТБ із широкою лікарською резистентністю (надзвичайно резистентного ТБ). У цей час ТБ із широкою лікарською резистентністю вже поширився по всіх континентах. Мікобактерії, що викликають ТБ із широкою лікарською резистентністю, є резистентними до першої лінії лікарських засобів для лікування ТБ, Рифампіцину, Ізоніазиду, Піразинаміду, Етамбутолу й, крім того, до хінолонів і аміноглікозидів другої лінії. (Nature Med. 2007, 13, 295-298) Поряд зі збільшенням кількості захворювань ТБ повсюдно, це викликає близько 2000000 смертей щорічно по всьому світі. Для лікування таких захворювань, як (ТБ) або гансеніоз, існує гостра необхідність у нових лікарських засобах з новими механізмами дії, особливо з метою подолання резистентності до лікарського засобу й подолання відомих драматичних побічних ефектів існуючих лікарських засобів. Метою даного винаходу є одержання нових сполук, що мають активність стосовно мікобактерій, як потенційно нові лікарські засоби для лікування туберкульозу, для того щоб перебороти проблеми, що стосуються резистентності й непереносимості ліків. Дана мета досягається забезпеченням сполук формули I , 1 2 7 8 9 9 у якій R і R незалежно одне від одного являють собою NO2, NR R , NHOR , COOR , CN, 10 11 12 13 CONR R , CHO, F, Cl, Br, SO2NR R , нижчу алкоксильну групу, OCF3, моно-, ди- або трифторметил; 3 4 R і R незалежно одне від одного являють собою H, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, який містить 1-3 ланок у ланцюзі, F, Cl, Br, нижчу алкоксильну групу; 5 R являє собою H, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-7 ланок у ланцюзі; 6 R являє собою радикал: , у якому X являє собою насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, або 5 6 R і R разом являють собою бівалентні радикали, у яких n становить 1-4: 1 UA 99300 C2 5 10 15 20 25 30 35 40 45 , 7 13 R -R незалежно одне від одного являють собою H або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який 7 8 10 11 12 13 містить 1-5 ланок у ланцюгуи, феніл, бензил, або R і R разом, R і R разом, R і R разом являють собою лінійний або розгалужений аліфатичний бівалентний радикал, який містить 1-7 ланок у ланцюзі; 14 15 R і R незалежно одне від одного представляють, H, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, F, Cl, Br, NO2, NH2, CF3. У переважному варіанті здійснення даний винахід стосується сполук формули (I), вибраних із групи, яка складається з: 14 15 2-[4-(2-R ,5-R -феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 14 15 2-[4-(2-R ,6-R -феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 14 15 2-[4-(3-R ,5-R -феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2 2-[бензил(метил)аміно]-8-нітро-6-R -4H-1,3-бензотіазин-4-ону, 5 2-[бензил(R )аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 5 2 2-[бензил(R )аміно]-8-нітро-6-R -4H-1,3-бензотіазин-4-ону, 5 2-[бензил(R )аміно]-8-нітро-6-хлор-4H-1,3-бензотіазин-4-ону, 5 2-[бензил(R )аміно]-8-нітро-6-фтор-4H-1,3-бензотіазин-4-ону, 5 1 2-[бензил(R )аміно]-8-R -6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 1 5 14 15 у які R , R , R і R мають вище згадані значення. Ще конкретніше даний винахід має відношення, щонайменше, до одної сполуки, вибрану із групи, яка складається з: 2-[4-(4-хлорфеніл) піперазин-1-іл]-6,8-динітро-4H-1,3-бензотіазин-4-ону, 2-[4-(5-хлор-2-метилфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4ону, 8-нітро-6-(трифторметил)-2-{4-[3-(трифторметил)феніл]піперазин-1-іл}-4H-1,3-бензотіазин-4ону, 2-[бензил(етил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[бензил(метил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[4-(2-фторфеніл)піперазин-1-іл]-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-(4-бензилпіперазин-1-іл)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-(бензиламіно)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-{метил[(1R)-1-фенілетил]аміно}-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[бензил(метил)аміно]-6-хлор-8-нітро-4H-1,3-бензотіазин-4-ону. Автори винаходу застосовували 4 різних способи синтезу знову відкритих і нових похідних 1,3-бензотіазин-4-ону. Способи A, B і C припускають застосування як вихідної речовини добре відомих полізаміщених 2-хлор(бром)-бензкарбоксамідів, багато які з яких описані в літературі або їх можна легко одержати за допомогою аналогічних способів (Isaew S. G. Farm. Zh. (Kiev), 2000, 52; Makosza M., Nizamov S. Org. Prep, and Proced. Int., 1997, 29, 707; Nerin C, Tornes A. R., Domento C, Cacho J. J. Agr. and Food Chem., 1996, 44, 4009; Thiel W., Mayer R., Jauer E.-A., Modrow H., Dost H. J. Prakt. Chem., 1986, 328, 497; Yokoyama M., Yoshida S., Imamoto T. Synthesis, 1982, 591; Romanowski J., Eckstein Z. Pol. J. Chem., 1984, 58, 263; Nisato D., Sacilotto R., Frigerio M., Boveri S., Palmisano G., Lesma G. Org. Prep. Proced. Int., 1985, 17, 75; Oikawa N., Nakagawa Y., Nishimura K., Ueno T., Fujita T., Pestic. Sci, 1994, 41, 139; Welch D.E., Baron R.R., J. Med. Chem., 1969, 12, 299; Fuller R. W., Molloy B.B., Day W.A., Roush B.W., March M.M., J. Med. Chem., 1973, 16, 101 і багато хто інші). 2 UA 99300 C2 5 10 15 20 Спосіб A Вихідні 2-хлорбензкарбоксаміди обробляли 1,0-1,2 еквімолярною кількістю солей металів дитіокарбаматів у спиртах, ацетоні або в їхній суміші при 0-50C протягом періоду часу від близько чверті години до близько 24 годин. Переважно, дану реакцію проводять у спирті при кімнатній температурі. Дану реакційну суміш розбавляли водою, і відфільтровували твердий 2дитіокарбамоілбензкарбоксамід. На наступній стадії можна застосовувати неочищений продукт або можна перекристалізувати його з придатного органічного розчинника. 2дитіокарбамоілбензкарбоксамід обробляли слабкою основою (наприклад Na 2HPO4, NaHCO3, Na2CO3, і т.д.) у воді, спиртах або в суміші вода/спирт при температурі 50-100C протягом 2-36 годин. Переважно, дану реакцію проводять у суміші вода/спирт при 50-75 °C протягом близько 24 годин. Після завершення реакції 2-заміщений-4H-1,3-бензотіазин-4-ону одержують за допомогою загальноприйнятих процедур одержання, наприклад тритурації з етилацетатом або розведення водою, фільтрації й перекристалізації з придатного органічного розчинника. Спосіб B Даний спосіб припускає застосовувати надлишку дитіокарбамату металу як слабкої основи в бензотіазіноновій циклізації й не виділяти 2-дитіокарбамоілбензкарбоксамід. Таким чином, вихідні 2-хлорбензкарбоксаміди можна обробляти 1,2-2,5 еквімолярною кількістю солей металів дитіокарбаматів у спиртах, ацетоні або в їхній суміші при 20-80 °C протягом періоду близько 336 годин. Переважно, дану реакцію проводять у спирті або в суміші вода/спирт при 50-75 °C протягом близько 24 годин. Цільовий заміщений-4H-1,3-бензотіазин-4-ону одержують за допомогою загальноприйнятих процедур одержання зі Способу A. Спосіб C 3 UA 99300 C2 5 10 15 20 25 30 35 40 45 Спосіб C Даний спосіб застосовує як вихідну речовину 2-хлорбензолкарбоксаміди. Дані сполуки обробляли 1,1-2,0-кратним надлишком солей металів алкілксантогенату, наприклад комерційно доступним етилксантогенатом калію, при температурі 20-100C у різних спиртах, ацетоні, ацетонітрилі або інших придатних органічних розчинниках, протягом періоду часу від близько півгодини до близько 24 годин. Переважно, дану реакцію проводять у спирті при кімнатній температурі протягом близько 24 годин. Виділений 2-алкокси-4H-1,3-бензотіазин-4-ону 5 6 обробляли відповідним аміном HNR R в оцтовій кислоті, спиртах, етилацетаті, ДМФА, ацетоні або ацетонітрилі протягом періоду часу аж до 48 годин для повної заміни алкоксильної групи на відповідний амін. Після завершення цього процесу одержану реакційну суміш можна 5 6випарювати й розбавляти водою або її можна відразу розбавляти водою. Цільовий 2-NR R 4H1,3-бензотіазин-4-ону одержували за допомогою стандартних процедур виділення, наприклад фільтрації й перекристалізації з придатного органічного розчинника. Спосіб D Також застосуємо класичний спосіб синтезу 1,3-бензотіазин-4-ону за допомогою застосування реакції тіоціонатних солей з 2-хлорарилхлорангідридом і наступної обробки реакційної маси відповідним аміном. Даний спосіб добре описаний у науковій літературі, наприклад: J. Imrich, P. Kristian, Coll. Czech. Chem. Commun., 1982, 47, 3268-3282; D. Koscik, P. Kristian, J. Gonda, E. Dandarova, Coll. Czech. Chem. Commun., 1983, 48, 3315-3328; D. Koscik, P. Kristian, O. Forgac, Coll. Czech. Chem. Commun., 1983, 48, 3427-3432; T. H. Cronin, H.-J. E. Hess, Пат. US 3522247. Як не дивно, сполуки даного винаходу проявляють сильну антибактеріальну активність, особливо стосовно мікобактерій з мінімальними пригнічуючими концентраціями (МПК) у діапазоні 0,000012-0,78 мкг/мл для швидко зростаючих мікобактерій, 0,39-3,12 мкг/мл для M. tuberculosis, у тому числі мультирезистентних штамів, визначеними за допомогою класичного способу, і 2,0-50,0 нг/мл для M. tuberculosis H37Rv, визначеними за допомогою способу із застосуванням барвника Alamar Blue. Як не дивно, сполуки даного винаходу демонструють високий рівень селективності стосовно мікобактерій, що лише драматично зменшує можливість несприятливих побічних ефектів. Сполуки даного винаходу є немутагенними при 5 мг/мл в SOS-Хромотесті (M.Isidori, M. Lavorgna, A.Nardelli, L.Pascarella, A. Parella, Sci. Total Environ., 2005, 346, 87-98; M. Bombardier, N. Bermingham, R. Legault, A. Fouquet, Chemosphere, 2001, 42, 931-44; D.A. Widdick, D.I. Edwards, Mutat. Res., 1991, 259, 89-93). Таким чином, сполуки даного винаходу застосовуються для лікування туберкульозних інфекцій і інших мікобактеріальних інфекцій у людей і у тварин. Відповідно, даний винахід стосується фармацевтичних композицій, що містять сполуки формули I. Крім того, даний винахід стосується сполуки формули I для застосування в способі лікування бактеріальної інфекції в ссавців. Переважними сполуками формули I для застосування в подібному способі є сполуки, спеціально перераховані вище. Сполуки даного винаходу формулюють для застосування за допомогою одержання розведеного розчину або суспензії у фармацевтично прийнятному водному, органічному або водно-органічному середовищі для місцевого або парентерального введення за допомогою внутрішньовенної, підшкірної або внутрішньом'язової ін'єкції, або для інтраназального застосування; або одержують у формі таблетки, капсули або водної суспензії із 4 UA 99300 C2 5 10 15 20 25 30 35 40 45 50 55 загальноприйнятими допоміжними речовинами для перорального введення або у вигляді супозиторію. Дані сполуки можна застосовувати в дозах від 0,001-1000 мг/кг маси тіла. Приклади, які випливають нижче в наступній експериментальній частині, служать для ілюстрації даного винаходу, але не повинні бути витлумачені як його обмеження. Структури сполук даного винаходу були встановлені способами синтезу й елементним аналізом, і за допомогою спектрів ядерного магнітного резонансу й мас-спектрів. Вихідні речовини Хімічні речовини й розчинники були придбані в компанії Alfa-Aesar (GB) або Aldrich Co. (Sigma-Aldrich Cпівтемпература плавленняаny, St-Louis, US) і застосовувалися в синтезі без додаткового очищення. Температури плавлення визначали відповідно до процедури Британського фармацевтичного кодексу (BP) і не коректувалися (Electrothermal 9001, GB). Якщо аналізи виражаються тільки символами елементів, то результати аналізу попадають у межі 0,3 % теоретичних значень (Carlo-Erba 5500, Italy). ЯМР спектри реєстрували за допомогою 1 установки Varian Unity Plus 400 (США). Зрушення в H ЯМР представляють в ppm убік слабкого поля відносно тетраметилсілану (ТМС) (). Мас-спектри одержували за допомогою установки Finnigan SSQ-700 (США) із прямою інжекцією. Реакції й чистоту сполук контролювали за допомогою ТСХ, застосовуючи алюмінієві пластини із Силікагелем 60 F 254 (Merck Co, Germany). Приклад 1 2-[4-(4-хлорфеніл)піперазин-1-іл]-6,8-динітро-4H-1,3-бензотіазин-4-он, (сполуки 1) 0,5 г 2-хлор-3,5-динітробензкарбоксаміду розчиняли в 25 мл етанол. Одержану реакційну суміш обробляли 0,39 г дигідратом натрієвої солі 4-(4-хлорфеніл)-піперазиндитіокарбамату й залишали на 6 год. при кімнатній температурі. Одержану реакційну суміш доливали до 50 мл охолодженої води й жовтий осад, що вийшов, відфільтровували. Чистий кінцевий продукт одержували після перекристалізації з етанолу. 2-Амінокарбоніл-4,6-динітрофеніл-4-(4хлорфеніл)піперазин-1-карбодитіоат являє собою ясно-жовту кристалічно тверду речовину. + Вихід 68 %. Температура плавлення 178-180C. MС m/z 481 (M ). Аналітично розраховано для C18H16ClN5O5S2: C, 44,86; H, 3,35; N, 14,53; S, 13,31 Одержано: C, 44,71; H, 3,36; N, 14,62; S, 13,35 0,5 г 2-амінокарбоніл-4,6-динітрофеніл-4-(4-хлорфеніл)піперазин-1-карбодитіоату розчиняли в 25 мл етанолу. Одержану реакційну суміш обробляли 0,2 г Na 2HPO4 12H2O і кип'ятили зі зворотним холодильником протягом 6 год. Реакційну суміш прохолоджували в холодильнику, і ясно-жовтий осад, що вийшов, відфільтровували й промивали 50 мл води й 30 мл метанолу. Чистий кінцевий продукт одержували після перекристалізації двічі з етанолу. 2-(l, 4-2-[4-(4Хлорфеніл)піперазин-1-іл]-6,8-динітро-4H-1,3-бензотіазин-4-он являє собою ясно-жовту кристалічну тверду речовину. Вихід 38 %. Температура плавлення 279-281 °C (EtOH) + MС m/z 447 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 9,08 і 8,95 (два 1H, два с, 2CH), 6,88 і 6,71 (два 2H, д, C 6H4Cl), 3,68 і 3,30 (два 4H, м, N(CH2CH2)2N) год./млн. Аналітично розраховано для C18H14ClN5O5S: C, 48,27; H, 3,15; N, 15,04; S, 7,16 Одержано: C, 48,34; H, 3,22; N, 14,97; S, 7,23 Приклад 2 2-[4-(5-хлор-2-метилфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-он, (сполука 2) Дотримуючись процедури Приклада 1, застосовуючи 2-хлор-3-нітро-5трифторметилбензкарбоксамід як вихідну речовину. Ясно-жовта кристалічна тверда речовина. Вихід 44 %. Температура плавлення 158-161 °C (ДМФА/вода) + MС m/z 484 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 8,80 і 8,77 (два 1H, два с, 2CH), 7,32 (1H, с, CH), 9,95 і 6,73 (два 1H, д, два CH), 3,65 і 3,29 (два 4H, м, N(CH2CH2)2N), 2,29 (3H, с, CH3) год./млн. Аналітично розраховано для C20H16ClF3N4O3S: C, 49,54; H, 3,33; N, 11,55; S, 6,61 Одержано: C, 49,45; H, 3,40; N, 11,47; S, 6,83 Приклад 3 8-Нітро-6-(трифторметил)-2-{4-[3-(трифторметил)феніл]піперазин-1-іл}-4H-1,3-бензотіазин-4он, (сполука 3) Дотримуючись процедури Приклада 1, застосовуючи 2-хлор-3-нітро-5трифторметилбензкарбоксамід як вихідну речовину. Ясно-жовта кристалічна тверда речовина. Вихід 33 %. Температура плавлення 201-203 °C (EtOH). + MС m/z 504 (M ). 5 UA 99300 C2 H ЯМР (ДМСО-d6/CDCl3) 8,80 і 8,77 (два 1H, два с, 2CH), 7,61 (1H, с, CH), 7,39 і 7,03 (два 1H, д, два CH), 3,66 і 3,31 (два 4H, м, N(CH2CH2)2N) год./млн. Аналітично розраховано для C20H14F6N4O3S: C, 47,62; H, 2,80; N, 11,11; S, 6,36 Одержано: C, 47,74; H, 2,91; N, 11,29; S, 6,53 Приклад 4 2-[Бензил(етил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, (сполука 4) Суспензію 1,2 г 2-хлор-3-аміно-5-трифторметилбензкарбоксаміду в 45 мл етанолу обробляли 2,0 г дигідрату натрієвої солі бензил(етил)дитіокарбамату й кип'ятили зі зворотним холодильником протягом 14 год. Темно-червону реакційну суміш розбавляли 70 мл води, прохолоджували в холодильнику протягом 6 годин, що вийшов ясно-жовтий осад відфільтровували й промивали 50 мл ефіру. Чистий кінцевий продукт одержували після колоночної хроматографії (гексан/ацетон 3:1). 2-[Бензил(етил)аміно]-8-нітро-6-(трифторметил)4H-1,3-бензотіазин-4-он являє собою ясно-жовту кристалічну тверду речовину. Вихід 40 %. Температура плавлення 94-97 °C. + MС m/z 409 (M ). 1H ЯМР (ДМСОd6/CDCl3) 8,80 і 8,77 (два 1H, два с, 2CH), 7,41-7,25 (5H, м, C6H5), 4,62 (2H, з, CH2), 3,43 (2H, кв., CH2), 1,01 (3H, т, CH3) год./млн. Аналітично розраховано для C18H14F3N3O3S: C, 52,81; H, 3,45; N, 10,26; S, 7,83 Одержано: C, 52,73; H, 3,38; N, 10,44; S, 7,89 Приклад 5 2-[Бензил(метил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-он, (сполука 5) Дотримуючись процедури Приклада 4. Ясно-жовта кристалічна тверда речовина. Вихід 47 %. Температура плавлення 120-124 °C (EtOH/вода). + MС m/z 395 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 8,81 і 8,77 (два 1H, два с, 2CH), 7,40-7,25 (5H, м, C6H5), 4,64 (2H, с, CH2), 2,87 (3H, с, CH3) год./млн. Аналітично розраховано для C17H12F3N3O3S: C, 51,64; H, 3,06; N, 10,63; S, 8,11 Одержано: C, 51,76; H, 3,13; N, 10,41; S, 8,34 Приклад 6 2-[4-(2-Фторфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-он, (сполука 6) Дотримуючись процедури Приклада 1. Ясно-жовта кристалічна тверда речовина. Вихід 37 %. Температура плавлення 164-168C (i-PrOH). + MС m/z 454 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 8,81 і 8,77 (два 1H, два с, 2CH), 6,76 (3H, м, 3CH), 6,11 (1H, м, CH), 3,68 і 3,30 (два 4H, м, N(CH2CH2)2N)год./млн. Аналітично розраховано для C19H14F4N4O3S: C, 50,22; H, 3,11; N, 12,33; S, 7,06 Одержано: C, 50,08; H, 3,21; N, 12,46; S, 7,09 Приклад 7 2-(4-Бензилпіперазин-1-іл)-8-нітро-6-трифторметил)-4H-1,3-бензотіазин-4-он, (сполука 7) Дотримуючись процедури Приклада 4. Ясно-жовта кристалічна тверда речовина. Вихід 51 %. Температура плавлення 161-163 °C (EtOH/ДМФА). + MС m/z 450 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 8,80 і 8,76 (два 1H, два с, 2CH), 7,19-7,28 (5H, м, Ph), 3,48 (2H, с, CH2), 3,38 і 3,09 (два 4H, м, N(CH2CH2)2N) год./млн. Аналітично розраховано для C17H18N4O7S: C, 53,33; H, 3,80; N, 12,44; S, 7,12 Одержано: C, 53,29; H, 4,01; N, 12,48; S, 7,06 Приклад 8 2-(Бензиламіно)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-он, (сполука 8) Суспензію 2,5 г 2-хлор-3-нітро-5-трифторметилбензкарбоксаміду в 25 мл етанолу обробляли 1,75 г етилксантогенату натрію й залишали на 24 год. при кімнатній температурі. Одержану реакційну суміш доливали до 50 мл охолодженої води й жовтий осад, що вийшов, відфільтровували. Чистий 2-етокси-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-он одержували після перекристалізації із суміші етанол/вода у вигляді білої кристалічної твердої речовини. Вихід 58 %. Температура плавлення 146-148 °C. + MС m/z 320 (M ). Аналітично розраховано для C11H7F3N2O4S: C, 41,26; H, 2,20; N, 8,75; S, 10,01 Одержано: C, 41,34; H, 2,22; N, 8,87; S, 10,27 Розчин 0,7 г 2-етокси-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону в 15 мл оцтової кислоти обробляли 0,4 мл бензиламіну й кип'ятили зі зворотним холодильником протягом 14 1 5 10 15 20 25 30 35 40 45 50 55 60 6 UA 99300 C2 5 10 15 20 25 30 35 40 год. Одержану реакційну суміш випарювали й залишок обробляли 10 мл води, жовтий осад відфільтровували й промивали 50 мл води. Чистий кінцевий продукт одержували після перекристалізації двічі із суміші етанол/ДМФА. 2-(Бензиламіно)-8-нітро-6-(трифторметил)-4H1,3-бензотіазин-4-он являє собою ясно-жовту кристалічну тверду речовину. Вихід 73 %. Температура плавлення 192-194 °C. + MС m/z 381 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) δ 9,27 (1H, ушир. с, NH), 8,80 і 8,75 (два 1H, два с, 2CH), 7,74-7,49 (5H, м, Ph), 4,49 (2H, с, CH2) год./млн. Аналітично розраховано для C16H10F3N3O3S: C5 50,39; H, 2,64; N, 11,02; S, 8,41 Одержано: C, 50,42; H, 2,61; N, 10,89; S, 8,64 Приклад 9 2-(Метил[(1R)-1-фенілетил]аміно}-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-он, (сполука 9) Дотримуючись процедури Приклада 1. Ясно-жовта кристалічна тверда речовина. Вихід 54 %. Температура плавлення 110-113 °C (очищення за допомогою колоночної хроматографії ацетон/гексан 5:1). + MС m/z 409 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 8,82 і 8,76 (два 1H, два с, 2CH), 7,84, 7,43, 7,15 (5H, 3 м, Ph), 4,84 (H, м, CH), 3,07 (3H, с, NCH3), 1,39 (3H, д, CH3) год./млн. Аналітично розраховано для C18H14F3N3O3S: C, 52,81; H, 3,45; N, 10,26; S5 7,83 Одержано: C, 52,73; H, 3,46; N, 10,19; S, 7,92 Приклад 10 2-[Бензил(метил)аміно]-6-хлор-8-нітро-4H-1,3-бензотіазин-4-он, (сполука 10) Дотримуючись процедури Приклада 8. Ясно-жовта кристалічна тверда речовина. Вихід 64 %. Температура плавлення 138-141 °C (очищення за допомогою колоночної хроматографії ацетон/гексан 4:1). + MС m/z 361 (M ). 1 H ЯМР (ДМСО-d6/CDCl3) 8,37 і 8,23 (два 1H, два с, 2CH), 7,45-7,35 (5H, м, Ph), 4,62 (2H, 2, CH2), 2,87 (3H, з, CH3) год./млн. Аналітично розраховано для C16H12ClN3O3S: C, 53,11; H, 3,34; N, 11,61; S, 8,86 Одержано: C, 53,19; H, 3,30; N, 11,52; S, 8,89 Приклад 11 Визначення in vitro інгібітуючої активності сполук даного винаходу стосовно мікобактерій. Антибактеріальні активності даних сполук стосовно Mycobacterium smegmatis SG 987, M. aurum SB66, M. vaccae IMET 10670 і M. fortuitum B досліджували за допомогою визначення мінімальних гнітючих концентрацій (МПК) за допомогою способу бульйонного мікророзведення в середовищі Мюлера-Хінтона (Difco) відповідно до рекомендацій НККЛС (Національний комітет із клінічним лабораторним стандартам) [National Committee for Clinical Laboratory Standards: th Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; 5 Ed.; Villanova, Ed.; Approved standard Document M7-A5. NCCLS, (2000)]. Одержані результати представлені в Таблиці 1. Таблиця 1 Антимікробна активність сполук формули I, визначена по мінімальних гнітючих концентраціях МПК [мкг/мл] Сполука 1 2 3 4 5 6 7 8 9 10 M. Smegmatis МПК [мкг/мл] 0,78 0,05 0,04 0,0062 0,0156 0,005 0,05 0,00078 0,0000121 0,0062 M. vaccae МПК [мкг/мл] 0,0062 0,008 0,0031 0,0008 0,0005 0,005 0,05 0,0000121 0,0000121 0,00031 7 M. fortuitum МПК [мкг/мл] 0,78 0,031 0,0031 0,0062 0,0156 0,005 0,05 0,00078 0,0000121 0,00156 UA 99300 C2 5 10 15 20 Приклад 12 Активність стосовно M. tuberculosis H37Rv досліджували за допомогою нижче описаного способу для визначення мінімальних гнітючих концентрацій (МПК) і мінімальних бактерицидних концентрацій (МБК): Штами інокулювали на твердому середовищі Левенштейна-Йенсена. Через 21 день вирослі 8 культури застосовували для одержання суспензії інокуляту, що відповідає 510 мікробних клітин/мл. В 0,2 мл пробірках одержану суспензію інокулювали в 2 мл рідкого середовища Школьнікової, що містить відповідні концентрації досліджуваних сполук - від 100,0 до 0,195 мкг/мл, . Після 14 днів інкубації при 37 °C ці пробірки з рідким середовищем центрифугували протягом 15 хв при 3000 об/хв. Після видалення супернатанту одержаний осад ресуспендували в 0,8 мл стерильного розчину 0,9 % NaCl. 0,1 мл суспензії застосовували для готування мазків, які згодом були пофарбовані за способом Циль-Нільсена. Осад, який залишився, інокулювали в 0,2 мл обсягах у трьох пробірках у твердому середовищі Левенштейна-Йенсена, не утримуючого лікарського засобу, для того щоб визначити мінімальні бактерицидні концентрації (МБК). Одержані результати були зареєстровані після 21-28 днів культивації при 37 °C. Контрольними були пробірки, культивовані з досліджуваними штамами, неопрацьованими досліджуваними речовинами. Вважали, що мінімальною бактерицидною концентрацією лікарських засобів (МБК) є концентрація лікарського засобу, повністю інгібуючий ріст мікобактерій на твердому середовищі. Бактеріостатичний ефект (МПК) характеризувався наявністю в мазку лише одиничних мікобактерій і сильним зменшенням числа колоній, що виросли на твердому середовищі, у порівнянні з контрольними мазками. Одержані результати представлені в Таблиці 2. Таблиця 2 Антимікробна активність сполук формули I по відношенню до Mycobacterium tuberculosis H37Rv і клінічних ізолятів HSRE резистентного штаму й XTB штаму, визначена по мінімальних гнітючих концентраціях (МПК) і мінімальним бактерицидним концентраціям (МБК) Штам H37Rv HSRE резистентний X TB H37Rv HSRE резистентний X TB H37Rv HSRE резистентний X TB H37Rv HSRE резистентний X TB Сполука 5 8 10 Ізоніазид (INH) МБК (мкг/мл) 3,12 3,12 3,12 1,56 1,56 1,56 0,78 1,56 0,39 1,56 не активний не активний МПК (мкг/мл) 1,56 1,56 1,56 1,56 0,78 0,78 0,39 1,56 0,39 0,78 HSRE: мультирезистентний штам XTB: надзвичайно резистентний штам 25 30 Приклад 13 Активність стосовно M. tuberculosis H37Rv визначали також за допомогою аналізу, заснованого на відновленні резазуріну, (МПК96). Даний спосіб був докладно описаний в: P. Quillardet, O. Huisman, R. D'Ari, M. Hofnung, Proc. Natl. Acad. Sci USA, 1982, 79, 5971-5; J.C. Palomino, A. Martin, M. Camacho, H. Guerra, J. Swings, F. Portaels, Antimicrob. Agents Chemother., 2002, 46, 2720-2. Одержані результати представлені в Таблиці 3. 8 UA 99300 C2 Таблиця 3 Антимікобактеріальна активність сполук формули I, визначена по мінімальних пригнічуючих концентраціях (МПК) [нг/мл] Сполуки 4 5 8 9 10 INH M. tuberculosis H37Rv (нг/мл) 2 3 50 0,4 25 125 ФОРМУЛА ВИНАХОДУ 5 1. Сполука формули І R R 1 R 3 S 5 N R 6 N R 2 R 10 15 4 O , (І) або її сіль, 1 2 7 8 9 9 у якій R і R незалежно одне від одного являють собою NO2, NR R , NHOR , COOR , CN, 10 11 12 13 CONR R , CHO, F, Cl, Br, SO2NR R , нижчу алкоксильну групу, OCF3, моно-, ди- або трифторметил; 3 4 R і R незалежно одне від одного являють собою Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, який містить 1-3 ланки у ланцюзі, F, Сl, Вr, нижчу алкоксильну групу; 5 R являє собою Н, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-7 ланок у ланцюзі; 6 R являє собою радикал: R 15 X R 20 14 , у якому X являє собою насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, або 5 6 R і R разом являють собою бівалентні радикали, у яких n становить 1-4, N (CH2 )n R 14 R 14 N 25 15 15 R або , 7 13 R -R незалежно одне від одного являють собою Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, який 7 8 10 11 12 13 містить 1-5 ланок у ланцюзі, феніл, бензил, або R і R разом, R і R разом, R і R разом являють собою лінійний або розгалужений аліфатичний бівалентний радикал, який містить 1-7 ланок у ланцюзі; 14 15 R і R незалежно одне від одного представляють, Н, лінійний або розгалужений аліфатичний радикал, який містить 1-5 ланок у ланцюзі, F, Сl, Вr, NO2, NH2 або CF3. R 9 UA 99300 C2 5 10 15 20 25 30 35 40 45 50 2. Сполука формули І за п. 1, вибрана із групи, яка складається з: 14 15 A) 2-[4-(2-R ,5-R -феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4Н-1,3-бензотіазин-4-ону, у 14 15 якому R являє собою Н, a R являє собою F, Сl або Вr, 14 15 B) 2-[4-(3-R ,5-R -феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у 14 15 якому R являє собою Н, R являє собою F або Сl, 2 2 C) 2-[бензил(метил)аміно]-8-нітро-6-R -4H-1,3-бензотіазин-4-ону, у якому R являє собою CF3, Cl або F, 5 1 1 D) 2-[бензил(R )aмінo]-8-R -6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у якому R являє собою 7 8 5 7 8 CF3, NO2, NHOH або NR R , a R , R і R мають такі ж значення, які визначені в п. 1, 2 2 E) 6-R -2-[метил(2-фенілетил)аміно]-8-нітро-4H-1,3-бензотіазин-4-ону, у якому R має таке ж значення, яке визначене в п. 1, 1 1 F) 6-трифторметил-2-[метил(2-фенілетіл)аміно]-8-R -4H-1,3-бензотіазин-4-ону, у якому R має таке ж значення, яке визначене в п. 1, 14 15 G) 2-[4-(2-R ,6-R -феніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у 14 15 якому R і R мають такі ж значення, які визначені в п. 1, 5 5 Н) 2-[бензил(R )аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, у якому R має таке ж значення, яке визначене в п. 1, 5 2 2 5 І) 2-[бензил(R )аміно]-8-нітро-6-R -4H-1,3-бензотіазин-4-ону, у якому R і R мають такі ж значення, які визначені в п. 1, 5 5 J) 2-[бензил(R )аміно]-8-нітро-6-хлоро-4H-1,3-бензотіазин-4-ону, у якому R має таке ж значення, яке визначене в п. 1, 5 5 K) 2-[бензил(R )аміно]-8-нітро-6-фторо-4H-1,3-бензотіазин-4-ону, у якому R має таке ж значення, яке визначене в п. 1. 3. Сполука формули (І) за п. 1, вибрана із групи, яка складається з: 2-{метил[(1R)-1-фенілетил]аміно}-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[4-(4-хлорфеніл)піперазин-1-іл]-6,8-динітро-4H-1,3-бензотіазин-4-ону, 2-[4-(5-хлор-2-метилфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 8-нітро-6-(трифторметил)-2-{4-[3-(трифторметил)феніл]піперазин-1-іл}-4H-1,3-бензотіазин-4ону, 2-[бензил(етил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[бензил(метил)аміно]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[4-(2-фторфеніл)піперазин-1-іл]-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-(4-(бензилпіперазин-1-іл)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-(бензиламіно)-8-нітро-6-(трифторметил)-4H-1,3-бензотіазин-4-ону, 2-[бензил(метил)аміно]-6-хлор-8-нітро-4H-1,3-бензотіазин-4-ону, або її сіль. 4. Застосування сполуки формули (І) або її солі за будь-яким з пунктів 1-3 для одержання фармацевтичної композиції. 5. Застосування сполуки формули (І) або її солі за будь-яким з пунктів 1-3 для одержання лікарського засобу для терапевтичного або профілактичного лікування мікробної інфекції у ссавців. 6. Застосування за п. 5, де мікробною інфекцією ссавців є туберкульозна або гансеніозна інфекція. 7. Фармацевтична композиція, яка містить сполуку за будь-яким з пунктів 1-3. 8. Застосування сполуки за будь-яким з пунктів 1-3 або її солі у способі терапевтичного або профілактичного лікування мікробної інфекції у ссавців. 9. Застосування сполуки за будь-яким з пунктів 1-3 або її солі у способі терапевтичного або профілактичного лікування туберкульозної або гансеніозної інфекції у ссавців. 5 6 10. Спосіб одержання 2-NR R -4H-1,3-бензотіазин-4-онів формули І за п. 1, при якому проводять реакцію 2-хлорбензкарбоксамідів з 1,1-2,5-кратним надлишком солей металів алкілксантогенатів при температурі 20-100 °C у розчиннику та наступну обробку одержаного 25 6 алкокси-4Н-1,3-бензотіазин-4-ону аміном HNR R у розчиннику при температурі 20-100 °C. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Назва патенту англійськоюAntimicrobial compounds, their synthesis and their use for treatment of mammalian infections
Автори англійськоюMollmann, Ute, Makarov, Vadim, Stewart, N., Cole
Назва патенту російськоюАнтимикробные соединения, их синтез и применение для лечения инфекций у млекопитающих
Автори російськоюМелльманн Утэ, Макаров Вадим, Стюарт Т. Коул
МПК / Мітки
МПК: A61K 31/5415, C07D 279/08, A61P 31/08, A61P 31/06
Мітки: інфекцій, синтез, антимікробні, лікування, ссавців, сполуки, застосування
Код посилання
<a href="https://ua.patents.su/12-99300-antimikrobni-spoluki-kh-sintez-i-zastosuvannya-dlya-likuvannya-infekcijj-u-ssavciv.html" target="_blank" rel="follow" title="База патентів України">Антимікробні сполуки, їх синтез і застосування для лікування інфекцій у ссавців</a>
Попередній патент: Привідна система для прокатного стана, зокрема для пілігримового стана холодної прокатки
Наступний патент: Композиція для очищення води, її застосування та спосіб очищення води
Випадковий патент: Спосіб фінішної обробки напівпровідникових пластин












