Стабільний водний препарат антитіла в гістидинацетатному буфері
Номер патенту: 89798
Опубліковано: 10.03.2010
Автори: Гві Шіан Ц., Ліу Жунь, Шень Е, Анд'я Джеймс Д.
Формула / Реферат
1. Стабільний водний фармацевтичний препарат, який містить моноклональне антитіло в гістидинацетатному буфері, рН від 5,5 до 6,5, де моноклональне антитіло чутливе до дезамідування та агрегації і де препарат не ліофілізований і не піддавався попередній ліофілізації.
2. Препарат за п. 1, у якому значення рН дорівнює від 5,8 до 6,2.
3. Препарат за п. 1, у якому концентрація гістидинацетатного буфера дорівнює від приблизно 1 мМ до приблизно 200 мМ.
4. Препарат за п. 3, у якому концентрація гістидинацетатного буфера дорівнює від приблизно 10 мМ до приблизно 40 мМ.
5. Препарат за п. 1, у якому концентрація антитіла дорівнює від приблизно 10 мг/мл до приблизно 250 мг/мл.
6. Препарат за п. 5, у якому концентрація моноклонального антитіла дорівнює від приблизно 20 мг/мл до приблизно 40 мг/мл.
7. Препарат за п. 5, у якому концентрація моноклонального антитіла дорівнює від приблизно 80 мг/мл до приблизно 250 мг/мл.
8. Препарат за п. 1, що додатково містить сахарид.
9. Препарат за п. 8, у якому сахарид являє собою дисахарид.
10. Препарат за п. 8, у якому сахарид являє собою трегалозу.
11. Препарат за п. 8, у якому сахарид являє собою сахарозу.
12. Препарат за п. 8, у якому концентрація сахариду дорівнює від приблизно 10 мМ до приблизно 1 М.
13. Препарат за п. 12, у якому концентрація сахариду дорівнює від приблизно 60 мМ до приблизно 250 мМ.
14. Препарат за п. 1, який додатково містить поверхнево-активну речовину.
15. Препарат за п. 14, у якому поверхнево-активна речовина являє собою полісорбат.
16. Препарат за п. 15, у якому поверхнево-активна речовина являє собою полісорбат 20.
17. Препарат за п. 14, у якому концентрація поверхнево-активної речовини дорівнює від приблизно 0,0001 % до приблизно 1,0 %.
18. Препарат за п. 17, у якому концентрація поверхнево-активної речовини дорівнює від приблизно 0,01 % до приблизно 0,1 %.
19. Препарат за п. 1, у якому моноклональне антитіло являє собою повнорозмірне антитіло.
20. Препарат за п. 19, у якому моноклональне антитіло являє собою IgGl антитіло.
21. Препарат за п. 1, у якому моноклональне антитіло являє собою гуманізоване антитіло.
22. Препарат за п. 1, у якому моноклональне антитіло являє собою фрагмент антитіла, який містить антигензв'язувальну ділянку.
23. Препарат за п. 22, у якому фрагмент антитіла являє собою Fab або F(ab')2 фрагмент.
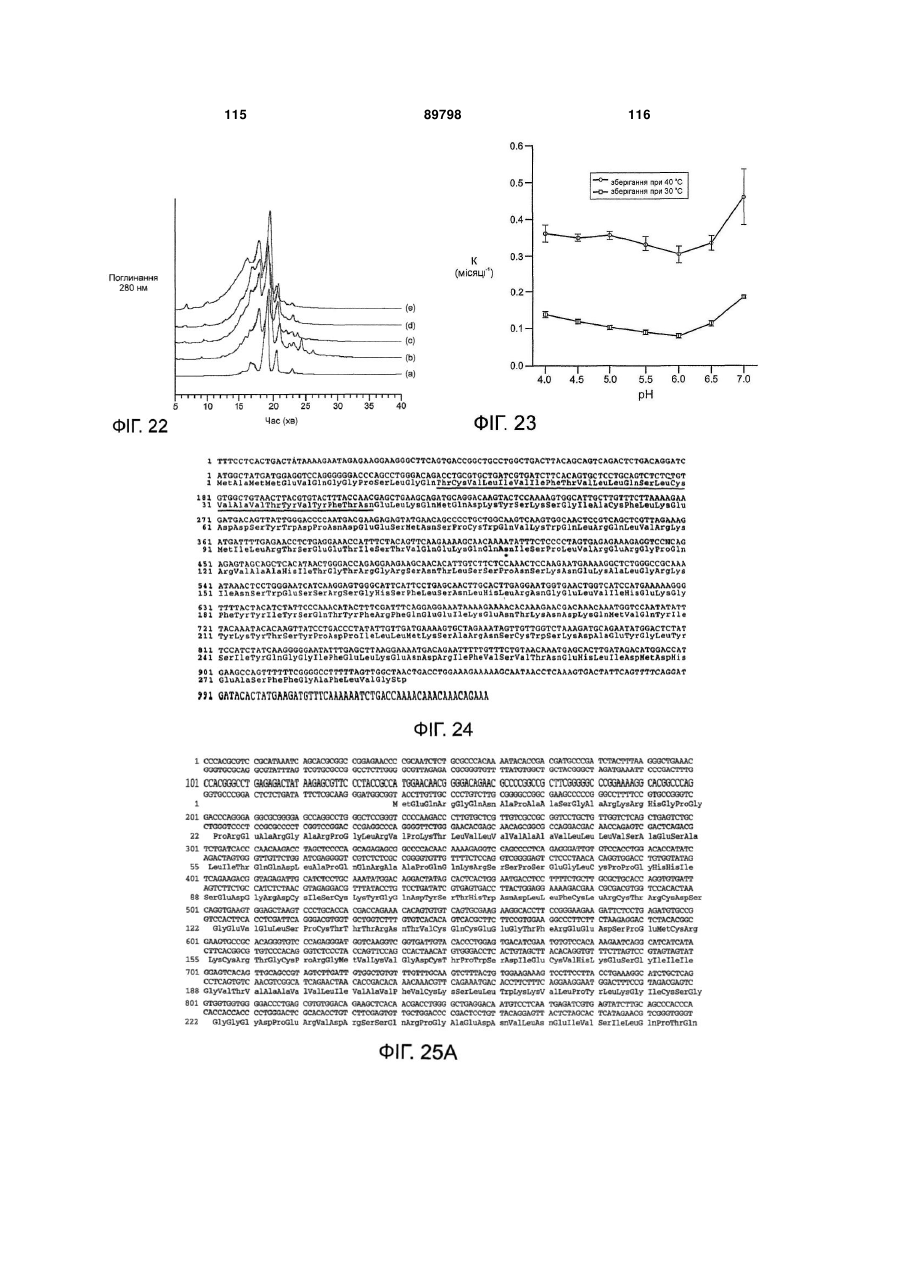
24. Препарат за п. 1, який є стерильним.
25. Препарат за п. 1, у якому моноклональне антитіло зв'язується з антигеном, вибраним із групи, яка включає HER2, CD20, DR5, BR3, IgE та VEGF.
26. Препарат за п. 25, у якому антиген являє собою CD20 і моноклональне антитіло являє собою гуманізоване 2Н7.
27. Препарат за п. 25, у якому антиген являє собою VEGF і моноклональне антитіло являє собою Бевацизумаб.
28. Препарат за п. 1, який є стабільним при зберіганні приблизно при 40 °С принаймні протягом 4 тижнів.
29. Препарат за п. 1, який є стабільним при зберіганні приблизно при 5 °C або приблизно 15 °С принаймні протягом 3 місяців.
30. Препарат за п. 1, який є стабільним при зберіганні приблизно при -20 °С принаймні протягом 3 місяців.
31. Препарат за п. 1, який є стабільним при заморожуванні й відтаванні.
32. Препарат за п. 1, який призначений для внутрішньовенного (в/в), підшкірного (п/ш) або внутрішньом'язового (в/м) введення.
33. Препарат за п. 32, який призначений для в/в введення й концентрація антитіла дорівнює від приблизно 20 мг/мл до приблизно 40 мг/мл.
34. Препарат за п. 32, який призначений для п/ш введення й концентрація антитіла дорівнює від приблизно 80 мг/мл до приблизно 250 мг/мл.
35. Флакон із пробкою, яка проколюється шприцом, який містить препарат за пунктом 1 всередині флакона.
36. Флакон за п. 35, який зберігають приблизно при 2-8 °С.
37. Флакон за п. 35, який являє собою флакон об'ємом 20 см3 або 50 см3.
38. Ємність із нержавіючої сталі, яка містить препарат за п. 1 всередині ємності.
39. Ємність за п. 38, у якій препарат заморожений.
40. Препарат за п. 1 для застосування в способі лікування захворювання або розладу у пацієнта, де спосіб включає введення препарату пацієнтові у кількості, ефективній для лікування захворювання або розладу.
41. Водний фармацевтичний препарат, який містить:
(а) повнорозмірне IgGl антитіло, чутливе до дезамідування і агрегації у кількості від приблизно 10 мг/мл до приблизно 250 мг/мл;
(б) гістидинацетатний буфер, рН від 5,5 до 6,5;
(в) сахарид, вибраний із групи, яка включає трегалозу і сахарозу, у кількості від приблизно 60 мМ до приблизно 250 мМ; і
(г) полісорбат 20 у кількості від приблизно 0,01 % до приблизно 0,1%, де препарат не ліофілізований і не піддавався попередній ліофілізації.
42. Спосіб зменшення дезамідування та агрегації терапевтичного моноклонального антитіла, який передбачає приготування антитіла у вигляді лікарського препарату у гістидинацетатному буфері, рН від 5,5 до 6,5.
43. Спосіб за п. 42, який передбачає оцінку дезамідування та агрегації перед та після приготування антитіла у вигляді лікарського препарату.
44. Водний фармацевтичний препарат, який містить антитіло, яке зв'язується з доменом II в HER2 у гістидинацетатному буфері при рН від приблизно 5,5 до приблизно 6,5, сахарид і поверхнево-активну речовину, де препарат не ліофілізований і не піддавався попередній ліофілізації.
45. Препарат за п. 44, у якому антитіло до HER2 включає амінокислотні послідовності варіабельного легкого та варіабельного важкого ланцюгів, представлені в SEQ ID NО: 3 та 4, відповідно.
46. Препарат за п. 45, у якому антитіло до HER2 включає амінокислотну послідовність легкого ланцюга, вибрану із SEQ ID NО: 15 та 23, і амінокислотну послідовність важкого ланцюга, вибрану із SEQ ID NО: 16 та 24.
47. Препарат за п. 44, у якому рН дорівнює від приблизно 5,8 до приблизно 6,2.
48. Препарат за п. 44, у якому антитіло являє собою повнорозмірне антитіло.
49. Препарат за п. 44, у якому концентрація антитіла дорівнює від приблизно 20 мг/мл до приблизно 40 мг/мл.
50. Водний фармацевтичний препарат, який містить Пертузумаб у кількості від приблизно 20 мг/мл до приблизно 40 мг/мл, гістидинацетатний буфер, сахарозу та полісорбат 20, де рН препарату дорівнює від приблизно 5,5 до приблизно 6,5, де препарат не ліофілізований і не піддавався попередній ліофілізації.
51. Препарат за п. 50, який містить приблизно 30 мг/мл Пертузумабу, приблизно 20 мМ гістидинацетату, приблизно 120 мМ сахарози і приблизно 0,02 % полісорбату 20, де рН препарату приблизно дорівнює 6,0.
52. Флакон із пробкою, яка проколюється шприцом, що містить препарат за пунктом 44.
53. Ємність із нержавіючої сталі, що містить препарат за п. 44 у ємності.
54. Фармацевтичний препарат за п. 44 для застосування у способі лікування HER2-експресуючого раку у пацієнта, де спосіб передбачає введення пацієнтові препарату у кількості, ефективній для лікування HER2-експресуючого раку.
55. Водний фармацевтичний препарат, який містить антитіло до DR5 у гістидиновому буфері при рН від приблизно 5,5 до приблизно 6,5, сахарид і поверхнево-активну речовину, де препарат не ліофілізований і не піддавався попередній ліофілізації, і де антитіло до DR5 містить амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NО: 52, і амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NО: 51.
56. Препарат за п. 55, у якому рН препарату дорівнює від приблизно 5,8 до приблизно 6,2.
57. Водний фармацевтичний препарат, який містить Апомаб у кількості від приблизно 10 мг/мл до приблизно 30 мг/мл, гістидинацетатний буфер, трегалозу і полісорбат 20, де рН препарату дорівнює від приблизно 5,5 до приблизно 6,5, де препарат не ліофілізований і не піддавався попередній ліофілізації.
58. Препарат за п. 57, який містить приблизно 20 мг/мл Апомабу, приблизно 20 мМ гістидинацетату, приблизно 240 мМ трегалози і приблизно 0,02 % полісорбату 20, де рН приблизно дорівнює 6,0.
59. Флакон із пробкою, яка проколюється шприцом, який містить препарат за пунктом 55.
60. Ємність із нержавіючої сталі, яка містить препарат за п. 55 у ємності.
61. Фармацевтичний препарат за п. 55 для застосування у способі лікування злоякісного новоутворення у пацієнта, де спосіб передбачає введення пацієнту препарату у кількості, ефективній для лікування злоякісного новоутворення.
62. Препарат за п. 61, де злоякісне новоутворення являє собою солідну пухлину.
63. Препарат за п. 61, де злоякісне новоутворення являє собою неходжкінську лімфому.
Текст
1. Стабільний водний фармацевтичний препарат, який містить моноклональне антитіло в гістидинацетатному буфері, рН від 5,5 до 6,5, де моноклональне антитіло чутливе до дезамідування та агрегації і де препарат не ліофілізований і не піддавався попередній ліофілізації. 2. Препарат за п. 1, у якому значення рН дорівнює від 5,8 до 6,2. 3. Препарат за п. 1, у якому концентрація гістидинацетатного буфера дорівнює від приблизно 1 мМ до приблизно 200 мМ. 4. Препарат за п. 3, у якому концентрація гістидинацетатного буфера дорівнює від приблизно 10 мМ до приблизно 40 мМ. 5. Препарат за п. 1, у якому концентрація антитіла дорівнює від приблизно 10 мг/мл до приблизно 250 мг/мл. 6. Препарат за п. 5, у якому концентрація моноклонального антитіла дорівнює від приблизно 20 мг/мл до приблизно 40 мг/мл. 7. Препарат за п. 5, у якому концентрація моноклонального антитіла дорівнює від приблизно 80 мг/мл до приблизно 250 мг/мл. 8. Препарат за п. 1, що додатково містить сахарид. 9. Препарат за п. 8, у якому сахарид являє собою дисахарид. 2 (19) 1 3 29. Препарат за п. 1, який є стабільним при зберіганні приблизно при 5°C або приблизно 15°С принаймні протягом 3 місяців. 30. Препарат за п. 1, який є стабільним при зберіганні приблизно при -20°С принаймні протягом 3 місяців. 31. Препарат за п. 1, який є стабільним при заморожуванні й відтаванні. 32. Препарат за п. 1, який призначений для внутрішньовенного (в/в), підшкірного (п/ш) або внутрішньом'язового (в/м) введення. 33. Препарат за п. 32, який призначений для в/в введення й концентрація антитіла дорівнює від приблизно 20 мг/мл до приблизно 40 мг/мл. 34. Препарат за п. 32, який призначений для п/ш введення й концентрація антитіла дорівнює від приблизно 80 мг/мл до приблизно 250 мг/мл. 35. Флакон із пробкою, яка проколюється шприцом, який містить препарат за пунктом 1 всередині флакона. 36. Флакон за п. 35, який зберігають приблизно при 2-8°С. 37. Флакон за п. 35, який являє собою флакон об'ємом 20 см3 або 50 см3. 38. Ємність із нержавіючої сталі, яка містить препарат за п. 1 всередині ємності. 39. Ємність за п. 38, у якій препарат заморожений. 40. Препарат за п. 1 для застосування в способі лікування захворювання або розладу у пацієнта, де спосіб включає введення препарату пацієнтові у кількості, ефективній для лікування захворювання або розладу. 41. Водний фармацевтичний препарат, який містить: (а) повнорозмірне IgGl антитіло, чутливе до дезамідування і агрегації у кількості від приблизно 10 мг/мл до приблизно 250 мг/мл; (б) гістидинацетатний буфер, рН від 5,5 до 6,5; (в) сахарид, вибраний із групи, яка включає трегалозу і сахарозу, у кількості від приблизно 60 мМ до приблизно 250 мМ; і (г) полісорбат 20 у кількості від приблизно 0,01 % до приблизно 0,1%, де препарат не ліофілізований і не піддавався попередній ліофілізації. 42. Спосіб зменшення дезамідування та агрегації терапевтичного моноклонального антитіла, який передбачає приготування антитіла у вигляді лікарського препарату у гістидинацетатному буфері, рН від 5,5 до 6,5. 43. Спосіб за п. 42, який передбачає оцінку дезамідування та агрегації перед та після приготування антитіла у вигляді лікарського препарату. 44. Водний фармацевтичний препарат, який містить антитіло, яке зв'язується з доменом II в HER2 у гістидинацетатному буфері при рН від приблизно 5,5 до приблизно 6,5, сахарид і поверхневоактивну речовину, де препарат не ліофілізований і не піддавався попередній ліофілізації. 45. Препарат за п. 44, у якому антитіло до HER2 включає амінокислотні послідовності варіабельного легкого та варіабельного важкого ланцюгів, представлені в SEQ ID NО: 3 та 4, відповідно. 46. Препарат за п. 45, у якому антитіло до HER2 включає амінокислотну послідовність легкого ланцюга, вибрану із SEQ ID NО: 15 та 23, і амінокис 89798 4 лотну послідовність важкого ланцюга, вибрану із SEQ ID NО: 16 та 24. 47. Препарат за п. 44, у якому рН дорівнює від приблизно 5,8 до приблизно 6,2. 48. Препарат за п. 44, у якому антитіло являє собою повнорозмірне антитіло. 49. Препарат за п. 44, у якому концентрація антитіла дорівнює від приблизно 20 мг/мл до приблизно 40 мг/мл. 50. Водний фармацевтичний препарат, який містить Пертузумаб у кількості від приблизно 20 мг/мл до приблизно 40 мг/мл, гістидинацетатний буфер, сахарозу та полісорбат 20, де рН препарату дорівнює від приблизно 5,5 до приблизно 6,5, де препарат не ліофілізований і не піддавався попередній ліофілізації. 51. Препарат за п. 50, який містить приблизно 30 мг/мл Пертузумабу, приблизно 20 мМ гістидинацетату, приблизно 120 мМ сахарози і приблизно 0,02 % полісорбату 20, де рН препарату приблизно дорівнює 6,0. 52. Флакон із пробкою, яка проколюється шприцом, що містить препарат за пунктом 44. 53. Ємність із нержавіючої сталі, що містить препарат за п. 44 у ємності. 54. Фармацевтичний препарат за п. 44 для застосування у способі лікування HER2-експресуючого раку у пацієнта, де спосіб передбачає введення пацієнтові препарату у кількості, ефективній для лікування HER2-експресуючого раку. 55. Водний фармацевтичний препарат, який містить антитіло до DR5 у гістидиновому буфері при рН від приблизно 5,5 до приблизно 6,5, сахарид і поверхнево-активну речовину, де препарат не ліофілізований і не піддавався попередній ліофілізації, і де антитіло до DR5 містить амінокислотну послідовність легкого ланцюга, представлену в SEQ ID NО: 52, і амінокислотну послідовність важкого ланцюга, представлену в SEQ ID NО: 51. 56. Препарат за п. 55, у якому рН препарату дорівнює від приблизно 5,8 до приблизно 6,2. 57. Водний фармацевтичний препарат, який містить Апомаб у кількості від приблизно 10 мг/мл до приблизно 30 мг/мл, гістидинацетатний буфер, трегалозу і полісорбат 20, де рН препарату дорівнює від приблизно 5,5 до приблизно 6,5, де препарат не ліофілізований і не піддавався попередній ліофілізації. 58. Препарат за п. 57, який містить приблизно 20 мг/мл Апомабу, приблизно 20 мМ гістидинацетату, приблизно 240 мМ трегалози і приблизно 0,02 % полісорбату 20, де рН приблизно дорівнює 6,0. 59. Флакон із пробкою, яка проколюється шприцом, який містить препарат за пунктом 55. 60. Ємність із нержавіючої сталі, яка містить препарат за п. 55 у ємності. 61. Фармацевтичний препарат за п. 55 для застосування у способі лікування злоякісного новоутворення у пацієнта, де спосіб передбачає введення пацієнту препарату у кількості, ефективній для лікування злоякісного новоутворення. 62. Препарат за п. 61, де злоякісне новоутворення являє собою солідну пухлину. 63. Препарат за п. 61, де злоякісне новоутворення являє собою неходжкінську лімфому. 5 Даний винахід стосується препаратів антитіл, які містять моноклональні антитіла, приготовлені в гістидин-ацетатному буфері, а також препарату, який містить антитіло, яке зв'язується з доменом II в HER2 (наприклад, Пертузумаб), і препарату, який містить антитіло, яке зв'язується з DR5 (наприклад, Апомаб). Успіхи розвитку біотехнології, досягнуті в останні десятиліття, надали можливість одержання різних білків для фармацевтичних застосувань за допомогою технологій рекомбінантних ДНК. У зв'язку з тим, що білки є великими й більш комплексними в порівнянні зі звичайними органічними й неорганічними лікарськими засобами (тобто додатково до комплексних тривимірних структур, мають багато функціональних груп), препарати таких білків характеризуються специфічними проблемами Для підтримання біологічної активності білка препарат повинен зберігати інтактною конформаційну цілісність принаймні корової послідовності амінокислот білків, однак одночасно захищати різні функціональні групи білків від деградації. Шляхи деградації білків можуть торкатися хімічної нестабільності (тобто будь-які процеси, які задіють модифікацію білків шляхом утворення зв'язків або розщеплення, що приводить до утворення нової хімічної структури) або фізичну нестабільність (тобто зміни вищого порядку структури білка). Хімічна нестабільність може відбуватися в результаті дезамідування, рацемізації, гідролізу, окислення, бета-елімінації або дисульфідного обміну. Фізична нестабільність може відбуватися в результаті, наприклад, денатурації, агрегації, преципітації або адсорбції. Трьома найпоширенішими шляхами розпаду білків є агрегація, дезамідування й окислення. Cleland та ін., Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993). Препарати антитіл Білками, які застосовуються для фармацевтичних цілей, є, зокрема, антитіла. Прикладом антитіла, яке використовується для лікування, є антитіло, яке зв'язується з HER2 антигеном, таке як Пертузумаб. У патенті US 6,339,142 описана композиція HER2 антитіла, яка містить суміш антитіла до HER2 і один або більше його кислотних варіантів, де кількість кислотного (их) варіанта (ів) становить менше ніж приблизно 25%. Трастузумаб являє приклад HER2 антитіла. У патентах US 6,267,958 і 6,685,940 (Andya та ін.) описані ліофілізовані препарати антитіл, включаючи препарати HER2 і IgE антитіл У заявках WO97/04807 і US 2004/0197326А1 (Fick та ін.) описані способи лікування алергічної астми за допомогою IgE антитіла Заявка WO99/01556 (Lowman та ін.) стосується IgE антитіла з аспартиловими залишками, схильними до ізомеризації, і його поліпшених варіантів. У заявці US 2002/0045571 (Liu та ін.) описані концентровані препарати білків зі зменшеною в'язкістю, прикладами яких є препарати гуманізованих IgE антитіл, rhuMAb E25 і Е26. У заявках WO 02/096457 і US 2004/0170623 (Arvinte 89798 6 та ін.) описані стабільні рідкі препарати, які містять анти-IgE антитіло Е25. Див. також, US 2004/0197324 ΑΙ (Liu і Shire), яка стосується висококонцентрованого анти-IgE препарату. У патенті US 6,171,586 (Lam та ін.) описані стабільні водні препарати антитіл Антитіло F(ab')2 rhuMAb CD18 приготовлене в натрій-ацетатному й гістидин-НСІ буферах. Кращим препаратом для rhuMAb CD18 є 10мМ ацетат натрію, 8% трегалоза, 0,01% TWEEN 20™, рН5,0. Ацетатні препарати (рН5,0) для rhuMAb CD20, які зберігали при 40°С протягом одного місяця, демонструють підвищену стабільність у порівнянні з іншими зразками, приготовленими в гістидині (рН5,0 або 6,0). У заявці US 2003/0190316 (Kakuta та ін.) описані приготовлені у вигляді лікарських препаратів антитіло hPM-1, гуманізоване антитіло до рецептора IL-6 Втрата мономеру була найбільшою в цитраті натрію (рН6,7), потім у фосфаті натрію (рН6,8), Трис-НСІ (рН7,2), гістидин-НСІ (рН7,2) і гліцин (рН7,6) у порядку зменшення. Оцінювали дію фосфату Na (рН6,5), фосфату His (рН6,0 або 6,5), His-HCl (рН6,5) і фосфату Na (рН6,0) на стабільність hPM-1. В WO2004/071439 (Burke та ін.) заявляється, що забруднення виникають у препараті наталізумаб (анти-альфа4 інтегрин гуманізоване моноклональне антитіло) внаслідок розкладання полісорбату 80, приблизно при окисній реакції, яка задіює іони металів і гіситидин. Отже, був вибраний фосфатний буфер. WO 2000/066160 (паралельна заявка англійською мовою ЕР 1 174 148А1) (Okada та ін.) стосується препарату гуманізованого C4G1 антитіла, яке зв'язується з рецептором фібриногену глікопротеїну GPIIb/IIIa мембрани тромбоцита людини, у натрій-фосфатному або натрій-цитратному буфері. WO 2004/019861 (Johnson та ін.) стосується CDP870, пегільованого анти-TNFα Fab фрагменту, приготовленому при концентрації 200мг/мл в 50мМ ацетаті натрію (рН5,5) і 125мМ хлориді натрію. WO 2004/004639 (Nesta, P) стосується препарату для hu242-DMl, імунотоксину, який активується пухлиною, в 50мМ буфері янтарної кислоти (рН6,0) і сахарози (5%мас./об). В WO 03/039485 (Kaisheva та ін.) виявлено, що даклізумаб (гуманізоване антитіло до рецептора IL-2) має найбільшу стабільність у натрійсукцинатному буфері при рН6,0, і швидко втрачає ефективність у гістидині, тому що буфер окислюється. WO 2004/001007 стосується CD80 моноклонального антитіла в гістидин-НСІ, натрій-ацетатному або натрій-цитратному буфері. Патент US 6,252,055 (Relton, J.) стосується анти-СD4 і анти-СD23 антитіл, приготовлених у вигляді лікарських препаратів у малеаті, сукцинаті, натрій-ацетатному або фосфатному буферах, з яких у як кращий був ідентифікований фосфатний буфер. 7 Патент US 5,608,038 (Eibl та ін.) стосується висококонцентрованих препаратів поліклонального імуноглобуліну, який містить імуноглобулін, глюкозу або сахарозу, і хлорид натрію. WO 03/015894 (Oliver та ін.) стосується водного препарату 100мг/мл SYNAGIS®, 25мМ гістидинНСІ, 1,6мМ гліцину, рН6,0 і ліофілізованого SYNAGIS®, який потім готують у вигляді лікарського препарату (перед ліофілізацією), що містить 25мМ гістидин, 1,6мМ гліцин і 3% мас/об маннит при рН6,0. В US 2004/0191243 ΑΙ (Chen тa iн.) описаний препарат ABX-IL8, IgG2 антитіла людини. US 2003/0113316 Al (Kaisheva та ін.) стосується ліофілізованого препарату антитіла до рецептора IL2. Антитіла до HER2 Сімейство рецепторів HER2 тирозинкіназ являє собою важливі модулятори росту, диференціації й виживання клітин. Вказане сімейство рецепторів включає чотири різні представники, включаючи рецептори епідермального фактора росту (EGFR, ErbBl або HER1), HER2 (ЕrbВ2 або р185neu), HER3 (ЕrbВ3) і HER4 (ЕrbВ4 або tyro2). EGFR, який кодується геном erbBX, задіюється в процес злоякісного росту в людини. Зокрема, підвищена експресія EGFR спостерігається при раку молочної залози, сечового міхура, легені, голови, шиї й шлунка, а також у випадку гліобластоми. Підвищена експресія рецептора EGFR часто асоційована з підвищеною продукцією ліганду EGFR, трансформуючого фактора росту альфа (TGF-α), тими самими пухлинними клітинами, приводячи до активації рецептора через шлях аутокринної стимуляції (Baselga and Mendelsohn Pharmac Ther. 64: 127-154 (1994)). Моноклональні антитіла проти EGFR або його лігандів, TGA-α і EGF, розглядаються як терапевтичні засоби при лікуванні таких видів злоякісних новоутворень (див., наприклад, Baselga and Mendelsohn, вище; Masui та ін., Cancer Research, 44: 1002-1007 (1984) і Wu та ін., J. Chn. Invest, 95: 1897-1905 (1995)). Другий представник сімейства HER, р185neu, спочатку був ідентифікований як продукт трансформуючого гену з нейробластом щурів, яким вводили хімічний препарат. Активована форма протоонкогену neu виникає в результаті точкової мутації (заміна валіну на глютамінову кислоту) у трансмембранній ділянці кодованого білка. Ампліфікація людського гомолога neu спостерігається при раку молочної залози і яєчника й корелює з поганим прогнозом (Slamon та ін., Science, 235: 177-182 (1987); Slamon та ін., Science, 244: 707712 (1989); патент US 4968603). Дотепер в пухлинах людини не виявлені точкові мутації, аналогічні до neu протоонкогену. Суперекспресія HER2 (найчастіше, але не повністю відповідно до генної ампліфікації) також спостерігається при інших карциномах, включаючи карциноми шлунка, ендометрію, слинної залози, легені, нирки, товстої кишки, щитовидної залози, підшлункової залози й сечового міхура (див., серед інших, King та ін., Science, 229: 974 (1985); Yokota та ін., Lamcet 1: 765-767 (1986); Fukushige та ін., Моl. Cell. Вiol., 6: 955-958 (1986); Guerin та ін., Oncogene Res., 3: 21 89798 8 31 (1988); Cohen та ін., Oncogene, 4: 81-88 (1989); Yonemura та ін., Cancer Res, 51: 1034 (1991); Borst та ін., Gynecol. Oncol, 38: 364 (1990); Weiner та ін., Cancer Res., 50: 421-425 (1990); Kern та ін., Cancer Res., 50: 5184 (1990); Park та ін., Cancer Res., 49: 6605 (1989); Zhau та ін., Моl. Carcinog., 3: 254-257 (1990); Aasland та ін., Br. J. Cancer, 57: 358-363 (1988); Williams та ін., Pathobiology 59: 46-52 (1991); і McCann та ін., Cancer, 65: 88-92 (1990)). HER2 може суперекспресуватися при раку передміхурової залози (Gu та ін., Cancer Lett., 99: 185-9 (1996); Ross та ін., Hum Pathol, 28: 827-33 (1997); Ross та ін., Cancer 79: 2162-70 (1997) і Sadasivan та ін., J. Urol, 150: 126-31(1993)). с Антитіла проти щурячого р185" " і білкових продуктів людського HER2, описані Дребіном зі співавторами (Drebin і ін.), викликають утворення антитіл проти генного продукту neu щурів, р185neu (див, наприклад, Drebin та ін., Cell, 41: 695-706 (1985); Myers та ін., Meth Enzym., 198: 277-290 (1991); і WO 94/22578). Дребін зі співавторами (Drebin та ін., Oncogene, 2: 273-277 (1988)) показали, що суміші антитіл, активних у відношенні двох різних ділянок на р185neu, приводять до синергічних протипухлинних ефектів на neuтрансформованих клітинах NIH-3T3, імплантованих мишам nude, (див. також патент US 5824311, виданий 20 жовтня 1998 року). Худзіак із співавт. (Hudziak та ін., Моl. Cell. Biol, 9(3): 1165-1172 (1989)) описують одержання панелей антитіл до HER2, які були охарактеризовані з використанням клітинної лінії пухлини молочної залози людини SK-BR-3. Відносну проліферацію клітин SK-BR-3 після експозиції з антитілами визначають за фарбуванням моношарів кристалічним фіолетовим через 72 години. У рамках даного тесту визначають максимальне інгібування антитілом, яке називають 4D5, яке інгібує клітинну проліферацію на 56%. Інші антитіла в розглянутій панелі знижують клітинну проліферацію в меншому ступені, за даними даного тесту. Було також показано, що антитіло 4D5 сенсибілізує клітинну лінію пухлини людини, що здійснює суперекспресію HER2, до цитотоксичним ефектів TNF-α (см. також патент US 5677171, виданий 14 жовтня 1997 року). Описані Худзиаком із співавт. (Husziak та ін.) антитіла до HER2 були також охарактеризовані іншими авторами (Fendly та ін., Cancer Research, 50: 1550-1558 (1990); Kotts та ін., In Vitro 26(3): 59A (1990); Sarup та ін., Growth Regulation, 1 72-82 (1991); Shepard та ін., J. Clin Immunol., 11(3): 117127 (1991); Kumar та ін., Моl. Cell. Biol, 11(2): 979986 (1991); Lewis та ін., Cancer Immunol. Immunother., 37: 255-263 (1993); Pietras та ін., Oncogene, 9: 1829-1838 (1994); Vitetta та ін., Cancer Research, 54: 5301-5309 (1994); Sliwkowski та ін., J. Biol. Chem., 269(20): 14661-14665 (1994); Scott та ін., J. Biol. Chem., 266: 14300-5 (1991); D'souza та ін., Proc. Natl. Acad. Sci., 91: 7202-7206 (1994); Lewis та ін., Cancer Research, 56: 14571465 (1996) і Schaefer та ін., Oncogene, 15: 13851394(1997)). Рекомбінантна гуманізована версія мишиного антитіла HER2 4D5 (huMab4D5-8, rhuMab HER2, Трастузумаб (Trastuzumab) або HERCEPTIN®; 9 патент US 5821337), клінічно активний у пацієнтів з метастазуючими раковими пухлинами молочної залози, що здійснюють суперекспресію HER2, яким проводилася попередня велика протиракова терапія (Basegla та ін., J. Clin. Oncol., 14: 737-744 (1996)). Трастузумаб (Trastuzumab) був схвалений Агентством з контролю за лікарськими й харчовими продуктами США (Food and Drug Administration) 25 вересня 1998 року для лікування пацієнтів з метастазуючими раковими пухлинами молочної залози, у випадку, якщо пухлини здійснюють суперекспресію HER2 білки. У літературі також описані інші антитіла до HER2 з різними властивостями (Tagliabue та ін., Int J. Cancer., 47: 933-937 (1991); McKenzie та ін., Oncogene, 4: 543-548 (1989); Maier та ін., Cancer Res., 51: 5361-5369 (1991); Bacus та ін., Molecular Carcinogenesis, 3: 350-362 (1990); Stancovski та ін., PNAS (USA) 88: 8691-8695 (1991); Bacus та ін., Cancer Research, 52: 2580-2589 (1992); Xu та ін., Int. J Cancer 53: 401-408 (1993); WO 94/00136; Kasprzyk та ін., Cancer Research, 52: 2771-2776 (1992); Hancock та ін., Cancer Res., 51: 4575-4580 (1991); Shawver та ін., Cancer Res, 54: 1367-1373 (1994); Arteaga та ін., Cancer Res, 54: 3758-3765 (1994); Harwerth та ін., J. Bol. Chem., 267: 1516015167 (1992); патент US 5783186 і Klapper та ін., Oncogene 14: 2099-2109 (1997)). Скринінг із метою виявлення гомологів привів до ідентифікації двох інших представників сімейства рецепторів HER: HER3 (патенти US 5183884 і 5480968, а також Kraus та ін., PNAS (USA) 86: 9193-9197 (1989)) і HER4 (заявка на патент ЕР №599274; Plowman та ін., Proc. Natl. Acad. Sci. USA, 90: 1746-1750 (1993) і Plowman та ін., Nature, 366: 473-475 (1993)). Обидва вказані рецептора проявляють підвищену експресію принаймні в деяких клітинних лініях раку молочної залози. Рецептори HER в основному знайдені в різних сполученнях у клітинах і, вважається, що гетеродимеризація підвищує розмаїтість клітинних відповідей на багато лігандів HER (Earp та ін., Breast Cancer Research and Treatment 35: 115-132 (1995)). EGFR зв'язується із шістьома різними лігандами: епідермальний фактор росту (EGF), трансформуючий фактор росту альфа (TGF-α), амфірегулін, гепарин-зв'язуючий епідермальний фактора росту (HB-EGF), бетацелюлін і епірегулін (Groenen та ін., Growth Factors, 11: 235-257 (1994)). Сімейство білків герегулінів, які одержують при альтернативному сплайсингу одного гена, дає ліганди для HER3 і HER4. Сімейство герегулінів включає герегуліни альфа, бета й гама (Holmes та ін., Science, 256: 1205-1210 (1992); патент US 5641869; і Schaefer та ін., Oncogene, 15:1385-1394 (1997)), фактори диференціації neu (NDF), гліальні фактори росту (GGF), фактор, який індукує активність ацетилхолінового рецептора (ARIA), і фактор, утворений із сенсорних і рухових нейронів (SMDF) У літературі є відповідні огляди (див. Groenen та ін., Growth Factors, 11: 235-257 (1994); Lemke та ін., G. Molec & Cell. Neurosa., 7: 247-262 (1996) і Lee та ін., Pharm Rev, 47: 51-85 (1995)). Недавно були ідентифіковані три додаткові ліганди HER: нейрегулін-2 (NRG-2), який, як повідомля 89798 10 ється, зв'язується з HER3 або HER4 (Chang та ін., Nature 387: 509-512 (1997), і Carraway та ін., Nature, 387: 512-516 (1997)), нейрегулін-3, який зв'язується з HER4 (Zhang та ін., PNAS (USA), 94(18): 9562-7 (1997)), і нейрегулін-4, який зв'язується з HER4 (Нагагі та ін., Oncogene, 18: 2681-89 (1999)), HB-EGF, бетацелюлін і епірегулін також зв'язуються з HER4. Оскільки EGF і TGF-α не зв'язуються з HER2, EGF стимулює EGFR і HER2 до утворення гетеродимеру, який активує EGFR, що проводить до фосфорилування HER2 у гетеродимері. Димеризація та/або трансфосфорилування, як видно, активують тирозинкіназу HER2 (див., Еаrр та ін., вище). Аналогічно, у тому випадку, коли HER3 спільно експресується з HER2, утворюється активний сигнальний комплекс і антитіла, спрямовані проти HER2, здатні руйнувати даний комплекс (Sliwkowski та ін., J. Biol. Chem., 269(20): 1466114665 (1994)). Додатково, афінність HER3 у відношенні гетерорегуліну (HRG) підвищується до більше високого рівня афінності у випадку спільної експресії з HER2 (див. також Levi та ін., Journal of Neuroscience 15: 1329-1340 (1995); Morrissey та ін., Proc Natl Acad Sci USA 92: 1431-1435 (1995); і Lewis та ін., Cancer Res, 56: 1457-1465 (1996) у тому, що стосується білкового комплексу HER2HER3. HER4, як і HER3, утворить активний сигнальний комплекс із HER2 (Carraway and Cantley, Cell, 78: 5-8 (1994)). Для впливу на сигнальну систему HER було розроблене антитіло rhuMAb 2C4 (Pertuzumab, OMNITARG™) як гуманізоване антитіло, яке інгібує димеризацію HER2 з іншими HER рецепторами, що приводить до інгібування здійснюваного під дією ліганду фосфорилування й активації, а також шляхи активації RAS і АКТ у напрямку зчитування інформації. На фазі І випробувань Пертузумабу (Pertuzumab) як єдиного засобу для лікування солідних пухлин 3 пацієнтів із прогресуючим раком яєчників піддавали лікуванню Пертузумабом В одного пацієнта відзначалася стійка часткова відповідь, а в іншого пацієнта відзначалася стабілізація захворювання протягом 15 тижнів (Agus та ін., Proc. Am. Soc. Clin. Oncol., 22: 192, Abstract 771 (2003)). Антитіла до DR5 У даній галузі техніки були ідентифіковані різні ліганди й рецептори, які належать до суперсімейства фактора некрозу пухлини (TNF) Лігандами цього суперсімейства є, наприклад, фактор некрозу пухлини альфа ("TNF-альфа"), фактор некрозу пухлини бета ("TNF-бета" або "лімфотоксинальфа"), лімфотоксин-бета ("LT-бета"), CD30 ліганд, CD27 ліганд, CD40 ліганд, ОХ-40 ліганд, 41ВВ ліганд, LIGHT, Аро-1 ліганд (також позначається як Fas ліганд або CD95 ліганд), Аро-2 ліганд (також позначається як Apo2L або TRAIL), Аро-3 ліганд (також позначається як TWEAK), APRIL, OPG ліганд (також позначається як RANK ліганд, ODF або TRANCE), і TALL-1 (також позначається як Bly, BAFF або THANK) (Див., наприклад, Ashkenazi, Nature Review, 2: 420-430 (2002); Ashkenazi i Dixit, Science, 281: 1305-1308 (1998); Ashkenazi і Dixit, Curr. Opin. Cell Biol., 11: 255-260 11 (2000); Golstein, Curr. Biol, 7: 750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, cc.377-411; Locksley та ін., Cell, 104: 487-501 (2001); Grass і Dower, Blood, 85: 3378-3404 (1995); Schmid та ін., Proc. Natl. Acad. Sci., 83: 1881 (1986); Dealtry та ін., Eur. J. Immunol, 17: 689 (1987); Pitti та ін., J. Biol. Chem., 271: 12687-12690 (1996); Wiley та ін., Immunity, 3: 673-682 (1995); Browning та ін., Cell, 72: 847-856 (1993); Armitage та ін., Nature, 357: 80-82 (1992), WO 97/01633, опублікована 16 січня 1997 року; WO 97/25428, опублікована 17 липня 1997 року; Marsters та ін., Curr Biol., 8: 525528 (1998); Chicheportiche та ін., Biol. Chem., 272: 32401-32410 (1997); Hahne та ін., J. Exp. Med., 188: 1185-1190 (1998); WO98/28426, опублікована 2 липня 1998 року; WO98/46751, опублікована 22 жовтня 1998 року; WO/98/18921, опублікована 7 травня 1998 року; Moore та ін., Science, 285: 260263 (1999); Shu та ін., J. Leukocyte Biol., 65: 680 (1999); Schneider та ін., J. Exp. Med., 189: 17471756 (1999); Mukhopadhyay та ін., J. Biol. Chem., 274: 15978-15981 (1999)). Індукція різних реакцій-відповідей клітин, опосередковуваних таким сімейством лігандів TNF, звичайно ініціюється шляхом їх зв'язування зі специфічними рецепторами в клітинах. Деякі, але не всі, ліганди сімейства TNF зв'язуються з, і індукують різні біологічні дії за допомогою "рецепторів смерті" на клітинній поверхні, активуючи каспази або ферменти, які здійснюють шлях клітинної загибелі або апоптоз (Salvesen та ін., Cell, 91: 443446 (1997)). Із представників суперсімейства рецепторів TNF дотепер були ідентифіковані TNFR1, TNFR2, ТАСІ, GITR, CD27, ОХ-40, CD30, CD40, HVEM, Fas (також позначається як Аро-1 або CD95), DR4 (також позначається як TRAIL-R1), DR5 (також позначається як Аро-2 або TRAIL-R2), Dс1, Dc2, остеопротегерин (OPG), RANK і Аро-3 (також позначається як DR3 або TRAMP). Більшість із цих представників сімейства рецепторів TNF мають подібну типову структуру рецепторів клітинної поверхні, включаючи позаклітинну, трансмембранну і внутрішньоклітинну ділянки, тоді як інші виявляються в природі у вигляді розчинних білків без трансмембранного й внутрішньоклітинного домену. Позаклітинна частина типових TNFR містить повторюваний фрагмент амінокислотної послідовності множинних збагачених цистеїном доменів (CRD), починаючи з ΝΗ2-кінця. Ліганд, який позначається як Apo-2L або TRAIL, був ідентифікований декілька років тому як представник TNF сімейства цитокінів. (див., наприклад, Wiley та ін., Immunity, 3: 673-682 (1995); Pitti та ін., J. Biol. Chem., 271: 12697-12690 (1996); WO 97/01633; WO 97/25428; патент US 5,763,223, виданий 9 червня 1998 року; патент US 6,284,236, виданий 4 вересня 2001 року.). Повнорозмірна нативна послідовність Apo2L/TRAIL поліпептиди людини містить 281 амінокислоту, трансмембранний білок типу II. Деякі клітини можуть продукувати розчинну форму поліпептиду, що зустрічається в природі, за допомогою ферментативного розщеплення позаклітинної ділянки поліпептиду (Маriani та ін., J. Cell. Biol., 137: 221-229 (1997)). При хро 89798 12 матографічних дослідженнях розчинних форм Apo2L/TRAIL виявили гомотримерну структуру, подібну до структури TNF та інших споріднених білків (Hymowitz та ін., Molec. Cell, 4: 563-571 (1999); Cha та ін., Immunity, 11: 253-261 (1999); Mongkolsapaya та ін., Nature Structural Biology, 6: 1048 (1999); Hymowitz та ін., Biochemistry, 39: 633644 (2000)). Однак було виявлено, що Apo2L/TRAIL, на відміну від інших представників сімейства TNF, характеризується унікальною структурною особливістю, а саме що три цистеїніві залишки (в 230-ому положенні кожної субодиниці гомотримеру) разом координуються атомом цинку, і що зв'язування цинку є важливим для стабільності й біологічної активності тримеру. (Hymowitz та ін., вище; Bodmer та ін., J. Biol. Chem., 275: 2063220637 (2000)). В літературі було описано, що Apo2L/TRAIL може брати участь у модуляції імунної системи, включаючи аутоімунні захворювання, такі як ревматоїдний артрит (див., наприклад, Thomas та ін., J. Immunol., 161: 2195-2200 (1998); Johnsen та in., Cytokine, 11: 664-672 (1999); Griffith та ін., J. Exp. Med., 189: 1343-1353 (1999); Song та ін., J. Exp. Med., 191: 1095-1103 (2000)). Також було описано, що розчинні форми Apo2L/TRAIL індукують апоптоз у різних злоякісних клітинах, включаючи пухлини ободової кишки, легені, молочної залози, передміхурової залози, сечового міхура, нирки, яєчників і головного мозку, а також меланому, лейкоз і множинну мієлому (див., наприклад, Wiley та ін., вище; Pitti та ін., вище; патент US 6,030,945, виданий 29 лютого 2000 року; патент US 6,746,668, виданий 8 червня 2004 року; Rieger та ін., FEBS Letters, 427: 124-128 (1998); Ashkenazi та ін., J. Clin. Invest., 104: 155162 (1999); Walczak та ін., Nature Med., 5:157-163 (1999); Keane та ін., Cancer Research, 59: 734-741 (1999); Mizutani та ін., Chn. Cancer Res., 5: 26052612 (1999); Gazitt, Leukemia, 13: 1817-1824 (1999); Yu та ін., Cancer Res., 60: 2384-2389 (2000); Chinnaiyan та ін., Proc. Natl. Acad. Sci., 97: 17541759 (2000)). Дослідження в умовах in vivo на моделях пухлин у мишей додатково підтвердили, що Apo2L/TRAIL, окремо або в комбінації з хіміотерапією або променевою терапією може виявляти ефективну протипухлинну дію (див., наприклад, Ashkenazi та ін., вище; Walzcak та ін., вище; Gliniak та ін., Cancer Res., 59: 6153-6158 (1999); Chinnaiyan та ін., вище; Roth та ін., Biochem. Biophys. Res. Comm., 265: 1999 (1999); заявка РСТ US/00/15512; заявка РСТ US/01/23691). На відміну від багатьох типів злоякісних клітин, більшість нормальних типів клітин людини є резистентними до апоптозу, який індукується певними рекомбінантними формами Apo2L/TRAIL (Ashkenazi та ін., вище; Walzcak та ін., вище). Jo та ін., описали, що розчинна форма Apo2L/TRAlL, мічена полігістидином, індукує апоптоз в умовах in vitro у нормальних виділених гепатоцитах людини, але не в нелюдських гепатоцитах (Jo та ін., Nature Med., 6: 564-567 (2000); див. також Nagata, Nature Med., 6: 502-503 (2000)). Вважають, що певні рекомбінантні препарати Apo2L/TRAIL можуть відрізнятися за своїми біологічними властивостями і біологічними діями 13 на патологічні клітини в порівнянні з нормальними клітинами, залежно, наприклад, від наявності або відсутності маркерної молекули, вмісту цинку й% вмісту тримеру (див., Lawrence та ін., Nature Med., Letter to the Editor, 7: 383-385 (2001); Qin та ін., Nature Med., Letter to the Editor, 7: 385-386 (2001)). Було виявлено, що Apo2L/TRAIL зв'язується принаймні з п'ятьма різними рецепторами. Принаймні два рецептори, які зв'язуються з Apo2L/TRAIL, містять функціональний, цитоплазматичний домен смерті. Один з таких рецепторів позначається як "DR4" (і альтернативно як TR4 або TRAIL-R1) (Pan та ін., Science, 276: 111-113 (1997); див. також WO98/32856, опублікована 30 липня 1998 року; WO99/37684, опублікована 29липня 1999 року; WO 00/73349, опублікована 7 грудня 2000 року; патент US 6,433,147, виданий 13 серпня 2002 року; патент US 6,461,823, виданий 8 жовтня 2002 року., і патент US 6,342,383, виданий 29 січня 2002 року.). Інший такий рецептор для Apo2L/TRAIL позначається як DR5 (також альтернативно позначається як Аро-2; TRAIL-R або TRAIL-R2, TR6, Tango63, hAPO8, TRICK2 або KILLER) (див., наприклад, Sheridan та ін., Science, 277: 818-821 (1997), Pan та ін., Science, 277: 815-818 (1997), WO98/51793, опублікована 19 листопада 1998 року; WO98/41629, опублікована 24 вересня 1998 року; Screaton і ін., Curr. Biol., 7: 693-696 (1997); Walczak та ін., ЕМВО J., 16: 5386-5387 (1997); Wu та ін., Nature Genetics, 17: 141-143 (1997); WO98/35986, опублікована 20 серпня 1998 року; ЕР870,827, опублікована 14 жовтня 1998 року; WO98/46643, опублікована 22 жовтня 1998 року; WO99/02653, опублікована 21 січня 1999 року; WO99/09165, опублікована 25 лютого 1999 року; WO99/11791, опублікована 11 березня 1999 року; US 2002/0072091, опублікована 13 серпня 2002 року; US 2002/0098550, опублікована 7 грудня 2001 року; US 6,313,269, виданий 6 грудня 2001 року; US 2001/0010924, опублікована 2 серпня 2001 року; US 2003/01255540, опублікована 3 липня 2003 року; US 2002/0160446, опублікована 31 жовтня 2002 року., US 2002/0048785, опублікована 25 квітня 2002 року; US 6,342,369, виданий у лютому 2002; US 6,569,642, виданий 27 травня 2003 року., US 6,072,047, виданий 6 червня 2000 року., US 6,642,358, виданий 4 листопада 2003 року; IS 6,743,625, виданий 1 червня 2004 року.). Як і для DR4, для DR5 описана наявність цитоплазматичного домену смерті й здатність передавати сигнал апоптозу при зв'язуванні ліганду (або при зв'язуванні молекули, такої як агоніст антитіла, що імітує дію ліганду). Кристалічна структура комплексу, утвореного між Аро-2L/TRAIL і DR5, описана в Hymowitz та ін., Molecular Cell, 4: 563-571 (1999). При зв'язуванні ліганду обоє DR4 і DR5 незалежно можуть запускати апоптоз шляхом залучення й активування ініціатора апоптозу, каспази-8, за допомогою адапторної молекули, що містить домен смерті, що позначається як FADD/Mortl (Kischkel та ін., Immunity, 12: 611-620 (2000); Sprick та ін., Immunity, 12: 599-609 (2000); Bodmer та ін., Nature Cell Biol., 2: 241-243 (2000)). 89798 14 Описано, що Apo2L/TRAIL також зв'язується з тими рецепторами, які позначаються як Dс1, Dc2 і OPG, які, як вважають, діють як інгібітори, а не трансдуктори сигналів (див., наприклад, Dс1 (також позначуваний як TRID, LIT або TRAIL-R3) (Pan та ін., Science, 276:111-113 (1997); Sheridan та ін., Science, 277:818-821 (1997); McFarlane та ін., J Bwl. Chem., 272:25417-25420 (1997); Schneider та ін., FEBS Letters, 416:329-334 (1997); Degli-Esposti та ін., J Exp Med., 186:1165-1170 (1997); і Mongkolsapaya та ін., J. Immunol, 160:3-6 (1998)); Dc2 (який також називається TRUNDD або TRAILR4) (Marsters та ін., Curr. Biol., 7:1003-1006 (1997); Pan та ін., FEBS Letters, 424:41-45 (1998); DegliEsposti та ін., Immunity, 7:813-820 (1997)), і OPG. На відміну від DR4 і DR5, рецептори Dс1 і Dc2 не передають сигналів апоптозу. У літературі описані певні антитіла, які зв'язуються з рецепторами DR4 та/або DR5. Наприклад, антитіла до DR4, націлені на рецептор DR4 і які мають агоністичну або апоптотичну дію в певних клітинах ссавців, описані, наприклад, в WO 99/37684, опублікованій 29 липня 1999 року; WO 00/73349, опублікованій 12 липня 2000 року; WO 03/066661, опублікованій 14 серпня 2003 року. Див. також, наприклад, Griffith та ін., J. Immunol., 162: 2597-2605 (1999); Chuntharapai та ін., J. Immunol., 166: 4891-4898 (2001); WO 02/097033, опубліковану 2 грудня 2002 року; WO 03/042367, опубліковану 22 травня 2003 року; WО 03/038043, опубліковану 8 травня 2003 року; WО 03/037913, опубліковану 8 травня 2003 року. Певні антитіла до DR5 також описані, наприклад, в WO 98/51793, опублікованій 8 листопада 1998 року; Griffith та ін., J. Immunol., 162: 2597-2605 (1999); Ichikawa та ін., Nature Med, 7: 954-960 (2001); Hylander та ін., "An Antibody to DR5 (TRAIL-Receptor 2) Suppresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice", Abstract, 2d International Congress on Monoclonal Антитіла in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; WO 03/038043, опублікованій 8 травня 2003 року; WО 03/037913, опублікованій 8 травня 2003 року. Крім того, описані певні антитіла, які мають перехресну реактивність до обох рецепторів DR4 і DR5 (див., наприклад, патент US 6,252,050, виданий 26 червня 2001 року.). Даний винахід стосується, зокрема, принаймні ідентифікації гістидин-ацетату, рН від 5,5 до 6,5, як кращого придатного буфера для приготування препаратів моноклональних антитіл, особливо повнорозмірних IgG1 антитіл, які чутливі до дезамідування та/або агрегації. У таких препаратах уповільнюється руйнування приготовленого антитіла. Отже, у першому аспекті, винахід стосується стабільного фармацевтичного препарату, який містить моноклональне антитіло в гістидинацетатному буфері, рН від 5,5 до 6,5. Моноклональне антитіло переважно зв'язується з антигеном, вибраним із групи, яка включає HER2, CD20, DR5, BR3, IgE і VEGF. Додатково, винахід стосується способу лікування захворювання або розладу в пацієнта, який передбачає введення пацієнтові препарату в кіль 15 кості, ефективній для лікування захворювання або розладу. В іншому аспекті, винахід стосується фармацевтичного препарату, який містить' (а) повнорозмірне IgG1 антитіло, чутливе до дезамідування або агрегації, у кількості від приблизно 10мг/мл до приблизно 250мг/мл; (б) гістидин-ацетатний буфер, рН від 5,5 до 6,5; (в) сахарид, вибраний із групи, яка включає трегалозу й сахарозу, у кількості від приблизно 60мМ до приблизно 250мМ; і (г) полісорбат 20 у кількості від приблизно 0,01% до приблизно 0,1%. Винахід також стосується способу зменшення дезамідування або агрегації терапевтичного моноклонального антитіла, який передбачає приготування антитіла у вигляді лікарського препарату в гістидин-ацетатному буфері, рН від 5,5 до 6,5. У ще іншому варіанті здійснення, винахід стосується фармацевтичного препарату, який містить антитіло, яке зв'язується з доменом II в HER2, у гістидиновому буфері при рН від приблизно 5,5 до приблизно 6,5, сахарид і поверхнево-активну речовину. Винахід також стосується фармацевтичного препарату, який містить Пертузумаб у кількості від приблизно 20мг/мл до приблизно 40мг/мл, гістидин-ацетатний буфер, сахарозу, і полісорбат 20, де рН препарату дорівнює від приблизно 5,5 до приблизно 6,5. Винахід також стосується фармацевтичного препарату, який містить DR5 антитіло в гістидиновому буфері при рН від приблизно 5,5 до приблизно 6,5, сахарид і поверхнево-активну речовину. В іншому аспекті, винахід стосується фармацевтичного препарату, який містить Апомаб у кількості від приблизно 10мг/мл до приблизно 30мг/мл, гістидин-ацетатний буфер, трегалозу, і полісорбат 20, де рН препарату дорівнює від приблизно 5,5 до приблизно 6,5. У ще одному варіанті здійснення, винахід забезпечує спосіб лікування злоякісного новоутворення в пацієнта, який передбачає введення пацієнтові фармацевтичного препарату в кількості, ефективній для лікування злоякісного новоутворення. Винахід також стосується флакона із пробкою, яка проколюється шприцом, або ємності з нержавіючої сталі, що містить всередині флакону або ємності препарат, необов'язково в замороженому вигляді. Крім того, винахід забезпечує спосіб одержання фармацевтичного препарату, який передбачає: (а) приготування препарату моноклонального антитіла; і (б) оцінку фізичної стабільності, хімічної стабільності або біологічної активності моноклонального антитіла в препараті. На Фіг.1 показані домени I-IV (SEQ ID NO: 1922, відповідно) позаклітинного домену в HER2. На Фіг.2А і 2В показані результати вирівнювання амінокислотних послідовностей варіабельного легкого (Vl) (Фіг.2А) і варіабельного важкого (VH) (Фіг.2В) доменів мишиного моноклонального антитіла 2С4 (SEQ ID NO: 1 і 2, відповідно); VL і VH доменів гуманізованого антитіла 2С4 версії 574 (SEQ ID NO: З і 4, відповідно), і консенсусних пос 89798 16 лідовностей Vl і Vh каркасних ділянок людини (hum кі, легка каппа, підгрупа І; humlll, важка, підгрупа III) (SEQ ID NO: 5 і 6, відповідно). Зірочками показані відмінності між гуманізованим антитілом 2С4 версії 574 і мишиним моноклональним антитілом 2С4 або між гуманізованим антитілом 2С4 версії 574 і каркасною ділянкою молекули людини. У дужках показані гіперваріабельні ділянки (CDR). На Фіг.3А і 3В показані амінокислотні послідовності легкого й важкого ланцюга Пертузумабу (SEQ ID NO: 15 і 16, відповідно). CDR виділені жирним шрифтом. Розрахована молекулярна маса легкого ланцюга й важкого ланцюга становить 23,52622кДа й 49,21656кДа (цистеїни у відновленій формі). Вуглеводна частина приєднана до Asn 299 важкого ланцюга. На Фіг.4А і 4В показані амінокислотні послідовності легкого й важкого ланцюга Пертузумабу, кожна з яких включає інтактну послідовність сигнального пептиду на аміно-кінці (SEQ ID NO: 17 і 18, відповідно). На Фіг.5 схематично показане зв'язування 2С4 у сайті зв'язування гетеродимеру в HER2, що перешкоджає гетеродимеризацй з активованим EGFR або HER3. На Фіг.6 показана дієвідміна в HER2/HER3 зі шляхами МАРК і Akt. На Фіг.7 показані результати порівняння активностей Трастузумабу й Пертузумабу. На Фіг.8 показано результати дослідження стабільності препарату Пертузумабу при іонообмінному аналізі (ІЕХ). На Фіг.9 показано результати дослідження стабільності препарату Пертузумабу при аналізі за допомогою гель-хроматографії (SEC). На Фіг.10 наведені результати дослідження фізичної стабільності Пертузумабу в різних препаратах На Фіг.11 наведені результати дослідження збовтування рідких препаратів Пертузумабу. На Фіг.12 наведені результати іншого дослідження збовтування рідких препаратів Пертузумабу. На Фіг.13 наведені результати дослідження заморожування-відтавання препарату Пертузумабу. На Фіг.14А і 14В показані амінокислотні послідовності легкого ланцюга (SEQ ID NO: 13) і важкого ланцюга (SEQ ID NO: 14) Трастузумабу. На Фіг.15А і 15В показаний варіант послідовності легкого ланцюга Пертузумабу (SEQ ID NO: 23) і варіант послідовності важкого ланцюга Пертузумабу (SEQ ID NO: 24). На Фіг.16А і 16В показані олігосахаридні структури, які звичайно спостерігаються в IgG антитілах. На Фіг.17А і 17В показані послідовності легких і важких ланцюгів (SEQ ID NO: 37-44) специфічних анти-IgG антитіл Е25, Е26, НАЕ1 і Нu-901. На Фіг.17А, варіабельний легкий домен закінчується залишками VEIK, залишок 111. На Фіг.17В, варіабельний важкий домен закінчується залишками VTVSS, біля залишку 120. На Фіг.18А показані результати вирівнювання амінокислотних послідовностей варіабельного 17 легкого домену (VL) кожного з мишиного 2Н7 (SEQ ID NO: 25), гуманізованого 2H7v16 варіанти (SEQ ID NO: 26), і каппа легкого ланцюга підгрупи І людини (SEQ ID NO: 27). CDR в VL для 2Н7 і hu2H7v16 наведені, як вказано нижче: CDR1 (SEQ ID NO: 57), CDR2 (SEQ ID NO: 58) і CDR3 (SEQ ID NO: 59). На Фіг.18В показані результати вирівнювання амінокислотних послідовностей варіабельного важкого домену (VH) кожного з мишиного 2Н7 (SEQ ID NO: 28), гуманізованого 2H7v16 варіанти (SEQ ID NO: 29), і консенсусної послідовності важкого ланцюга підгрупи III людини (SEQ ID NO: 30). CDR в VH для 2Н7 і hu2H7v16 наведені, як вказано нижче: CDR1 (SEQ ID NO: 60), CDR2 (SEQ ID NO: 61) і CDR3 (SEQ ID NO: 62). На Фіг.18А і 18В, CDR1, CDR2 і CDR3 у кожному ланцюзі наведені в дужках, фланковані фланкуючими ділянками, FR1-FR4, як вказано. 2Н7 стосується мишиного 2Н7 антитілу. Зірочки між двома рядками послідовностями вказують положення, які відрізняються у двох послідовностей. Нумерація залишків наведена згідно із Kabat та ін., Sequences of Immunological Interest, 5th Ed Public Health Service, National Institutes of Health, Bethesda, Md. (1991), із вставками, позначеними як a, b, с, d і e. На Фіг.19 показані послідовності варіабельних доменів трьох різних антитіл до VEGF з SEQ ID NO:31-36. На Фіг.20 показаний профіль елюювання при здійсненні гель-хроматографії (SEC) для наступних зразків Апомабу: (а) контроль і препарати, приготовлені при (b) рН4,0, (с) рН5,0, (d) pH6,0 і (e) рН7,0. Приготовлені зразки зберігали при 40°С протягом 2 місяців перед дослідженням. На Фіг.21 показаний кінетичний аналіз рН профілю при втраті мономеру в антитілі Апомаб при зберіганні. За кінетикою мономеру спостерігали за допомогою SEC при зберіганні при 30°С і 40°С і розраховували коефіцієнти кінетики першого порядку. На Фіг.22 показаний профіль елюювання при іонообміннії хроматографії (ІЕС) зразків Апомабу в наступному порядку: (а) контроль і препарати, приготовлені при (b) рН4,0, (с) рН5,0, (d) рН6,0 і (e) рН7,0. Приготовлені зразки зберігали при 40°С протягом 2 місяців перед дослідженням. На Фіг.23 показаний кінетичний аналіз рН профілю при втраті головного піка ІЕС при зберіганні. За кінетикою головного піка спостерігали за допомогою ІЕС при зберіганні при 30°С і 40°С і розраховували коефіцієнти кінетики першого порядку. На Фіг.24 показана нуклеотидна послідовність Аро-2 ліганду кДНК людини (SEQ ID NO: 45) і її похідна амінокислотна послідовність (SEQ ID NO: 46). "Ν" у положенні 447 нуклеотиду (в SEQ ID NO: 45) використовується для позначення того, що нуклеотидною основою може бути "Т" або "G". На Фіг.25А і 25В показана амінокислотна послідовність, яка складається з 411 залишку, рецептора DR5 людини (SEQ ID NO: 47), як опубліковано в WO 98/51793 19 листопада 1998 року, і 89798 18 кодувальна нуклеотидна послідовність (SEQ ID NO: 48). На Фіг.26А і 26В показана амінокислотна послідовність, яка складається з 440 залишків, рецептора DR5 людини (SEQ ID NO: 49), і кодувальна нуклеотидна послідовність (SEQ ID NO: 50), як також опубліковано в WO 98/35986 20 серпня 1998 року. На Фіг.27 показана амінокислотна послідовність важкого ланцюга Апомабу 7.3 (SEQ ID NO: 51). На Фіг.28 показана амінокислотна послідовність легкого ланцюга Апомабу 7.3 (SEQ ID No.52). На Фіг.29 показані результати вирівнювання амінокислотних послідовностей важкого ланцюга 16Е2 (SEQ ID NO: 53) і важкого ланцюга Апомабу 7.3 (SEQ ID NO: 51). На Фіг.30 показані результати вирівнювання амінокислотних послідовностей легкого ланцюга 16Е2 (SEQ ID NO: 54) і легкого ланцюга Апомабу 7.3 (SEQ ID NO: 52). На Фіг.31А і 31В показані варіабельна важка амінокислотна послідовність (Фіг.31A; SEQ ID NO: 55) і варіабельна легка амінокислотна послідовність (Фіг.31В; SEQ ID NO: 56) Апомабу 7.3. CDR залишки виділені жирним шрифтом. На Фіг.32 показані результати вирівнювання легких ланцюгів зрілих 2H7v16 і 2H7v511 (SEQ ID NO: 63 і 64, відповідно). Послідовності наведені з нумерацією залишків варіабельного домену згідно із Kabat нумерацією залишків константного домену згідно із Еu. На Фіг.33 показані результати вирівнювання важких ланцюгів зрілих 2H7v16 і 2H7v511 (SEQ ID NO: 65 і 66, відповідно). Послідовності наведені з нумерацією залишків варіабельного домену згідно із Kabat нумерацією залишків константного домену згідно із Еu. І. Визначення Термін "фармацевтичний препарат" стосується препарату, який знаходиться в такій формі, що дозволяє ефективно проявлятися біологічної активності препарату, і який не містить додаткових компонентів, неприйнятно токсичних для пацієнта, якому будуть вводити препарат. Такі препарати є стерильними. "Стерильний" препарат є асептичним або не містить всіх живих мікроорганізмів і їх спор. У даному винаході, "заморожений" препарат означає препарат, температура якого нижче 0°С. Як правило, заморожений препарат не є висушенимим виморожуванням, його ні раніше, ні надалі не піддавали ліофілізації. Переважно, заморожений препарат містить заморожену для зберігання лікарська речовина (у ємності з нержавіючої сталі) або заморожений лікарський продукт (у флаконі для цільового застосування). "Стабільний" препарат являє собою препарат, у якому білок по суті зберігає свою фізичну стабільність та/або хімічну стабільність та/або біологічну активність при зберіганні. Переважно, препарат по суті зберігає свою фізичну й хімічну стабільність, а також свою біологічну активність при зберіганні. Період зберігання звичайно вибирають, виходячи з передбачуваного періоду терміну 19 придатності препарату. З рівня техніки доступні різні аналітичні методики вимірювання стабільності білків і огляди наведені, наприклад, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991) і Jones, A. Adv Drug Delivery Rev 10: 29-90 (1993). Стабільність може бути обмірювана при вибраній температурі за певний період часу. Переважно, препарат є стабільним приблизно при 40°С принаймні приблизно протягом 2-4 тижнів, та/або стабільним приблизно при 5°С та/або 15°С принаймні протягом 3 місяців, та/або стабільним приблизно при -20°С принаймні протягом 3 місяців або принаймні протягом 1 року. Крім того, препарат переважно є стабільним після заморожування (наприклад, до -70°С) і відтавання препарату, наприклад, після 1, 2 або З циклів заморожування й відтавання. Стабільність може бути оцінена якісно та/або кількісно за допомогою багатьох різних методів, включаючи оцінку утворення агрегатів (наприклад, використовуючи гель-хроматографію, шляхом вимірювання каламутності та/або шляхом візуального контролю); шляхом вимірювання заряду гетерогенності за допомогою катіонообмінної хроматографії або капілярно-зонного електрофорезу; дослідження аміно-кінцевої або карбоксикінцевої послідовності; мас-спектрометричного аналізу; SDS-PAGE аналізу для порівняння відновленого й інтактного антитіла; аналізу пептидної карти (наприклад трипсиновий або LYS-C); оцінки біологічної активності або функції зв'язування антигену антитілом; і т.д. Нестабільність може включати одне або декілька явищ: агрегацію, дезамідування (наприклад, Asn дезамідування), окислення (наприклад, Met окислення), ізомеризацію (наприклад, Asp ізомеризацію), кліпування/гідроліз/фрагментацію (наприклад, фрагментацію шарнірної ділянки), утворення сукциніміду, неспареного (их) цистеїну (ів), подовження на Nкінці, обробку С-кінці, різне глікозилування, і др. У даному винаході "дезамідоване" моноклональне антитіло стосується антитіла, у якому один або більше його аспарагінових залишків дериватизовані, наприклад, до аспарагінової кислоти або ізо-аспарагінової кислоти. Антитіло, яке "чутливе до дезамідування" стосується антитіла, яке містить один або більше залишків, які схильні до дезамідування. Антитіло, яке "чутливе до агрегації" стосується антитіла, яке може агрегувати із іншою (йми) молекулою (ами) антитіла, особливо при заморожуванні та/або перемішуванні. Антитіло, яке "чутливе до фрагментації 1" стосується антитіла, яке може розщеплюватися на два або більше фрагменти, наприклад, у його шарнірній ділянці. Під "зменшенням дезамідування, агрегації або фрагментації" розуміють запобігання або зниження кількості дезамідування, агрегації або фрагментації відносно моноклонального антитіла, приготовленого у вигляді лікарського препарату при різному значенні рН або в різному буфері. У даному винаході, "біологічна активність" моноклонального антитіла стосується здатності антитіла зв'язуватися з антигеном і приводити до 89798 20 вимірюваної біологічної реакції-відповіді, яка може бути виміряна в умовах in vitro або in vivo. Така активність може бути антагоністичною (наприклад, де антитіло являє собою HER2) або агоністичною (наприклад, де антитіло зв'язує DR5). У випадку Пертузумабу, в одному варіанті здійснення, біологічна активність стосується здатності антитіла, приготовленого у вигляді лікарського препарату, інгібувати проліферацію лінії ракових клітин молочної залози людини MDA-MB-175-VII. Якщо антитіло являє собою Апомаб, то біологічна активність може ставитися, наприклад, до здатності антитіла, приготовленого у вигляді лікарського препарату, убивати клітини раку ободової кишки Соlо205. Під "ізотонічним" розуміють, що препарат, який представляє інтерес, по суті має таке ж осмотичний тиск, як і кров людини. Ізотонічні препарати звичайно будуть мати осмотичний тиск від приблизно 250 до 350мОсмоль. Ізотонічність можна вимірювати, наприклад, за допомогою осмометра з тиском насиченої пари або типу замороженого льоду. Як використовується в даному винаході, "буфер" стосується буферного розчину, який протидіє змінам рН шляхом впливу його кислотно-основних сполучених компонентів. Буфер згідно із даним винаходом переважно має значення рН в інтервалі від приблизно 5,0 до приблизно 7,0, переважно від приблизно 5,5 до приблизно 6,5, наприклад, від приблизно 5,8 до приблизно 6,2, і найбільш переважно має рН близько 6,0. Прикладами буферів, які контролюють значення рН у цьому інтервалі, є ацетат, сукцинат, сукцинат, глюконат, гістидин, цитрат, гліцилгліцин і інші буфери на основі органічних кислот. Кращим буфером згідно із даним винаходом є гістидиновий буфер. "Пстидиновий буфер" являє собою буфер, що містить іони гістидину. Прикладами гістидинових буферів гістидин-хлорид, гістидин-ацетат, гістидин-фосфат, гістидин-сульфат. Кращим гістидиновим буфером, як визначено в прикладах згідно із даним винаходом, є гістидин-ацетат. У кращому варіанті здійснення винаходу, гістидин-ацетатний буфер одержують шляхом титрування L-гістидину (вільна основа, тверда речовина) з оцтовою кислотою (рідина). Переважно, гістидиновий буфер або гістидин-ацетатний буфер має значення рН від 5,5 до 6,5, переважно рН від 5,8 до 6,2. У даному винаході "сахарид" містить загальний склад (СН2О)n і його похідні, включаючи моносахариди, дисахариди, трисахариди, полісахариди, сахароспирти, відновлені цукри, невідновлені цукри й т.д. Прикладами сахаридів згідно із даним винаходом є глюкоза, сахароза, трегалоза, лактоза, фруктоза, мальтоза, декстран, гліцерин, декстран, еритритол, гліцерин, арабіт, силіт, сорбіт, маніт, мелібіоза, мелецитоза, рафіноза, манотріоза, стахіоза, мальтоза, лактулоза, мальтулоза, глюцит, мальтит, лактит, ізо-мальтулоза й ін. Кращим сахаридом згідно із даним винаходом є невідновлений дисахарид, такий як трегалоза або сахароза. У даному винаході "поверхнево-активна речовина" стосується поверхнево-активного агента, переважно неіонної поверхнево-активної речови 21 ни. Прикладами поверхнево-активних речовин для цілей даного винаходу є полісорбат (наприклад, полісорбат 20 і, полісорбат 80); полоксамер (наприклад, полоксамер 188); Тритон; додецилсульфат натрію (SDS); лаурилсульфат натрію; октилглікозид натрію; лаурил-, міристил-, лінолеїл- або стеарил-сульфобетаїн; лаурил-, міристил-, лінолеїл- або стеарил-саркозин; лінолеїл-, міристил- або цетил-бетаїн; лауроамідопропіл-, кокамідопропіл-, лінолеамідопропіл-, міристамідопропіл-, пальмідопропіл-, або ізостеарамідопропіл-бетаїн (наприклад, лауроамідопропіл); міристамідопропіл-, пальмідопропіл-, або ізостеарамідопропілдиметиламін; натрійметилкокоїл-, або динатрійметилолеїл-таурат; і серії MONAQUAT™ (Mona Industries, Inc., Paterson, New Jersey); поліетилгліколь, поліпропілгліколь, і співполімери етилену й пропіленгліколю (наприклад, Pluronics, PF68 і ін.); і ін. Кращою поверхнево-активному речовиною згідно із даним винаходом є полісорбат 20. Термін «рецептор HER» являє собою рецептор білка тирозинкінази, який належить до сімейства рецепторів HER і включає рецептори EGFR, HER2, HER3 і HER4, а також інших представників даного сімейства, які можуть бути ідентифіковані в майбутньому. Рецептор HER звичайно містить позаклітинний домен, що може зв'язувати ліганд HER, ліпофільний трансмембранний домен, консервативний внутрішньоклітинний тирозинкіназний домен і сигнальний домен на карбокси-кінці, який містить декілька тирозинових залишків, які можуть бути фосфориловані. Кращий рецептор HER являє собою нативну послідовність людського рецептора HER. Позаклітинний домен HER2 включає чотири домену: домен І (амінокислотні залишки приблизно на ділянці 1-195), домен II (амінокислотні залишки приблизно на ділянці 196-320), домен III (амінокислотні залишки приблизно на ділянці 321-488) і домен IV (амінокислотні залишки приблизно на ділянці 489-632) (залишки пронумеровані без сигнального пептиду) (див. Garrett та ін., Моl. Cell., 11: 495-505 (2003); Cho та ін., Nature., 421: 756-760 (2003); Franklin та ін., Cancer Cell., 5: 317-328 (2004); або Plowman та ін., Proc. Natl. Acad. Sci., 90: 1746-1750 (1993). Див., також креслення на Фіг.1, прикладений до даного опису. Терміни «ErbB1», «HER1», «рецептор епідермального фактора росту» і «EGFR» у контексті даного опису використовуються взаємозамінно й стосуються EGFR, описаного, наприклад, у роботі Карпентера із співавт. (Carpenter та ін., Ann. Rev. Biochem., 56: 881-914 (1987), включаючи його природні мутантні форми (наприклад, делеційний мутант EGFR, описаний, наприклад, у роботі Хамфрі із співавт. (Humphrey та ін., PNAS (USA), 87: 42074211 (1990)). Термін erbB1 стосується гена, який кодує білковий продукт EGFR. Терміни «ЕrbВ2» і «HER2» використовуються взаємозамінно й стосуються людського білка HER2, описаного в літературі (див., наприклад, Semba та ін., PNAS (USA)., 82: 6497-6501 (1985) і Yamomoto та ін., Nature, 319: 230-234 (1986) (номер доступу в Genebank X03363). Термін «еrb2» стосується гена, який кодує людський ЕrbВ2, і 89798 22 «neu» стосується гена, який кодує щурячий neu р185 . Кращий HER2 являє собою нативну послідовність людського HER2. Терміни «ЕrbВ3» і «HER3» стосуються поліпептидного рецептора, описаного, наприклад, у патентах US 5183884 і 5480968, а також у роботі Крауса із співавт. (Kraus та ін., PNAS (USA), 86: 9193-9197(1989)). Терміни «ErbB4» і «HER4» у контексті даного опису стосуються поліпептидного рецептора, описаного, наприклад у заявці на патент ЕР 599274; а також у роботах Плаумана із співавт. (Plowman та ін., Proc. Natl. Acad. Sci. USA, 90: 1746-1750 (1993), і Plowman та ін., Nature, 366: 473-475 (1993)), включаючи його ізоформи, описані, наприклад, в WO 99/19488, опублікованій 22 квітня 1999 року. Термін «ліганд HER» означає поліпептид, який зв'язується з рецептором HER та/або активує його. Ліганд HER, який представляє особливий інтерес у контексті даного опису, стосується нативної послідовності людського ліганду HER, такого як епідермальний фактор росту (EGF) (Savage та ін., J. Biol. Chem., 247: 7612-7621 (1972)); трансформючий фактор росту альфа (TGF-α) (Marquardt та ін., Science 223 1079-1082 (1984)); амфірегулін, також відомий як аутокринний фактор росту невриноми або кератиноцитів (Shoyab та ін., Science, 243: 1074-1076 (1989)); Kimura та ін., Nature, 348: 257260 (1990); і Cook та ін., Моl. Cell. Bsol., 11: 25472557 (1991); бетацелюлін (Ching та ін., Science 259: 1604-1607 (1993)) і Sasada та ін, Biochem. Biophys. Res. Соmmun., 190: 1173 (1993)); гепаринзв'язувальний епідермальний фактор росту (HBEGF) (Higashiyama та ін., Science, 251: 936-939 (1991)); епірегулін (Toyoda та ін., J. Biol. Chem., 270: 7495-7500 (1995)); і Komurasaki та ін., Oncogene, 15: 2841-2848 (1997)); герегулін (див. нижче); нейрегулін-2 (NRG-2) (Carraway et. al., Nature, 387: 512-516 (1997)); нейрегулін-3 (NRG-3) (Zhang et. al., Proc. Natl. Acad. Sci., 94: 9562-9567 (1997)); нейрегулін-4 (NRG-4) (Harari et. al., Oncogene, 18: 2681-89 (1999)) або крипто (CR-1) (Kannan та ін., J. Biol. Chem., 272(6): 3330-3335 (1997)). Ліганди HER, які зв'язують EGFR, включають EGF, TGF-α, амфірегулін, бетацелюлин, HBEGF і епірегулін. Ліганди HER, які зв'язують HER3, включають герегуліни. Ліганди HER, здатні зв'язувати HER4, включають бетацелюлин, епірегулін, НВ- EGF, NRG-2, NRG-3, NRG-4 і герегуліни. Термін «герегулін» (HRG) у контексті даного опису стосується поліпептиду, який кодується генним продуктом герегуліну, описаного в патенті US 5641869 або в роботі Марчіонні із сшвавт. (Marchionni та ін., Nature, 362: 312-318 (1993)). Приклади герегуліну включають герегулін-α, герегулін-β1, герегулін-β2, герегулін-β3 (Holmes та ін., Science 256: 1205-1210 (1992); і патент US 5641869); фактор диференціації лем (NDF) (Peles та ін., Cell 69: 205-216 (1992)); фактор, який індукує активність ацетилхолінового рецептора (ARIA) (Falls та ін., Cell 72: 801-815 (1993); фактор росту гліальних клітин (GGF) (Marchionni та ін., Nature, 362: 312-318 (1993)); фактор, утворений із сенсорних ι рухових нейронів (SMDF) (Но та ін., J. Biol. Chem., 270: 14523-14532 (1995)); -герегулін 23 (Schaefer et. al., Oncogene 15: 1385-1394 (1997)). Термін включає також біологічно активні фрагменти та/або варіанти за амінокислотною послідовністю нативної послідовності поліпептиду HRG, такі як EGF-подібний фрагмент його домену (наприклад, HRGp1177-244). Термін «димер HER» у контексті даного опису являє собою нековалентно асоційований димер, який включає принаймні два різні рецептори HER. Такі комплекси можуть утворюватися, коли клітина, яка експресує два або декілька рецепторів HER, піддається впливу ліганду HER, і можуть бути виділені імунопреципітацією і далі проаналізовані методом SDS-PAGE, як описано, наприклад, у роботі Silwkowski та ін., J. Biol. Chem., 269(20): 14661-14665 (1994). Приклади таких димерів HER включають гетеродимери EGFR-HER2, HER2-HER3 і HER3-HER4. Крім того, димер HER може включати два або більше рецептори HER2, об'єднаних з іншим рецептором HER, таким як HER3, HER4 або EGFR. З димером можуть бути асоційовані інші білки, такі як субодиниця цитокінового рецептора (наприклад, gp130). Термін «сайт зв'язування гетеродимеру» на HER2 стосується ділянки в позаклітинному домені HER2, яка контактує або вступає у взаємодію з ділянкою в позаклітинному домені EGFR, HER3 або HER4 при утворенні з них димеру. Така ділянка виявлена в домені II в HER2 (Franklin та ін., Cancer Cell, 5: 317-328(2004)) Терміни «активація HER» або «активація HER2» стосуються активації або фосфорилуванню одного або декількох рецепторів HER або рецепторів HER2. В основному, активація HER приводить до сигнальної трансдукції (яка, наприклад, викликається внутрішньоклітинним доменом кінази, яка фосфорилує тирозинові залишки в рецепторі HER або в поліпептидному субстраті). HER активація може бути опосередкована зв'язуванням ліганду HER з димером HER, що включає рецептор HER, який представляє інтерес. Зв'язування ліганду HER з димером HER може активувати домен кінази одного або декількох рецепторів HER у димері й, таким чином, приводити до фосфорилування тирозинових залишків в одному або декількох рецепторах HER та/або до фосфорилування тирозинових залишків у додатковому(их) поліпептиді(ах) субстрату, такому як внутрішньоклітинні Akt або МАРК кінази. Термін «антитіло» у контексті даного опису використовується в найбільш широкому розумінні й конкретно охоплює повнорозмірні моноклональні антитіла, поліклональні антитіла, поліспецифічні антитіла (наприклад, біспецифічні антитіла), утворені принаймні із двох повнорозмірних антитіл і фрагментів антитіл, які демонструють бажану біологічну активність. Термін «моноклональне антитіло» у контексті даного опису стосується антитіла, отриманого з популяції по суті гомогенних антитіл, наприклад, індивідуальних антитіл, що включають популяцію, представники якої ідентичні або зв'язуються з тим самим епітопом, за винятком можливих варіантів, які можуть виникати в процесі продукції моноклонального антитіла, такі варіанти звичайно присутні 89798 24 в мінорних кількостях. На відміну від препаратів поліклональних антитіл, які в типовому випадку включають різні антитіла, спрямовані проти різних детермінант (епітопів), кожне моноклональне антитіло спрямоване проти однієї детермінанти на антигені. Крім своєї специфічності, моноклональні антитіла мають перевагу в тому, що вони не забруднені іншими імуноглобулінами. Визначення «моноклональний» вказує на характер антитіла, які одержують по суті з гомогенної популяції антитіл, і його не слід трактувати в плані обмеження способу одержання антитіл певним методом. Наприклад, моноклональні антитіла, використовувані відповідно до даного винаходу, можуть бути отримані за методом гідридом, вперше описаному Kohler та ін., Nature, 256: 495 (1975), або можуть бути отримані з використанням рекомбінантої ДНК (див., наприклад, патент US 4816567). «Моноклональні антитіла» можуть бути виділені з бібліотеки фагових антитіл з використанням методик, описаних у літературі (див., наприклад, Clackson та т , Nature, 352: 624-628 (1991) і Marks та ін., J. Моl. Вiol., 222: 581-597 (1991)). Наведені в даному описі моноклональні антитіла включають, зокрема, «химерні» антитіла, у яких частина важкого та/або легкого ланцюга ідентична або гомологічна до відповідних послідовностей в антитілах, отриманих з конкретного виду або які належать конкретному класу або підкласу антитіл, тоді як частина ланцюга(ів), що залишилася, ідентична або гомологічна до відповідних послідовностей в антитілах, отриманих з іншого виду або які належать до іншого класу або підкласу антитіл, а також фрагменти таких антитіл, за умови, що вони демонструють бажану біологічну активність (патент US 4816567; і Morrison та ін., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). Цікаві в контексті даного опису химерні антитіла включають «приматизовані» антитіла, які включають антигензв'язувальні послідовності варіабельного домену, отримані від приматів, відмінних від людини (наприклад, Old World Monkey, Аре і т.п.), і послідовності константної ділянки людської молекули. Термін «фрагменти антитіл» включає частина повнорозмірного антитіла, що переважно включає антиген-зв'язувальну або варіабельну ділянку. Приклади антитільних фрагментів включають фрагменти Fab, Fab', F(ab')2 і Fv, диантитіла, лінійні антитіла, одноланцюгові молекули антитіл і поліспецифічні антитіла, утворені з антитільного(их) фрагмента(ів). «Повнорозмірне антитіло» являє собою таке антитіло, яке включає антиген-зв'язувальну варіабельну ділянку, а також константний домен легкого ланцюга (CL) і константні домени важкого ланцюга СН1, СН2 і СН3. Константні домени можуть являти собою константні домени нативної послідовності (наприклад, константні домени нативної послідовності людини) або їх варіанти за амінокислотною послідовністю. Переважно, повнорозмірне антитіло має одну або декілька ефекторні функції. Термін «основний вид антитіла» у контексті даного опису стосується структури антитіла в композиції, що у кількісному відношенні являє собою 25 переважну антитільну молекулу в композиції. В одному варіанті здійснення винаходу, основний вид антитіла являє собою антитіло до HER2, таке як антитіло, яке зв'язується з доменом II HER2, антитіло, яке інгібує димеризацію HER більш ефективно, ніж Трастузумаб (Trastuzumab), та/або антитіло, яке зв'язується із сайтом зв'язування гетеродимеру HER2. Кращий варіант вказаного основного виду антитіла до HER2 у контексті даного опису являє собою такий варіант, який включає варіабельну легку й варіабельну важку амінокислотні послідовності SEQ ID NO: 3 і 4, і найбільш переважно, включає амінокислотні послідовності легкого ланцюга й важкого ланцюга, SEQ ID NO: 15 і 16 (Пертузумаб). Термін «варіант амінокислотної послідовності» антитіла в контексті даного опису являє собою антитіло з амінокислотною послідовністю, яка відрізняється від послідовності, наявної в основному виді антитіла. Звичайно варіанти амінокислотної послідовності мають принаймні приблизно 70% гомологію з основним видом антитіла й, переважно, вони характеризуються принаймні приблизно 80%, більш переважно, принаймні 90% гомологією з основним видом антитіла. Варіанти амінокислотної послідовності містять заміщення, делеції та/або вставки в певних положеннях всередині даної амінокислотної послідовності або в безпосередній близькості від амінокислотної послідовності основного виду антитіла. Приклади варіантів амінокислотних послідовностей у контексті даного опису включають кислий варіант (наприклад, дезамідований варіант антитіла), основний варіант, антитіло з лідерним подовженням на аміно-кінці (наприклад, VHS-) на його одному або двох легких ланцюгах, антитіло з С-кінцевим лізиновим залишком на його одному або двох важких ланцюгах, і т.п., а також включають сполучення різних амінокислотних послідовностей важкого та/або легкого ланцюгів. Варіанти антитіл, особливо цікаві в контексті даного опису, являють собою антитіло, яке включає лідерне подовження на аміно-кінці в одному або двох ланцюгах антитіла, що необов'язково також включає інші відмінності за амінокислотною послідовністю та/або за глікозилуванням відносно основного виду антитіла. "Терапевтичне моноклональне антитіло" являє собою антитіло, яке використовується для лікування людини. Терапевтичні моноклональні антитіла, описані в даному винаході, включають: HER2 антитіла для злоякісних і різних незлоякісних захворювань або розладів; CD20 або BR3 антитіла для лікування злоякісних В-клітин, аутоімунних захворювань, відторгнення трансплантата або блокування імунної реакції-відповіді на чужорідний антиген; IgE антитіла для лікування IgEопосередкованого розладу; DR5 або VEGF антитіла для лікування злоякісного новоутворення. Термін «варіант за глікозилуванням» антитіла в контексті даного опису стосується антитіла з одним або декількома вуглеводними фрагментами, приєднаними до молекули, яка відрізняється від одного або декількох вуглеводних фрагментів, приєднаних до антитіла основного виду. Приклади варіантів за глікозилуванням включають антитіло з 89798 26 G1 або G2 олігосахаридною структурою замість G0 олігосахаридної структури, приєднаної до Fc ділянки, антитіло з одним або двом вуглеводними фрагментами, приєднаними до його одного або двох легких ланцюгів, антитіло без вуглеводного фрагмента, приєднаного до його одного або двох важким ланцюгів антитіла й т.п., а також сполучення таких змін у глікозилуванні. У тому випадку, коли антитіло містить Fc ділянку, олігосахаридна структура, така як структура, показана на Фіг.16, може бути приєднана до одного або двох важких ланцюгів антитіла, наприклад, за залишком 299 (298, нумерація залишків згідно із Еu). У випадку Пертузумабу, G0 являє собою домінуючу олігосахаридну структуру, з іншими можливими олігосахаридними структурами, такими як G0-F, G-1, Man5, Маn6, G1-1, G1(1-6), G1(1-3) і G2, які зустрічаються в менших кількостях у композиції Пертузумабу. Якщо спеціально не вказано інакше, термін «G1 олігосахаридна структура» у контексті даного опису включає G1-1, G1-1, G1(1-6) і G1(1-3) структури. Термін «лідерне подовження на аміно-кінці» у контексті даного опису стосується одного або декількох амінокислотних залишків аміно-кінцевої лідерної послідовності, які присутні на аміно-кінці одного або декількох важких або легких ланцюгів антитіла. Приклад аміно-кінцевого лідерного подовження включає три амінокислотних залишки або складається із трьох амінокислотних залишків VHS, присутніх на одному або обох легких ланцюгах варіанта антитіла. Термін «гомологія» визначається як відсоток залишків в амінокислотній послідовності варіанта, які оцінюються як ідентичні, за результатами вирівнювання послідовностей і введення, при необхідності, гепів, для досягнення максимального відсотка гомології. Способи й комп'ютерні програми, які застосовують для такого вирівнювання, відомі в даній галузі. Одна з відповідних комп'ютерних програм являє собою «Align 2», розроблену компанією Genentech Inc., що була зареєстрована з документацією для користувачів у Бюро США із захисту авторських прав (United States Copyright Office, Washington, DC 20559) 10 грудня 1991 року. Термін «ефекторні функції» антитіла стосується біологічної активності, обумовленої Fc ділянкою (нативна послідовність Fc ділянки або варіант Fc ділянки за амінокислотною послідовністю) антитіла. Приклади ефекторних функцій антитіла включають зв'язування С1q, комплементзалежна цитотоксичність, зв'язування Fc рецептора, антитілообумовлена клітиннозалежна цитотоксичність (ADCC), фагоцитоз, негативна регуляція рецепторів клітинної поверхні (наприклад, рецептора В клітин; BCR) і т.п. Залежно від амінокислотної послідовності константної ділянки своїх важких ланцюгів повнорозмірні антитіла можуть бути розділені на різні «класи». Ідентифіковано п'ять основних класів повнорозмірних антитіл: IgA, IgD, IgE, IgG i IgM, і деякі з них можуть бути поділені на «підкласи» (ізотипи), наприклад, IgG1, IgG2, IgG3, lgG4, IgA i IgA2. Важкий ланцюг константних доменів, що від 27 повідає різним класам антитіл, називають α, δ, ε, та μ, відповідно. Субодиничні структури й тривимірні конфігурації різних класів імуноглобулінів добре відомі. Терміни «антитіло-обумовлена клітиннозалежна цитотоксичність» і «ADCC» стосуються клітинної реакції, у якій специфічні цитотоксичні клітини, які експресують Fc рецептори (Fc) (наприклад, природні клітини-кілери (NK), нейтрофіли й макрофаги), розпізнають зв'язане антитіло на цільовій клітині й далі викликають лізис цільової клітини. Первинні клітини для реакції ADCC, клітини NK експресують тільки Fc RIII, тоді як моноцити експресують Fc RI, Fc RII і Fc RIII. Експресія Fc на гематопоетичних клітинах показана в таблиці 3 на сторінці 464 у роботі Раветча й Кінета (Ravetch and Kinet, Annu. Rev. Immunol, 9: 457-92 (1991)). Для оцінки ADCC активності молекули, що цікавить, проводять тест ADCC in vitro, описаний у патенті US 5500362 або 5821337. Застосовувані в таких тестах ефекторні клітини включають мононуклеарні клітини периферичної крові (МНПК (РВМС)) і природні клітини-кіллери (NK). Альтернативно або додатково, ADCC активність молекули, що цікавить, може бути оцінена in vitro, наприклад, на моделі тварин, такий як описана в роботі Клайнеса із співавт. (Clynes та ін., PNAS (USA), 95: 652-656 (1998)). Термін «ефекторні клітини людини» стосується лейкоцитів, які експресують один або декілька Fc і виконують ефекторну функцію. Переважно клітина експресує принаймні Fc RIII і виконує ADCC ефекторну функцію. Приклади людських лейкоцитів, які задіюються в ADCC, включають мононуклеарні клітини периферичної крові (МНПК), природні клітини-кілери (NK), моноцити, цитотоксичні Τ клітини і нейтрофіли, при цьому МНПК і ΝΚ клітини є кращими. Ефекторні клітини можуть бути виділені зі свого нативного джерела, наприклад, із крові або МНПК, як показано в даному описі. Терміни «Fc рецептор» або «FcR» у контексті даного опису використовується для опису рецептора, що зв'язується з Fc ділянкою антитіла. Переважно FcR являє собою нативну послідовність людського FcR. Крім того, кращий FcR являє собою такий рецептор, який зв'язується з IgG антитілом (гама рецептор), і включає рецептори підкласів Fc RI, Fc RII і Fc RIII, у тому числі алельні варіанти й форми вказаних рецепторів, отримані при альтернативному сплайсингу. Рецептори Fc RII включають Fc RIIA («активуючий» рецептор) і Fc RIIB («інгібуючий» рецептор), які мають подібні амінокислотні послідовності й відрізняються, насамперед, за своїми цитоплазматичними доменами. Активуючий рецептор Fc RIIA включає тирозин-вмісний активуючий мотив імунорецептора (ІТАМ) у своєму цитоплазматичному домені Інгібуючий рецептор Fc RIIB включає тирозинвмісний інгібуючий мотив імунорецептора (ІТІМ) у своєму цитоплазматичному домені (див. огляд М. in Daeron, Annu. Rev. Immunol., 15: 203-234 (1997)). Fc описані в ряді робіт (Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-92 (1991); Capel та ін., Immunomethods, 4: 25-34 (1994); і de Haas тa iн., J. 89798 28 Lab. Clin. Med., 126: 330-41 (1995)). Інші FcR, включаючи такі форми, які можуть бути ідентифіковані в майбутньому, охоплюються терміном «FcR», який використовують у даному описі. Даний термін також включає неонатальний рецептор FcRn, який відповідає за перенесення материнських IgG у плід (Guyer та ін., J. Immunol., 117-587 (1976) і Kim та ін., J. Immunol., 24: 249 (1994)). Термін «комплементзалежна цитотоксичність» або «CDC» стосується здатності молекули лізувати свою мішень у присутності комплементу. Шлях активації комплементу ініціюється в результаті зв'язування першого компонента системи комплементу (Clq) з молекулою (наприклад, антитілом) у комплексі з відповідним антигеном. Для оцінки активації комплементу проводять CDC тест, описаний, наприклад, у роботі Gazzano-Santoro тa iн.,J Immunol Methods 202: 163 (1996). Термін «нативні антитіла» звичайно означає гетеротетрамерні глікопротеїни з масою приблизно 150000 Дальтон, які складаються із двох ідентичних легких (L) ланцюгів і двох ідентичних важких (Н) ланцюгів. Кожний легкий ланцюг приєднаний до важкого ланцюга одним ковалентним дисульфідним зв'язком, при цьому кількість дисульфідних зв'язків у важких ланцюгах різних імуноглобулінових ізотипів варіює. Кожний важкий і легкий ланцюг також містить певним чином розташовані міжланцюгові дисульфідні містки. Кожний важкий ланцюг містить один кінцевий варіабельний домен (VH), за яким знаходиться декілька константних доменів. Кожний легкий ланцюг має варіабельний домен на одному кінці (VL) і константний домен на іншому кінці. Константний домен легкого ланцюга певним чином розташований відносного першого константного домену важкого ланцюга, і варіабельний домен легкого ланцюга певним чином розташований відносно варіабельного домену важкого ланцюга. Вважається, що деякі амінокислотні залишки утворюють інтерфейс між варіабельними доменами легкого ланцюга й важкого ланцюга. Термін «варіабельний» визначає той факт, що деякі частини варіабельних доменів істотно відрізняються за послідовністю між антитілами й виконують певну роль при зв'язуванні й визначенні специфічності кожного конкретного антитіла до конкретного антигену. Однак, варіабельність нерівномірно розподілена за варіабельними доменами антитіл. Вона сконцентрована в трьох сегментах, які називаються гіперваріабельними ділянками, у варіабельних доменах, як легкого ланцюга, так і важкого ланцюга. Більш висококонсервативні частини варіабельних доменів називають каркасними ділянками (FR). Варіабельні домени нативних важкого й легкого ланцюга включають, кожний, чотири FR, які в основному мають β-складчасту конфігурацію, з'єднаний трьома гіперваріабельними ділянками, які утворюють петлі, що об'єднують і в деяких випадках утворюючу частину β-складчастої структури. Гіперваріабельні ділянки в кожному ланцюзі підтримуються разом у безпосередній близькості від FR і разом з гіперваріабельними ділянками іншого ланцюга беруть участь в утворенні антиген-зв'язувального сайту антитіл (див. 29 Kabat та ін., Sequences of Proteins of Immunological th Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константні домени не утягуються безпосередньо у зв'язування антитіла з антигеном, але демонструють різні ефекторні функції, такі як участь антитіла в антитілообумовленої клітиннозалежної цитотоксичності (ADCC). Термін «гіперваріабельна ділянка» у контексті даного опису стосується амінокислотних залишків антитіла, які відповідають за зв'язування антигену. Гіперваріабельна ділянка, в основному, включає амінокислотні залишки з «ділянки, яка визначає комплементарність» або «CDR» (наприклад, залишки 24-34 (L1), 50-56 (L2) і 89-97 (L3) у варіабельному домені легкого ланцюга й 31-35 (Н1), 50-56 (Н2) і 95-102 (Н3) у варіабельному домені важкого ланцюга (Kabat та ін., Sequences of Proteins of th Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) та/або залишки з «гіперваріабельної петлі» (наприклад, залишки 26-32 (L1), 50-52 (L2) і 91-96 (L3) у варіабельному домені легкого ланцюга й 26-32 (Н1), 53-55 (Н2) і 96-101 (Н3) у варіабельному домені важкого ланцюга (Chothia and Lesk J. Моl. Βiol., 196: 901-917 (1987)). Залишки в «каркасній ділянці» або «FR» включають такі залишки варіабельного домену, які відрізняються від залишків, що входять у гіперваріабельний домен, наведений вище. Розщеплення антитіл папаїном дає два ідентичних антигензв'язувальних фрагменти, які називають «Fab» фрагментами, кожний з яких містить один антигензв'язувальний сайт і залишковий «Fc» фрагмент, назва якого відображає його здатність швидко кристалізуватися. Пепсинова обробка приводить до одержання фрагмента F(ab')2, що містить два антигензв'язувальні сайти й усе ще здатний до об'єднання з антигеном. «Fv» являє собою мінімальний антитільний фрагмент, що містить повний сайт розпізнавання антигену й зв'язування антигену. Дана ділянка складається з димеру, який включає один варіабельний домен важкого ланцюга й один варіабельний домен легкого ланцюга, у твердій, нековалентній асоціації. Ця така конфігурація, у рамках якої три гіперваріабельних ділянки кожного варіабельного домену взаємодіють, визначаючи сайт зв'язування антигену на поверхні VH-VL димера. У сукупності, шість гіперваріабельних ділянок визначають антигензв'язувальнуюспецифічність антитіла. Однак, навіть один варіабельний домен (або половина Fv, який включає тільки три гіперваріабельні ділянки, специфічних для антигену) має здатність розпізнавати антиген і зв'язуватися з ним, хоча й з меншої афінністю, ніж повний сайт зв'язування. Fab фрагмент також містить константний домен легкого ланцюга й перший константний домен (СНІ) важкого ланцюга. Fab' фрагменти відрізняються від Fab фрагментів додаванням декількох залишків на карбокси-кінці СНІ домену важкого ланцюга, що включає один або декілька цистеїнів із шарнірної ділянки антитіла. Fab'-SH являє собою позначення Fab', у якому цистеїновий(і) зали 89798 30 шок(ки) константних доменів містять принаймні одну вільну тіолову групу. F(ab')2 фрагменти антитіл звичайно одержують у вигляді пари Fab' фрагментів, які містять між собою шарнірні цистеїни. Відомі також інші хімічні структури фрагментів антитіл. Термін «легкі ланцюги» антитіл з будь-якого виду хребетних може стосуватися одного із двох типів, які чітко відрізняються, що називають каппа ( ) і ламбда ( ), що визначається амінокислотними послідовностями їх константних доменів. «Одноланцюгові Fv» або «scFv» фрагменти антитіл включають домени VH і VL антитіла, де вказані домени присутні в одноланцюговому поліпептиді. Переважно Fv поліпептид також включає поліпептидний лінкер між доменами VH і VL, що дозволяє «scFv» формувати бажану структуру для зв'язування антигену. У літературі є огляд scFv (див. Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol.113, Rosenberg and Moore eds., Springer-Verlag, New York, pp.269-315 (1994)). scFv фрагменти антитіл до HER2 описані в WO 93/16185, у патенті US 5571894 і патенті US 5587458. Термін «диантитіла» стосується малих фрагментів антитіл із двома антигензв'язувальними сайтами, фрагменти яких включають варіабельний домен важкого ланцюга (VH), з'єднаний з варіабельним доменом легкого ланцюга (VL) в одному і тому ж поліпептидному ланцюзі (VH-VL). При використанні лінкера, довжина якого занадто мала для того, щоб здійснювалося спарювання між двома доменами одного ланцюга, створюються умови для того, щоб домени спаровувалися з комплементарними доменами іншого ланцюга з утворенням двох антигензв'язувальних сайтів. Диантитіла більш повно описані, наприклад, в ЕР 404097, WO 93/11161 і Hollinger та ін., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993). «Гуманізовані» форми антитіл з організмів, відмінних від людини (наприклад, із гризунів), являють собою химерні антитіла, які містять мінімальну послідовність, отриману з імуноглобуліну, відмінного від людського. Найчастіше, гуманізовані антитіла являють собою людські імуноглобуліни (реципієнтне антитіло), у яких залишки з гіперваріабельної ділянки реципієнта заміщені залишками з гіперваріабельної ділянки від виду, відмінного від людини (донорне антитіло), такого як миша, щур, кролик або примат, відмінний від людини, які мають бажану специфічність, афінність й функціональні властивості. У деяких випадках залишки каркасної ділянки (FR) людського імуноглобуліну заміщають відповідними залишками із джерела, відмінного від людини. Крім того, гуманізовані антитіла можуть включати залишки, які не зустрічаються в реципієнтному антитілі або в донорному антитілі. Такі модифікації створюють для того, щоб додатково підвищити функціональні можливості антитіла. У цілому, гуманізоване антитіло включає по суті всі або принаймні один або, у типовому випадку, два варіабельні домени, у яких всі або по суті всі гіперваріабельні петлі відповідають таким в імуноглобуліні, відмінному відлюдний, або всі або по суті всі FR представляють такі 31 FR, які мають послідовність імуноглобуліну людини. Гуманізоване антитіло необов'язково також буде включати принаймні частину константної ділянки імуноглобуліну (Fc), у типовому випадку людського імуноглобуліну. Додаткові деталі описані в літературі (Jones та ін., Nature 321: 522-525 (1986); Riechmann та ін., Nature 332: 323-329 (1988) і Presta Curr. Op. Struct. Biol., 2: 593-596 (1992)). Гуманізовані антитіла до HER2 включають huMAb4D5-l, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 і huMAb4D5-8 або Trastuzumab (HERCEPTIN®), як показано в таблиці 3 у патенті US 5821337, що включений у даний опис як посилання; гуманізовані антитіла 520С9 (WO 93/21319) і гуманізовані антитіла 2С4 наведені в даному описі. У контексті даного опису терміни Трастузумаб (HERCEPTIN®) і huMAb4D5-8 стосуються антитіла, яке включає амінокислотні послідовності легкого й важкого ланцюгів SEQ ID NO: 13 і 14, відповідно. У контексті даного опису терміни Пертузумаб, rhuMAb 2C4 і OMNITARG™ стосуються антитіла, яке включає амінокислотні послідовності варіабельного легкого й варіабельного важкого ланцюгів SEQ ID NO: 3 і 4, відповідно. У тому випадку, коли Пертузумаб являє собою повнорозмірне антитіло, він переважно включає амінокислотні послідовності легкого й важкого ланцюгів SEQ ID NO: 15 і 16, відповідно. «Оголене антитіло» являє собою таке антитіло (у контексті даного опису), що не кон'юговано з гетерологічною молекулою, такою як цитотоксичний фрагмент або радіоактивна мітка. Антитіло із "зрілою афінністю" являє собою антитіло з одним або декількома змінами в одній або більше з його гіперваріабельних ділянок, які приводять до поліпшення спорідненості антитіла до антигену, у порівнянні з батьківським антитілом, що не має цієї (их) зміни(змін). Кращі антитіла зі зрілою афінністю мають спорідненість із антигеном-мішенню в наномолярному або навіть пікомолярному діапазоні. Антитіла зі зрілою афінністю одержують за допомогою методик, відомих у даній галузі. В Marks та ін. Bio/Technology 10: 779-783 (1992) описане дозрівання афінності за допомогою перестановки VH і VL доменів. Випадковий мутагенез CDR та/або каркасних ділянок описаний в: Barbas та ін. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier та ін. Gene 169: 147-155 (1995); Yelton та ін. J. Immunol. 155: 1994-2004 (1995); Jackson та ін., J. Immunol. 154(7): 3310-9 (1995); і Hawkins і ін, J. Моl. Biol. 226: 889-896 (1992). "Агоніст антитіла" являє собою антитіло, яке зв'язується з рецептором і активує його. Як правило, здатність агоніста антитіла активувати рецептор є принаймні кількісно подібна (і може бути надзвичайно кількісно подібна) із природним лігандом агоніста рецептора. Прикладом агоніста антитіла є агоніст, що зв'язується з рецептором суперсімейства рецепторів TNF, таким як DR5, і індукує апоптоз клітин, які експресують рецептор TNF (наприклад, DR5). Дослідження для визначення індукції апоптозу описані в заявках WO 89798 32 98/51793 і WO 99/37684, які обидві спеціально включені в даний винахід як посилання. «Виділене» антитіло являє собою таке антитіло, яке було ідентифіковане та/або відновлене з компонента його природного оточення. Контамінуючі компоненти природного оточення включають матеріали, які можуть перешкоджати діагностичному або терапевтичному використанню антитіла, і можуть включати ферменти, гормони й інші протеїнові й непротеїнові розчинені речовини. У кращих варіантах антитіло очищають (1) до вмісту більше, ніж 95мас.% антитіла, за даними методу Лоурі, і найбільш переважно до вмісту більше, ніж 99мас.% (2) до ступеня, достатнього для одержання принаймні 15 залишків N-кінцевої або внутрішньої амінокислотної послідовності при проведенні центрифужного варіанта секвенування або (3) до гомогенності, за результатами аналізу в SDSPAGE, у відновних або в не відновних умовах, з використанням кумасі-блю або, переважно, з використанням срібного барвника. Виділене антитіло включає антитіло in situ у рекомбінантних клітинах, де не присутній принаймні один компонентів із природного оточення антитіла. Однак, звичайне антитіло виділяють із використанням принаймні однієї стадії очищення. Антитіло до HER2, що «інгібує димеризацію HER більш ефективно, ніж Трастузумаб», являє собою таке антитіло, яке знижує або усуває утворення димеру HER2 більш ефективно (наприклад, принаймні у два рази більш ефективно), ніж Трастузумаб. Переважно таке антитіло інгібує димеризацію HER2 принаймні також ефективно, як антитіло, вибране із групи, яка складається з моноклонального антитіла миші 2С4, Fab фрагменту мишиного моноклонального антитіла 2С4, Пертузумабу й Fab фрагменту Пертузумабу. Можна оцінити інгібування димеризації HER при безпосередньому дослідженні димерів HER або за результатами оцінки активації HER, або за проходженням сигналу в напрямку зчитування інформації, які приводять до димеризації HER та/або на основі аналізу сайту зв'язування aнтитіла-HER2 і т.п. Тести для скринінгу антитіл на їх здатність інгібувати димеризацію HER, більш ефективних, ніж Трастузумаб, описані в літературі (Agus та ін., Cancer Cell 2: 127-137 (2002) і WO 01/00245 (Adams та ін.)). Тільки як приклад слід зазначити, що можна тестувати інгібування димеризації HER при оцінці, наприклад, інгібування утворення димеру HER (див., наприклад, Фіг.1А-В у роботі Agus та ін., Cancer Cell, 2: 127-137 (2002) і WO 01/00245), за зниженням активації ліганду HER у клітинах, які експресують димери HER (див., наприклад, WO 01/00245 і Фіг.2В у роботі Agus та ін., Cancer Cell, 2: 127-137 (2002)); за блокуванням зв'язування ліганду HER із клітинами, які експресують димери HER (див., наприклад, WO 01/00245 і Фіг.2Е в роботі Agus та ін., Cancer Cell, 2: 127- 137 (2002)); за інгібуванням росту ракових клітин (наприклад, клітин MCF7, MDA-MD-134, ZR-75-1, MD-MB-175, Т-47D), які експресують димери HER у присутності (або за відсутності) ліганду HER (див., наприклад, WO 01/00245 і Фіг.3A-D у роботі Agus та ін., Cancer Cell, 2: 127-137 (2002)); за інгібуванняи прохо 33 дження сигналу внапрямку зчитування інформації (наприклад, за інгібуванням HRG-залежного фосфорилування АКТ або за інгібуванням HRG- або TGF-α-залежного фосфорилування МАРК) (див., наприклад, WO01/00245 і Фіг.2C-D у роботі Agus та ін., Cancer Cell, 2: 127-137 (2002)). Можна оцінити, інгібує чи антитіло димеризацію HER шляхом вивчення сайту зв'язування aнтитіло-HER2, наприклад, при оцінці структури або моделі, такої як кристалічна структура антитіла, зв'язаного з HER2 (див., наприклад, Franklin та ін., Cancer Cell, 5: 317-328 (2004)). Антитіло до HER2 може «інгібувати HRGзалежне фосфорилування АКТ» та/або «інгібувати HRG- або TGFa-залежне фосфорилування МАРК» більш ефективно (наприклад, принаймні більш ефективно у два рази), ніж Трастузумаб (див., наприклад, як приклад Agus та ін., Cancer Cell, 2: 127-137 (2002) і WO 01/00245). Антитіло до HER2 може являти собою таке антитіло, яке «не інгібує розщеплення ектодомену HER2» (Molina та ін., Cancer Res., 61: 4744-4749 (2001)). Антитіло до HER2, яке «зв'язується із сайтом зв'язування гетеродимеру» HER2, зв'язується із залишками в домені II (і необов'язково також зв'язується із залишками інших доменів позаклітинного домену HER2, таких як домени І і III) і може просторово заважати, принаймні до деякої міри, утворенню гетеродимеру HER2-EGFR, HER2HER3, HER2-HER4. Франкліна із співавт. (Franklin та ін., Cancer Cell, 5: 317-328 (2004)) охарактеризували кристалічну структуру гетеродимеру HER2IleTy3yMa6, депонованого в банку даних білків (RCSB Protein Data Bank (ID Code IS78)), привівши приклад антитіла, яке зв'язується із сайтом зв'язування гетеродимеру HER2. Антитіло, яке «зв'язується з доменом II» в HER2, зв'язується із залишками в домені II і необов'язково із залишками в іншому(них) домені(ах) HER2, таких як домени І і III. Краще антитіло, яке зв'язується з доменом II, зв'язується з місцем з'єднання між доменами І, II і III в HER2. Термін «агент, який інгібує ріст» у контексті даного опису стосується з'єднання або композиції, які інгібують ріст клітини, особливо HERекспресуючої ракової клітини in vitro або in vivo. Таким чином, агент, який інгібує ріст, може бути таким агентом, що істотно знижує відсоток HERекспресуючих клітин в S фазі. Приклади рістінгібуючих агентів включають агенти, які блокують прогресію клітинного циклу (у місці, відмінному від S фази), такі як агенти, які індукують зупинку на G1 фазі й зупинку на Μ фазі. Класичні блокатори Μ фази включають алкалоїди барвінку (вінкристин і вінбластин), таксани й інгібітори топоізомерази II, такі як доксорубіцин, епірубіцин, даунорубіцин, етопозид і блеоміцин. Дія агентів, які індукують зупинку на G1 фазі, також поширюється на S фазу, зупиняючи її, і включають, наприклад, ДНКалкувальні агенти, такі як тамоксифен, преднізон, дакарбазин, меклоретамін, цисплатин, метотрексат, 5-фторурацил і ара-С. Додаткова інформація може бути знайдена у відповідному посібнику (The Molecular Basis of Cancer, Mendelsohn and Israel, 89798 34 eds., Chapter 1, за назвою «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami та ін. (WB Saunders: Philadelphia, 1995), особливо с.13). Приклади антитіл, «які інгібують ріст», включають такі антитіла, які зв'язуються з HER2 і інгібують ріст ракових клітин, які суперекспресують HER2. Кращі рістінгібуючі антитіла до HER2 інгібують ріст пухлинних клітин молочної залози SKBR-3 у клітинній культурі більш ніж на 20%, і переважно більш ніж на 50% (зокрема, від приблизно 50% до приблизно 100%), у концентрації антитіла, рівної приблизно 0,5-30 мкг/мл, де інгібування росту визначають через шість днів після експозиції клітин SK-BR-3 з антитілами (див. патент US 5677171, виданий 14 жовтня 1997 року). Тест на інгібування росту клітин SK-BR-3 описаний більш детально в вказаному патенті й також наводиться нижче в даному описі. Краще рістінгібуюче антитіло являє собою гуманізований варіант мишиного моноклонального антитіла 4D5, наприклад, Трастузумаб. Антитіло, яке «індукує апоптоз», являє собою таке антитіло, яке індукує програмовану загибель клітин, яку визначають за зв'язуванням анексину V, за фрагментацією ДНК, за зморщуванням клітини, розведенню ендоплазматичного ретикулюма, фрагментації клітин та/або за утворенням мембранних везикул (які називають апоптозними тілами). Вказана клітина звичайно представляє таку клітину, яка експресує антиген, з яким зв'язується антитіло. Переважно, така клітина являє собою пухлинну клітину. Наприклад, транслокація фосфатидилсерину (ФС) може бути виміряна за зв'язуванням анексину; фрагментація ДНК може бути оцінена за утворенням «ступінчастості» ДНК; і ядерна/хроматинова конденсація разом із фрагментацією ДНК може бути оцінена за збільшенням числа гіподиплоїдних клітин. Переважно, антитіло, яке індукує апоптоз, являє собою таке антитіло, яке приводить до приблизно 2-50-кратної, переважно, приблизно 5-50-кратної й, найбільш переважно, приблизно до 10-50-кратної індукції зв'язування анексину, щодо необроблених клітин, у тесті на зв'язування анексину з використанням клітин, які експресують антиген, з яким зв'язується антитіло. Приклади антитіл, які індукують апоптоз, включають HER2 антитіла 7С2 і 7F3, і певні DR5 антитіла. «Епітоп 2С4» являє собою ділянку в позаклітинному домені HER2, з якою зв'язується антитіло 2С4. Для проведення скринінгу з метою виявлення антитіл, які зв'язуються з епітопом 2С4, може бути проведений звичайний тест з перехресного блокування, такий як тест, описаний у відповідному посібнику (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ED Harlow and David Lane (1988)). Альтернативно, може бути проведене картування епітопу для оцінки, чи зв'язується антитіло з епітопом 2С4 в HER2. Епітоп 2С4 включає залишки домену II у позаклітинному домені HER2.234 і Пертузумаб зв'язуються з позаклітинним доменом HER2 у місці з'єднання доменів І, II і ІІІ (Franklin та ін., Cancer Cell 5: 317-328 (2004)). «Епітоп 4D5» являє собою ділянку в позаклітинному домені HER2, з якою зв'язуються антитіло 35 4D5 (АТСС CRL 10463) і Трастузумаб. Даний епітоп розташований близько до трансмембранного домену HER2, локалізуючись всередині домену IV в HER2. З метою скринінгу антитіл, які зв'язуються з епітопом 4D5, проводять традиційний тест з перехресного блокування, описаний, наприклад, у відомому посібнику (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ED Harlow and David Lane (1988)). Альтернативно, може бути проведене картування епітопу для оцінки, чи зв'язується антитіло з 4D5 епітопом в HER2 (наприклад, з одним або декількома залишками на ділянці, яка включає залишки від приблизно 529 до приблизно 625, включно, в HER2). «Епітоп 7C2/7F3» являє собою ділянку на амінокінці всередині домену І позаклітинного домену HER2, з якою зв'язуються антитіла 7С2 та/або 7F3 (кожне з яких депоноване в АТСС, див. нижче). З метою скринінгу антитіл, які зв'язуються з епітопом 7C2/7F3, може бути проведений традиційний тест із перехресного блокування, такий як тест, описаний у відповідному посібнику (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ED Harlow and David Lane (1988)). Альтернативно, може бути проведене картування епітопу для оцінки, чи зв'язується антитіло з епітопом 7C2/7F3 в HER2 (тобто з будь-якими одним або декількома залишками на ділянці від приблизно 22 до приблизно 52 залишку в HER2). Термін «лікування» у контексті даного опису стосується й терапевтичного варіанта лікування, і профілактичних, або превентивних заходів. Пацієнти, які потребують лікування, включають як тих, хто вже має захворювання, так і тих пацієнтів, у відношенні яких необхідно провести профілактику. У цьому зв'язку, пацієнт, який підлягає лікуванню, може бути діагностований, як такий, що має захворювання або схильний, або чутливий до захворювання. Терміни «рак» і «раковий» стосуються або описують фізіологічний стан у ссавців, який у типовому випадку характеризується нерегульованим ростом клітин. Приклади раку включають, без обмеження, карциному, лімфому, бластому (включаючи медулобластому й ретинобластому), саркому (включаючи ліпосаркому й саркому синовіальних клітин), нейроендокринні пухлини (включаючи карциноїдні пухлини, гастриному й рак острівкових клітин), мезотеліому, нейриному (включаючи акустичну невриному), менінгіому, аденокарциному, меланому й лейкоз або лімфоїдний злоякісний ріст. Більш конкретні приклади таких видів раку включають плоскоклітинний рак (наприклад, плоскоклітинний рак епітеліальних клітин), рак легені, включаючи дрібноклітинний рак легені, недрібноклітинний рак легені, аденокарциному легені й плоскоклітинну карциному легені, рак очеревини, гепатоцелюлярний рак, рак шлунка, включаючи рак шлунково-кишкового тракту, рак підшлункової залози, гліобластому, рак шийки матки, рак яєчника, рак печінки, рак молочної залози, рак сечового міхура, гепатому, рак товстої кишки, рак прямої кишки, колоректальний рак, рак ендометрію або матки, карциному слинної залози, рак нирки, або ренальний рак, рак передміхурової за 89798 36 лози, рак вульви, рак щитовидної залози, гетапокарциному, анальну карциному, карциному статевого члена, тестикулярний рак, рак стравоходу, пухлини жовчних шляхів, а також рак голови й шиї. Термін «ефективна кількість» стосується кількості лікарського засобу, яка є ефективною для лікування захворювання в пацієнта. У тому випадку, коли вказане захворювання являє собою рак, ефективну кількість лікарського засобу може знижувати число ракових клітин, знижувати розмір пухлини, інгібувати (тобто, сповільнювати певною мірою й переважно зупиняти) інфільтрацію ракових клітин у периферичні органи, інгібувати (тобто, знижувати певною мірою або переважно зупиняти) метастазування пухлини, інгібувати, певною мірою, ріст пухлини та/або послабляти, певною мірою, один або декілька симптомів, асоційованих з раком. Залежно від того ступеня, у якому лікарський засіб може попереджати ріст та/або знищувати існуючі ракові клітини, засіб може бути цитостатичним та/або цитотоксичним. Ефективну кількість може збільшувати період вільного виживання без прогресування, приводячи до об'єктивної реакції (включаючи часткову реакцію, PR, або повну, CR), підвищувати загальний час виживання та/або ослабляти один або декілька симптомів раку. Термін «НЕК2-експресуючий рак» являє собою такий вид раку, який включає клітини, що містять на поверхні білок HER2. Рак, який здійснює «суперекспресію» рецептора HER, являє собою такий вид раку, що має істотно підвищений рівень рецептора HER, такого як HER2, на клітинній поверхні, у порівнянні з нераковою клітиною того ж типу тканини. Така суперекспресія може бути викликана генною ампліфікацією або підвищеним рівнем транскрипції або трансляції. Суперекспресія рецептора HER може бути визначена в діагностичному або прогностичному тесті шляхом оцінки підвищених рівнів білка HER, що має на поверхні клітини (наприклад, у рамках імуногістохімічного тесту, ІНС). Альтернативно або додатково, можна вимірювати рівні в клітині нуклеїнової кислоти, яка кодує HER, наприклад, за допомогою флуоресцентної гібридизації in situ (FISH, див. WO 98/45479, опубліковану в жовтні 1998 року), за допомогою саузерн-блотингу або з використанням методики полімеразноланцюгової реакції (ПЛР), такий як кількісна ПЛР у масштабі реального часу (ОТ-ПЛР). Можна також досліджувати ступінь суперекспресії рецептора HER за допомогою визначення схованого антигену (наприклад, у позаклітинному домені HER) у біологічній рідині, такий як сироватка (див., наприклад, патент US 4933294, виданий 12 червня 1990 року; WO 91/05264, опубліковану 18 квітня 1991 року; патент US 5401638, виданий 28 березня 1995 року; і Sias та ін., J. Immunol. Methods 132: 73-80 (1990)). Крім вказаних вище тестів, фахівцямпрактикам відомо й доступно безліч інших тестів in vivo. Наприклад, клітини в організмі пацієнта піддають впливу антитіла, яке може бути необов'язково позначено міткою, яку виявляють, наприклад, радіоактивним ізотопом, після чого оцінюють рівень зв'язування антитіла із клітинами в організмі пацієнта, наприклад, проводячи зовнішнє скану 37 вання радіоактивності або при відборі для аналізу біопсійного зразка, узятого з пацієнта, який раніше піддавався впливу антитіла. І навпаки, рак, який «не експресує рецептор HER2», являє собою такий вид раку, який не експресує рецептор HER2 у більшій мірі, ніж нормальні клітини, у порівнянні з нераковими клітинами того ж типу тканини. Рак, що «здійснює суперекспресію» ліганду HER, являє собою такий вид раку, який продукує істотно більш високі рівні лігандів у порівнянні з не раковою клітиною того ж типу тканини. Така суперекспресія може бути викликана генною ампліфікацією або в результаті підвищеної транскрипції або трансляції. Суперекспресія HER може бути визначена діагностично за допомогою оцінки рівня ліганду (або нуклеїнової кислоти, яка його кодує) у пацієнта, наприклад, у біопсійному зразку пухлини або при використанні різних діагностичних тестів, таких як ІНС, FISH, саузерн-блотинг, ПЛР, а також у рамках тестів in vivo, описаних вище. Термін «цитотоксичний агент» у контексті даного опису стосується речовини, яка інгібує функції клітин або перешкоджає здійсненню такої функції та/або викликає деструкцію клітин. Вказаний термін включає радіоактивні ізотопи (At211,І131,І125, Y90, Re186, Re188, Sm 153, Ві212, Ρ32 і радіоактивні ізотопи Lu), хіміотерапевтичні агенти й токсини, такі як малі молекули токсинів або ензиматично активні токсини бактерій, грибів, рослин або токсини тваринного походження, включаючи їх фрагменти та/або варіанти. «Хіміотерапевтичний агент» являє собою хімічну сполуку, яку використовують при лікуванні раку. Приклади хіміотерапевтичних агентів включають алкілувальні агенти, такі як тіотепа й циклофосфамід (CYTOXAN®); алкілсульфонати, такі як бісульфан, імпросульфан і піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа й уредопа; етиленіміни й метиламеламіни, включаючи альтретамін, триетиленмеламін, триетиленфосфорамід, триетилентіофосфорамід і триметилоломеламін; ацетогеніни (особливо булатацин і булатацинон); дельта-9тетрагідроканабінол (дронабінол, MARINOL®); бета-лапахон; лапахол; колхіцини; бетулінова кислота; камптотецин (включаючи синтетичний аналог топотекан (HYCAMTIN®), СРТ-11 (іринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин і 9-амінокамптотецин); бріостатин; калістатин; СС1065 (включаючи його адозелезинові, карзелезинові й бізелезинові синтетичні аналоги); подофілотоксин; подофілінова кислота; теніпозид; криптофіцини (особливо криптофіцин 1 і криптофіцин 8); доластатин; дуокарміцин (включаючи синтетичні аналоги KW-2189 і СВ-ТМ1); елеутеробін; панкратистатин; саркодиктіїн; спонгістатин; азотисті засоби, такі як хлорамбуцил, хлорнафазин, хлорофосфамід, естрамустин, іфосфамід, мехлоретамін, гідрохлорид оксиду мехлоретаміну, мелфалан, новембіхін, фенестерин, преднімустин, трофосфамід, урацилова мазь; нітрозосечовини, такі як кармустин, хлорозотоцин, фотемустин, ломустин, німустин і ранімнустин; антибіотики, такі як енедіїнові антибіотики (наприклад, каліхеаміцин, 89798 38 особливо, каліхеаміцин гама II і каліхеаміцин омега II (див, наприклад, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динеміцин, включаючи динеміцин А; еспераміцин; а також неокарциностатиновий хромофор і споріднені хромопротеїновие енедіїнові антибіотики-хромофори), аклациномизини, актиноміцин, аутраміцин, азасерин, блеоміцини, кактиноміцин, карабіцин, карминоміцин, карцинофілін, хромоміцини, дактиноміцин, даунорубіцин, деторубіцин, 6-діазо-5-оксо-L-норлейцин, доксорубіцин (включаючи ADRIAMYCIN®, морфолінодоксорубіцин, ціаноморфоліно- доксрубіцин, 2піроліно-доксорубіцин, ліпосомальна форма для ін'єкцій доксорубіцину-НСІ (DOXIL®), ліпосомальний доксорубіцин TCL D-99 (MYOCET®), пеглілований ліпосомальний доксорубіцин (CAELYX®) і дезоксидоксорубіцин), епірубіцин, езорубіцин, ідарубіцин, марцеломіцин, мітоміцини, такі як мітоміцин С, мікофенолова кислота, ногаламіцин, олівоміцини, пепломіцин, потфіроміцин, пуроміцин, квеламіцин, родорубіцин, стрептонігрин, стрептозоцин, туберцидин, убенімекс, зиностатин, зорубіцин; антиметаболіти, такі як метотрексат, гемцитабш (GEMZAR®), тегафур (UFTORAL®), капецитабін (XELODA®), епотилон і 5-фторурацил (5-ФУ); аналоги фолієвої кислоти, такі як деноптерин, метотрексат, птероптерин, триметрексат; пуринові аналоги, такі як флударабін, 6меркаптопурин, тіамиприн, тіогуанін; піримідинові аналоги, такі як анцитабін, азацитидин, 6азауридин, кармофур, цитарабін, дидезоксіуридин, доксифлуридин, еноцитабін, флоксуридин; антиадреналові сполуки, такі як аміноглютетімід, мітотан, трилостан; засоби, що поповнюють фолієву кислоту, такі як фролінова кислота; ацеглатон; альдофосфамідний глікозид; амінолевулінова кислота; енілурацил; амсакрин; бестрабуцил; бісантрен; едатраксат; дефофамін, демекольцин; діазиквон, елфорнітин; еліптинію ацетат; етоглюцид; нітрат галію; гідроксисечовина; лентинан; лонідаїнін; майтанзиноїди, такі як майтанзин і ансамитоцини; мітогуазон; мітоксантрон; мопіданмол; нітраерин; пентостатин; фенамет; пірарубіцин; лозоксантрон; 2-етилгідразид; прокарбазин; полісахаридний комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофіран; спірогерманій; тенуазонова кислота; триазиквон; 2,2',2"трихлортриетиламін; трихотецени (особливо Т-2 токсин, веракурин А, роридин А і ангуїдин); уретан; дакарбазин; маномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид («Аrа-С»); тіотепа; таксоїд, наприклад, паклітаксел (TAXOL®), композиція паклітакселу на основі наночастинок, отримана генноінженерними методами з альбуміну (ABRAXANE™), і доцетаксел (TAXOTERE®); хлоранбуцил; 6-тіогуанін, меркаптопурин; метотрексат; платинові агенти, такі як цисплатин, оксаліплатин і карбоплатин; препарати барвінку, які перешкоджають полімеризації тубуліну з мікротрубочок, що утворюються, які включають вінбластин (VELBAN®), вінкристин (ONCOVIN®), віндезин (ELDISIN®, FILDESIN®), і вінорелбін (NAVELBINE®); етопозид (VP-16); іфосфамід; мітоксантрон; лейкововін; новантрон; едатрексат; дауноміцин; аміноптерин; ібандронат; 39 інгібітор топоізомерази RFS 2000; дифторметилорнітин (DMFO); ретиноїди, такі як ретиноєва кислота, включаючи бексаротен (TARGRET1N®); бісфосфонати, такі як клодронат (наприклад, BONEFOS® або OSTAC®), етидронат (D1DROCAL®), NE-58095, золедронова кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памідронат (AREDIA®), тилудронат (SKELID®), або резидронат (ACTONEL®); троксацитабін (1,3-діоксолановий нуклеозидний аналог цитозину); антисмислові олігонуклеотиди, особливо ті, які інгібують експресію генів на сигнальних шляхах, які задіюються в аберантну проліферацію клітин, такі як, наприклад, РКС-альфа, Raf, H-Ras і рецептор фактора росту епідермальних клітин (EGF-R); вакцини, такі як вакцина THERATOPE® і вакцини для генної терапії, наприклад, вакцина ALLOVECTIN®, вакцина LEUVECTIN® і вакцина VAXID®; інгібітор топоізомерази 1 (наприклад, LURTOTECAN®); rmRH (наприклад, ABARELIX®); BAY439006 (сорафеніб; Bayer); SU-11248 (Pfizer); перифозин, інгібітор СОХ-2 (наприклад, целекоксиб або еторикоксиб); протеосомний інгібітор (наприклад, PS341); бортезоміб (VELCADE®); ССІ779; типіфарніб (R11577); орафеніб, АВТ510; інгібітор Всі-2, такий як облімерсен-натрій (GENASENSE®); піксантрон; інгібітори EGFR (див. наведене нижче визначення); інгібітори тирозинкінази (див. наведене нижче визначення); і фармацевтични прийнятні солі, кислоти або похідні вказаних вище з'єднань, а також сполучення двох або більше вказаних вище сполук, таких як CHOP, скорочена назва комбінованої терапії з використанням циклофосфаміду, доксорубіцину, вінкристину й преднізолону, і FOLFOX, скорочена назва лікування, що включає оксиплатин (FLOXATIN™), об'єднане з 5-ФУ й лейкововіном. У дане визначення також включаються антигормональні агенти, які діють у плані регуляції або інгібування гормонального впливу на пухлині, такі як антиестрогени зі змішаним агоністичним/антагоністичним профілем, що включають тамоксифен (NOLVADEX®), 4гідрокситамоксифен, тореміфен (FARESTON®), ідоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен і селективні модулятори рецептора естрогену (SERM), такі як SERM3; чисті антиестрогени без агоністичних властивостей, такі як фулвестрант (FASLODEX®) і ЕМ800 (такі агенти можуть блокувати димеризацію рецептора естрогену (ER), інгібувати зв'язування ДНК, підвищувати метаболізм ER та/або пригнічувати рівні ER), інгібітори ароматази, що включають стероїдні інгібітори ароматази, такі як форместан і екземестан (AROMASIN®), і нестероїдні інгібітори ароматази, такі як анастразол (ARIMIDEX®), летрозол (FEMARA®) і аміноглютетімід і інші інгібітори ароматази, які включають ворозол (RIVISOR®), ацетат мегестролу (MEGASE®), фадрозол, імідазол; агоністи гормон-рилізингу лютеїнізуючого гормону, що включають леупролід (LUPRON® і ELIGARD®), гозерелін, бузерелін і триптерелін; статеві гормони, що включають прогестини, такі як ацетат мегестролу й ацетат медроксипрогестерону, естрогени, такі як діетилстилбестрол і премарин, і андроге 89798 40 ни/ретиноїди, такі як флуоксиместерон, всі трансретиноєві кислоти й фенретинід; онапристон; антипрогестерони; негативні регулятори рецептора естрогену (ERD), антиандрогени, такі як флутамід, нілутамід і бікалутамід; тестолактон; і фармацевтично прийнятні солі, кислоти або похідні будь-якої із вказаних вище сполук, а також сполучення двох або більше вказаних сполук. У контексті даного опису термін «EGFRспрямований лікарський засіб» стосується терапевтичного агента, що зв'язується з EGFR і необов'язково інгібує активацію EGFR. Приклади таких агентів включають антитіла й малі молекули, які зв'язуються з EGFR. Приклади антитіл, які зв'язуються з EGFR, включають МАb 579 (АТСС CRL НВ 8506), МАb 455 (АТСС CRL НВ 8507), МАb 225 (АТСС CRL НВ 8508), МАb 528 (АТСС CRL 8509) (див. патент US 4943533, Mendelsohn та ін.,) і їх варіанти, такі як химеризоване антитіло 225 (С225 або Cetuximab; ERBUTIX®) і людське антитіло 225 зі зміненою формою (Н225) (див. WO 96/40210, Imclone Systems Inc.); антитіла, які зв'язують мутантний EGFR типу II (патент US 5212290); гуманізовані й химерні антитіла, які зв'язуються з EGFR, описані в патенті US 5891996; і людські антитіла, які зв'язуються з EGFR, такі як ABX-EGF (див. WO 98/50433, Abgenix) Антитіло до EGFR може бути кон'юговане із цитотоксичним засобом, у такий спосіб одержують імунокон'югат (див., наприклад, ЕР659,439А2, Merck Patent Gmb). Прикладами невеликих молекул, які зв'язуються з EGFR, є ZD1839 або Гефітиніб (IRESSA™; Astra Zeneca), CP-358774 або Ерлотиніб HCL (TARCEVA™; Genentech/OSI) і AG1478, AG1571 (SU 5271; Sugen). «Інгібітор тирозинкінази» являє собою молекулу, яка певною мірою інгібує тирозинкіназну активність тирозинкінази, таку як рецептор HER. Приклади таких інгібіторів включають EGFR-спрямовані лікарські засоби, вказані в попередньому абзаці, а також малі молекули інгібітору тирозинкінази HER2, такі як ТАК165, доступний від Takeda; подвійні HER інгібітори, зокрема, ЕКВ-569 (доступний від Wyeth), що переважно зв'язується з EGFR, але інгібує і HER2, і EGFR-суперекспресуючі клітини; GW572016 (доступний від Glaxo), пероральний тирозинкіназний інгібітор HER2 і EGFR; РKІ-166 (доступний від Novartis); інгібітори pan-HER, зокрема, канертиніб (СІ-1033; Pharmacia); інгібітори Raf-1, зокрема, антисмисловий агент ISIS-5132, доступний від ISIS Pharmaceutical, що інгібує сигнальний шлях від Raf-1; ТК інгібітори, не спрямовані на HER, такі як іматинібу мезилат (GLEEVAC™), доступний від Glaxo; інгібітор позаклітинно регульованої МАРКО кінази І СІ-1040 (доступний від Pharmacia); хіназоліни, такі як PD 153035,4-(3-хлораніліно)хіназолін; піридопіримідини; піримідопіримідини; піролопіримідини, такі як CGP 59326, CGP 60261 і CGP 62706, піразолопіримідини, 4-(феніламіно)-7Н-піроло[2,3d]піримідини; куркумін (диферилоілметан, 4,5біс(4-фтораніліно)фталімід); нітротіофенові фрагменти, які містять тирфостини; PD-0183805 (Warner-Lamber); антисмислові молекули (наприклад, такі, які зв'язуються з нуклеїновою кислотою, 41 що кодує HER); хіноксаліни (патент US 5804396); трифостини (патент US 5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); інгібітори pan-HER, такі як СІ-1033 (Pfizer); афінітак (ISIS 3521; Isis/Lilly); іматинібу мезилат (Gleevac; Novartis); PKI-166 (Novartis); GW2016 (Glaxo SmithKline), СІ-1033 (Pfizer); EKB-569 (Wyeth); семаксиніб (Sugen); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), або агенти, описані в інших роботах: патент US 5804396; WO 99/09016 (American Cyanamid); WO 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc.), WO 96/33978 (Zeneca); WO 96/3397 (Zeneca) і WO 96/33980 (Zeneca). Термін «антиангіогенний агент» стосується сполуки, яка блокує або перешкоджає, у деякій мірі, розвитку кровоносних судин. Антиангіогенний фактор може бути представлений, наприклад, малою молекулою або антитілом, які зв'язуються з фактором росту або рецептором фактора росту, що задіюються у прогресування ангіогенезу. Кращий антиангіогенний фактор у контексті даного опису являє собою антитіло, яке зв'язується з фактором росту ендотелію судин (VEGF), таке як бевацизумаб (Bevacizumab) (AVASTIN®). Термін «цитокін» являє собою родовий термін для позначення білків, які вивільняють однією клітинною популяцією, які діють на інші клітини як міжклітинний медіатор. Приклади таких цитокінів включають лімфокіни, монокіни й традиційні поліпептидні гормони. У число цитокінів включається також гормон росту, такий як гормон росту людини, N-метіонільний гормон росту людини й гормон росту бика, паратиреоїдний гормон, тироксин, інсулін, проінсулин, релаксин, прорелаксин, глікопротеїнові гормони, такі як фолікулостимулювальний гормон (ФСГ), тиреоїдстимулювальний гормон (ТСГ) і лютеїнізуючий гормон (ЛГ), фактор росту клітин печінки, фактор росту фібробластів, пролактин, плацентарний лактоген, фактор некрозу пухлини α і β; мулеріан-інгібуюча речовина; мишиний пептид, асоційований з гонадотропіном; інгібин; активін; фактор росту ендотелію судин; інтегрин; тромбопоетин (ТПО); фактори росту нервових клітин, такі як NGF-β; фактор росту тромбоцитів; трансформуючі фактори росту (TGF), такі як TGF-α і TGF-β; інсуліноподібний фактор росту -l і II; еритропоетин (ЕРО); остеоіндуктивні фактори; інтерферони, такі як інтерферон-α, -β і - ; колонієстимулюючі фактори (КСФ (CSF)), такі як макрофагальний КСФ (М-КСФ (M-CSF)); гранулоцитарно-макрофагальний КСФ (ГМ-КСФ (GMCSF)); гранулоцитарний КСФ (Г-КСФ (G-CSF)); інтерлейкіни (IL), такі як IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некрозу пухлинних клітин, такий як TGF-α і TGF-β; і інші поліпептидні фактори, що включають LIF і набір з лігандом (KL). У контексті даного опису, термін цитокіни включає білки із природних джерел або з рекомбінантної клітинної культури й біологічно активні еквіваленти нативної послідовності цитокінів. 89798 42 Антитіло, яке готують у вигляді лікарського препарату, переважно по суті чисте й бажано по суті гомогенне (тобто вільне від забруднюючих білків і т.д.). "По суті чисте" антитіло означає композицію, що містить принаймні приблизно 90мас.% антитіла, виходячи із загальної ваги композиції, переважно принаймні приблизно 95мас.%. "По суті гомогенне" антитіло означає композицію, що містить принаймні приблизно 99мас.% антитіла, виходячи із загальної ваги композиції. Термін "поверхневий маркер В-клітин" або "поверхневий антиген В-клітин", який використовується у даному описі, стосується антигену, який експресується на поверхні В-клітин, що є "мішенню" для дії антитіла, яке з ним зв'язується. Прикладами поверхневих маркерів В-клітин являються CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 і CD86 лейкоцитарні поверхневі маркери (для опису, див. The nd Leukocyte Antigen Facts Book, 2 Edition. 1997, ed Barclay та ін., Academic Press, Harcourt Brace & Co., New York). Інші поверхневі маркери В-клітин включають RP105, FcRH2, B-cell CR2, CCR6, Р2Х5, HLA-DOB, CXCR5, FCER2, BR3, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, ВСМА і 239287. Поверхневий маркер В-клітин, що представляє особливий інтерес згідно із даним винаходом, переважно експресується на В-клітинах у порівнянні з іншими тканинами ссавців, відмінними від В-клітин, і може експресуватися як на попередниках В-клітин, так і на зрілих В-клітинах. Кращими поверхневим маркером В-клітин згідно із даним винаходом є CD20 або BR3. "CD20" антиген, або "CD20," являє собою неглікозилований протеїн з молекулярною масою близько 35кДа, що виявляється на поверхні більш ніж 90% В-клітин периферичної крові або лімфоїдних органів. CD20 знаходиться на поверхні як нормальних, так і злоякісних В-клітин, але він не експресується стовбуровими клітинами. Іншими назвами CD20, які зустрічаються в літературі, є "Влімфоцитарний рестриктивний антиген" і "Вр35". D20 антиген описаний, наприклад, в Clark та ін., Рrос. Natl. Acad. Sci. (USA) 82: 1766 (1985) Винятково для цілей даного винаходу, "гуманізований 2Н7" стосується гуманізованого варіанта 2Н7 антитіла, CDR послідовності якого описані в патенті US 5,500,362 (Фіг.5 і 6), що спеціально включений у даний винахід як посилання. Прикладами гуманізованих 2Н7 антитіл згідно із даним винаходом включають варіанти, описані в WO 2004/056312, яка також спеціально включена в даний винахід як посилання, а також інші варіанти, включаючи, але не обмежуючись тільки ними· 2H7v16, 2H7v31,2H7v73, 2H7v75, 2H7v96, 2H7v114, 2H7v115, 2H7v116, 2H7v138, 2H7v477, 2H7v375, і ін. В одному варіанті здійснення винаходу, гуманізоване 2Н7 антитіло містить одну, дві, три, чотири, п'ять або шість наступних CDR послідовностей: CDR L1 послідовність RASSSVSYXH, де X являє собою Μ або L (SEQ ID NO: 67), наприклад 43 SEQ ID NO: 57 (Фіг.18А), CDR L2 послідовність SEQ ID NO: 58 (Фіг.18А), CDR L3 послідовність QQWXFNPPT, де X являє собою S або A (SEQ ID NO: 68), наприклад SEQ ID NO: 59 (Фіг.18A), CDR H1 послідовність SEQ ID NO: 60 (Фіг.18В), CDR H2 послідовність AIYPGNGXTSYNQKFKG, де X являє собою D або A (SEQ ID NO: 69), наприклад SEQ ID NO: 61 (Фіг.18В), і CDR H3 послідовність VVYYSXXYWYFDV, де X в 6 положенні являє собою Ν, Α, Υ, W або D, і X в 7 положенні являє собою S або R (SEQ ID NO: 70), наприклад SEQ ID NO: 62 (Фіг.18B). Вищенаведені CDR послідовності звичайно знаходяться у каркасних ділянках варіабельних легких і варіабельних важких послідовностей людини, таких як головним чином консенсусні FR залишки людини каппа легкого ланцюга підгрупи І людини (VL 1), і головним чином консенсусні FR залишки людини важкого ланцюга підгрупи III людини (VHIII). Див. також WO 2004/056312 (Lowman та ін.). Варіабельна важка ділянка може бути з'єднана з константною ділянкою IgG ланцюга людини, де ділянка може являти собою, наприклад, IgG1 або IgG3, включаючи нативну послідовність і варіантні константні ділянки. У кращому варіанті здійснення винаходу, таке антитіло містить послідовність варіабельного важкого домену SEQ ID NO: 29 (v16, як показано на Фіг.18В), необов'язково також містить послідовність варіабельного легкого домену SEQ ID NO: 26 (v16, як показано на Фіг.18А), що необов'язково містить одну або декілька амінокислотних замін у положеннях 56,100 та/або 100а, наприклад, D56A, N100A або N100Y, та/або S100a у варіабельному важкому домені й одну або декілька амінокислотних замін у положеннях 32 та/або 92, наприклад, M32L та/або S92A, у варіабельному легкому домені. Переважно, антитіло являє собою інтактне антитіло, яке містить амінокислотні послідовності легкого ланцюга SEQ ID NO: 63 або 64, і амінокислотні послідовності важкого ланцюга SEQ ID NO: 65, 66, 71 або 72. Краще гуманізоване 2Н7 антитіло являє собою окрелізумаб (Genentech). Антитіло згідно із даним винаходом додатково може містити принаймні одну амінокислотну заміну в Fc ділянці, що поліпшує ADCC активність, таку як амінокислотні заміни в положеннях 298, 333, і 334, переважно S298A, Е333А, і K334А, використовуючи нумерацію залишків важкого ланцюга згідно із Еu. Див. також патент US 6,737,056 В1, Presta. Будь-яке із цих антитіл додатково може містять принаймні одну амінокислотну заміну в Fc ділянці, що поліпшує FcRn зв'язування або період напіввиведення із сироватки, наприклад, заміну в 434 положенні у важкому ланцюзі, таку як N434W. Див. також патент US 6,737,056B1, Presta. Будь-яке із цих антитіл додатково може містити принаймні одну амінокислотну заміну в Fc ділянці, що підвищує CDC активність, наприклад, містити принаймні заміну в 326 положенні, переважно 89798 44 K326А або K326W. Див. також патент US 6,528,624В 1 (Idusogie та ін.). Деякими кращими гуманізованими 2Н7 варіантами є ті варіанти, які містять варіабельний легкий домен SEQ ID NO: 26 і варіабельний важкий домен SEQ ID NO: 29, включаючи ті, які містять або не містять замін в Fc ділянці (якщо він міститься), і ті варіанти, які містять варіабельний важкий домен зі зміною N100A; або D56A і Ν100А; або D56A, N100Y, і S100a; в SEQ ID NO: 29 і варіабельний легкий домен зі зміною M32L; або S92A; або M32L і S92A; в SEQ ID NO: 26. М34 у варіабельному важкого ланцюзі 2H7v16 був ідентифікований як можливе джерело стабільності антитіла і являє собою інший потенційний кандидат для здійснення заміни. У цілому, для деяких різних кращих варіантів здійснення винаходу, варіабельна ділянка варіантів на основі 2H7v16 містить амінокислотну послідовність v16 за винятком положень амінокислотних замін, які наведені нижче в таблиці. Якщо спеціально не вказано інакше, то 2Н7 варіанти будуть мати такий же легкий ланцюг, що й в v16. Приклади варіантів гуманізованого 2Н7 антитіла Зміни Зміни легважкого Версія 2Н7 кого ланЗміни Fc ланцюга цюга (VL) (VH) 16 для посилання 31 S298A, ЕЗЗЗА, К334А 73 N100А M32L 75 N100А M32L S298A, ЕЗЗЗА, К334А 96 D56A, S92A N100A 114 D56A, M32L, S298A, ЕЗЗЗА, N100A S92A К334А 115 D56A, M32L, S298A, ЕЗЗЗА, N100A S92A К334А, E356D, M358L 116 D56A, M32L, S298A, К334А, N100A S92A К322А 138 TJ56A, M32L, S298A, ЕЗЗЗА, N100A S92A К334А, К326А 477 D56A, M32L, S298A, ЕЗЗЗА, N100A S92A К334А, К326А, N434W 375 K334L 588 S298A, ЕЗЗЗА, К334А, К326А 511 D56A, M32L, S298A, ЕЗЗЗА, N100Y, S92A К334А, К326А S100a Одне краще гуманізоване 2Н7 містить 2H7v16 послідовність варіабельного легкого домену: DIQMTQSPSSLSASVGDRVTITCRASSSVSYMHWY QQKPGKAPKPLIYAPSNLASGVPSRFSGSGSGTDF TLTISSLQPEDFATYYCQQWSFNPPTFGQGTKVEIK R (SEQ ID NO: 26); 45 і 2H7v16 послідовність варіабельного важкого домену: EVQLVESGGGLVQPGGSLRLSCAASGYTFTSY NMHWVRQAPGKGLEWVGAIYPGNGDTSYNQKFK GRFTISVDKSKNTLYLQMNSLRAEDTAV?YYCARVVYYSNSYWYFDVWGQGTLVTVSS (seq id no: 29). Якщо гуманізоване 2H7v16 антитіло являє собою інтактне антитіло, то воно може містити амінокислотну послідовність легкого ланцюга: (SEQ ID NO:63); DRVTITCRASSSVSYMHWYQQKPGKAPKPLIYAPSNLASGVPSRFSGSGSGTDFTLTIS SLQPEDFATYYCQQWSFNPPTFGQGTKVEIKRTVA APSVF1FPPSDEQLKSGTASVVCLLNNFYPREAKV QWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTL SKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQID NO: 63); і амінокислотну послідовність важкого ланцюга SEQ ID NO: 65 або: (SEQ ID NO:71). SLRLSCAASGYTFTSYNMHWVRQAPGKG LEWVGAIYPGNGDTSYNQKFKGRFTISVDKSKNTLY LQMNSLRAEDTAVYYCARVVYYSNSYWYFDVWGQ GTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCL VKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLY SLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVE PKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTL MISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHN AKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKC KVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYK TTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSV MHEALHNHYTQKSLSLSPG (SEQ ID NO: 71). Інше краще гуманізоване 2Н7 антитіло містить 2H7v511 послідовність варіабельного легкого домену: DIQMTQSPSSLSASVGDRVTITCRASSSVSYLHWYQQKPGKAPKPLIYAPSNLASGVPSRFGSGSGTDFTLTISSLQPEDFATYYCQQWAFNPPTF GQGTKVEIKR (SEQ ID NO; 73) і 2H7v511 послідовність варіабельного важкого домену: EVQLVESGGGLVQPGGSLRLSCAASGYTFTSYNMHWVRQAPGKGLEWVGAIYPGNGATS YNQKFKGRFTISVDKSKNTLYLQMNSLRAEDTAVYY CARVVYYSYRYWYFDVWGQGTLVTVSS (SEQ ID NO: 74). Якщо гуманізоване 2H7v511 антитіло являє собою інтактне антитіло, то воно може містити амінокислотну послідовність легкого ланцюга: DIQMTQSPSSLSASVGDRVTITCRASSSVSYLHWYQQKPGKAPKPLIYAPSNLASGVPSRFGSGSGTDFTLTISSLQPEDFATYYCQQWAFNPPTF GQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVC LLNNFYPREAKVQWKVDNALQSGNSQESVTEQDS KDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSP VTKSFN RGEC (SEQIDNO:64) і амінокислотну послідовність важкого ланцюга SEQ ID NO: 66 або: EVQLVESGGGLVQPGGSLRLSCAASGYTFTSYNMHWVRQAPGKGLEWVGAIYPGNGATS YNQKFKGRFTISVDKSKNTLYLQMNSLRAEDTAVYY CARVVYYSYRYWYFDVWGQGTLVTVSSASTKGPS VFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWN SGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGT 89798 46 QTYICNVNHKPSNTKVDKKVEPKSCDKTHCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTC VVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQ YNATYRVVSVLTVLHQDWLNGKEYKCKVSNAALPA PIAATISKAKGQPREPQVYTLPPSREEMTKNQVSLT CLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSD GSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNH YTQKSLSLSPG (SEQ ID NO: 72). У даному винаході "злоякісні захворювання Вклітин " включають не-ходжкінську лімфому (NHL), включаючи низькодиференційовану/фолікулярну NHL, дрібноклітинну лімфоцитарну (SL) NHL, середньодиференційовану/фолікулярну NHL, середньодиференційовану дифузійну NHL, високодиференційовану імунобластну NHL, високодиференційовану лімфобластну NHL, високодиференційовану дрібноклітинну з нерозсіченими ядрами NHL, недиференційовану NHL, лімфому клітин мантії, зв'язану зі СНІДом лімфому й макроглобулінемію Вальденстрема; лейкоз, включаючи гострий лімфобластний лейкоз (ALL), хронічний лімфоцитарний лейкоз (CLL), лейкоз ворсинчатих клітин і хронічний мієлобластний лейкоз; а також інші злоякісні захворювання гематологічних клітин. Такі злоякісні захворювання можна піддавати лікуванню за допомогою антитіл, спрямованих на поверхневі маркери В-клітин, таких як CD20. Термін "не-ходжкінська лімфома" або "NHL", як використовується в даному винаході, стосується злоякісного новоутворення в лімфатичній системі, яке відрізняється від ходжкінських лімфом. Ходжкінські лімфоми звичайно можна диференціювати від неходжкінських лімфом за наявністю клітин Ріда-Штернберга й відмінності вказаних клітин при не-ходжкінських лімфомах. Прикладами неходжкінських лімфом, охоплюваних цим терміном, як використовується в даному винаході, є будь-які лімфоми, які будуть ідентифіковані в майбутньому фахівцем у даній галузі (наприклад, онкологом або патологом) відповідно до схем класифікації, відомих у даній галузі, таких як переглянута європейсько-американська схема лімфом (REAL), як описано в Color Atlas of Clinical Hematology, Third Edition; A. Victor Hoffbrand і John E. Pettit (eds.) (Harcourt Publishers Limited 2000) (див., зокрема, Фіг.11.57, 11.58 та/або 11.59). Більш кращі приклади включають, але не обмежуючись тільки ними, рецидивуючу або яка не піддається лікуванню NHL, низькодиференційовану NHL фронтальної лінії, NHL на стадіях III/IV, стійку до хіміотерапії NHL, лімфобластний лейкоз та/або лімфому попередників В-клітин, дрібноклітинну лімфоцитарну лімфому, хронічний лімфацитарний лейкоз Вклітин та/або пролімфоцитарний лейкоз та/або дрібноклітинний лімфоцитарний лейкоз, пролімфоцитарний лейкоз В-клітин, імуноцитому та/або лімфопластичну лімфому. лімфому крайової зони В-клітин, лімфому крайової зони селезінки, лімфому крайової зони екстравузлів - MALT, лімфому крайової зони вузлів, лейкоз ворсинчатих клітин, плазмацитому та/або мієлому плазматичних клітин, низькодиференційовану/фолікулярну, середньодиференційовану/фолікулярну NHL, лімфому клітин мантії, лімфому центру фолікула (фолікуля 47 рну), середньодиференційовану дифузійну NHL, дифузійну велику лімфому В-клітин, прогресуючу NHL (включаючи прогресуючу NHL фронтальної лінії й прогресуючу рецидивуючу NHL), NHL, рецидивуючу після аутологічної трансплантації стовбурових клітин або нечутливу до неї, первинну середостіночну велику лімфому В-клітин, первинну випітну лімфому, високодиференційовану імунобластну NHL, високодиференційовану лімфобластну NHL, високодиференційовану дрібноклітинну з нерозсіченими ядрами NHL, недиференційовану NHL, лімфому Буркіта, лімфобластний лейкоз та/або лімфому попередників (периферичних) Тклітин, лімфому та/або лейкоз дорослих Т-клітин, хронічний лімфоцитарний лейкоз та/або пролімфатичний лейкоз Т-клітин, великий гранулярний лімфоцитарний лейкоз, грибоподібний мікоз та/або синдром Цезарі, лімфому природних кілерів ектравузлів/Т-клітин (назального типу), лімфому Тклітин ентеропатичного типу, печінковоселезінкову лімфому Т-клітин, підшкірну панікуліто-подібну лімфому Т-клітин, шкірні лімфоми, анапластичну великоклітинну лімфому, ангіоцентричну лімфому, лімфому Т-клітин кишечнику, лімфому периферичних Т-клітин (якщо спеціально не вказано інакше) і ангиоімунобластну лімфому Тклітин. Термін "аутоімунне захворювання", яке використовується у даному описі, стосується захворювання або патологічного стану, що виникає у власних тканинах організму, і спрямованому проти них, або його інтегруванню або прояву або його результуючому стану. Прикладами аутоімунних захворювань або патологічних станів є, без обмеженнями вказаних, артрит (ревматоїдний артрит, хвороба Стіла, остеоартрит, псоріатичний артрит і анкілозуючий спондилоартрит), псоріаз, дерматит, включаючи атопічний дерматит, хронічна ідиопатична кропивниця, включаючи хронічну аутоімунну кропивницю, поліміозит/дерматоміозит, токсичний епідермальний некроліз, склеродерма (включаючи системну склеродерму), склероз, такий як прогресуючий системний склероз, запальне захворювання кишечнику (IBD) (наприклад, хвороба Крона, виразковий коліт, аутоімунне запальне захворювання кишечнику), гангренозна піодермія, вузлувата еритема, первинний склерозуючий холангіт, епісклерит), респіраторний-дистрес синдром, включаючи респіраторний дистрес-синдром дорослих (ARDS), менінгіт, захворювання, опосередковані IgG, такі як анафілактичний і алергічний і атопічний риніт, енцефаліт, такий як енцефаліт Расмусена, увеїт або аутоімунний увеїт, коліт, такий як мікроскопічний коліт і колагенозний коліт, гломерулонефрит (GN), такий як мембранний GN (мембранну нефтопатію), ідіопатичний мембранний GN, мебранний проліферативний GN (MPGN), включаючи тип І і тип II, і швидко прогресуючий GN, алергічні стани, алергічна реакція, екзема, астма, стани, в яких задіяні інфільтрація Тклітинами й хронічна запальна реакція-відповідь, атеросклероз, аутоімунний міокардит, порушення адгезії лімфоцитів, системний червоний вовчок (SLE), такий як шкірний SLE, підгострий шкірний червоний вовчок, вовчок (включаючи нефрит, ен 89798 48 цефаліт, педіатричну, нениркову, дископодібну, алопецію), підлітковий цукровий діабет (тип І), включаючи педіатричний інсулін-залежний цукровий діабет (IDDM), цукровий діабет у дорослих (діабет II типу), розсіяний склероз (MS), такий як спино-оптичний MS, імунні відповіді, зв'язані з реакцією гіперчутливості негайного й уповільненого типів, опосередкованої цитокінами й Тлімфоцитами, туберкульоз, саркоїдоз, гранулематоз, включаючи лімфатоїдний гранулематоз, гранулематоз Вегенера, агранулоцитоз, васкуліт (включаючи васкуліт великих судин (включаючи ревматичну поліміалгію й артеріїт гігантських клітин (Такаясу)), васуліт середніх судин (включаючи хворобу Кавасакі й вузликовий поліартеріїт), васкуліт ЦНС, системний некротизуючий васкуліт, і АМСА-асоційований васкуліт, такий як васкуліт Чург-Штрауса або гранулематозний алергічний ангіїт (CSS)), темпоральний артеріїт, апластична анемія, Коомбс-позитивна анемія, анемія Дайемонда-Блекфена, гемолітична анемія або імунна гемолітична анемія, включаючи аутоімунню гемолітичну анемію (АІНА), перніційна анемія, щира еритроцитарна аплазія (PRCA), недостатність фактора VIII, гемофілія А, аутоімунна нейтропенія, панцитопенія, лейкопенія, захворювання, асоційовані з діапедезом лейкоцитів, запальні захворювання центральної нервової системи, синдром множинного ураження органів, захворювання, опосередковані комплексом антиген-антитіло, захворювання, зв'язані з утворенням антигломерулярних антитіл у базальній мембрані, антифосфоліпідний антитільний синдром, алергічний нейрит, хвороба Бехчета, синдром Кастельмана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стівенса-Джонсона, пемфігоїд, такий як бульозний пемфігоїд, пухирчатка (включаючи звичайну, ексфоліативну, і пухирчатку слизової мембрани пемфігоїд), аутоімунні поліендокринопатії, синдром Рейтера, імунокомплексний нефрит, хронічна нейропатія, така як IgG полінейропатіі або опосередкована IgG нейропатія, тромбоцитопенія (наприклад, така як розвивається в пацієнтів з інфарктом міокарда), включаючи тромботичну тромбоцитопенічну пурпуру (ТТР) і аутоімунну або імунно-опосередковану тромбоцитопенію, таку як ідіопатична тромбоцитопенічна пурпура (ІТР), включаючи хронічну або гостру ІТР, аутоімунні захворювання яєчок і яєчників, включаючи аутоімунний орхіт і оофорит, первинний гіпотиреоїдизм, гіпопаратиреоз, аутоімунні ендокринні захворювання, включаючи аутоімунний тиреоїдит, хронічний тиреоїдит (тиреоїдит Хашимото) або підгострий тиреоїдит, аутоімунне захворювання щитовидної залози, ідіопатичний гіпотиреоїдизм, хвороба Адісона, хвороба Грейвса полігландулярні синдроми, такі як аутоімунний полігландулярний синдром (або синдроми полігландулярної ендокринопатії), паранеопластичні синдроми, включаючи неврологічні паранеопластичні синдроми, включаючи міастенічний синдром Ламберт-Еатона або синдром Ламберт-Еатона, синдром "дерев'яної людини", енцефаломієліти, такі як алергічні енцефаломієліти, астенічний бульбарний параліч, дегенерація мозочка, лімбічний енцефаліт та/або 49 енцефаліт стовбура мозку, нейроміотонія, синдром танцюючих очей або синдром танцюючих очей-міоклонус (OMS), і сенсорна невропатія, синдром Шихана, аутоімунний гепатит, хронічний гепатит, люпоїдний гепатит, хронічний активний гепатит або аутоімунний хронічний активний гепатит, лімфоїдний інтерстиціальний пневмоніт, облітеруючий бронхіоліт (нетрансплантаційний) на противагу NSIP, синдром Гієйна-Барре, хвороба Бергера (IgG нефропатія), біліарний первинний цироз печінки, целіакія (глютенова хвороба), важковиліковний синдром мальабсорбції, поліморфний дерматит, кріоглобулінемія, бічний аміотрофічний склероз (ALS; хвороба Лу Геріга), захворювання коронарної артерії, аутоімунне захворювання іннервації (AIED); або аутоімунна втрата слуху, синдром танцюючих очей-міоклонус (OMS), поліхондрія, така як резистентна поліхондрія, легеневий альвеолярний протеїноз, амілоїдоз, гігантоклітинний гепатит, склерит, незлоякісний лшфоцитарний лейкоцитоз, первинний лімфоцитарний лейкоцитоз, що включає лімфоцитарний лейкоцитоз моноклональних В-клітин (наприклад, доброякісну моноклональну гаммапатію й моноклональнуюгаммапатію невизначеного походження, MGUS), периферичну невропатію, паранеопластичний синдром, патології каналів, такі як епілепсія, мігрень, аритмія, м'язові розлади, глухота, сліпота, періодичний параліч, і патології каналів ЦНС, аутизм, запальна міопатія, осередковий сегментний гломерулосклероз (FSGS), ендокринна офтальмопатія, увеоретиніт, аутоімунне гепатологічне порушення, фіброміалгія, множинна ендокринна патологія, синдром Шмідта, адреналіт, атрофічний гастрит, старече слабоумство, демієлінізуючі захворювання, постінфарктний синдром, осередкова алопеція, CREST синдром (кальциноз, віброхвороба, порушення моторики стравоходу, склеродактиліия й телеангіектазія), аутоімунна безплідність у чоловіків і жінок, анкілозуючий спондилоартрит, змішане захворювання сполучної тканини, хвороба Шагаса, ревматична атака, повторний аборт, екзогенний алергічний альвеоліт, ексудативна багатоформна еритема, пост-кардіотомічний синдром, синдром Кушинга, хвороба любителів птахів, сімейний гломерулонефтрит із глухотою, альвеоліт, такий як алергічний альвеоліт і фіброзуючий альвеоліт, колагенова хвороба легенів, реакція при переливанні, проказа, малярія, лейшманіоз, кипаносомоз, шистосомоз, аскаридоз, аспергільоз, синдром Самперта, ревматоїдний пневмоконіоз, тропічна гарячка, ендокардит, ендоміокардіальний фіброз, ендофтальміт, еритема elevatum et diutinum, гемолітична хвороба немовлят, еозинофільний фаціїт, синдром Шульмана, синдром Фелті, фларіасіс, цикліт, такий як хронічний цикліт, гетерохронічний цикліт, або цикліт Фуксу, хвороба Шейлена-Геноха, інфікування вірусом імунодефіциту людини (HIV), інфікування еховірусом, кардіоміопатія, хвороба Альцгеймера, інфікування парвовірусом, інфікування вірусом краснухи, синдроми після вакцинації, вроджене інфікування краснухою, інфікування вірусом Епштейна - Барра, свинка, синдром Еванса, аутоімунне пошкодження гонад, мала хорея, післястре 89798 50 птококовий нефрит, облітеруючий тромбангіїт, дифузійний тиреотоксичний зоб, прогресуюча рухова атаксія, і гігантоклітинна поліміалгія. "Суперсімейство рецептора фактора некрозу пухлини " або "суперсімейство рецептора TNF" у даному винаході стосується рецепторних поліпептидів, які зв'язуються цитокінами в сімействі TMF. Як правило, ці рецептори є трансмембранними рецепторами І типу з однією або декількома повторюваними послідовностями, збагаченими цистеїном, у їх позаклітинному домені. Суперсімейство рецептора TNF додатково може бути розділене на (1) рецептори смерті; (2) рецептора-пастки; і (3) сигнальні рецептори, у яких відсутні домени смерті. "Рецептор смерті" містить у їх цитоплазматичній або внутрішньоклітинній ділянці "домен смерті", тобто ділянку або послідовність, що передає сигнали в клітину, які можуть привести до апаптозу або до індукції певних генів. В "рецепторахпастках" відсутні функціональний домен смерті й вони нездатні передавати сигнали, що приводять до апоптозу. Прикладами цитокінів у сімействі генів TNF є фактор некрозу пухлин-альфа (TNFальфа), фактор некрозу пухлин-бета (TNF-бета або лімфотоксин), CD30 ліганд, CD27 ліганд, CD40 ліганд, ОХ-40 ліганд, 4-1ВВ ліганд, Аро-1 ліганд (також позначається як Fas ліганд або CD95 ліганд), Аро-2 ліганд (також позначається як TRAIL), Аро-3 ліганд (також позначається як TWEAK), остеопротегерін (OPG), APRIL, RANK ліганд (також позначається як TRANCE), і TALL-1 (також позначається як Bly, BAFF або THANK). Прикладами рецепторів у суперсімействі рецептора TNF є: рецептор фактора некрозу пухлини 1 типу (TNFR1), рецептор фактора некрозу пухлини 2 типи (TNFR2), рецептор фактора росту нервів р75 (NGFR), антиген поверхні В-клітин CD40, антиген Т-клітин ОХ-40, Аро-1 рецептор (який також називається Fas або CD95), Аро-3 рецептор (який також називається DR3, swl-1, TRAMP і LARD), рецептор, який називається "Transmembrane Activator and CAML-Interactor" або "ТАСІ", ВСМА білок, DR4, DR5 (який альтернативно позначається як Аро-2; TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 або KILLER), DR6, Dс1 (також позначається як TRID, LIT або TRAIL-R3), Dc2 (який також називається TRAIL-R4 або TRUNDD), OPG, Dc3 (який також називається TR6 або М68), CAR1, HVEM (який також називається ATAR або TR2), GITR, ZTNFR-5, NTR-1, TNFL1, CD30, бетарецептор лімфотоксину (LTBr), 4-1ВВ рецептор і TR9 (ЕР988, 371А1). Терміни "Аро-2 ліганд", "Apo-2L", "Apo2L", Аро2 ліганд/TRAIL" і "TRAIL" використовуються в даному винаході взаємозамінно й стосуються поліпептидної послідовності, що містить амінокислотні залишки 114-281, включно, 95-281, включно, залишки 92-281, включно, залишки 91-281, включно, залишки 41-281, включно, залишки 39-281, включно, залишки 15-281, включно, або залишки 1-281, включно, амінокислотної послідовності, наведеної на Фіг.24 (SEQ ID NO: 46), а також біологічно активні фрагменти, варіанти з делеціями, вставками та/або заміщеннями вищевказаних послідовностей. В одному варіанті здійснення, поліпептидна 51 послідовність містить залишки 114-281, наведені на Фіг.24 (SEQ ID NO: 46). Необов'язково, поліпептидна послідовність містить залишки 92-281 або залишки 91-281, наведені на Фіг.24 (SEQ ID NO 46). Apo-2L поліпептиди можуть кодуватися нативною нуклеотидною послідовністю, наведеною на Фіг.24 (SEQ ID NO: 45). Необов'язково, кодон, який кодує залишок Pro119 (Фіг.24; SEQ ID NO: 45), може являти собою "ССТ" або "CCG". Необов'язково, фрагменти або варіанти є біологічно активними й мають принаймні близько 80% амінокислотної послідовності ідентичної, або принаймні близько 90% послідовності ідентичної, або принаймні 95%, 96%, 97%, 98% або 99% послідовності ідентичної до будь-якої з вищенаведених послідовностей. Визначення охоплює заміщені варіанти Аро-2 ліганду, у яких принаймні одна з його нативних амінокислот заміщені іншою амінокислотою, такою як залишок аланіну. Визначення також охоплює нативну послідовність Аро-2 ліганду, виділену із джерела Аро-2 ліганду, або отриману рекомбінантними та/або синтетичними методами. Аро-2 ліганд за винаходом включає поліпептиди, які позначаються як Аро-2 ліганд або TRAIL, описані в WO97/01633, опублікованій 16 січня 1997 року., WO97/25428, опублікованій 17 липня 1997 року., WO99/36535, опублікованій 22 липня 1999 року., WO 01/00832, опублікованій 4 січня 2001 року., WO02/09755, опублікованій 7 лютого 2002 року., WO 00/75191, опублікованій 14 грудня 2000 року., і патенті US 6,030,945, виданому 29 лютого 2000 року. Терміни звичайно використовуються стосовно форм Аро-2 ліганду, які включають мономерні, димерні, тримерні, гексамерні або високо- олігомерні форми поліпептиду. У всій нумерації амінокислотних залишків стосовно послідовності Apo-2L використовується нумерація згідно із Фіг.24 (SEQ ID NO: 46), якщо спеціально не вказано інакше. "Рецептор Аро-2 ліганду " охоплює рецептори, які в даній галузі позначаються як "DR4" і "DR5." Pan та ін. описали представників сімейства рецепторів TNF, які позначаються як "DR4" (Pan та ін., Science, 276: 111-113 (1997); див. також WO98/32856, опубліковану 30 липня 1998 року; WO 99/37684, опубліковану 29 липня 1999 року; WO 00/73349, опубліковану 7 грудня 2000 року; US 6,433,147, виданий 13 серпня 2002 року; US 6,461,823, виданий 8 жовтня 2002 року., і US 6,342,383, виданий 29 січня 2002 року.). Sheridan та ін., Science, 277: 818-821 (1997) і Pan та ін., Science, 277: 815-818 (1997) описали інший рецептор для Apo2L/TRAIL (див. також WO98/51793, опубліковану 19 листопада 1998 року; WO98/41629, опубліковану 24 вересня 1998 року.). Цей рецептор позначається як DR5 (рецептор також альтернативно позначається як Аро-2; TRAILR, TR6, Tango-63, hAPO8, TRICK2 або KILLER; Screaton та ін., Сurr. Вiol., 7: 693-696 (1997); Walczak та ін., EMBOJ., 16: 5386-5387 (1997); Wu та ін., Nature Genetics, 17: 141-143 (1997); WO98/35986, опублікована 20 серпня 1998 року; ЕР870,827, опублікована 14 жовтня 1998 року; WO98/46643, опублікована 22 жовтня 1998 року; WO99/02653, опублікована 21 січня 1999 року; WO99/09165, опублікована 25 лютого 1999 року; 89798 52 WO99/11791, опублікована 11 березня 1999 року; US 2002/0072091, опублікована 13 серпня 2002 року, US 2002/, опублікована 7 грудня 2001 року; US 6,313,269, виданий 6 грудня 2001 року; US 2001/0010924, опублікована 2 серпня 2001 року; US 2003/01255540, опублікована 3 липня 2003 року; US 2002/0160446, опублікована 31 жовтня 2002 року., US 2002/0048785, опублікована 25 квітня 2002 року; US 6,569,642, виданий 27 травня 2003 року., US 6,072,047, виданий 6 червня 2000 року., US 6,642,358, виданий 4 листопада 2003 року). Як описано вище, інші рецептори для Apo2L включають Dс1, Dc2 і OPG. Термін "рецептор Apo-2L", коли використовується в даному винаході, охоплює нативні послідовності рецепторів і варіантів рецепторів. Ці терміни охоплюють Apo-2L рецептор, які експресуються в багатьох ссавців, включаючи людину. Рецептор Apo-2L може ендогенно екпресуватися, як відбувається в природі в різних поколіннях тканин людини, або може експресуватися за допомогою рекомбінантних або синтетичних методів. "Нативна послідовність рецептора Apo-2L" містить поліпептид, який має амінокислотну послідовність, ідентичну до такої рецептора Apo-2L, що має природне походження. Таким чином, нативна послідовність рецептора Apo-2L може мати амінокислотну послідовність рецептора Apo-2L, що зустрічається в природі, з будь-яких ссавців, включаючи людини. Така нативна послідовність рецептора Apo-2L може бути виділена із природи або може бути отримана рекомбінантним або синтетичним шляхом. Термін "нативна послідовність рецептора Apo-2L" переважно охоплює які зустрічаються в природі усічені або секретовані форми рецептора (наприклад, розчинна форма, що містить, наприклад, послідовність позаклітинного домену), варіантні форми, які зустрічаються в природі (наприклад, форми альтернативного сплайсингу) і зустрічаються в природі алельні варіанти. Варіанти рецептора можуть включати фрагменти або делеційні мутанти нативної послідовності рецептора Apo-2L. На фігурах 25А-С показана послідовність, що складається з 411 амінокислоти, рецептора DR5 людини, разом з її нуклеотидною послідовністю (SEQ ID NO: 47 і 48), як опубліковано в WO 98/51793 19 листопада 1998 року. У даній галузі відомий варіант транскрипційного сплайсингу рецептора DR5 людини. Цей варіант сплайсинга кодує послідовність із 440 амінокислот рецептора DR5 людини, як показано на фігурах 26А-С, разом з його нуклеотидною послідовністю (SEQ ID NO: 49 і 50), і як опубліковано в WO 98/35986 20 серпня 1998 року. "Антитіло рецептора смерті", як використовується в даному винаході, у цілому стосується антитіла або антитіл, спрямованих на рецептор у суперсімействі рецептора фактора некрозу пухлини й що містить домен смерті, здатний передавати сигнали апоптозу, і такі антитіла включають DR5 антитіло й DR4 антитіло. "Антитіло рецептора DR5", "антитіло до DR5", або "анти-DR5 антитіло" використовується в широкому розумінні й стосується антитіл, які зв'язуються принаймні з однією формою DR5 рецептора або його позаклітинним доменом. Необов'язкове анти 53 тіло до DR5 злите або зв'язане з гетерологічною послідовністю або молекулою. Переважно, гетерологічна послідовність дозволяє або полегшує утворення антитілом комплексів вищого порядку або олігомерних комплексів. Необов'язково, антитіло до DR5 зв'язується з DR5 рецептором, але не зв'язується або перехресно не реагує з будь-якими іншими рецепторами Apo-2L (наприклад, DR4, Dс1, або Dc2). Необов'язкове антитіло є агоністом сигнальної активності DR5. Необов'язково, антитіло до DR5 за винаходом зв'язується з рецептором DR5 у діапазоні концентрацій від приблизно 0,1н до приблизно 20мМ, як визначено в аналізі зв'язування ВІАсоrе. Необов'язково, DR5 антитіла за винаходом проявляють значення ІС50 в інтервалі від приблизно 0,6 нМ до приблизно 18мМ, як визначено в аналізі зв'язування ВІАсоrе. Винятково для цілей даного винаходу, термін "Апомаб" стосується агоністу антитіла, який зв'язується з DR5 і містить амінокислотні послідовності варіабельного важкого й варіабельного легкого ланцюга, наведені в SEQ ID NO: 55 і 56. Переважно Апомаб містить важкі й легкі ланцюги, наведені в SEQ ID NO: 51 і 52, відповідно. II. Одержання антитіл Нижче наведені методики одержання антитіл, які можуть бути приготовлені у вигляді лікарських препаратів згідно із даним винаходом. (і) Відбір і приготування антигену Переважно, антиген, з яким зв'язується антитіло, являє собою біологічно значимий глікопротеїн, і введення антитіла ссавцеві, який страждає від захворювання або розладу, може приводити до терапевтичної переваги в цього ссавця. Проте, також можуть розглядатися антитіла, спрямовані на неполіпептидні антигени (такі як зв'язані з пухлиною гліколіпідні антигени; див. патент US 5,091,178). Якщо антиген являє собою поліпептид, то він може бути трансмембранною молекулою {наприклад, рецептор) або лігандом, таким як фактор росту. Прикладами антигенів є молекули, такі як ренін; гормон росту, включаючи гормон росту людини й бичачий гормон росту; фактор, що стимулює виділення гормону росту; паратиреоїдний гормон; тиреотропін; ліпопротеїни; альфа-1антитрипсин; А-ланцюг інсуліну; В-ланцюг інсуліну; проінсулін; фолікулостимулювальний гормон; кальцитонін; лютеїнізузуючий гормон; глюкагон; фактори згортання крові, такі як фактор VIIIC, фактор IX, тихорєцької фактор (TF) і фактор фон Вілебранда; фактори, які перешкоджають згортанню крові, такі як протеїн С; передсердний натрійуретичний фактор; сурфактант легенів; активатор плазміногену, такий як урокіназа або активатор плазміногену в сечі або тканинного типу людини (t-PA); бомбезин, тромбін; гемопоетичний фактор росту; фактор некрозу пухлини -альфа й -бета; енкефаліназа; RANTES (регульований за активацією нормально експресованих і секретованих Т-клітин); запальний білок макрофагів людини (МІР-1альфа); сироватковий альбумін, такий як сироватковий альбумін людини; інгібуюча речовина Мюллеріана; Α-ланцюг релаксину; В-ланцюг релаксину; 89798 54 прорелаксин; мишиний гонадотропинасоційований пептид; мікробний білок, такий як бета-лактамаза; ДНаза; IgE; цитотоксичний зв'язаний з Т-лімфоцитами антиген (CTLA), такий як CTLA-4; інгібін; активін; фактор росту ендотелію судин (VEGF); рецептори гормонів або факторів росту; протеїн А або D; ревматоїдні фактори; нейротрофічний фактор, такий як нейротрофічний фактор, який має походження з кісток (BDNF), нейротрофін-3, -4, -5 або -6 (NT-3, NT-4, NT-5, або NT-6), або фактор росту нервів, такий як NGF-b; фактор росту похідних тромбоцитів (PDGF); фактор росту фібробластів, такий як aFGF і bFGF, фактор росту епідермісу (EGF); трансформуючий фактор росту (TGF), такий як TGF-альфа й TGFбета, включаючи TGF-b1, TGF-b2, TGF-bЗ, TGF-b4 або TGF-b5; фактор некрозу пухлини (TNF), такий як TNF-альфа або TNF-бета; інсулін-подібний фактор росту -І і -II (IGF-I і IGF-II); des(1-3)-IGF-I (IGF-I головного мозку), зв'язувальні білки інсулінподібного фактора росту; CD білки, такі як CD3, CD4, CD8, CD19, CD20, CD22 і CD40; еритропоетин; остеоиндуктивние фактори; імунотоксини; кістковий морфогенетичний білок (BMP); інтерферон, такий як інтерферон-альфа, -бета й -гама; колонієстимулувальні фактори (CSF), наприклад, M-CSF, GM-CSF, і G-CSF; інтерлейкіни (IL), наприклад, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9 і IL-10, супероксиддисмутаза; рецептори Т-клітин; рецептори поверхневих мембран; фактор, який прискорює руйнування; вірусний антиген, такий як, наприклад, частина оболонки СНІДу; транспортні білки; "хомінг"-рецептори; адресний; регуляторні білки; інтегрини, такі як С-D11a, CD11b, CD11c, CD18, ICAM, VLA-4 і VCAM; зв'язаний з пухлиною антиген, такий як рецептор HER2, HER3 або HER4: і фрагменти будь-яких перерахованих вище поліпептидів. Прикладами молекулярних цілей для антитіл згідно із даним винаходом є CD білки, такі як CD3, CD4, CD8, CD19, CD20, CD22, CD34 і CD40; представники сімейства рецепторів ErbB, такі як рецептор EGF, HER2, HER3 або HER4 рецептор; поверхневі антигени В-клітин, такі як CD20 або BR3, представники суперсімейства рецептора некрозу пухлини, включаючи DR5; антиген стовбурних клітин передміхурової залози (PSCA); молекули адгезії клітин, такі як LFA-1, Масі, р150.95, VLA-4, ICAM-1, VCAM, альфа4/бета7 інтегрин, і альфаv/бета3 інтегрин, включаючи їх альфа або бета субодиниці (наприклад, антитіла до CD11a, CD18 або CD11b); фактори росту, такі як VEGF, а також їх рецептори; тканинний фактор (TF); фактор некрозу пухлини (TNF), такий як TNF-альфа або TNFбета, інтерферон-альфа-інтерферон (альфа-IFN); інтерлейкін, такий як IL-8; IgE; антигени групи крові; flk2/fkt3 рецептор; рецептор ожиріння (OB); mpl рецептор; CTLA-4; протеїн С і ін. Як імуногени для виробництва антитіл можна використовувати розчинні антигени або їх фрагменти, необов'язково кон'юговані з іншими молекулами. Для трансмембранних молекул, таких як рецептори, як імуногени можна використовувати їх фрагменти (наприклад, позаклітинний домен рецептора). Альтернативно, як імуноген можна вико 55 ристовувати клітини, які експресують трансмембранну молекулу. Такі клітини можуть мати походження із природного джерела (наприклад, лінії ракових клітин), або можуть являти собою клітини, трансформовані для експресії трансмембранної молекули за допомогою рекомбінантних методик. Для фахівця в даній галузі очевидні також інші антигени і їх форми, придатні для одержання антитіл. Для одержання антитіл до HER2, HER2 антиген, який використовується для їх одержання, може являти собою, наприклад, розчинну форму позаклітинного домену HER2 або його частину, що містить необхідний епітоп. Альтернативно, для продукції антитіл можна використовувати клітини, які експресують на своїй клітинній поверхні HER2 (наприклад, NIH-3T3 клітини, трансформовані для понадекспресії HER2; або лінія клітин карциноми, така як клітини SK-BR-3, див. Stancovski та ін., PNAS (USA) 88: 8691-8695 (1991)). (іі) Моноклональні антитіла Моноклональні антитіла одержують із популяції по суті гомогенних антитіл, тобто, індивідуальних антитіл, що включають популяцію, представники якої ідентичні та/або зв'язуються з тим самим епітопом, за винятком можливих варіантів, які можуть виникати при одержанні моноклональних антитіл. Так, визначення «моноклональний» вказує на характер антитіла, що не являє собою суміш окремих антитіл. Наприклад, моноклональні антитіла можуть бути отримані з використанням методу гібридом, вперше описаним Колером із співавт. (Kohler та ін., Nature, 256: 495 (1975)) або можуть бути створені з використанням методик рекомбінантної ДНК (патент US 4816567). У рамках методики гібридоми мишу або іншу підходящу тварину як організм-хазяїн, такий як хом'як, імунізують відповідно до наведеного вище опису, для прояву дії лімфоцитів, які продукують або здатні продукувати антитіла, які можуть специфічно зв'язуватися з білком, який використовують для імунізації. Альтернативно, лімфоцити можуть бути імунізовані in vitro. Лімфоцити далі зливають із мієломними клітинами з використанням підходящого об'єднуючого агента, такого як поліетиленгліколь, з утворенням гібридомних клітин (Goding, Monoclonal Antibodies. Principles and Practice, pp.59-103 (Academic Press, 1986)). Отримані в такий спосіб гібридомні клітини висівають і вирощують у підходящому культуральному середовищі, яке переважно містить одну або декілька речовин, які інгібують ріст або виживання незлитих вихідних мієломних клітин. Наприклад, якщо вихідні мієломні клітини не містять фермент гіпоксантингуанінфосфорибозилтрансферазу (HGPRT або HPRT), то культуральне середовище для гібридом у типовому випадку буде включати гіпоксантин, аміноптерин і тимідин (середовище HAT), що в істотній мірі перешкоджає росту HGPRT-дефіцитних клітин. Кращі мієломні клітини являють собою такі клітини, які ефективно зливаються, підтримують стабільний високий рівень продукції антитіл вибраними антитіло-продукуючими клітинами й чутливі до 89798 56 середовища, таке як середовище HAT. Серед них кращими мієломними клітинними лініями є мишині мієломні лінії, такі як лінії, отримані з мишиних пухлин МОРС-21 і МРС-11, доступні від Salk Institute Cell Distribution Center, San Diego, California USA, і SP-2 або клітини X63-Ag8-653, доступні від Американської Колекції типових культур (American Type Culture Collection, Rockville, Maryland USA). Описані також людські мієломні й гетеромієломні клітинні лінії миші-людини для продукції людських моноклональних антитіл (Kozbor, J. Immunol., 133: 3001 (1984); і Brodeur та ін., Monoclonal Antibodies Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)). Культуральне середовище, у якому вирощують гібридомні клітини, аналізують для визначення продукції моноклональних антитіл проти антигену. Переважно, специфічність за зв'язуванням моноклональних антитіл, які продукуються гібридомними клітинами, визначають імуноосажденням або тестом на зв'язування in vitro, таким як радіоімуноаналіз (РІ) або твердофазний імуноферментний аналіз (ELISA). Афінність за зв'язуванням моноклонального антитіла може бути, визначена, наприклад, за методикою Скетчарда (Scatchard) (Munson і ін., Anal. Biochem., 107: 220 (1980)). Після ідентифікації гібридомних клітин як клітини, які продукують антитіла з бажаною специфічністю, афінністтю та/або активністю, такі клони можуть бути піддані субклонуванню за процедурами граничного розведення з наступним вирощуванням за стандартними методиками (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Підходящі культуральні середовища для даної мети включають, наприклад, середовище D-MEM і середовище RPMI-1640. Крім того, гібридомні клітини можуть вирощуватися in vivo у вигляді асцитних пухлин у тварин. Моноклональні антитіла, які секретуються субклонами, можуть бути відповідним чином відділені від культурального середовища, асцитної рідини або сироватки з використанням звичайних процедур очищення антитіл, таких як, наприклад, очищення на колонці з білком А-сефарозою, хроматографія на гідроксилапатиті, гель-електрофорез, діаліз або афінна хроматографія. ДНК, яка кодує моноклональні антитіла, може бути легко виділена й секвенована з використанням традиційних процедур (наприклад, з використанням олігонуклеотидних зондів, які здатні специфічно зв'язуватися з генами, що кодують важкий й легкий ланцюги мишиних антитіл). Гібридомні клітини служать як переважне джерело такої ДНК. Після виділення ДНК може бути введена у вектор експресії, який потім трансфікують у хазяйські клітини, такі як Е. coli, COS клітини, клітини яєчника китайського хом'яка (СНО) або мієломні клітини, які в іншому випадку не продукують антитільний білок, з досягненням синтезу моноклональних антитіл у рекомбінантних хазяйських клітинах. Рекомбінантна експресія ДНК, що кодує антитіла, у бактеріях описана в ряді оглядів (Skerra та ін., 57 Сurr. Opinion in Immunol., 5: 256-262 (1993) і Pliickthun, Immunol. Revs., 130: 151-188 (1992)). В іншому варіанті моноклональні антитіла або фрагменти антитіл можуть бути виділені з бібліотеки фагових антитіл, одержуваних з використанням методик, описаних у літературі (McCafferty та ін., Nature., 348: 552-554 (1990)). Клаксон і Маркс (Clackson та w., Nature., 352: 624-628 (1991) і Marks та ін., J. Моl. Віоl., 222: 581-597 (1991)) описують виділення мишиних і людських антитіл, відповідно, з використанням фагових бібліотек. Наступні очищення приводять до продукції високоафінних (у нМ діапазоні) людських антитіл, одержуваних за рахунок перегрупування ланцюгів (Marks та ін., Bio/Technology, 10: 779-783 (1992)), а також при проведенні комбінаторної інфекції й рекомбінації in vivo як стратегія створення дуже більших фагових бібліотек (Waterhouse та ін., Nuc. Acids, Res.,21: 2265-2266 (1993)). Таким чином, дані методики являють собою життєздатні альтернативи традиційним гібридомним методикам моноклональних антитіл для виділення моноклональних антитіл. ДНК може бути також модифікована, наприклад, шляхом заміщення кодувальної послідовності константних доменів важкого ланцюга й легкого ланцюга людської молекули замість гомологічних мишиних послідовностей (патент US 4816567; і Morrison та ін., Proc. Natl. Acad. Sei. USA., 81: 6851 (1984)) або шляхом ковалентного приєднання до всієї кодувальної послідовності імуноглобуліну або до частини кодувальної послідовності для не імуноглобулінового поліпептиду. У типовому випадку такі не імуноглобулінові пептиди заміщають константними доменами антитіла, або вони можуть бути заміщені варіабельними доменами одного антиген-об'єднаного сайту антитіла з утворенням химерного бивалентного антитіла, що включає антиген-об'єднаний сайт зі специфічністю до одного антигену й інший антиген-об'єднаний сайт зі специфічністю до іншого антигену. (iiі) Гуманізовані антитіла Методи гуманізації антитіл із джерел, відмінних від людини, описані в літературі. Переважно гуманізоване антитіло містить один або декілька амінокислотних залишків, введених у нього з іншого джерела, яке відмінне від людини. Вказані амінокислотні залишки, відмінні від людських, які звичайно називають «імпортними» залишками, які в типовому випадку беруть із «імпортного» варіабельного домену. Гуманізація може бути по суті проведена за методикою Вінтера із сотр. (Winter and co-workes) (Jones та ін., Nature, 321: 522-525 (1986); Riechman та ін., Nature., 332: 323-327 (1988); Verhoeyen тa ін., Science, 239: 1534-1536 (1988)) шляхом заміщення послідовностей гіперваріабельних ділянок на відповідні послідовності людського антитіла. Відповідно, такі «гуманізовані» антитіла являють собою химерні антитіла (патент US 4816567), у яких значно менше, ніж в інтактному варіабельному домені людського антитіла заміщено відповідною послідовністю з виду, відмінного від людини. Практично, гуманізовані антитіла являють собою в типовому випадку людські 89798 58 антитіла, у яких деякі залишки гіперваріабельної ділянки й, можливо, деякі залишки FR заміщені залишками з аналогічних сайтів в антитілах гризунів. Вибір людських варіабельних доменів як легкого, так і важкого ланцюгів, які використовують для одержання гуманізованих антитіл, дуже важливий для досягнення антигенності. Відповідно до так званого методу «бест-фіт» («best-fit»), або найкращого припасування, послідовність варіабельного домену в антитілі гризуна піддають скринінгу з використанням повної бібліотеки відомих послідовностей варіабельних доменів антитіл людини. Людська послідовність, яка відрізняється найбільшою близькістю до послідовності гризуна, відбирається як каркасну ділянку людської молекули (FR) для гуманізованого антитіла (Sims та ін., J. Immunol.,151: 2296 (1993)); Chothia та m.,J. Моl. Вiol., 196: 901 (1987)). В іншій методиці використовується конкретна каркасна ділянка, яку одержують з консенсусної послідовності всіх людських антитіл певної підгрупи легких або важких ланцюгів. Такого роду підхід може бути використаний для одержання ряду різних гуманізованих антитіл (Carter та ін., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992)); Presta й ін., J. Immunol., 151: 2623 (1993)). Крім того, важливо, щоб при гуманізації антитіл зберігалася висока афінність до антигену й інші корисні біологічні властивості. Для досягнення даної мети, відповідно до кращого методу, гуманізовані антитіла одержують при проведенні аналізу вихідних послідовностей і різних концептуальних гуманізованих продуктів з використанням тривимірних моделей вихідних і гуманізованих послідовностей. Тривимірні імуноглобулінові моделі доступні й відомі фахівцям у даній галузі. Доступні також комп'ютерні програми, які дозволяють побачити ймовірні тривимірні конформаційні структури вибраних передбачуваних імуноглобулінових послідовностей. При огляді таких картин можна проаналізувати ймовірну роль залишків у функціонуванні передбачуваної імуноглобулінової послідовності, тобто провести аналіз залишків, які впливають на здатність даного імуноглобуліну зв'язувати свій антиген. У цьому випадку залишки FR можуть бути відібрані й об'єднані з реципієнтними й імпортними послідовностями, так щоб досягалися бажані характеристики антитіла, такі як підвищена афінність для цільового(их) антигену(ів). В основному, залишки гіперваріабельної ділянки безпосередньо й найбільш значно залучені в процес зв'язування з антигеном, роблячи на нього вплив У документі WO 01/00245 описується одержання репрезентативних гуманізованих антитіл до HER2, які зв'язують HER2 і блокують активацію ліганду рецептора HER Особливо цікаве в даному контексті гуманізоване антитіло блокує EGF, TGFα та/або HRG-опосередковану активацію МАРК по суті настільки ж ефективно, як і мишине моноклональне антитіло 2С4 (або його Fab фрагмент) та/або зв'язує HER2 по суті настільки ж ефективно, як і мишине моноклональне антитіло 2С4 (або його Fab фрагмент). Описане в даному винаході гуманізоване антитіло може, наприклад, включати 59 залишки гіперваріабельної ділянки із джерела, відмінного від людини, включеного у варіабельний домен важкого ланцюга молекули людини й може також включати заміщення в каркасній ділянці (FR) у положенні, вибраному із групи, яка складається з 69Н, 71Н і 73Н, де використовується система нумерації варіабельного домену, відповідно до певної системи (Kabat та ін., Sequences of Proteins of th Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). В одному варіанті гуманізоване антитіло включає заміщення в FR по двох або всіх положеннях: 69Н, 71Н і 73Н. Репрезентативне гуманізоване антитіло, яке представляє інтерес у даному контексті, включає в гіперваріабельній ділянці важкого ланцюга залишки GFTFTDYTMX, де X переважно означає D або S (SEQ ID NO: 7), DVNPNSGGSIYNQRFKG (SEQ ID NO: 8) та/або NLGPSFYFDY (SEQ ID NO: 9), необов'язково включаючи модифікації амінокислот таких CDR залишків, тобто такі модифікації, які по суті зберігають або підвищують афінність антитіл. Наприклад, варіант антитіла, цікавого в контексті даного опису, може мати від приблизно одного до приблизно семи або приблизно п'ять амінокислотних заміщень у вказані вище CDR послідовностях варіабельної ділянки важкого ланцюга. Такі варіанти антитіл можуть бути отримані шляхом афінного насичення, наприклад, як буде описано нижче. Найбільш краще гуманізоване антитіло включає у варіабельному домені важкого ланцюга амінокислотну послідовність SEQ ID NO: 4. Гуманізоване антитіло може включати залишки гіперваріабельної ділянки варіабельного домену легкого ланцюга KASQDVSIGVA (SEQ ID NO: 10); SASYXXX, де X в 5-ому положенні означає переважно R або L, X в 6-ому положенні означає переважно Υ або Ε, Φ в 7-ому положенні означає переважно Τ або S (SEQ ID NO: 11); та/або QQYYIYPYT (SEQ ID NO: 12), наприклад, додатково до CDR залишків варіабельного домену важкого ланцюга, вказаним у попередньому абзаці. Такі гуманізовані антитіла необов'язково включають модифікації амінокислот у вказані вище CDR залишках, наприклад, модифікації, які по суті зберігають або підвищують афінність антитіла. Наприклад, варіант антитіла, цікавого в контексті даного опису, може мати від приблизно одного до приблизно семи або приблизно п'ять амінокислотних заміщень у вказані вище CDR послідовностях варіабельного домену легкого ланцюга. Такі варіанти антитіл можуть бути отримані шляхом афінного насичення, наприклад, за описаною нижче методикою. Найбільш краще гуманізоване антитіло включає амінокислотну послідовність варіабельного домену легкого ланцюга SEQ ID NO: 3. Даний винахід також стосується «дозрілих» у плані афінності антитіл, які зв'язуються з HER2 і блокують активацію ліганду рецептора HER Вихідне антитіло може являти собою людське антитіло або гуманізоване антитіло, наприклад, антитіло, яке включає варіабельні послідовності легкого та/або послідовності важкого ланцюга SEQ ID NO: 3 і 4, відповідно (наприклад, варіант 574) «Дозріле» у плані афінності антитіло переважно зв'язу 89798 60 ється з рецептором HER2 з афінністю, що перевершує афінність мишиного 2С4 або варіанта 5С4 (наприклад, від приблизно двох або приблизно чотирьох разів до приблизно 10 разів або приблизно 1000 разів підвищеної афінністю, за даними оцінки з використанням НЕR2-позаклітинного домену (ECD) по методу ELISA). Репрезентативні CDR залишки варіабельного важкого ланцюга, що підходять для заміщення, включають Н28, Н30, Н34, Н35, Н64, Н96, Н99 або сполучення двох або більше залишків (наприклад, двох, трьох, чотирьох, п'яти, шести або семи таких залишків). Приклади CDR залишків варіабельного домену легкого ланцюга, що підходять для зміни, включають L28, L50, L53, L56, L91, L92, L93, L94, L96, L97 або сполучення двох або більше залишків (наприклад, двох, трьох, чотирьох, п'яти або приблизно до десяти таких залишків). У даному описі розглядаються різні форми гуманізованого антитіла або «дозрілого» у плані афінності антитіла. Наприклад, гуманізоване антитіло або «дозріле» у плані афінності антитіло може являти собою антитільний фрагмент, такий як Fab, що необов'язково може бути кон'югований з одним або декількома цитотоксичними агентами з одержанням імунокон'югата. Альтернативно, гуманізоване антитіло або «дозріле» у плані афінності антитіло може являти собою повнорозмірне антитіло, таке як повнорозмірне IgG1 антитіло. (iv) Антитіла людини Як альтернатива процесів гуманізації можна одержувати людські антитіла. Наприклад, у цей час можливо створювати трансгенних тварин (наприклад, мишей), які здатні при імунізації продукувати повний репертуар людських антитіл, під час відсутності продукції ендогенного імуноглобуліну. Наприклад, описано, що гомозиготні делеції в гені з'єднувальної ділянки важкого ланцюга антитіла (JH) у химерних і мутантних мишах зародкової лінії приводять до повного інгібування продукції ендогенного антитіла. Перенесення генної сукупності людського зародкового імуноглобуліну в зародкову лінію таких мутантних мишей приводить до продукції людських антитіл при антигенній провокації (див, наприклад, Jakobovits та ін., Proc. Natl. Acad. Sci. USA., 90: 2551 (1993); Jakabovits та ін., Nature, 362: 255-258 (1993); Bruggermann та ін., Year in Immuno., 7: 33 (1993); і патенти US 5591669, 5589369 і 5545807. Альтернативно, методика прояву активності фагів (McCafferty та ін., Nature, 348: 552-553 (1990)) може використовуватися для продукції людських антитіл і антитільних фрагментів in vitro з генного репертуару варіабельного домену імуноглобуліну (V) від імунізованих донорів. Відповідно до даної методики, гени для V домену антитіла клонують у рамці зчитування в основному або мінорному гені білкової оболонки або ниткоподібного бактеріофага, такого як М13 або fd, і проявляють як функціональні антитільніе фрагменти на поверхні фагової частинки. Оскільки ниткоподібна частинка містить копію одноланцюгової ДНК фагового геному, селекція на основі функціональних властивостей антитіл також приводить до селекції гена, що кодує антитіло, яке демонструє вказані власти
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody formulation in histidine-acetate buffer
Автори англійськоюAndya James D., Gwee Shiang C., Liu Jun
Назва патенту російськоюСтабильный водный препарат антитела в гистидинацетатном буфере
Автори російськоюАндья Джеймс Д., Гви Шиан Ц., Лиу Жунь
МПК / Мітки
МПК: A61K 47/18, A61P 35/00, A61K 39/395
Мітки: гістидинацетатному, препарат, стабільний, антитіла, водний, буфері
Код посилання
<a href="https://ua.patents.su/120-89798-stabilnijj-vodnijj-preparat-antitila-v-gistidinacetatnomu-buferi.html" target="_blank" rel="follow" title="База патентів України">Стабільний водний препарат антитіла в гістидинацетатному буфері</a>
Попередній патент: Монета здоров’я
Наступний патент: Сигаретна упаковка і спосіб її виготовлення
Випадковий патент: Лікувальний озонатор