Анти-vegf/dll4-імуноглобулін з подвійними варіабельними доменами і його застосування
Номер патенту: 111306
Опубліковано: 11.04.2016
Автори: Наумовскі Луї, Гу Цзицзе, Хіксон Джонатан А., Чарі Раві, Лепп Сьюзан Е., Хааш Діанна Л., Цао Сяньхуа, Гупта Супрія, Амброзі Домінік Дж., Лі Інчунь, Замірі Камеллія
Формула / Реферат
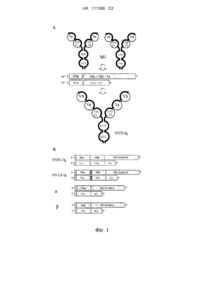
1. Зв'язувальний білок, який містить перший і другий поліпептидні ланцюги, при цьому кожен з них містить VD1-(X1)n-VD2-C-(X2)n, де
VD1 означає перший варіабельний домен;
VD2 означає другий варіабельний домен;
С означає константний домен;
X1 означає лінкер;
Х2 означає Fc-область;
n дорівнює 0 або 1;
при цьому домени VD1 у першому і другому поліпептидних ланцюгах утворюють першу функціональну зв'язуючу мішень ділянку, і домени VD2 у першому і другому поліпептидних ланцюгах утворюють другу функціональну зв'язуючу мішень ділянку, і при цьому зв'язувальний білок здатний до зв'язування DLL4 і VEGF, при цьому:
(і) варіабельні домени, які утворюють функціональну зв'язуючу мішень ділянку для DLL4, містять:
три CDR з послідовності SEQ ID NO: 39 і три CDR з послідовності SEQ ID NO: 40, і
(іі) варіабельні домени, які утворюють функціональну зв'язуючу мішень ділянку для VEGF, містять:
три CDR з послідовності SEQ ID NO: 41 і три CDR з послідовності SEQ ID NO: 42.
2. Зв'язувальний білок за п. 1, у якому зв'язувальний білок містить перший поліпептидний ланцюг, який містить перший VD1-(X1)n-VD2-C-(X2)n, де
VD1 означає перший варіабельний домен важкого ланцюга;
VD2 означає другий варіабельний домен важкого ланцюга;
С означає константний домен важкого ланцюга;
X1 означає лінкер;
Х2 означає Fc-область;
n дорівнює 0 або 1; і
у якому зв'язувальний білок містить другий поліпептидний ланцюг, що містить другий VD1-(X1)n-VD2-C-(X2)n, де
VD1 означає перший варіабельний домен легкого ланцюга;
VD2 означає другий варіабельний домен легкого ланцюга;
С означає константний домен легкого ланцюга;
X1 означає лінкер;
n дорівнює 0 або 1 у випадку (Х1)n;
n дорівнює 0 у випадку (Х2)n,
при цьому домени VD1 у першому і другому поліпептидних ланцюгах утворюють першу функціональну зв'язуючу мішень ділянку, і домени VD2 у першому і другому поліпептидних ланцюгах утворюють другу функціональну зв'язуючу мішень ділянку.
3. Зв'язувальний білок за п. 1 або 2, у якому зв'язувальний білок містить:
(і) варіабельні домени, які утворюють функціональну зв'язуючу мішень ділянку для DLL4, що містить послідовності:
SEQ ID NO: 39 і SEQ ID NO: 40, і
(іі) варіабельні домени, які утворюють функціональну зв'язуючу мішень ділянку для VEGF, що містить послідовності:
SEQ ID NO: 41 і SEQ ID NO: 42.
4. Зв'язувальний білок за будь-яким із пп. 1-3, у якому зв'язувальний білок містить два перші і два другі поліпептидні ланцюги і чотири функціональні зв'язуючі мішень ділянки.
5. Зв'язувальний білок за будь-яким із пп. 1-4, у якому лінкер X1 містить будь-яку з послідовностей SEQ ID NO: 1-38 або основану на G/S послідовність.
6. Зв'язувальний білок за будь-яким із пп. 1-4, у якому лінкер X1 містить послідовність SEQ ID NO: 2 у першому поліпептидному ланцюзі і SEQ ID NO: 6 у другому поліпептидному ланцюзі.
7. Зв'язувальний білок за будь-яким із пп. 1-6, у якому Fc-область зв'язувального білка являє собою Fc-область із IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE або IgD або її варіант.
8. Зв'язувальний білок за будь-яким із пп. 1-7, у якому Fc-область зв'язувального білка являє собою Fc-область із варіантом послідовності.
9. Зв'язувальний білок за будь-яким із пп. 1-6, у якому зв'язувальний білок містить послідовності константної області SEQ ID NO: 74 і/або SEQ ID NO: 73.
10. Зв'язувальний білок за будь-яким із пп. 1-9, у якому перший поліпептидний ланцюг зв'язувального білка містить послідовність SEQ ID NO: 56 і другий поліпептидний ланцюг зв'язувального білка містить послідовність SEQ ID NO: 64.
11. Зв'язувальний білок за п. 1, у якому перший і другий поліпептидні ланцюги зв'язувального білка містять послідовності SEQ ID NO: 74 і 73.
12. Зв'язувальний білок за будь-яким із пп. 1-11, у якому зв'язувальний білок здатний:
(a) зв'язуватися з VEGF з константою дисоціації (KD) не більш ніж приблизно 7,0×10-10 М, яку вимірюють, використовуючи резонанс поверхневого плазмону, і/або блокувати активність VEGF з ІС50 не більш ніж приблизно 3,8 нМ, яку вимірюють у конкурентному ELISA VEGFR1; і/або
(b) зв'язуватися з DLL4 з константою дисоціації (KD) не більш ніж приблизно 1,0×10-8 М, яку вимірюють, використовуючи резонанс поверхневого плазмону, і/або блокувати активність DLL4 з ІС50 не більш ніж приблизно 1,09 нМ, яку вимірюють у конкурентному ELISA Notch.
13. Композиція, яка містить зв'язувальний білок за будь-яким із пп. 1-12 і щонайменше один додатковий засіб.
14. Композиція за п. 13, у якій додатковий засіб включає щонайменше один із засобів: молекулу імуноадгезії, візуалізуючий засіб, терапевтичний засіб, цитотоксичний засіб, радіоактивну мітку, фермент, флуоресціюючу мітку, люмінесцентну мітку, біолюмінесцентну мітку, магнітну мітку, біотин, антиметаболіт, алкілуючий засіб, антибіотик, фактор росту, цитокін, антиангіогенний засіб, антимітотичний засіб, антрациклін, токсин або апоптозний засіб, хіміотерапевтичний засіб; візуалізуючий засіб, інгібітор ангіогенезу, інгібітор кінази (включаючи, але без обмеження, інгібітор KDR і ТІЕ-2), модулятор костимулюючої молекули (включаючи, але без обмеження, анти-В7.1, анти-В7.2, CTLA4-Ig, анти-СD20), блокатор молекули адгезії (включаючи, але без обмеження, анти-LFA-1-антитіло, антитіло проти E/L-селектину, aнти-VEGF-мАт, aнти-DLL4-мАт, низькомолекулярний інгібітор), антитіло проти цитокіну або його функціональний фрагмент (включаючи, але без обмеження, анти-ІL-18, анти-TNF або антитіло проти IL-6/рецептора цитокіну), метотрексат, циклоспорин, рапаміцин, FK506, реєстровану мітку або репортер, антагоніст TNF, протиревматичний засіб, міорелаксант, наркотик, нестероїдний протизапальний лікарський засіб (НПЗЗ), анальгетик, анестетик, седативний засіб, локальний анестетик, блокатор нервово-м'язового проведення, протимікробний засіб, протипсоріатичний засіб, кортикостероїд, анаболічний стероїд, еритропоетин, імунізацію, імуноглобулін, імуносупресор, гормон росту, гормонозамісний лікарський засіб, радіофармацевтичний засіб, антидепресант, антипсихотичний засіб, стимулятор, лікарський засіб проти астми, бета-агоніст, інгаляційний стероїд, епінефрин або аналог, цитокін, антагоніст цитокіну, протигіпертонічний засіб, діуретик, антагоніст адренергічного рецептора, блокатор кальцієвих каналів, інгібітор реніну, інгібітор АСЕ, антагоніст рецептора ангіотензину II, судинорозширювальний засіб, агоніст альфа-2, клонідин, метилдопу, гідралазин, празозин, резерпін, моксонідин, кванфацин, периндоприл/індапамід, лофексидин, метирозин, антикоагулянт, варфарин, гепарин, низькомолекулярний гепарин, далтепарин, аргатробан, бевалірудин, лепірудин і декстрозу.
15. Композиція за п. 13, у якій додатковий засіб включає один або декілька з наступних засобів: цитотоксичний засіб, хіміотерапевтичний засіб, антиангіогенний засіб, анти-СТLA4-антитіло, блокатор кальцієвих каналів, інгібітор АСЕ, FOLFIRI, паклітаксел, карбоплатин, доксил, топотекан і цисплатин.
16. Застосування зв'язувального білка за будь-яким із пп. 1-12 або фармацевтичної композиції за будь-яким із пп. 13-15 у виробництві лікарського засобу для лікування захворювання, яке характеризується надмірним ростом судин, набряком або аномальною експресією або активністю DLL4 і/або VEGF, у суб'єкта.
17. Застосування за п. 16, у якому лікарський засіб додатково містить щонайменше один додатковий засіб для лікування захворювання, яке характеризується надмірним ростом судин, набряком або аномальною експресією або активністю DLL4 і/або VEGF, у суб'єкта.
18. Застосування за п. 17, у якому щонайменше один додатковий засіб включає один або декілька з наступних засобів: іринотекан, лейковорин, 5-FU, темозоломід, капецитабін, гемцитабін і паклітаксел.
19. Застосування за п. 17, у якому щонайменше один додатковий засіб включає один або декілька з наступних засобів: цитотоксичний засіб, хіміотерапевтичний засіб, антиангіогенний засіб, анти-СТLА4-антитіло, блокатор кальцієвих каналів, інгібітор АСЕ, FOLFIRI, паклітаксел, карбоплатин, доксил, топотекан і цисплатин.
20. Застосування за будь-яким із пп. 16-19, у якому захворюванням є карцинома прямої і ободової кишки, рак яєчника, рак шийки матки, рак молочної залози, рак легені або рак підшлункової залози.
21. Застосування за будь-яким із пп. 16-19, у якому захворюванням є первинна або метастатична злоякісна пухлина, рак молочної залози, рак ободової кишки, рак прямої кишки, рак легені, недрібноклітинний рак легені, аденокарцинома, рак ротової частини глотки, рак гортанної частини глотки, рак стравоходу, рак шлунка, рак підшлункової залози, рак печінки, рак жовчного міхура, рак жовчних проток, рак тонкого кишечнику, рак сечових шляхів, рак нирок, рак сечового міхура, рак уротелію, рак жіночих статевих шляхів, рак шийки матки, рак матки, рак яєчників, хоріокарцинома, гестаційна трофобластична хвороба, рак чоловічих статевих шляхів, рак простати, рак сім'яних пухирців, рак сім'яників, пухлини зародкових клітин, рак ендокринних залоз, рак щитовидної залози, рак надниркової залози, рак гіпофіза, рак шкіри, гемангіоми, меланоми, саркоми, саркома кісток, саркома м'яких тканин, саркома Капоші, пухлини головного мозку, пухлини нервів, пухлини очей, пухлини оболонок головного мозку, астроцитоми, гліома, гліобластоми, ретинобластоми, нейроми, нейробластоми, шваноми і менінгіоми, солідні пухлини, що виникають у результаті гематопоетичних злоякісних новоутворень, лейкоз, лімфома, ходжкінська лімфома, неходжкінська лімфома, рак шлунка, рак сечового міхура, рак простати, рак прямої кишки, гематологічні злоякісні новоутворення, абеталіпопротеїнемія, акроціаноз, гострий лейкоз, гострий лімфобластний лейкоз (ALL), гострий мієлоїдний лейкоз (AML), В-клітинна лімфома, лімфома Беркітта, хронічний мієлоцитарний лейкоз (CML), хронічний лімфоцитарний лейкоз (CLL), карцинома прямої і ободової кишки, волосатоклітинний лейкоз, злоякісна лімфома, злоякісний гістіоцитоз, злоякісна меланома, множинна мієлома, карцинома підшлункової залози, паранеопластичний синдром, гіперкальцемія при злоякісних новоутвореннях, саркоми, солідні пухлини, макулярна дегенерація, цукровий діабет типу 1, діабетична ретинопатія або атеросклероз.
22. Застосування за будь-яким із пп. 16-17, у якому захворюванням є рак ободової кишки і/або лікарський засіб додатково містить один або декілька з наступних засобів: іринотекан, лейковорин, темозоломід, гемцитабін, паклітаксел, капецитабін і 5-FU.
23. Застосування за будь-яким із пп. 16-17, у якому захворюванням є гліобластома і/або лікарський засіб додатково містить темозоломід.
24. Застосування за будь-яким із пп. 16-17, у якому захворюванням є рак підшлункової залози і/або лікарський засіб додатково містить гемцитабін.
25. Застосування за будь-яким із пп. 16-17, у якому захворюванням є рак молочної залози і/або лікарський засіб додатково містить паклітаксел.
26. Застосування за будь-яким із пп. 16-25, у якому лікарський засіб додатково містить:
одну або кілька амінокислот, один або декілька полісахаридів і/або полісорбат і зв'язувальний білок у концентрації приблизно 0,1-100 мг/мл, при цьому фармацевтична композиція має рН 5,0-7,0.
27. Застосування за п. 26, у якому одна або кілька амінокислот містять гістидин і він присутній у концентрації 10-20 мМ.
28. Застосування за п. 26 або 27, у якому один або декілька полісахаридів містять сахарозу і вона присутня в концентрації 0-8,0 % маса/об'єм (мас./об.).
29. Застосування за будь-яким із пп. 26-28, у якому полісорбатом є полісорбат-80 і він присутній у концентрації 0-0,06 % мас./об.
30. Застосування за будь-яким із пп. 26-29, у якому одна або кілька амінокислот містять аргінін і він присутній у концентрації 0-1,5 % мас./об.
31. Застосування за будь-яким із пп. 26-30, у якому зв'язувальний білок присутній у концентрації 0,1-25 мг/мл.
32. Застосування за п. 26, у якому композиція містить 15 мМ гістидину, 0,03 % (мас./об.) полісорбату-80, 4 % (мас./ об.) сахарози і 25 мг/мл зв'язувального білка і має рН 6.
Текст
Реферат: Винахід належить до зв’язувального білка, який специфічно зв’язується з DLL4 і VEGF, композиції, що містить вказаний білок та застосування зв’язувального білка або композиції, що його містить для виробництва лікарського засобу для лікування захворювання , яке характеризується надмірним ростом судин, набряком або аномальною експресією або активністю DLL4 і/або VEGF. UA 111306 C2 (12) UA 111306 C2 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка вимагає пріоритет згідно з 35 U.S.C. § 119 на основі попередньої заявки на видачу патенту США № 61/721072, поданої 1 листопада 2012 року, і попередньої заявки на видачу патенту США № 61/787927, поданої 15 березня 2013 року, обидві заявки включені в даний опис у вигляді посилання в повному обсязі. У даному описі розкриті полівалентні і поліспецифічні зв’язувальні білки, способи одержання зв’язувальних білків і їх застосування для діагностики, пригнічення, профілактики і/або лікування раку, пухлин і/або інших залежних від ангіогенезу захворювань. Сконструйовані білки, такі як поліспецифічні зв’язувальні білки, здатні зв'язувати два або більше антигенів, відомі в даній галузі. Такі поліспецифічні зв’язувальні білки можуть бути створені з використанням злиття клітин, хімічної кон'югації або методики одержання рекомбінантної ДНК. Існує множина поліспецифічних зв’язувальних білкових структур, відомих у даній галузі; однак багато таких структур і способів мають явні недоліки. Біспецифічні антитіла були одержані з використанням методики квадром. Однак присутність помилково спарених побічних продуктів і значущо знижені виходи продукції при використанні такої методики означають, що вимагаються складні способи очищення. Біспецифічні антитіла також можуть бути одержані в результаті хімічної кон'югації двох різних мАт. Однак такий спосіб не дає гомогенних препаратів. Інші способи, застосовувані раніше, включають зв'язування двох вихідних антитіл за допомогою гетеробіфункціонального поперечнозшивального агента, одержання тандемних одноланцюжкових молекул Fv, діантитіл, біспецифічних діантитіл, одноланцюжкових діантитіл і дидіантитіл. Однак кожний з таких способів має недоліки. Крім того, була описана конструкція полівалентного антитіла, що містить два повтори Fab у важкому ланцюзі IgG і здатна зв'язувати чотири молекули антигену (дивіться публікацію PCT № WO 0177342 і публікацію Miller зі співавторами (2003), J. Immunol. 170(9):4854-61). Системи ліганд-рецептор еволюціонували спільно для підтримання специфічності. Їх взаємодії активують специфічну передачу сигналів для конкретної біологічної активності. Однак білки, що зв’язують рецептор, які не є лігандами, такі як моноспецифічні антитіла, бі- або поліспецифічні зв’язувальні білки, сполучення неконкурентних антитіл або інші білки, що зв’язують рецептор, які зв'язуються з позаклітинним доменом (ECD) рецептора, можуть упізнавати епітопи, відмінні від ділянки рецептора, що зв’язує ліганд. Зв'язування з таким відмінним епітопом(ами) на ECD рецептора може передавати конформаційні зміни внутрішньоклітинному домену, що може приводити до нового несподіваного каскаду передачі сигналу. У патенті США № 7612181 (включеному в даний опис у вигляді посилання в повному обсязі) пропонується нове сімейство зв’язувальних білків, здатних зв'язувати два або більше антигенів з високою афінністю, що названі зв’язувальними білками з подвійним варіабельним доменом (DVD-зв’язувальний білок) або імуноглобулінами з подвійним варіабельним доменом (DVD-Ig). DVD-молекули є тетравалентними Ig-подібними білками з подвійною специфічністю, здатними зв'язувати два різних епітопи на одній і тій же молекулі або дві різних молекули одночасно. DVD є унікальними зв’язувальними білками, що складаються з двох варіабельних доменів, злитих з N-кінцем бівалентного антитіла. Варіабельні домени можуть бути безпосередньо злиті один з одним або можуть бути зв'язані через синтетичні пептидні лінкери різної довжини й амінокислотного складу. DVD можуть бути сконструйовані з інтактними і функціональними Fcдоменами, дозволяючи їм потім опосередковувати відповідні ефекторні функції. Форма DVD унаслідок гнучкості відносно вибору пари антитіл, орієнтації двох антигензв’язувальних доменів і довжини лінкера, що їх зв'язує, може забезпечувати нові терапевтичні можливості. Хоча в даній галузі пропонується множина структур з деякими перевагами і недоліками, необхідні специфічні конструкції для одержання полівалентних зв’язувальних білків зі специфічними властивостями, що зв'язуються зі специфічними мішенями. Крім того, нові послідовності варіабельних доменів можуть додатково поліпшувати властивості зв’язувальних білків. Зокрема, поліпшені DVD, що зв'язуються з DLL4 і VEGF, можуть виявитися корисними. Відповідно, у даному описі розкриті імуноглобуліни з подвійними варіабельними доменами, які одержуються з використанням каркаса зв’язувального білка, розкритого в патенті США № 7612181 (включеному в даний опис у вигляді посилання в повному обсязі), і містять конкретні перший і другий поліпептидні ланцюги, при цьому кожний містить першу і другу послідовності варіабельних доменів (наприклад, послідовності, перераховані в таблиці 2), що утворюють функціональні зв’язувальні ділянки для VEGF і DLL4. У деяких варіантах перший і другий поліпептидні ланцюги містять першу і другу послідовності варіабельного домену, кожна з яких містить три CDR з однієї з послідовностей, перерахованих у таблиці 2, і утворюють функціональні ділянки зв'язування для VEGF і DLL4. 1 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 DLL4 є лігандом, залученим у передачу сигналів від клітини до клітини за допомогою шляху рецептора Notch. Така комунікація між клітинами необхідна для багатьох біологічних процесів, таких як диференціювання, проліферація і гомеостаз. Шлях передачі сигналу Notch є однією із систем, яка використовується широким колом еукаріот. Такий шлях, особливо рецептор Notch, також важливий для функціонального пухлинного ангіогенезу. Таким чином, інгібування функції рецептора Notch, блокування рецептора Notch і/або блокування шляху передачі сигналу Notch є можливими стратегіями створення протипухлинних композицій і способів терапії. Було доведено, що низькомолекулярні інгібітори рецептора Notch часто бувають токсичними, оскільки вони пригнічують експресію рецепторів Notch дикого типу (нормальну) в організмі. Таким чином, різних представників шляху передачі сигналів Notch можна розглядати як потенційні мішені для терапії. Лігандом рецептора Notch у судинній системі є Delta 4 або Deltaподібний 4 (DLL4). Широко експресований у судинній системі DLL4 важливий для розвитку судин (Yan et al., Clin. Cancer Res., 13(24):7243-7246 (2007); Shutter et al., Genes Dev., 14(11):1313-1318 (2000); Gale et al., Proc. Natl. Acad. Sci. USA, 101(45):15949-15954 (2004); Krebs et al., Genes Dev., 14(11):1343-1352 (2000)). У мишей, гетерозиготних по DLL4, спостерігають ембріональну загибель внаслідок великих дефектів розвитку судин (Gale et al., Proc. Natl. Acad. Sci. USA, 101(45):15949-15954 (2004); Duarte et al., Genes Dev., 18(20):2474-2478 (2004); Krebs et al., Genes Dev., 18(20):2469-2473 (2004)). Експресія DLL4 може бути індукована VEGF (Liu et al., Mol. Cell Biol., 23(1):14-25 (2003); Lobov et al., Proc. Natl. Acad. Sci. USA, 104(9):3219-3224 (2007)). VEGF є сигнальним білком, продукованим клітинами, залученими в ангіогенез. Крім того, DLL4 може негативно регулювати передачу сигналу VEGF, частково за допомогою репресії VEGFR2 і індукції VEGR1 (Harrington et al., Microvasc. Res., 75(2):144-154 (2008); Suchting et al., Proc. Natl. Acad. Sci. USA, 104(9):32253230 (2007)). Тонка координація між DLL4 і VEGF важлива для функціонального ангіогенезу, що робить і DLL4, і VEGF потенційними мішенями для терапевтичного втручання. Крім своєї фізіологічної ролі DLL4 і VEGF також піддаються підвищувальній регуляції в кровоносних судинах у пухлинах (Gale et al., Proc. Natl. Acad. Sci. USA, 101(45):15949-15954 (2004); Mailhos et al., Differentiation, 69(2-3):135-144 (2001); Patel et al., Cancer Res., 65(19):86908697 (2005); Patel et al., Clin. Cancer Res., 12(16):4836-4844 (2006); Noguera-Troise et al., Nature, 444(7122):1032-1037 (2006)). Було показано, що блокування DLL4 інгібує ріст первинних пухлин у множині моделей (Noguera-Troise et al., Nature, 444(7122):1032-1037 (2006); Ridgway et al., Nature, 444(7122):1083-1087 (2006); Scehnet et al., Blood, 109(11):4753-4760 (2007)). Інгібування DLL4 ефективне навіть проти пухлин, що резистентні до анти-VEGF-терапії. Таким чином, комбіноване інгібування і DLL4, і VEGF може приводити до посиленої протипухлинної терапії. Цікаво, що на відміну від інгібування VEGF, яке знижує формування судин у пухлині, блокування DLL4 приводить до збільшення щільності судинної системи в пухлині, при цьому судини є аномальними, не можуть підтримувати ефективне перенесення крові і є функціонально неефективними. Таким чином, руйнування обох лігандів VEGF і DLL4 забезпечує різні способи дії потенційних протипухлинних засобів лікування. Хоча в даній галузі відомі антитіла і різні зв’язувальні конструкції, зберігається необхідність у поліпшеній цілеспрямованій дії і підвищеній ефективності зв'язування з VEGF і DLL4, наприклад, для лікування злоякісної пухлини і канцерогенезу. У даній галузі є потреба в поліпшених полівалентних зв’язувальних білках, здатних зв'язувати DLL4 і VEGF. Відповідно пропонуються нові зв’язувальні білки, при цьому зв’язувальні білки здатні зв'язувати DLL4 і VEGF. У деяких варіантах зв’язувальні білки здатні, наприклад, зв'язуватися з DLL4 і VEGF з поліпшеною афінністю зв'язування і/або ефективністю нейтралізації. Пропонуються зв’язувальні білки, здатні цілеспрямовано діяти на два епітопи, при цьому зв’язувальні білки здатні зв'язувати DLL4 і VEGF. В одному варіанті пропонуються зв’язувальні білки, здатні зв'язувати епітопи DLL4 і VEGF з високою афінністю. В одному варіанті зв’язувальні білки містять каркас зв’язувального білка з подвійним варіабельним доменом, що містить послідовності CDR і варіабельних доменів, перераховані в таблиці 2. В одному варіанті каркас зв’язувального білка з подвійним варіабельним доменом містить каркас, описаний у патенті США № 7612181 (включеному в даний опис у вигляді посилання в повному обсязі). В одному варіанті пропонуються зв’язувальні білки, які містять поліпептидний ланцюг, що може зв'язувати два епітопи двох різних білків (VEGF і DLL4), при цьому поліпептидний ланцюг містить VD1-(X1)n-VD2-C-(X2)n, де VD1 означає перший варіабельний домен, VD2 означає другий варіабельний домен, C означає константний домен, X1 означає амінокислоту або поліпептид, X2 означає Fc-область, і n дорівнює 0 або 1. У деяких варіантах VD1 і VD2 у зв’язувальному білку являють собою варіабельні домени важкого ланцюга. У деяких варіантах VD1 і VD2 здатні зв'язувати епітоп DLL4 і епітоп VEGF. У деяких варіантах C означає 2 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 константний домен важкого ланцюга, такий як CH1. У деяких варіантах X1 означає лінкер, за умови, що X1 не означає CH1. У різних варіантах зв’язувальний білок, розкритий у даному описі, містить поліпептидний ланцюг, що зв'язує епітоп DLL4 і епітоп VEGF, при цьому поліпептидний ланцюг містить VD1(X1)n-VD2-C-(X2)n, де VD1 містить перший варіабельний домен важкого ланцюга, VD2 містить другий варіабельний домен важкого ланцюга, C містить константний домен важкого ланцюга, X1 містить лінкер, і X2 містить Fc-область. В одному варіанті X1 означає лінкер, за умови, що він не є CH1. В одному варіанті кожний з варіабельних доменів важкого ланцюга VD1 і VD2 містить три CDR, вибрані з CDR у послідовностях SEQ ID NO:39, 41, 43, 45, 47, 49, 51 або 53 (тобто CDR 1-3 з однієї з таких послідовностей), при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить три CDR у послідовності SEQ ID NO:39. В іншому варіанті зв’язувальний білок здатний зв'язувати DLL4 і VEGF. В одному варіанті варіабельні домени важкого ланцюга VD1 і VD2 містять послідовності SEQ ID NO:39, 41, 43, 45, 47, 49, 51 або 53, при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить послідовності SEQ ID NO:39. У різних варіантах зв’язувальний білок, розкритий у даному описі, містить поліпептидний ланцюг, що зв'язує епітоп DLL4 і епітоп VEGF, при цьому поліпептидний ланцюг містить VD1(X1)n-VD2-C-(X2)n, де VD1 містить перший варіабельний домен легкого ланцюга, VD2 містить другий варіабельний домен легкого ланцюга, C містить константний домен легкого ланцюга, X1 містить лінкер, і X2 не містить Fc-область. В одному варіанті X1 означає лінкер, за умови, що він не є CH1 або CL. В одному варіанті кожний з варіабельних доменів легкого ланцюга VD1 і VD2 містить три CDR, вибрані з CDR у послідовностях SEQ ID NO:40, 42, 44, 46, 48, 50, 52 або 54 (тобто CDR 1-3 з однієї з таких послідовностей), при цьому щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить три CDR у послідовності SEQ ID NO:40. В іншому варіанті зв’язувальний білок здатний зв'язувати DLL4 і VEGF. В одному варіанті кожний з варіабельних доменів легкого ланцюга VD1 і VD2 містить послідовності SEQ ID NO:40, 42, 44, 46, 48, 50, 52 або 54, при цьому щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:40. В іншому варіанті розкритий зв’язувальний білок, що зв'язує епітоп DLL4 і епітоп VEGF. У деяких варіантах зв’язувальний білок містить перший і другий поліпептидні ланцюги, при цьому кожний з першого і другого поліпептидних ланцюгів незалежно містить VD1-(X1)n-VD2-C-(X2)n, де VD1 означає перший варіабельний домен, VD2 означає другий варіабельний домен, C означає константний домен, X1 означає лінкер, X2 означає Fc-область, і n дорівнює 0 або 1, при цьому домени VD1 у першому і другому поліпептидних ланцюгах утворюють першу функціональну ділянку, що зв’язує мішень, і домени VD2 у першому і другому поліпептидних ланцюгах утворюють другу функціональну ділянку, що зв’язує мішень. В одному варіанті X2 містить Fc-область, коли n=1, і X2 не містить Fc-області, коли n=0. У деяких варіантах послідовності X1 у першому і другому поліпептидних ланцюгах є однаковими. В інших варіантах послідовності X1 у першому і другому поліпептидних ланцюгах є різними. У деяких варіантах X1 у щонайменше одному з поліпептидних ланцюгів не є доменом CH1 і/або доменом CL. В одному варіанті послідовність X1 є коротким лінкером (наприклад, 6, 5, 4, 3 або 2 амінокислоти). В іншому варіанті послідовність X1 є довгим лінкером (наприклад, 6, 7, 8, 9, 10, 11, 12, 15, 20, 25, 30 або більше амінокислот). В іншому варіанті послідовність X1 в одному із двох поліпептидних ланцюгів являє собою короткий лінкер, а послідовність X1 в іншому поліпептидному ланцюзі являє собою довгий лінкер. В одному варіанті кожний з варіабельних доменів важкого ланцюга VD1 і VD2 містить три CDR з послідовностей SEQ ID NO:39, 41, 43, 45, 47, 49, 51 або 53 (тобто CDR 1-3 з однієї з таких послідовностей), при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить три CDR у послідовності SEQ ID NO:39; і варіабельні домени легкого ланцюга VD1 і VD2 містять три CDR з послідовностей SEQ ID NO:40, 42, 44, 46, 48, 50, 52 або 54 (тобто CDR 1-3 з однієї з таких послідовностей), при цьому щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить три CDR у послідовності SEQ ID NO:40. В іншому варіанті зв’язувальний білок здатний зв'язувати DLL4 і VEGF. В одному варіанті варіабельні домени важкого ланцюга VD1 і VD2 містять послідовності SEQ ID NO:39, 41, 43, 45, 47, 49, 51 або 53, при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:39, і варіабельні домени легкого ланцюга VD1 і VD2 містять послідовності SEQ ID NO:40, 42, 44, 46, 48, 50, 52 або 54, при цьому щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:40. У різних варіантах розкритий зв’язувальний білок, який здатний зв'язувати VEGF і DLL4. У деяких варіантах зв’язувальний білок містить перший і другий поліпептидні ланцюги, при цьому 3 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 кожний з першого і другого поліпептидних ланцюгів незалежно містить VD1-(X1)n-VD2-C-(X2)n, де VD1 означає перший варіабельний домен, VD2 означає другий варіабельний домен, C означає константний домен, X1 означає лінкер, X2 означає Fc-область, і n дорівнює 0 або 1, при цьому домени VD1 у першому і другому поліпептидних ланцюгах утворюють першу функціональну ділянку, що зв’язує мішень, і домени VD2 у першому і другому поліпептидних ланцюгах утворюють другу функціональну ділянку, що зв’язує мішень. В одному варіанті варіабельні домени, які утворюють функціональну ділянку, що зв’язує мішень, для VEGF, містять три CDR з послідовності SEQ ID NO:41 і три CDR з послідовності SEQ ID NO:42 (наприклад, CDR 1-3 з послідовності SEQ ID NO:41 і CDR 1-3 з послідовності SEQ ID NO:42, присутні в окремих ланцюгах, при цьому CDR у кожному ланцюзі розподілені в зазначеному порядку і розділені придатними каркасними послідовностями з утворенням функціональної зв’язувальної ділянки). В одному варіанті варіабельні домени, які утворюють функціональну ділянку, що зв’язує мішень, для DLL4, містять три CDR з послідовності SEQ ID NO:39 і три CDR з послідовності SEQ ID NO:40 (наприклад, CDR 1-3 з послідовності SEQ ID NO:39 і CDR 1-3 з послідовності SEQ ID NO:40, присутні в окремих ланцюгах, при цьому CDR у кожному ланцюзі розподілені в зазначеному порядку і розділені придатними каркасними послідовностями з утворенням функціональної зв’язувальної ділянки). В одному варіанті зв’язувальний білок містить функціональну ділянку, що зв’язує мішень, для VEGF, що містить три CDR з послідовності SEQ ID NO:41 і три CDR з послідовності SEQ ID NO:42 (наприклад, CDR 1-3 з послідовності SEQ ID NO:41 і CDR 1-3 з послідовності SEQ ID NO:42), і функціональну ділянку, що зв’язує мішень, для DLL4, що містить три CDR з послідовності SEQ ID NO:39 і три CDR з послідовності SEQ ID NO:40 (наприклад, CDR 1-3 з послідовності SEQ ID NO:39 і CDR 1-3 з послідовності SEQ ID NO:40). В одному варіанті зв’язувальний білок містить функціональну ділянку, що зв’язує мішень, для VEGF, що містить послідовності SEQ ID NO:41 і SEQ ID NO:42, і функціональну ділянку, що зв’язує мішень, для DLL4, що містить послідовності SEQ ID NO:39 і SEQ ID NO:40. В одному варіанті зв’язувальний білок містить перший поліпептидний ланцюг, що містить послідовність SEQ ID NO:56, і другий поліпептидний ланцюг, що містить послідовність SEQ ID NO:64. В одному варіанті зв’язувальний білок містить перший поліпептидний ланцюг, що містить послідовність SEQ ID NO:73, і другий поліпептидний ланцюг, що містить послідовність SEQ ID NO:74. У деяких варіантах варіабельні домени, що утворюють ділянку зв'язування для DLL4, включають домени, описані в публікації заявки на видачу патенту США № 20110217237, і/або варіабельні домени, що утворюють ділянку зв'язування для VEGF, включають домени, описані в публікації заявки на видачу патенту США № 20100076178, що включені в даний опис у вигляді посилання в повному обсязі. В одному варіанті зв’язувальний білок містить h1A11.1-SLAv. В одному варіанті зв’язувальний білок h1A11.1-SL-Av містить Fc-область з мутанта LALA IgG1 людини. Для розробки й одержання зв’язувального білка, придатного для застосування як терапевтичного засобу для людини, наприклад як протиракового/протипухлинного засобу, може вимагатися більше, ніж просто ідентифікація зв’язувального білка, здатного зв'язуватися з необхідною мішенню або мішенями. Наприклад, кандидат може зв'язувати свою мішень (мішені), але виявляти знижену здатність інгібувати або нейтралізувати необхідну мішень, може створювати труднощі при приготуванні стабільного препарату, може виявляти небажані фармакокінетичні властивості або може бути зв'язаний зі складностями при одержанні в придатній системі експресії (наприклад, експресії в клітині-хазяїні, такій як CHO). Таким чином, фактори, які необхідно враховувати при розробці придатного терапевтичного засобу, включають, але без обмеження, (a) кінетику зв'язування (швидкість утворення комплексу, швидкість розпаду комплексу й афінність) як для внутрішнього, так і для зовнішнього антигензв’язувальних доменів, (b) ефективності в різних біохімічних і клітинних біологічних аналізах, (c) ефективності in vivo у відповідних моделях пухлин, (d) фармакокінетичні і фармакодинамічні властивості, (e) можливість виробництва, включаючи рівень експресії білка в вибраних лініях клітин, масштабованість, посттрансляційну модифікацію, фізико-хімічні властивості, такі як відсотковий вміст мономерів, розчинність і стабільність (власна стабільність, стабільність при заморожуванні/розморожуванні, стабільність при зберіганні і т. д.), (f) властивості, пов'язані з приготуванням препарату, (g) потенційний ризик імуногенності, і (h) токсикологічні властивості молекули. Також можна оцінювати здатність до зв'язування і валентність, оскільки вони можуть впливати на властивості зв'язування й ефективність молекули в клітині. У випадку деяких зв’язувальних білків навіть невеликі зміни в амінокислотних послідовностях варіабельних доменів, константних доменів і/або лінкерів потенційно можуть впливати (позитивно або негативно) на один або декілька таких факторів, і, таким чином, може бути проведена оцінка сполучення факторів, щоб вибрати кращого 4 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 кандидата. Після ідентифікації кращого кандидата проводять додаткову оцінку in vivo терапевтичних властивостей включаючи оцінку безпеки, ефективності й активності у тварин і людини. У зв'язку з цим несподівано було виявлено, що зв’язувальний білок, який містить послідовності SEQ ID NO:56 і SEQ ID NO:64 або містить послідовності SEQ ID NO:73 і SEQ ID NO:74, мав чудове сполучення властивостей, таких як кінетика зв'язування (тобто константа дисоціації), що перевищує терапевтично застосовний поріг, поліпшена здатність до нейтралізації, підвищена ефективність in vivo, чудові властивості, що забезпечують можливість одержання препарату, необхідна картина глікозилування, придатний профіль фармакокінетики й ефективна експресія в клітинах-хазяїнах у порівнянні з іншими оцінюваними зв’язувальними білками, що містять інші варіабельні домени і/або лінкерні послідовності. Зв’язувальні білки для порівняння можуть включати білки, що мають такі ж послідовності варіабельних доменів і орієнтації, але з іншими лінкерами, а також білки, що мають змінені орієнтації зв’язувальних доменів і/або інших послідовностей варіабельних доменів (наприклад, послідовностей з дозрілою афінністю, повністю людських послідовностей і т. д.). У деяких варіантах такі чудові властивості залежать від вибору конкретних послідовностей варіабельних доменів (наприклад, SEQ ID NO:39-42), конкретної орієнтації доменів, що зв'язують VEGF і DLL4, у внутрішніх і зовнішніх положеннях (наприклад, орієнтації, представлені в послідовностях SEQ ID NO:56 і SEQ ID NO:64), конкретних лінкерних послідовностей (наприклад, варіабельні домени важкого ланцюга і коротка лінкерна послідовність, використовувані в послідовності SEQ ID NO:56, і варіабельні домени легкого ланцюга і довга лінкерна послідовність, використовувані в послідовності SEQ ID NO:64) і/або конкретних послідовностей константних доменів (наприклад, послідовності константного домену, використовувані в послідовностях SEQ ID NO:73 і 74). У деяких варіантах тільки зміна лінкерної послідовності може мати значимий вплив на функціональні властивості. Наприклад, вибір лінкерної послідовності, використовуваної в послідовності SEQ ID NO:73 і 74 (поряд з варіабельними і константними доменами, включеними в такі послідовності), може сприяти несподіваному поліпшенню терапевтичних властивостей зв’язувального білка для людини. Наприклад, у таблиці 9 показаний вплив різних лінкерних послідовностей на протипухлинну ефективність in vivo, яку вимірювали в моделях ксенотрансплантатів аденокарциноми прямої й ободової кишки і гліобластоми. Таким чином, наприклад, застосування послідовностей SEQ ID NO:56 і 64 або SEQ ID NO:73 і 74 (включаючи лінкерні послідовності, що входять в них) може забезпечувати несподіване підвищення протипухлинної ефективності in vivo. У різних варіантах зв’язувальний білок, розкритий у даному описі, має необхідну афінність зв'язування, здатність до блокування і/або активність у нейтралізації VEGF і/або DLL4, наприклад, на рівнях, приблизно порівнянних з рівнями, спостережуваними у випадку антитіл проти VEGF (наприклад, AVASTIN®) або DLL4 (наприклад, антитіло h1A11.1). У деяких варіантах зв’язувальний білок має підвищену афінність, здатність до блокування і/або активність у нейтралізації VEGF і/або DLL4 у порівнянні зі зв’язувальними білками DVD-Ig, що містять інші послідовності варіабельних доменів або лінкери. У деяких варіантах зв’язувальний білок містить функціональну ділянку, що зв’язує мішень, для VEGF, що містить три CDR з послідовності SEQ ID NO:41 і три CDR з послідовності SEQ ID NO:42, і функціональну ділянку, що зв’язує мішень, для DLL4, що містить три CDR з послідовності SEQ ID NO:39 і три CDR з послідовності SEQ ID NO:40; або містить функціональну ділянку, що зв’язує мішень, для VEGF, що містить послідовності SEQ ID NO:41 і SEQ ID NO:42, і функціональну ділянку, що зв’язує мішень, для DLL4, що містить послідовності SEQ ID NO:39 і SEQ ID NO:40; або містить послідовності SEQ ID NO:56 і SEQ ID NO:64; або містить послідовності SEQ ID NO:73 і SEQ ID NO:74. Наприклад, зв'язувальний білок (наприклад, зв'язувальний білок, що містить послідовності SEQ ID NO:56 і SEQ ID NO:64 або містить послідовності SEQ ID NO:73 і SEQ ID NO:74) може мати здатність зв'язуватися з VEGF з константою дисоціації (K D) не більше ніж -10 приблизно 7,010 М, яку вимірюють, використовуючи резонанс поверхневого плазмону, і/або блокуючу VEGF активність з IC50 не більше ніж приблизно 3,8 нМ, що вимірюють у конкурентному ELISA VEGFR1; і/або здатний зв'язуватися з DLL4 з константою дисоціації (K D) -8 не більше ніж приблизно 1,010 M, яку вимірюють з використанням резонансу поверхневого плазмону, і/або може мати блокуючу DLL4 активність з IC 50 не більше ніж приблизно 1,09 нМ, що вимірюють у конкурентному ELISA Notch. У деяких варіантах зв’язувальний білок (наприклад, зв'язувальний білок, що містить послідовності SEQ ID NO:56 і SEQ ID NO:64 або містить послідовності SEQ ID NO:73 і SEQ ID NO:74) може мати підвищену активність у нейтралізації DLL4, у тому числі й у випадку присутності VEGF, у порівнянні з сумішшю антитіл до VEGF і DLL4 (наприклад, вихідних антитіл, 5 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуваних для одержання варіабельних доменів для зв’язувального білка). У деяких варіантах зв’язувальний білок може мати підвищення на порядок активності в нейтралізації DLL4, також і у випадку присутності VEGF, у порівнянні з сумішшю антитіл до VEGF і DLL4 (наприклад, вихідних антитіл, використовуваних для одержання варіабельних доменів для зв’язувального білка). Наприклад, у таблиці 24 показано, що зв’язувальний білок, який містить послідовності SEQ ID NO:73 і SEQ ID NO:74, може мати підвищення на порядок активності в нейтралізації DLL4, у тому числі й у присутності щонайменше приблизно 1,2 нМ VEGF (наприклад, щонайменше приблизно 1,2, 1,5, 2, 2,5, 5, 10, 50, 150 або більше), у порівнянні із сумішшю антитіл до VEGF і DLL4 (вихідних антитіл, використовуваних для одержання варіабельних доменів для зв’язувального білка). Така властивість нейтралізувати DLL4 може бути корисною, оскільки в ситуації лікування пухлини in vivo рівні VEGF звичайно більш високі поблизу пухлини, ніж у загальній циркуляції, що забезпечує як поліпшений напрямок до мішені, так і підвищену активність у нейтралізації функціонального DLL4 у місці пухлини. У різних варіантах зв’язувальний білок (наприклад, зв'язувальний білок, що містить послідовності SEQ ID NO:56 і SEQ ID NO:64 або містить послідовності SEQ ID NO:73 і SEQ ID NO:74) виявляє поліпшені властивості, наприклад підвищену безпеку, підвищену стабільність, більш високу активність, знижені запальні й імунні відповіді або інші корисні для терапії людини in vivo властивості, у порівнянні з іншими засобами лікування злоякісних пухлин і/або васкуляризованих пухлин. Засоби лікування, придатні для порівняння, можуть включати введення низькомолекулярного протипухлинного засобу або антитіла проти VEGF (наприклад, авастину®) і/або DLL4 (наприклад, антитіла h1A11.1), або зв’язувального білка DVD-Ig, що містить інші послідовності варіабельного домену і/або лінкери. У деяких варіантах зв’язувальний білок виявляє поліпшені властивості в порівнянні із сучасним стандартом лікування злоякісної пухлини і/або васкуляризованої пухлини. Наприклад, зв'язувальний білок може мати поліпшену кінетику зв'язування, чудову терапевтичну ефективність in vivo, поліпшену здатність піддаватися обробці при приготуванні препарату (включаючи зменшену агрегацію і підвищену стабільність при зберіганні), поліпшену фармакокінетику, знижену запальну або імунну відповідь і/або підвищені рівні експресії в клітині-хазяїні. У деяких варіантах зв’язувальний білок (наприклад, зв'язувальний білок, що містить послідовності SEQ ID NO:56 і SEQ ID NO:64 або містить послідовності SEQ ID NO:73 і SEQ ID NO:74) викликає переважаючі (наприклад, адитивні і/або нададитивні) ефекти в сполученні з одним або декількома протипухлинними засобами, у порівнянні з анти-VEGF-антитілом або анти-DLL4-антитілом у сполученні з одним або декількома протипухлинними засобами або у порівнянні зі зв’язувальним білком DVD-Ig, що містить інші послідовності варіабельних доменів і/або лінкери, у сполученні з одним або декількома протипухлинними засобами. Наприклад, переважаючими зв’язувальними властивостями можуть бути властивості, зазначені в таблицях 27-30 і 34. Наприклад, зв'язувальний білок може викликати щонайменше приблизно 50% або більше (наприклад, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150% або більше) інгібування росту пухлини або затримку росту пухлини після введення окремо або в сполученні з одним або декількома протипухлинними засобами, у порівнянні з необробленою пухлиною. Протипухлинним засобом може бути, наприклад, один або декілька з наступних засобів: іринотекан, FOLFIRI, темозоломід, гемцитабін, паклітаксел, 5-FU і капецитабін або будь-який інший низькомолекулярний або біологічний засіб, застосовуваний при лікуванні конкретної злоякісної пухлини. Зв’язувальний білок окремо або в сполученні з одним або декількома протипухлинними засобами можна застосовувати як лікарський засіб для лікування, наприклад, раку ободової кишки, гліобластоми, раку підшлункової залози або раку молочної залози. В одному варіанті зв’язувальний білок з подвійним варіабельним доменом (DVD-Ig) містить два перших і два других поліпептидних ланцюги, що описані в попередньому абзаці (тобто містить чотири поліпептидних ланцюги), при цьому кожний з поліпептидних ланцюгів незалежно містить VD1-(X1)n-VD2-C-(X2)n, де VD1 означає перший варіабельний домен, VD2 означає другий варіабельний домен, C означає константний домен, X1 означає лінкер, X2 означає Fcобласть, і n дорівнює 0 або 1. У деяких варіантах перший ланцюг являє собою важкий ланцюг і спарений з другим ланцюгом, що являє собою легкий ланцюг. Такий зв’язувальний білок DVD-Ig містить чотири функціональні ділянки, що зв’язують мішень. У деяких варіантах лінкери X1 у першому і другому поліпептидних ланцюгах є однаковими або різними. У деяких варіантах зв’язувальні білки DVD-Ig містять щонайменше дві послідовності варіабельних доменів (наприклад, VD1 і VD2), здатних зв'язувати два або більше епітопів (наприклад, два, три або чотири) одного і того ж або різних білків в будь-якій орієнтації. У деяких варіантах VD1 і VD2 вибирають незалежно. В одному варіанті кожний з варіабельних доменів важкого ланцюга VD1 і 6 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 VD2 містить три CDR з послідовності SEQ ID NO:39, 41, 43, 45, 47, 49, 51 або 53, при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить три CDR у послідовності SEQ ID NO:39, і варіабельні домени легкого ланцюга VD1 і VD2 містять три CDR у послідовності SEQ ID NO:40, 42, 44, 46, 48, 50, 52 або 54, при цьому щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить три CDR у послідовності SEQ ID NO:40. В іншому варіанті зв’язувальний білок здатний зв'язувати DLL4 і VEGF. В одному варіанті кожний з варіабельних доменів важкого ланцюга VD1 і VD2 містить послідовності SEQ ID NO:39, 41, 43, 45, 47, 49, 51 або 53, при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:39, і кожний з варіабельних доменів легкого ланцюга VD1 і VD2 містить послідовності SEQ ID NO:40, 42, 44, 46, 48, 50, 52 або 54, при цьому щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:40. В іншому варіанті зв’язувальний білок з подвійним варіабельним доменом містить послідовність важкого ланцюга і легкого ланцюга, що показана в таблиці 2, при цьому щонайменше один з варіабельних доменів важкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:39 і/або щонайменше один з варіабельних доменів легкого ланцюга VD1 і/або VD2 містить послідовність SEQ ID NO:40. У наступному варіанті будь-який з варіантів з важкого ланцюга, легкого ланцюга, двох ланцюгів або чотирьох ланцюгів містить щонайменше один лінкер X1, що включає лінкери, вибрані з послідовностей SEQ ID NO:1-38. В одному варіанті X2 означає Fc-область. В іншому варіанті X2 означає варіант Fc-області. У ще одному варіанті Fc-область, якщо вона присутня в першому поліпептиді, являє собою Fc-область з нативною послідовністю або Fc-область з варіантом послідовності. У ще одному варіанті Fc-область являє собою Fc-область з IgG1, Fc-область з IgG2, Fc-область з IgG3, Fcобласть з IgG4, Fc-область з IgA, Fc-область з IgM, Fc-область з IgE або Fc-область з IgD. У деяких варіантах Fc-область являє собою Fc-область з мутанта LALA IgG1 людини, що є мутантом антитіла b12, яке забезпечує захист від вірусу ВІЛ. Пропонується спосіб одержання зв’язувального білка, що зв'язує два різних білка-мішені. В одному варіанті спосіб одержання зв’язувального білка включає в себе стадії: a) одержання першого вихідного антитіла або його антигензв’язувальної частини, що зв'язує перший епітоп; b) одержання другого вихідного антитіла або його антигензв’язувальної частини, що зв'язує другий епітоп; c) одержання конструкції(ій), кодуючої будь-який зі зв’язувальних білків, описаних у даній публікації; і d) експресії поліпептидних ланцюгів так, щоб був створений зв’язувальний білок, що зв'язує перший і другий епітопи. У будь-якому з описаних у даній публікації варіантів варіабельний домен важкого ланцюга VD1, якщо він присутній, і варіабельний домен легкого ланцюга, якщо він присутній, можуть бути з першого вихідного антитіла або його антигензв’язувальної частини; варіабельний домен важкого ланцюга VD2, якщо він присутній, і варіабельний домен легкого ланцюга, якщо він присутній, можуть бути з другого вихідного антитіла або його антигензв’язувальної частини. Перше і друге вихідні антитіла можуть бути однаковими або різними. В одному варіанті перше вихідне антитіло або його антигензв’язувальна частина зв'язує перший антиген, і друге вихідне антитіло або його антигензв’язувальна частина зв'язує другий антиген. В одному варіанті перший і другий антигени є різними антигенами. В іншому варіанті перше вихідне антитіло або його антигензв’язувальна частина зв'язує перший антиген з іншою ефективністю, відмінною від ефективності, з якою друге вихідне антитіло або його антигензв’язувальна частина зв'язує другий антиген. У ще одному варіанті перше вихідне антитіло або його антигензв’язувальна частина зв'язує перший антиген з афінністю, відмінною від афінності, з якою друге вихідне антитіло або його антигензв’язувальна частина зв'язує другий антиген. В іншому варіанті перше вихідне антитіло або його антигензв’язувальна частина і друге вихідне антитіло або його антигензв’язувальна частина є антитілами людини, CDRприщепленими антитілами, гуманізованими антитілами і/або антитілами з дозрілою афінністю. В іншому варіанті зв’язувальний білок має щонайменше одну необхідну властивість, яку має перше вихідне антитіло або його антигензв’язувальна частина або друге вихідне антитіло або його антигензв’язувальна частина. Альтернативно перше вихідне антитіло або його антигензв’язувальна частина і друге вихідне антитіло або його антигензв’язувальна частина мають щонайменше одну необхідну властивість, що виявляється зв’язувальним білком. В одному варіанті необхідною властивістю є один або декілька параметрів антитіла. В іншому варіанті параметрами антитіла є специфічність відносно антигену, афінність відносно антигену, активність, біологічна функція, упізнавання епітопа, стабільність, розчинність, ефективність 7 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 продукування, імуногенність, фармакокінетика, біологічна приступність, перехресна реактивність з тканинами або зв'язування ортологічних антигенів. В одному варіанті зв’язувальний білок є полівалентним. В іншому варіанті зв’язувальний білок є поліспецифічним. Полівалентні і/або поліспецифічні зв’язувальні білки, описані в даній публікації, мають необхідні властивості, зокрема з терапевтичної точки зору. Наприклад, полівалентний і/або поліспецифічний зв’язувальний білок може (1) інтерналізуватися (і/або катаболізуватися) швидше, ніж бівалентне антитіло, клітиною, експресуючою антиген, з яким антитіла зв'язуються; (2) бути агоністом зв’язувального білка; і/або (3) індукувати загибель клітин і/або апоптоз клітини, експресуючої антиген, з яким полівалентний зв’язувальний білок здатний зв'язуватися. "Вихідне антитіло", що забезпечує щонайменше одну специфічність зв'язування антигену для полівалентного і/або поліспецифічного зв’язувального білка, може являти собою антитіло, яке інтерналізується (і/або катаболізується) клітиною, експресуючою антиген, з яким антитіло зв'язується; і/або може бути агоністичним, індукуючим клітинну загибель і/або індукуючим апоптоз антитілом, і полівалентний і/або поліспецифічний зв’язувальний білок, що описаний у даній публікації, може мати поліпшення однієї або декількох таких властивостей. Крім того, вихідне антитіло може не мати будь-яку одну або декілька з зазначених властивостей, але може набувати однієї або декілької з них у випадку конструювання у вигляді полівалентного зв’язувального білка, що описаний у даній публікації. В іншому варіанті зв’язувальний білок має константу швидкості утворення комплексу (K on) з 2 -1 -1 однією або декількома мішенями щонайменше приблизно 10 М с ; щонайменше приблизно 3 -1 -1 4 -1 -1 5 -1 -1 10 М с ; щонайменше приблизно 10 М с ; щонайменше приблизно 10 М с або 6 -1 -1 щонайменше приблизно 10 М с , яку вимірювали, використовуючи резонанс поверхневого плазмону. В одному варіанті зв’язувальний білок має константу швидкості утворення комплексу 2 -1 -1 3 -1 -1 (Kon) з однією або декількома мішенями від приблизно 10 М с до приблизно 10 М с ; від 3 -1 -1 4 -1 -1 4 -1 -1 5 -1 -1 приблизно 10 М с до приблизно 10 М с ; від приблизно 10 М с до приблизно 10 М с 5 -1 -1 6 -1 -1 або від приблизно 10 М с до приблизно 10 М с , яку вимірювали, використовуючи резонанс поверхневого плазмону. В іншому варіанті зв’язувальний білок має константу швидкість розпаду комплексу (K off) з -2 -1 -3 однією або декількома мішенями не більше ніж приблизно 10 с ; не більше ніж приблизно 10 -1 -4 -1 -5 -1 с ; не більше ніж приблизно 10 с ; не більше ніж приблизно 10 с або не більше ніж -6 -1 приблизно 10 с , яку вимірювали, використовуючи резонанс поверхневого плазмону. В одному варіанті зв’язувальний білок має константу швидкості розпаду комплексу (K off) з однією або -2 -1 -3 -1 -3 -1 декількома мішенями від приблизно 10 с до приблизно 10 с ; від приблизно 10 с до -4 -1 -4 -1 -5 -1 -5 -1 приблизно 10 с ; від приблизно 10 с до приблизно 10 с або від приблизно 10 с до -6 -1 приблизно 10 с , яку вимірювали, використовуючи резонанс поверхневого плазмону. В іншому варіанті зв’язувальний білок має рівноважну константу дисоціації (K D) відносно -7 -8 однієї декількох мішеней не більше ніж приблизно 10 М; не більше ніж приблизно 10 М; не -9 -10 -11 більше ніж приблизно 10 М; не більше ніж приблизно 10 М; не більше ніж приблизно 10 М -12 або не більше ніж приблизно 10 М. В одному варіанті зв’язувальний білок має рівноважну -7 -8 константу дисоціації (KD) відносно мішеней від приблизно 10 M до приблизно 10 М; від -8 -9 -9 -10 приблизно 10 М до приблизно 10 М; від приблизно 10 М до приблизно 10 М; від приблизно -10 -11 -11 -12 10 М до приблизно 10 М або від приблизно 10 М до приблизно 10 М. У деяких варіантах анти-DLL4/анти-VEGF-зв’язувальний білок виявляє підвищену активність (наприклад, підвищену здатність заважати, інгібувати і/або нейтралізувати активність DLL4 і/або VEGF) у порівнянні з анти-DLL4- або анти-VEGF-антитілом. У деяких варіантах активність зв’язувального білка можна оцінити в будь-якому аналізі, використовуваному для оцінки активності VEGF і/або DLL4, наприклад в аналізі зв'язування VEGF і/або DLL4 у ELISA, аналізі BIACORE™, аналізі DLL4-Notch-репортера, аналізі стимульованої VEGF проліферації/життєздатності ендотеліальних клітин або у будь-якому іншому аналізі, відомому фахівцю в даній галузі. У деяких варіантах зв’язувальний білок виявляє підвищену активність відносно DLL4 у присутності VEGF. В іншому варіанті пропонується кон’югат, що містить будь-який зі зв’язувальних білків, описаних у даній публікації, і додатково містить визначений засіб. В одному варіанті засобом є молекула для імуноадгезії, візуалізуючий засіб, терапевтичний засіб або цитотоксичний засіб. В одному варіанті візуалізуючим засобом є радіоактивна мітка, фермент, флуоресціююча мітка, люмінесцентна мітка, біолюмінесцентна мітка, магнітна мітка або біотин. В іншому варіанті 3 14 35 90 99 111 125 131 177 166 153 радіоактивною міткою є H, C, S, Y, Tc, In, I, I, Lu, Ho або Sm. У ще одному варіанті терапевтичним або цитотоксичним засобом є антиметаболіт, алкілувальний засіб, антибіотик, фактор росту, цитокін, протиангіогенний засіб, антимітотичний засіб, антрациклін, токсин або апоптозний засіб. У деяких варіантах засобом є один або декілька з наступних 8 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 засобів: іринотекан, лейковорин, 5-FU, темозоломід, гемцитабін і паклітаксел. В одному варіанті засобом є іринотекан. В одному варіанті засобом є лейковорин. В одному варіанті засобом є 5FU. В одному варіанті засобом є іринотекан, лейковорин і 5-FU. В одному варіанті засобом є темозоломід. В одному варіанті засобом є гемцитабін. В одному варіанті засобом є паклітаксел. В іншому варіанті кон’югат містить зв’язувальний білок і лікарський засіб. В одному варіанті зв’язувальний білок у кон’югаті містить перший і другий поліпептидні ланцюги, при цьому кожний з першого і другого поліпептидних ланцюгів незалежно містить VD1-(X1)n-VD2-C-(X2)n, де VD1 означає перший варіабельний домен, VD2 означає другий варіабельний домен, C означає константний домен, X1 означає лінкер, і X2 означає Fc-область, при цьому домени VD1 у першому і другому поліпептидних ланцюгах утворюють першу функціональну ділянку, що зв’язує мішень, і домени VD2 у першому і другому поліпептидних ланцюгах утворюють другу функціональну ділянку, що зв’язує мішень, і при цьому зв’язувальний білок здатний зв'язувати VEGF і DLL4. У деяких варіантах домени VD1 і VD2 містять послідовності CDR або варіабельних доменів з будь-якої з послідовностей, описаних у таблиці 2, спарених і розподілених з утворенням функціональних зв’язувальних ділянок для VEGF і DLL4. В одному варіанті лікарський засіб у кон’югаті вибраний з групи, що складається з інгібітору мітозу, протипухлинного антибіотика, імуномодулюючого засобу, вектора для генної терапії, алкілувального засобу, антиангіогенного засобу, антиметаболіту, засобу, що містить бор, хемопротекторного засобу, гормону, протигормонального засобу, кортикостероїду, фотоактивного терапевтичного засобу, олігонуклеотиду, радіонуклідного засобу, інгібітору топоізомерази, інгібітору тирозинкінази і радіосенсибілізатора. В іншому варіанті лікарський засіб вибраний із групи, що складається з іксемпри, доластатину 10, доластатину 15, ауристатину E, ауристатину PE, монометилауристатину D (MMAD або похідного ауристатину D), монометилауристатину E (MMAE або похідного ауристатину E), монометилауристатину F (MMAF або похідного ауристатину F), фенілендіаміну ауристатину F (AFP), ауристатину EB (AEB), ауристатину EFP (AEFP), складного ефіру AE 5-бензоїлвалеріанової кислоти (AEVB), метотрексату, даунорубіцину, вінкристину, мейтанзину, мейтанзинолу, складних C-3-ефірів мейтанзинолу, ансамітоцину P1, ансамітоцину P2, ансамітоцину P3, ансамітоцину P4, доцетакселу, паклітакселу, наночастинок паклітакселу, сульфату віндезину, вінкристину, вінбластину, вінорелбіну, актиноміцинів, актиноміцину D, антраміцину, чикаміцину A, DC-18, мазетраміцину, неотраміцину A, неотраміцину B, протракарцину B, SG2285, сибаноміцину, сибіроміцину, антрациклінів, даунорубіцину, доксорубіцину, епірубіцину, ідарубіцину, каліхеаміцинів, γ1’,α2’,α3’,N-ацетил-γ1’, PSAG, θ’1, дуокарміцинів, адозелезину, бізелезину і карзелезину, блеоміцину, мітоміцину, плікаміцину, бацили Кальмета-Герена (БЦЖ), левамізолу, протипухлинних вакцин, рекомбінантної бівалентної вакцини проти вірусів папіломи людини (HPV) типів 16 і 18, рекомбінантної квадривалентної вакцини проти вірусів папіломи людини (HPV) типів 6, 11, 16 і 18, сипулейцелу-T, цитокінів, паратиреоїдного гормону; тироксину; інсуліну; проінсуліну; релаксину; прорелаксину; глікопротеїдних гормонів, таких як фолікулостимулюючий гормон (FSH), тиреостимулюючого гормону (TSH) і лютеїнізуючого гормону (LH), фактора росту печінки; фактора росту фібробластів, пролактина, плацентарного лактогену, фактора некрозу пухлин, мюллерової інгібуючої субстанції, мишачого асоційованого з гонадотропіном пептиду, інгібіну, активіну, фактора росту ендотелію судин, інтегрину, тромбопоетину (TPO), факторів росту нервів, таких як NGF, фактора росту тромбоцитів, трансформуючих факторів росту (TGF), інсуліноподібного фактора росту-I і -II, еритропоетину (EPO), остеоіндуктивних факторів, інтерферонів, таких як інтерферон-α, -β і -γ, колонієстимулюючих факторів (CSF), CSF гранулоцитів-макрофагів (GM-CSF) і CSF гранулоцитів (G-CSF), інтерлейкінів (IL), таких як IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, фактора некрозу пухлин і інших поліпептидних факторів, включаючи LIF і kitліганд (KL), колонієстимулюючих факторів, еритропоетину (епоетину), філграстиму, сарграмостину, промегапоетину, опрелвекіну, імуномодулюючих генних терапевтичних засобів, нуклеїнової кислоти, кодуючої функціональний, терапевтичний ген, який використовують для заміни мутантного або з іншим чином порушеною функцією (наприклад, укороченого) гена, асоційованого зі злоякісною пухлиною, нуклеїнової кислоти, яка кодує або іншим чином забезпечує продукцію терапевтичного білка для лікування злоякісної пухлини, алкілсульфонатів, бусульфану, азотистих іпритів, хлорамбуцилу, циклофосфаміду, естрамустину, іфосфаміду, мехлоретаміну і мелфалану, нітрозосечовин, кармустину, фотемустину, ломустину, німустину, стрептохоцину, триазинів і гідразинів, дакарбазину, прокарбазину, темозоломіду, етиленімінів, тіотепи, діазиквону, мітоміцину C, похідних метиламіну, епоксидів, алтретаміну, діангідрогалактитолу, дибромдулцитолу, ангіостатину, ABX EFG, C1-1033, PKI-166, вакцини EGF, EKB-569, GW2016, ICR-62, EMD 55900, CP358, PD153035, 9 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 AG1478, IMC-C225, OSI-774, ерлотинібу, ангіостатину, арестину, ендостатину, BAY 12-9566 і 5фторурацилу або доксорубіцину, канстатину, карбоксіамідотриозолу і з паклітакселом, EMD121974, S-24, вітаксину, диметилксантеноноцтової кислоти, IM862, інтерлейкіну-12, інтерлейкіну-2, NM-3, HuMV833, PTK787, RhuMab, ангіозиму, IMC-1C11, неовастату, маримастату, приномастату, BMS-275291, COL-3, MM1270, SU101, SU6668, SU11248, SU5416, з паклітакселом, з гемцитабіном і цисплатином і з іринотеканом і цисплатином і з випромінюванням, текогалану, темозоломіду і ПЕГ-інтерферону-a2b, тетратіомолібдату, TNP470, талідоміду, CC-5013 і з таксотером, тумстатину, 2-метоксіестрадіолу, пастки VEGF, інгібіторів mTOR (дефоролімусу, еверолімусу і темсиролімусу), інгібіторів тирозинкінази (наприклад, іматинібу, гефітинібу, дасатинібу, сунітинібу, нілотинібу, лапатинібу, сорафенібу, фосфоінозитид-3-кіназ (PI3K), антагоністів фолієвої кислоти, метотрексату, 4-амінофолієвої кислоти, лометрексолу, пеметрекседу, триметрексату, антагоністів піримідину, азацитидину, капецитабіну, цитарабіну, децитабіну, 5-фторурацилу, 5-втор-2’-дезоксіуридин-5’-фосфату, 5фторуридинтрифосфату, гемцитабіну, фоксуридину, антагоніста пурину азатіоприну, кладрибіну, меркаптопурину, флударабіну, пентостатину, 6-тіогуаніну, інгібіторів аденозиндезамінази, кладрибіну, флударабіну, неларбіну, пентостатину, борофіцину, бортезомібу, цитопротекторних засобів, аміфостину, дексразоксану, месни, андрогенів, естрогенів, ацетату медроксипрогестерону, прогестинів, аміноглутетиміду, анастрозолу, бікалутаміду, хлортрианізенів, ацетату ципротерону, дегареліксу, ексеместану, флутаміду, фулвестранту, госереліну, летрозолу, лейпроліду, лупрону, ацетату медроксипрогестерону, ацетату мегестролу, тамоксифену, триптореліну, аспарагінази, дакарбазину, оксисечовини, левамізолу, мітотану, прокарбазану, третиноїну, глюкокортикоїдів, преднізону, хромагенів, барвників, антисмислових олігонуклетидів, які або зустрічаються в природі, або синтезовані з використанням стандартних і/або нестандартних нуклеотидів (включаючи інтерференцію РНК (РНК-і)), двониткової РНК (днРНК), малої інтерферуючої РНК (міРНК), мікроРНК (мікроРНК), 111 177 212 213 211 62 64 аптамерів, CpG-олігонуклеотидів, рибозимів, ангіозиму, In, Lu, Bi, Bi, At, Cu, Cu, 67 90 125 131 32 33 47 111 67 142 153 16 166 166 186 188 189 12 Cu, Y, I, I, P, P, Sc, Ag, Ga, Pr, Sm, Tb, Dy, Ho, Re, Re, Re, Pb, 223 225 59 75 77 89 99 105 109 143 149 169 194 198 199 211 Ra, Ac, Fe, Se, As, Sr, Mo, Rh, Pd, Pr, Pm, Er, Ir, Au, Au, Pb, Co58, Ga-67, Br-80m, Tc-99m, Rh-103m, Pt-109, In-111, Sb-119, I-125, Ho-161, Os-189m, Ir-192, Dy11 152, At-211, Bi-212, Ra-223, Rn-219, Po-215, Bi-211, Ac-225, Fr-221, At-217, Bi-213, Fm-255, C, 13 15 75 198 224 126 133 77 113m 95 97 103 105 107 203 121m 122m N, O, Br, Au, Ac, I, I, Br, In, Ru, Ru, Ru, Ru, Hg, Hg, Te, Te, 125m 165 167 168 197 109 105 142 143 161 166 199 57 58 51 59 Te, Tm, Tm, Tm, Pt, Pd, Rh, Pr, Pr, Tb, Ho, Au, Co, Co, Cr, Fe, 75 201 225 76 169 Se, TI, Ac, Br, Yb, таксану, цисплатину, метронідазолу, місонідазолу, десметилмісонідазолу, пімонідазолу, етанідазолу, німоразолу, мітоміцину C, RSU 1069, SR 4233, E09, RB 6145, нікотинаміду, 5-бромдезоксіуридину (BUdR), 5-йоддезоксіуридину (IUdR), бромдезоксицитидину, фтордезоксіуридину (FUdR), оксисечовини, похідних гематопорфірину, фотофрину(r), похідних бензопорфірину, NPe6, етіопорфірину олова (SnET2), феоборбіду a, бактеріохлорофілу a, нафталоціанінів, фталоціанінів, фталоціаніну цинку, камптотецинів, іринотекану, топотекану, амсакрину, даунорубіцину, доксорубіцину, епіподофілотоксинів, еліптицинів, епірубіцину, етопозиду, разоксану, теніпозиду, акситинібу, босутринібу, цедиранібу, дасатинібу, ерлотинібу, гефітинібу, іматинібу, лапатинібу, лестауротинібу, нілотинібу, семаксанібу, сунітинібу, вандетанібу, абрину, ланцюга A абрину, альфа-токсину, білків Aleurites fordii, аматоксину, кротину, курцину, білків діантину, дифтерійного токсину, ланцюга A дифтерійного токсину, активних фрагментів дифтерійного токсину, що не зв'язуються, дезоксирибонуклеази (ДНКази), гелоніну, мітогеліну, ланцюга A модецину, інгібітору Memordica charantia, неоміцину, онконази, феноміцину, білків Phytolaca americana (PAPI, PAPII і PAP-S), противірусного білка лаконосу, ендотоксину Pseudomonas, екзотоксину Pseudomonas, ланцюга A екзотоксину Pseudomonas aeruginosa, рестриктоцину, рицину, ланцюга A рицину, рибонуклеази (РНКази), інгібітору Saponaria officinalis, сапорину, альфа-сарцину, стафілококового ентеротоксину-A, правцевого токсину, цисплатину, карбоплатину й оксаліплатину (елоксатину, Sanofi Aventis), інгібіторів протеосом, PS-341, інгібіторів HDAC, вориностату, беліностату, ентиностату, моцетиностату, панобіностату, інгібіторів ЦОГ-2, заміщених сечовин, інгібіторів білків теплового шоку, гелданаміцину, адренокортикальних супресорів, трикотеценів, A12, 19D12, Cp751-871, H7C10, альфа-IR3, ScFV/FC, EM/164, матузумабу, ербітуксу, вектибіксу, мАт 806, німотуксимабу, AVEO, AMG102, 5D5 (OA-5d5), H244G11, Ат №14 (MM 121-14), герцептину, 1B4C3; 2D1D12, NVP-AEW541-A, BMS-536924 (1Hбензоімідазол-2-іл)-1H-піридин-2-ону), BMS-554417, циклолігану, TAE226, PQ401, іреси, CI-1033 (PD 183805), лапатинібу (GW-57206), тикербу, тарцеви, PKI-166, PD-158780, EKB-569, тирфостину AG 1478 (4-(3-хлораніліно)-6,7-диметоксихіназоліну), PHA665752, ARQ 197, капецитабіну, 5-трифторметил-2'-дезоксіуридину, метотрексату натрію, ралтитрекседу, 10 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 пеметрекседу, тегафуру, цитозинарабінозиду (цитарабіну), 5-азацитидину, 6-меркаптопурину (меркаптопурину, 6-MP), азатіоприну, 6-тіогуаніну, пентостатину, фосфату флударабіну, кладрибіну (2-CdA, 2-хлордезоксіаденозину), інгібітору рибонуклеотидредуктази, циклофосфаміду, неосару, іфосфаміду, тіотепи, BCNU 1,3-бі(2-хлоретил)-1-нітрозосечовини, CCNU 1-(2-хлоретил)-3-циклогексил-1-нітрозосечовини (метил-CCNU), гексаметилмеламіну, бусульфану, прокарбазину-HCl, дакарбазину (DTIC), хлорамбуцилу, мелфалану, карбоплатину, оксаліплатину, доксорубіцину-HCl, цитрату даунорубіцину, мітоксантрону-HCl, актиноміцину D, етопозиду, топотекану-HCl, теніпозиду, іринотекану-HCl (CPT-II), вінкристину, сульфату вінбластину, тартрату вінорелбіну, сульфату віндезину, паклітакселу, доцетакселу, абраксану, іксабепілону, мезилату іматинібу, малату сунітинібу, тозилату сорафенібу, моногідрату гідрохлориду нілотинібу, L-аспарагінази, альфа-інтерферону, авастину, IL-2, алдеслейкіну, пролейкіну, IL-12, цитрату тореміфену, фулвестранту, ралоксифену-HCl, анастразолу, летрозолу, фадрозолу (CGS 16949A), ексеместану, ацетату лейпроліду, лупрону, ацетату госереліну, памоату триптореліну, бусереліну, нафареліну, сетрореліксу, бікалутаміду, нілутаміду, ацетату мегестролу, аналогів соматостатину, пренднізолону, дексаметазону, кетоконазолу, сиролімусу, темсиролімусу (CCI-779), дефоролімусу (AP23573), іринотекану; лейковорину; FOLFIRI; 5-FU; еналаприлу; ніфедипіну; клонідину; темозоломіду; гемцитабіну; капецитабіну; падитакселу; регорафенібу; пертузумабу і еверолімусу (RAD00I). У деяких варіантах розкрита композиція, яка містить один або декілька зв’язувальних білків, що описані в даній публікації, і один або декілька додаткових засобів, наприклад хіміотерапевтичний засіб. Наприклад, композиція може містити один або декілька зв’язувальних білків у розчині з одним або декількома додатковими засобами. У деяких варіантах засіб являє собою один або декілька з наступних засобів: іринотекан, лейковорин, 5-FU, темозоломід, гемцитабін і паклітаксел. В одному варіанті засобом є іринотекан. В одному варіанті засобом є лейковорин. В одному варіанті засобом є 5-FU. В одному варіанті засобом є іринотекан, лейковорин і 5-FU. В одному варіанті засобом є темозоломід. В одному варіанті засобом є гемцитабін. В одному варіанті засобом є паклітаксел. В іншому варіанті зв’язувальний білок є кристалізованим зв’язувальним білком і існує у вигляді кристала. В одному варіанті кристал являє собою кристал, що не містить носія, з фармацевтично контрольованим вивільненням. В іншому варіанті кристалізований зв’язувальний білок має більш тривалий час напівжиття in vivo, ніж розчинний аналог зв’язувального білка. У ще одному варіанті кристалізований зв’язувальний білок зберігає біологічну активність. В іншому варіанті зв’язувальний білок, описаний у даній публікації, глікозилований. Наприклад, картина глікозилування являє собою картину глікозилування у людини. Також пропонується ізольована нуклеїнова кислота, кодуюча будь-який зі зв’язувальних білків, розкритих у даному описі. У наступному варіанті пропонується вектор, який містить ізольовану нуклеїнову кислоту, розкриту в даному описі, при цьому вектором є pcDNA; pTT (Durocher et al. (2002), Nucleic Acids Res. 30(2); pTT3 (pTT з додатковим сайтом множинного клонування); pEFBOS (Mizushima and Nagata (1990), Nucleic Acids Res. 18(17)); pBV; pJV; pcDNA3.1 TOPO; pEF6 TOPO; pBOS; pHybE або pBJ. В одному варіанті вектором є вектор, розкритий у публікації патенту США № 20090239259. В іншому аспекті клітина-хазяїн трансформована вектором, розкритим у даному описі. В одному варіанті клітиною-хазяїном є прокаріотична клітина, наприклад E. coli. В іншому варіанті клітиною-хазяїном є еукаріотична клітина, наприклад клітина найпростішого, клітина тварини, клітина рослини або клітина гриба. В одному варіанті клітиною-хазяїном є клітина ссавця, включаючи, без обмеження, CHO, COS, NS0, SP2, PER.C6, або клітина гриба, така як Saccharomyces cerevisiae, або клітина комахи, така як Sf9. В одному варіанті два або більше зв’язувальних білків, наприклад з різними специфічностями, одержують в одній рекомбінантній клітині-хазяїні. Наприклад, експресія суміші антитіл була названа Oligoclonics™ (Merus B.V., The Netherlands) і описана в патентах США №№ 7262028 і 7429486. Пропонується спосіб одержання зв’язувального білка, розкритого в даному описі, який включає в себе культивування кожної з клітин-хазяїнів, розкритих у даному описі, у культуральному середовищі в умовах, достатніх для продукування зв’язувального білка. В одному варіанті 50-75% зв’язувального білка, одержаного таким способом, представлено тетравалентним зв’язувальним білком з подвійною специфічністю. В іншому варіанті 75-90% зв’язувального білка, одержаного таким способом, представлено тетравалентним зв’язувальним білком з подвійною специфічністю. В іншому варіанті, 90-95% одержаного зв’язувального білка представлено тетравалентним зв’язувальним білком з подвійною специфічністю. 11 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті пропонується композиція для вивільнення зв’язувального білка, при цьому композиція містить кристалізований зв’язувальний білок, інгредієнт і щонайменше один полімерний носій. В одному варіанті полімерним носієм є полі(акрилова кислота), полі(ціаноакрилат), полі(амінокислота), полі(ангідрид), полі(депсипептид), складний полі(ефір), полі(молочна кислота), співполімер (молочної-гліколевої кислоти) або PLGA, полі(bгідроксибутират), полі(капролактон), полі(діоксанон); полі(етиленгліколь), полі((гідроксипропіл)метакриламід), полі[(органо)фосфазен], складний полі(ортоефір), полі(вініловий спирт), полі(вінілпіролідон), співполімер малеїновий ангідрид-алкілвініловий ефір, поліол плюронік, альбумін, альгінат, целюлоза, похідне целюлози, колаген, фібрин, желатин, гіалуронова кислота, олігосахарид, глікаміноглікан, сульфатований полісахарид, їх суміші і співполімери. В одному варіанті інгредієнтом є альбумін, сахароза, трегалоза, лактит, желатин, гідроксипропіл-β-циклодекстрин, метоксиполіетиленгліколь або поліетиленгліколь. Інший варіант стосується способу лікування ссавця, який включає в себе стадію введення ссавцю ефективної кількості композиції, розкритої в даному описі. Пропонується фармацевтична композиція, яка містить зв’язувальний білок, розкритий у даному описі, і фармацевтично прийнятний носій. У деяких варіантах фармацевтична композиція містить щонайменше один додатковий терапевтичний засіб для лікування розладу. Наприклад, додатковий засіб може являти собою терапевтичний засіб, хіміотерапевтичний засіб; засіб для візуалізації, цитотоксичний засіб, інгібітор ангіогенезу, інгібітор кінази (включаючи, але без обмеження, інгібітор KDR і TIE-2), модулятор молекули костимуляції (включаючи, але без обмеження, анти-B7.1, анти-B7.2, CTLA4-Ig, анти-CD20), блокатор молекули адгезії (включаючи, але без обмеження, анти-LFA-1-антитіло, антитіло проти E/Lселектину, низькомолекулярний інгібітор), антитіло проти цитокіну або його функціональний фрагмент (включаючи, але без обмеження, анти-IL-18, анти-TNF або антитіло проти IL6/рецептора цитокіну), анти-VEGF-мАт; анти-DLL4-мАт; метотрексат, циклоспорин, рапаміцин, FK506, реєстровану мітку або репортер, антагоніст TNF, протиревматичний засіб, міорелаксант, наркотик, нестероїдний протизапальний лікарський засіб (НПЗЗ), анальгетик, анестетик, седативний засіб, локальний анестетик, блокатор нервово-м'язового проведення, протимікробний засіб, протипсоріатичний засіб, кортикостероїд, анаболічний стероїд, еритропоетин, імунізацію, імуноглобулін, імуносупресор, гормон росту, гормонозамісний лікарський засіб, радіофармацевтичний засіб, антидепресант, антипсихотичний засіб, стимулятор, лікарський засіб проти астми, бета-агоніст, інгаляційний стероїд, епінефрин або аналог, цитокін або антагоніст цитокіну. У деяких варіантах додатковим терапевтичним засобом є хіміотерапевтичний засіб. У деяких варіантах додатковим засобом є один або декілька з наступних засобів: іринотекан, лейковорин, 5-FU, темозоломід, гемцитабін і паклітаксел. В одному варіанті засобом є іринотекан. В одному варіанті засобом є лейковорин. В одному варіанті засобом є 5-FU. В одному варіанті засобом є іринотекан, лейковорин і 5-FU. В одному варіанті засобом є темозоломід. В одному варіанті засобом є гемцитабін. В одному варіанті засобом є паклітаксел. У різних варіантах пропонується спосіб діагностики і/або лікування людини, що страждає від розладу, який може бути діагностований і/або який можна лікувати за допомогою цілеспрямованого впливу на мішені VEGF і/або DLL4 (наприклад, будь-якого розладу ангіогенезу або будь-якого іншого розладу, асоційованого з аномальною експресією VEGF і/або DLL4), який включає в себе введення людині зв’язувального білка, розкритого в даному описі, так, щоб активність мішені або мішеней у людини була інгібована і один або декілька симптомів були ослаблені або було здійснене лікування. Зв’язувальні білки, пропоновані в даному описі, можна застосовувати для діагностики і/або лікування людей, що страждають від первинних і метастатичних злоякісних пухлин, включаючи карциноми молочної залози, ободової кишки, прямої кишки, легені, ротової частини глотки, гортанної частини глотки, стравоходу, шлунка, підшлункової залози, печінки, жовчного міхура і жовчних проток, тонкого кишечнику, сечовивідних шляхів (включаючи нирки, сечовий міхур і уротелій), жіночих статевих шляхів (включаючи шийку матки, матку і яєчники, а також хоріокарциному і гестаційну трофобластичну хворобу), чоловічих статевих шляхів (включаючи пухлини простати, сім’яних пухирців, сім’яників і зародкових клітин), ендокринних залоз (включаючи щитовидну залозу, надниркові залози і гіпофіз) і шкіри, а також гемангіоми, меланоми, саркоми (включаючи саркоми кісток і м'яких тканин, а також саркому Капоші), пухлини головного мозку, нервів, очей й оболонки головного мозку (включаючи астроцитоми, гліоми, гліобластоми, ретинобластоми, нейроми, нейробластоми, шваноми і менінгіоми), пухлини, що виникають у результаті гематопоетичних злоякісних новоутворень, гострий лейкоз, гострий лімфобластний лейкоз (ALL), гострий мієлоїдний лейкоз (AML), B-клітинну лімфому, лімфому Беркітта, хронічний мієлоцитарний 12 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 лейкоз (CML), хронічний лімфоцитарний лейкоз (CLL), волосатоклітинний лейкоз, ходжкінські і неходжкінські лімфоми, гематопоетичні злоякісні новоутворення, саркому Капоші, злоякісну лімфому, злоякісний гістіоцитоз, злоякісну меланому, множинну меланому, паранеопластичний синдром/гіперкальцемію при злоякісних новоутвореннях або солідні пухлини. У деяких варіантах спосіб лікування злоякісної пухлини у пацієнта включає в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції. В одному варіанті злоякісна пухлина являє собою рак ободової кишки. В одному варіанті злоякісна пухлина являє собою гліобластому. В одному варіанті злоякісна пухлина являє собою рак підшлункової залози. В одному варіанті злоякісна пухлина являє собою рак молочної залози. У деяких варіантах способи лікування злоякісної пухлини, які включають у себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції, приводять до зменшення росту пухлини або уповільнення росту пухлини, що щонайменше приблизно еквівалентні очікуваним адитивним ефектам сполучення анти-VEGF антитіла й анти-DLL4-антитіла. У деяких варіантах способи приводять до зменшення росту пухлини або уповільнення росту пухлини, що є більше ніж адитивними (наприклад, зменшення більше, ніж зменшення, очікуване у випадку адитивності передбачуваних ефектів анти-VEGF-антитіла й анти-DLL4-антитіла). У деяких варіантах спосіб лікування злоякісної пухлини включає в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції в сполученні з одним або декількома додатковими засобами, наприклад хіміотерапевтичним або біологічним засобом. У деяких варіантах засіб являє собою один або декілька з наступних засобів: регорафеніб (STIVAGRA™), пертузумаб (PERJECTA™), іринотекан, лейковорин, 5-FU, темозоломід, гемцитабін і паклітаксел. В одному варіанті засобом є іринотекан. В одному варіанті засобом є лейковорин. В одному варіанті засобом є 5-FU. В одному варіанті засобом є іринотекан, лейковорин і 5-FU. В одному варіанті засобом є темозоломід. В одному варіанті засобом є гемцитабін. В одному варіанті засобом є паклітаксел. У деяких варіантах способи лікування злоякісної пухлини, які включають в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції в сполученні з одним або декількома додатковими засобами, приводять до зменшення росту пухлини або уповільнення росту пухлини, що щонайменше еквівалентні очікуваним адитивним ефектам сполучення зв’язувального білка і додаткового засобу. У деяких варіантах способи приводять до зменшення росту пухлини або уповільнення росту пухлини, що можуть бути більше, ніж адитивні (наприклад, зменшення більше, ніж зменшення, очікуване у випадку адитивності передбачуваних ефектів зв’язувального білка і додаткового засобу). У деяких варіантах спосіб лікування раку ободової кишки включає в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції, необов'язково в сполученні з одним або декількома засобами: іринотеканом, лейковорином і 5FU. У деяких варіантах спосіб лікування гліобластоми включає в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції, необов'язково в сполученні з темозоломідом. У деяких варіантах спосіб лікування раку підшлункової залози включає в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції, необов'язково в сполученні з гемцитабіном. У деяких варіантах спосіб лікування раку молочної залози включає в себе введення одного або декількох зв’язувальних білків, розкритих у даному описі, або їх фармацевтичної композиції, необов'язково в сполученні з паклітакселом. У різних варіантах зв’язувальні білки, пропоновані в даному винаході, можуть бути введені в сполученні з одним або декількома протигіпертонічними засобами. Один або декілька протигіпертонічних засобів можуть бути вибрані з групи, що складається з діуретика, антагоніста адренергічного рецептора, блокатора кальцієвих каналів, інгібіторів реніну, інгібіторів ACE, антагоністів рецептора ангіотензину II, судинорозширювальних засобів, агоністів альфа-2. Наприклад, засіб може являти собою один або декілька з наступних засобів: клонідин, еналаприл; ніфедипін; метилдопа, гідралазин, празозин, резерпін, моксонідин, кванфацин, периндоприл/індапамід, лофексидин і метирозин. У деяких варіантах зв’язувальні білки, пропоновані в даному винаході, можуть бути введені в сполученні з одним або декількома антикоагулянтами. Наприклад, антикоагулянтом може бути один або декілька з наступних засобів: варфарин, гепарин, низькомолекулярний гепарин, дальтепарин-натрій, аргатробан, бівалірудин, лепірудин і декстроза. У деяких варіантах зв’язувальні білки, пропоновані в даному винаході, можуть бути введені в сполученні з одним або декількома протигіпертонічними засобами й одним або декількома антикоагулянтами. 13 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 У різних варіантах зв’язувальні білки, пропоновані в даному винаході, можна застосовувати для діагностики і/або лікування людей, що страждають від макулярної дегенерації (включаючи вологу форму), діабетичної ретинопатії і/або будь-якого іншого захворювання або розладу, характеризованого надмірним ростом судин або набряком. В одному варіанті зв’язувальні білки або їх антигензв’язувальні частини застосовують для лікування злоякісної пухлини або запобігання або інгібування метастазів пухлин, описаних у даній публікації, використовуючи їх або окремо, або в сполученні з променевою терапією і/або хіміотерапевтичними засобами. В одному варіанті хіміотерапевтичні або біологічні засоби, з якими можна сполучати зв’язувальні білки, пропоновані в даному винаході, включають наступні засоби: 13-цисретиноєву кислоту; 2-CdA; 2-хлордезоксіаденозин; 5-азацитидин; 5-фторурацил; 5-FU; 6меркаптопурин; 6-MP; 6-TG; 6-тіогуанін; абраксан; акутан®; актиноміцин-D; адріаміцин®; адруцил®; афінітор®; агрилін®; ала-корт®; алдеслейкін; алемтузумаб; ALIMTA; алітретиноїн; алкабан-AQ®; алкеран®; повністю трансретиноєву кислоту; альфа-інтерферон; алтретамін; аметоптерин; аміфостин; аміноглутетимід; анагрелід; анандрон®; анастрозол; арабінозилцитозин; Ara-C аранесп®; аредію®; аримідекс®; аромазин®; аранон®; триоксид миш'яку; арзеру®; аспарагіназу; ATRA; авастин®; азацитидин; BCG; BCNU; бендамустин; бевацизумаб; бексаротен; BEXXAR®; бікалутамід; BiCNU; бленоксан®; блеоміцин; бортезоміб; бусульфан; бусульфекс®; C225; кальцій-лейковорин; кампат®; камптосар®; камптотецин-11; капецитабін; карак™; карбоплатин; кармустин; кармустин в облатках; казодекс®; CC-5013; CCI779; CCNU; CDDP; CeeNU; церубідин®; цетуксимаб; хлорамбуцил; цисплатин; цитроворумфактор; кладрибін; кортизон; космеген®; CPT-11; циклофосфамід; цитадрен®; цитарабін; ліпосомний цитарабін; цитозар-U®; цитоксан®; дакарбазин; дакоген; дактиноміцин; дарбепоетин альфа; дасатиніб; дауноміцин; даунорубіцин; гідрохлорид даунорубіцину; ліпосомний даунорубіцин; дауноксом®; декадрон; децитабін; дельта-кортеф®; дельтазон®; денілейкін; дифтитокс; депоцит™; дексаметазон; ацетат дексаметазону; фосфат натріюдексаметазону; дексазон; декстразоксан; DHAD; DIC; діодекс; доцетаксел; доксил®; доксорубіцин; ліпосомний доксорубіцин; дроксію™; DTIC; DTIC-Dome®; дуралон®; ефудекс®; елігард™; еленц™; елоксатин™; елспар®; емцит®; епірубіцин; епоетин альфа; ербітукс; ерлотиніб; L-аспарагіназу Erwinia; естрамустин; етіол; етопофос®; етопозид; фосфат етопозиду; еулексин®; еверолімус; евісту®; ексеместан; фарестон®; фаслодекс®; фемару®; філграстим; флуоксуридин; флудару®; флударабін; флуороплекс®; фторурацил; фторурацил (крем); флуоксиместерон; флутамід; фолінову кислоту; FUDR®; фулвестрант; гефітиніб; гемцитабін; гемтузумабу озогаміцин; гемзар; глівек™; гліадел® в облатці; GM-CSF; госерелін; колонієстимулюючий фактор гранулоцитів (G-CSF); колонієстимулюючий фактор гранулоцитівмакрофагів (G-MCSF); галотестин®; герцептин®; гексадрол; гексален®; гексаметилмеламін; HMM; гікамтин®; гідрею®; ацетат гідрокорту®; гідрокортизон; фосфат натрію гідрокортизону; сукцинат натрію гідрокортизону; фосфат гідрокортону; гідроксисечовину; ібритумомаб; ібритумомабу тіуксетан; ідаміцин®; ідарубіцин іфекс®; інтерферон-альфа; інтерферон-альфа2b (ПЕГ-кон’югат); іфосфамід; інтерлейкін-11 (IL-11); інтерлейкін-2 (IL-2); мезилат іматинібу; карбоксамід імідазолу; інтрон A®; іресу®; іринотекан; ізотретиноїн; іксабепілон; іксемпру™; KADCYCLA®; кідролазу (t); ланакорт®; лапатиніб; L-аспарагіназу; LCR; леналідомід; летрозол; лейковорин; лейкеран; лейкін™; лейпролід; лейрокристин; лейстатин™; ліпосомний Ara-C; рідкий Pred®; ломустин; L-PAM; L-сарколізин; лупрон®; лупрон депо®; матулан®; максидекс; мехлоретамін; гідрохлорид мехлоретаміну; медралон®; медрол®; мегейс®; мегестрол; ацетат мегестролу; мелфалан; меркаптопурин; месну; меснекс™; метотрексат; метотрексат-натрій; метилпреднізолон; метикортен®; мітоміцин; мітоміцин-C; мітоксантрон; M-преднізол®; MTC; MTX; мустарген®; мустин; мутаміцин®; мілеран®; мілоцел™; мілотарг®; навелбін®; неларабін; неосар®; нейласту™; неймегу®; нейпоген®; нексавар®; ніландрон®; нілотиніб; нілутамід; ніпент®; азотистий іприт; новалдекс®; новантрон®; енплейт; октреотид; ацетат октреотиду; офатумумаб; онкоспар®; онковін®; онтак®; онксал™; опрелвекін; орапред®; оразон®; оксаліплатин; паклітаксел; паклітаксел, зв'язаний з білком; памідронат; панітумумаб; панретин®, параплатин®; пазопаніб; педіапред®; ПЕГ-інтерферон; пегаспаргазу; пегфілграстим; ПЕГ-інтрон™; ПЕГ-L-аспарагіназу; пеметрексед; пентостатин; фенілаланініприт; платинол®; платинол-AQ®; преднізолон; преднізон; прелон®; прокарбазин; прокрит®; пролейкін®; проліфероспан 20 з імплантатом кармустину; пуринетол®; ралоксифен; ревіімід®; ревматрекс®; ритуксан®; ритуксимаб; роферон-A®; роміплостим; рубекс®; гідрохлорид рубідоміцину; сандостатин®; сандостатин LAR®; сарграмостин; солу-кортеф®; солу-медрол®; сорафеніб; сприцел™; STI-571; стрептозоцин; SU11248; сунітиніб; сутент®; тамоксифен; тарцеву®; таргретин®; тасигну®; таксол®; таксотере®; темодар®; темозоломід; темсиролімус; 14 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 теніпозид; TESPA; талідомід; таломід®; тера-цис®; тіогуанін; тіогуанін таблоїд®; тіофосфоамід; тіоплекс®; тіотепу; TICE®; топосар®; топотекан; тореміфен; торисел®; тозитумомаб; трастузумаб; треанду®; третиноїн; трексал™; трисенокс®; TSPA; TYKERB®; VCR; вектибікс™; велбан®; велкад®; вепезид®; весаноїд®; віадур®; відазу®; вінбластін; сульфат вінбластину; вінкасар Pfs®; вінкристин; вінорелбін; тартрат вінорелбіну; VLB; VM-26; вориностат; вотрієнт; VP-16; вумон®; кселоду®; заносар®; зевалін™; зинекард®; золадекс®; золедронову кислоту; золінзу або зомету® і/або будь-який інший засіб, спеціально не зазначений в даному описі, мішенню яких є подібні шляхи. В іншому варіанті способи лікування пацієнта, що страждає від розладу, включають в себе стадію введення одного або декількох зв’язувальних білків, розкритих у даному описі, або окремо або введення зв’язувального білка(ів) до, одночасно або після введення другого засобу. У конкретному варіанті фармацевтичні композиції, розкриті в даному описі, вводять пацієнту за допомогою перорального, парентерального, підшкірного, внутрішньом’язового, внутрішньовенного, внутрішньосуглобового, внутрішньобронхіального, внутрішньочеревного, внутрішньокапсулярного, внутрішньохрящового, внутрішньопорожнинного, внутрішньомозочкового, інтрацеребровентрикулярного введення, введення усередину ободової кишки, інтрацервікального, внутрішньошлункового, внутрішньопечінкового, внутрішньоміокрадіального, внутрішньокісткового, внутрішньотазового, внутрішньоперикардіального, внутрішньоочеревинного, внутрішньоплеврального введення, введення усередину простати, внутрішньолегеневого, внутрішньоректального, внутрішньониркового, внутрішньоретинального, інтраспінального, інтрасиновіального, інтраторакального, внутрішньоматкового, внутрішньоміхурового, болюсного, вагінального, ректального, букального, під'язикового, інтраназального або трансдермального введення. У різних варіантах пропонуються способи визначення присутності, кількості або концентрації одного або декількох антигенів або їх фрагментів у тестованому зразку, при цьому один або декілька антигенів або їх фрагментів являють собою DLL4 і/або VEGF. Спосіб включає в себе аналіз тестованого зразка відносно антигену або його фрагмента з використанням імуноаналізу. У імуноаналізі (і) використовують щонайменше один зв’язувальний білок і щонайменше одну реєстровану мітку, і імуноаналіз (ii) включає в себе порівняння сигналу, генерованого реєстрованою міткою, як прямого або опосередкованого указання на присутність, кількість або концентрацію антигену або його фрагмента в тестованому зразку, із сигналом, генерованим як пряме або опосередковане указання на присутність, кількість або концентрацію антигену або його фрагмента в контролі або калібрувальному еталоні. Калібрувальний еталон необов'язково є частиною калібрувальних еталонів, де кожний з калібрувальних еталонів відрізняється від інших калібрувальних еталонів у серії по концентрації антигену або його фрагмента. Спосіб може включати в себе (і) здійснення контакту тестованого зразка з щонайменше одним уловлюючим засобом, що зв'язується з епітопом на антигені або його фрагменті, для того, щоб утворився комплекс, що містить уловлюючий засіб і антиген або його фрагмент, (ii) здійснення контакту комплексу, що містить уловлюючий засіб і антиген або його фрагмент, з щонайменше одним засобом для виявлення, що містить реєстровану мітку і зв'язується з епітопом на антигені або його фрагменті, що не зв'язується уловлюючим засобом, з утворенням реєстрованого комплексу, і (iii) визначення присутності, кількості або концентрації антигену або його фрагмента в тестованому зразку на основі сигналу, генерованого реєстрованою міткою в реєстрованому комплексі, утвореному на стадії (ii), при цьому щонайменше один уловлюючий засіб і/або щонайменше один засіб для виявлення являє собою щонайменше один зв’язувальний білок. Альтернативно в деяких варіантах спосіб визначення присутності, кількості або концентрації одного або декількох антигенів або їх фрагментів у тестованому зразку може включати в себе (і) здійснення контакту тестованого зразка з щонайменше одним уловлюючим засобом, що зв'язується з епітопом на антигені або його фрагменті, для того, щоб утворився комплекс, який містить уловлюючий засіб і антиген або його фрагмент, і одночасно або послідовно в будьякому порядку здійснення контакту тестованого зразка з антигеном, міченим реєстрованою міткою, або його фрагментом, що може конкурувати з будь-яким антигеном або його фрагментом у тестованому зразку за зв'язування з щонайменше одним уловлюючим засобом, при цьому будь-який антиген або його фрагмент, присутній у тестованому зразку, і мічений реєстрованою міткою антиген конкурують один з одним за утворення виявлюваного комплексу, і (ii) визначення присутності, кількості або концентрації антигену або його фрагмента в тестованому зразку на основі сигналу, генерованого реєстрованою міткою у виявлюваному комплексі, утвореному на стадії (і), при цьому щонайменше один уловлюючий засіб являє собою щонайменше один зв’язувальний білок, і при цьому сигнал, генерований реєстрованою 15 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 міткою в уловлюючому виявлюваному комплексі, зворотно пропорційний кількості або концентрації антигену або його фрагмента в тестованому зразку. У різних варіантах тестований зразок може бути одержаний від пацієнта, і в такому випадку спосіб може додатково включати в себе діагностику, прогнозування або оцінку ефективності терапевтичного/профілактичного лікування пацієнта. Якщо спосіб додатково включає в себе оцінку ефективності терапевтичного/профілактичного лікування пацієнта, то спосіб необов'язково додатково включає в себе модифікацію терапевтичного/профілактичного лікування пацієнта таким чином, який необхідний для підвищення ефективності. Спосіб може бути адаптований для застосування в автоматизованій системі або напівавтоматизованій системі. Відповідно, способи, описані в даній публікації, також можна застосовувати для визначення того, чи має суб'єкт або чи піддається він ризику розвитку даного захворювання, розладу або стану. Зокрема, такий спосіб може включати в себе стадії: (a) визначення концентрації або кількості одного або декількох аналітів або їх фрагментів у тестованому зразку, одержаному від суб'єкта (наприклад, із застосуванням способів, описаних у даній публікації, або способів, відомих у даній галузі); і (b) порівняння концентрації або кількості аналіту(ів) або його фрагмента(ів), які визначають на стадії (a), з попередньо визначеним рівнем, при цьому, якщо концентрація або кількість аналіту(ів), визначувані на стадії (a), задовольняють значення попередньо визначуваного рівня, то визначають, що суб'єкт не має або не піддається ризику розвитку даного захворювання, розладу або стану. Однак, якщо концентрація або кількість аналіту(ів), визначувані на стадії (a), не задовольняють значення попередньо визначуваного рівня, то визначають, що суб'єкт має або піддається ризику розвитку даного захворювання, розладу або стану. Крім того, у винаході пропонуються способи моніторингу прогресування захворювання у суб'єкта. У деяких варіантах способи включають в себе стадії: (a) визначення концентрації або кількості в тестованому зразку, одержаному від суб'єкта, одного або декількох аналітів; (b) визначення концентрації або кількості аналіту(ів) у більш пізньому тестованому зразку, узятому від того ж суб'єкта; і (c) порівняння концентрації або кількості аналіту(ів), які визначають на стадії (b), з концентрацією або кількістю аналіту(ів), визначуваними на стадії (a), при цьому, якщо концентрація або кількість, визначувані на стадії (b), не змінюються або є незадовільними в порівнянні з концентрацією або кількістю, визначуваними на стадії (a), то визначають, що захворювання у суб'єкта продовжується, прогресує або погіршується. При порівнянні, якщо концентрація або кількість, які визначають на стадії (b), є задовільними в порівнянні з концентрацією або кількістю, які визначають на стадії (a), то визначають, що захворювання у суб'єкта припинене, регресувало або стан покращився. Необов'язково способи моніторингу прогресування захворювання додатково включають в себе порівняння концентрації або кількості аналіту(ів), які визначають на стадії (b), наприклад, з попередньо визначуваним рівнем. Крім того, необов'язково способи включають в себе лікування суб'єкта однією або декількома фармацевтичними композиціями протягом визначеного періоду часу, якщо порівняння показує, що концентрація або кількість аналіту(ів), які визначають на стадії (b), наприклад, незадовільно змінені в порівнянні з попередньо визначуваним рівнем. Також пропонується набір для аналізу тестованого зразка відносно присутності або концентрації одного або декількох антигенів або їх фрагментів, при цьому один або декілька антигенів являють собою DLL4 і/або VEGF. Набір містить щонайменше один зв’язувальний білок, що описаний у даній публікації, для аналізу тестованого зразка відносно антигену або його фрагмента, і інструкції по виконанню аналізу тестованого зразка відносно антигену або його фрагмента. В одному варіанті щонайменше один зв’язувальний білок необов'язково мічений реєстрованою міткою. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Креслення є схематичним представленням конструкції зв’язувальних білків з подвійними варіабельними доменами (DVD) і показує стратегію створення зв’язувального DVD-білка з двох вихідних антитіл. ДОКЛАДНИЙ ОПИС Пропонуються полівалентні і/або поліспецифічні зв’язувальні білки, здатні зв'язувати епітопи на двох різних білках. Також пропонуються зв’язувальні білки з подвійними варіабельними доменами (також називані DVD, зв'язувальними DVD-білками або імуноглобулінами з подвійними варіабельними доменами (DVD-Ig™)) і їх фармацевтичні композиції, а також нуклеїнові кислоти, рекомбінантні експресуючі вектори і клітини-хазяїни для одержання таких 16 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв’язувальних DVD-білків. Також пропонуються способи застосування зв’язувальних DVD-білків для виявлення специфічних антигенів або in vitro, або in vivo. Якщо в даному описі не визначене інше, наукові і технічні терміни, використовувані в даному описі, мають значення, які звичайно мають на увазі фахівці в даній галузі. У випадку будь-якої можливої неясності визначення, наведені в даному описі, мають пріоритет у порівнянні з будьяким словниковим або зовнішнім визначенням. Якщо відповідно до контексту не потрібне інше, то терміни в однині повинні включати терміни в множині, а терміни в множині повинні включати і форму однини. Використання "або" означає "і/або", якщо не зазначене інше. Використання терміна "включаючи", а також інших форм, таких як "включає" і "включений", не є обмежуючим. Буде зрозуміло, що будь-який діапазон, описаний у даній публікації, включає кінцеві точки і всі значення між кінцевими точками. Заголовки розділів, використовувані в даному описі, наведені тільки в організаційних цілях і їх не слід розглядати як такі, що обмежують описуваний предмет винаходу. Усі документи або частини документів, цитовані в даній заявці, включаючи, але без обмеження, патенти, заявки на видачу патентів, статті, книги і монографії, спеціально включені в даний опис у вигляді посилання в повному обсязі для будь-якої мети. У тій мірі, у якій документи, включені у вигляді посилання, суперечать розкриттю, що міститься в описі, опис буде заміняти будь-який суперечний матеріал. Як правило, номенклатура, використовувана в зв'язку з культурою клітин або тканин, молекулярною біологією, імунологією, мікробіологією, генетикою і хімією білків і нуклеїнових кислот і гібридизацією, описана в даній публікації, добре відома і широко застосовується в даній галузі. Способи і методики, пропоновані в описі, звичайно здійснюють відповідно до звичайних способів, добре відомих у даній галузі, і як описано в різних загальних і більш конкретних публікаціях, які цитовані й обговорюються протягом даного опису, якщо не зазначене інше. Ферментативні реакції і способи очищення здійснюють відповідно до інструкцій виробника або як звичайно здійснюють у даній галузі, або як описано в даній публікації, якщо не зазначене інше. Номенклатури, використовувані у зв'язку з зазначеним, і лабораторні способи і методики аналітичної хімії, хімії органічного синтезу і медичної і фармацевтичної хімії, описані в даній публікації, являють собою способи і методики, добре відомі і широко застосовувані в даній галузі, якщо не зазначене інше. Використовують стандартні методики хімічного синтезу, хімічних аналізів, приготування фармацевтичних засобів, препаратів і їх доставки і лікування пацієнтів. Щоб винахід можна було легше зрозуміти, нижче надане визначення окремих термінів. Термін "антитіло" стосується молекули імуноглобуліну (Ig), яка звичайно складається з чотирьох поліпептидних ланцюгів, двох важких (H) ланцюгів і двох легких (L) ланцюгів, або його функціонального фрагмента, мутанта, варіанта або похідного, котрі зберігають ознаки зв'язування епітопа молекули Ig. Такі форми антитіла у вигляді фрагмента, мутанта, варіант або похідного відомі в даній галузі. В одному варіанті повнорозмірного антитіла кожен важкий ланцюг складається з варіабельної області важкого ланцюга (VH) і константної області важкого ланцюга (CH). CH складається з трьох доменів, CH1, CH2 і CH3. Кожен легкий ланцюг складається з варіабельної області легкого ланцюга (VL) і константної області легкого ланцюга (CL). CL складається з одного домену CL. VH і VL можуть бути додатково підрозділені на області гіперваріабельності, називані областями, що визначають комплементарність (CDR), між якими знаходяться більш консервативні області, називані каркасними областями (FR). Звичайно кожна VH і VL складається з трьох CDR і чотирьох FR, що розподілені від амінокінця до карбоксильного кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекули імуноглобулінів можуть бути будь-якого типу (наприклад IgG, IgE, IgM, IgD, IgA і IgY), класу (наприклад, , IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2)) або підкласу. Термін "біспецифічне антитіло" стосується антитіла, яке зв'язує один антиген (або епітоп) на одному з його двох зв’язувальних плечей (одна пара HC/LC) і зв'язує інший антиген (або епітоп) на своєму другому зв’язувальному плечі (інша пара HC/LC). Біспецифічне антитіло має два окремих антигензв’язувальних плеча (обидва мають специфічність і мають послідовності CDR) і є моновалентним для кожного антигену, з яким воно зв'язується. Біспецифічні антитіла включають антитіла, одержані з використанням методики квадром (Milstein and Cuello (1983), Nature, 305(5934):537-40), за допомогою хімічної кон'югації двох різних моноклональних антитіл (Staerz et al. (1985), Nature, 314(6012):628-31) або способом "виступ у западину" або подібними способами, що дозволяють вводити мутації в Fc-область (Holliger et al. (1993), Proc. Natl. Acad. Sci. USA, 90(14):6444-6448). Антитіло "з дозрілою афінністю" являє собою антитіло з однією або декількома змінами в одній або декількох його CDR, що приводять до поліпшення афінності антитіла відносно антигену, у порівнянні з вихідним антитілом, що не має такої зміни (змін). Приклади антитіл з 17 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 дозрілою афінністю можуть мати наномолярні або навіть пікомолярні афінності відносно антигену-мішені. Антитіла з дозрілою афінністю одержують способами, відомими в даній галузі. У публікації Marks зі співавторами ((1992) BioTechnology, 10:779-783) описане дозрівання афінності за рахунок перетасування доменів VH і VL. Випадковий мутагенез залишків CDR і/або каркаса описаний у публікаціях: Barbas et al. (1994), Proc. Nat. Acad. Sci. USA, 91:3809-3813; Schier et al. (1995), Gene, 169:147-155; Yelton et al. (1995), J. Immunol. 155:1994-2004; Jackson et al. (1995), J. Immunol. 154(7):3310-9; Hawkins et al. (1992), J. Mol. Biol. 226:889-896, і мутація в вибраних положеннях для мутагенезу, положеннях контактів або гіпермутацій з використанням посилюючого активність амінокислотного залишку описана в патенті США № 6914128. Термін "CDR-прищеплене антитіло" стосується антитіла, яке містить послідовності варіабельних областей важкого і легкого ланцюгів, у яких послідовності однієї або декількох областей CDR у VH і/або VL замінені послідовностями CDR іншого антитіла. Наприклад, два антитіла можуть бути з різних видів, такі як антитіла, що мають мишачі варіабельні області важкого і легкого ланцюгів, у яких одна або декілька мишачих CDR були замінені послідовностями CDR людини. Термін "гуманізоване антитіло" стосується антитіла виду, відмінного від людини, що було змінене так, щоб воно було більш "подібним до людського", тобто більш подібним з послідовностями зародкової лінії людини. Одним з типів гуманізованого антитіла є CDRприщеплене антитіло, у якому послідовності CDR тварини, відмінної від людини, введені в послідовності VH і VL людини, щоб замінити відповідні послідовності CDR людини. Термін "гуманізоване антитіло" також означає антитіло або його варіант, похідне, аналог або фрагмент, що містить послідовності каркасної області (FR), які мають значиму ідентичність (наприклад, щонайменше 80%, щонайменше 85%, щонайменше 90%, щонайменше 95%, щонайменше 98% або щонайменше 99% ідентичність) з амінокислотною послідовністю послідовностей FR антитіла людини, і щонайменше одну CDR, що має значиму ідентичність (наприклад, щонайменше 80%, щонайменше 85%, щонайменше 90%, щонайменше 95%, щонайменше 98% або щонайменше 99% ідентичність) з амінокислотною послідовністю CDR виду, відмінного від людини. Гуманізоване антитіло може містити по суті усі з щонайменше одного і звичайно двох варіабельних доменів (Fab, Fab’, F(ab’)2, FabC, Fv), у яких послідовності всіх або по суті всіх областей CDR відповідають CDR-областям імуноглобуліну виду, відмінного від людини (тобто донорного антитіла), і послідовність усіх або по суті всіх FR-областей є FR-областями імуноглобуліну людини. Гуманізоване антитіло також може містити області CH1, шарніра, CH2, CH3 і CH4 важкого ланцюга з антитіла людини. У деяких варіантах гуманізоване антитіло містить тільки гуманізований легкий ланцюг. В одному варіанті гуманізоване антитіло також містить щонайменше частину Fc-області імуноглобуліну людини. У деяких варіантах гуманізоване антитіло містить тільки гуманізований легкий ланцюг. У деяких варіантах гуманізоване антитіло містить тільки гуманізований важкий ланцюг. У деяких варіантах гуманізоване антитіло містить тільки гуманізований варіабельний домен легкого ланцюга і/або гуманізований варіабельний домен важкого ланцюга. У деяких варіантах гуманізоване антитіло містить легкий ланцюг, а також щонайменше варіабельний домен важкого ланцюга. У деяких варіантах гуманізоване антитіло містить важкий ланцюг, а також щонайменше варіабельний домен легкого ланцюга. Терміни "зв’язувальний білок з подвійними варіабельними доменами" і "імуноглобулін з подвійними варіабельними доменами" стосуються зв’язувального білка, що має два варіабельних домени, у кожному зі своїх двох плечей (наприклад, пари HC/LC) (дивіться публікацію PCT № WO 02/02773), кожний з яких здатний зв'язуватися з антигеном. В одному варіанті кожні варіабельні домени зв'язують різні антигени або епітопи. В іншому варіанті варіабельні домени зв'язують один і той же антиген або епітоп. В іншому варіанті зв’язувальний білок з подвійними варіабельними доменами має два ідентичних антигензв’язувальних плеча з ідентичною специфічністю й ідентичними послідовностями CDR і є бівалентним відносно кожного антигену, з яким воно зв'язується. В одному варіанті зв’язувальні DVD-білки можуть бути моноспецифічними, тобто здатними зв'язувати один антиген, або поліспецифічними, тобто здатними зв'язувати два або більше антигенів. Зв’язувальні DVD-білки, що містять два поліпептиди DVD важкого ланцюга і два поліпептиди DVD легкого ланцюга, названі DVD-Ig™. В одному варіанті кожна половина зв’язувальний DVD-білок, що складається з чотирьох ланцюгів, містить поліпептид DVD важкого ланцюга і поліпептид DVD легкого ланцюга і дві антигензв’язувальних ділянки. В одному варіанті кожна зв’язувальна ділянка містить варіабельний домен важкого ланцюга і варіабельний домен легкого ланцюга, усього з 6 CDR, залученими в зв'язування антигену на антигензв’язувальну ділянку. 18 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "антиідіотипічне антитіло" стосується антитіла, вироблюваного проти амінокислотної послідовності ділянки зв'язування з антигеном іншого антитіла. Антиідіотипічні антитіла можуть бути введені для посилення імунної відповіді проти антигену. Термін "біологічна активність" стосується будь-якої однієї або декількох біологічних властивостей молекули (або присутньої в природі, яку виявляють in vivo, або одержуваної або доступної завдяки використанню способів рекомбінації). Біологічні властивості включають, але без обмеження, зв'язування рецептора, індукцію клітинної проліферації, інгібування росту клітин, індукцію інших цитокінів, індукцію апопотозу і ферментативну активність. Термін "нейтралізація" стосується протидії біологічній активності антигену в тому випадку, коли зв’язувальний білок специфічно зв'язується з антигеном. В одному варіанті нейтралізуючий зв’язувальний білок зв'язується з антигеном (наприклад, цитокіном) і знижує його біологічну активність на щонайменше приблизно 20, 40, 60, 80, 85% або більше. "Специфічність" стосується здатності зв’язувального білка вибірково зв'язувати антиген. "Афінність" означає силу взаємодії між зв’язувальним білком і антигеном, і вона визначається послідовністю CDR зв’язувального білка, а також природою антигену, наприклад його розміром, формою і/або зарядом. Зв’язувальні білки можуть бути вибрані по афінності, яка забезпечує необхідні терапевтичні результати при мінімізації негативних побічних ефектів. Афінність можна виміряти, використовуючи способи, відомі фахівцю в даній галузі (US 20090311253). Термін "потенційна активність" стосується здатності зв’язувального білка досягати необхідного ефекту і є мірою його терапевтичної ефективності. Потенційну активність можна оцінити, використовуючи способи, відомі фахівцю в даній галузі (US 20090311253). Термін "перехресна реактивність" стосується здатності зв’язувального білка зв'язувати іншу мішень, відмінну від мішені, проти якої він одержаний. Звичайно зв’язувальний білок може зв'язувати свою тканину(и)/антиген(и)-мішень з достатньо високою афінністю, але буде виявляти відповідну низьку афінність відносно нормальних тканин/антигенів, що не є мішенями. Окремі зв’язувальні білки звичайно вибирають так, щоб вони задовольняли два критерії: (1) зв'язування антитіла з тканиною, яке візуалізують, використовуючи способи забарвлення, відомі в даній галузі, відповідає відомій експресії мішені антитіла, і (2) подібні картини забарвлення між тканинами людини і видів, використовуваних для токсикологічної оцінки (наприклад, мишей і макак-крабоїдів), з одного і того ж органа. Зазначені й інші способи оцінки перехресної реактивності відомі фахівцю в даній галузі (US 20090311253). Термін "біологічна функція" стосується специфічної дії зв’язувального білка in vitro або in vivo. Зв’язувальні білки можуть мати як мішені декілька класів антигенів і можуть досягати необхідних терапевтичних результатів за допомогою множини механізмів дії. Мішенями зв’язувальних білків можуть бути розчинні білки, антигени клітинної поверхні і/або відкладення позаклітинних білків. Зв’язувальні білки можуть агонізувати, антагонізувати або нейтралізувати активність своїх мішеней. Зв’язувальні білки можуть сприяти кліренсу мішеней, з якими вони зв'язуються, або можуть приводити до цитотоксичності при зв'язуванні з клітинами. Частини двох або більше антитіл можуть бути включені в полівалентну форму, щоб добитися більше однієї відмітної функції в одній молекулі зв’язувального білка. Аналізи in vitro і моделі in vivo, використовувані для оцінки біологічної функції, відомі фахівцю в даній галузі (US 20090311253). "Стабільний" зв’язувальний білок являє собою білок у тому випадку, коли зв’язувальний білок по суті зберігає свою фізичну стабільність, хімічну стабільність і/або біологічну активність при зберіганні. Бажаним є полівалентний зв’язувальний білок, що є стабільним in vitro при різних температурах протягом тривалого періоду часу. Способи стабілізації зв’язувальних білків і оцінки їх стабільності при різних температурах відомі фахівцю в даній галузі (US 20090311253). Термін "розчинність" стосується здатності білка зберігатися диспергованим у водному розчині. Розчинність білка у водному препараті залежить від правильного розподілу гідрофобних і гідрофільних амінокислотних залишків, і тому розчинність може корелювати з одержанням білків, підданих правильному укладанню. Фахівець у даній галузі зможе виявити підвищення або зниження розчинності зв’язувального білка з використанням рутинних методик ВЕРХ і способів, відомих фахівцю в даній галузі (US 20090311253). Зв’язувальні білки можуть бути одержані з використанням різних хазяїнів або можуть бути одержані in vitro, і відносний вихід на одне дослідження визначає "ефективність продукції". Фактори, що впливають на ефективність продукції, включають, але без обмеження, тип клітинхазяїнів (прокаріотичні або еукаріотичні), вибір експресуючого вектора, вибір нуклеотидної послідовності і застосовувані способи. Матеріали і способи, використовувані при одержанні зв’язувальних білків, а також вимірювання ефективності продукції відомі фахівцю в даній галузі (US 20090311253). 19 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "імуногенність" означає здатність речовини індукувати імунну відповідь. Введення терапевтичного зв’язувального білка може приводити в деяких випадках до імунної відповіді. Потенційні елементи, що можуть індукувати імуногенність у полівалентній формі, можна аналізувати під час відбору вихідних антитіл, і можуть бути початі кроки для зниження такого ризику, щоб оптимізувати вихідні антитіла перед включенням їх послідовностей у полівалентну форму зв’язувального білка. Способи зниження імуногенності антитіл і зв’язувальних білків відомі фахівцю в даній галузі (US 20090311253). Терміни "мітка" і "реєстрована мітка" означають компонент, зв'язаний з членом пари, що специфічно зв'язується, таким як антитіло або його аналіт, щоб зробити реакцію (наприклад, зв'язування) між членами пари, що специфічно зв'язується, реєстрованою. Міченого представника пари, що специфічно зв'язується, називають "міченим реєстрованою міткою". Таким чином, термін "мічений зв’язувальний білок" стосується білка з включеною міткою, яка забезпечує ідентифікацію зв’язувального білка. В одному варіанті мітка є реєстрованим маркером, який може продукувати сигнал, що реєструють візуально або інструментальними способами, наприклад, включення радіоактивно міченої амінокислоти або зв'язування з поліпептидом залишків біотинілу, що можуть бути виявлені авідином, що містить маркер (наприклад, стрептавідином, що містить флуоресціюючий маркер, або з використанням ферментативної активності, що може бути виявлена оптичними або колориметричними способами). Приклади міток для поліпептидів включають, але без обмеження, наступні мітки: 3 14 35 90 99 111 125 131 177 166 радіоактивні ізотопи або радіонукліди (наприклад, H, C, S, Y, Tc, In, I, I, Lu, Ho 153 або Sm); хромогени, флуоресціюючі мітки (наприклад, ФІТЦ, родамін, лантанідні люмінофори), ферментативні мітки (наприклад, пероксидаза хрону, люцифераза, лужна фосфатаза), хемілюмінесцентні маркери; групи біотинілу; попередньо визначувані поліпептидні епітопи, упізнавані другим репортером (наприклад, парні послідовності лейцинової блискавки, сайти зв'язування для других антитіл, домени зв'язування металів, епітопні мітки) і магнітні засоби, такі як хелати гадолінію. Типові приклади міток, звичайно використовуваних для імуноаналізів, включають компоненти, що випромінюють світло, наприклад сполуки акридинію, і компоненти, що продукують флуоресценцію, наприклад флуоресцеїн. В зв'язку з цим компонент сам по собі може бути не мічений реєстрованою міткою, але може ставати реєстрованим після взаємодії з іншим компонентом. Термін "кон’югат" стосується зв’язувального білка, такого як антитіло або DVD-Ig, хімічно зв'язаного з другим хімічним компонентом, таким як терапевтичний або цитотоксичний засіб. Термін "засіб" включає хімічну сполуку, суміш хімічних сполук, біологічну макромолекулу або екстракт, одержаний з біологічних матеріалів. Приклади терапевтичних або цитотоксичних засобів включають без обмеження таксол, цитохалазин B, граміцидин D, еметин, мітоміцин, етопозид, тенопозид, вінкристин, вінбластін, доксорубіцин, даунорубіцин, дигідроксіантрациндіон, мітоксантрон, мітраміцин, актиноміцин D, 1-дегідротестостерон, глюкокортикоїди, прокаїн, тетракаїн, лідокаїн, пропранолол, метопролол, атенолол, бісопролол і пуроміцин і їх аналоги або гомологи. При використанні в контексті імуноаналізу кон’югат може являти собою мічене реєстрованою міткою антитіло або DVD-Ig, використовувані як засіб для виявлення. Терміни "кристал" і "кристалізоване" стосуються зв’язувального білка (наприклад, антитіла) або його антигензв’язувальної частини, які існують у формі кристала. Кристали являють собою одну з форм твердого стану речовини, що відрізняється від інших форм, таких як аморфний твердий стан або рідкокристалічний стан. Кристали складаються з правильних повторюваних тривимірних решіток атомів, іонів, молекул (наприклад, білків, таких як антитіла) або молекулярних ансамблів (наприклад, комплексів антиген/антитіло). Такі тривимірні решітки розташовані відповідно до конкретних математичних взаємозв'язків, що добре відомі в даній галузі. Фундаментальну одиницю або будівельний блок, що повторюється в кристалі, називають асиметричною одиницею. Повторення асиметричної одиниці в структурі, що підпорядковується деякій добре визначеній кристалографічній симетрії, створює "елементарну комірку" кристала. Повторення елементарної комірки в результаті регулярних трансляцій у всіх трьох напрямках створює кристал. Дивіться Giege R. and Ducruix A. Barrett, Crystallization of Nucleic Acids and nd Proteins, a Practical Approach, 2 ed., pp. 201-16, Oxford University Press, New York, N.Y. (1999). Термін "вектор" стосується молекули нуклеїнової кислоти, здатної до транспорту іншої нуклеїнової кислоти, з якою вона зв'язана. Одним з типів векторів є "плазміда", що являє собою кільцеву двониткову петлю ДНК, у яку можуть бути ліговані додаткові ділянки ДНК. Іншим типом вектора є вірусний вектор, у випадку якого додаткові фрагменти ДНК можуть бути ліговані у вірусний геном. Інші вектори включають РНК-вектори. Деякі вектори здатні до автономної реплікації в клітині-хазяїні, у яку вони введені (наприклад, бактеріальні вектори, що мають 20 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 бактеріальний початок реплікації, і епісомні вектори ссавців). Інші вектори (наприклад, неепісомні вектори ссавців) можуть бути інтегровані в геном клітини-хазяїна при введенні в клітину-хазяїна і при цьому реплікуються разом з геномом хазяїна. Деякі вектори здатні керувати експресією генів, з якими вони оперативно зв'язані. Такі вектори в даному описі називають "рекомбінантними експресуючими векторами" (або просто "експресуючими векторами"). Загалом, експресуючі вектори, застосовні в способах рекомбінації ДНК, часто мають форму плазмід. У даному описі терміни "плазміда" і "вектор" можуть бути використані взаємозамінно, оскільки плазміда є найбільш широко застосовуваною формою вектора. Однак мається на увазі, що винахід включає й інші форми експресуючих векторів, такі як вірусні вектори (наприклад, дефіцитні по реплікації ретровіруси, аденовіруси й аденоасоційовані віруси), які виконують еквівалентні функції. Група векторів pHybE (заявка на видачу патенту США з реєстраційним № 61/021282) може бути використана для клонування вихідного антитіла і зв’язувального DVD-білка. V1, одержаний з pJP183; pHybE-hCg1,z,non-a V2, можна використовувати для клонування важких ланцюгів антитіла і DVD з константною областю дикого типу. V2, одержаний з pJP191; pHybE-hCk V3, можна використовувати для клонування легких ланцюгів антитіла і DVD з константною областю каппа. V3, одержаний з pJP192; pHybE-hCI V2, можна використовувати для клонування легких ланцюгів антитіла і DVD з константною областю лямбда. V4, побудований із сигнальним пептидом лямбда і константною областю каппа, можна використовувати для клонування легких ланцюгів DVD з гібридним лямбда-каппа V-доменом. V5, побудований із сигнальним пептидом каппа і константною областю лямбда, можна використовувати для клонування легких ланцюгів DVD з гібридним каппа-лямбда V-доменом. V7, одержаний з pJP183; pHybE-hCg1,z,non-a V2, можна використовувати для клонування важких ланцюгів антитіла і DVD з мутантною константною областю (234235 а/к). Терміни "рекомбінантна клітина-хазяїн" або "клітина-хазяїн" стосуються клітини, у яку була введена екзогенна ДНК. Такі терміни стосуються не тільки конкретної клітини суб'єкта, але і потомства такої клітини. Оскільки в наступних поколіннях можуть мати місце деякі модифікації або внаслідок мутації, або внаслідок впливу навколишнього середовища, таке потомство в дійсності може бути не ідентичним вихідній клітині, але усе ще буде входити в обсяг терміна "клітина-хазяїн" у використовуваному в даному описі розумінні. В одному варіанті клітинихазяїни включають прокаріотичні і еукаріотичні клітини. В одному варіанті еукаріотичні клітини включають клітини найпростіших, грибів, рослин і тварин. В іншому варіанті клітини-хазяїни включають без обмеження лінію прокаріотичних клітин E. coli; лінії клітин ссавців CHO, HEK 293, COS, NS0, SP2 і PER.C6; лінію клітин комах Sf9 і клітини грибів Saccharomyces cerevisiae. Термін "трансфекція" охоплюють широку множину способів, звичайно застосовуваних для введення екзогенної нуклеїнової кислоти (наприклад, ДНК) у клітину-хазяїна, наприклад електропорацію, преципітацію фосфатом кальцію, трансфекцію з використанням DEAEдекстрану і тому подібні. Термін "цитокін" стосується білка, що вивільняється однією популяцією клітин, який діє на іншу популяцію клітин як міжклітинний медіатор. Термін "цитокін" включає білки з природних джерел або з культури рекомбінантних клітин і біологічно активні еквіваленти цитокінів з нативною послідовністю. Термін "біологічний зразок" означає визначену кількість речовини з живого організму або раніше живого організму. Такі речовини включають, але без обмеження, кров (наприклад, цільну кров), плазму, сироватку, сечу, амніотичну рідину, синовіальну рідину, ендотеліальні клітини, лейкоцити, моноцити, інші клітини, органи, тканини, кістковий мозок, лімфатичні вузли і селезінку. Термін "компонент" стосується елемента композиції. У зв'язку з діагностичним набором, наприклад, компонентом може бути уловлююче антитіло, антитіло для детекції або кон’югат антитіла, контроль, калібрувальний еталон, серія калібрувальних еталонів, панель для визначення чутливості, ємність, буфер, розріджувач, сіль, фермент, кофактор ферменту, реагент для виявлення, реагент/розчин для попередньої обробки, субстрат (наприклад, у вигляді розчину), розчин для зупинення реакції тощо, що може бути включений в набір для аналізу тестованого зразка. Таким чином, "компонент" може включати в деяких варіантах поліпептид або інший аналіт, зазначений вище, який іммобілізують на твердій підкладці, наприклад завдяки зв'язуванню з антитілом проти аналіту (наприклад, антитілом проти поліпептиду). У деяких варіантах один або декілька компонентів можуть бути в розчині або можуть бути ліофілізовані. "Контроль" стосується композиції, яка не містить аналіту ("негативний контроль") або містить аналіт ("позитивний контроль"). Позитивний контроль може містити відому концентрацію аналіту. "Контроль", "позитивний контроль" і "калібрувальний еталон" можуть бути використані в 21 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 даному описі взаємозамінно відносно композиції, що містить відому концентрацію аналіту. "Позитивний контроль" може бути використаний для встановлення характеристик ефективності аналізу і є корисним показником цілісності реагентів (наприклад, аналітів). "Попередньо визначувана межа відсікання" і "попередньо визначуваний рівень", загалом, стосуються значення межі відсікання в аналізі, який використовують для оцінки результатів діагностичної/прогностичної/терапевтичної ефективності шляхом порівняння результатів аналізу з попередньо визначуваною межею відсікання/рівнем, що вже був зв'язаний або асоційований з різними клінічними параметрами (наприклад, тяжкістю захворювання, прогресуванням/відсутністю прогресування/поліпшенням і т. д.). Хоча в даному описі можуть бути наведені приклади попередньо визначуваних рівнів, добре відомо, що значення межі відсікання можуть варіювати, залежно від природи імуноаналізу (наприклад, використовуваних антитіл і т. д.). Фахівець у даній галузі зможе адаптувати наведений в даній публікації опис для інших імуноаналізів, щоб одержати специфічні для імуноаналізу значення межі відсікання для таких інших імуноаналізів на основі даного опису. Беручи до уваги, що точне значення попередньо визначуваної межі відсікання/рівня може варіювати від аналізу до аналізу, загалом, можуть бути застосовні кореляції, що описані в даній публікації (за необхідності). "Реагент для попередньої обробки", наприклад, реагент для лізису, преципітації і/або солюбілізації, який використовують у діагностичному аналізі, що описаний у даній публікації, являє собою реагент, який лізує будь-які клітини і/або солюбілізує будь-який аналіт, який присутній у тестованому зразку. Попередня обробка необов'язкова для всіх зразків, що описані в даній публікації. Поряд з іншим солюбілізація аналіту (наприклад, поліпептиду, що представляє інтерес) може викликати вивільнення аналіту з ендогенних зв’язувальних білків, присутніх у зразку. Реагент для попередньої обробки може бути гомогенним (не потребуючим стадії розділення) або гетерогенним (потребуючим стадії розділення). У деяких варіантах при використанні гетерогенного реагенту для попередньої обробки преципітовані білки, що зв’язують аналіт, витягають з тестованого зразка перед проведенням наступної стадії аналізу. "Реагенти для контролю якості" у контексті імуноаналізів і наборів, описаних у даній публікації, включають, але без обмеження, калібрувальні еталони, контролі і панелі для оцінки чутливості. Звичайно використовують один або декілька "калібрувальних еталонів" або "стандартів", щоб одержати калібрувальні (стандартні) криві для інтерполяції концентрації молекули-мішені, такої як антитіло або аналіт. У деяких варіантах можна використовувати один калібрувальний еталон, який близький попередньо визначуваній позитивній/негативній межі відсікання. Альтернативно, в інших варіантах можна використовувати декілька калібрувальних еталонів (тобто більше одного калібрувального еталона або різну кількість калібрувальних еталонів), щоб одержати "панель чутливості" або установити "градієнт чутливості". Термін "партнер у специфічному зв'язуванні" стосується члена пари, що специфічно зв'язується. Пара, що специфічно зв'язується, містить дві різні молекули, які специфічно зв'язуються одна з одною хімічними або фізичними способами. У різних варіантах на доповнення до специфічного зв'язування антигену й антитіла інші пари, що специфічно зв'язуються, можуть включати біотин і авідин (або стрептавідин), вуглеводи і лектини, комплементарні нуклеотидні послідовності, ефекторні і рецепторні молекули, кофактори і ферменти, інгібітори ферментів і ферменти, тощо. Крім того, пари, що специфічно зв'язуються, можуть включати в деяких варіантах члени, які є аналогами вихідних членів, що специфічно зв'язуються, наприклад аналіт-аналог. Імунореактивні члени, що специфічно зв'язуються, включають антигени, фрагменти антигенів і антитіла, включаючи моноклональні і поліклональні антитіла, а також їх комплекси, фрагменти і варіанти (включаючи фрагменти варіантів), або виділені, або одержані рекомбінантно. Термін "Fc-область" визначає C-кінцеву область важкого ланцюга імуноглобуліну, що може бути створена при розщепленні інтактного антитіла папаїном. Fc-область може являти собою Fc-область з нативною послідовністю або варіант Fc-області. Fc-область імуноглобуліну звичайно містить два константних домени, домен CH2 і домен CH3, і необов'язково містить домен CH4. Заміни амінокислотних залишків у Fc-частині для зміни ефекторної функції антитіла відомі в даній галузі (наприклад, патенти США №№ 5648260 і 5624821). Fc-область опосередковує декілька важливих ефекторних функцій, наприклад індукцію цитокінів, залежну від антитіл опосередковану клітинами цитотоксичність (ADCC), фагоцитоз, залежну від комплементу цитотоксичність (CDC) і час напівжиття/швидкість кліренсу антитіла і комплексів антиген-антитіло. У деяких випадках такі ефекторні функції вимагаються для терапевтичного імуноглобуліну, але в інших випадках можуть бути необов'язковими або навіть шкідливими, залежно від терапевтичних цілей. 22 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "антигензв’язувальна частина" зв’язувального білка означає один або декілька фрагментів зв’язувального білка (наприклад, антитіла), що зберігають здатність специфічно зв'язуватися з антигеном. Антигензв’язувальна функція зв’язувального білка може здійснюватися фрагментами повнорозмірного антитіла, а також біспецифічною, з подвійною специфічністю або поліспецифічною формами. Приклади зв’язувальних фрагментів, охоплюваних терміном "антигензв’язувальна частина" зв’язувального білка, включають (i) Fabфрагмент, моновалентний фрагмент, що складається з доменів VL, VH, CL1 і CH1; (ii) F(ab’)2фрагмент, бівалентний фрагмент, що містить два F(ab)’-фрагменти, зв'язані дисульфідним зв'язком у шарнірній області; (iii) Fd-фрагмент, що складається з доменів VH і CH1; (iv) Fvфрагмент, що складається з доменів VL і VH одного плеча антитіла, (v) dAb-фрагмент, що містить один варіабельний домен; і (vi) ізольовану область, що визначає комплементарність (CDR). Крім того, хоча два домени Fv-фрагмента, VL і VH, кодуються окремими генами, вони можуть бути зв'язані з використанням способів рекомбінації синтетичним лінкером, що дозволяє одержувати з них один ланцюг білка, у якому області VL і VH складають пари з утворенням моновалентних молекул (відомих як одноланцюжковий Fv (scFv)). Також мається на увазі, що такі одноланцюжкові антитіла охоплені терміном "антигензв’язувальна частина" антитіла. Також включені інші форми одноланцюжкових антитіл, такі як діантитіла. Крім того, одноланцюжкові антитіла також включають "лінійні антитіла", що містять пари тандемних ділянок Fv (VH-CH1VH-CH1), що разом з комплементарними поліпептидами легкого ланцюга утворюють пари антигензв’язувальних областей. Термін "полівалентний зв’язувальний білок" означає зв’язувальний білок, що містить дві або більше антигензв’язувальних ділянок. В одному варіанті полівалентний зв’язувальний білок сконструйований так, що він має три або більше антигензв’язувальних ділянок і є антитілом, що не зустрічається в природі. Термін "поліспецифічний зв’язувальний білок" стосується зв’язувального білка, здатного зв'язувати дві або більше споріднених або неспоріднених мішеней. В одному варіанті зв’язувальні DVD-білки, пропоновані в даному винаході, містять дві або більше антигензв’язувальних ділянок і є тетравалентними або полівалентними зв’язувальними білками. Термін "лінкер" означає амінокислотний залишок або поліпептид, що містить два або більше амінокислотних залишків, зв'язаних пептидними зв'язками, які використовують для зв'язування двох поліпептидів (наприклад, двох доменів VH або двох доменів VL). Приклади таких лінкерних поліпептидів добре відомі в даній галузі (дивіться, наприклад, публікації Holliger et al. (1993), Proc. Natl. Acad. Sci. USA, 90:6444-6448; Poljak et al. (1994), Structure, 2:1121-1123). Терміни "нумерація по Кебату", "визначення по Кебату" і "маркірування по Кебату" використовують у даному описі взаємозамінно. Такі терміни, що відомі в даній галузі, стосуються системи нумерації амінокислотних залишків, які є більш варіабельними (тобто гіперваріабельними), ніж інші амінокислотні залишки у варіабельних областях важкого і легкого ланцюгів антитіла або його антигензв’язувальної частини (Kabat et al. (1971), Ann. NY Acad., Sci. 190: 382-391, і Kabat, E. A. et al. (1991), Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). У випадку варіабельної області важкого ланцюга гіперваріабельна область знаходиться в діапазоні положень амінокислот 31-35 у випадку CDR1, положень амінокислот 50-65 у випадку CDR2 і положень амінокислот 95-102 у випадку CDR3. У випадку варіабельній області легкого ланцюга гіперваріабельна область знаходиться в діапазоні положень амінокислот 24-34 у випадку CDR1, положень амінокислот 50-56 у випадку CDR2 і положень амінокислот 89-97 у випадку CDR3. Термін "CDR" означає область, що визначає компліментарність, у послідовності варіабельної області імуноглобуліну. Існує три CDR у кожній з варіабельних областей важкого ланцюга і легкого ланцюга, що названі CDR1, CDR2 і CDR3 у випадку кожної з варіабельних областей важкого і легкого ланцюгів. Термін "набір CDR" стосується групи з трьох CDR, що знаходяться в одній варіабельній області, здатній зв'язувати антиген. Точні границі таких CDR визначають по-різному відповідно до різних систем. Система, описана Кебатом (Kabat et al. (1987) і (1991)), не тільки забезпечує чітку систему нумерації залишків, застосовну до будь-якої варіабельної області антитіла, але також дозволяє виявити точні границі залишків, що визначають три CDR. Такі CDR можуть бути названі CDR відповідно до системи Кебата. Чотія зі співавторами (Chothia and Lesk (1987), J. Mol. Biol. 196:901-917; Chothia et al. (1989), Nature 342:877-883) знайшли, що деякі субчастини в CDR відповідно до системи Кебата приймають майже ідентичні конформації пептидного кістяка, незважаючи на наявність великої розмаїтості на рівні амінокислотної послідовності. Такі субчастини названі L1, L2 і L3 або H1, H2 і H3, де "L" і "H" означають області легкого ланцюга і важкого ланцюга, відповідно. Такі області можуть бути названі CDR відповідно до системи Чотія, що мають границі, які перекриваються з CDR 23 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідно до системи Кебата. Інші границі, що визначають CDR, які перекриваються з CDR відповідно до системи Кебата, описані Padlan (1995) (FASEB J. 9:133-139) і MacCallum (1996) (J. Mol. Biol. 262(5):732-45). Інші визначення границь CDR можуть не строго відповідати одній з зазначених вище систем, однак будуть перекриватися з CDR згідно з Кебатом, хоча вони можуть бути більш короткими або більш довгими у світлі попередніх оцінок або експериментальних даних про те, що конкретні залишки або групи залишків або навіть повні CDR значимо не впливають на зв'язування антигену. У способах, застосовуваних згідно з даним винаходом, можна використовувати CDR, визначувані відповідно до будь-якої з зазначених систем, хоча в деяких варіантах використані CDR, визначувані згідно з Кебатом або Чотія. Термін "епітоп" означає область антигену, що зв'язується зв’язувальним білком, наприклад область, здатну специфічно зв'язуватися з імуноглобуліном або T-клітинним рецептором. У деяких варіантах епітопні детермінанти включають в себе хімічно активні поверхневі групи молекул, таких як амінокислоти, бічні ланцюги цукрів, фосфорил або сульфоніл, і в деяких варіантах можуть мати специфічні ознаки тривимірної структури і/або специфічні характеристики заряду. В одному варіанті епітоп містить амінокислотні залишки області антигену (або його фрагмента), що, як відомо, зв'язуються з комплементарною ділянкою на специфічному партнері в зв'язуванні. Фрагмент антигену може містити більше одного епітопа. У деяких варіантах зв’язувальний білок специфічно зв'язує антиген, коли він розпізнає свій антиген-мішень у складній суміші білків і/або макромолекул. Зв’язувальні білки "зв'язуються з одним і тим же епітопом", якщо антитіла перехресно конкурують (наприклад, одне запобігає зв'язуванню іншого зі зв’язувальним білком або інгібує модулюючу дію на інший зв'язування зі зв’язувальним білком). Способи візуалізації і моделювання упізнавання епітопа відомі фахівцю в даній галузі (US 20090311253). "Фармакокінетика" стосується процесу, у якому лікарський засіб всмоктується, розподіляється, метаболізується і екскретується організмом. У деяких варіантах для створення полівалентної молекули зв’язувального білка з необхідним фармакокінетичним профілем вибирають вихідні моноклональні антитіла з фармакокінетичними профілями, подібними з необхідним профілем. ФК-профілі вибраних вихідних моноклональних антитіл можуть бути легко визначені з використанням, наприклад, гризунів у способах, відомих фахівцю в даній галузі (US 20090311253). "Біодоступність" стосується кількості активного лікарського засобу, що досягає своєї мішені після введення. Біодоступність є функцією декількох раніше описаних властивостей, включаючи стабільність, розчинність, імуногенність і фармакокінетику, і може бути оцінена з використанням способів, відомих фахівцю в даній галузі (US 20090311253). Термін "резонанс поверхневого плазмону" стосується оптичного явища, яке забезпечує можливість аналізу біспецифічних взаємодій у режимі реального часу за допомогою виявлення змін концентрацій білків на біосенсорній матриці, наприклад, з використанням системи BIAcore (BIAcore International AB, a GE Healthcare Co., Uppsala, Sweden and Piscataway, NJ). Додатковий опис дивіться в публікації Jonsson U. et al. (1993), Ann. Biol. Clin. 51:19-26. Термін "Kon" означає константу швидкості асоціації зв’язувального білка (наприклад, антитіла або DVD) з антигеном з утворенням комплексу (наприклад, комплексу DVD/антиген). Термін "Kon" також означає "константу швидкості асоціації" або "ka", які використовують у даному описі взаємозамінно. Таке значення показує швидкість зв'язування зв’язувального білка з його мішенню або швидкість утворення комплексу між зв’язувальним білком (наприклад, антитілом) і антигеном. Це також показано в рівнянні нижче: Антитіло ("Ат") + антиген ("Аг") Ат-Аг. Термін "Koff" означає константу швидкості розпаду комплексу або "константу швидкості дисоціації" зв’язувального білка (наприклад, антитіла або DVD) зі зв'язаного комплексу (наприклад, комплексу DVD/антиген), як відомо в даній галузі. Таке значення показує швидкість дисоціації зв’язувального білка (наприклад, антитіла) від його мішені або розділення комплексу Ат-Аг з перебігом часу на вільне антитіло й антиген, як показано в рівнянні нижче: Ат + Аг Ат-Аг. Терміни "KD" і "рівноважна константа дисоціації" означають значення, одержане при вимірюванні у випадку титрування в рівновазі або шляхом ділення константи швидкості дисоціації (Koff) на константу швидкості асоціації (K on). Константу швидкості асоціації, константу швидкості дисоціації і рівноважну константу дисоціації використовують для представлення афінності зв'язування зв’язувального білка (наприклад, антитіла або DVD) відносно антигену. Способи визначення констант швидкості асоціації і дисоціації добре відомі в даній галузі. Застосування основаних на флуоресценції способів забезпечує високу чутливість і можливість дослідження зразків у фізіологічних буферах у рівновазі. Можна використовувати інші 24 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 експериментальні підходи і прилади, такі як аналіз BIAcore® (аналіз взаємодії біологічних молекул) (наприклад, прилад, доступний з BIAcore International AB, a GE Healthcare company, Uppsala, Sweden). Крім того, також можна використовувати аналіз KinExA® (аналіз кінетичного виключення), доступний з Sapidyne Instruments (Boise, Idaho). Термін "варіант" означає поліпептид, який відрізняється від даного поліпептиду по амінокислотній послідовності за рахунок додавання (наприклад, інсерції), делеції або консервативної заміни амінокислот, але який зберігає біологічну активність даного поліпептиду (наприклад, варіант VEGF-антитіла може конкурувати з анти-VEGF-антитілом за зв'язування з VEGF). Консервативна заміна амінокислоти, тобто заміна амінокислоти іншою амінокислотою з подібними властивостями (наприклад, гідрофільністю і/або ступенем або розподілом заряджених областей), як відомо в даній галузі, звичайно полягає в мінорній зміні. Такі мінорні зміни можуть бути ідентифіковані, частково, в результаті аналізу гідропатичного індексу амінокислот, як відомо в даній галузі (дивіться, наприклад, Kyte et al. (1982), J. Mol. Biol. 57:105132). В одному аспекті здійснюють заміни амінокислот, що мають гідропатичні індекси 2. Також можна використовувати гідрофільність амінокислот для виявлення замін, які можуть приводити до одержання білків, що зберігають біологічну функцію. Врахування гідрофільності амінокислот у контексті пептиду дозволяє обчислювати найбільшу середню локальну гідрофільність такого пептиду, корисну міру, яка, як повідомлялося, добре корелює з антигенністю і імуногенністю (дивіться, наприклад, патент США № 4554101). Заміна амінокислот, що мають подібні значення гідрофільності, може приводити до одержання пептидів, які зберігають біологічну активність, наприклад імуногенність, як відомо в даній галузі. В одному аспекті заміни здійснюють, використовуючи амінокислоти, що мають значення гідрофільності, які відрізняються одне від одного в межах 2. І на індекс гідрофобності, і на значення гідрофільності амінокислот впливає конкретний бічний ланцюг такої амінокислоти. Зрозуміло, що відповідно до такого спостереження заміни амінокислот, які сумісні з біологічною функцією, залежать від відносної подібності амінокислот і, зокрема, бічних ланцюгів таких амінокислот, як виявлено по гідрофобності, гідрофільності, заряду, розміру й інших властивостях. Термін "варіант" також включає поліпептиди або їх фрагменти, що були по-різному процесовані, наприклад в результаті протеолізу, фосфорилування або іншої посттрансляційної модифікації, але ще зберігають біологічну активність і/або реактивність відносно антигену, наприклад здатність зв'язуватися з VEGF і/або DLL4. Термін "варіант" охоплює фрагменти варіанта, якщо не визначене інше. Варіант може бути на 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 89, 88, 87, 86, 85, 84, 83, 82, 81, 80, 79, 78, 77, 76 або 75% ідентичним послідовності дикого типу. I. Створення зв’язувальних білків Пропонуються зв’язувальні білки, здатні зв'язувати два різних антигени, і способи їх одержання. Зв’язувальний білок може бути створений з використанням різних методик. Також пропонуються експресуючі вектори, клітина-хазяїн і способи створення зв’язувального білка. A. Створення вихідних моноклональних антитіл Варіабельні домени зв’язувального DVD-білка можуть бути одержані з вихідних антитіл (Ат), включаючи поліклональні Ат і моноклональні Ат (мАт), здатні зв'язувати антигени, що представляють інтерес. Такі антитіла можуть бути такими, що зустрічаються в природі, або можуть бути створені з використанням методики рекомбінації. Фахівцю в даній галузі добре відомо багато способів одержання антитіл, включаючи, але без обмеження, методики на основі гібридом, спосіб одержання антитіл з відібраних лімфоцитів (SLAM), використання фагового, дріжджового дисплея або дисплея на основі злиття РНК-білок або іншої бібліотеки, імунізацію тварини, відмінної від людини, що має щонайменше деякі локуси імуноглобуліну людини, і одержання химерних, CDR-прищеплених і гуманізованих антитіл. Дивіться, наприклад, публікацію патенту США № 20090311253 A1. Варіабельні домени також можуть бути одержані з використанням методик дозрівання афінності. B. Критерії відбору вихідних моноклональних антитіл Пропонується варіант, що включає в себе відбір вихідних антитіл з щонайменше однією або декількома властивостями, необхідними в молекулі зв’язувального DVD-білка. В одному варіанті необхідною властивістю є один або декілька параметрів антитіла, таких як, наприклад, антигенна специфічність, афінність відносно антигену, потенційна активність, біологічна функція, упізнавання епітопа, стабільність, розчинність, ефективність продукування, імуногенність, фармакокінетика, біодоступність, перехресна тканинна реактивність або зв'язування ортологічних антигенів. Дивіться, наприклад, публікацію патенту США № 20090311253. C. Молекули зв’язувальних білків 25 UA 111306 C2 5 10 15 20 25 У різних варіантах зв’язувальний білок може бути сконструйований так, щоб два різних варіабельних домени легкого ланцюга (VL) із двох різних вихідних моноклональних антитіл були зв'язані в тандемі безпосередньо або через лінкер способами одержання рекомбінантної ДНК, з наступним константним доменом легкого ланцюга CL. Подібним чином, важкий ланцюг містить два різних варіабельних домени важкого ланцюга (VH), зв'язаних у тандемі безпосередньо або через лінкер, з наступним константним доменом CH1 і Fc-областю (креслення). У різних варіантах варіабельні домени можуть бути одержані з використанням методики рекомбінації ДНК із вихідних антитіл, створених будь-яким зі способів, описаних у даній публікації. В одному варіанті варіабельний домен є варіабельним доменом важкого або легкого ланцюга миші. В іншому варіанті варіабельний домен є CDR-прищепленим або гуманізованим варіабельним доменом важкого або легкого ланцюга. В одному варіанті варіабельний домен є варіабельним доменом важкого або легкого ланцюга людини. У різних варіантах лінкерна послідовність може являти собою одну амінокислоту або поліпептидну послідовність. В одному варіанті вибір лінкерних послідовностей оснований на аналізі кристалічної структури декількох молекул Fab. Існує природне гнучке зв'язування між варіабельним доменом і константним доменом CH1/CL у структурі молекули Fab або антитіла. Таке природне зв'язування звичайно містить приблизно 10-12 амінокислотних залишків, серед яких 4-6 залишків з C-кінця V-домену і 4-6 залишків з N-кінця домену CL/CH1. У деяких варіантах зв’язувальні DVD-білки створюють, використовуючи N-кінцеві 5-6 амінокислотних залишків або 11-12 амінокислотних залишків CL або CH1 як лінкер в легкому ланцюзі і важкому ланцюзі, відповідно. N-кінцеві залишки доменів CL або CH1, зокрема перші 5-6 амінокислотних залишків, можуть приймати конформацію петлі без строгих вторинних структур і тому можуть діяти як гнучкі лінкери між двома варіабельними доменами. N-кінцеві залишки доменів CL або CH1 є природним подовженням варіабельних доменів, оскільки вони є частиною послідовностей Ig, і тому їх використання великою мірою мінімізує будь-яку імуногенність, що потенційно виникає через лінкери і сполуки. У різних варіантах зв’язувальні білки, розкриті в даному описі, містять щонайменше один лінкер, що містить одну або декілька послідовностей SEQ ID NO:1-38 (таблиця 1). В одному варіанті X2 означає Fc-область. В іншому варіанті X2 означає варіант Fc-області. 30 Таблиця 1 Список лінкерних послідовностей SEQ ID NO: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Послідовність astkgpsvfplap astkgp ggggsg GGGGSGGGGS GGGGSGGGGSGGGG tvaapsvfifpp tvaap ggggsg GGSGGGGSG GGSGGGGSGgggS ggSgg GGSGGGGSGggS AKTTPKLEEGEFSEAR AKTTPKLEEGEFSEARV AKTTPKLGG SAKTTPKLGG SAKTTP RADAAP RADAAPTVS SEQ ID NO: 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 Послідовність RADAAAAGGPGS RADAAAA SAKTTPKLEEGEFSEARV ADAAP ADAAPTVSIFPP TVAAP TVAAPSVFIFPP QPKAAP QPKAAPSVTLFPP AKTTPP AKTTPPSVTPLAP akttap akttapsvyplap GGGGSGGGGSGGGGS GENKVEYAPALMALS GPAKELTPLKEAKVS GHEAAAVMQVQYPAS TVAAPSVFIFPPTVAAPSVFIFPP ASTKGPSVFPLAPASTKGPSVFPLAP Інші лінкерні послідовності можуть включати будь-яку послідовність будь-якої довжини, одержану з домену CL/CH1, але не всі залишки домену CL/CH1; наприклад перші 5-12 амінокислотних залишків домену CL/CH1. В іншому прикладі лінкери легкого ланцюга можуть 26 UA 111306 C2 5 10 15 20 25 30 35 40 45 50 55 бути вибрані з Cκ або Cλ; і лінкери важкого ланцюга можуть бути одержані з CH1 будь-якого ізотипу, включаючи Cγ1, Cγ2, Cγ3, Cγ4, Cα1, Cα2, Cδ, Cε і Cμ. Лінкерні послідовності також можуть бути одержані з інших білків, таких як Ig-подібні білки (наприклад, TCR, FcR, KIR); основані на G/S послідовності (наприклад, повтори G4S); одержані із шарнірної області послідовності і інші природні послідовності з інших білків. Інші лінкерні послідовності можуть включати будь-яку послідовність будь-якої довжини, що містить повтори G/S (наприклад, послідовність, що містить повтори мотиву GGGS) або будь-які інші пептидні лінкери. В одному варіанті константний домен зв'язують із двома зв'язаними варіабельними доменами з використанням методики рекомбінації ДНК. В одному варіанті послідовність, що містить зв'язані варіабельні домени важкого ланцюга, зв'язують з константним доменом важкого ланцюга, і послідовність, що містить зв'язані варіабельні домени легкого ланцюга, зв'язують з константним доменом легкого ланцюга. В одному варіанті константні домени являють собою константні домени важкого ланцюга людини і константні домени легкого ланцюга людини, відповідно. В одному варіанті важкий ланцюг DVD додатково зв'язують з Fc-областю. Fcобласть може являти собою Fc-область з нативною послідовністю або варіант Fc-області. В іншому варіанті Fc-область являє собою Fc-область людини. В іншому варіанті Fc-область включає Fc-область з IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE або IgD. В одному варіанті розкрите антитіло, або його функціональний антигензв’язувальний фрагмент, що включає антитіло, яке має функціональну ділянку зв'язування для одного з антигенів-мішеней, перерахованих у таблиці 2, і містить спарену область VH і VL, вибрану з пар, перерахованих у таблиці 2, або містить області CDR таких областей VH і VL. Наприклад, антитіло може містити області VH і VL з таблиці 2, що утворюють функціональну ділянку зв'язування для DLL4. В одному варіанті у функціональному антигензв’язувальному фрагменті зберігаються області варіабельного домену (наприклад, області CDR, взяті зі спарених послідовностей VH і VL, зазначених у таблиці 2), достатні для зв'язування антигену-мішені. Функціональний антигензв’язувальний фрагмент може включати гуманізоване, повністю людське, верблюдизоване, одноланцюжкове, химерне, синтетичне, рекомбінантне, гібридне, мутантне, зі зворотними мутаціями або CDR-прищеплене антитіло або Fab, F(ab’)2, Fv, scFv, Fd, dAb, VHH (також називане наноантитілом) або інший фрагмент антитіла, що зберігає функцію зв'язування антигену, включаючи біспецифічні або поліспецифічні антитіла. В одному варіанті пропонується зв’язувальний білок, що містить варіабельні домени, вибрані з доменів, зазначених у таблиці 2. В одному варіанті зв’язувальний білок містить перший ланцюг і другий ланцюг і дві функціональних зв’язувальних ділянки, що описані вище, і при цьому перший і другий ланцюги зв’язувального білка утворюють дві функціональних зв’язувальних ділянки для одного або декількох антигенів-мішеней, перерахованих у таблиці 2. В одному варіанті кожна функціональна зв’язувальна ділянка містить спарені послідовності VH і VL, вибрані з пар, перерахованих у таблиці 2 (наприклад, спарені послідовності VH і VL, що утворюють ділянку зв'язування для DLL4), або містять області CDR з таких областей VH і VL. У деяких варіантах перший ланцюг містить першу послідовність VH і другу послідовність VH, вибрані з таблиці 2, або містить послідовності CDR з таких послідовностей VH, і другий ланцюг містить першу послідовність VL і другу послідовність VL, вибрані з таблиці 2, або містить послідовності CDR з таких послідовностей VL. В інших варіантах розподіл VH-VL у першій або другій ділянці зв'язування є перехресним між двома ланцюгами, так що кожен ланцюг містить домен VH з однієї ділянки зв'язування і домен VL з іншої ділянки зв'язування, при цьому зберігаються дві функціональні зв’язувальні ділянки. В одному варіанті два поліпептиди DVD важкого ланцюга і два поліпептиди DVD легкого ланцюга об'єднані з утворенням зв’язувального DVD-білка. У таблиці 2 перераховані амінокислотні послідовності областей VH і VL ілюстративних антитіл, застосовних для лікування захворювання. В одному варіанті пропонується DVD, що містить щонайменше дві з областей VH і/або VL, перерахованих у таблиці 2, у будь-якій орієнтації, при цьому щонайменше одна з послідовностей VH і/або VL являє собою послідовність SEQ ID NO:39 або SEQ ID NO:40. У деяких варіантах VD1 і VD2 вибрані незалежно. Послідовності доменів VH і VL, наведені нижче, містять області, що визначають комплементарність (CDR), і каркасні послідовності. У деяких варіантах одна або декілька таких CDR і/або каркасних послідовностей замінені без втрати функції іншими CDR і/або каркасними послідовностями зі зв’язувальних білків, які, як відомо в даній галузі, зв'язуються з таким же антигеном. 27 UA 111306 C2 Таблиця 2 Список амінокислотних послідовностей областей VH і VL анти-DLL4- і анти-VEGF-антитіл для створення зв’язувальних білків, включаючи полівалентні зв’язувальні білки (послідовності CDR зазначені жирним шрифтом) Унікальний SEQ ID ідентифікацій-ний номер NO: АВТ Область білка 39 h1A11.1 DLL4 VH 40 h1A11.1 DLL4 VL 41 Av 42 Av 43 AB285VH VEGF VH (послідов-ність 2) 44 AB285VL VEGF VL (послідов-ність 2) 45 AB288VH VEGF VH (послідов-ність 3) 46 AB288VL VEGF VL (послідов-ність 3) 47 AB305VH VEGF VH (послідов-ність 4) 48 AB305VL VEGF VL (послідов-ність 4) 49 AB308VH VEGF VH (послідов-ність 5) 50 AB308VL VEGF VL (послідов-ність 5) 51 AB318VH VEGF VH (послідов-ність 6) 52 AB318VL VEGF VL (послідов-ність 6) 53 AB333VH VEGF VH (послідов-ність 7) 54 AB333VL VEGF VL (послідов-ність 7) VEGF VH (послідов-ність 1) VEGF VL (послідов-ність 1) Послідовність 1234567890123456789012345678901234567890 evqlvesggglvqpggslrlscaasgftfsnfpmawvrqapgkgle wvatisssdgttyyrdsvkgrftisrdnaknslylqmnslraedtavy ycargyynspfaywgqgtlvtvss diqmtqspsslsasvgdrvtitcrasediysnlawyqqkpgkapklliy dtnnladgvpsrfsgsgsgtdftltisslqpedfatyycqqynnypptfgqg tkleikr evqlvesggglvqpggslrlscaasgytftnygmnwvrqapgkgle wvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyyca kyphyygsshwyfdvwgqgtlvtvss diqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpGkapkvliy ftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtk veikr EVTLRESGPALVKPTQTLTLTCTASGYTFTNYGM NWVRQPPGKGLEWVGWINTYTGEPTYAADFKRR FTFSLDTSKSQAVLTMTNMDPVDTATYYCAKYPHY YGSSHWYFDVWGQGTTVTVSS DIVMTQSPDSLAVSLGERATINCSASQDISNYLNW YQQKPGQAPKVLIYFTSSLHSGVPDRFSGSGSGTD FTLTISSLQAEDVAVYYCQQYSTVPWTFGGGTKVEIKR EVQLVQSGTEVKKPGESLKISCKASGYTFTNYGMNW VRQMPGKGLEWVGWINTYTGEPTYAADFKRQFTFSL DTSFSTAFLQWSSLKASDTAMYYCAKYPHYYGSSHW YFDVWGQGTMVTVSS EIVMTQSPATLSVSPGERATLSCSASQDISNYLNWYQ QKPGQAPRVLIYFTSSLHSDVPARFSGSGSGTEFTLTIS SLQSEDFAVYYCQQYSTVPWTFGQGTRLEIKR EVQLLESGGGLVQPGGSLRLSCAASGYTFTNYGMNW VRQAPGKGLEWVGWINTYTGEPTYAADFKRRFTFSLD TSKSTAYLQMNSLRAEDTAVYYCAKYPHYYGSSHWYF DVWGQGTLVTVSS EIVMTQSPGTLSLSPGERATLSCSASQDISNYLNWYQQK PGQAPRVLIYFTSSLHSGVPDRFSGSGSGTDFTLTISRLE PEDFAVFYCQQYSTVPWTFGQGTKVEIKR EVQLVESGGGLVQPGRSLRLSCAASGYTFTNYGMNWV RQAPGKGLEWVGWINTYTGEPTYAADFKRRFTFSLDTA KSSAYLQMNSLRAEDTAVYYCAKYPHYYGSSHWYFDV WGQGTLVTVSS DIQMTQSPSSLSASVGDRVTITCSASQDISNYLNWYQQ KPGKAPKVLIYFTSSLHSGVPSRFSGSGSGTDFTLTISSL QPEDVATYYCQQYSTVPWTFGQGTKVEIKR EVQLVESGGGLVQPANSLKLSCAASGYTFTNYGMNWV RQSPKKGLEWVGWINTYTGEPTYAADFKRRFTFSLDTA KSTAYLQMDSLRSEDTATYYCAKYPHYYGSSHWYFD VWGQGVLVTVSS DIRMTQSPASLSASLGETVNIECSASQDISNYLNWYQQ KPGKAPQVLIYFTSSLHSGVPSRFSGSGSGTQFSLKINS LQSEDVATYYCQQYSTVPWTFGGGTKLELKR QVQLQQSGAELMKPGASVKLSCKATGYTFTNYGMNWV KQRPGHGLEWVGWINTYTGEPTYAADFKRKFTFTLDTS SSTAYIQLISLTTEDSAIYYCAKYPHYYGSSHWYFDVWGQ GTLLTVSA DILMTQSPAILSVSPGERVSFSCSASQDISNYLNWYQQ RTNGAPRVLIYFTSSLHSGVPSRFSGGGSGTDFTLSINS VESEDIADYYCQQYSTVPWTFGAGTKLELKR 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-vegf/dll4 dual variable domain immunoglobulins and uses thereof
Автори англійськоюHickson, Jonathan, A., Haasch, Deanna, L., Gupta, Supriya, Chari, Ravi, Zamiri, Camellia, Gu, Jijie, Ambrosi, Dominic, J., Lappe, Susan, E., Li, Yingchun, Naumovski, Louie, Cao, Xianhua
Назва патенту російськоюАнти-vegf/dll4-иммуноглобулин с двойными вариабельными доменами и его применение
Автори російськоюХиксон Джонатан А., Хааш Дианна Л., Гупта Суприя, Чари Рави, Замири Камеллия, Гу Цзицзе, Амбрози Доминик Дж., Лэпп Сьюзан Э., Ли Инчунь, Наумовски Луи, Цао Сяньхуа
МПК / Мітки
МПК: C07K 16/18, C07K 16/46, C07K 16/22, A61K 39/395
Мітки: варіабельними, подвійними, доменами, застосування
Код посилання
<a href="https://ua.patents.su/122-111306-anti-vegf-dll4-imunoglobulin-z-podvijjnimi-variabelnimi-domenami-i-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Анти-vegf/dll4-імуноглобулін з подвійними варіабельними доменами і його застосування</a>
Попередній патент: Конденсовані лактами арилу та гетероарилу
Наступний патент: Балістичний лазерний гравіметр з індукційно-динамічною катапультою для симетричного способу вимірювання прискорення вільного падіння
Випадковий патент: Спосіб лікування пульмогенної артеріальної гіпертензії у хворих на хронічні обструктивні захворювання легень