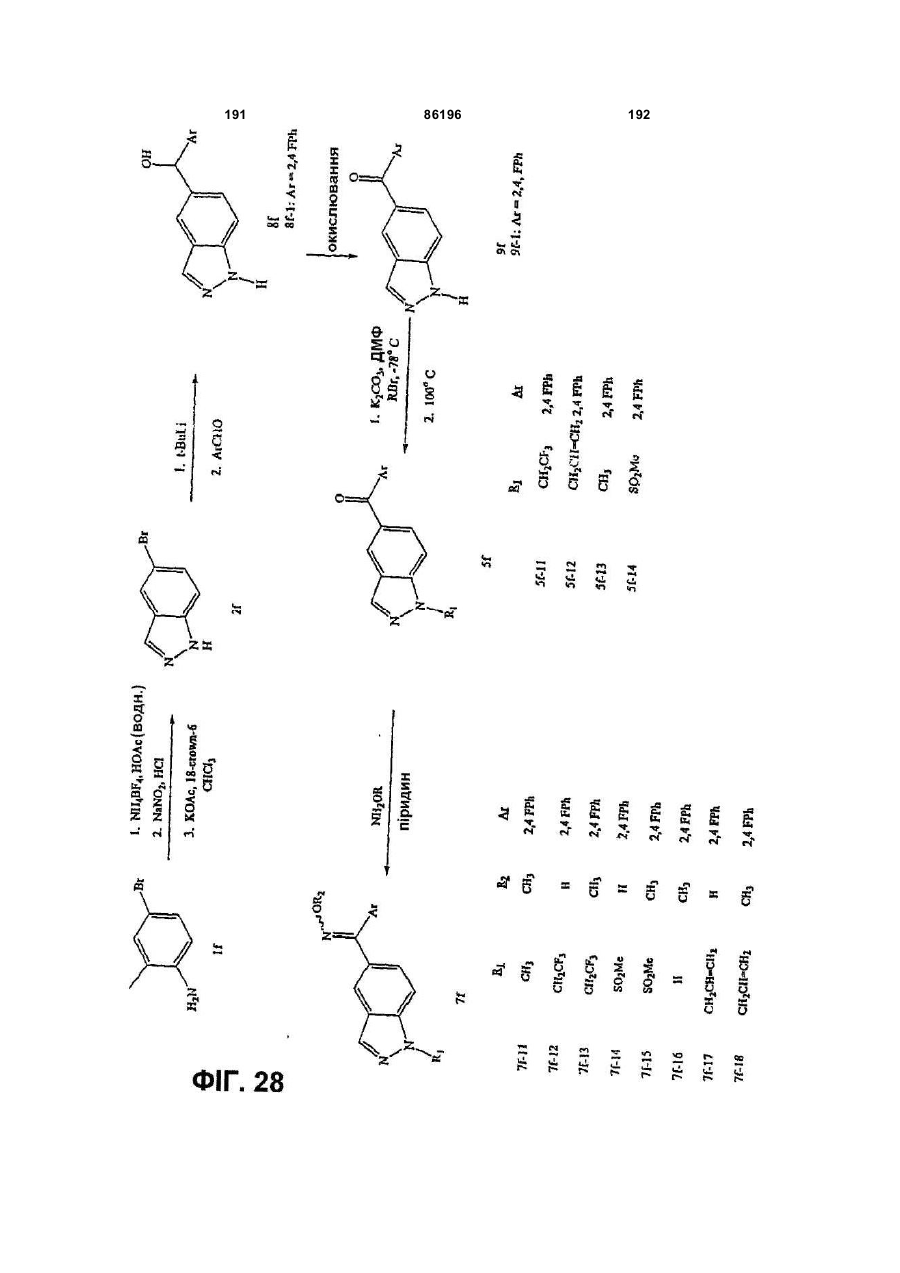
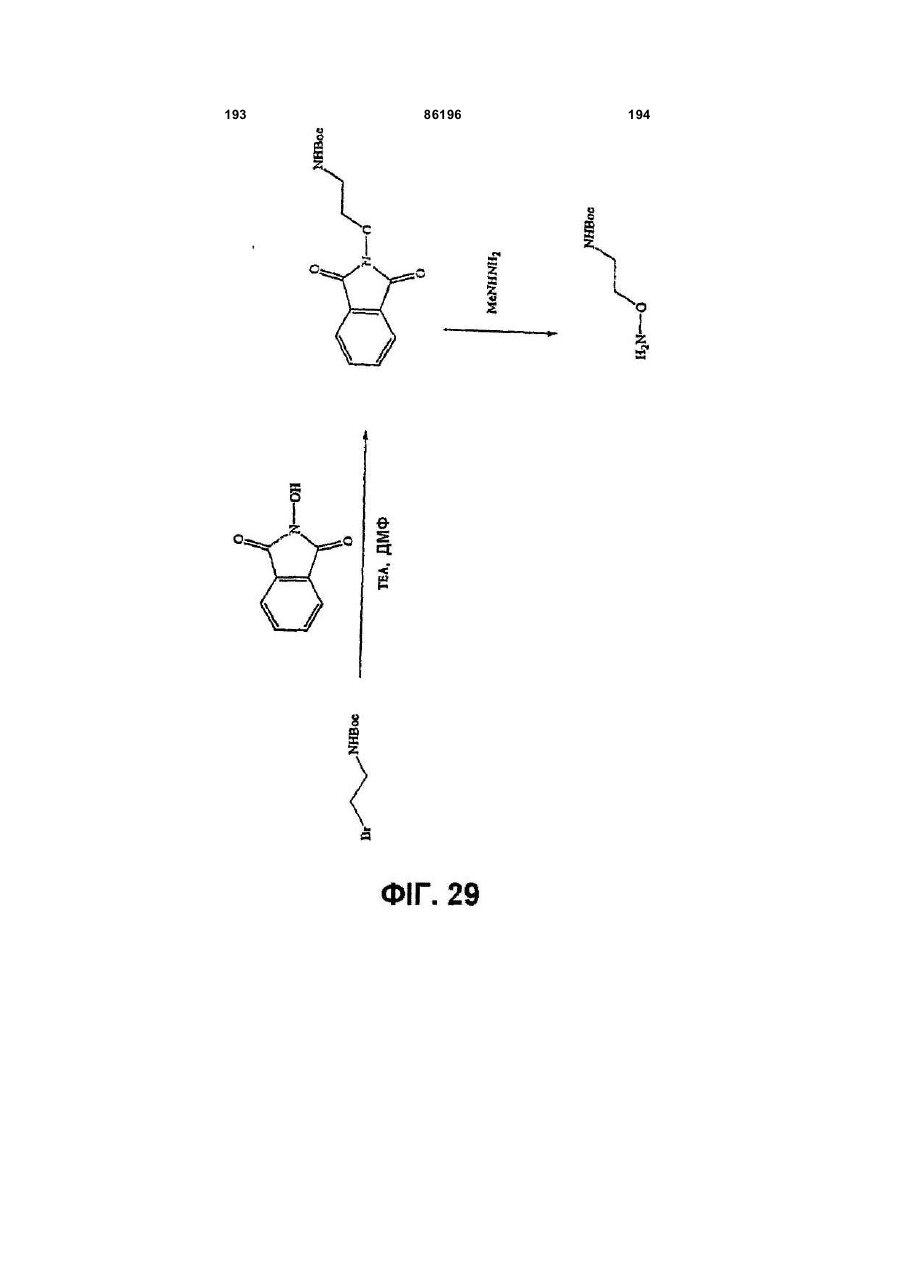
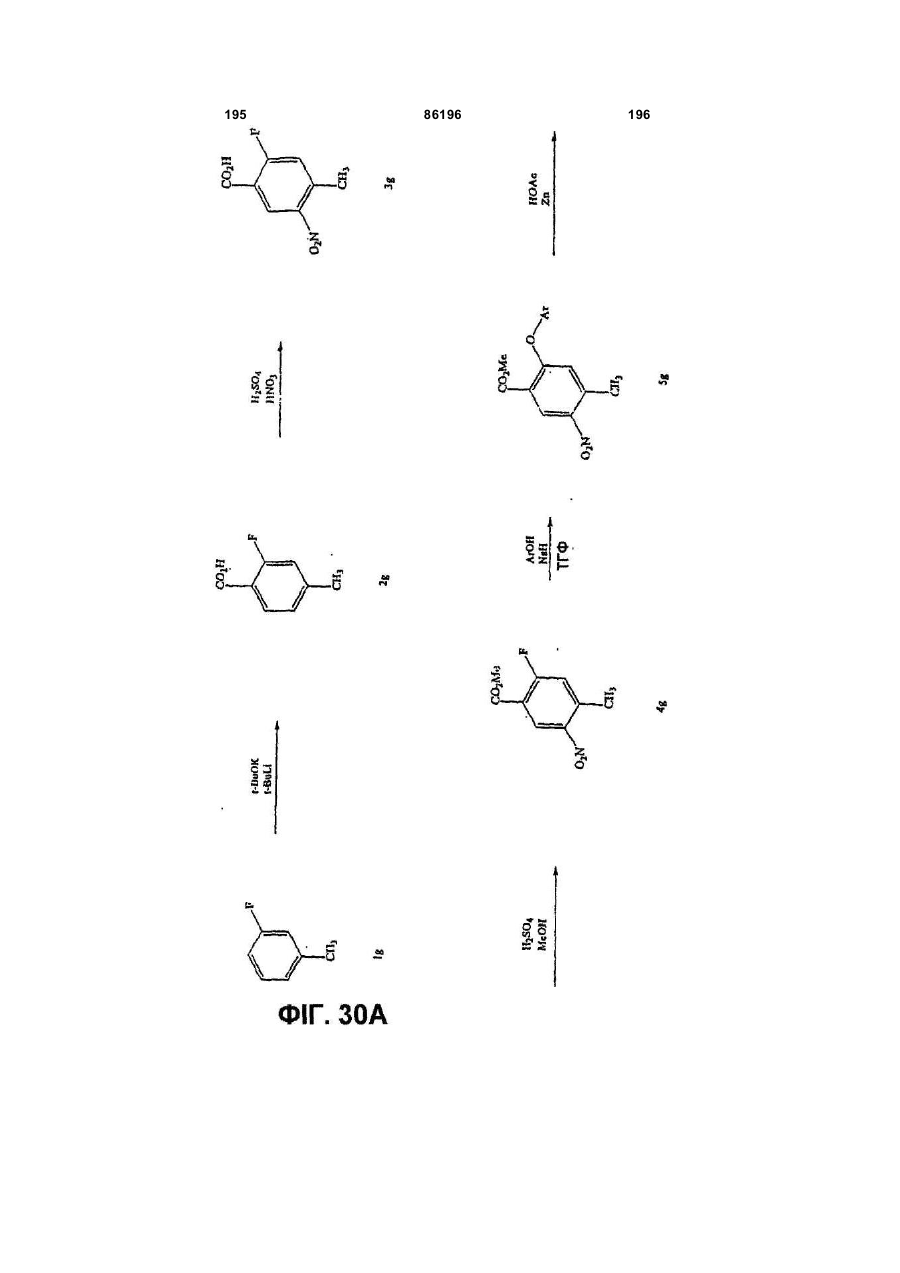
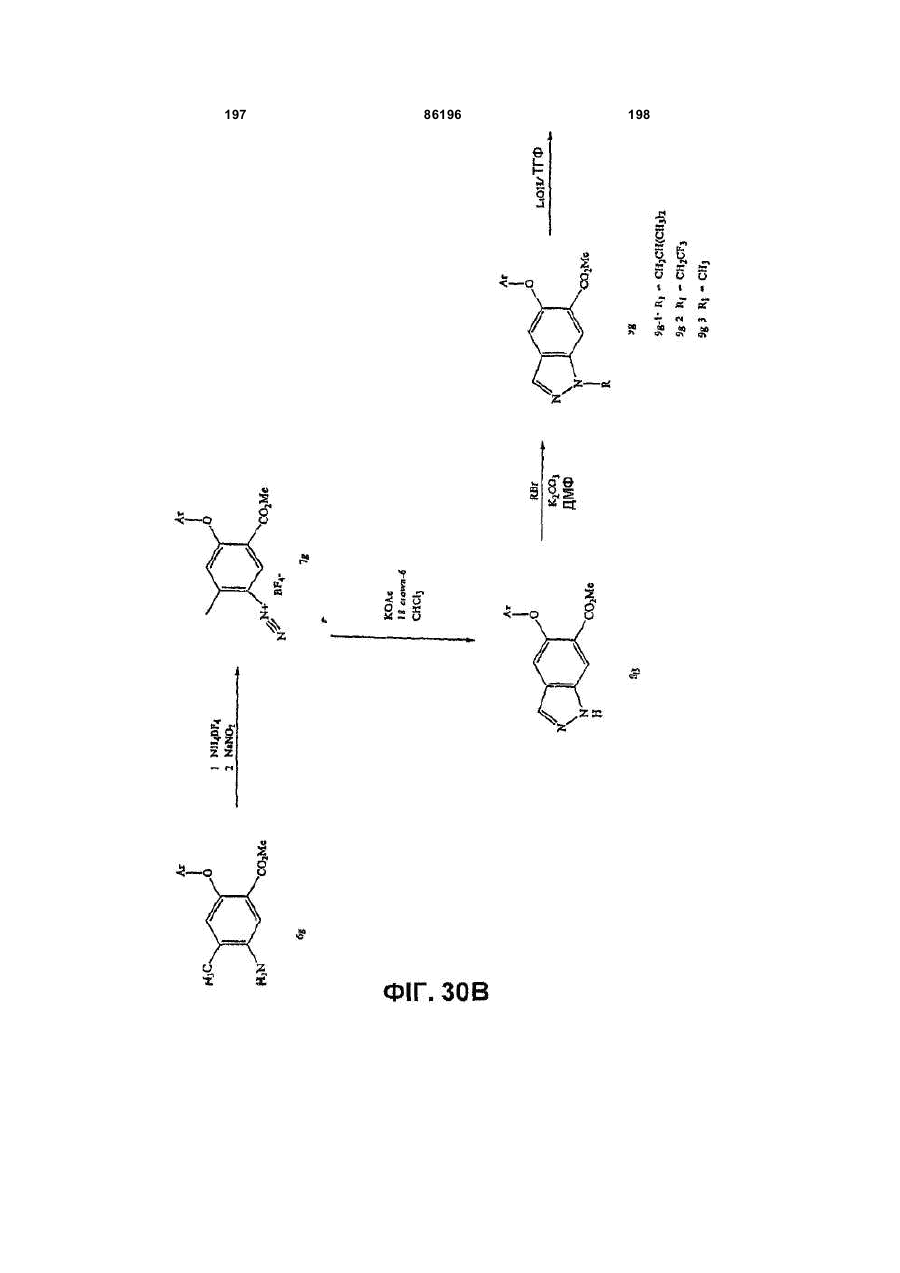
Похідні індазолу як інгібітори р38 та їх застосування
Номер патенту: 86196
Опубліковано: 10.04.2009
Автори: Мареска Дейвід А., Ріцці Джеймз, Гарві Даррен, Мансон Марк, Рао Чанг, Гроунберг Роберт, Кім Юнбу, Кім Ганхеок, Родрігес Марта, Балачарі Деван, Вайгерз Гай
Формула / Реферат
1. Сполука, вибрана з такої сукупності сполук:
амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
[5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-іл]морфолін-4-ілметанон;
[5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-іл]-(4-метилпіперазин-1-іл)-метанон;
(1-бензилпіперидин-4-іл)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(2-бензиламіноетил)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(2-піперидинілетил)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(2-піролідин-1-ілетил)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(3-морфолін-4-ілпропіл)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(3-диметиламінопропіл)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(2-диметиламіноетил)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
метил-(1-метилпіперидин-4-іл)амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
[3-(метилфеніламіно)пропіл]амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
трет-бутилестер 3-{[5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбоніл]аміно}-піролідин-1-карбонової кислоти;
5-(4-флуорофенокси)-1-(2,2,2-трифлуороетил)-1Н-індазол-6-карбонової кислоти (2-диметиламіноетил)амід;
(2-диметиламіноетил)амід 5-(4-флуорофенокси)-1-метил-1Н-індазол-6-карбонової кислоти;
(2-диметиламіноетил)амід 5-(4-флуорофеноксі)-1Н-індазол-6-карбонової кислоти;
метилестер 4-аміно-2-{[5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбоніл]аміно}бутирової кислоти;
метилестер 4-аміно-2-{[5-(4-флуорофенокси)-1-(2,2,2-трифлуороетил)-1Н-індазол-6-карбоніл]аміно}бутирової кислоти;
метилестер 4-аміно-2-{[5-(4-флуорофенокси)-1-метил-1Н-індазол-6-карбоніл]аміно}бутирової кислоти;
(S)-N-(4-aміно-1-гідроксибутан-2-іл)-5-(4-флуорофенокси)-1-ізобутил-1Н-індазол-6-карбоксамід;
(S)-метил 2-(5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбоксамідо)-4-(диметиламіно)бутаноат;
(S)-5-(2,4-дифлуорофенокси)-N-(4-(диметиламіно)-1-гідроксибутан-2-іл)-1-ізобутил-1Н-індазол-6-карбоксамід;
(1-гідроксиметил-3-ізопропіламінопропіл)амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(S)-2-{[5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбоніл]аміно}-4-диметиламінобутирова кислота;
(1-гідроксиметил-3-піперидин-1-ілпропіл)амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(3-диметиламіно-1-диметилкарбамоїлпропіл)амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(3-диметиламіно-1-метилкарбамоїлпропіл)амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(1-карбамоїл-3-диметиламінопропіл)амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
[1-(2-диметиламіноетил)-2-гідрокси-2-метилпропіл]амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
{1-гідроксиметил-3-[(2-метоксіетил)метиламіно]пропіл}амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
[3-диметиламіно-1-(2-гідроксіетилкарбамоїл)пропіл]амід (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти;
(3-диметиламінопропіл)амід 5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-сульфонової кислоти;
(S)-метил 2-(5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-сульфонамідо)-4-(диметиламіно)бутаноат;
[2-(1-метилпіролідин-2-іл)етил]амід 5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-сульфонової кислоти і
(2-диметиламіноетил)амід 5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-сульфонової кислоти.
2. Сполука за п. 1, яка відрізняється тим, що є
(1-карбамоїл-3-диметиламінопропіл)амідом (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти.
3. Сполука за п. 1, яка відрізняється тим, що є (2-диметиламіноетил)амідом 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти.
4. Сполука за п. 1, яка відрізняється тим, що є
(S)-метил 2-(5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбоксамідо)-4-(диметиламіно)бутаноатом.
5. Сполука за п. 1, яка відрізняється тим, що є
(S)-5-(2,4-дифлуорофенокси)-N-(4-(диметиламіно)-1-гідроксибутан-2-іл)-1-ізобутил-1Н-індазол-6-карбоксамідом.
6. Сполука за п. 1, яка відрізняється тим, що є
(1-гідроксиметил-3-ізопропіламінопропіл)амідом (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти.
7. Сполука за п. 1, яка відрізняється тим, що є
(3-диметиламіно-1-диметилкарбамоїлпропіл)амідом (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти.
8. Сполука за п. 1, яка відрізняється тим, що є
(3-диметиламіно-1-метилкарбамоїлпропіл)амідом (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6-карбонової кислоти.
9. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-8 разом з фармацевтично прийнятним розріджувачем або носієм.
10. Застосування сполуки за будь-яким з пп. 1-8 у виготовленні медикаменту для лікування стану, опосередкованого р38.
11. Застосування за п. 10, яке відрізняється тим, що зазначеним станом, опосередкованим р38, є запальна хвороба, аутоімунна хвороба, деструктивний розлад кістки, проліферативний розлад, інфекційна хвороба, вірусна хвороба або нейродегенеративна хвороба.
Текст
1. Сполука, вибрана з такої сукупності сполук: амід 5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6карбонової кислоти; [5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6іл]морфолін-4-ілметанон; [5-(4-флуорофеноксі)-1-ізобутил-1Н-індазол-6-іл](4-метилпіперазин-1-іл)-метанон; (1-бензилпіперидин-4-іл)амід 5-(4-флуорофеноксі)1-ізобутил-1Н-індазол-6-карбонової кислоти; (2-бензиламіноетил)амід 5-(4-флуорофеноксі)-1ізобутил-1Н-індазол-6-карбонової кислоти; (2-піперидинілетил)амід 5-(4-флуорофеноксі)-1ізобутил-1Н-індазол-6-карбонової кислоти; 2 (19) 1 3 86196 4 [2-(1-метилпіролідин-2-іл)етил]амід 5-(2,4метилестер 4-аміно-2-{[5-(4-флуорофенокси)-1дифлуорофеноксі)-1-ізобутил-1Н-індазол-6метил-1Н-індазол-6-карбоніл]аміно}бутирової киссульфонової кислоти і лоти; (2-диметиламіноетил)амід 5-(2,4(S)-N-(4-aміно-1-гідроксибутан-2-іл)-5-(4дифлуорофеноксі)-1-ізобутил-1Н-індазол-6флуорофенокси)-1-ізобутил-1Н-індазол-6сульфонової кислоти. карбоксамід; 2. Сполука за п. 1, яка відрізняється тим, що є (S)-метил 2-(5-(2,4-дифлуорофеноксі)-1-ізобутил(1-карбамоїл-3-диметиламінопропіл)амідом (S)-51Н-індазол-6-карбоксамідо)-4(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6(диметиламіно)бутаноат; карбонової кислоти. (S)-5-(2,4-дифлуорофенокси)-N-(4-(диметиламіно)3. Сполука за п. 1, яка відрізняється тим, що є (21-гідроксибутан-2-іл)-1-ізобутил-1Н-індазол-6диметиламіноетил)амідом 5-(4-флуорофеноксі)-1карбоксамід; ізобутил-1Н-індазол-6-карбонової кислоти. (1-гідроксиметил-3-ізопропіламінопропіл)амід (S)4. Сполука за п. 1, яка відрізняється тим, що є 5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6(S)-метил 2-(5-(2,4-дифлуорофеноксі)-1-ізобутилкарбонової кислоти; 1Н-індазол-6-карбоксамідо)-4(S)-2-{[5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н(диметиламіно)бутаноатом. індазол-6-карбоніл]аміно}-45. Сполука за п. 1, яка відрізняється тим, що є диметиламінобутирова кислота; (S)-5-(2,4-дифлуорофенокси)-N-(4-(диметиламіно)(1-гідроксиметил-3-піперидин-1-ілпропіл)амід (S)1-гідроксибутан-2-іл)-1-ізобутил-1Н-індазол-65-(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6карбоксамідом. карбонової кислоти; 6. Сполука за п. 1, яка відрізняється тим, що є (3-диметиламіно-1-диметилкарбамоїлпропіл)амід (1-гідроксиметил-3-ізопропіламінопропіл)амідом (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н(S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Ніндазол-6-карбонової кислоти; індазол-6-карбонової кислоти. (3-диметиламіно-1-метилкарбамоїлпропіл)амід 7. Сполука за п. 1, яка відрізняється тим, що є (S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Н(3-диметиламіно-1індазол-6-карбонової кислоти; диметилкарбамоїлпропіл)амідом (S)-5-(2,4(1-карбамоїл-3-диметиламінопропіл)амід (S)-5дифлуорофеноксі)-1-ізобутил-1Н-індазол-6(2,4-дифлуорофеноксі)-1-ізобутил-1Н-індазол-6карбонової кислоти. карбонової кислоти; 8. Сполука за п. 1, яка відрізняється тим, що є [1-(2-диметиламіноетил)-2-гідрокси-2(3-диметиламіно-1-метилкарбамоїлпропіл)амідом метилпропіл]амід (S)-5-(2,4-дифлуорофеноксі)-1(S)-5-(2,4-дифлуорофеноксі)-1-ізобутил-1Нізобутил-1Н-індазол-6-карбонової кислоти; індазол-6-карбонової кислоти. {1-гідроксиметил-3-[(29. Фармацевтична композиція, яка містить сполуку метоксіетил)метиламіно]пропіл}амід (S)-5-(2,4за будь-яким з пп. 1-8 разом з фармацевтично дифлуорофеноксі)-1-ізобутил-1Н-індазол-6прийнятним розріджувачем або носієм. карбонової кислоти; 10. Застосування сполуки за будь-яким з пп. 1-8 у [3-диметиламіно-1-(2виготовленні медикаменту для лікування стану, гідроксіетилкарбамоїл)пропіл]амід (S)-5-(2,4опосередкованого р38. дифлуорофеноксі)-1-ізобутил-1Н-індазол-611. Застосування за п. 10, яке відрізняється тим, карбонової кислоти; що зазначеним станом, опосередкованим р38, є (3-диметиламінопропіл)амід 5-(2,4запальна хвороба, аутоімунна хвороба, деструктидифлуорофеноксі)-1-ізобутил-1Н-індазол-6вний розлад кістки, проліферативний розлад, інсульфонової кислоти; фекційна хвороба, вірусна хвороба або нейроде(S)-метил 2-(5-(2,4-дифлуорофеноксі)-1-ізобутилгенеративна хвороба. 1Н-індазол-6-сульфонамідо)-4(диметиламіно)бутаноат; Ця заявка заявляє пріоритет [заявки США №10/688849, поданої 15 жовтня 2003 року, і заявки США №10/378164, поданої 3 березня 2003 року]; обидві вони включені у всій своїй цілісності у цей документ посиланням. Винахід стосується нових інгібіторів кінази МАР р38 і пов'язаних з ними кіназ, а також фармацевтичних композицій, що містять ці інгібітори, і способів приготування цих інгібіторів. Вони можуть бути використані для лікування запалення, остеоартриту, ревматоїдного артриту, псоріазу, хвороби Крона, запальної кишкової хвороби, раку, автоімунних хвороб і інших опосередкованих цитокінами хвороб. Численні хронічні і гострі запальні стани пов'язують з надмірним продукуванням запальних цитокінів. Такі цитокіни включають (і не лише) фактор альфа некрозу пухлини (TNF-α), інтерлейкін 1 бета (IL-1β), інтерлейкін 8 (IL-8) і інтерлейкін 6 (IL6). Ревматоїдний артрит (RA) є хронічною хворобою, з TNF-α і IL-1β якої пов'язаний її початок і прогресуюче руйнування кістки і суглоба. Нещодавно схвалені терапевтичні лікування RA включають застосування розчинного антагоніста рецептора TNF-α (етанерцепт) і рецептора IL-1 (анакінра). Ці лікування ґрунтуються на блокування здатності відповідних цитокінів зв'язуватись з їх природними рецепторами. Зараз досліджуються 5 86196 6 р38 у реакції клітин на IL-1 і TNF була досліджена інші способи лікування хвороб, опосередкованих на ряді клітинних систем, що мають відношення до цитокінами. Один з таких методів включає інгібузапальної реакції, з використанням піридинілімідавання сигнального шляху, який регулює синтез і зольного інгібітору: ендоте-ліальні клітини і IL-8 продукування прозапальних цитокінів, подібних до [Hashimoto, S., et al., J. Pharmacol. Exp. Ther., 293: р38. 370-375 (2001)], фібробластів і IL-6/GM-CSF/PGE2 Р38 (також CSBP або RK) є кіназою протеїну, [Beyaert, R., et al., EMBOJ., 15: 1914-1923 (1996)], активованого серин/треонін-мітогеном (МАРК), нейтрофилів і IL-8 [Albanyan, Ε. Α., et al., Infect. яка, як було показано, регулює прозапальні цитоImmun., 68: 2053-2060 (2000)], макрофагів і IL-1 кіни. Р38 була вперше ідентифікована як кіназа, [Caivano, M. and Cohen, P., J. Immunol., 164: 3018яка стала тирозином, фосфорилованим у моноци3025 (2000)] і клітин гладких м'язів і RANTES [Maтах миші після обробки ліпополісахаридом (LPS). ruoka, S., et al., Am. J. Respir. Crit. Care Med, 161: Зв'язок між р38 і реакцією клітин на цитокіни впе659-668 (1999)]. Руйнівні ефекти багатьох хворобрше був встановлений [Saklatval J., et al., Cell, 78: ливих станів викликаються надпродукцією проза1039-1049 (1994)], який показав, що IL-1 активує пальних цитокінов. Здатність інпбіторів р38 регукаскад кінази протеїну, що призводить до фосфолювати цю надпродукцію робить їх прекрасними рилювання протеїну теплового шоку, Hsp27, як кандидатами для агентів, що змінюють хворобу. варіант, кіназою 2 протеїну, активованого активоІнгібітори р38 є активними у відношенні багаваним мітогеном протеїном (кіназа-2 МАРКАР). тьох загальновизнаних моделей захворювань і Аналіз пептидних послідовностей, отриманих з демонструють позитивні ефекти в ряді стандарточищеної кінази, вказує, що вона є спорідненою з них тваринних моделей запалення, включаючи р38 МАРК, активованою LPS у моноцитах миші індукований колагеном артрит щурів [Jackson, J. [Han, J., et al., Science, 265: 808-811 (1994)]. Також R., et al., J. Pharmacol. Exp. Ther., 284: 687-692 було показано, що р38 МАРК сама була активова(1998)]; адъювантно індукований артрит щурів на розташованою вище за потоком кіназою у від[Badger, Α. Μ., et al., Arthritis Rheum., 43: 175-183 повідь на різні клітинні стреси, включаючи піддан(2000); Badger, A. M., et al., J. Pharmacol. Exp. ня дії УФ опромінювання і осмотичний шок, а тип Ther., 279: 1453-1461 (1996)]; і індукований каргекінази, що безпосередньо фосфорилює Hsp27, був наном набряк лапи у мишей [Nishikori, Т., et al., підтверджений МАРКАР кіназою-2 [Rouse, J., et al., Eur. J. Pharm., 451: 327-333 (2002)]. У цих тваринCell, 78: 1027-1037 (1994)]. У подальшому дослідних моделях було показано, що молекули, що блоники у SmithKline Beecham показали, що р38 МАРК кують дію р38, є ефективними в інгібуванні резорє молекулярною ціллю для ряду піридинілімідазобції кістки, запалення і інших імунних патолопй і льних сполук, що інгібували продукування TNF з запальних патологій Таким чином, безпечний і збуджених LPS моноцитів людини [Lee, J., et al., ефективний інгібітор р38 дасть спосіб лікування Nature, 372: 739-746]. Це стало ключовим відкритзахворювань, що підточують здоров'я ι які можна тям і привело до розробки цілого ряду селективрегулювати модулюванням сигнального шляху них інгібіторів МАРК р38 і з'ясуванню їхньої ролі у р38, подібного, але не обмеженого цим, РА. цитокіновій передачі сигналів. Інгібітори р38 добре відомі фахівцям у даній В даний час відомо, що численні форми МАРК області техніки. Огляди ранніх інгібіторів сприяли р38 (α, β, γ, δ), кожна з яких кодується окремим встановленню залежності активності від структури, геном, утворюють частину кіназного каскаду, важливої для поліпшення активності як in vitro, так включеного у реакцію клітин на різні стимули, і in vivo [Salituro, Ε. G., et al., Current Medicinal включаючи осмотичний стрес, УФ світло і опосеChemistry, 6: 807-823 (1999) і Foster, M. L, et al., редковані цитокіном події. Вважають, що ці чотири Drug News Perspect, 13: 488-497 (2000)]. Більш ізоформи р38 регулюють різні аспекти внутрішньосучасні огляди сконцентровані на структурному клітинної передачі сигналів. Його активація є часрізноманітті нових інгібіторів, досліджуваних як тиною каскаду сигнальних подій, що приводять до інгібітори р38 [Boehm, J D. and Adams, J. L, Exp. синтезу і продукування прозапальних цитокінов, Opin. Ther. Patents, 10: 25-37 (2000)]. У цьому виподібних TNF-α. Р38 діє шляхом фосфорилювания наході описана нова група заміщених 2-аза-[4,3,0]субстратів, розташованих у каскаді нижче, які біциклічних гетероароматичних сполук як інгібітовключають інші кінази і транскрипційні фактори. На рів р38, які є корисними у лікуванні запалення, моделях in vitro і in vivo було показано, що агенти, остеоартриту, ревматоїдного артриту, автоімунних що інгібують кіназу р38, блокують продукцію цитозахворювань ι у лікуванні інших опосередкованих кінов, включаючи (але без обмеження) TNF-α, IL-6, цитокіном захворювань. IL-8 і IL-1β [Adams, J. L, et al., Progress in Medicinal У винаході запропоновано сполуки, способи Chemistry, 38:1-60 (2001)]. одержання цих сполук і фармацевтичні композиції, Було показано, що моноцити периферичної що містять їх і інгібують р38 альфа і пов'язані з крові (МПК), при стимуляції ліпополіса-харидом ним опосередковані р38 явища, наприклад, інгібу(ЛПС) in vitro, експресують і секретують прозапавання продукування цитокінов. Такі сполуки, які льні цитокіни. Інгібітори р38 ефективно блокують звичайно називають 2-аза-[4,3,0]біциклічними геці дія, коли МПК попередньо обробляють такими тероароматичними кільцями, є корисними як терасполуками перед тим, як стимулювати за допомопевтичні агенти відносно захворювань, які можна гою ЛПС [Lee, J. С, et al., Int. J. Immunopharmacol., лікувати інгібуванням сигнального шляху р38. Вза10: 835-843 (1988)]. Ефективність інгібіторів р38 на галі винахід стосується інгібіторів р38 загальної тваринних моделях запального захворювання Формули І: прискорила дослідження лежачих в основі механізмів, які могли б пояснити дію цих інгібіторів. Роль 7 86196 I де Y - C,N; W є С, Ν, S або О, за умови, що W є N, S або О, коли Υ є С, і W є С або Ν, коли Υ є Ν; U - СН або Ν, V - C-E aбo N; X - О, S, SO, SO2, NR7, С=О, CHR7, -C=NOR1, C=CHR1 або CHOR1; R1 - H, PO3H2, SO3H2, алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл або Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-цикпоалкіл, Zn-гетероциклоалкіл або Zn-Ar1 можуть бути заміщені або не заміщені; Ζ - алкілен, який має від 1 до 4 атомів карбону, або алкенілен або алкінілен, кожний з яких має від 2 до 4 атомів карбону, причому зазначені алкілен, алкенілен або алкінілен можуть бути заміщені або не заміщені; R7 - Η або заміщений або незаміщений метил; Аr1 - заміщений або незаміщений арил або гетероарил; А - Н, ОН, захисна групу для аміно, Zn-NR2R3, Zn-NR2(C=O)R2, Zn-SO2R2, Zn-SOR2, Zn-SR2, ZnOR2, Zn-(C=O)R2, Zn-(C=O)OR2, Zn-O-(C=O)R2, алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-цикпоалкіл, Zn-гетероциклоалкіл або Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Znгетероциклоалкіл або Zn-Ar1 можуть бути заміщені або не заміщені; R2 і R3 незалежно є Н, ОН, захисною групою для аміно, захисною групою для спирту, захисною групою для кислоти, захисною групою для тіо, алкілом, алілом, алкенілом, алкінілом, гетероалкілом, гетероалілом, гетероалкенілом, гетероалкінілом, алкокси, гетероалкокси, Zn-циклоалкілом, Znгетероциклоалкілом або Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл або Zn-Ar1 можуть бути заміщені або не заміщені, або R2 разом з R3 і N утворюють насичений або частково ненасичений гетероцикл, що має один або більше гетероатомів, причому зазначений гетероцикл може бути заміщений або незаміщений і може бути конденсований з ароматичним кільцем; В - Η, ΝΗ2 або заміщений або незаміщений метил; Ε - Η, Zn-NR2R3, Zn-(C=O)R4, Zn-(C=O)R5, Zn5 NR (C=O)R5, Zn-O(C=O)R5, Zn-OR5, Zn-SO2R5, ZnSOR5, Zn-SR5, Zn-NH(C=O)NHR5 або R5; R4 - заміщена або незаміщена природна або неприродна амінокислота, захищена природна або неприродна амінокислота, NH(CHR6) (CH2)mOR5, де m є цілим числом від 1 до 4, або NR2R3; 8 R5 - Η, ОН, захисна група для аміно, захисна група для спирту, захисна група для кислоти, захисна група для тіо, алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Znгетероциклоалкіл або Zn-Ar1, де зазначені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл або Zn-Ar1 можуть бути заміщені або не заміщені; R6 - природний амінокислотний бічний ланцюг, Zn-NR2R3, Zn-OR5, Zn-SO2R5, Zn-SOR5 або Zn-SR5; і n дорівнює 0 або 1, за умови, що коли В є Н, і А є CH=CH-R8, де R8 є заміщеним або незаміщеним алкілом, алкенілом, циклоалкілом, гетероциклоалкілом, арилом або гетероарилом, то Х-Аr1 є замісником, а Аr1 не є заміщеним або незаміщеним арилом, гетероарилом, NH-алкілом, NH-циклоалкілом, NHгетероцикпоалкілом, NH-арилом, NHгетероарилом, NH-алкокси або NH-діалкіламід, коли X є О, S, C=O, S=O, C=CH2, CO2, NH або N(С1-C8алкіл). Винахід також стосується фармацевтично прийнятних проліків, фармацевтично активних метаболітів і фармацевтично прийнятних солей сполуки Формули І. Також описані способи одержання сполук Формули І. II В іншому втіленні винахід стосується сполук загальної Формули II: де А, В, X і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули III: III де А, В, Χ, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули IV: IV де А, В, Χ, Ε і Аr1 є такими, як визначено вище, за умови, що коли В є Н, і А є СН=СН-R8, де R8 є заміщеним або незаміщеним алкілом, алкенілом, циклоалкілом, гетероциклоалкілом, арилом або гетероарилом, то Х-Аr1 є замісником, а Аr1 не є заміщеним або незаміщеним арилом, гетероарилом, NH-алкілом, NH-циклоалкілом, NHгетероциклоалкілом, ΝΗ-арилом, NHгетероарилом, NH-алкокси або NH-діалкіламідом, 9 86196 коли X є О, S, C=O, S=O, C=CH2, CO2, NH або N(С1-С8алкіл). У ще одному втіленні винахід стосується сполук загальної Формули V: V де А, X, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули VI: 10 XI де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули XII: XII VI де А, В, Е, R1 і Аr1 є такими, як визначено ви де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули VII: У ще одному втіленні винахід стосується сполук загальної Формули XIII: VII XIII де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули VIII: де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується етерних сполук загальної Формули XIV: VIII XIV де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули IX: IX де А, В, X, Аr1, R2 і R3 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули XV: ще. XV де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули X: X де А, В, Ε і Аr1 є такими, як визначено вище. У ще одному втіленні винахід стосується сполук загальної Формули XI: де А, В, X і Аr1 є такими, як визначено вище, a R і R13 незалежно є алкілом, алілом, алкенілом, алкінілом, циклоалкілом, гетероцикпоалкілом, арилом або гетероарилом, причому зазначені алкіл, аліл, алкеніл, алкініл, циклоалкіл, гетероциклоалкіл, арил або гетероарил можуть бути заміщені або не заміщені. У ще одному втіленні винахід стосується сполук загальної Формули XVI: 12 11 86196 12 же бути заміщеним або незаміщеним і може бути конденсований з ароматичним кільцем; Ζ - алкілен, що має від 1 до 4 атомів карбону, або алкенілен або алкінілен, кожний з яких має від XVI 2 до 4 атомів карбону, причому зазначені алкілен, алкенілен або алкінілен можуть бути заміщені або не заміщені; n дорівнює 0 або 1; U - CRc абo N; де А, В, X, R2, R3 і Аr1 є такими, як визначено V - CRc абo N; вище. R0 - Η, F, СІ, метил або заміщений метил; У ще одному втіленні винахід стосується споX - О, S, SO, SO2, NR5, C=O, CH2, CH2Zn-OH лук загальної Формули XVII: або C=NORd; R5 - Η, метил або заміщений метил; Rd - Η, РО3Н2, SO3H2, алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероал-кеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, де зазначений циклоалкіл є насиченим або частXVII ково ненасиченим, Zn-гетероциклоалкіл, де зазначений гетероциклоалкіл є насиченим або частково ненасиченим, або Zn-Ar1, де зазначений алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероапкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-цикпоалкіл, Zn-гетероциклоалкіл і Zn-Ar1 модe Y – CR1, O, S aбo NR2; 3 4 жуть бути заміщені або не заміщені; W - CR , Ν, NR , S або О, за умови, що W є G, Н, J і Τ незалежно є N або CRz, за умови, NR4, S або О, коли Υ с CR1, і W є CR3 або Ν, коли 2 що, коли будь-які з зазначених G, Н, J і Τ є Ν, то Υ є NR ; загальна кількість G, Н, J або Т, що є N, не переR3 - Η, NH2, F, СІ, метил або заміщений метил; вищує 2; R4 - Η, або метил, або заміщений метил; Rz - Η, F, СІ, Br, CF3, OR6, SR6, нижчий (С1R1 і R2 незалежно є Н, ОН, захисною групою С4)алкіл, CN або NR6R7; для аміно, Zn-NRaRb Zn-NRa(C=O)Rb, Zn-SO2Ra, Zna a a a a R6 і R7 незалежно є Η, CF3, нижчим (С1SOR , Zn-SR , Zn-OR , Zn-(C=O)R , Zn-(C=O)OR , С4)алкілом або нижчим (С1-С4)гетероалкілом; Zn-O-(C=O)Ra, алкілом, алілом, алкенілом, алкініQ - -NR8CONH-, -NHCO-, -NR8SO2NH-, -NHSO2лом, гетероалкілом, гетероалілом, гетероалкені, -CONR11-; лом, геіероалкінілом, алкокси, гетероалкокси, ZnR8 - Η або нижчий (С1-С4)алкіл; цикпоалкілом, де зазначений цикпоалкіл є насичеR11 - Η або нижчий (С1-С4)алкіл; ним або частково ненасиченим, ZnRx - -(CR9R10)m-, -O(CR9R10)m-, NH(CR9R10)mгетероциклоалкілом, де зазначений гетероциклоаабо -S(CR9R10)m-, за умови, що Q є -CONR11-, коли лкіл є насиченим або частково ненасиченим, або 1 Rx є -O(CR9R10)m-, -NH(CR9R10)m- або -S(CR9R10)m-; Zn-Ar , причому зазначені алкіл, аліл, алкеніл, алR9 і R10 незалежно є Н або нижчим алкілом, кініл, гетероалкіл, гетероаліл, гетероалкеніл, гетеабо R9 і R10 разом з атомами, до яких вони приєдроалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, нані, утворюють циклоалкільне кільце, що може Zn-гетероциклоалкіл і Zn-Ar1 можуть бути заміщені бути насиченим або частково ненасиченим; або не заміщені; m дорівнює 1 - 3; Аr1 - арил або гетероарил, кожний з яких може Ry - Η, ΡΟ3Η, захисна група для аміно, захисна бути заміщений абo незаміщений; група для оксигену, алкіл, аліл, алкеніл, алкініл, Ra і Rb незалежно є Н, ОН, захисною групою гетероалкіл, гетероаліл, гетероапкеніл, гетероалдля аміно, захисною групою для спирту, захисною кініл, алкокси, гетероалкокси, Zn-циклоалкіл, де групою для кислоти, захисною групою для сульзазначений циклоалкіл є насиченим або частково фуру, алкілом алілом, алкенілом, алкінілом, гетененасиченим, Z n-гетероциклоалкіл, де зазначений роалкілом, гетероалілом, гетероалкенілом, гетегетероциклоалкіл є насиченим або частково ненароалкінілом, алкокси, гетероалкокси, Znсиченим, або Zn-Ar2, причому зазначені алкіл, аліл, цикпоалкілом, де зазначений цикпоалкіл є насичеалкеніл, алкініл, гетероалкіл, гетероаліл, гетероалним або частково ненасиченим Znкеніл, гетероалкініл, алкокси, гетероалкокси, Znгетероциклоалкілом, де зазначений гетероциклоациклоалкіл, Zn-Ar2 і Zn-гетероциклоалкіл можуть лкіл є насиченим або частково ненасиченим або бути заміщені або не заміщені; Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алАr2 - арил або гетероарил, кожний з яких може кініл, гетероглкіл, гетероаліл, гетероалкеніл, гетебути заміщеним або незаміщеним, причому зазнароалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, чене заміщення може здійснюватись 1-3 замісниZn-гетероциклоалкіл і Zn-Ar1 можуть бути заміщені ками, незалежно обраними з F, СІ, Br, CF3, CN, або не заміщені, алкілу, алілу, алкенілу, алкінілу, гетероалкілу, геабо Ra і Rb разом з атомами, до яких вони притероалілу, гетероалкені-лу, гетероалкінілу, -OR12, єднані, утворюють насичене або частково ненасиSR12, -SO2R12, -SO2NR13R12, NR13SO2R12, Ζnчене гетероциклічне кільце, яке має один або циклоалкілу, де зазначений циклоалкіл є насичебільш гетероатомів, а зазначений гетероцикл моним або частково ненасиченим, Zn 13 86196 14 вній тварині вводять ефективну кількість сполуки гетероциклоалкіл, де зазначений гетероциклоалкіл Формули I-XVII, або її фармацевтично прийнятної є насиченим або частково ненасиченим, або Znсолі, або проліків, що розщеплюються in vivo. Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, У ще одному аспекті винахід стосується спогетероалкіл, гетероаліл, гетероалкеніл, гетероалсобу інгібування продукування таких цитокінов, як кініл, алкокси, гетероалкокси, Zn-циклоалкіл, ZnTNF-α, IL-1, IL-6 i IL-8, при якому теплокровній твагетероциклоалкіл і Zn-Ar1 можуть бути заміщені рині вводять ефективну кількість сполуки Формул або не заміщені; I-XVII, або її фармацевтично прийнятної солі, або R12 і R13 незалежно є Н, алкілом, алілом, алкепроліків, що розщеплюються in vivo. нілом, алкінілом, гетероалкіл ом, гете-роалілом, У ще одному аспекті винахід стосується спогетероалкенілом, гетероалкінілом, Znсобу забезпечення ефекту інгібування кінази р38, циклоалкілом, де зазначений циклоалкіл є насичепри якому теплокровній тварині вводять ефективним або частково ненасиченим, Znну кількість сполуки Формул I-XVII, або її фармагетероциклоалкіл, де зазначений гетероциклоалкіл цевтично прийнятної солі, або проліків, що розщеє насиченим або частково ненасиченим, або Znплюються in vivo. Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, У ще одному аспекті винаходу запропоновано гетероалкіл, гетероаліл, гетероалкеніл, гетероаллікування або попередження стану, опосередковакініл, алкокси, гетероалкокси, Zn-циклоалкіл, Znного р38, при якому людині або тварині, що стражгетероциклоалкіл і Zn-Ar1 можуть бути заміщені дає від нього, вводять кількість сполуки, ефективабо не заміщені; ну для лікування або попередження зазначеного де, коли Аr2 заміщений -SO2NR13R12, то R12 і 13 стану, опосередкованого р38, або фармацевтичну R можуть утворювати циклоалкільне кільце або композицію, що містить зазначену сполуку Формул гетероциклоалкільне кільце, яке може бути заміI-XVII, або її фармацевтично прийнятну сіль, або щене або незаміщене, причому зазначене заміпроліки, що розщеплюються in vivo. Стан, опосещення може здійснюватись замісниками, обраниредкований р38, який можна лікувати способами ми з алкілу, алілу, алкенілу, алкінілу, гетероалкілу, згідно з винаходом, включає запальні захворювангетероалілу, гетероалкенілу, гетероалкінілу, алконя, автоімунні захворювання, деструктивні кісткові кси, гетероалкокси, Zn-циклоалкіл, де зазначений порушення, проліферативні порушення, інфекційні циклоалкіл є насиченим або частково ненасичезахворювання, вірусні захворювання або нейроденим, -COR12, -SO2R12, Zn-гетероциклоалкіл, де загенеративні захворювання. значений гетероциклоалкіл є насиченим або частСполуки згідно з винаходом можуть також бути ково ненасиченим, або Zn-Ar1, причому зазначені використані як засоби попередження загибелі кліалкіл, аліл, алкеніл, алкініл, гетероалкіл, гетеротин і гіперплазії і, отже, їх можна застосовувати аліл, гетероалкеніл, гетероалкініл, алкокси, гетедля лікування або попередження реперфузії/ішемії роалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл і Znпри інсульті, серцевих нападах і гіпоксії органів. Ar1 можуть бути заміщені або не заміщені; Сполуки згідно з винаходом можуть також бути де, коли Q є -CONR11-, то Ry разом з R11 додавикористані для попередження індукованої тромтково є циклоалкільним кільцем або гетероциклобіном агрегації тромбоцитів. алкільним кільцем, яке може бути заміщене або Сполуки згідно з винаходом переважно можна незаміщене групами, обраними з алкілу, алілу, застосовувати у комбінації з іншими відомими теалкенілу, алкінілу, гетероалкілу, гетероалілу, гетерапевтичними агентами. роалкенілу, гетероалкінілу, алкокси, гетероалкокВинахід також стосується фармацевтичних си, Zn-циклоалкілу, насиченого або частково ненакомпозицій, що містять ефективну кількість агента, сиченого, Zn-гетероциклоалкілу, насиченого або обраного з сполук Формул I-XVII або їх фармацевчастково ненасиченого, Zn-Ar1, -COR14 або тично прийнятних проліків, фармацевтично активSO2R14, причому зазначені алкіл, аліл, алкеніл, них метаболітів або фармацевтично прийнятних алкініл, гетероалкіл, гетероаліл, гетероалкеніл, солей. гетероалкініл, алкокси, гетероалкокси, ZnДодаткові переваги і нові ознаки цього винациклоалкіл, Zn-гетероциклоалкіл, Zn-Ar1, -COR14 і ходу частково будуть наведені в описі винаходу SO2R14 можуть бути заміщені або не заміщені; і нижче, і частково стануть очевидними для фахівR14 - алкіл, аліл, алкеніл, алкініл, гетероалкіл, ців у даній області техніки після гетероаліл, гетероалкеніл, гетероалкініл, Znвивчення цього опису, або них можуть стати циклоалкіл, де зазначений циклоалкіл є насиченим зрозумілими при реалізації винаходу. Переваги або частково ненасиченим, Zn-гетероциклоалкіл, винаходу можуть бути уяснені і реалізовані за донасичений або частково ненасичений, або Zn-Ar1, помогою агентів, комбінацій, композицій і способів, причому зазначені алкіл, аліл, алкеніл, алкініл, конкретно визначених у Формулі винаходу. гетероалкіл, гетероаліл, гетероалкеніл, гетероалСупроводжуючі креслення, включені в цей докініл, алкокси, гетероалкокси, Zn-циклоалкіл, Znкумент, утворюють частину опису винаходу і ілюсгетероциклоалкіл і Zn-Ar1 можуть бути заміщені трують необмежуючі втілення винаходу, разом з або не заміщені. описом пояснюючи принципи винаходу. У кресУ ще одному аспекті винахід стосується споленнях: лук, що інгібують продукування таких цитокінов, як Фіг.1 - реакційна схема синтезу сполук, що TNF-α, IL-1, IL-6 і IL-8, включаючи сполуки Формул мають загальну структуру 7а; I-XVII. Фіг.2 - реакційна схема синтезу сполуки 14а; У ще одному аспекті винахід стосується споФіг.3 - реакційна схема синтезу сполуки 15а; собу лікування захворювань або медичних станів, Фіг.4 - реакційна схема синтезу сполуки 16а; опосередкованих цитокінами, при якому теплокро 15 86196 16 Фіг.47 - реакційна схема синтезу сполуки 32t; Фіг.5 - реакційна схема синтезу сполуки 17а; Фіг.48 - реакційна схема синтезу сполуки 4u; Фіг.6 - реакційна схема синтезу сполуки 18а; Фіг.49 - реакційна схема синтезу сполук 7v і 8v; Фіг.7 - реакційна схема синтезу сполук, що і мають загальну структуру 7b; Фіг.50 - реакційна схема синтезу сполуки 10v. Фіг.8 - реакційна схема синтезу сполуки 8b; Фіг.51 - реакційна схема синтезу сполуки 17d. Фіг.9А-9В - реакційна схема синтезу сполуки Фіг.52 - реакційна схема синтезу сполуки 20d. 10с; Фіг.53 - реакційна схема синтезу сполуки 26d. Фіг.10 - реакційна схема синтезу сполуки 14с; Фіг.54 - реакційна схема синтезу сполуки 47d. Фіг.11 - реакційна схема синтезу сполуки 17с; Сполуки Формул І-XVIІ згідно з винаходом моФіг.12 - реакційна схема синтезу сполук, що жуть бути використані для інгібування р38 альфа і мають загальну структуру 18с; пов'язаних з ним опосередкованих р38 явищ, наФіг.13 - реакційна схема синтезу сполуки 26с; приклад, продукування цитокінов. Такі сполуки є Фіг.14А-14В - реакційна схема синтезу сполуки ефективними як терапевтичні агентів при захво34с; рюваннях, які можна лікувати інгібуванням сигнаФіг.15 - реакційна схема синтезу сполуки 38сльного шляху р38. Взагалі винахід стосується спо1; лук загальної Формули І: Фіг.16 - реакційна схема синтезу сполуки 39с; Фіг.17 - реакційна схема синтезу сполуки 40с; Фіг.18 - реакційна схема синтезу сполуки 4d; Фіг.19 - реакційна схема синтезу сполук, що I мають загальну структуру 5d; Фіг.20 - реакційна схема синтезу сполуки 8d; Фіг.21 - реакційна схема синтезу сполуки 10d1; де Y - C,N; Фіг.22 - реакційна схема синтезу сполуки 11dW - С, Ν, S або О, за умови, що W є Ν, S або 1; О, коли Υ є С, і W є С або Ν, коли Υ є Ν; Фіг.23 - реакційна схема синтезу сполуки 13d; U - СН або Ν; Фіг.24А-24В - реакційна схема синтезу сполуки V - C-E aбo N; 8е-1; Χ - О, S, SO, SO2, NR7, C=O, CHR7, -C=NOR1, Фіг.25 - реакційна схема синтезу сполуки 9е; C=CHR1 або CHOR1; Фіг.26 - реакційна схема синтезу сполуки 10еR1 - H, PO3H2, SO3H2, алкіл, аліл, алкеніл, алкі1; ніл, гетероалкіл, гетероаліл, гетероал-кеніл, гетеФіг.27 - реакційна схема синтезу сполук, що роалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, мають загальну структуру 7f; Zn-гетероцикпоалкіл або Zn-Ar1, причому зазначені Фіг.28 - інша реакційна схема синтезу сполук, алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетерощо мають загальну структуру 7f; аліл, гетероалкеніл, гетероалкініл, алкокси, гетеФіг.29 - реакційна схема синтезу проміжного роалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл або карбоксаміду, використаного у синтезі сполук 7f-5 і Zn-Ar1 можуть бути заміщені або не заміщені; 7f-6; Ζ - алкілен, що має від 1 до 4 атомів карбону, Фіг.30А-30С - реакційна схема синтезу сполук, або алкенілен або алкінілен, кожний з яких має від що мають загальну структуру 1g; 2 до 4 атомів карбону, причому зазначені алкілен, Фіг.31 - реакційна схема синтезу сполук, що алкенілен або алкінілен можуть бути заміщені або мають загальну структуру 4f; не заміщені; Фіг.32 - реакційна схема синтезу сполук, що R7 - Η або заміщений або незаміщений метил; мають загальну структуру 5f; Аr1 - заміщений або незаміщений арил або геФіг.33 - інша реакційна схема синтезу сполук, тероарил; що мають загальну структуру 5f; А - Н, ОН, захисна група для аміно, Zn-NR2R3, Фіг.34 - реакційна схема синтезу сполук, що Zn-NR2(C=O)R2, Zn-SO2R2, Zn-SOR2, Zn-SR2, Zn-OR2, мають загальну структуру 2h; Zn-(C=O)R2, Zn-(C=O)OR2, Zn-O-(C=O)R2, алкіл, Фіг.35 - реакційна схема синтезу сполук, що аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гемають загальну структуру 1j; тероалкеніл, гетероалкініл, алкокси, гетероалкокФіг.36 - реакційна схема синтезу сполук, що си, Zn-циклоалкіл, Zn-гетероциклоалкіл або Zn-Ar1, мають загальну структуру 1k; причому зазначені алкіл, аліл, алкеніл, алкініл, Фіг.37 - реакційна схема синтезу сполук, що гетероалкіл, гетероаліл, гетероалкеніл, гетероалмають загальну структуру 1m; кініл, алкокси, гетероалкокси, Zn-циклоалкіл, ZnФіг.38 - реакційна схема синтезу сполуки 6n; гетероциклоалкіл або Zn-Ar1 можуть бути заміщені Фіг.39 - реакційна схема синтезу сполуки 13р; або не заміщені; Фіг.40 - реакційна схема синтезу сполуки 16р; R2 і R3 незалежно є Н, ОН, захисною групою Фіг.41А-В - реакційна схема синтезу сполук 9qдля аміно, захисною групою для спирту, захисною 1 і 9q-2; групою для кислоти, захисною групою для тіо, алФіг.42 - реакційна схема синтезу сполуки 6r-2; кілом, алілом, алкенілом, алкіні-лом, гетероалкіл Фіг.43А-В - реакційна схема синтезу сполуки ом, гетероалілом, гетероапкенілом, гетероалкіні8s-2; лом, алкокси, гетероалкокси, Zn-циклоалкілом, ZnФіг.44 - реакційна схема синтезу сполуки 7t-2; гетероцикпоалкілом або Zn-Ar1, причому зазначені Фіг.45 - реакційна схема синтезу сполуки 26t; алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероФіг.46 - реакційна схема синтезу сполуки 28t; 17 86196 18 Термін "алкенілен" стосується лінійного або аліл, гетероалкеніл, гетероалкініл, алкокси, гетерозгалуженого двовалентного гідрокар-бонового роалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл або радикалу довжиною від двох до дванадцяти атомів Zn-Ar1 можуть бути заміщені або не заміщені, або карбону, який містить щонайменше один подвійR2 разом з R3 і N утворюють насичений або частний зв'язок, де алкеніленовий радикал може бути, ково ненасичений гетероцикл, що має один або як варіант, незалежно заміщений одним або більбільше гетероатомів, може бути заміщений або ше замісниками, описаними тут. Приклади вклюнезаміщений і може бути конденсований з аромачають, але без обмеження, етенілен, пропенілен тичним кільцем; тощо. В - Η, ΝΗ2 або заміщений або незаміщений Термін "алкініл" стосується лінійного або розметил; галуженого одновалентного гідрокарбонового раΕ - Η, Zn-NR2R3, Zn-(C=O)R4, Zn-(C=O)R5, Znдикалу довжиною від двох до дванадцяти атомів NR5(C=O)R5, Zn-O(C=O)R5, Zn-OR5, Zn-SO2RS, Znкарбону, який містить щонайменше один потрійний SOR5, Zn-SRS, Zn-NH(C=O)NHR5 або R5; зв'язок. Приклади включають, але без обмеження, R4 - заміщена або незаміщена природна або етиніл, пропиніл тощо, де алкінільний радикал неприродна амінокислота, захищена природна або може бути, як варіант, незалежно заміщений однеприродна амінокислота, NH(CHR6) (CH2)mOR5, ним або більше замісниками, описаними тут. де m є цілим числом від 1 до 4, або NR2R3; Термін "алкінілен" стосується лінійного або R5 є Н, ОН, захисна група для аміно, захисна розгалуженого двовалентного гідрокарбоновго група для спирту, захисна група для кислоти, зарадикалу довжиною від двох до дванадцяти атомів хисна група для тіо, алкіл, аліл, алкеніл, алкініл, карбону, який містить щонайменше один потрійний гетероалкіл, гетероаліл, гетероал-кеніл, гетероалзв'язок, де алкініленовий радикал може бути, як кініл, алкокси, гетероалкокси, Zn-циклоалкіл, Znваріант, незалежно заміщений одним або більше гетероциклоалкіл або Zn-Ar1, де зазначені алкіл, замісниками, описаними тут. аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, геТермін "аліл" стосується радикалу формули тероалкеніл, гетероалкініл, алкокси, гетероалкокRC=CHCHR, в якій R - алкіл, алкеніл, алкініл, цикси, Zn-циклоалкіл, Zn-гетероциклоалкіл або Zn-Ar1 лоалкіл, гетероциклоалкіл, арил, гетероарил або можуть бути заміщені або не заміщені; будь-який замісник, визначений тут, причому аліл R6 - природний амінокислотний бічний ланцюг, може бути, як варіант, незалежно заміщений одZn-NR2R3, Zn-OR5, Zn-SO2R5, Zn-SOR5 або Zn-SR5; і ним або більше замісниками, описаними тут. n дорівнює 0 або 1, Термін "циклоалкіл" стосується насиченого за умови, що коли В є Н, і А є CH=CH-R8, де R8 або частково ненасиченого циклічного гідрокарбоє заміщений або незаміщений алкіл, алкеніл, цикнового радикалу, який має від трьох до дванадцялоалкіл, гетероциклоалкіл, арил або гетероарил, ти атомів карбону, причому циклоалкіл може бути, то Х-Аr1 є замісником, в якому Аr1 не є заміщеним як варіант, незалежно заміщений одним або більабо незаміщеними арилом гетероарилом, NHше замісниками, описаними тут. Крім того, термін алкілом, NН-циклоалкілом, NH"циклоалкіл" включає біциклічні і трициклічні цикгетероциклоалкілом, NH-арилом, NHлоалкільні структури, які можуть включати насичегетероарилом, NH-алкокси або NH-діалкіламідом, ний або частково ненасичений циклоалкіл, конколи X є О, S, C=O, S=O, C=CH2, CO2, NH або денсований з насиченим або частково N(С1-С8)алкіл). ненасиченим циклоалкільним або гетероциклоалВикористаний тут термін "алкіл" стосується кільним кільцем, або арильним, або гетероарильнасиченого лінійного або розгалуженого однованим кільцем. Приклади циклоалкільних груп вклюлентного гідрокарбонового радикалу довжиною від чають, але без обмеження, цикпопропіл, одного до дванадцяти атомів карбону, в якому циклобутил, циклопентил, циклогексил, циклогепалкільний радикал може бути, як варіант, незалетил тощо. жно заміщений одним або більше замісниками, Термін "гетероалкіл" стосується насиченого описаними нижче. Приклади алкільних груп вклюлінійного або розгалуженого одновалентного гідчають, але без обмеження, метил, етил, n-пропіл, рокарбонового радикалу довжиною від одного до ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, дванадцяти атомів карбону, де щонайменше один пентил, ізо-пентил, трет-пентил, гексил, ізогексил атом карбону, замінений гетероатомом, обраним з тощо. Ν, Ο або S, і де радикал може бути карбоновим "Алкілен" означає лінійний або розгалужений радикалом або гетероатомним радикалом (тобто насичений двовалентний гідрокарбоно-вий радигетероатом може знаходитись в середині або на кал довжиною від одного до дванадцяти атомів кінці цього радикала). Гетероалкільний радикал карбону, наприклад, метилен, етилен, пропілен, 2може бути, як варіант, незалежно заміщений одметилпропілен, пентилен тощо. ним або більше замісниками, описаними тут. ТерТермін "алкеніл" стосується лінійного розгалумін "гетероалкіл" охоплює алкокси- і гетероалкокженого одновалентного гідрокарбонового радикаси-радикали. лу довжиною від двох до дванадцяти атомів карТермін "гетероциклоалкіл" стосується насичебону, який містить щонайменше один подвійний ного або частково ненасиченого циклічного радизв'язок, наприклад, етенілу, пропенілу тощо, де калу довжиною від 3 до 8 кільцевих атомів, в якоалкенільний радикал може бути, як варіант, незаму щонайменше один атом кільця є гетероатомом, лежно заміщений одним або більше замісниками, обраним з нітрогену, оксигену і сульфуру, при описаними тут, і включає радикали, що мають цьому інші атоми кільця є С, а один або більш "цис-" і "транс-" орієнтації або, в іншому варіанті, атомів кільця можуть бути, як варіант, незалежно "Е-" і "Z-" орієнтації. 19 86196 20 залежно заміщений одним або більше замісниказаміщені одним або більше замісниками, описаними, описаними тут. Приклади включають, але без ми нижче і гетероциклоалкільне кільце може бути обмеження, фурил, тієніл, піроліл, піридил, піранасиченим або частково ненасиченим. Радикал золіл, піримідиніл, імідазоліл, піразиніл, індоліл, може бути карбоновим радикалом або гетероатотіофен-2-іл, хіноліл, бензопіраніл, тіазоліл і їх похімним радикалом. "Гетероциклоалкіл" також вклюдні. чає радикали, в яких гетероциклічні радикали конТермін "галоген" означає флуор, хлор, бром денсовані з ароматичними або або йод. гетероароматичними кільцями. Приклади гетероТермін "захисні групи для аміну" стосується циклоал-кільних кілець включають, але без обмеорганічних груп, призначених для захисту атомів ження, піролидин, піперидин, піперазин, тетрагіднітрогену від небажаних реакцій у процесах синтеропіраніл, морфолін, тіоморфолін, гомопіперазин, зу і включає, але без обмеження, бензил, бензилофталімід і їх похідні. ксикарбоніл (CBZ), трет-бутоксикарбоніл (Вос), Термін "гетероалкеніл" стосується лінійного трифлуорацетил тощо. або розгалуженого одновалентного гідрокарбоноТермін "захисні групи спирту" стосується оргавого радикалу довжиною від двох до дванадцяти нічних груп, призначених для захисту спиртових атомів карбону, який містить щонайменше один груп або замісників від небажаних реакцій у проподвійний зв'язок, наприклад, етенілу, пропенілу цесах синтезу і включає, але без обмеження, тощо, де щонайменше один з атомів карбону замі(триметилсиліл)етоксиметил (SEM), трет-бутил, нений гетероатомом, обраним з Ν, Ο або S, і де метоксиметил (MOM) тощо. радикал може бути карбоновим радикалом або Термін "захисні групи сульфуру" стосується гетероатомним радикалом (тобто гетероатом моорганічних груп, призначеним для захисту сульфуже знаходитись в середині або на кінці цього радировмісних груп або замісників від небажаних реаккала). Гетероалкенільний радикал може бути, як цій у процесах синтезу і включає, але без обмеваріант, незалежно заміщений одним або більше ження, бензил, (триметилсиліл)етоксиметил замісниками, описаними тут, і включає радикали, (SEM), трет-бутил, тритил тощо. що мають "цис-" і "транс-" орієнтації або, в іншому Термін "захисні групи кислоти" стосується орваріанті, "E-" і "Z-" орієнтації. ганічних груп, призначеним для захисту кислотних Термін "гетероалкініл" стосується лінійного груп або замісників від небажаних реакцій у проабо розгалуженого одновалентного гідроцесах синтезу, і включає, але без обмеження, бенкарбонового радикалу довжиною від двох до двазил, (триметилсиліл)етоксиметил (SEM), метилнадцяти атомів карбону, який містить щонайменетил і трет-бутилові естери тощо. ше один потрійний зв'язок. Приклади включають, Загалом, різні угруповання або функціональні але без обмеження, етиніл, пропиніл тощо, де щогрупи сполук Формул I-XVII можуть бути, як варінайменше один атом карбону замінений гетероант, заміщені одним або більше замісниками. Приатомом, обраним з Ν, Ο або S, і де радикал може клади придатних для цього замісників включають, бути карбоновим радикалом або гетероатомним але без обмеження, галоген, алкіл, аліл, алкеніл, радикалом (тобто гетероатом може знаходитись в алкініл, гетероалкіл, гетероаліл, гетероалкеніл, середині або на кінці цього радикала). Гетероалкігетероалкініл, алкокси, гетероалкокси, Znнільний радикал може бути, як варіант, незалежно цикпоалкіл, Zn-гетероциклоалкіл, Ζn-OR, Zn-NO2, заміщений одним або більше замісниками, описаZn-CN, Zn-CO2R, Zn-(C=O)R, Zn-O(C=O)R, Zn-Oними тут. алкіл, Zn-OAr, Zn-SH, Zn-SR, Zn-SOR, Zn-SO2R, Zn-SТермін "гетероаліл" стосується радикалів, що Ar, Zn-SOAr, Zn-SO2Ar, арил, гетероарил, Zn-Ar, Znмають формулу RC=CHCHR, в якій R - алкіл, ал(C=O)NR2R3, Zn-NR2R3, Zn-NR(C=O)R Zn-SO2 кеніл, алкініл, циклоалкіл, гетероциклоалкіл, арил, NR2R3, PO3H2, SO3H2, захисні групи для аміну, загетероарил або будь-який замісник, визначений хисні групи для спирту, захисні групи для сульфутут, а щонайменше один атом карбону замінений ру або захисні групи для кислоти, де: гетероатомом, обраним з Ν, Ο або S, і де радикал Ζ - алкілен, що має від 1 до 4 атомів карбону, може бути карбоновим радикалом або гетероатоабо алкенілен або алкінілен, кожний з яких має від мним радикалом (тобто гетероатом може знаходи2 до 4 атомів карбону, причому зазначені алкілен, тись в середині або на кінці цього радикала). Гетеалкенілен або алкінілен можуть бути заміщені або роаліл може бути, як варіант, незалежно не заміщені; заміщений одним або більше замісниками, описаn дорівнює 0 або 1, ними тут. R1, R2 і R3 - алкіл, аліл, алкеніл, алкініл, гете"Арил" означає одновалентний ароматичний роалкіл, гетероаліл, гетероалкеніл, гетероалкініл, гідрокарбоновий моноциклічний радикал з 6-10 алкокси, гетероалкокси, Zn-цикпоалкіл або Znкільцевих атомів або поліцикпічний ароматичний гетероциклоалкіл, і гідрокарбон, як варіант, незалежно заміщений одАr - арил або гетероарил, причому зазначені ним або більше замісниками, описаними тут. алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероБільш конкретно, термін "арил" включає, але без аліл, гетероалкеніл, гетероалкініл, алкокси, гетеобмеження, феніл, 1-нафтил, 2-нафтил і їх похідні. роалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл, Аr, "Гетероарил" означає одновалентний моноциR1, R2 і R3 можуть бути додатково заміщеними або клічний ароматичний радикал з 5-10 кільцевими незаміщеними. атомами або поліциклічний ароматичний радикал, Сполуки згідно з винаходом можуть мати один який у кільці містить один або більше гетероатоабо більше асиметричних центрів; отже, такі спомів, обраних з N, О або S, при цьому інші атоми луки можуть бути отримані у вигляді індивідуалькільця є С. Ароматичний радикал, як варіант, не 21 86196 22 пропіолати, оксалати, малонати, сукцинати, субних (R)- або (S)-стереоізомерів або у вигляді їх ерати, себакати, фумарати, малеати, бутин-1,4сумішей. Якщо не зазначено інше, то мають на діоати, гексин-1,6-діоати, бензоати, хлорбензоати, увазі, що опис або найменування конкретної спометилбензоати, динітробензоати, гідроксибензоалуки в описі і Формулі винаходу включають як інти, метоксибензоати, фталати, сульфонати, ксидивідуальні енантіомери, так і їх суміші, рацемічні лолсульфонати, фенілацетати, фенілпропіонати, або інші. Відповідно, винахід також включає рацефенілбутирати, цитрати, лактати, γмати і розділені енантіомери і діастереомери спогідроксибутирати, гліколати, тартрати, метансульлук Формул I-XVII. Способи визначення стереохімії фонати, пропансульфонати, нафталін-1і розділення стереоізомерів добре відомі [див. обсульфонати, нафталін-2-сульфонати і манделати. говорення у розділі 4 "Advanced Organic Якщо сполука згідно з винаходом є основою, Chemistry", 4-th ed. J. March, John Wiley and Sons, то бажана фармацевтично прийнятна сіль може New York, 1992]. бути отримана будь-яким відомим придатним споКрім сполук Формул I-XVII, винахід також собом, наприклад, обробкою вільної основи неорвключає сольвати, фармацевтично прийнятні проганічною кислотою, наприклад, гідрохлорною кисліки, фармацевтично активні метаболіти і фармалотою, гідробромною кислотою, сульфуровою цевтично прийнятні солі таких сполук. кислотою, нітрогеновою кислотою, фосфорною Термін "сольват" стосується агрегату молекукислотою тощо, або такою органічною кислотою, ли з однією або більш молекулами розчинника. як оцтова кислота, малеїнова кислота, бурштино"Фармацевтично прийнятними проліками" є ва кислота, мигдальна кислота, фумарова кислосполуки, що можуть бути перетворені у фізіологічта, малонова кислота, піровиноградна кислота, них умовах або за допомогою сольволізу у зазнащавлева кислота, гліколева кислота, саліцилова чену сполуку або у фармацевтично прийнятну сіль кислота, піранозидильна кислота, наприклад, глютакої сполуки. куронова кислота або галактуронова кислота, "Фармацевтично активним метаболітом" є фаальфа-гідроксикислота, наприклад, лимонна кисрмакологічно активний продукт, що утворюється в лота або винна кислота, амінокислота, наприклад результаті метаболізму в організмі зазначеної аспарагінова кислота або глутамінова кислота, сполуки або її солі. Метаболіти сполуки можуть ароматична кислота, наприклад, бензойна кислота бути ідентифіковані загальноприйнятими методаабо корична кислота, сульфонова кислота, наприми, відомими фахівцям, а їх активність може бути клад, л-толуолсульфонова кислота або етансульвизначена 30 допомогою тестів, подібних описафонова кислота тощо. ним тут. Якщо сполука згідно з винаходом є кислотою, Проліки і активні метаболіти сполуки можуть то бажана фармацевтично прийнятна сіль може бути ідентифіковані з використанням загальнобути отримана будь-яким придатним способом, прийнятих методів. Є відомими різні форми пролінаприклад, обробкою вільної кислоти такою неорків, а приклади похідних таких проліків описані, ганічною або органічною основою, амін (первиннаприклад, в [a) Design of Prodrugs, edited by Η. ний, вторинний або третинний), гідроксидом лужBundgaard, (Elsevier, 1985) і Methods in ного металу або гідроксидом лужноземельного Enzymology, Vol.42, p.309-396, ed. K. Widder, et al. металу тощо. Ілюстративні приклади придатних (Academic Press, 1985); б) А Textbook of Drug Deсолей включають, але без обмеження, органічні sign and Development, ed. Krogsgaard-Larsen and солі, отримані з амінокислот, наприклад, гліцину і H. Bundgaard, Chapter 5 "Design and Application of аргініну, амонію, первинних, вторинних і третинних Prodrugs", by H. Bundgaard p.113-191 (1991); в) Н. амінів і циклічних амінів, таких як піперидин, морBundgaard, Advanced Drug Delivery Reviews, 8, 1фолін і піперазин, і неорганічні солі натрію, каль38 (1992); г) H. Bundgaard, et al., Journal of Pharmaцію, калію, магнію, марганцю, заліза, міді, цинку, ceutical Sciences, 77: 285 (1988); і д) N. Kakeya, et алюмінію і літію. al., Chem. Pharm. Bull., 32: 692 (1984)]; кожний з Сполуки згідно з винаходом можуть бути цих документів включений в опис посиланням. отримані з використанням реакційних процедур і "Фармацевтично прийнятною сіллю" є сіль, що схем синтезів, описаних нижче, за допомогою мезберігає біологічну ефективність вільних кислот і тодів, відомих в рівні техніки, з використанням легоснов зазначеного сполуки і не є небажаною біоко доступних вихідних речовин. логічно або в іншому відношенні. Сполуки згідно з Крім сполук загальної Формули І, винахід довинаходом можуть бути достатньо кислотними, датково включає сполуки загальної Формули II: достатньо основними або мати і ті і інші функціональні групи і, відповідно, взаємодіяти з кожною з багатьох неорганічних або органічних основ і неорганічних і органічних кислот з утворенням фармаII цевтично прийнятної солі. Приклади фармацевтично прийнятних солей включають солі, отримані взаємодією сполук згідно з винаходом з мінеральною або органічною кислотою або неорганічною де А, В, X і Аr1 є такими, як визначено вище. основою; такі солі включають сульфати, піросульФіг.1-6 містять приклади синтезу конкретних фати, бісульфати, сульфіти, бісульфіти, фосфати, сполук загальної Формули II. В одному з загальних моногідрофосфати, дигідрофосфати, метафосфаспособів синтезу піразольні сполуки Формули II ти, пірофосфати, хлориди, броміди, йодиди, ацеодержують у такий спосіб. 2-хлор-4-метил-5тати, пропіонати, деканоати, каприлати, акрилати, нітропіридин у придатному безводному розчиннику форміати, ізо-бутирати, капроати, гептаноати, 23 86196 24 обробляють арил- або гетероарилфенолом або тіофенолом і основою, наприклад, NaH. Через певний період часу реакційну суміш розподіляють IV між органічним розчинником і водою і з органічного шару виділяють 2-О-арил- або S-арил-заміщену-4метил-5-нітропіридинову проміжну сполуку. Замісник NO2 потім відновлюють, наприклад, обробкою порошком заліза в оцтовій кислоті при нагріванні де А, В, Χ, Ε і Аr1 є такими, як визначено вище, протягом періоду часу з подальшою обробкою за умови, що коли В є Н, і А є СН=СН-R8, де R8 є придатною основою, наприклад, NaOH. Отриману заміщений або незаміщений алкіл, алкеніл, циклоанілінову проміжну сполука виділяють екстракцією алкіл, гетероциклоалкіл, арил або гетероарил, то реакційної суміші органічним розчинником. Потім Х-Аr1 є замісником, в якому Аr1 не є заміщеним або проміжну анілінову сполуку з'єднують з тетрафлунезаміщеним арилом, гетероарилом, NH-алкілом, орборатом амонію з подальшим доданням основи, NH-циклоалкілом, NH-гетероциклоалкілом, NHнаприклад, KОАс, і каталізатора фазового переноарилом, ΝΗ-гетероарилом, NH-алкокси або NHсу (наприклад 18-краун-6) і одержують біциклічну діалкіламідом, коли X є О, S, C=O, S=O, C=CH2, піразольну сполуку Формули II, де А - гідроген. Для CO2, NH або N(С1-C8алкiл). одержання 1-Ν-заміщених піразольних сполук ФоФіг.9-13 містять приклади синтезу конкретних рмули II, де А не є гідрогеном, піразольну сполука сполук загальної Формули IV. В одному загальнопіддають взаємодії з придатною основою і сполуму способі синтезу сполуки Формули IV одержують кою формули RX, де X - галоген, а R - алкіл, аліл, у такий спосіб. 6-нітроіндол обробляють основою і алкеніл, алкініл, аліл, циклоалкіл, гетероциклоалйодом і отриманий 3-йод-6-нітроіндол обробляють кіл, бензил або СН2-гетероарил, як це визначено основою і агентом з захисною групою для аміно, вище. наприклад, триметилсилілетоксиметилхлоридом (SEM-CI). Обробка захищеної 6-нітроіндольної сполуки транс-2-фенілвинілборною кислотою і придатним каталізатором, таким, як Pd(PPh3)4, дає III 1-Ν-фенілвиніл-6-нітроіндольну проміжну сполуку. Відновлення замісника 6-NO2 відновлюючим агентом, наприклад, гідразином, і придатним каталізатором (наприклад паладієм на вугіллі) дає 1-ΝУ ще одному втіленні винахід стосується спозаміщену 6-аміноіндольну похідну. Обробка цієї лук загальної Формули III: похідної нітритом натрію з подальшим доданням де А, В, Χ, Ε і Аr1 є такими, як визначено вище. йодиду натрію і йоду дає 1-Ν-заміщену-3Фіг.7-8 містять приклади синтезу конкретних фенілвиніл-6-йодіндазольну похідну. Обробка цієї сполук загальної Формули III. В одному загальнопохідної окислювачами, наприклад, тетроксидом му способі синтезу сполуки Формули III одержують осмію і перйодатом натрію, дає 1-N-захищену-3у такий спосіб. Арилтіофенол або арилфенол докарбальдегід-6-йодіндазольну похідну. Ця похідна дають до сильної основи у безводному розчиннику потім може бути використана в деяких схемах сині потім піддають взаємодії з 5-хлор-3-метил-2тезу з одержанням різних індазольних сполук згіднітропіридином, одержуючи 6-S-арил- або 6-Оно з винаходом, як описано, наприклад, у Приклаарил-заміщене 2-метил-3-нітропіридиновое промідах. жне сполука. Замісник NO2 відновлюють, наприВ іншому варіанті способу синтез 6-ОАrклад, обробкою порошком заліза в оцтовій кислоті заміщеної сполуки Формули IV здійснюють у такий при нагріванні протягом певного періоду часу з спосіб. Обробка 2-флуор-4-гідроксиацетофенону подальшою обробкою придатною основою, наприпридатним реагентом з захисною групою для феклад, NaOH. Отриману анілінову проміжну сполука нолу, з подальшим доданням гідразину при нагрівиділяють екстракцією реакційної суміші органічванні для індукування циклізації дає індазольну ним розчинником. Проміжну анілінову сполуку посполуку, яку захищають у положенні 1-N придаттім обробляють тетрафлуорборатом амонію з поним реагентом з захисною групою для аміно. Видальшим доданням основи, наприклад, KОАс, і далення захисної групи для фенолу і обробка арикаталізатора фазового переносу (наприклад 18лборною кислотою з подальшим видаленням краун-6) і одержують біциклічну азаіндазольну захисної групи для аміно дає 6-ОАr-заміщену спосполуку Формули III, де А - гідроген. Для одержанлуку Формули IV. ня 1-Ν-заміщених азаіндазольних сполук Формули У ще одному варіанті способу синтез 6-3АrIII, де А не є гідрогеном, азаіндазольну сполуку заміщеної сполуки Формули IV здійснюють у такий піддають взаємодії з придатною основою і сполуспосіб. 4-флуортіофенол обробляють сильною кою формули RX, де X - галоген, a R - алкіл, аліл, основою, наприклад як трет-бутоксидом калію і до алкеніл, алкініл, циклоалкіл, гетероциклоалкіл, отриманого феноксиду додають 2,4бензил або СН2-гетероарил, як це визначено видифлуорпропіофенон. Додання гідразину до отрище. маної проміжної сполуки з подальшим нагріванням У ще одному втіленні винахід стосується сподля індукування циклізації дає 6-SАr-заміщену лук загальної Формули IV: сполуку Формули IV. В іншому варіанті способу синтез 5-ОАr- і 6SАr-заміщеної сполуки Формули IV здійснюють у 25 86196 26 такий спосіб. Етерифікація 5-флуор-2нітробензойної кислоти з подальшою обробкою отриманого естеру сумішшю АrОН або ArSH і сиVI льної основи дає 5-ХАr-заміщений метиловий етер 2-нітробензойної кислоти, де X є О або S. Омилення цього естеру з подальшим доданням гідроксиду амонію дає 2-нітробензамідну проміжну сполуку. 2-нітробензамід перетворюють у 2нітробензонітрильну проміжну сполуку обробкою оксалілхлоридом. Відновлення нітрозамісника з VII подальшим доданням нітриту натрію дає 3-аміно5-ХАr-заміщену індазольну сполуку Формули IV, де X є О або S. В іншому варіанті способу синтез 6-ОАrде А, В, Ε і Аr1 є такими, як визначено вище. заміщеної сполуки Формули IV здійснюють у такий Фіг.14-15 містять приклади синтезу конкретних спосіб. 2-флуор-4-гідроксибензонітрил з'єднують з сполук, які мають загальну Формулу VI, а на Фіг.18, арилборною кислотою, ацетатом міді і основою, 19 і 23 представлено приклади синтезу конкретних одержуючи 2-флуор-4-арилоксибензонітрильну сполук загальної Формули VII. В одному загальнопроміжну сполуку. Перемішаний розчин цього му способі синтезу сполуки Формул VI і VII одерпроміжного сполука з гідразином нагрівають під жують у такий спосіб. 5-йод-1Н-індазол одержують зворотним холодильником, одержуючи З-аміно-6обробкою 5-аміно-1Н-індазолу розчином NaNO2 у арилоксиіндазольну сполуку. Ця сполука може воді з подальшим доданням КІ. Після виділення бути використана як вихідна для синтезу 3продукту екстракцією реакційної суміші органічним амідіндазольних похідних з використанням станрозчинником, цей продукт може бути потім викодартної хімії синтезу амідів, відомої фахівцям. ристаний у різних способах синтезу для одержанУ ще одному втіленні винахід стосується споня індазольних сполук згідно з винаходом. В одлук загальної Формули V: ному з способів 1-аміногрупу 5-йод-1Н-індазола захищають придатною захисною групою для аміно і захищений 5-йодіндазол обробляють основою, порошком міді і арилфенолом або арилтіофеноV лом, одержуючи 5-О-арил-заміщений індазол (Формула VI) або 5-S-арил-заміщений індазол (Формула VII). Видалення захисної групи для аміно дає де А, X, Ε і Аr1 є такими, як визначено вище. сполуку згідно з винаходом Формули VI або VII. Фіг.24-26 містять приклади синтезу конкретних В іншому варіанті способу 5-йод-1Н-індазол сполук, які мають загальну Формулу V. В одному обробляють основою і RX або Аr1СН2Х, де R - алзагальному способі синтезу сполуки Формули V кіл або аліл, а Аr1 є арильна або гетероарильна одержують у такий спосіб. 4-флуор-2група, як це визначено вище, і X є галогеном або гідроксибензойну кислоту піддають етерифікації і іншою придатною відщеплювальною групою. 1-Ν2-гідроксигрупу захищають придатною захисною заміщений 5-йодіндазол потім обробляють осногрупою для спирту. Заміщення флуорогрупи грувою, порошком міді і арилтіофенолом або арилпою О-Аr або S-Ar здійснюють обробкою основою і фенолом, одержуючи 5-О-арил-заміщену індазоАrOН або ArSH, де Аr є арилом або гетероарилом, льну (Формула VI) або 5-S-арил-1-N-заміщену визначеними вище. Видалення захисної групи для індазольну (Формула VII) сполуку згідно з винахоспирту і омилення естеру з подальшою обробкою дом. кар-бонілдіімідазолом для здійснення циклізації дає 6-ОАr- або 6-SАr-3-гідроксибензізоксазольну сполуку. 3-гідроксибензізоксальну сполуку перетворюють у 3-хлорбензізоксазольну похідну обробкою РОСІ 3 і основою. Цей продукт потім може бути використаний для одержання 3-О-Аr- або 3NН-Аr-заміщених бензізоксазольних сполук згідно з винаходом. Наприклад, 6-заміщену-3хлорбензізоксазольну сполуку можна додати до суміші АrOН і сильної основи (наприклад Na) з одержанням 6-заміщеної-3-О-Аr-бензізоксальної похідної. В іншому варіанті способу синтезу 6заміщена-3-хлорбензізоксазольна сполука може бути додана до суміші ArNH2 і сильної основи з одержанням б-заміщеної-3-NHArбензізоксазольної похідної. У ще одному втіленні винахід стосується сполук загальних Формул VI і VII: VIII У ще одному втіленні винахід стосується сполук загальної Формули VIII: де А, В, Ε і Аr1 є такими, як визначено вище. Фіг.22 містить приклад синтезу конкретної сполуки загальної Формули VIII. В одному загальному способі синтезу сполуки Формули VIII одержують окислюванням сполуки Формули VII окислювачем, який окисляє арилсульфид до відповідної арилсульфінільної похідної. У ще одному втіленні винахід стосується сполук загальної Формули IX: 27 86196 28 Аr1 є такою, як визначено вище, з подальшою обробкою придатним окислювачем, дає 1-Nзаміщену сполуку Формули XI. Альтернативний спосіб синтезу сполуки Формули XI показаний на IX Фіг.33. У ще одному втіленні винахід стосується сполук загальної Формули XII: де А, В, Ε і Аr1 є такими, як визначено вище. Фіг.21 містить приклад синтезу конкретної сполуки загальної Формули IX. В одному загальному способі синтезу сполуки Формули IX одержують окислюванням сполуки Формули VII окислювачем, який окисляє арилсульфид до відповідної арилсульфонільної похідної. XII ще. X У ще одному втіленні винахід стосується сполуки загальної Формули X: де А, В, Ε і Аr1 є такими, як визначено вище. Фіг.31 містить приклад синтезу конкретної сполуки загальної Формули X. В одному загальному способі синтезу сполуки Формули X одержують у такий спосіб. До суміші тетрафлуорборату амонію і оцтової кислоти додають 4-бром-2метиланілин. Через деякий час до цієї суміші додають нітрит натрію і потім основу, наприклад, ацетат калію, і каталізатор фазового переносу, наприклад, 18-краун-6, одержуючи 5-броміндазол. Броміндазол обробляють RBr у присутності основи, одержуючи 1-Ν-заміщену 5-броміндазольну похідну, де R є "А", як це визначено вище для Формули X, за винятком гідрогену. Обробка 1-Νзаміщеної похідної Аr1СНО у присутності сильної основи, наприклад, бутиллітію, де Аr1 визначено вище, дає спиртову сполуку Формули X. У ще одному втіленні винахід стосується сполук загальної Формули XI: де А, В, Е, R1 і Аr1 є такими, як визначено ви Фіг.27 містить приклад синтезу конкретної сполуки загальної Формули XII. В одному загальному способі синтезу сполуки Формули XII одержують у такий спосіб. До суміші тетрафлуорборату амонію і оцтової кислоти додають 4-бром-2метиланілин. Через деякий час до цієї суміші додають нітрит натрію і потім основу, наприклад, ацетат калію, і каталізатор фазового переносу, наприклад, 18-краун-6, одержуючи 5-броміндазол. Броміндазол обробляють RBr у присутності основи, одержуючи 1-Ν-заміщену 5-броміндазольну похідну, де R - алкіл, аліл, АrСН2 або гетероарилСН2, як визначено вище. Обробка 1-Ν-заміщеної похідної Аr1СНО у присутності сильної основи, наприклад, бутиллітію, де Аr1 є такою, що визначена вище, з подальшою обробкою придатним окислювачем дає 1-Ν-заміщену 5-C=OR похідну. Додання NH2OR1 до цієї похідної у піридині, де R6 є такою, що визначена вище, дає оксим Формули XII. Альтернативний спосіб синтезу сполуки Формули XII містить Фіг.28. У ще одному втіленні винахід стосується сполук загальної Формули XIII: XIII XI де А, В, Ε і Аr1 є такими, як визначено вище. Фіг.32 містить приклад синтезу конкретної сполуки загальної Формули XI. В одному загальному способі синтезу сполуки Формули XI одержують у такий спосіб. До суміші тетрафлуорборату амонію і оцтової кислоти додають 4-бром-2метиланілин. Через деякий час до цієї суміші додають нітрит натрію і потім основу, наприклад, ацетат калію, і каталізатор фазового переносу, наприклад, 18-краун-6, одержуючи 5-броміндазол. Броміндазол обробляють RBr у присутності основи, одержуючи 1-Ν-заміщене 5-броміндазольну проміжну сполуку, в якій R є "А", як визначено вище для Формули XI, за винятком гідрогену. Обробка 1-N-заміщеної проміжної сполуки Аr1СНО у присутності сильної основи, наприклад, бутиллітію, де де А, В, Ε і Аr1 є такими, як визначено вище. Фіг.34 містить приклад синтезу конкретної сполуки загальної Формули XIII. В одному загальному способі синтезу сполуки Формули XIII одержують у такий спосіб. До суміші тетрафлуорборату амонію і оцтової кислоти додають 4-бром-2метиланілин. Через деякий час до суміші додають нітрит натрію і потім основу, наприклад, ацетат калію, і каталізатор фазового переносу, наприклад, 18-краун-в, одержуючи 5-броміндазол. Броміндазол обробляють RBr у присутності основи, одержуючи 1-Ν-заміщену 5-броміндазольну проміжну сполуку, де R є "А", як визначено вище для Формули XIII, за винятком гідрогену. Обробка 1-Νзаміщеної проміжної сполуки сильною основою, наприклад, трет-бутиллітієм, з подальшим доданням триметилборату дає індазольну проміжну сполуку - 5-борну кислоту. Додання мідного (II) каталізатора з подальшим доданням заміщеного 29 86196 30 або незаміщеного аніліну дає сполуку Формули В одному загальному способі синтезу сполуки XIII. Формули XVI одержують у такий спосіб. 5-ОАr-6У ще одному втіленні винахід стосується споСО2Ме-індазольну похідну одержують, як описано лук загальної Формули XIV: вище для синтезу Формули XIV, а потім відновлюють, наприклад, обробкою ВН3 у ТГФ. Очищення дає сполуку Формули XVI. У ще одному втіленні винахід стосується сполук загальної Формули XVII: XIV де А, В, X, Аr1, R2 і R3 є такими, як визначено вище. Фіг.30А-30С містять приклад синтезу конкретної сполуки загальної Формули XIV. В одному загальному способі синтезу сполуки Формули XIV одержують у такий спосіб. 1-флуор-3-метилбензол піддають реакції приєднання з утворенням 2флуор-4-метилбензойної кислоти і потім нітруванню з одержанням 2-флуор-4-метил-5нітробензойної кислоти. Кислотну групу етерифікують і флуорогрупу заміщують Аr- обробкою АrOН і сильною основою. Відновлення нітрогрупи з подальшими динітрогенуванням і циклізацією дає 5-ОАr-6-СО2Ме - індазольну похідну, яку потім обробляють RBr у присутності основи, одержуючи 1N заміщену похідну. Гідроліз естерною групи з подальшим амідуванням дає 6-амід-індазольну похідну Формули XIV. У ще одному втіленні винахід стосується сполук загальної Формули XV: XV де А, В, X, і Аr1 є такими, як визначено вище, і R12 і R13 незалежно є алкілом, алілом, алкенілом, алкінілом, циклоалкілом, гетероциклоалкілом, арилом або гетероарилом, які можуть бути заміщені або не заміщені. Фіг.34 містить приклад синтезу конкретної сполуки загальної Формули XV. В одному загальному способі синтезу сполуки Формули XV одержують у такий спосіб. 5-ОАr-6-СО2Ме-індазольну похідну одержують, як описано вище для синтезу сполуки Формули XIV, і потім обробляють RBr у присутності основи, одержуючи 1-N заміщену похідну. Гідроліз естерноі групи з подальшою обробкою карбонілдіімідазолом і амінокислотою дає 6заміщену індазольну похідну Формули XV. У ще одному втіленні винахід стосується сполук загальної Формули XVI: XVI де А, В, X, R2, R3 і Аr1 є такими, як визначено вище. XVII де Y - CR1,O,S aбo NR2; W - CR3, N, NR4, S або О, за умови, що W є NR4, S або О, коли Υ є CR1, і W є CR3 або Ν, коли Ye NR2; R3 - Η, NH2, F, СІ, метил або заміщений метил; R4 - Η, або метил або заміщений метил; R1 і R2 незалежно є Н, ОН, захисною групою для аміно, Zn-NRaRb, Zn-NRa(C=O)Rb, Zn-SO2Ra, ZnSORa, Zn-SRa, Zn-ORa, Zn-(C=O)Ra, Zn-(C=O)ORa, Zn-O-(C=O)Ra, алкілом, алілом, алкенілом, алкінілом, гетероалкілом, гетероалілом, гетероалкенілом, гетероалкінілом, алкокси, гетероалкокси, Znциклоалкілом, де зазначений циклоалкіл є насиченим або частково ненасиченим, Ζnгетероцикпоалкілом, де зазначений гетероциклоалкіл є насиченим або частково ненасиченим, або Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Zn-гетероцикпоалкіл і Zn-Ar1 можуть бути заміщені або не заміщені; Аr1 - арил або гетероарил, кожний з яких може бути заміщений або незаміщений; Ra і Rb незалежно є Н, ОН, захисною групою для аміно, захисною групою для спирту, захисною групою для кислоти, захисною групою для сульфуру, алкілом, алілом, алкенілом, алкінілом, гетероалкілом, гетероалілом, гетероалкенілом, гетероалкінілом, алкокси, гетероалкокси, Znциклоалкілом, де зазначений циклоалкіл є насиченим або частково ненасиченим, Znгетероциклоалкілом, де зазначений гетероциклоалкіл є насиченим або частково ненасиченим, або Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалкеніл, гетероалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл і Zn-Ar1 можуть бути заміщені або не заміщені, або Ra і Rb разом з атомами, до яких вони приєднані, утворюють насичене або частково ненасичене гетероциклічне кільце, яке має один або більш гетероатомів у зазначеному кільці, причому зазначений гетероцикл може бути заміщений або незаміщений і може бути конденсований з ароматичним кільцем; Ζ - алкілен, що має від 1 до 4 атомів карбону, або алкенілен, або алкінілен, кожний з яких має від 31 86196 32 роалкокси, Zn-циклоалкіл, Zn-гетероциклоалкіл і Zn2 до 4 атомів карбону, причому зазначені алкілен, Ar1 можуть бути заміщені або не заміщені; алкенілен або алкінілен можуть бути заміщені або R12 і R13 незалежно є Н, алкілом, алілом, алкене заміщені; нілом, алкінілом, гетероалкілом, гете-роалілом, n дорівнює 0 або 1; гетероалкенілом, гетероалкінілом, ZnU є CR0 або Ν; циклоалкілом, де зазначений цикпоалкіл є насичеV є CR0 aбo N; ним або частково ненасиченим, ZnRc - Η, F, СІ, метил або заміщений метил; гетероциклоалкілом, де зазначений гетероциклоаX - О, S, SO, SO2, NR5, C=O, CH2, CH2Zn-OH лкіл є насиченим або частково ненасиченим, або або C=NORd; Zn-Ar1, причому зазначені алкіл, аліл, алкеніл, алR5 - Η, метил або заміщений метил; d кініл, гетероалкіл, гетероаліл, гетероалкеніл, гетеR - Η, РО3Н2, SO3H2, алкіл, аліл, алкеніл, алкіроалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, ніл, гетероалкіл, гетероаліл, гетероалкеніл, гетеZn-гетероциклоалкіл і Zn-Ar1 можуть бути заміщені роалкініл, алкокси, гетероалкокси, Zn-циклоалкіл, або не заміщені; де зазначений циклоалкіл є насиченим або частпричому, коли Аr2 заміщений -SO2NR13R12, то ково ненасиченим, Zn-гетероциклоалкіл, де зазна12 R і R13 можуть утворювати циклоалкільне кільце чений гетероциклоалкіл є насиченим або частково 1 або гетероциклоалкільне кільце, яке може бути ненасиченим, або Ζn-Ar , причому зазначені алкіл, заміщене або незаміщене і зазначене заміщення аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, геможе здійснюватись замісниками, обраними з алтероалкеніл, гетероалкініл, алкокси, гетероалкоккілу, алілу, алкенілу, алкінілу, гетероалкілу, гетеси, Zn-цикпоалкіл, Zn-гетероциклоалкіл і Zn-Ar1 мороалілу, гетероалкенілу, гетероалкінілу, алкокси, жуть бути заміщені або не заміщені; гетероалкокси, Zn-циклоалкілу, де зазначений цикG, Н, J і Τ незалежно є N або CRZ, за умови, поалкіл є насиченим або частково ненасиченим, що коли будь-які з зазначених G, Н, J і Τ є Ν, то COR12, -SO2R12, Zn-гетероциклоалкілу, де зазначезагальна кількість G, Н, J або Т, що є N, не перений гетероциклоалкіл є насиченим або частково вищує 2; ненасиченим, або Zn-Ar1, причому зазначені алкіл, Rz - Η, F, СІ, Br, CF3, OR6, SR6, нижчий (С16 7 аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, геC4)алкіл, CN або NR R ; тероалкеніл, гетероалкініл, алкокси, гетероалкокR6 і R7 незалежно є Η, CF3, нижчим (С1си, Zn-циклоалкіл, Zn-гетероциклоалкіл і Zn-Ar1 моC4)алкілом або нижчим (С1-C4)гетероалкілом; жуть бути заміщені або не заміщені; Q - -NR8CONH-, -NHCO-, -NR8SO2NH-, -NHSO2де, коли Q є -CONR11-, то Ry разом з R11 є до, -CONR11-; 8 датковим циклоалкільним кільцем або гетероцикR - Η або нижчий (С1-C4)алкіл; поалкільним кільцем, що може бути заміщене або R11 - Η або нижчий (С1-C4)алкіл; незаміщене групами, обраними з алкілу, алілу, Rx - -(CR9R10)m-, -O(CR9R10)m-, NH(CR9R10)mалкенілу, алкінілу, гетероалкілу, гетероалілу, гетеабо -S(CR9R10)m-, за умови, що Q є -CONR11, коли роалкенілу, гетероалкінілу, алкокси, гетероалкокRx є -O(CR9R10)m-, -NH(CR9R10)m- або -S(CR9R10)m-; си, Zn-циклоалкілу, де зазначений циклоалкіл є R9 і R10 незалежно є Н або нижчим алкілом, насиченим або частково ненасиченим, Znабо R9 і R10 разом з атомами, до яких вони приєдгетероциклоалкілу, де зазначений гетероцикпоалнані, утворюють циклоалкільне кільце, яке може кіл є насиченим або частково ненасиченим, Zn-Ar1, бути насиченим або частково ненасиченим; -COR14 або -SO2R14, причому зазначений алкіл, m дорівнює 1-3; аліл, алкеніл, алкініл, гетероалкіл, гетероаліл, геRy - Η, РО3Н, захисна група для аміно, захисна тероалкеніл, гетероалкініл, алкокси, гетероалкокгрупа для оксигену, алкіл, аліл, алке-ніл, алкініл, си, Zn-циклоалкіл, Zn-гетероциклоалкіл, Zn-Ar1, гетероалкіл, гетероаліл, гетероалкеніл, гетероалCOR14 і -SO2R14 можуть бути заміщені або не закініл, алкокси, гетероалкокси, Zn-циклоалкіл, де міщені; і зазначений цикпоалкіл є насиченим або частково R14 - алкіл, аліл, алкеніл, алкініл, гетероалкіл, ненасиченим, Ζn-гетероциклоалкіл, де зазначений гетероаліл, гетероалкеніл, гетероалкініл, Znгетероциклоалкіл є насиченим або частково ненацикпоалкіл, де зазначений циклоалкіл є насиченим сиченим, або Zn-Ar2, причому зазначені алкіл, аліл, або частково ненасиченим, Zn-гетероциклоалкіл, алкеніл, алкініл, гетероалкіл, гетероаліл, гетероалде зазначений гетероциклоалкіл є насиченим або кеніл, гетероалкініл, алкокси, гетероалкокси, Znчастково ненасиченим, або Zn-Ar1, причому зазнациклоалкіл, Zn-Ar2 і Ζn-гетероциклоалкіл можуть чені алкіл, аліл, алкеніл, алкініл, гетероалкіл, гетебути заміщені або не заміщені; роаліл, гетероалкеніл, гетероалкініл, алкокси, геАr2 - арил або гетероарил, кожний з яких може тероалкокси, Zn-цикпоалкіл, Zn-гетероциклоалкіл і бути заміщений або незаміщений і зазначене заZn-Ar1 можуть бути заміщені або не заміщені. міщення може здійснюватись 1-3 замісниками, Фіг.38-50 містять приклади синтезу конкретних незалежно обраними з F, СІ, Вr, CF3, CN, алкілу, сполук загальної Формули XVII. алілу, алкенілу, алкінілу, гетероалкілу, гетероаліТерапевтично ефективні кількості сполук згідлу, гетероалкенілу, гетеро-алкінілу, -OR12, -SR12, но з винаходом можуть бути використані для лікуSO2R12, -SO2NR13R12, NR13SO2R12, Zn-циклоалкіл, вання захворювань, опосередкованих модулюванде зазначений циклоалкіл є насиченим або частням або регулюванням протеїнокіназ. "Ефективна ково ненасиченим, Zn-гетероциклоалкілу, де закількість" означає кількість сполуки, яка при ввезначений гетероциклоалкіл є насиченим або частденні ссавцю, що потребує такого лікування, є доково ненасиченим, або Zn-Ar1, причому зазначені статньою для лікування захворювання, опосередалкіл, аліл, алкеніл, алкініл, гетероалкіл, гетерокованого активністю однієї або більше аліл, гетероалкеніл, гетероалкініл, алкокси, гете 33 86196 34 ту; зв'язуючі агенти, наприклад, крохмаль; змащупротеїнкінази, наприклад, р38 альфа, і пов'язаних вачі, наприклад, стеарат магнію, стеаринову з цим опосередкованих р38 подій, наприклад, прокислоту або тальк; консерванти, наприклад, етилдукування цитокінов. Так, наприклад, терапевтичабо пропіл-n-гідроксибензоат, і антиоксиданти, но ефективною кількістю сполуки Формул I-XVII, наприклад, аскорбінову кислоту. Препарати у фоабо її солі, активного метаболіту або проліків, є рмі таблеток можуть бути непокритими або мати кількість, достатня для модулювання, регулювання покриття для модифікації їх дезинтеграцї і подаабо інгібування активності однієї або більше прольшої абсорбції активного інгредієнта в шлунковотеїнокіназ таким чином, що хворобливий стан, кишковому тракті, або для поліпшення їх стабільякий опосередковується цією активністю, усуваності і/або зовнішнього вигляду, у будь-якому виється або полегшується. падку, з використанням традиційних покриваючих Кількість даного агента, що відповідає такій кіагентів і методик, добре відомих фахівцям. лькості, може варіюватись в залежності від таких Композиції для перорального застосування факторів, таких як конкретна сполука, хвороблиможуть мати форму твердих желатинових капсул, вий стан і його важкість, і особливостей (наприв яких активний інгредієнт змішано з інертним твеклад, ваги) ссавця, що потребує такого лікування, і рдим розріджувачем, наприклад, карбонатом може бути звичайним чином визначена фахівцем. кальцію, фосфатом кальцію або каоліном, або "Лікування" означає щонайменше пом'якшення мати форму м'яких желатинових капсул, в яких хворобливого стану у ссавця, наприклад, людини, активний інгредієнт змішано з водою або олією, що знаходиться під зазнає впливу, щонайменше наприклад, арахісовим маслом, вазеліновою олією частково, активності однієї або більше протеїнкіабо маслиновою олією. наз, наприклад, р38, і включає, але без обмеженВодні суспензії звичайно містять активний інгня, профілактику виникнення хворобливого стану у редієнт у вигляді тонкого порошку разом з одним ссавця, особливо коли виявлено, що цей ссавець або більше суспендуючими агентами, наприклад, схильний до такого хворобливого стану, який однатрійкарбоксиметилцеллюлозою, метилцеллюлонак, у нього ще не виявлений; модулювання і/або зою, гідроксипропілцеллюлозою, альгінатом наінгібувані хворобливого стану; і/або полегшення трію, полівинілпіролидоном, трагакантовою камехворобливого стану. ддю і гуміарабіком; диспергуючим або Для застосування сполуки Формули I-XVII або зволожуючим агентом, наприклад, лецитином, або її фармацевтично прийнятної солі, або проліків, продуктами конденсації алкіленоксиду з жирними що розщеплюється in vivo, у терапевтичному лікукислотами (наприклад поліоксиетиленстеаратом), ванні (включаючи профілактичне лікування) ссавабо продуктами конденсації етиленоксиду з довгоців, у тому числі людини, її звичайно виготовляють ланцюговими аліфатичними спиртами, наприклад у вигляді фармацевтичної композиції у відповідногептадекаетиленоксикетанолом, або продуктами сті з стандартною фармацевтичною практикою. конденсації етиленоксиду з неповними естерами, Відповідно до цього аспекту винаходу запропонощо видобуваються з жирних кислот і гекситу, навано фармацевтичну композицію, що містить споприклад, поліоксиетиленсорбіт моноолеатом, або луку Формули I-XVII або її фармацевтично прийняпродуктами конденсації етиленоксиду з неповними тну сіль, або проліки, що розщеплюються in vivo, естерами, що видобуваються з жирних кислот і як визначено вище, разом з фармацевтично приангідридів гекситу, наприклад, поліетиленсорбитйнятними розріджувачем або носієм. моноолеатом. Водні суспензії також можуть містиКомпозиції згідно з винаходом можуть існувати ти один або більше консервантів (наприклад, етилу формі, придатній для перорального застосуванабо пропіл-n-гідроксибензоат), антиоксидантів (наня (наприклад у вигляді таблеток, коржів, твердих приклад, аскорбінову кислоту), забарвлювачів, або м'яких капсул, водних або масляних суспензій, коригентів і/або підсолоджувачів (наприклад, саемульсій, дисперсних порошків або гранул, сирохарозу, сахарин або аспартам). пів або еліксирів), для місцевого застосування Масляні суспензії можуть бути приготовлені (наприклад у вигляді кремів, мазей, гелів або водсуспендуванням активного інгредієнту в рослинній них або масляних розчинів, або суспензій), для олії (наприклад, арахісовій олії, маслиновій олії, введення інгаляцією (наприклад у вигляді тонкокунжутній олії або кокосовій олії) або у мінеральній подрібненого порошку або рідкого аерозолю), для олії (наприклад, вазеліновій олії). Масляні суспенвведення шляхом інсуфляції (наприклад у вигляді зії можуть також містити згущувач, наприклад, тонкоподрібненого порошку) або для парентерабджолиний віск, твердий парафін або цетиловий льного введення (наприклад у вигляді стерильного спирт. Для надання приємного смаку до перораводного або масляного розчину для внутрішньольного препарату можуть бути додані підсолоджувенного, підшкірного або внутрішньо-м'язового вачі, зазначені вище, і коригенти. Ці композиції дозування або у вигляді супозиторію для ректальможуть бути збережені доданням антиоксиданту, ного дозування). Наприклад, композиції, признанаприклад, аскорбінової кислоти. чені для перорального застосування, можуть місДисперсні порошки і гранули, придатні для тити, наприклад, один або більше забарвлювачів, одержання водної суспензії доданням води, звипідсолоджувачів, коригентів і/або консервантів. чайно містять активний інгредієнт разом з дисперПридатні фармацевтично прийнятні ексципієнгуючим або зволожуючим агентом, суспендуючим ти для приготування таблеток включають, наприагентом і одним або більше консервантами. Приклад, інертні розріджувачі, наприклад, лактозу, клади придатних диспергуючих або зволожуючих карбонат натрію, фосфат кальцію або карбонат агентів і суспендуючих агентів були наведені викальцію, гранулюючі і розпушуючі агенти, наприще. Також можуть бути присутніми додаткові ексклад, кукурудзяний крохмаль або альгінову кисло 35 86196 36 бути використані звичайні аерозольні пропеленти, ципієнти, наприклад, підсолоджувачі, коригенти наприклад, леткі флуоровані гідрокарбони, причоабо забарвлювачі. му гідрокарбони і аерозольний пристрій пристосоФармацевтичні композиції згідно з винаходом вано для вивільнення дозованої кількості активнотакож можуть мати форму емульсій типу олії-уго інгредієнта. воді. Масляна фаза може бути рослинною олією, Для додаткової інформації про фармацевтичні наприклад, маслиновою олією або арахісовою препарати [див. главу 25,2 у Comprehensive олією, або мінеральною олією, наприклад, наприMedicinal Chemistry, Volume 5, Corwin Hansch; клад, вазеліновою олією, або сумішшю будь-яких Chairman of Editorial Board, Pergamon Press 1990], цих олій. Придатними емульгаторами можуть бути, включену посиланням. наприклад, природні смоли, зокрема, гуміарабік Кількість сполуки згідно з винаходом, яку поабо трагакантова камедь, природні фосфатиди, єднують з одним або більше ексципієнтом для наприклад, соя культурна, лецитин, естери або одержання уніфікованої лікарської форми, обов'янеповні естери, що видобуваються з жирних кисзково буде варіюватись в залежності від організму лот і ангідридів гекситу (наприклад, сорбітмоноо"хазяїна", якого лікують, і конкретного способу леат) і продукти конденсації' зазначених неповних введення. Наприклад, препарат, призначений для естерів з етиленоксидом, наприклад, поліоксиетиперорального введення людині, буде містити, наленсорбитмоноолеат. Емульсії можуть також місприклад, від 0,5мг до 2г активного інгредієнта з тити підсолоджувачі, коригенти і консерванти. належною і зручною кількістю ексципієнтів, що Сиропи і еліксири можуть бути приготовлені з може варіюватись від приблизно 5% до приблизно підсолоджувачами, наприклад, гліцерином, пропі98% (за масою) загальної композиції. Дозовані ленгліколем, сорбітом, аспартамом або сахаролікарські форми звичайно містять від приблизно зою, і також можуть містити заспокоюючі засоби, 1мг до приблизно 50мг активного інгредієнта. Для консервант, коригент і/або забарвлювач. додаткової інформації про способи введення і реФармацевтичні композиції також можуть мати жими дозування [див. главу 25,3 у Comprehensive форму стерильної водної або масляної суспензії Medicinal Chemistry, Volume 5, Corwin Hansch; для ін'єкцій, яка може бути приготовлена відомими Chairman of Editorial Board, Pergamon Press 1990], методами з використанням одного або більше включену посиланням. придатних диспергуючих або зволожуючих агентів Розмір дози сполуки Формули I-XVII для тераі суспендуючих агентів, згаданих вище. Стерильпевтичних або профілактичних цілей природно ним препаратом для ін'єкцій також може бути стеваріювати в залежності від природи і важкості старильний розчин або суспензія для ін'єкцій в нетокнів, віку і статі тварини або пацієнта і способу ввесичному, прийнятному для парентерального дення, відповідно до правил, добре відомих у мезастосування розріджувачі або розчиннику, напридицині. клад, розчин у 1,3-бутандіолі. Згідно з одним з аспектів винаходу сполука Супозиторні препарати можуть бути приготовзгідно з винаходом або її фармацевтично прийнялені змішуванням активного інгредієнта з придаттні солі або проліки можуть бути приготовлені у ним неподразнюючим ексципієнтом, таким, що є формі фармацевтичних композицій для введення твердим при звичайних температурах, але стає тваринам або людині для лікування або профілакрідиною при ректальній температурі, і який, отже, тики стану, опосередкованого р38. Термін "стан, буде плавитись в прямій кишці з вивільненням опосередкований р38" тут означає будь-яке захволіків. Придатні ексципієнти включають, наприклад, рювання або інший небезпечний стан, в яких р38, масло какао і полі-етиленгліколі. як відомо, відіграє роль. Він включає стани, як віЛокальні препарати, наприклад, креми, мазі, домо, викликані надлишковим продукуванням IL-1, гелі і водні або масляні розчини або суспензії, звиTNF, IL-6 або IL-8. Такі стани включають, але без чайно можуть бути отримані шляхом готування обмеження, запальні захворювання, автоімунні активного інгредієнта з звичайним прийнятним для захворювання, деструктивні кісткові порушення, локального застосування розчинником або розріпроліферативні порушення, інфекційні захворюджувачем з використанням відомих методів. вання, вірусні захворювання і нейродегенеративні Композиції для введення інсуфляцією можуть захворювання. мати форму тонкоподрібненого порошку, який місЗапальні захворювання, які можна лікувати тить частки з середнім діаметром, наприклад, або запобігати, включають, але без обмеження, 30мкМ або менше, при цьому сам порошок вклюгострий панкреатит, хронічний панкреатит, астму, чає або тільки активний інгредієнт, або активний алергії і респіраторний дистресс-синдром доросінгредієнт, розбавлений одним або більше фізіолих. логічно прийнятними носіями, наприклад, лактоАвтоімунні захворювання, які можна лікувати зою. Порошок для інсуфляції зручно зберігати в або відвертати, включають, але без обмеження, капсулі, що містить, наприклад, від 1 до 50мг актигломерулонефрит, ревматоїдний артрит, системну вного інгредієнта, для застосування з турбоінгалячервону волчанку, склеродерму, хронічний тиреоїторним пристроєм, наприклад, таким, що застосодит, хворобу Грейвса, автоімунний гастрит, інсулівується для інсуфляції відомого агента нозалежний цукровий діабет (тип І), автоімунну кромоглікату натрію. гемолітичну анемію, автоімунну нейтропенію, Композиції для введення шляхом інгаляції' тромбоцитопенію, атопічний дерматит, хронічний можуть мати форму традиційного аерозолю під активний гепатит, астенічний бульбарний параліч, тиском, пристосованого для вивільнення активного розсіяний склероз, запальну хворобу кишечнику, інгредієнта, або аерозолю, що містить тонкоподрібнені тверді речовини або рідкі краплі. Можуть 37 86196 38 СНІД, пов'язаний з СНІД комплекс або злоякісвиразковий коліт, хворобу Крона, псоріаз або хвоність, келоїдне утворення, утворення рубцевої робу "трансплантат проти хазяїна". тканини, хворобу Крона, виразковий коліт або гіДеструктивні кісткові порушення, які можна ліпертермію. Хвороби, опосередковані TNF, також кувати або відвертати, включають, але без обмевключають вірусні інфекції, наприклад, ВІЛ, ЦМВ, ження, остеопороз, остеоартрит і кісткові поругрип і герпес; і вірусні інфекції у ветеринари, нашення, пов'язані з множинною мієломою. приклад, лентивірусні інфекції, включаючи, але Проліферативні захворювання, які можна лікубез обмеження, вірус кінської інфекційної анемії, вати або відвертати, включають, але без обмевірус артриту кіз, вірус висна або вірус маеді ження, гостру мієлоїдну лейкемію, хронічну мієло(maedi); або ретровірусні інфекції, включаючи віїдну лейкемію, метастатичну меланому, саркому рус імунодефіциту кішок, вірус імунодефіциту корів Капоши і множинну мієлому. або вірус імунодефіциту собак. Інфекційні захворювання, які можна лікувати Хвороба або стан, опосередковані IL-8, вклюабо відвертати, включають, але без обмеження, чають захворювання, що характеризуються масисепсис, септичний шок і шигеллез. вною інфільтруванням нейтрофілів, наприклад, Вірусні захворювання, які можна лікувати або псоріаз, запальна хвороба кишечнику, астма, ревідвертати, включають, але без обмеження, гостперфузійне ушкодження серця і нирок, респіраторий інфекційний гепатит (включаючи гепатит А, рний дистресс-синдром дорослих, тромбоз і глогепатит В і гепатит С), ВІЛ-інфекцію і ЦМВ (цитомерулонефрит. мегаловірусний) ретиніт. Крім того, сполуки згідно з винаходом можуть Дегенеративні стани або захворювання, які бути використані локально для лікування або можна лікувати або відвертати сполуками згідно з профілактики станів, викликаних або загострених винаходом, включають, але без обмеження, хвоIL-1 або TNF. Такі стани включають збуджені сугробу Альцгеймера, хворобу Паркінсона, церебралоби, екзему, псоріаз, запальні стани шкіри, нальну ішемію і інші нейродегенеративні захворюприклад, сонячний опік, запальні стани очей, навання. приклад, кон'юнктивіт, гіпертермію, біль і інші "Стани, опосередковані р38" також включають стани, пов'язані з запаленням. ішемію/реперфузію при інсульті, серцеві напади, Сполуку згідно з винаходом можна застосовуішемію міокарду, гіпоксію органів, судинну гіпервати у комбінації з іншими ліками і терапіями, що плазію, гіпертрофію серця і тромбин-индуковану використовуються для лікування хворобливих стаагрегацію тромбоцитів. нів, в яких корисним є інгібування цитокінов, зокКрім того, інгібітори р38 згідно з винаходом тарема IL-1, TNF, IL-6 або IL-8. кож здатні інгібувати експресію індуцибельних Наприклад, завдяки своїй здатності інгібувати прозапальних білків, таких, як простагландинцитокіни, сполуки Формули I-XVII мають велике ендопероксид-синтаза-2 (PGHS-2), також відома значення при лікуванні деяких запальних і незапаяк циклооксигеназа-2 (СОХ-2). Тому, інші "стани, льних захворювань, які у даний час лікують нестеопосередковані р38" включають набряк, аналгезію, роїдними протизапальними ліками (NSAID), інгібулихоманку і біль, зокрема, нервово-м'язовий біль, ючими циклооксигеназу, наприклад, такими, як головний біль, раковий біль, зубний біль і артритіндометацин кеторолак, ацетилсаліцилова кислоний біль. та, ібупрофен, суліндак, толметин і піроксикам. Стани і хвороби, які можна лікувати або відвеСпільне введення сполуки Формули I-XVII з NSAID ртати інгібіторами р38 згідно з винаходом, також може привести до зниження кількості останнього можуть бути зручно згруповані згідно з цитокіном агента, необхідного для досягнення терапевтично(наприклад IL-1, TNF, IL-6, IL-8), який, як припусго ефекту, і, відповідно, до зменшення імовірності кають, відповідає за це захворювання. несприятливих побічних ефектів від уведення Так, хвороба або стан, опосередковані IL-1, NSAID, таких як шлунково-кишкові ускладнення. включають ревматоїдний артрит, остеоартрит, Таким чином, згідно з ще одною ознакою винахоінсульт, ендотоксемію і/або токсичний шок, западу, запропоновано фармацевтичну композицію, льну реакцію, викликану ендотоксином, запальну яка містить сполуку Формули I-XVII або її фармахворобу кишечнику, туберкульоз, атеросклероз, цевтично прийнятну сіль або естер, здатний до м'язову дистрофію, кахексію, псоріатичний артрит, розщеплення in vivo, у сполученні або у суміші з синдром Рейтера, подагру, травматичний артрит, нестероїдним протизапальним агентом, що інгібує артрит, викликаний вірусом краснухи, гострий сициклооксигеназу, і фармацевтично прийнятний новіт, діабет, захворювання панкреатичних βрозріджувач або носій. клітин і хворобу Альцгеймера. Сполуки Формули I-XVII також можуть бути виХвороба або стан, опосередковані TNF, вклюкористані у лікуванні таких станів, як ревматоїдний чають ревматоїдний артрит, ревматоїдний спонартрит, у комбінації з протиартритними агентами, диліт, остеоартрит, подагричний артрит і інші артнаприклад, золотом, метот-рексатом, стероїдами і ритні стани, сепсис, септичний шок, ендотоксичний пеніцилінаміном, і таких станів, як остеоартрит, у шок, грамнегативний сепсис, токсичний шок, рескомбінації з стероїдами. піраторний дистресс-синдром дорослих, церебраСполуки згідно з винаходом також можна ввольну малярію, хронічне обструктивне захворювандити при деградаційних захворюваннях, наприня легенів, силікоз, легеневий саркоїдоз, клад, остеоартриті, з хондрозахисними, протидегрезорбцію кістки, реперфузійне ушкодження, реарадаційними і/або репаративними агентами, кцію "трансплантат проти хазяїна", відторгнення наприклад, діацереїном (Diacerhein), препаратами алотрансплантату, лихоманку і міальгії внаслідок гіалуронової кислоти, такими як гіалан, Румалон, інфекції, кахексію, вторинну стосовно інфекції, 39 86196 40 Артепарон, і глюкозаміновими солями, наприклад, показання рідинного сцинциляційного лічильника Антрилом. (Packard TopCount HTS). Сполуки Формули I-XVII також можна застосоАналіз РВМС вувати при лікуванні астми у комбінації з такими Здатність сполук згідно з винаходом інгібувати протиастматичними агентами, як бронходілататопродукування TNF-α оцінювали, використовуючи ри і антагоністи лейкотрієнов. мононуклеарні клітини периферичної крові людини Незважаючи на те, що сполуки Формули I-XVII ("РВМС"), що синтезують і секретують TNF-α при головним чином мають велике значення як терастимуляції ліпополісахаридом. певтичні агентів для застосування у теплокровних Розчини досліджуваної сполуки готували, робтварин (включаючи людину), вони також корисні лячи 5-кратні послідовні розведення в ДМСО, які кожного разу, коли виникає потреба інгібувати дію потім розбавляли до 5-кратних маткових розчинів цитокінов. Таким чином, вони є корисними як фарозбавленням MEM, 2%-ної, деактивованої нагрірмакологічні стандарти для застосування при розванням з фетальною телячою сироваткою ("FBS"), робці нових біологічних тестів і в пошуку нових 20мм HEPES, 2мм L-глютаміну і 1% пеніцифармакологічних агентів. лін/стрептоміцину. Активність сполук згідно з винаходом може буРВМС виділяли з людської крові, як описано ти проаналізована стосовно інгібування р38 in нижче. Зразки цільної крові збирали від волонтерів vitro, in vivo або у клітинній лінії. Дослідження in у Vacutainer™ CPT (Becton Dickinson). Вміст пробіvitro включають дослідження, що визначають інгірок перемішували і центрифугували при кімнатній буванні або кіназну активність, або АТФазну актитемпературі (18-25°С) у горизонтальному роторі вність активованої р38. Альтернативні дослідженпротягом мінімум 15хвил. при 1500-1800 RCF (відня in vitro кількісно визначають здатність інгібітору носна відцентрова сила). Для кожного донора шазв'язуватись з р38, причому вимірювання можуть ри лейкоцитів поєднували в окремій пробірці і двічі бути проведені шляхом радіоактивного мічення промивали фосфатно-сольовим буфером ("PBS"). інгібітору перед зв'язуванням, виділенням комплеКлітинний осад ре суспендували у MEM, 2%-ній, ксу інгібітор/р38 і визначенням кількості його, зв'ядеактивованій нагріванням з фетальною телячою заного з радіоізотопом, або шляхом проведення сироваткою ("FBS"), 20мм HEPES, 2мм Lконкурентного експерименту, в якому нові інгібітоглютаміну і 1% пеніцилін/стрептоміцину. Загальну ри інкубують з р38, зв'язаною з відомими радіолікількість клітин визначали гемоцитометром, і конгандами. Ці і інші дослідження є корисними в анацентрацію клітинної суспензії доводили до лізах in vitro і в клітинних культурах і добре відомі 2´106клітин/мкл. фахівцям. У кожну лунку 96-ямкового планшета для кліАналізи інгібіторної дії сполук згідно з винахотинних культур додавали 0,1мкл клітинної суспендом на клітинних культурах можуть бути викорисзії. Додавали 30мкл розчину досліджуваної сполутані для визначення кількостей TNF-α, IL-1, IL-6 ки і клітини інкубували при 37°С в інкубаторі з СО2 або IL-8, що продукуються у цільній крові або її (5% СО2) протягом 1год. Потім у кожну лунку доклітинних фракціях, у клітинах, оброблених інгібідавали 20мкл 7,5нг/мкл ліпополісахариду (ЛПС з тором, у порівнянні з клітинами, обробленими неЕ. соlі K-235) і клітини повертали в інкубатор з 5% гативними контрольними речовинами. Рівень цих СО2 при 37°С на 16-20год. Клітини центрифугувацитокінов може бути визначений через викорисли протягом 15хвил. при 1100 RCF. Приблизно тання наявних у продажі ELISA або згідно з опи0,12мкл надосадової рідини переносили в чистий сом у розділі Біологічні Приклади, наведеному 96-ямковий поліпропіленовий планшет. Зразки нижче. аналізували або відразу, або зберігали при -80°С Біологічні приклади для подальшого використання для аналізу. Рівні Біологічні активності сполук згідно з винахоTNF-α визначали у кожному зразку з використандом були продемонстровані подальшими аналізаням імуноферментного аналізу (ELISA) TNF-α люми in vitro. дини, як описано нижче. Біохімічний аналіз р38 Рівні TNF-α визначали, використовуючи таку Активність р38 аналізували при кімнатній темметодику. Планшети, покриті антитілами TNF-α, пературі у 100мкл реакційної суміші, що містила приготовляли доданням в лунки 96-ямкового 5нМ активованого ферменту р38а і 1мкМ ATF-2 планшета Immunol 4 [Immulon 4 ELISA Flat Bottom (злитого білка активуючого фактора транскрипції, Plate; Dynex, номер у каталозі 011-010-3855] 2) як субстрат у 25мм HEPES (рН7,4), 100мкМ ва150мкл 2мкг/мкл очищених мишачих моноклонанадату, 1мм DTT, 10мм МgСІ 2 і 10мкМ [□-33Р]-АТФ льних анти-TNF-α Іg у карбонат-бікарбонатному (приблизно 0,1мкКю Р33/реакція). Реакцію перерибуфері (ВuрН™ Carbonate-Bicarbonate Buffer Pack) вали через 30-40хвил. доданням 25%-ного ТХУ, і інкубували протягом ночі при 2-8°С. Покриваючий залишали стояти протягом 5хвил. і потім перенорозчин видаляли і додавали 200мкл "блокуючого сили безпосередньо на мембранний фільтраційбуфера" (20мм HEPES рН7,4, 150мм NaCI, 2% ний планшет GF-B. Фільтр двічі промивали протяБСА), і планшети зберігали при 2-8°С до викорисгом 30сек. 0,5%-ною фосфорною кислотою з тання. Десятиточечну стандартну криву для рековикористанням Tomtec Mach III Automated Harмбінантного людського TNF-α одержували шляхом vester. Після промивання вакуум підтримували послідовних розведень (1:2) у "розріджувачі для протягом 30сек., щоб висушити фільтр. У кожну зразків" (20мм HEPES, рН7,4,150мм NaCI, 2мм лунку фільтраційного планшета додавали приблиМgСІ 2, 1% БСА) з максимальною концентрацією зно 30мкл сцинциляційної рідини і потім знімали 6000пг/мкл. 41 86196 42 Блокуючий розчин видаляли з планшетів для каталозі 34064]; n-нітрофенілфосфат [Sigma, № у імуноферментного аналізу TNF-α шляхом 5каталозі N2765]. кратного промивання по 300мкл "буфера для проУ Таблиці 3 показано результати інгібування мивання" (20мм HEPES, рН7,4, 150мм NaCI, 2мм р38 і інгібування індукованої ЛПС секреції TNF-α з МgСІ 2, 0,02% Tween-20). В усі лунки додавали мононуклеарних клітин периферійної крові людини 50мкл "розріджувача для зразків", а потім в усі ("РВМС"). "Активною" сполукою визначали сполулунки додавали або 50мкл стандартного розчину ку, що показала IC50 нижче 500нМ. TNF-α, або надосадову рідину досліджуваної сполуки. Планшет інкубували при кімнатній темпераТаблиця 3 турі протягом 1год. при перемішуванні (300об./хв.). Планшет промивали 5 разів по 300мкл "буфера Інгібування р38 Сполука РВМС ІС50(нМ) для промивання". У кожну лунку додавали 100мкл IC50(hM) 0,2мкг/мкл біотинілованого козячого анти-TNF-α 7f-1 активна активна людини в "розріджувачі антитіл" (20мм HEPES, 7f-2 активна активна рН7,4, 150мм NaCI, 2мм МgСІ 2,1% БСА, 0,02% 7f-3 активна активна Tween-20) і планшет інкубували при кімнатній тем7f4 активна не аналізували пературі протягом 1год. при перемішуванні 7f-7 активна не аналізували (300об./хв.). Планшет промивали 5 разів по 7f-9 активна не аналізували 300мкл "буфера для промивання" на лунку. У кож7f-12 активна не аналізували ну лунку додавали по 100мкл 0,02мкг/мкл стрепта7f-13 активна не аналізували відинолужної фосфатази в "розріджувачі для анти7f-14 активна не аналізували тіл" і планшет інкубували при кімнатній 7f-15 активна не аналізували температурі протягом 1год. при перемішуванні 7f-17 активна не аналізували (300об./хв.). Планшет промивали 5 разів по 11g-1 активна не аналізували 300мкл "буфера для промивання" на лунку. У кож11g-10 активна активна ну лунку додавали по 200мкл 1мг/мкл pΝΡΡ (п11g-14 активна не аналізували нітрофенілфосфату) у дієтаноламіновому буфері з 4f-1 активна активна 0,5мм МgСІ 2 і планшет інкубували протягом 304f-2 активна активна 45хвил. при кімнатній температурі і перемішуванні 4f-7 активна не аналізували (300об./хв.). Хід реакції контролювали шляхом 4f-8 активна не аналізували визначення оптичної щільності (OD): коли верхня 4f-9 активна активна стандартна величина досягала значення OD між 2,0 і 3,0, у кожну лунку додавали по 50мкл 2N 4f-10 активна не аналізували NaOH. Оптичну щільність у кожній лунці визначали 5f-1 активна активна протягом 30хвил., використовуючи мікротитрацій5f-2 активна активна ний планшет-ридер, встановлений на 405нм. Дані 5f-7 активна активна аналізували в XLfit з використанням 45f-8 активна не аналізували параметричної апроксимаційної кривої. 5f-9 активна активна В описаних вище дослідженнях використову5f-10 активна активна вали такі реагенти: фосфатно-сольовий буфер 5f-11 активна не аналізували Дульбекко без кальцію або магнію [Gibco, № у ка5f-12 активна не аналізували талозі 14190]; мінімальне підтримуюче середови2h-1 активна активна ще Голка [MEM; Gibco, № у каталозі 11090]; пені2h-2 активна активна цилін-стрептоміцин [Gibco, № у каталозі 15140]; L2h-10 активна активна глютамін, 200мм [Gibco, № у каталозі 25030]; 1j-2 активна не аналізували HEPES, 1Μ [Gibco, № у каталозі 15630]; фетальна 1j-4 активна не аналізували теляча сироватка ["FBS "; НуСІопе, № у каталозі 2h-1 активна активна SH30070,03]; ліпополісахариди з Escherichia coli К28t активна 235 ["ЛПС"; Sigma, № у каталозі L2018); анти-TNF9q-2 активна α, очищені мишачі моноклональні Ig [R&D Systems, 7t-1 активна № у каталозі МАВ210]; упаковка ВирН™ карбонат6n активна бікарбонатного буфера [Pierce, № у каталозі 16p активна 28382]; HEPES (FW 238,3; Sigma, № у каталозі Н3575]; NaCI [Sigma, № у каталозі S7653]; бичачий Дослідження мишей сироватковий альбумін ["БСА"; Jackson ImmunoReseach, № у каталозі 001-000-162]; поліоМишача модель індукованого ЛПС продукування TNF-α ксиетилен 20 сорбітан монолаурат [Sigma, № у каталозі Р2287]; гексагідрат хлориду магнію TNF-α індукували в мишах-самцях породи [Sigma, № у каталозі М2670]; рекомбінантний TNFDBA-2J (від Jackson Laboratories) ін'єкцією 2мг/кг ліпополісахариду (Sigma, St. Louis) у хвостову веα людини [R&D Systems, № у каталозі 210ТА010]; біотинілування, афінно очищені, козячі Іg проти ну. Через 90хвил. мишей, анестезованих ізофлураном, знекровлювали серцевою пункцією. Потім TNF-α [R&D Systems, № у каталозі BAF210]; стрептавідино-лужна фосфатаза [Jackson зразки крові залишали згортатись протягом двох год. при 4°С і центрифугували. Сироватку відоImmunoResearch, № у каталозі 016-050-084]; дієтаноламіновий субстратний буфер [Pierce, № у кремлювали в пробірки типу "епендорф" для подальшого аналізу TNF-α. Аналіз TNF-α проводили, 43 86196 44 використовуючи набір для ELISA (Quantikine, MN), суспензій. За 30хвил. до ін'єкції ЛПС сполуку ARвідповідно до інструкцій, доданих до набору. 00112190 (10, 30 і 100мг/кг) перорально вводили 7 Сполуку AR-00112190 одержували з 10% групам мишей-самців породи DBA-2J (сім тварин у ДМСО і 90% 20%-ного 2-гідроксил-βгрупі). циклодекстрину (HPCD). Сполука AR-00112190 є Обробка сполукою AR-00112190 (10, 30 і похідною сполуки 14g (див. Фіг.3), де А є ізобути100мг/кг) також значно зменшувала рівні TNF-α. лом. Потім сполуку послідовно розбавляли розAR-00112190 показала аналогічне інгібування чинником (10% ДМСО, 90% 20%-ного HPCD) для (42%) в дозі 100мг/кг (Таблиця 4). одержання концентрацій, необхідних для менших Результати цього аналізу показали істотну подоз. Сполука переходила у розчин з доданням зитивну дію при 10, 30 і 100мг/кг AR-00112190 ДМСО, а потім "виходила" з розчину при доданні (29%, 44% і 42%). 20%-ного HPCD. Тому сполуку дозували у вигляді Таблиця 4 Група Обробка I ЛПС+Розчинник II ЛПС+AR-00112190, 10мг/кг III ЛПС+AR-00112190, 30мг/кг IV ЛПС+AR-00112190, 100мг/кг Тварина 1 2 3 4 5 6 7 1 2 3 4 5 6 7 1 2 3 4 5 6 7 1 2 3 4 5 6 7 Рівень TNF, пг/мол 3290 3545 3212 5604 4978 2947 3196 3373 2047 2782 2080 2365 3298 2967 2815 1826 1464 3135 1393 2124 2074 1783 1832 2333 3257 1553 1683 Препаративні приклади Подальші приклади ілюструють винахід. Однак слід відзначити, що ці приклади не обмежують винаходу і призначені тільки для того, щоб запропонувати спосіб практичного здійснення винаходу. Фахівцю зрозуміло, що описані хімічні реакції можуть бути легко адаптовані для одержання цілого ряду інших інгібіторів р38 згідно з винаходом, і інші способи одержання сполук згідно з винаходом розглядаються як такі, що входять в об'єм винаходу. Наприклад, синтез сполук згідно з винаходом, для яких не наведено прикладів, може бути успішно здійснений за допомогою модифікацій, очевидних для фахівців, наприклад, з використанням відповідних захисних груп, що заважають, або шляхом використання інших придатних реагентів, відомих у даній області техніки, які відрізняються від описаних, і/або шляхом стандартних змін реакційних умов. В іншому варіанті, інші реакції, описа Середнє зна- Стандартне від% інгібування чення хилення 3825 390 0 2706 206 29 2126 292 44 2216 224 42 ні тут або відомі з рівня техніки, будуть визнані придатними для одержання інших сполук згідно з винаходом. Приклади У Прикладах, описаних нижче, якщо не зазначено інакше, всі температури визначені в градусах Цельсія. Реагенти були придбані від таких комерційних постачальників, як Aldrich Chemical Company, Lancaster, TCI або Maybridge, і, якщо не зазначено інакше, вони були використані без додаткового очищення. Тетрагідрофуран (ТГФ), Ν,Ν-диметилформамід (ДМФ), ДХМ (ДХМ), толуол, діоксан і 1,2-дифлуоретан були придбані від Aldrich у надійно закритих пляшках і використані у тому вигляді, в якому були отримані. Описані нижче реакції звичайно проводили при позитивному тиску нітрогену або аргону, або з використанням осушувального патрону (якщо не зазначено інакше) у безводних розчинниках; реак 45 86196 46 Приблизно 800мг сполуки 5а (без додаткового ційні колби звичайно були обладнані гумовими очищення), 312мг ацетату калію і 190мг 18-краун-6 мембранами для введення субстратів і реагентів розчиняли/суспендували у 5мл хлороформу в атшприцом. Скляний посуд сушили в сушильній шамосфері сухого нітрогену. Потім реакційну суміш фі і/або нагріванням. розподіляли між СН2СІ 2 і водою. Шар СН2СІ 2 проКолонну хроматографію виконували на системивали водою і розсолом, сушили над Na2SO4, мі Biotage (виробник: Dyax Corporation), яка має фільтрували і концентрували під вакуумом. Отриколонки з силікагелем, або на картриджі з силікаманий залишок очищали на колонці Biotage, одергелем SepPak (Waters). жуючи 388мг сполуки 6а. Спектри 1Н-ЯМР реєстрували на приладі Стадія D: 173,3мг сполуки 6а, 195мг карбонату Bruker, що працює при 300МГц, або на приладі калію, 110мкл 4-метоксибензил-хлориду і 10,5мг Varian, що працює при 400Мгц. Спектри 1Н-ЯМР йодиду натрію розчиняли/суспендували у 1мл безодержували з розчинів CDCI 3 (у млн-1) з викорисводного ДМФ в атмосфері сухого нітрогену. Реактанням хлороформу як еталону (7,25млн-1). Інші ційну суміш нагрівали до 85°С протягом 1,5год. і розчинники для ЯМР використовували в разі попотім охолоджували до температури навколиштреби. Коли повідомляється про мультиплетности нього середовища. Реакційну суміш розподіляли піків, то використовуються такі скорочення: s (синміж СН2СІ 2 і водою і шар СН2СІ 2 промивали водою глет), d (дублет), t (триплет), m (мультиплет), br і розсолом, сушили над Na2SO4, фільтрували і (розширений), dd (дублет дублетів), dt (дублет концентрували під вакуумом. Отриманий залишок триплетів). У тих випадках, коли приведені констаочищали на колонці Biotage, одержуючи приблизнти взаємодії, вони представлені в герцах (Гц). но 100мг сполуки 7а. Приклад 1 Одержання 5-(4Приклад 2 Одержання 1-аліл-5-(4флуорсфенілсульфаніл)-1-(4-метоксибензил)-1Нфлуорфенокси)-1H-піразоло[3,4-с]піридину (14а) піразоло[3,4-с]піридину (7а) Фіг.2 - реакційна схема синтезу сполуки 14а Фіг.1 - реакційна схема синтезу сполуки 7а зазагальної Формули II. гальної Формули II. У цьому прикладі описано синСтадія А: У круглодонній колбі 4-флуорфенол тез сполуки 7а, де R - 4-метоксибензил, і X - суль(сполука 8а; 1,3мл, 2,0ммоль) розбавляли 25мл фур. безводного ТГФ і реакційну суміш охолоджували у Стадія А: 1,285г 2-хлор-4-метил-5крижаній ванні і повільно додавали трет-бутоксид нітропіридину (сполука 1а) і 1,023г 4калію (12,0мл, 12,0ммоль). Потім додавали 2-хлорфлуорбензолтіолу розчиняли у 15мл безводного 4-метил-5-нітропіридин (сполука 1а; 2,23г, ТГФ в атмосфері сухого нітрогену. До цього розчи12,5ммоль) і реакційну суміш нагрівали до кімнатну повільно додавали 207мг гідриду натрію (95% в ної температури і перемішували протягом 12год. олії). Потім реакційну суміш розподіляли між Реакційну суміш концентрували і залишок розбавЕtOАс і 0,1N водним NaOH (для видалення будьляли СН2СІ 2. Органічний шар промивали 1N розякої кількості тіолу що не прореагував), потім орчином NaOH і розсолом, сушили над Na2SO4 і фіганічний шар промивали розсолом, сушили над льтрували. Фільтрат концентрували до темного Na2SO4, фільтрували і концентрували під вакуузалишку, який очищали на колонці з діоксидом мом. Отриманий залишок очищали на колонці Bioкремнію Biotage 40Μ, елююючи сумішшю tage, елююючи градієнтом: від 1:1 гексан/СН2СІ 2 СН2СІ 2/гексани (50:50) і одержуючи 2,84г сполуки до 100% СН2СІ 2 і одержуючи 1,90г сполуки 2а. 10а у вигляді білої твердої речовини. Стадія В: Приблизно 1,90г сполуки 2а і 1,88г Стадія В: У круглодонній колбі сполуку 10а порошку заліза додавали до 20мл оцтової кислоти (2,6г, 11ммоль) розбавляли 40мл ЕЮН, потім дов атмосфері сухого нітрогену. Потім реакційну судавали Pd(OH)2 (230мг, 2ммоль) з подальшим доміш нагрівали при 90°С протягом приблизно данням форміату амонію (3,3г, 53ммоль). Реакцій45хвил. з одержанням проміжного продукту За. ну суміш нагрівали при 80°С до повної витрати Приблизно 1,90г проміжного продукту 3а і 1,160г вихідної речовини 10а, що визначали за допомоNaOH розчиняли у 20мл метанолу в атмосфері гою РХВЕ (рідинна хроматографія високої ефектисухого нітрогену протягом приблизно 3,5год. і повності). Реакційну суміш фільтрували через папір з тім реакційну суміш охолоджували до температури скловолокна і фільтрат концентрували. Залишок навколишнього середовища і перемішували при розбавляли СН2СІ 2 і органічний шар промивали цій температурі протягом 12год. Реакційну суміш насиченим NaHCO3 і розсолом, сушили над концентрували під вакуумом і потім розподіляли Na2SO4, фільтрували і концентрували, одержуючи між СН2СІ 2 і водою. Шар СН2СІ 2 промивали розсо1,92г сполуки 11а у вигляді білої твердої речовини. лом, сушили над Na2SO4, фільтрували і концентСтадія С: Сполуку 11а перетворювали у спорували під вакуумом, одержуючи сполуку 4а. луку 13а згідно з способом, описаним у стадії С Стадія С: 1,54г сполуки 4а (без додаткового Прикладу 1. Сполуку 11а і тетрафлуорборат амоочищення) і 896мг тетрафлуорборату амонію пенію переносили в розчин ацетону і води (1:1). Пореносили в 10мл розчину ацетону і води (1:1). Потім реакційну суміш вносили у крижану ванну тім реакційну суміш вносили у крижану ванну (0°С), додавали концентровану НСІ, потім нітрит (0°С), до якої додавали 600мкл концентрованої натрію і отримували осад. Осад збирали, сушили НСІ, а потім 514мг нітриту натрію. Потім реакційну на повітрі і потім додатково сушили шляхом азеосуміш перемішували протягом приблизно 45хвил., тропної перегонки з етанолу і толуолу, одержуючи після чого формувався осад проміжної сполуки 5а. проміжну сполуку 12а. Сполуку 12а, ацетат калію і Осад збирали, сушили на повітрі і потім додатково 18-краун-6 розчиняли/суспендували в хлороформі сушили шляхом азеотропної перегонки з етанолу і в атмосфері сухого нітрогену. Потім реакційну сутолуолу, одержуючи приблизно 800мг сполуки 5а. 47 86196 48 ним отвором для нітрогену сполуку 6а, отриману міш розподіляли між СН2СІ2 і водою. Шар СН2СІ 2 відповідно до Прикладу 1, розбавляли 4мл ДМФ, промивали водою і розсолом, сушили над Na2SO4, потім додавали 22мг NaH і починалося виділення фільтрували і концентрували під вакуумом. Отрипухирців. Після стабілізації додавали алілбромід маний залишок очищали на колонці Biotage, одер(0,8мл) і реакцію перемішували в атмосфері нітрожуючи сполуку 13а. гену при кімнатній температурі. Реакційну суміш Стадія D: У круглодонній колбі сполуку 13а гасили водою і потім концентрували. Залишок перозбавляли 4мл ДМФ, потім додавали 22мг NaH і реносили в СН2СІ 2 і промивали насиченим розчипочиналося виділення пухирців. Після стабілізації ном бікарбонату натрію і розсолом і потім сушили додавали 0,8мл алілброміду і суміш перемішували до оранжевої плівки. Плівку очищали на колонці в атмосфері нітрогену при кімнатній температурі. Biotage 12Μ з діоксидом кремнію, елююючи суміРеакційну суміш гасили водою і потім концентрушшю 4% ЕtOАс/СН2СІ 2 і одержуючи сполуку 18а. вали. Залишок розбавляли СН2СІ 2 і органічний Приклад 7 Одержання 1-Ν-заміщених 4шар промивали насиченим бікарбонатом натрію і азаіндазолов (7b) розсолом, концентрували до плівки і сушили. Фіг.7 - реакційна схема синтезу сполуки 7b заОтриманий залишок очищали на колонці Biotage гальної Формули III. 12Μ з діоксидом кремнію, елююючи сумішшю 4% Стадія А: У круглодонній колбі 4ЕtOАс:СН2СІ 2 і одержуючи сполуку 14а. флуорбензолтіол розбавляли безводним ТГФ. Приклад 3 Одержання 3-[5-(4Реакційну суміш охолоджували до 0°С у крижаній флуорфенілокси)-піразоло[3,4-с]піридин-1-іл]ванні і потім до реакційної суміші повільно додапропан-1,2-діолу (15а) вали 1,0М трет-бутоксид калію в ТГФ. Реакційну Фіг.3 - реакційна схема синтезу сполуки 15а суміш перемішували при 0°С протягом 10хвил., загальної Формули II. У круглодонній колбі 79мг потім додавали 5-хлор-3-метил-2-нітропіридин (0,3ммоль) сполуку 14а, отриману відповідно до (сполука 1b) і реакційну суміш перемішували при Прикладу 2, розбавляли 2мл безводного СН2СІ 2. В 0°С протягом 10хвил. і потім нагрівали до кімнататмосфері нітрогену додавали триметиламін-Nної температури. Реакційну суміш концентрували і оксид (27мг, 0,35ммоль). Після того розчинення залишок розбавляли СН2СІ 2. СН2СІ 2 промивали 1N усіх твердих речовин додавали Os4 (11мг, розчином NаОН і розсолом, сушили над Na2SO4, 0,04ммоль) і реакційну суміш перемішували при фільтрували і фільтрат концентрували до жовтої кімнатній температурі. Потім реакційну суміш розолії. Отриманий залишок очищали на колонці Bioподіляли між СН2СІ 2 і водою. Органічний шар суtage 40Μ, елююючи сумішшю гексан/СН2СІ 2 (50:50) шили над Na2SO4, фільтрували і потім концентруі одержуючи сполуку 3d. вали до плівки. Плівку очищали на колонці Biotage Стадія В: Сполуку 30 відновлювали порошком 12Μ з діоксидом кремнію, елююючи ЕtOАс і одерзаліза і оцтовою кислотою, як описано в Прикладі жуючи 82мг сполуки 15а. 1, стадія В, одержуючи сполуку 4b. Приклад 4 Одержання [5-(4-флуорфенілокси)Стадія С: Сполуку 4b обробляли тетрафлуорпіразоло[3,4-с]піридин-1-іл]-ацетальдегіду (16а) боратом амонію в потім концентрованою НСІ і нітФіг.4 - реакційна схема синтезу сполуки 16а. ритом натрію, як описано в Прикладі 1, стадія С, 0,3М розчин NalO4 (2мл) поєднували з 1г силікагеодержуючи проміжну сполуку 5b. Без додаткового лю з одержанням суспензії. Суспензію розбавляли очищення сполуку 5b з'єднували з ацетатом калію 3мл СН2СІ 2 і додавали 82мг (0,3ммоль) сполуки і 18-краун-6, як описано в Прикладі 1, стадія С, 15а, отриманої відповідно до Прикладу 3, у суодержуючи сполуку 6b. спензію з 1мл СН2СІ 2 і цю суспензію перемішували Стадія D: Кожну з сполук 7b-1, 7b-2 і 7b-3 одепротягом 2год. Через 3год. реакційну суміш фільтржували з сполуки 6b, як показано на Фіг.7. Для рували і наповнювач промивали СН2СІ 2. Фільтрат одержання сполуки 7b-1 сполуку 6b обробляли концентрували, одержуючи 35мг сполуки 16а у NaH і алілбромідом, як описано у Прикладі 6. вигляді коричневої плівки. Приклад 8 Приклад 5 Одержання 3-[5-(4-флуорфенілсульфаніл)Одержання 5-(4-флуорфенілокси)-1-оксазол-5піразоло[4,3-b]піридин-1-іл]-пропіламіну (8b) ілметил-1Н-піразоло[3,4-с]піридину (17а) Фіг.8 - реакційна схема синтезу сполуки 8Ь заФіг.5 - реакційна схема синтезу сполуки 17а гальної Формули III. У круглодонній колбі сполуку загальної Формули II. У круглодонній колбі сполуку 7b-3, отриману відповідно до Прикладу 7, розбав16а (32мг, 0,11ммоль), отриману відповідно до ляли СН2СІ 2 і трифлуороцтовою кислотою. РеакПрикладу 4, поєднували з МеОН (2мл) і K2СО3 ційну суміш перемішували до витрати вихідної (32мг, 0,2ммоль), потім додавали тозилметилізоречовини, що визначали ТШХ і потім концентруваціанід (25мг, 0,13ммоль) і реакційну суміш нагрівали і отриманий залишок розбавляли СН2СІ 2. ли до температури дефлегмації. Потім реакційну СН2СІ 2 промивали 1N NaOH і розсолом, сушили суміш концентрували і залишок розбавляли над Na2SO4, фільтрували і концентрували. ОтриСН2СІ 2. СН2СІ 2 промивали водою і 1N НСІ, відоманий залишок очищали на колонці Biotage 12Μ з кремлювали і концентрували. Отриманий залишок діоксидом кремнію, елююючи сумішшю 10% очищали на колонці з діоксидом кремнію, елюююMeOH/CH2CI 2/NH4OH і одержуючи сполуку 8b. чи сумішшю 80% ЕtOАс/СН2СІ2 і одержуючи споПриклад 9 луку 17а. Одержання 6 (4-флуорфенілсульфаніл)-3-(4Приклад 6 Одержання 1-аліл-5-(4-флуорметоксибензил)-1Н-індазолу (1 Ос) фенілсульфаніл)-1Н-піразоло[3,4-с]піридину (18а) Фіг.9 - реакційна схема синтезу сполуки 10с Фіг.6 - реакційна схема синтезу сполуки 18а загальної Формули IV. загальної Формули II. У круглодонній колбі з вхід 49 86196 50 Стадія F: Сполуку 6с (1,90г) і 509мг дигідрату Стадія А: У круглодонній колбі 6-нітроіндол триметиламін-N-оксиду розчиняли в 30мл СН2СІ 2 в (сполука 1с; 15,5г, 95ммоль) розчиняли у 1,4атмосфері сухого нітрогену. До цієї реакційної судіоксані (400мл). Додавали NaOH (3,8г, 95ммоль) і міші додавали 51мг тетроксиду осмію. Реакційну реакційну суміш перемішували протягом 10хвил. суміш перемішували протягом 12год. при кімнатній Потім до реакційної суміші додавали 266мл 2N температурі. Додавали перйодат натрію (1,71г), NaOH з подальшим доданням кристалів йоду (дві розчинений приблизно у 30мл води і реакційну порції по 54,4г для загального додання 214ммоль) суміш перемішували протягом 1год. Потім реакі реакційну суміш перемішували протягом 12год. ційну суміш розподіляли між EtOAc і водою. Шар Реакційну суміш гасили 10%-ною лимонною кислоEtOAc промивали розсолом, сушили над Na2SO4, тою і розбавляли ЕtOАс. Органічний шар промифільтрували і концентрували під вакуумом. Отривали 10%-ним NaHSO3, NaHCO3 і розсолом, сушиманий залишок очищали на колонці Biotage, одерли над Na2SO4, фільтрували і концентрували, жуючи 889мг сполуки 7с. одержуючи 27,5мг сполуки 2с у вигляді оранжевої Стадія G: Сполуку 7с (460мг) додавали до твердої речовини. 10мл безводного ТГФ в атмосфері сухого нітрогеСтадія В: Сполуку 2с (5,18г) розчиняли в 50мл ну. Суміш охолоджували до -78°С і потім додавали безводного ТГФ в атмосфері сухого нітрогену. До 2,80мл 4-метоксифенілмагнійброміду у ТГФ (0,5М). цього розчину додавали 18,8мл 1,0М розчину Реакційну суміш повільно нагрівали до кімнатної трет-бутоксиду калію у ТГФ. Реакційну суміш петемператури, гасили водою і розподіляли між ремішували протягом приблизно 15хвил., після EtOAc і насиченим водним NaHCO3. Органічний чого додавали 3,20мл хлортриметилсилану. Потім шар сушили над Na2SO4, фільтрували і концентруреакційну суміш розподіляли між ЕtOАс і насичевали під вакуумом. Отриманий залишок очищали ним водним NaHCO3. Органічну фазу сушили над на колонці Biotage, одержуючи 320мг проміжного Na2SO4, фільтрували і концентрували під вакуупродукту. Проміжний продукт (151мг) розчиняли в мом. 1мл СН2СІ 2 і 60мкл триетилсилану в атмосфері Отриманий залишок очищали на колонці Bioсухого нітрогену. До цієї реакційної суміші додаваtage, одержуючи 3,85г сполука 3с у вигляді жовтої ли 1мл трифлуороцтової кислоти. Потім реакційну твердої речовини. суміш концентрували під вакуумом і залишок розСтадія С: Сполуку 3с (3,85г), 766г транс-2поділяли між СН2СІ 2 і водним насиченим NaHCO3. фенілвінілборної кислоти, 531мг Pd(PPh3)4 і Шар СН2СІ 2 сушили над Na2SO4, фільтрували і 14,20мл 2,0М Na2CO3 розчиняли/суспендували у концентрували під вакуумом. Отриманий залишок 50мл діоксану в атмосфері сухого нітрогену. Реакочищали на колонці Biotage, елююючи градієнтом: ційну суміш гріли при температурі дефлегмації від 10:1 гексан/СН2СІ 2 до 100% СН2СІ 2 і одержуюпротягом ночі, потім охолоджували до температучи 76,6мг сполуки 8с. ри навколишнього середовища і концентрували Стадія Н: Сполуку 8с (151мг), 80мкл 4під вакуумом. Отриманий залишок розподіляли флуорфенілтіолу, 12,0мг порошку міді і 300мкл між СН2СІ 2 і водою. Шар СН2СІ 2 сушили над 5,ОМ водного NaOH додавали до 1мл безводного Na2SO4, фільтрували і концентрували під вакууДМФ в запаяній пробірці і потім гріли при 90°С мом. Отриманий залишок очищали на колонці Bioпротягом 16год. Реакційну суміш розподіляли між tage, одержуючи сполуку 4с. СН2СІ 2 і 1,0М водним NaOH. Шар СН2СІ 2 промиваСтадія D: Сполуку 4с (573мг) і 103мг 10% Pd/C ли 1,0М водного NaOH, 3,0Н водним NH4OH і розрозчиняли/суспендували в 10мл розчину еон/TГФ солом, сушили над Na2SO4, фільтрували і концен(3:1) в атмосфері сухого нітрогену. До цього розтрували під вакуумом. Залишок очищали на чину додавали 500мкл гідразину і реакційну суміш колонці Biotage, одержуючи 76,6мг сполуки 9с. перемішували протягом 2год. при температурі Стадія І: Сполуку 9с (76,6мг) і 100мкл етиленнавколишнього середовища. Потім реакційну судіаміну розчиняли в 1,6мл 1,0М розчину флуориду міш фільтрували через целіт, целіт промивали тетрабутиламонію у ТГФ в атмосфері сухого нітроЕtOН і СН2СІ 2 і фільтрат концентрували під вакуугену. Реакційну суміш нагрівали до температури мом. Отриманий залишок розподіляли між СН2СІ 2 і дефлегмації протягом приблизно 12год. Потім реводою. Шар СН2СІ 2 промивали водою і розсолом, акційну суміш охолоджували до кімнатної темпесушили над Na2SO4, фільтрували і концентрували ратури і розподіляли між СН2СІ 2 і водою. Шар під вакуумом, одержуючи сполуку 5с. СН2СІ 2 промивали 10%-ною водною лимонною Стадія Е: Сполуку 5с (2,51г) розчиняли у 30мл кислотою і насиченим водним NaHCO3, сушили оцтової кислоти і 6мл води в атмосфері сухого над Na2SO4, фільтрували і концентрували під ванітрогену. До цієї реакційної суміші додавали куумом. Залишок очищали на колонці Biotage, 3,2мл концентрованої НСІ. Реакційну суміш потім елююючи градієнтом: від 5:1 гексан/СН2СІ 2 до охолоджували до 0°С і додавали 535мг нітриту 100% СН2СІ 2, одержуючи 25мг сполуки 10с. натрію. Потім реакційну суміш перемішували проПриклад 10 тягом приблизно 30хвил., після чого додавали Одержання [6-(4-флуорфенілсульфаніл)-1Н4,0мл водного розчину 1,23мг йодиду натрію і iндазол-3-iл] метанолу (14с) 885мг йоду. Приблизно через 4год. реакційну суФіг.10 - реакційна схема синтезу сполуки 14с міш гасили водним насиченим NаНСО3 (повільне загальної Формули IV. додання) і потім розподіляли між СН2СІ 2 і водою. Стадія А: Сполуку 7с (520мг), отриману відпоШар СН2СІ 2 сушили над Na2SO4, фільтрували і відно до Прикладу 9, розчиняли в 5мл метанолу в концентрували під вакуумом. Отриманий залишок атмосфері сухого нітрогену. До цього розчину доочищали на колонці Biotage, одержуючи 1,90г сподавали 98,3мг борогідриду натрію. Приблизно челуки 6с. 51 86196 52 рез 30хвил. реакційну суміш концентрували під Стадія А: 2-флуор-4-гідроксиацетофенон (сповакуумом і потім розподіляли між СН2СІ 2 і водою. лука 19с; 1,42г) і 1,40г карбонату калію розчиняШар СН2СІ 2 сушили над Na2SO4, фільтрували і ли/суспендували у 30мл безводного ДМФ в атмоконцентрували під вакуумом. Отриманий залишок сфері сухого нітрогену. До цієї реакційної суміші очищали на колонці Biotage, одержуючи сполуку додавали 1,20мл бензилброміду. Приблизно через 12с. 90хвил. реакційну суміш нагрівали до 65°С протяСтадія В: Сполуку 12с (151мг), метанол, гом 45хвил. і потім охолоджували до кімнатної 100мкл 4-флуорфенілтіолу, 6,0мг порошку міді і температури. Реакційну суміш концентрували під 250мкл 5,0М водного NaOH додавали до 1мл безвакуумом і залишок розподіляли між СН2СІ 2 і воводного ДМФ в запаяній пробірці і потім гріли при дою. Шар СН2СІ 2 промивали водою і розсолом, 90°С протягом 30год., після чого реакційну суміш сушили над Na2SO4, фільтрували і концентрували охолоджували до температури навколишнього під вакуумом, одержуючи сполуку 20с. середовища і розподіляли між СН2СІ2 і 1,0М водСтадія В: Сполуку 20с (1,87г) додавали до ним NaOH. Шар СН2СІ 2 промивали 1,0М водним 20мл етиленгліколю в атмосфері сухого нітрогену. NaOH, 3,0Н водним NH4OH і розсолом, сушили До цієї реакційної суміші додавали 250мкл безвонад Na2SO4, фільтрували і концентрували під вадного гідразину. Суміш перемішували протягом куумом. Отриманий залишок очищали на колонці 1год. при кімнатній температурі і потім гріли при Biotage, елююючи сумішшю СН2СІ 2/ЕtOАс (5:1) і 160°С протягом 7год. Потім реакційну суміш охоодержуючи 67,9мг сполуки 13с. лоджували до кімнатної температури і гасили воСтадія С: Сполука 13с (67,9мг) і 100мкл етидою. Сіль, що випала в осад, збирали і сушили на лендіаміну розчиняли у 1,5мл флуориду тетрабуповітрі, а потім додатково сушили шляхом азеоттиламонію у ТГФ (1,0М) в атмосфері сухого нітроропної перегонки з етанолу і толуолу. Сіль, що гену. Реакційну суміш нагрівали до температури випала в осад, розбавляли безводним ацетонітридефлегмації протягом приблизно 12год., потім лом і потім додавали 500мг диметиламінопіридину охолоджували до кімнатної температури і розподіі 311мг ди-трет-бутилдикарбонату (Вос-ангідриду). ляли між СН2СІ 2 і водою. Шар СН2СІ 2 промивали Після розчинення усіх твердих речовин реакційну 10%-ний водною лимонною кислотою і насиченим суміш концентрували під вакуумом і отриманий водним NaHCO3, сушили над Na2SO4, фільтрували залишок очищали на колонці Biotage, одержуючи і концентрували під вакуумом. Отриманий залишок 710мг сполуки 21с. очищали на колонці Biotage, одержуючи 18мг споСтадія С: Сполуку 21с (710мг), 662мг форміату луки 14с. амонію і 223мг каталізатора Перл-мана (Pearlman, Приклад 11 Pd(OH)2C) розчиняли/суспендували у 20мл етаноОдержання 6-(4-флуорфенілсульфаніл)-3лу в атмосфері сухого нітрогену. Реакцію гріли при метоксиметил-1H-iндазолу (17с) 85°С протягом 30хвил. і потім фільтрували через Фіг.11 - реакційна схема одержання сполуки целіт. Целіт промивали ЕtOН і об'єднані фільтрати 17с загальної Формули IV. концентрували під вакуумом. Отриманий залишок Стадія А: Сполуку 12с (186мг), отриману відрозподіляли між СН2СІ 2 і насиченим водним Naповідно до Прикладу 10, Стадія А, розчиняли у HCO3, сушили над Na2SO4, фільтрували і концент5мл безводного ТГФ в атмосфері сухого нітрогену. рували під вакуумом, одержуючи сполуку 22с. До цього розчину додавали 36,8мг гідриду натрію Стадія D: Сполуку 22с (103мг), 174мг 4(60% в олії), реакційну суміш перемішували протяфлуорфенілборної кислоти, 75мг ацетату міді (II) і гом приблизно 15хвил. і потім до реакційної суміші 300мкл триетиламіну розчиняли/суспендували у додавали 60мкл метилйодиду. Приблизно через 2мл безводного СН2СІ 2 і до цього розчину додава1год. реакційну суміш гасили водою і розподіляли ли 4Å молекулярні сита. Реакційну суміш піддаваміж СН2СІ 2 і водним насиченим NaHCO3. Шар ли дії повітря протягом приблизно 5год. і потім СН2СІ 2 сушили над Na2SO4, фільтрували і конценфільтрували і концентрували під вакуумом. Отритрували під вакуумом. Отриманий залишок очиманий залишок очищали на колонці Biotage, елющали на колонці Biotage, елююючи сумішшю юючи СН2СІ 2 і одержуючи 85мг сполуки 23с. СН2СІ 2/ЕtOАс (100:1) і одержуючи 76,1мг сполуки Стадія Е: Сполуку 23с (85мг) розчиняли у 2мл 15с. розчину СН2СІ/ТФУ (1:1) в атмосфері сухого нітроСтадія В: Сполуку 15с вводили в реакцію з 4гену. Реакційну суміш перемішували протягом флуортіофенолом, порошком міді і водним NaOH у приблизно 30хвил., після чого концентрували під ДМФ способом, описаним у Стадії В Прикладу 10, вакуумом. Отриманий залишок розподіляли між одержуючи сполуку 16с з виходом 22%. СН2СІ 2 і водним насиченим NaHCO3. Шар СН2СІ 2 сушили над Na2SO4, фільтрували і концентрували Стадія С: Сполуку 16с вводили в реакцію з під вакуумом, одержуючи 18с-2. флуоридом тетрабутиламонію і етилендіаміном у Для одержання інших сполук, що мають загаТГФ способом, описаним у Стадії С Прикладу 10, льну структуру 18с, сполуку 22с вводили в реакцію одержуючи сполуку 17с з виходом 53%. з фенілборатом або відповідним чином заміщеним Приклад 12 фенілборатом, як описано в стадії D, і потім оброОдержання 6-(4-флуорфенокси)-3-метил-1Нбляли, як описано у стадії Е. індазолу (18с-2) Приклад 13 Фіг.12 - реакційна схема синтезу сполуки, що Одержання 3-етил-6-(4мають загальну структуру 18с і загальну Формулу флуорФенілсульфаніл)-1Н-індазолу (26с) IV. У цьому прикладі описано синтез сполуки 18сФіг.13 - реакційна схема синтезу сполуки 26с 2, де Аr - 4-флуорфеніл. загальної Формули IV. 53 86196 54 Стадія А: 4-флуортіофенол (сполука 24с; концентрували в толуолі, одержуючи сполуку 30с у 900мкл) розчиняли у 40мл безводного ТГФ в атмовигляді білої твердої речовини. сфері сухого нітрогену. До цього розчину додавали Стадія D: У круглодонній колбі сполуку 30с 8,40мл трет-бутоксиду калію в ТГФ (1,0М), а потім розчиняли у 40мл тіонілхлориду і гріли при 90°С 10мл безводного ДМФ. Реакційну суміш перемішупротягом 2год. Реакційну суміш охолоджували і вали при температурі навколишнього середовища потім концентрували до жовтуватої твердої речопротягом 10хвил., після чого додавали 1,43г 2,4вини, яку розчиняли у 20мл ацетону і охолоджувадифлуорпропіофенону і суміш залишали реагували до 0°С у крижаній ванні і потім дуже повільно ти протягом приблизно 12год. при кімнатній темдодавали 10мл NH4OH. Реакційну суміш гасили пературі. Потім реакційну суміш розподіляли між водою і потім концентрували. Отриманий залишок Et2O і водою. Шар Et2O промивали насиченим воекстрагували СН2СІ 2, СН2СІ 2 сушили над Na2SO4 і дним NaHCO3, сушили над Na2SO4, фільтрували і концентрували, одержуючи сполуку 31с. концентрували під вакуумом, одержуючи сполуку Стадія Е: У круглодонній колбі сполуку 31с 25с. (3,4г, 12,3ммоль) розчиняли у 100мл дихлоретану і Стадія В: Сполуку 25с (2,34г) і 260мкл безводпотім додавали оксалілхлорид (5,4мл, 62ммоль) і ного гідразину суспендували/розчиняли в етиленгреакційну суміш гріли при 55°С протягом 2год. ліколі в атмосфері сухого нітрогену. Потім реакРеакційну суміш концентрували і отриману олію ційну суміш гріли при приблизно 70°С протягом перемішували у воді (50мл) і потім охолоджували 1год., потім при приблизно 160°С протягом 12год. до приблизно 0°С у крижаній ванні (з повільним Реакційну суміш охолоджували до кімнатної темдодаванням NH4OH для гасіння надлишку оксалілператури і гасили приблизно 100мл води і потім хлориду). Реакційну суміш екстрагували СН2СІ 2 і розподіляли між СН2СІ 2 і водою. Шар СН2СІ 2 проорганічний шар сушили над Na2SO4, фільтрували і мивали водою і водним насиченим NaHCO3, суконцентрували, одержуючи сполуку 32с у вигляді шили над Na2SO4, фільтрували і концентрували темної олії. під вакуумом. Отриманий залишок очищали на Стадія F: У круглодонній колбі сполуку 32с колонці Biotage, одержуючи 770мг сполуки 26с. (2,21г, 8,5ммоль) розбавляли 100мл ЕtOН і потім Приклад 14 додавали Pd(OH)2 (300мг) і потім форміат амонію Одержання 5-(4-флуорфенокси)-1H-індазол-3(2,7г, 43ммоль). Реакційну суміш нагрівали до теіл-аміну (34с) мператури дефлегмації протягом 18год., фільтруФіг.14 - реакційна схема синтезу сполуки 34с вали через папір з скловолокна для видалення Pd загальної Формули VI. і папір промивали ЕЮН. Фільтрат концентрували і Стадія А: У круглодонній колбі до 5-флуор-2отриманий залишок переносили в СН2СІ 2 і проминітробензойної кислоти (сполука 27с; 10,0г, вали насиченим бікарбонатом натрію і розсолом, 54,0ммоль) додавали 50мл МеОН і 200мл толуосушили над Na2SO4, фільтрували і концентрували, лу. Додавали приблизно 41мл триметилсилілдіаодержуючи сполуку 33с у вигляді жовтої твердої зометану (2,ОМ), повільно, при перемішуванні. речовини. Після припинення виділення пухирців реакцію гаСтадія G: Сполуку 33с (280мг, 1,3ммоль) вносили 1мл оцтової кислоти. Реакційну суміш концесили у круглодонну колбу у ванні з крижаною вонтрували у вакуумі, одержуючи сполуку 28с. дою і додавали 5мл НОАс і 2,5мл Н2О. Реакційну Стадія В: У круглодонній колбі 4-флуорфенол суміш підтримували при температурі 0°С, додава(4,0г, 35ммоль) розбавляли 100мл безводного ли НСІ (0,35мл, 6ммоль) і через 5хвил. додавали ТГФ. Реакційну суміш охолоджували до 0°С у криNaNO2 (93мг, 1,3ммоль). Приблизно через 1год. жаній ванні і потім повільно додавали 1,0М третдодавали дигідрат хлориду олова (II) (554мг, бутоксид калію в ТГФ (35мл, 35ммоль). Реакційну 2,5ммоль) і реакційну суміш перемішували протясуміш перемішували протягом 10хвил. і потім догом 30хвил. Потім реакційну суміш нагрівали до давали сполуку 28с (7,4г, 37ммоль) у 50мл ТГФ. кімнатної температури і концентрували і залишок Реакційну суміш перемішували при 0°С протягом переносили в СН2СІ 2. Органічний шар промивали 10хвил. і потім нагрівали до кімнатної температури водою і розсолом, фільтрували, сушили над і перемішували протягом приблизно 12год. РеакNa2SO4, фільтрували і концентрували до плівки. ційну суміш концентрували і залишок розбавляли Плівку розтирали з СН2СІ 2 і тверді речовини збиСН2СІ 2. СН2СІ 2 промивали 1N NaOH і розсолом, рали. Ці тверді речовини потім нагрівали у 1сушили над Na2SO4, фільтрували і концентрували бутанолі (120°С) у трубці під тиском протягом до отримання олії. Олію очищали на колонці Bio12год. для індукування циклізації, потім реакцію tage 40Μ, елююючи сумішшю гексан/СН2СІ 2 (50:50) охолоджували і тверду речовину збирали фільтруі одержуючи сполуку 29с у вигляді олії. ванням з одержанням сполуки 34с. Стадія С: У круглодонній колбі сполуку 29с Приклад 15 (40г, 13ммоль) додавали до 60мл МеОН з подаОдержання N-[6-(4-флуорфенокси)-1Нльшим доданням 6Ν NaOH (4,3мл, 26ммоль). Реаіндазол-3-іл]-ацетамiду (38с-1) кційну суміш перемішували при кімнатній темпераФіг.15 - реакційна схема синтезу сполуки 38с турі протягом 4год., потім концентрували і загальної Формули VI. У цьому прикладі описано отриманий залишок розбавляли 50мл води. Додасинтез сполуки 38с-1, де X - оксиген. вали приблизно 5мл 2N розчину НСІ (рН2,0) і з Стадія А: 2-флуор-4-гідроксибензонітрил (спорозчину осаджувалась тверда речовина, яку розлука 35с-1; 1,40г), 2,86г 4-флуорфенілборної кисчиняли у СН2СІ 2 і органічний шар промивали розлоти, 1,86г ацетату міді (II) і 7,20мл триетиламіну солом, сушили над Na2SO4, фільтрували і потім розчиняли/суспендували у 100мл безводного СН2СІ 2 і до цієї реакційної суміші додавали 4Å мо 55 86196 56 Приклад 18 лекулярні сита. Реакційну суміш піддавали дії поОдержання 5-(4-флуорфенілсульфаніл)-1Hвітря через осушувальний патрон і перемішували індазолу (4d) при температурі навколишнього середовища проФіг.18 - реакційна схема синтезу сполуки 4d тягом 16год. Реакційну суміш фільтрували і фільтзагальної Формули VII. рат промивали 10%-ним водним NaHSO4,1N водСтадія А: Суміш 6-йод-1Н-індазолу (сполука ним NaOH і розсолом, сушили над Na2SO4, 1d) у CH3CN (11мл) обробляли триетиламіном і фільтрували і концентрували під вакуумом, одердиметиламінопіридином. Після охолодження до жуючи 530мг сполуки 36с-1. 0°С додавали краплями розчин ди-третСтадія В: Сполуку 36с-1 (208мг) і 150мкл безбутилдикарбонату (Вос-ангідриду) у CH3CN водного гідразину розчиняли у 5мл бутанолу. Реа(10мл). Після перемішування при кімнатній темпекційну суміш нагрівали до температури дефлегмаратурі протягом 3год. реакційну суміш концентруції в атмосфері сухого нітрогену протягом 15год., вали у вакуумі і отриманий залишок розподіляли потім охолоджували до температури навколишміж Н2О і етером. Доданням N НСІ доводили рН до нього середовища, концентрували під вакуумом і 2 і органічну фазу відокремлювали, сушили розтирали з етиловим етером. Отриману рожеву (Na2SO4), фільтрували і концентрували у вакуумі, тверду речовину (сполука 37с-1) збирали фільтруодержуючи сполуку 2d у вигляді олії. ванням, промивали етиловим етером і потім суСтадія В: Суміш сполуки 2d у ДМФ (25мл) обшили на повітрі. робляли 5N KОН, порошком Сu і ArSH. У цьому Стадія С: Сполуку 37с-1 (97мг) і 40мкл оцтовоприкладі ArSH є 4-флуортіофенолом. Реакційну го ангідриду суспендували/розчиняли у дихлоресуміш гріли при 110°С протягом 48год., потім охотані в атмосфері сухого нітрогену. Реакційну суміш лоджували до кімнатної температури, концентрунагрівали до 60°С протягом приблизно 1год., потім вали у вакуумі, підкислювали 1N НСІ і екстрагуваохолоджували до кімнатної температури і переміли СН2СІ 2. Органічний шар фільтрували через шували протягом 12год. Білий осад (сполука 38спапір 1PS, концентрували у вакуумі і отриманий 1) збирали фільтруванням у вакуумі і потім сушили залишок очищали на колонці Biotage, елююючи на повітрі. 100% СН2СІ 2, 5% Et2O/CH2CI 2 і потім 10% Приклад 16 Et2O/CH2CI 2, одержуючи сполуку 4d. Одержання 2-[6-(4-флуорФенокси)-1H-iндазолПриклад 19 3-iл]-ізоіндол-1,3-діону (39с) Одержання 5-(4-Флуорфенілсульфаніл)-1Фіг.16 - реакційна схема синтезу сполуки 39с ізопропіл-1Н-індазолу (5d-1) загальної Формули VI. Фіг.19 - реакційна схема синтезу сполук загаСтадія А: Сполуку 37с-1, отриману відповідно льної структури 5d і загальної Формули VII. У цьодо Прикладу 15, розчиняли у 1мл бо-рану у ТГФ му прикладі описано синтез сполуки 5d-1, в якій R (1,0М) в атмосфері сухого нітрогену. Розчин гріли - ізопропіл. при 60°С протягом 2год., потім охолоджували до Розчин сполуки 4d, отриманої відповідно до кімнатної температури і гасили повільним доданПрикладу 18, у ТГФ (1мл) обробляли порошковим ням метанолу (3мл). Реакційну суміш концентруKОН з подальшим доданням 18-краун-6 і RI. У вали під вакуумом і отриманий залишок очищали цьому прикладі RI є ізопропілйодидом. Реакційну на колонці Biotage, елююючи сумішшю суміш перемішували при кімнатній температурі СН2СІ 2/ЕtOАс (3:1) і одержуючи сполуку 37с-1. протягом 18год. в атмосфері нітрогену. Потім реаСтадія В: Сполуку 37с-1 (660мг) і 654мг Nкційну суміш розбавляли СН2СІ 2 і фільтрували, карбоетоксифталіміду суспендували/розчиняли у фільтрат концентрували у вакуумі і залишок роз15мл дихлоретану в атмосфері сухого нітрогену бавляли СН2СІ 2. Органічний шар промивали насипри кімнатній температурі протягом приблизно ченим водним NaHCO3, фільтрували через папір 13год. Приблизно через 20хвил. реакційну суміш 1PS і концентрували у вакуумі. Отриманий залинагрівали до 65°С протягом 5,5год., після чого шок очищали на колонці Biotage, елююючи сумішохолоджували до кімнатної температури і фільтшю гексан/Et2O (4:1) і одержуючи сполуку 5d-1 у рували. Білий осад (сполука 39с) промивали дихвигляді жовтої олії. лоретаном і потім сушили на повітрі. Приклад 20 Приклад 17 Одержання 5-йод-1-(4-метоксибензил)-1НОдержання 3-(1,3-дигідроізоіндол-2-іл)-6-(4індазолу (8d-1) флуорфенокси)-1H-індазолу (40с) Фіг.20 - реакційна схема синтезу сполук 8d. У Фіг.17 - реакційна схема синтезу сполуки 40с цьому прикладі описано синтез сполуки 8d-1, де загальної Формули VI. Сполуку 39с (25мг), отриАr1 - 4-метоксифеніл. ману відповідно до Прикладу 16, суспендували у Стадія А: Суспензію 5-аміноіндазолу (сполука 1мл безводного ТГФ в атмосфері сухого нітрогену. 6d) у 6М розчині НСІ (150мл) охолоджували до 0°С До цього розчину додавали 1,0мл 1,0М розчину і обробляли краплями розчином NaNO2 у воді ВН3 у ТГФ. Реакційну суміш перемішували при (15мл). Після перемішування при 0°С протягом кімнатній температурі протягом приблизно 1год. і 30хвил. реакційну суміш додавали до холодного потім гріли при температурі дефлегмації протягом розчину КІ у воді (105мл). Суміш залишали нагрі2год. Потім реакційну суміш охолоджували до кімватись до кімнатної температури і перемішування натної температури і обережно додавали 2,0мл продовжували при кімнатній температурі протягом метанолу. Суміш перемішували протягом прибли18год. Суміш гасили 10%-ним Na2S2O3 і екстрагузно 10хвил. і потім концентрували під вакуумом. вали Et2O. Двофазну суміш фільтрували і нерозОтриманий залишок очищали на колонці Biotage, чинні тверді речовини промивали водою і сушили одержуючи 5мг сполуки 40с. 57 86196 58 у вакуумі протягом ночі. Органічну фазу відокремСтадія А: Розчин 5-йодіндазолу (сполука 1d) у лювали і додатково промивали водним насиченим піридині обробляли бензолсульфоніл-хлоридом NаНСО3 і водою, фільтрували через папір 1PS і при кімнатній температурі в атмосфері нітрогену випарювали у вакуумі до рожевого залишку. протягом 18год. Реакційну суміш концентрували у Стадія В: Розчин сполуки 1d у ДМФ обробляли вакуумі і залишок переносили в СН2СІ 2 і 1N НСІ. K2СО3 з подальшим доданням заміщеного або Органічний шар відокремлювали, фільтрували незаміщеного бензилгалогеніду при кімнатній темчерез фільтрувальний папір 1PS і концентрували у пературі в атмосфері нітрогену. У цьому прикладі вакуумі. Отриманий залишок очищали на колонці бензилгалогенідом є бензилхлорид. Суміш гріли Biotage, елююючи сумішшю гексан/Еt2О (5:1) і при 100°С протягом 48год. в атмосфері нітрогену. одержуючи сполуку 12d. Суміш обробляли 0,2екв. NaH (123мг) і нагрівання Стадія В: Суміш сполуки 12d, 5N KОН, порошпродовжували протягом 18год. Розчинник випарюку міді і 4-флуортіофенолу в розчині води і ДМФ вали у вакуумі і залишок переносили в СН2СІ 2 і 1N гріли під зворотним холодильником протягом приНСІ. Органічний шар відокремлювали, промивали близно 18год. Потім суміш охолоджували до кімводним насиченим NaHCO3 і концентрували з натної температури, підкислювали 1N НСІ і екстодержанням олії. Олію очищали на колонці рагували СН2СІ 2. Органічний шар фільтрували Biotage, елююючи градієнтом гексан/Еt2О (від 3:1 через папір 1PS, концентрували у вакуумі і отридо 3:2) і одержуючи сполуку 8d-1. маний залишок очищали на картриджі з силікагеПриклад 21 лем Sep Pak, елююючи сумішшю гексан/Еt2О (4:1) і Одержання 5-(4-ФлуорбензолсульФоніл)-1-(4одержуючи сполуку 13d. метоксибензил)-1Н-індазолу (10d-1) Приклад 24 Фіг.21 - реакційна схема синтезу сполук 10d Одержання 3-хлор-6загальної Формули IX. У цьому прикладі описано феноксибензо[d]ізоксазолу (8е-1) синтез сполуки 10d-1, де Аr1 - 4-метоксифеніл і Аr2 Фіг.24 - реакційна схема синтезу сполук 8е за- 4-флуорфеніл. гальної Формули V. У цьому прикладі описано синСтадія А: Суміш сполуки 8d, 5N КОН, порошку тез сполуки 8е-1, в якій Аr2 - феніл. міді і Ar2SH у розчині води і ДМФ нагрівали під Стадія А: Розчин 4-флуор-2-гідроксибензойної зворотним холодильником протягом приблизно кислоти (сполука 1е) у МеОН повільно обробляли 18год. У цьому прикладі Ar2SH є 4концентрованою H2SO4 і потім гріли під зворотним флуортіофенолом. Потім суміш охолоджували до холодильником протягом 12 днів. Потім реакційну кімнатної температури, підкислювали 1N НСІ і екссуміш концентрували у вакуумі до жовтої олії і трагували СН2СІ 2. Органічний шар фільтрували олію вносили у СН2СІ 2. Органічний шар промивали через папір 1PS, концентрували у вакуумі і отринасиченим водним NaHCO3, розсолом і водою, маний залишок очищали на картриджі з силікагесушили над Na2SO4, фільтрували і концентрували лем Sep Pak, елююючи сумішшю гексан/Et2O (4:1) і у вакуумі, одержуючи 12,7г сполуки 2е у вигляді одержуючи сполуку 9d. олії бурштинового кольору. Стадія В: Розчин сполуки 9d в ацетоні (0,2мл) Стадія В: Розчин сполуки 2е, K2СО3 і бензилхз MgSO4, обробляли розчином NalO4 і KМnО4 у лориду у ДМФ (200мл) гріли при 95°С протягом воді (0,2мл) і реакційну суміш перемішували при 18год. Суміш фільтрували і фільтрат концентрувакімнатній температурі протягом 18год. Потім реакли у вакуумі до жовтої олії. Олію очищали на коційну суміш обробляли водним бісульфітом натрію лонці Biotage, елююючи сумішшю гексан/ЕtOАс і екстрагували СН2СІ 2. Органічний шар фільтрува(7:2) і одержуючи 19,4г сполуки 3е у вигляді проли через папір 1PS і концентрували у вакуумі, зорої олії. одержуючи 2,1мг сполуки 10d у вигляді жовтої олії. Стадія С: Розчин сполуки 3е у ДМСО (2мл) Приклад 22 обробляли K2СО3 з подальшим доданням Аr2ОН Одержання 5-(4-флуорбензолсульфініл)-1-(4при кімнатній температурі в атмосфері нітрогену. У метоксибензил)-1Н-індазолу (11d-1) цьому прикладі Аr2ОН є фенолом. Суміш гріли при Фіг.22 - реакційна схема синтезу сполуки 11d-1 90°С протягом 3 днів в атмосфері нітрогену. Повізагальної Формули VIII. Розчин сполуки 9d-1, льно додавали воду (1мл) і продукт екстрагували отриманої відповідно до Прикладу 21, у суміші ЕtOАс. Водний шар відокремлювали і екстрагувавода/ацетонітрил (1:1) обробляли NalO4 і реакційли ЕtOАс. ну суміш перемішували при кімнатній температурі Об'єднані органічні екстракти промивали розпротягом 18год. Потім реакційну суміш фільтрувасолом, сушили над Na2SO4, фільтрували і конценли і фільтрат концентрували у вакуумі. Отриманий трували у вакуумі до темної олії. Олію очищали на залишок розподіляли між водою і СН2СІ 2. Органічколонці Biotage, елююючи сумішшю гексан/Еt2О ний шар відокремлювали фільтрували через папір (6:1) і одержуючи сполуку 4е-1 у вигляді прозорої 1PS, концентрували у вакуумі і очищали на картолії. риджі з силікагелем Sep Pak, елююючи градієнтом Стадія D: 1,0М розчин сполуки 4е-1 у МеОН гексан/Et2O (4:1,2:1 і 1:1), одержуючи сполуку 11d(30мл) продували нітрогеном і обробляли 20% 1. Pd(OH)2/C (15% за масою дорівнює 297мг). Через Приклад 23 реакційну суміш пропускали додаткову кількість Одержання 1-бензолсульфоніл-5-(4нітрогену і потім перемішували при кімнатній темфлуорфенілсульфаніл)-1Н-індазолу (13-d) пературі протягом 2 днів в атмосфері гідрогену. Фіг.23 - реакційна схема одержання сполуки Каталізатор відфільтровували і промивали МеОН. 13d загальної Формули VII. Фільтрат випарювали у вакуумі до прозорої олії, яку очищали на колонці Biotage, елююючи суміш 59 86196 60 чи сумішшю гексан/Еt2О (4:1) і одержуючи сполуку шю 5% Et2O/гексан і одержуючи сполуку 5е-1 у 10е-1 у вигляді жовтої олії. вигляді прозорої олії. Приклад 27 Стадія Е: 3М NaOH (9мл) додавали до розчину Одержання оксиму (2,4-дифлуорфеніл)-(1NH2OHHCI у воді (14мл) з подальшим доданням ізобутил-1Н-iнбазол-5-іл)-метанону (7f-1) розчину сполука 5е-1 у діоксані (10мл). Мутну суФіг.27 - реакційна схема синтезу сполук 7f заміш перемішували при кімнатній температурі прогальної Формули XII. У цьому прикладі описано тягом 18год. в атмосфері нітрогену. Отриману синтез сполуки 7f-1, в якій R1 - ізобутил, R2 -є Η і Аr прозору суміш охолоджували у крижаній ванні, - 2,4-дифлуорфеніл. підкислювали 2М НСІ і екстрагували EtOAc. Об'єдСтадія А: Тетрафлуорборат амонію (20,97г, нані органічні шари промивали розсолом, фільтру200ммоль) розчиняли у водному розчині оцтової вали через папір 1PS і випарювали у вакуумі, одекислоти (500мл АсОН/250мл води) і охолоджували ржуючи 235мг бежевої твердої речовини, яку до 0°С. Послідовно додавали 4-бром-2розтирали в суміші гексан/EtOAc (4:1) і отримана метиланілин (сполука 1f, 18,61г, 100ммоль) і 42мл білу тверду речовину (сполука 6е-1) збирали фільконцентрованої водної НСІ (36% (маса./маса), труванням. 12N, 500ммоль). Суміш перемішували протягом Стадія F: Розчин карбонілдіімідазолу у ТГФ 20хвил. при 0°С і потім додавали NaNO2 (7,59г, додавали до розчину сполуки 6е-1 у ТГФ і гріли під 110ммоль). Реакцію перемішували протягом 1год. зворотним холодильником протягом 18год. Потім при 0°С і нагрівали до кімнатної температури. Піссуміш концентрували у вакуумі, розбавляли воля 16год. при кімнатній температурі суміш концендою, підкислювали 1N НСІ і екстрагували СН2СІ 2. трували під зниженим тиском і залишок піддавали Органічний шар фільтрували через папір 1PS і азеотропній перегонці з толуолом і сушили під випарювали у вакуумі, одержуючи сполуку 7е-1 у високим вакуумом. Тверду речовину суспендували вигляді блідо-жовтої твердої речовини або піни. в 500мл СНСІ 3 і додавали KОАс (12,76г, Стадія G: Суспензію сполука 7е-1 у РОСІ 3 об130ммоль) і 18-краун-6 (7,93г, 30ммоль). Реакційну робляли триетиламіном при кімнатній температурі суміш перемішували протягом 1,5год. при кімнаті суміш гріли при 110°С протягом 6год. Суміш охоній температурі, потім промивали водою, сушили лоджували до кімнатної температури і виливали в над безводним MgSO4, фільтрували через целіт і склянку з крижаною водою. Продукт екстрагували концентрували під зниженим тиском, одержуючи СН2СІ 2, фільтрували через папір 1PS і випарювали 30г 5-бром-1Н-індазолу (2f) у вигляді жовтоу вакуумі, одержуючи 10мг сполуки 8е-1 у вигляді коричневої твердої речовини. Неочищену речовиолії бурштинового кольору. ну використовували без подальшого очищення. Приклад 25 Стадія В: Неочищену сполуку 2f (100ммоль) Одержання 3,6-диФенокси-бензо[d]ізоксазолу розчиняли у 250мл ДМФ. Додавали K2СО3 (20,7г, (9е-1) 150ммоль) і 1-бром-2-метилпропан (16,3мл, Фіг.25 - реакційна схема синтезу сполук 9е за150ммоль). Суміш гріли при 120°С в атмосфері гальної Формули V. У цьому прикладі описано синнітрогену протягом 16год., охолоджували до кімнатез сполуки 9е-1, в якій Аr1 - феніл і Аr2 - феніл. тної температури і концентрували під зниженим Розчин сполуки 8е-1, отриманої відповідно до тиском. До залишку додавали воду (200мл) і Прикладу 24, у ДМФ (1мл) додавали до суміші СН2СІ 2 (200мл) і інтенсивно перемішували протяNaH і фенолу (1мл) у ДМФ. Реакційну суміш гріли гом 30хвил. Шари розділяли і водний шар екстрапри 110°С протягом 18год. Розчинник випарювали гували СН2СІ 2. Об'єднані екстракти сушили над у вакуумі і залишок розподіляли між 1N НСІ і безводним MgSO4, фільтрували через целіт і конСН2СІ 2. Органічний шар відокремлювали і фільтцентрували під зниженим тиском, одержуючи прирували через папір 1PS. Випарювання розчинника близно 30г неочищеної речовини, яку очищали давало коричневу олію, яку очищали на картриджі хроматографією (етер/гексани: від 1:9 до 1:4), з силікагелем Sep Pak, елююючи сумішшю гекодержуючи 12,87г сполуки 3f-1 у вигляді темносан/Et2O (4:1) і одержуючи сполуку 9е-1 у вигляді червоної олії з виходом 50,8% для стадій А і В. прозорої олії, яка затверділа з утворенням довгих МСІЕР (+), виявлено: m/z 253 і 255 (М+1). білих голок. 1 Н-ЯМР (400МГц, CDCI 3) δ 7,93 (s, 1H), 7,87 Приклад 26 (m, 1H), 7,43 (m, 1H), 7,29 (m, 1H), 7,29 (m, 1H), Одержання (4-метокси-феніл)-(64,15 (m, 2H), 2,33 (m, 1H), 0,92 (m, 6H). феноксибензол[d]ізоксазол-3-іл)-аміну (10е-1) Стадія С: Сполуку 3f-1 (121,0мг, 0,478ммоль) Фіг.26 - реакційна схема синтезу сполук 10е розчиняли у 2мл етеру і охолоджували до -78°С. загальної Формули V. У цьому прикладі описано До цього розчину додавали трет-BuLi (1,70М у синтез сполуки 10е-1, в якій Аr1 - 4-метоксифеніл і пентані, 0,59мл, 1,004ммоль). Реакційну суміш Аr2 - феніл. Розчин Ar1NH2 у ТГФ охолоджували до перемішували протягом 1год. при -78°С. Додавали -78°С і обробляли n-бутиллітієм в атмосфері ніт2,6-дифлуорбензальдегід (58мкл, 0,526ммоль) при рогену. У цьому прикладі Ar1NH2 є аніліном. Після -78°С, охолоджувальну ванну видаляли і реакційну перемішування при -78°С протягом 20хвил. додасуміш повільно нагрівали до кімнатної температували розчин сполуки 8е-1, отриманої відповідно до ри. Реакцію гасили 10мл води. Шари розділяли і Прикладу 25, у ТГФ в атмосфері нітрогену. Суміш водний шар кілька разів екстрагували СН2СІ 2. Об'повільно нагрівали до кімнатної температури, поєднані екстракти сушили над безводним MgSO4, тім гасили водним насиченим NH4CI і екстрагували фільтрували через целіт, концентрували під зниСН2СІ 2. Органічний шар промивали 1N НСІ і воженим тиском і очищали хроматографією, викоридою, фільтрували через папір 1PS, концентрували стовуючи суміш етер/гексани (1:1) і одержуючи у вакуумі і очищали на картриджі Sep Рак, елююю
ДивитисяДодаткова інформація
Назва патенту англійськоюP38 inhibitors and methods of use thereof
Автори англійськоюMunson Mark, Mareska David A., Kim Youngboo, Groneberg Robert, Rizzi James, Rodriguez Martha, Kim Ganghyeok, Vigers Guy, Rao Chang, Balachari Devan, Harvey Darren
Назва патенту російськоюПроизводные индазола как ингибиторы р38 и их применение
Автори російськоюМансон Марк, Мареска Девид А., Ким Юнбу, Гроунберг Роберт, Рицци Джеймз, Родригес Марта, Ким Ганхеок, Вайгерз Гай, Рао Чанг, Балачари Деван, Гарви Даррен
МПК / Мітки
МПК: A61K 31/416, A61K 31/4745, A61K 31/503, C07D 471/02, A61K 31/4162, C07D 261/20, C07D 403/04, C07D 487/02, C07D 413/12, C07D 231/56, A61K 31/675, A61P 35/00, C07D 471/04, C07D 401/14
Мітки: похідні, інгібітори, індазолу, застосування
Код посилання
<a href="https://ua.patents.su/123-86196-pokhidni-indazolu-yak-ingibitori-r38-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні індазолу як інгібітори р38 та їх застосування</a>
Попередній патент: Упаковка, яка здатна закриватися повторно
Наступний патент: Магнітний датчик потоку (варіанти) та витратомір, який його включає
Випадковий патент: Спосіб визначення максимальних рівнів електричного поля промислової частоти за межами міських підстанцій високої напруги