Пестицидні композиції і способи, які їх стосуються
Номер патенту: 115126
Опубліковано: 25.09.2017
Автори: Спаркс Томас К., Фішер Ліндсі Гейл, Баум Еріх В., Ніяз Ноормохамед М., Деамікіс Карл, Джамп'єтро Наталі Крістін, Ван Нік Х., Крауз Гарі Д., Деметер Девід А., Дент Уілльям Хантер
Формула / Реферат
R1. Пестицидна композиція, яка містить сполуку молекули формули:
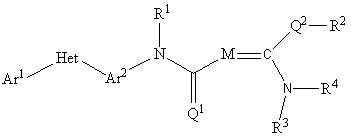 , формула (I)
, формула (I)
де
(А) Ar1 являє собою феніл, заміщений одним або більше замісниками, вибраними з C1-C6галогеналкілу та С1-С6галогеналкокси;
(B) Het являє собою триазоліл, оксадіазоліл або піразоліл;
(С) Ar2 являє собою феніл, необов'язково заміщений одним або більше замісниками, вибраними з C1-C6алкілу;
(D) R1 являє собою H або CH3;
(E) R2 вибраний з групи, що включає групу, визначену в пункті (K), H, C1-C6алкіл, C1-C6алкіл-OC(=О)C1-C6алкіл, CH2OC(=O)N(H)(C(=O)OCH2Ph) і CH2S (3,4,5-триметокси-2-тетрагідропіран);
(F) R3 являє собою феніл, заміщений одним або більше замісниками, вибраними з F, Cl, CH3, 2-CH(CH3)2, CH(CH3)(C2H5), OCH3 і фенілу;
(G) R4 вибраний із групи, визначеної в пункті (K) або H;
(Н) М являє собою N або CR5,
де R5 вибраний із групи, яка включає Н, CN і С(=О)(C1-C6алкіл);
(I) (1) Q1 являє собою О,
(2) Q2 вибраний із О або S;
(K) R2 і R4 являють собою (K) у випадку, коли R2 і R4 разом з C(Q2)(N) утворюють 4-7-членну насичену або ненасичену гідрокарбільну циклічну групу, де вказана гідрокарбільна циклічна група може бути заміщена оксо або C1-C6алкілом, або де група між Q2 і N являє собою СН2С(=О), CH2CH2, CH2CH2CH2 або СН2СН(СН3);
і носій.
2. Композиція за п. 1, яка містить сполуку, вибрану з наступних:
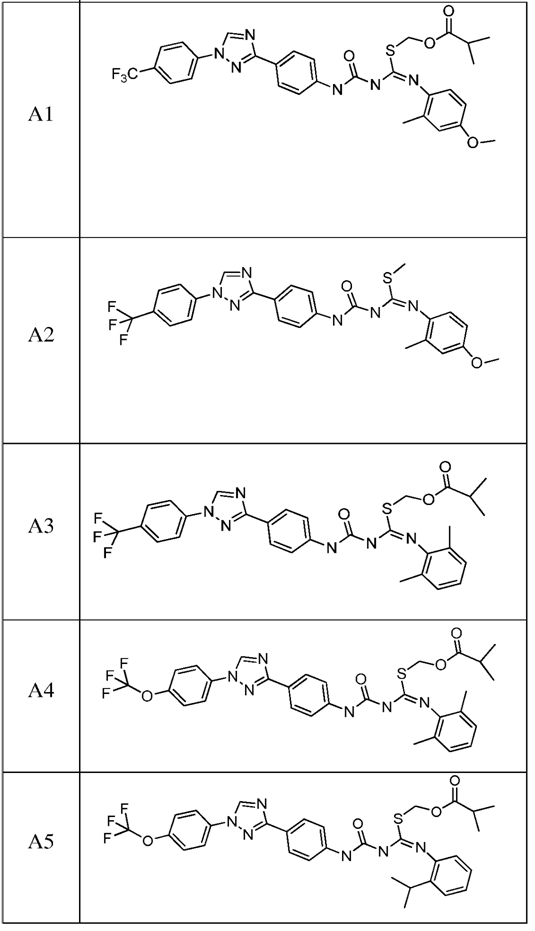
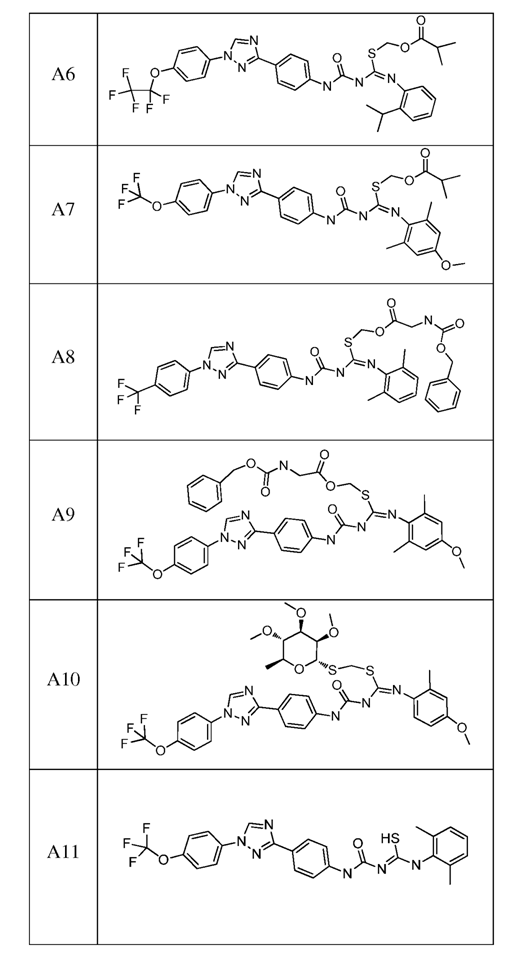
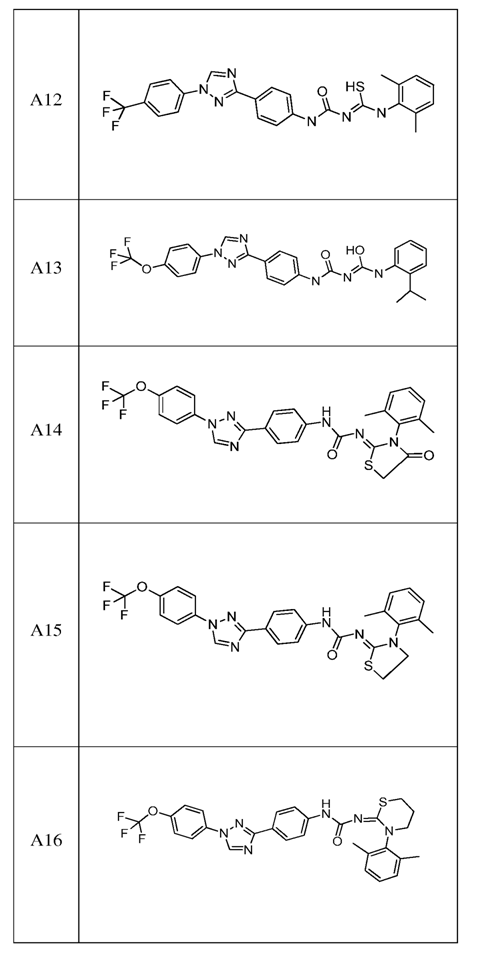
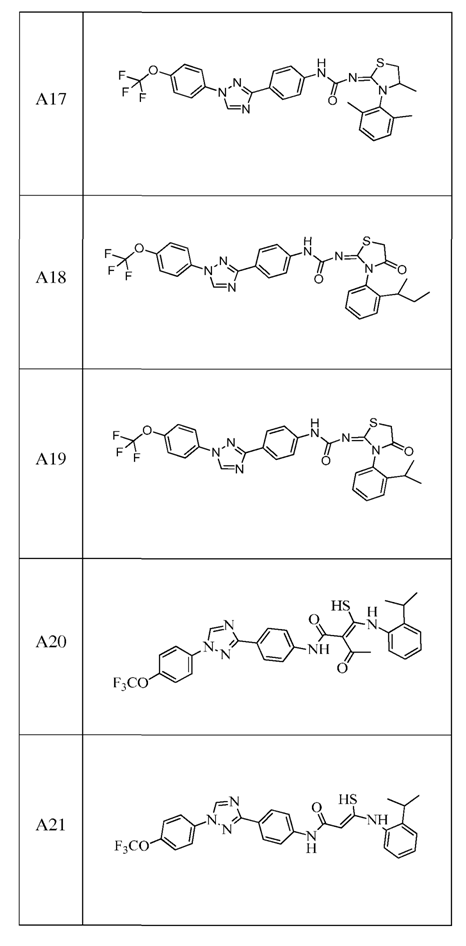
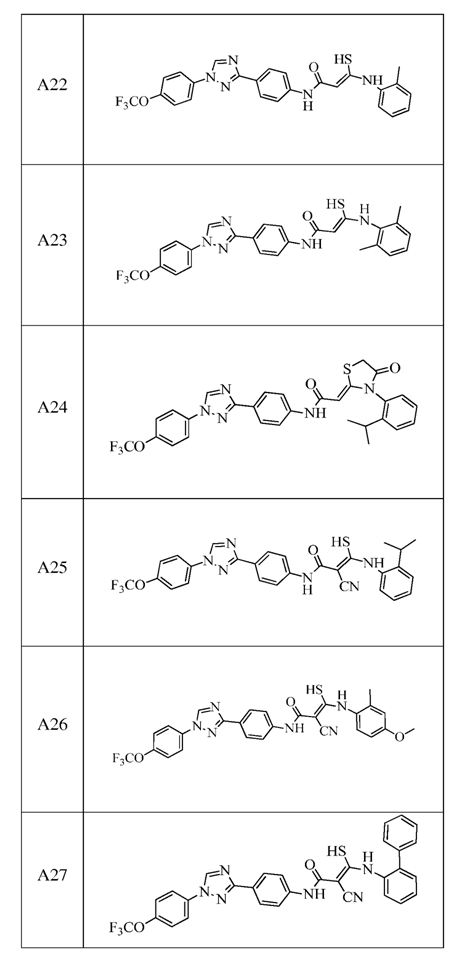
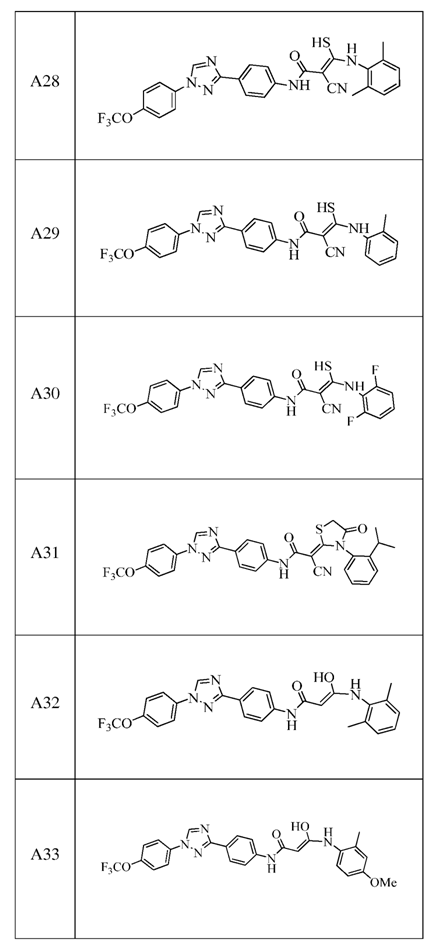
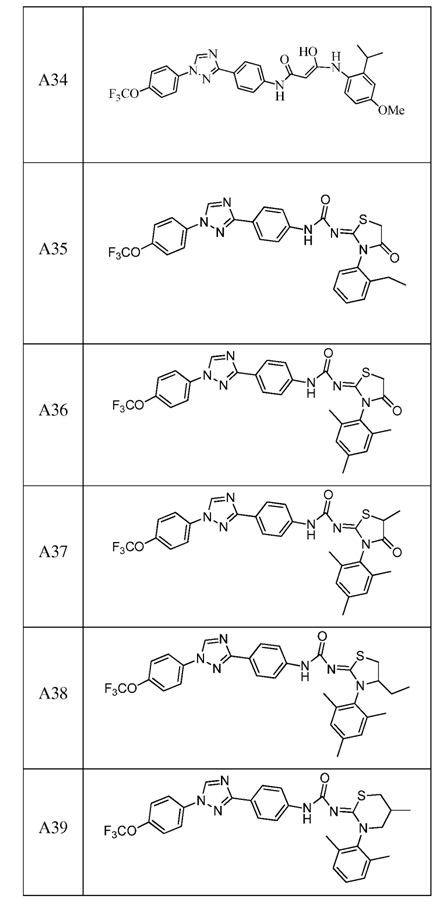
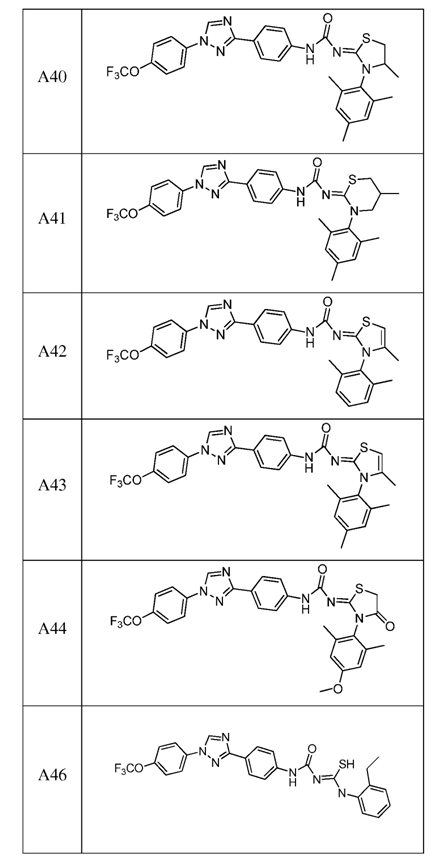
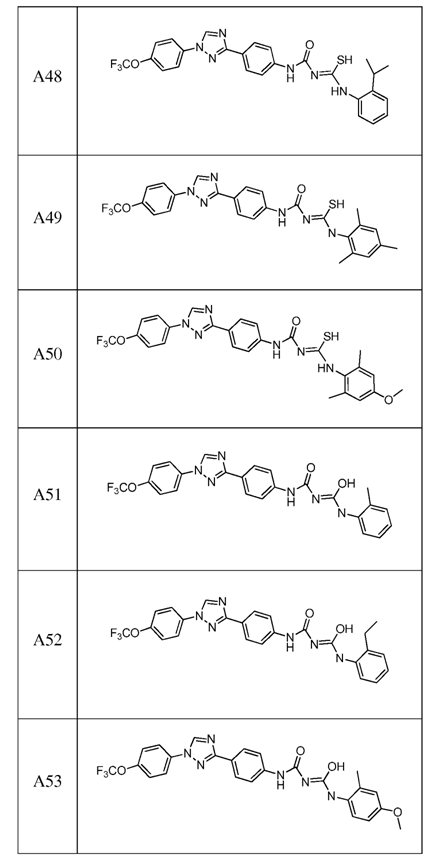
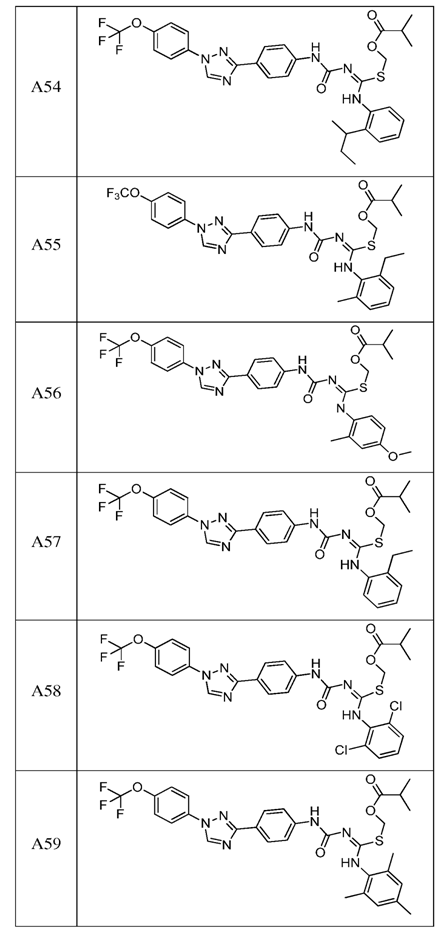
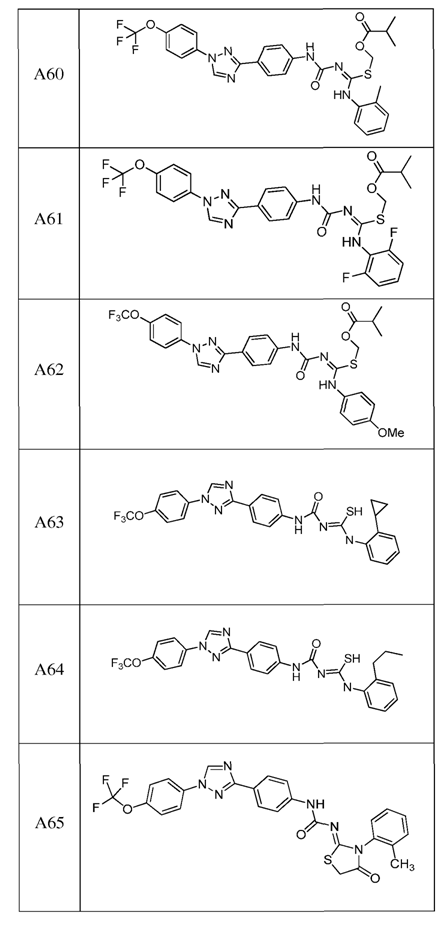
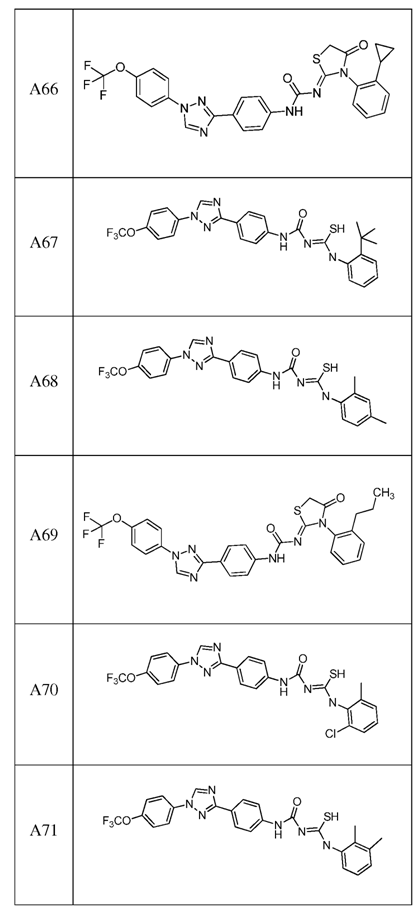
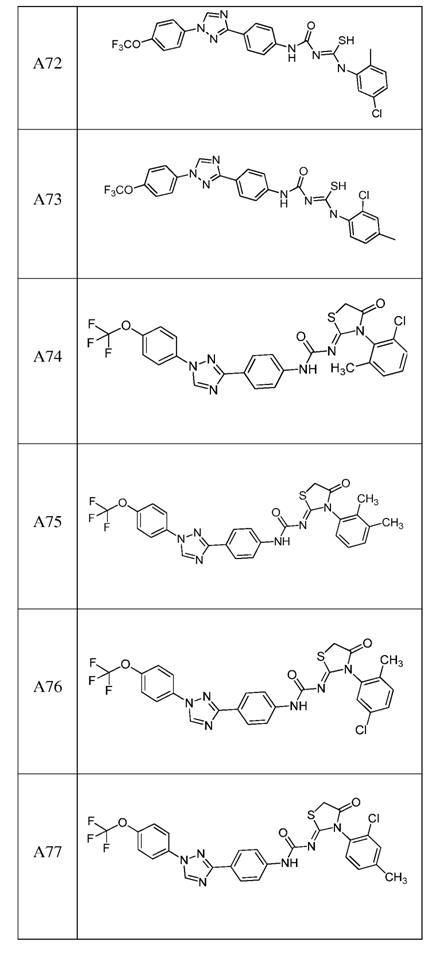
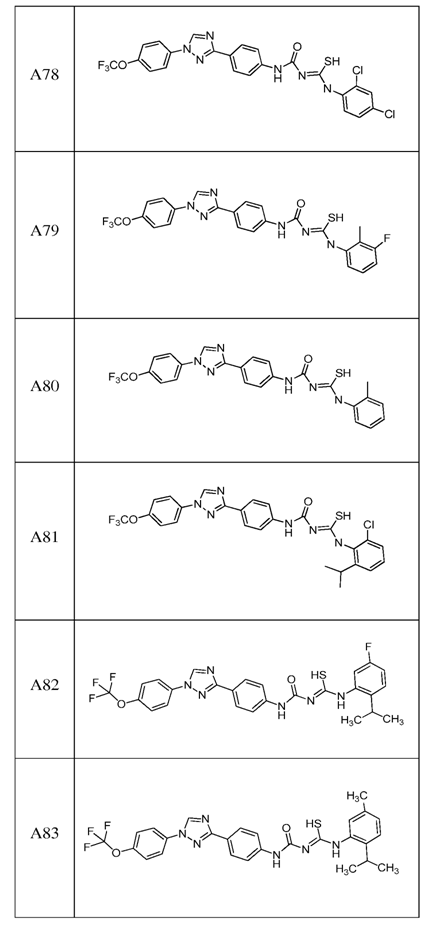
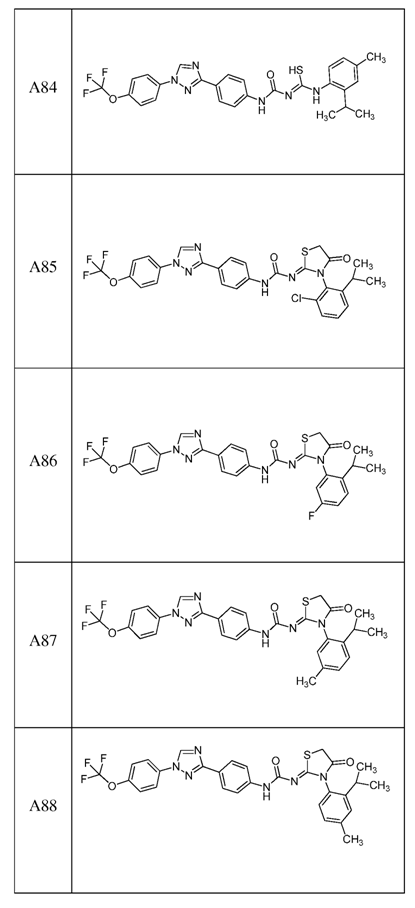
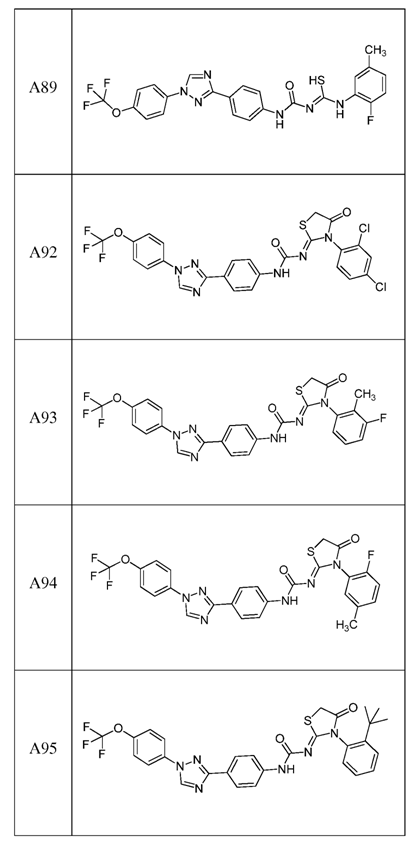
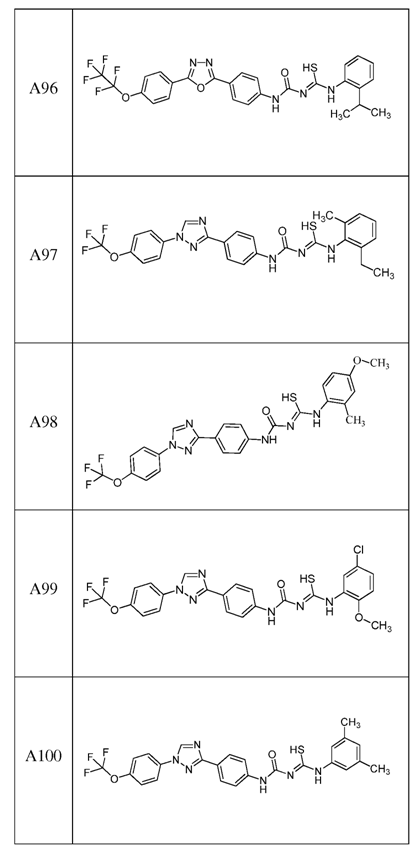
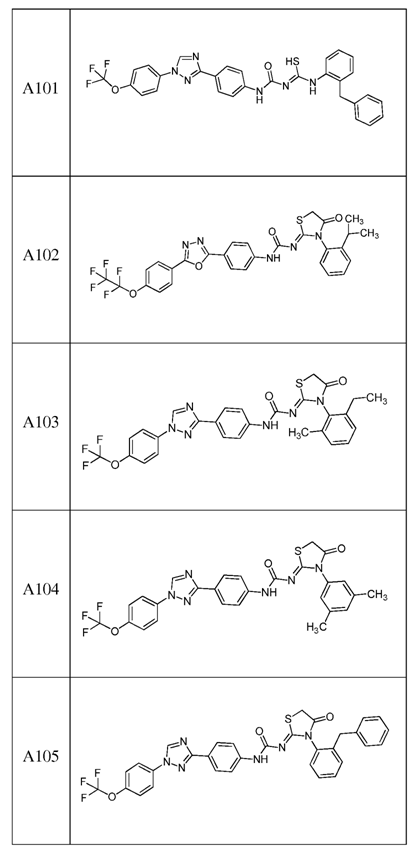
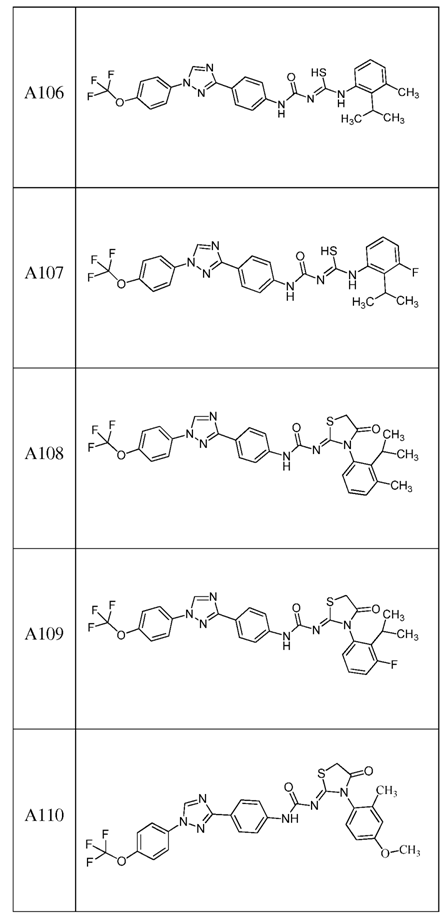
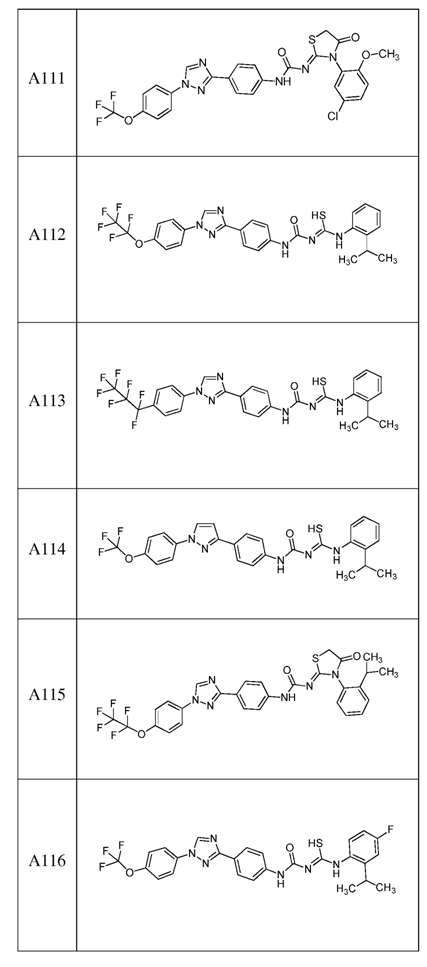
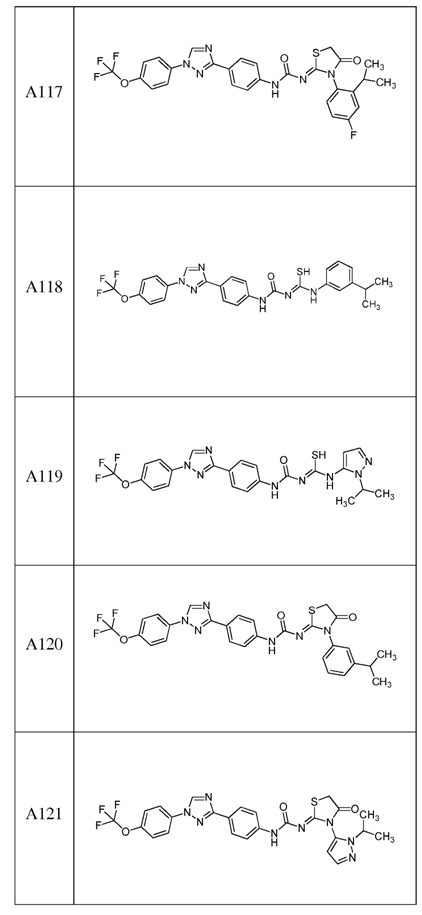
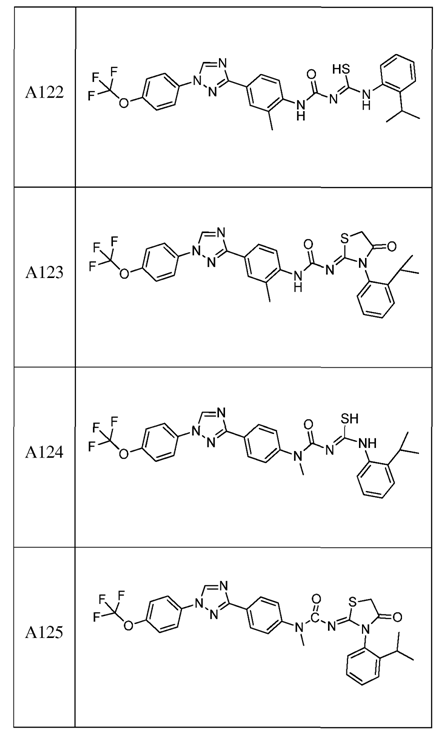
3. Композиція за п. 1, де сполука вказаної молекули представлена у формі пестицидно прийнятної кислотно-адитивної солі.
4. Композиція за п. 1, де молекула представлена у формі сольвату.
5. Композиція за п. 1, де сполука вказаної молекули представлена у формі поліморфа.
6. Композиція за п. 1, де сполука вказаної молекули містить 2Н.
7. Композиція за п. 1, де сполука вказаної молекули містить 14C.
8. Композиція за п. 1, де сполука вказаної молекули має один або декілька стереоізомерів.
9. Композиція за п. 1, яка додатково містить одну або більше сполук, які мають акарицидні, альгіцидні, авіцидні, бактерицидні, фунгіцидні, гербіцидні, інсектицидні, молюскоцидні, нематоцидні, родентицидні або віруцидні властивості.
10. Композиція за п. 1, яка додатково містить одну або більше сполук, які є антифідантами, репелентами птахів, хемостерилізаторами, гербіцидними антидотами, атрактантами комах, репелентами комах, репелентами ссавців, речовинами, які порушують процес спаровування, активаторами рослин, регуляторами росту рослин або синергістами.
11. Композиція за п. 1, яка додатково містить одну або більше сполук, які мають один з наступних механізмів дії: інгібітор ацетилхолінектерази; модулятор натрієвих каналів; інгібітор біосинтезу хітину; антагоніст GABA- і глютамат-керованих хлоридних каналів; агоніст GABA- і глютамат-керованих хлоридних каналів; агоніст ацетилхолінового рецептора; антагоніст ацетилхолінового рецептора; інгібітор MET I; інгібітор Mg-стимульованої АТФази; нікотиновий ацетилхоліновий рецептор; руйнівник мембран середньої кишки; руйнівник окисного фосфорилування і ріанодиновий рецептор (RyRs).
12. Композиція за п. 1, яка додатково містить насіння.
13. Композиція за п. 1, яка додатково містить насіння, що було генетично модифіковане для експресії однієї або більше ознак.
14. Композиція за п. 1, де вказана композиція інкапсульована в капсулу або нанесена на її поверхню або інкапсульована в капсулу і нанесена на її поверхню.
15. Композиція за п. 1, де вказана композиція інкапсульована в капсулу або нанесена на її поверхню або інкапсульована в капсулу і нанесена на її поверхню, і де діаметр вказаної капсули становить 100-900 нанометрів або 100-900 мікрон.
Текст
Реферат: Пестицидна композиція, яка містить сполуку формули (І) і носій. R Ar 1 Het Ar 2 1 Q N M 2 2 R 4 Cx Nx Q R 1 R 3 (І) UA 115126 C2 (12) UA 115126 C2 UA 115126 C2 5 10 15 20 25 30 35 40 45 50 55 60 Опис Перехресні посилання на споріднені заявки За даною заявкою заявляється пріоритет попередньої патентної заявки США 61/506743, поданої 12 липня 2011 року. Повний зміст вказаної попередньої заявки включений в даний опис за допомогою посилання. Галузь техніки, до якої належить винахід Об'єкти, розкриті в даному описі, стосуються сфери способів одержання молекул, які можуть застосовуватися як пестициди (наприклад, акарициди, інсектициди, молюскоциди і нематоциди), і способів застосування таких молекул для боротьби із сільськогосподарськими шкідниками. Передумови створення винаходу Сільськогосподарські шкідники щорічно викликають мільйони людських смертей в усьому світі. Крім того, існує більше десяти тисяч різновидів сільськогосподарських шкідників, які завдають значної шкоди сільському господарству. В усьому світі сільське господарство щорічно втрачає мільярди доларів США. Терміти викликають ушкодження усіх видів приватних і державних споруд. Збиток від ушкоджень, викликаних термітами, щорічно складає мільярди доларів США. Шкідники в харчових продуктах, що зберігаються, поїдають і заражають ці продукти. Щорічно в усьому світі збиток від втрат харчових продуктів при їхньому збереженні складає мільярди доларів США і, що більш важливо, позбавляє населення необхідної їжі. Існує реальна потреба в нових пестицидах. Деякі сільськогосподарські шкідники виробляють резистентність до пестицидів, що застосовуються в даний час. Сотні видів шкідників є резистентними до одного або більше пестицидів. Розвиток резистентності до традиційно застосовуваних пестицидів, таких як ДДТ, карбамати і фосфорорганічні сполуки, добре відомий, але резистентність виробляється навіть до деяких більш нових пестицидів. Таким чином, з багатьох причин, включаючи приведені вище, існує потреба в нових пестицидах. Визначення Представлений перелік прикладів визначень, у цілому, не є вичерпним і не повинен розглядатися як обмеження молекул, розкритих у даному описі. Варто розуміти, що замісник повинен відповідати правилам утворення хімічних зв'язків і обмежень стеричної сумісності відносно конкретної молекули, до якої він приєднаний. Термін «алкеніл» означає ациклічний ненасичений (який містить щонайменше один подвійний вуглець-вуглецевий зв'язок), розгалужений або нерозгалужений замісник, що містить атоми вуглецю і водню, наприклад, вініл, аліл, бутеніл, пентеніл і гексекніл. Термін «алкенілокси» означає алкеніл, який додатково містить одинарний вуглець-кисневий зв'язок, наприклад, алілокси, бутенілокси, пентенілокси, гексенілокси. Термін «алкокси» означає алкіл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, метокси, етокси, пропокси, ізопропокси, 1-бутокси, 2-бутокси, ізобутокси, третбутокси. Термін «алкіл» означає ациклічний насичений, розгалужений або нерозгалужений замісник, що містить атоми вуглецю і водню, наприклад, метил, етил, пропіл, ізопропіл, бутил і третбутил. Термін «алкініл» означає ациклічний ненасичений (який містить щонайменше один потрійний вуглець-вуглецевий зв'язок), розгалужений або нерозгалужений замісник, що містить атоми вуглецю і водню, наприклад, етиніл, пропаргіл, бутиніл, пентиніл. Термін «алкінілокси» означає алкініл, який додатково включає одинарний вуглець-кисневий зв'язок, наприклад, пентинілокси, гексинілокси, гептинілокси й октинілокси. Термін «арил» означає циклічний ароматичний замісник, який складається з атомів водню і вуглецю, наприклад, феніл, нафтил і біфеніліл. Термін «циклоалкеніл» означає моноциклічний або поліциклічний ненасичений (який включає щонайменше один подвійний вуглець-вуглецевий зв'язок) замісник, який складається з атомів вуглецю і водню, наприклад, циклобутеніл, циклопентеніл, циклогексеніл, норборненіл, біцикло[2.2.2]октеніл, тетрагідронафтил, гексагідронафтил і октагідронафтил. Термін «циклоалкенілокси» означає циклоалкеніл, що додатково включає одинарний вуглець-кисневий зв'язок, наприклад, циклобутенілокси, циклопенетнілокси, норборненілокси і біцикло[2.2.2]октенілокси. Термін «циклоалкіл» означає моноциклічний або поліциклічний насичений замісник, який складається з атомів вуглецю і водню, наприклад, циклопропіл, циклобутил, циклопентил, норборніл, біцикло[2.2.2]октил і декагідронафтил. 1 UA 115126 C2 5 10 15 20 25 30 35 40 45 50 Термін «циклоалкокси» означає циклоалкіл, що додатково включає одинарний вуглецькисневий зв'язок, наприклад, циклопропілокси, циклобутилокси, циклопентилокси, норборнілокси і біцикло[2.2.2]октилокси. Термін «галоген» означає фтор, хлор, бром і йод. Термін «галогеналкокси» означає алкоксигрупу, що додатково містить від одного до максимально можливої кількості однакових або різних атомів галогену, наприклад, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2тетрафторетокси і пентафторетокси. Термін «галогеналкіл» означає алкіл, що додатково включає від одного до максимально можливої кількості однакових або різних атомів галогену, наприклад, фторметил, трифторметил, 2,2-дифторетил, хлорметил, трихлорметил і 1,1,2,2-тетрафторетил. Термін «гетероцикліл» означає циклічний замісник, що може бути повністю насиченим, частково ненасиченим або повністю ненасиченим, де циклічна структура містить щонайменше один атом вуглецю і щонайменше один гетероатом, і де вказаний гетероатом являє собою атом азоту, атом сірки або атом кисню. Приклади ароматичних гетероциклілів включають, але без обмеження, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензоксазоліл, бензотієніл, бензотіазоліл, цинолініл, фураніл, індазоліл, індоліл, імідазоліл, ізоіндоліл, ізохінолініл, ізотіазоліл, ізоксазоліл, оксадіазоліл, оксазолініл, оксазоліл, фталазиніл, піразиніл, піразолініл, піразоліл, піридазиніл, піридил, піримідиніл, піроліл, хіназолініл, хінолініл, хіноксалініл, тетразоліл, тіазолініл, тіазоліл, тієніл, триазиніл і триазоліл. Приклади повністю насичених гетероциклілів включають, але без обмеження, піперазиніл, піперидиніл, морфолініл, піролідиніл, тетрагідрофураніл і тетрагідропіраніл. Приклади частково ненасичених гетероциклілів включають, але без обмеження, 1,2,3,4-тетрагідрохінолініл, 4,5-дигідроксазоліл, 4,5-дигідро-1Н-піразоліл, 4,5-дигідроізоксазоліл і 2,3-дигідро[1,3,4]оксадіазоліл. Докладний опис винаходу Даний винахід розкриває сполуки молекули представленої нижче формули (“формула (I)”): де 1 (А) Ar вибраний з (1) фуранілу, фенілу, піридазинілу, піридилу, піримідинілу, тієнілу або (2) заміщеного фуранілу, заміщеного фенілу, заміщеного піридазинілу, заміщеного піридилу, заміщеного піримідинілу або заміщеного тієнілу, де вказані заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл містять один або більше замісників, незалежно вибраних із групи, яка включає H, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C3C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=O)n(C1-C6алкіл), S(=O)n(C1x y x y C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)NR R , (C1-C6алкіл)NR R , C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), С(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=O)(C2-C6алкеніл), С(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де вказані заміщений феніл і заміщений фенокси містять один або більше замісників, незалежно вибраних із групи, яка включає H, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=O)n(C1-C6алкіл), S(=O)n(C1x y x y C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)NR R , (C1-C6алкіл)NR R , С(=O)(C1-C6алкіл), С(=O)O(C1-C6алкіл), С(=O)(C1-C6галогеналкіл), С(=O)O(C1-C6галогеналкіл), 2 UA 115126 C2 5 10 15 20 25 30 35 40 45 50 55 60 С(=O)(C3-C6циклоалкіл), С(=O)O(C3-C6циклоалкіл), С(=O)(C2-C6алкеніл), С(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), С(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл)феніл і фенокси; (B) Het являє собою 5- або 6-членне насичене або ненасичене гетероциклічне кільце, що містить один або більше гетероатомів, незалежно вибраних з атомів азоту, сірки або кисню, де 1 2 Ar і Ar не знаходяться в ортоположенні один відносно одного (але можуть знаходитися в метаабо пара-положенні, так що, наприклад, у п’ятичленному кільці вони знаходяться в положеннях 1,3, і в 6-членному кільці вони знаходяться в положеннях 1,3 або 1,4), і де вказане гетероциклічне кільце також може бути заміщеним одним або більше замісниками, незалежно вибраними з групи, яка включає Н, F, Cl, Br, I, CN, NО 2, оксо, C1-C6алкіл, C1-C6галогеналкіл, C3C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1х Y х Y C6галогеналкіл), OSО2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)NR R , (C1-C6алкіл)NR R , C(=О)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де вказані заміщений феніл і заміщений фенокси містять один або більше замісників, незалежно вибраних із групи, яка включає Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1х Y C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)H, C(=О)NR R , (C1х Y C6алкіл)NR R , C(=О)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), феніл і фенокси; 2 (С) Ar вибраний з (1) фуранілу, фенілу, піридазинілу, піридилу, піримідинілу, тієнілу або (2) заміщеного фуранілу, заміщеного фенілу, заміщеного піридазинілу, заміщеного піридилу, заміщеного піримідинілу або заміщеного тієнілу, де вказані заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл містять один або більше замісників, незалежно вибраних із групи, яка включає Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C3C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1х y х y C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)NR R , (C1-C6алкіл)NR R , C(=О)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де вказані заміщений феніл і заміщений фенокси містять один або більше замісників, незалежно вибраних із групи, яка включає Н, F, Cl, Br, I, CN, NO2, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1х y C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)H, C(=О)NR R (C1х y C6алкіл)NR R , C(=O)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), С(=О)(C1-C6галогеналкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл і фенокси; 1 (D) R вибраний із групи, яка включає Н, C1-C6алкіл, C3-C6циклоалкіл, C2-C6алкеніл, C2х y х y C6алкініл, S(=О)n(C1-C6алкіл), С(=О)NR R , (C1-C6алкіл)NR R , С(=О)О(C1-C6алкіл), С(=О)(C3C6циклоалкіл), С(=О)О((C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)ОС(=О)(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), (C1C6алкіл)OC(=O)O(C1-C6алкіл), де кожен алкіл, циклоалкіл, циклоалкокси, алкокси, алкеніл і алкініл необов'язково заміщений одним або більше замісниками, незалежно вибраними з групи, яка включає F, Cl, Br, I, CN, NO2, оксо, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3C6циклоалкокси, C3-C6галогенциклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, S(=О) n(C1х y C6алкіл), S(=О)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), С(=О)NR R , x y (C1-C6алкіл)NR R , C(=O)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), 3 UA 115126 C2 5 10 15 20 25 30 35 40 45 50 55 С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1C6алкіл)C(=О)О(C1-C6алкіл), феніл і фенокси; 2 (E) R вибраний із групи, яка включає групу, визначену в пункті (К), H, C 1-C6алкіл, C3C6циклоалкіл, C2-C6алкеніл, C2-C6алкініл, C(=О)(C1-C6алкіл), (C1-C6алкіл)О(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл), C1-C6алкілфеніл, C1-C6алкіл-О-феніл, C(=О)(Het-1), (Het-1), (C1-C6алкіл)(Het-1), C1-C6алкіл-O-C(=О)C1-C6алкіл, C1-C6алкіл-O-C(=О)(C1-C6алкіл), C1-C6алкіл-O-C(=О)ОC1х y х C6алкіл, C1-C6алкіл-О-С(=О)N(R R ), C1-C6алкілС(=О)N(R )C1-C6алкіл-(Het-1), C1х x y C6алкілC(=О)(Het-1), C1-C6алкілС(=О)N(R )C1-C6алкіл(N(R )(R ))(C(=O)OH), C1х х y x x C6алкілC(=O)N(R )C1-C6алкіл(R )(R ), C1-C6алкілC(=O)N(R )C1-C6алкіл(R )C(=O)-O-C1-C6алкіл, x х C1-C6алкілC(=O)N(R )C1-C6алкіл(N(R )C(=O)-O-C1-C6алкіл)(C(=O)OH), C1-C6алкілC(=O)(Het1)C(=O)-O-C1-C6алкіл, C1-C6алкіл-O-C(=O)-O-C1-C6алкіл, C1-C6алкіл-O-C(=O)C1-C6алкіл, C1C6алкіл-O-C(=O)C3-C6циклоалкіл, C1-C6алкіл-O-С(=O)(Het-1), C1-C6алкіл-O-C(=O)C1-C6алкілx x y N(R )C(=O)-O-C1-C6алкіл, C1-C6алкіл-NR R , (C1-C6алкіл)S-(Het-1) або C1-C6алкіл-O-(Het-1), де кожен алкіл, циклоалкіл, алкеніл, алкініл, феніл і (Het-1) необов'язково заміщений одним х y або більше замісниками, незалежно вибраними з групи, яка включає F, Cl, Br, I, CN, NO 2, NR R , C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C3-C6циклоалкеніл, C2-C6алкініл, C3-C6циклоалкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1-C6галогеналкіл), OSO2(C1х y х y C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)H, C(=О)OH, C(=О)NR R , (C1-C6алкіл)NR R , C(=О)(C1C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=O)O(C1-C6галогеналкіл), С(=O)(C3C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), C(=О)О(C2-C6алкеніл), (C1C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, х y фенокси, Si(C1-C6алкіл)3, S(=О)nNR R або (Het-1); 3 (F) R вибраний з фенілу, C1-C6алкілфенілу, C1-C6алкілу-О-фенілу, C2-C6алкеніл-O-фенілу, (Het-1), C1-C6алкіл(Het-1) або C1-C6алкіл-O-(Het-1), де кожен алкіл, циклоалкіл, алкеніл, алкініл, феніл і (Het-1) необов'язково заміщений одним х y або більше замісниками, незалежно вибраними з групи, яка включає F, Cl, Br, I, CN, NO 2, NR R , C1-C6алкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C3-C6циклоалкеніл, C2-C6алкініл, C3-C6циклоалкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1-C6галогеналкіл), OSO2(C1х y х y C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)H, C(=О)NR R , (C1-C6алкіл)NR R , C(=О)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), C(=О)(C3C6циклоалкіл), C(=O)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), О(C1C6алкіл), S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, фенокси і (Het-1); 4 (G) R вибраний із групи, визначеної в пункті (К), H або C1-C6алкілу; 5 (Н) М являє собою N або CR , 5 де R вибраний із групи, яка включає Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, S(=О)n(C1-C6алкіл), S(=О)n(C1-C6галогеналкіл), х y С(=О)NR R , С(=О)(C1-C6алкіл), С(=О)О(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)О(C1C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)О(C3-C6циклоалкіл), С(=О)(С2-С6алкеніл), С(=О)О(C2-C6алкеніл) або феніл; 1 (I) (1) Q вибраний із О або S, 2 (2) Q вибраний із О або S; х Y (J) R і R незалежно вибрані з групи, яка включає Н, C1-C6алкіл, C1-C6галогеналкіл, C3C6циклоалкіл, C3-C6галогенциклоалкіл, C2-C6алкеніл, C2-C6алкініл, S(=O)n(C1-C6алкіл), S(=O)n(C1C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), С(=О)Н, С(=О)(C1-C6алкіл), С(=О)О(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), С(=О)(C3C6циклоалкіл), С(=О)О(C3-C6циклоалкіл), С(=О)(С2-С6алкеніл), С(=О)О(С2-С6алкеніл), (C1C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)О(C1-C6алкіл) і феніл, де кожен алкіл, циклоалкіл, циклоалкокси, алкокси, алкеніл, алкініл, феніл, фенокси і (Het-1) необов'язково заміщений одним або більше замісниками, незалежно вибраними з групи, яка включає F, Cl, Br, I, CN, NO2, оксо, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1-C6алкокси, C1C6галогеналкокси, C2-C6алкеніл, C3-C6циклоалкеніл, C2-C6алкініл, C3-C6циклоалкініл, S(=O)n(C1C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), С(=О)Н, С(=О)ОН, С(=О)(C1-C6алкіл), С(=О)О(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)О(C1C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)О(C3-C6циклоалкіл), С(=О)(С2-С6алкеніл), С(=О)О(С2-С6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), С(=О)(C1C6алкіл)С(=О)О(C1-C6алкіл), феніл, галогенфеніл, фенокси і (Het-1), 4 UA 115126 C2 х 5 10 15 20 25 30 35 40 45 y або R і R разом можуть необов'язково утворювати 5-7-членну насичену або ненасичену циклічну групу, яка може містити один або більше гетероатомів, вибраних з атомів азоту, сірки і кисню, де вказана циклічна група може бути заміщеною замісником, вибраним із групи, яка включає F, Cl, Br, I, CN, оксо, тіоксо, C 1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1-C6алкокси, C1C6галогеналкокси, C2-C6алкеніл, C3-C6циклоалкеніл, C2-C6алкініл, C3-C6циклоалкініл, S(=О)n(C1C6алкіл), S(=О)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)(C1C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), C(=О)(C3C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, заміщений феніл, фенокси і (Het-1); 2 4 X 2 X (K) R і R разом з C (Q )(N ) утворюють 4-7-членну насичену або ненасичену гідрокарбільну циклічну групу, яка може містити один або більше додаткових гетероатомів, вибраних з атомів азоту, сірки і кисню, 6 7 де вказана гідрокарбільна циклічна група може бути необов'язково заміщена R і R , 6 7 де R і R незалежно вибрані з групи, яка включає Н, F, Cl, Br, I, CN, C 1-C6алкіл, оксо, тіоксо, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C3-C6циклоалкеніл, C2-C6алкініл, C3-C6циклоалкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1-C6галогеналкіл), OSO2(C1C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, заміщений феніл, фенокси або (Het-1); (L) (Het-1) являє собою 5- або 6-членне насичене або ненасичене гетероциклічне кільце, що містить один або більше гетероатомів, незалежно вибраних з атомів азоту, сірки або кисню, де вказане гетероциклічне кільце також може бути заміщено одним або більше замісниками, незалежно вибраними з групи, яка включає Н, F, Cl, Br, I, CN, NO 2, оксо, C1-C6алкіл, C1C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), х y х y C(=О)NR R , (C1-C6алкіл)NR R , C(=О)(C1-C6алкіл), С(=О)О(C1-C6алкіл), C(=О)(C1C6галогеналкіл), С(=О)О(C1-C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=О)(C1-C6алкіл)C(=О)О(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де вказані заміщений феніл і заміщений фенокси містять один або більше замісників, незалежно вибраних із групи, яка включає Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C1C6алкокси, C1-C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=О)n(C1-C6алкіл), S(=О)n(C1х y C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=О)H, C(=О)NR R , (C1х y C6алкіл)NR R , C(=O)(C1-C6алкіл), C(=О)О(C1-C6алкіл), C(=О)(C1-C6галогеналкіл), С(=О)О(C1C6галогеналкіл), C(=О)(C3-C6циклоалкіл), C(=О)О(C3-C6циклоалкіл), C(=О)(C2-C6алкеніл), С(=О)О(C2-C6алкеніл), (C1-C6алкіл)О(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), феніл і фенокси; і (M) n, кожний окремо, дорівнює 0, 1 або 2. Багато сполук молекули за даним винаходом можуть бути представлені в двох або 1 2 4 декількох таутомерних формах, наприклад, коли R , R або R являють собою Н (див., наприклад, «схему TAU» нижче). Для спрощення схем усі сполуки молекули показані у формі єдиного таутомера. Будь-який і всі альтернативні таутомери включені в обсяг даного винаходу, і не слід робити висновків відносно того, чи існує молекула в таутомерній формі, у якій вона зображена. 50 5 UA 115126 C2 5 10 15 20 25 30 35 40 45 . 1 В іншому варіанті здійснення винаходу Ar являє собою заміщений феніл. 1 В іншому варіанті здійснення винаходу Ar являє собою заміщений феніл, що містить один або більше замісників, вибраних з C1-C6галогеналкілу і C1-C6галогеналкокси. 1 В іншому варіанті здійснення винаходу Ar являє собою заміщений феніл, що містить один або більше замісників, вибраних з CF3, OCF3 і OC2F5. В іншому варіанті здійснення винаходу Het вибраний з бензофуранілу, бензоізотіазолілу, бензоізоксазолілу, бензоксазолілу, бензотієнілу, бензотіазолілу, цинолінілу, фуранілу, індазолілу, індолілу, імідазолілу, ізоіндолілу, ізохінолінілу, ізотіазолілу, ізоксазолілу, оксадіазолілу, оксазолінілу, оксазолілу, фталазинілу, піразинілу, піразолінілу, піразолілу, піридазинілу, піридилу, піримідинілу, піролілу, хіназолінілу, хінолінілу, хіноксалінілу, тетразолілу, тіазолінілу, тіазолілу, тієнілу, триазинілу, триазолілу, піперазинілу, піперидинілу, морфолінілу, піролідинілу, тетрагідрофуранілу, тетрагідропіранілу, 1,2,3,4-тетрагідрохінолінілу, 4,5дигідрооксазолілу, 4,5-дигідро-1H-піразолілу, 4,5-дигідроізоксазолілу і 2,3дигідро[1,3,4]оксадіазолілу. В іншому варіанті здійснення винаходу Het являє собою триазоліл. В іншому варіанті здійснення винаходу Het являє собою 1,2,4-триазоліл. В іншому варіанті здійснення винаходу Het являє собою оксадіазоліл. В іншому варіанті здійснення винаходу Het являє собою 1,3,4-оксадіазоліл. В іншому варіанті здійснення винаходу Het представляє піразоліл. 2 В іншому варіанті здійснення винаходу Ar являє собою феніл. 2 В іншому варіанті здійснення винаходу Ar являє собою заміщений феніл. 2 В іншому варіанті здійснення винаходу Ar являє собою заміщений феніл, що містить один або більше замісників, вибраних з C1-C6алкілу. 2 В іншому варіанті здійснення винаходу Ar являє собою заміщений феніл, що містить один або більше замісників, де вказаний замісник являє собою СН 3. 1 В іншому варіанті здійснення винаходу R являє собою H. 2 В іншому варіанті здійснення винаходу R являє собою групу, визначену пункті (K), H, C1х y C6алкіл, C1-C6алкіл-O-C(=О)C1-C6алкіл, C1-C6алкіл-O-C(=О)NR R або (C1-C6алкіл)S-(Het-1). 2 В іншому варіанті здійснення винаходу R являє собою групу, визначену в пункті (K), Н, СН3, C1-C6алкіл, CH2OC(=О)CH(CH3)2, CH2OC(=О)N(H)(C(=О)OCH2Ph) або CH2S(3,4,5-триметокси-2тетрагідропіран). 3 В іншому варіанті здійснення винаходу R являє собою заміщений феніл. 3 В іншому варіанті здійснення винаходу R являє собою заміщений феніл, де вказаний заміщений феніл містить один або більше замісників, вибраних з F, Cl, C 1-C6алкілу, C3C6циклоалкілу, C1-C6алкокси і фенілу. 3 В іншому варіанті здійснення винаходу R являє собою заміщений феніл, де вказаний заміщений феніл містить один або більше замісників, вибраних з F, CH3, 2-CH(CH3)2, CH(CH3)(C2H5), OCH3 і фенілу. 3 В іншому варіанті здійснення винаходу R являє собою заміщений феніл, де вказаний заміщений феніл містить більш ніж один замісник і щонайменше одна пара замісників знаходиться не в ортоположенні один відносно одного. 3 В іншому варіанті здійснення винаходу R являє собою C1-C6алкілфеніл. 3 В іншому варіанті здійснення винаходу R являє собою (Het-1). 4 В іншому варіанті здійснення винаходу R являє собою H. В іншому варіанті здійснення винаходу М являє собою N. 5 5 В іншому варіанті здійснення винаходу М являє собою CR , де R вибраний з Н, CN, С(=О)(C1-C6алкіл). 6 UA 115126 C2 1 5 10 15 20 25 30 35 40 В іншому варіанті здійснення винаходу Q являє собою O. 2 В іншому варіанті здійснення винаходу Q являє собою S. 2 В іншому варіанті здійснення винаходу Q являє собою O. 2 4 В іншому варіанті здійснення винаходу R і R являють собою групу, визначену в пункті (K), 2 4 X 2 X де R і R разом з C (Q )(N ) утворюють 4-7-членну насичену або ненасичену гідрокарбільну циклічну групу. 2 4 В іншому варіанті здійснення винаходу R і R являють собою групу, визначену в пункті (K), 2 4 X 2 X де R і R разом з C (Q )(N ) утворюють 4-7-членну насичену або ненасичену гідрокарбільну циклічну групу, де вказана гідрокарбільна циклічна група заміщена оксогрупою або C 1C6алкілом. 2 4 В іншому варіанті здійснення винаходу R і R являють собою групу, визначену в пункті (K), 2 4 X 2 X де R і R разом з C (Q )(N ) утворюють 4-7-членну насичену або ненасичену гідрокарбільну 2 х циклічну групу, де "зв’язувальна ланка" між Q і N являє собою СН2С(=О), CH2CH2, CH2CH2CH2 або СН2СН(СН3). Звичайно молекулярна маса молекул за даним винаходом становить приблизно від 400 дальтон до приблизно 1200 дальтон. Однак переважно молекулярна маса становить приблизно від 300 дальтон до приблизно 1000 дальтон, і більш переважно, молекулярна маса становить приблизно від 400 дальтон до приблизно 750 дальтон. Одержання триарильних проміжних продуктів Сполуки молекул за даним винаходом можуть бути отримані за допомогою одержання 1 2 триарильного проміжного продукту Ar -Het-Ar , і наступного зв'язування його з бажаним проміжним продуктом, з одержанням цільової сполуки. Для одержання молекул за даним винаходом може бути використана широка розмаїтість триарильних проміжних продуктів, за 2 умови, що такі триарильні проміжні сполуки містять придатну функціональну групу на Ar , до якого може приєднуватися інша частина цільового проміжного продукту. Придатні функціональні групи включають аміногрупу, ізоціанатну або карбоксильну групу. Ці триарильні проміжні продукти можуть бути отримані способами, описаними раніше в хімічній літературі, у тому числі в публікації Crouse et al., публікація РСТ WO2009/102736 Al (повний зміст якої включений в даний опис за допомогою посилання). Одержання сечовино-зв’язаних сполук Тіобіурети (тіобіссечовини) і біурети можуть бути отримані відповідно до схеми 1, схеми 2 і 2 схеми 3, описаних нижче. SR -тіосечовинні попередники (3) одержують з відповідної 2 тіосечовини (1) обробкою її R -X, де Х являє собою галоген, метансульфонат або аналогічну заміщувану групу. Звичайно їх виділяють у вигляді галогенгідратних (метансульфонатних) 2 солей. Наступна обробка SR -тіосечовинних попередників (3) ізоціанатом (4) (див., наприклад, Pandey, A.K.; et. al., Ind J. Chem., Sect. B: Org. Chem. Incl. Med. Chem. (1982), 21B(2), 150-2) або п-нітрофенілкарбаматом, таким як сполука (5), у присутності основи, такої як триетиламін, карбонат калію або карбонат цезію, приводить до утворення S-алкілтіобіурету (6). . 2 Коли R являє собою -СН2ОС(О)алкіл, обробка етанольним розчином HCl при температурі 2 приблизно від 0ºС до приблизно 50ºС приводить до видалення R і утворення тіобіурету (7) (схема 2). При більш тривалому нагріванні, наприклад, при нагріванні в етанольному розчині 7 UA 115126 C2 HCl до температури кипіння зі зворотним холодильником протягом приблизно від 1 до приблизно 24 годин, тіобіурет перетворюється в біурет (8) із заміною атома кисню атомом сірки. 5 10 15 20 . Альтернативний спосіб одержання тіобіуретів описаний Kaufmann, H.P.; Luthje, K. (Archiv Pharm. und Ber. Deutschen Pharm. (1960), 293, 150-9) і Oertel, G., et al. (Farb. Bayer, DE 1443873 A 19681031 (1972). Карбамоїлізотіоціанат (9) піддається обробці еквівалентом аніліну з утворенням сполуки (7) (схема 3). Інший шлях одержання тіобіуретів включає обробку N3 арилсечовини R -NCS (N. Siddiqui, et. al., Eur. J. Med. Chem., 46 (2011), 2236-2242). Інший шлях 3 одержання біуретів (8) включає обробку N-арилсечовини R -ізоціанатом (Briody, et. al., J. Chem. Soc, Perk. 2, 1977, 934-939). . Тіобіурети (7) можуть піддаватися перетворенню в різні циклізовані аналоги (10) шляхом обробки, наприклад, віцинальними дигалогенідами (наприклад, 1-бром-2-хлоретаном з утворенням 2-іміно-1,3-тіазолінів (10а)) або метилбромацетатом (з утворенням 2-іміно-1,3тіазолін-4-онів (10b)), або α-галогенкетонами (з утворенням 2-іміно-1,3-тіазолів (10с)), як показано на схемі 4. Може бути використана основа, така як карбонат калію або ацетат натрію, у протонному розчиннику або апротонному розчиннику при температурі приблизно від 0ºС до приблизно 100ºС. Варто розуміти, що з використанням умов, описаних вище, також можуть бути отримані кільця інших розмірів і з іншими замісниками; наприклад, відповідний шестичленний циклічний аналог (10d) може бути отриманий виходячи з 1,3-дигалогенпропанового попередника. 8 UA 115126 C2 5 . Альтернативний спосіб одержання аналогів формули (10b) описаний на схемі 5. Обробка 2іміно-1,3-тіазолін-4-ону (11) арилізоціанатом або проміжним продуктом (5) (схема 1) у присутності амінної основи, такої як триетиламін, приводить до одержання сполуки (10b). Інші способи одержання сполуки (10b) включають додавання карбонілдіімідазолу (11), з одержанням проміжної сполуки (12а), або додавання 4-нітрофенілхлорформіату, з одержанням сполуки 1 2 (12b). Сполука (12a) або (12b) може бути отримана для взаємодії з аніліном Ar -Het-Ar -NH2, з одержанням сполуки (10b). 9 UA 115126 C2 5 10 Ще один шлях одержання 1-(3-арилтіазолідин-2-іліден)-3-арилсечовини (10а) представлений на схемі 6. Обробка арилціанаміду (12) тіїраном у присутності основи, такої як карбонат калію, приводить до одержання 2-іміно-1,3-тіазоліну (14). Синтез і наступне ацилування 3-арил-2-імінотіазолідинів таким способом описане в патенті США 4867780 (F.X. Woolard) і в приведених там посиланнях. Наступна обробка сполуки (14) карбонілдіімідазолом (з утворенням сполуки 15а) або 4-нітрофенілхлорформіатом (з утворенням сполуки 15b) з наступним додаванням аніліну приводить до утворення сполуки (10а). Альтернативно, взаємодія сполуки (14) з арилізоціанатом або 4-нітрофенілкарбаматом (5) також приводить до одержання сполуки (10а). 10 UA 115126 C2 5 Можна бачити, що за допомогою методик, представлених на схемах 4-6, можуть бути отримані й інші аналоги, що містять 4-, 5- і 6-членні кільця різних конфігурацій з іншою картиною заміщення. Відомі й інші гетероциклічні системи, що містять екзоіміногрупу, включаючи, але без обмеження, 2-імінотіадіазолінони (16) (див. схему 7), 2-імінооксадіазолінони (17) (Syn. Comm, 2002, 32 (5), 803-812); 2-імінооксазолінони (18) або 2-імінотіадіазоли (19). Вони також можуть бути використані для одержання сполук молекул (20)-(23) відповідною заміною попередників у методиках, описаних на схемі 5 і схемі 6. 10 11 UA 115126 C2 5 10 Малонілмонотіоаміди ((25) і (26)) і малонілдіаміди (29) можуть бути отримані, як описано на 3 схемі 8. Конденсація -кетоаніліду або -ціаноаніліду (24) з R -NCS приводить до утворення 25 ацилмалономонотіоаміду (25). Коли R являє собою ацетильну групу, деацилування проводять при кип'ятінні зі зворотним холодильником у етанолі з утворенням малономонотіоаміду (26). Тіоаміди можуть бути піддані циклізації аналогічно описаному на схемах 5 і 6, з одержанням циклічних аналогів (27). Діамід (29) може бути отриманий з відповідної монокарбонової кислоти (28) в умовах зв'язування дициклогексилкарбодііміду-1-гідроксі-7-азабензотриазолу (див., наприклад, Jones, J., у The Chemical Synthesis of Peptides. Int. Ser. of Monographs on Chemistry, Oxford Univ. (Oxford, 1994), 23). 12 UA 115126 C2 5 10 15 20 Подальші перетворення алкілуванням NH-групи в аналогах, таких як сполуки (6), (10а), (10b), (10c), (20)-(23) і (27), можуть бути здійснені обробкою відповідної сполуки алкілуючим 1 агентом, R -X, де Х являє собою галоген, метансульфонільну групу або іншу аналогічну відхідну групу (схема 9). Для взаємодії необхідне використання сильної основи, такої як гідрид натрію (NaH) або гексаметилдисилазан калію, в апротонному розчиннику, такому як тетрагідрофуран або N,N-диметилформамід. . 1 Аналоги, у яких R не є Н, також можуть бути отримані, як показано на схемі 10. Алкілування 1 2 Ar -Het-Ar -NH2 і перетворення в тіосечовину (31) може бути досягнуто різними відомими способами. Наприклад, взаємодія з формальдегідом і бензотриазолом з наступним відновленням боргідридом натрію приводить до одержання N-метильного аналога (30). Перетворення в сполуку (31) може бути здійснене обробкою тіофосгеном і аміаком або бензоїлізотіоціанатом з наступною каталізованою основою розщепленням бензоїльної групи. Обробка сполуки (31) оксалілхлоридом і триетиламіном в умовах, вперше описаних J. Goerdeler і K. Jonas (Chem. Ber., 1966, 99(11), p. 3572-3581), приводить до утворення 2-аміно-1,3-тіазолін4,5-діону (32). Піроліз цього проміжного продукту при кип'ятінні зі зворотним холодильником у 3 толуолі приводить до одержання N-карбонілізотіоціанату (33), що при обробці з аміном R -NH 1 1 дає тіобіурет (7b, R означає CН3). Тіобіурети, у яких R не є Н, можуть бути піддані перетворенню в умовах, описаних на схемі 4, у циклічні аналоги, такі як сполука 10е. 1. бензоїлізотіоціанат 1 25 2 Арилізоціанат, Ar -Het-Ar -NCO, може бути оброблений безпосередньо N-арилтіосечовиною у присутності каталітичної кількості основи, такої як карбонат цезію або гідрид натрію, з одержанням тіобіурету (7) (схема 11). 13 UA 115126 C2 1 5 10 2 1 Спосіб одержання 1-(Ar )-3-(Ar )-1,2,4-триазолів (36), де Ar являє собою 4(галогеналкокси)фенільну або 4-(галогеналкіл)фенільну групу, включає сполучення 1-(4галогеналкокси)феніл-3-бром-1,2,4-триазолу або 1-(4-галогеналкіл)феніл-3-бром-1,2,4-триазолу (35, схема 12) з арилбороновою кислотою або складним ефіром арилборонової кислоти в умовах реакції Сузукі. Проміжні продукти (35), у свою чергу, можуть бути отримані взаємодією 3бром-1H-1,2,4-триазолу (Kroeger, C. F.; Miethchen, R., Chemische Berichte (1967), 100(1), 2250) (однак може використовуватися 3-хлор-1H-1,2,4-триазол) з 4-галогеналкокси-1-галогенбензолом (де галоген незалежно являє собою I, Br, Cl або F) у присутності металевого каталізатора, такого як CuI або Cu2O, і основи, такої як Cs2CO3, K3PO4 або K2CO3, з додатковим лігандом, таким як хінолін-8-ол, N,N'-диметилетилендіамін, інші 1,2-діаміни або гліцин, або без нього в полярному апротонному розчиннику, такому як ацетонітрил, ДМФА або ДМСО, при температурах в інтервалі приблизно від 70 до 150С. 15 1 20 25 1 Автори винаходу також описали нові 1-Ar -3-бром-1,2,4-триазоли, де Ar являє собою 4-(C1C6алкіл)феніл, 4-(C1-C6-галогеналкіл)феніл, 4-(C1-C6алкокси)феніл, 4-(C1C6галогеналкокси)феніл, 4-(C1-C6алкілтіо)феніл або 4-(C1-C6галогеналкілтіо)феніл, як проміжні продукти, які використовуються для одержання ряду молекул, заявлених у даному винаході (одержання описане на схемі 1. . Приклади Приклади приведені для ілюстрації даного винаходу, і варіанти здійснення винаходу, розкриті в представлених прикладах, не повинні розглядатися як його обмеження. 14 UA 115126 C2 5 10 15 20 25 30 35 40 45 Вихідні речовини, реагенти і розчинники, які одержували з комерційних джерел, використовували без додаткового очищення. Безводні розчинники купували як Sure/Seal™ від Aldrich і використовували такими, як було отримано. Температури плавлення визначали з використанням автоматизованої системи визначення температури плавлення OptiMelt від Stanford Research Systems і не коректувалися. Назви молекулам дані відповідно до програм складання назв хімічних сполук у MDL ISIS™/Draw 2.5, ChemBioDraw Ultra 12.0 або ACD Name Pro. Якщо такі програми не були здатні присвоїти сполуці молекули назву, сполуки молекули 1 одержували назву з використанням звичайних правил номенклатури. Дані H ЯМР спектра представлені в м. ч. () і записувалися при 400 МГц, якщо не вказане інше. Приклад 1. Одержання (Е)-((N’-(4-метокси-2-метилфеніл)-N-((4-(1-(4-(трифторметил)феніл)1H-1,2,4-триазол-3-іл)феніл)карбамоїл)карбамімідоїл)тіо)метилізобутирату (молекула A1) Стадія 1. 2-Метил-4-метоксифенілтіосечовину (0,5 грама (г), 2,55 ммоль) і бромметилізобутират змішують у 5 мл ацетону при температурі навколишнього середовища, і отриманий розчин перемішують протягом 18 годин. Потім розчин охолоджують до 0ºС, твердий осад, що утворився, збирають фільтруванням і сушать на повітрі, з одержанням HBr солі (Е)-(N’(4-метокси-2-метилфеніл)карбамімідоїлтіо)метилізобутирату (B1) (0,83 г, 82%): т. пл. 127-130ºС; 1 H ЯМР (CDCl3) 11,34 (с, 1Н), 10,29 (с, 1Н), 8,32 (с, 1Н), 7,09 (д, J=8,7 Гц, 1H), 6,79 (д, J=2,8 Гц, 1H), 6,74 (дд, J=8,7, 2,8 Гц, 1H), 3,81 (с, 3H), 2,69 (гептет, J=7,0 Гц, 1H), 2,31 (с, 3H), 1,22 (д, + J=7,0 Гц, 6H); ESI МС m/z 297 ([M+H] ). Стадія 2. Проміжний продукт, отриманий на стадії 1 (0,40 г, 1,06 ммоль), розчиняють у тетрагідрофурані (ТГФ; 7 мл) і додають 4-нітрофеніл-4-(1-(4-(трифторметил)феніл)-1H-1,2,4триазол-3-іл)фенілкарбамат (0,50 г, 1,06 ммоль). До отриманої суспензії додають N-етил-Nізопропілпропан-2-амін (основа Хеніга; 0,25 г, 1,9 ммоль) і розчин перемішують при температурі навколишнього середовища протягом 2 годин. Леткі речовини випарюють, і отриману смолисту олію очищають хроматографією на силікагелі (елюювання з градієнтом: EtOAc-гексани 0-50%), з одержанням вказаної в заголовку сполуки (425 мг, 61%) у вигляді білої твердої речовини: т. пл. 160-164ºС; 1 H ЯМР (CDCl3) 11,24 (с, 1Н), 8,64 (с, 1Н), 8,17 (д, J=8,7 Гц, 2Н), 7,92 (д, J=8,4 Гц, 2Н), 7,80 (д, J=8,5 Гц, 2H), 7,67 (д, J=8,7 Гц, 2H), 7,41 (с, 1H), 7,12 (д, J=8,6 Гц, 1H), 6,79 (д, J=2,8 Гц, 1H), 6,74 (дд, J=8,4, 3,1 Гц, 1H), 5,65 (с, 2H), 3,82 (с, 3H), 2,59 (гептет, J=7,0 Гц, 1H), 2,27 (с, 3H), 1,18 + (д, J=7,0 Гц, 6H); МС (ESI) m/z 627 ([M+H] ). Сполуки молекул A54-A62, представлені в таблиці 1, одержують відповідно до методик, описаних у прикладі 1. Представлені нижче сполуки молекул (приклади 2-10) одержують в умовах, використовуваних у прикладі 1. Приклад 2. (Z)-Метил-N-(4-метокси-2-метилфеніл)-N’-((4-(1-(4-(трифторметил)феніл)-1H1,2,4-триазол-3-іл)феніл)карбамоїл)карбамімідотіоат (молекула A2) Вказану в заголовку сполуку одержують у вигляді білої твердої речовини; 38 мг (11%), т. пл. 172-175ºС; 1 H ЯМР (CDCl3) 11,29 (с, 1H), 8,64 (с, 1H), 8,17 (д, J=8,7 Гц, 2H), 7,92 (д, J=8,5 Гц, 2H), 7,80 (д, J=8,5 Гц, 2H), 7,66 (д, J=8,7 Гц, 2H), 7,33 (с, 1H), 7,16 (д, J=8,6 Гц, 1H), 6,80 (д, J=2,9 Гц, 1H), + 6,75 (дд, J=8,6, 2,8 Гц, 1H), 3,82 (с, 3H), 2,38 (с, 3H), 2,30 (с, 3H); МС (ESI) m/z 541 ([М+Н] ). Приклад 3. (Е)-(N’-(2,6-Диметилфеніл)-N-(4-(1-(4-(трифторметил)феніл)-1H-1,2,4-триазол-3іл)фенілкарбамоїл)карбамімідоїлтіо)метилізобутират (молекула А3) 15 UA 115126 C2 5 10 15 20 25 30 35 Стадія 1. Проміжну HBr сіль (Е)-(N’-(2,6-диметилфеніл)карбамімідоїлтіо)метилізобутирату (B2) одержують з 1-(2,6-диметилфенілтіосечовини) в умовах, використовуваних у прикладі 1. Т. пл. 129-131ºС; 1 H ЯМР (CDCl3) 11,51 (с, 1H), 10,45 (с, 1H), 8,25 (с, 1H), 7,23 (д, J=7,5 Гц, 1H), 7,12 (д, J=7,4 Гц, 2H), 5,59 (с, 2H), 2,69 (гептет, J=7,0 Гц, 1H), 2,30 (с, 6H), 1,23 (д, J=7,0 Гц, 6H); МС (ESI) m/z + 280 ([М+Н] ). Стадія 2. Сполуку молекули A3 одержують відповідно до методики, аналогічно описаної в прикладі 1: 575 мг (59%) білої твердої речовини, т. пл. 173-176C; 1 H ЯМР (CDCl3) 11,21 (с, 1H), 8,65 (с, 1H), 8,18 (д, J=8,7 Гц, 2H), 7,92 (д, J=8,4 Гц, 2H), 7,80 (д, J=8,5 Гц, 2H), 7,68 (д, J=8,7 Гц, 2H), 7,20 (м, 1H), 7,14-7,04 (м, 2H), 5,65 (с, 2H), 2,59 (гептет, + J=7,0 Гц, 1H), 2,29 (с, 6H), 1,18 (д, J=7,0 Гц, 6H); МС (ESI) m/z 611 ([М+Н] ). Приклад 4. (Е)-(N’-(2,6-Диметилфеніл)-N-(4-(1-(4-(трифторметокси)феніл)-1H-1,2,4-триазол3-іл)фенілкарбамоїл)карбамімідоїлтіо)метилізобутират (молекула A4) Сполуку молекули A4 одержують відповідно до методики, аналогічно описаної в прикладі 1: 860 мг (52%) білої твердої речовини, т. пл. 148-151C; 1 H ЯМР (CDCl3) 11,21 (с, 1H), 8,55 (с, 1H), 8,17 (д, J=8,7 Гц, 2H), 7,81 (д, J=8,7 Гц, 2H), 7,67 (д, J=8,7 Гц, 2H), 7,42 (шир. с, 1H), 7,39 (д, J=8,7 Гц, 2H), 7,21-7,10 (м, 3H), 5,65 (с, 2H), 2,67-2,52 + (м, 1H), 2,29 (с, 6H), 1,18 (д, J=7,0 Гц, 6H); МС (ESI) m/z 627 ([М+Н] ). Приклад 5. (Z)-((N-(2-Ізопропілфеніл)-N’-((4-(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол3-іл)феніл)карбамоїл)карбамімідоїл)тіо)метилізобутират (молекула А5) Стадія 1. Проміжну HBr сіль (E)-(N’-(2-ізопропілфеніл)карбамімідоїлтіо)метилізобутирату (B3) одержують з 1-(2-ізопропілфенілтіосечовини) в умовах, використовуваних у прикладі 1, т. пл. 80-85ºС; 1 H ЯМР (CDCl3) 11,70 (с, 1H), 10,45 (с, 1H), 8,27 (с, 1H), 7,47-7,36 (м, 1H), 7,23 m, 1H), 7,15 (д, J=7,4 Гц, 2H), 5,59 (с, 2H), 3,17 (м, 1H), 2,69 (гептет, J=7,0 Гц, 1H), 1,26 (д, J=6,9 Гц, 3H), 1,22 + (д, J=6,9 Гц, 3H); МС (ESI) m/z 295 ([М+Н] ). Стадія 2. Сполуку молекули A5 одержують відповідно до методики, аналогічно описаної в прикладі 1: 382 мг (62%) білої твердої речовини, т. пл. 141-143C; 1 H ЯМР (CDCl3) 11,54 (с, 1H), 8,55 (д, J=3,7 Гц, 1H), 8,16 (д, J=8,6 Гц, 2H), 7,80 (д, J=9,1 Гц, 2H), 7,67 (д, J=8,6 Гц, 2H), 7,46-7,32 (м, 5H), 7,23-7,16 (м, 2H), 5,67 (с, 2H), 3,25-3,10 (м, 1H), + 2,65-2,52 (м, 1H), 1,24 (д, J=6,9 Гц, 6H), 1,17 (д, J=7,0 Гц, 6H); МС (ESI) m/z 641 ([М+Н] ). Приклад 6. (Z)-((N-(2-Ізопропілфеніл)-N’-((4-(1-(4-(пентафторетокси)феніл)-1Н-1,2,4-триазол3-іл)феніл)карбамоїл)карбамімідоїл)тіо)метилізобутират (молекула А6) 16 UA 115126 C2 5 10 15 20 25 30 Сполуку молекули A6 одержують відповідно до методики, аналогічно описаної в прикладі 1: 300 мг (45%) білої твердої речовини, т. пл. 154-156C; 1 H ЯМР (CDCl3) 11,54 (с, 1H), 8,56 (д, J=3,7 Гц, 1H), 8,17 (д, J=8,7 Гц, 2H), 7,81 (д, J=9,1 Гц, 2H), 7,67 (д, J=8,7 Гц, 2H), 7,46-7,33 (м, 5H), 7,24-7,19 (м, 2H), 5,67 (с, 2H), 3,29-3,08 (м, 1H), + 2,66-2,50 (м, 1H), 1,24 (д, J=6,9 Гц, 6H), 1,17 (д, J=7,0 Гц, 6H); МС (ESI) m/z 691 ([М+Н] ). Приклад 7. (Е)-(N'-(2,6-Диметил-4-метоксифеніл)-N-(4-(1-(4-(трифторметокси)феніл)-1Н1,2,4-триазол-3-іл)фенілкарбамоїл)карбамімідоїлтіо)метилізобутират (молекула А7) Стадія 1. Проміжну HBr сіль (E)-(N’-(2,6-диметил-4метоксифеніл)карбамімідоїлтіо)метилізобутирату (B4) одержують з 1-(2,6-диметил-4метоксифенілтіосечовини) в умовах, використовуваних на стадії 1 прикладу 1: т. пл. 152-154ºС; 1 H ЯМР (CDCl3) 6,62 (с, 2H), 5,59 (с, 2H), 3,79 (с, 3H), 2,68 (гептет, J=7,0 Гц, 1H), 2,25 (с, + 6H), 1,22 (д, J=7,0 Гц, 6H); МС (ESI) m/z 311 ([М+Н] ). Стадія 2. Сполуку молекули A7 одержують відповідно до методики, аналогічно описаної в прикладі 1: 955 мг (71%) білої твердої речовини, т. пл. 148-151C; 1 H ЯМР (CDCl3) 11,03 (с, 1H), 8,55 (с, 1H), 8,16 (д, J=8,7 Гц, 2H), 7,80 (д, J=9,1 Гц, 2H), 7,67 (д, J=8,7 Гц, 2H), 7,39 (м, 3H), 6,64 (с, 2H), 5,64 (с, 2H), 3,80 (с, 3H), 2,59 (гептет, J=7,0 Гц, 1H), + 2,25 (с, 6H), 1,17 (д, J=7,0 Гц, 6H); МС (ESI) m/z 657 ([М+Н] ). Приклад 8. (Z)-((N-(2,6-Диметилфеніл)-N’-((4-(1-(4-(трифторметил)феніл)-1Н-1,2,4-триазол3-іл)феніл)карбамоїл)карбамімідоїл)тіо)метил-2-(((бензилокси)карбоніл)аміно)ацетат (молекула A8) Проміжну HCl сіль ((N-(2,6-диметилфеніл)карбамімідоїл)тіо)метил-2(((бензилокси)карбоніл)аміно)ацетату (B5) одержують відповідно до методики, описаної на стадії 1 прикладу 1, і використовують без додаткового очищення. Сполуку молекули A8 (30 мг, 15%) виділяють у вигляді білої твердої речовини, т. пл. 142-148C; 1 H ЯМР (CDCl3) 11,26 (с, 1H), 8,64 (с, 1H), 8,16 (д, J=8,4 Гц, 2H), 7,91 (д, J=8,2 Гц, 2H), 7,79 (д, J=8,5 Гц, 2H), 7,71 (д, J=8,1 Гц, 2H), 7,54 (с, 1H), 7,34 (м, 5H), 7,15 (м, 3H), 5,69 (с, 2H), 5,23 (с, + 1H), 5,13 (с, 2H), 4,02 (д, J=5,7 Гц, 2H), 2,29 (с, 6H); МС (ESI) m/z 732 ([М+Н] ). Приклад 9. (Е)-((N’-(4-метокси-2,6-диметилфеніл)-N-((4-(1-(4-(трифторметил)феніл)-1Н1,2,4-триазол-3-іл)феніл)карбамоїл)карбамімідоїл)тіо)метил-2(((бензилокси)карбоніл)аміно)ацетат (молекула A9) 17 UA 115126 C2 5 10 15 20 25 30 35 Проміжну HCl сіль ((N-(2,6-диметил-4-метоксифеніл)карбамімідоїл)тіо)метил-2(((бензилокси)карбоніл)аміно)ацетату (B6) одержують відповідно до методики, описаної на стадії 1 прикладу 1, і використовують без додаткового очищення. Сполуку молекули A9 (330 мг, 46%) виділяють у вигляді білої твердої речовини, т. пл. 142-148C; 1 H ЯМР (CDCl3) 11,07 (с, 1H), 8,55 (с, 1H), 8,15 (д, J=8,5 Гц, 2H), 7,80 (д, J=8,8 Гц, 2H), 7,70 (д, J=8,4 Гц, 2H), 7,52 (д, J=3,1 Гц, 1H), 7,44-7,31 (м, 7H), 6,64 (с, 2H), 5,67 (с, 2H), 5,23 (с, 1H), + 5,12 (с, 2H), 4,02 (д, J=5,8 Гц, 2H), 3,80 (с, 3H), 2,21 (с, 6H); МС (ESI) m/z 778 ([М+Н] ). Приклад 10. (Z)-(((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагідро-2H-піран-2іл)тіо)метил-N-(4-метокси-2-метилфеніл)-N’-((4-(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол3-іл)феніл)карбамоїл)карбамімідотіоат (молекула A10) Проміжну HCl сіль (((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагідро-2H-піран-2іл)тіо)метил-(4-метокси-2-метилфеніл)карбамімідотіоату (B7) одержують відповідно до методики, описаної на стадії 1 прикладу 1, і використовують без додаткового очищення. Сполуку молекули A10 (240 мг, 43%) виділяють у вигляді білої твердої речовини, т. пл. 128132C; 1 H ЯМР (CDCl3) 11,19 (с, 1H), 8,56 (с, 1H), 8,15 (д, J=8,4 Гц, 2H), 7,80 (J=8,4 Гц, 2H), 7,66 (д, J=8,5 Гц, 2H), 7,38 (д, J=8,3 Гц, 2H), 7,14 (д, J=8,6 Гц, 1H), 6,82-6,69 (м, 3H), 5,69 (с, 1H), 4,46 (д, J=13,9 Гц, 1H), 4,05 (д, J=13,9 Гц, 1H), 3,91 (дд, J=9,3, 6,2 Гц, 1H), 3,81 (с, 3H), 3,67 (дд, J=3,2, 1,5 Гц, 1H), 3,56 (с, 3H), 3,46 (с, 3H), 3,44 (с, 3H), 3,38 (дд, J=9,3, 3,3 Гц, 1H), 3,21 (т, J=9,3 Гц, + 1H), 2,29 (с, 3H), 1,32 (д, J=6,1 Гц, 3H); МС (ESI) m/z 777 ([M+H] ). Приклад 11. Одержання N-[[(2,6-диметилфеніл)аміно]тіоксометил]-N’-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)фенілсечовини (молекула А11) До розчину сполуки молекули A4 (660 мг, 1,05 ммоль) у 75 мл метанолу додають 20 мл 1н. НСl, отриманий розчин нагрівають до 55С і витримують при вказаній температурі протягом 36 годин. Потім охолоджений розчин розбавляють ще 50 мл води, твердий осад, що утворився, збирають фільтруванням і сушать на повітрі, з одержанням 470 мг (81) вказаної в заголовку сполуки, т. пл. 233-235C. 1 H ЯМР (CDCl3) 8,54 (с, 1H), 8,12 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,1 Гц, 2H), 7,62 (д, J=8,8 Гц, + 2H), 7,44-7,29 (м, 4H), 7,22 (д, J=7,5 Гц, 2H), 4,01 (с, 2H), 2,17 (с, 6H); МС (ESI) m/z 527 ([М+Н] ). Сполуки молекул A44 і A49-A52, представлених у таблиці 1, одержують відповідно до методики, описаної в прикладі 11. Приклад 12. Одержання N-[[(2,6-диметилфеніл)аміно]тіоксометил]-N'-(4-(1-(4(трифторметил)феніл)-1Н-1,2,4-триазол-3-іл)фенілсечовини (молекула А12) 18 UA 115126 C2 5 10 15 20 25 30 35 40 До розчину сполуки молекули A3 (125 мг, 0,203 ммоль) у 5 мл МеОН додають 0,5 мл 7н. розчину NH3 у метанолі. Отриманий розчин перемішують при температурі навколишнього середовища протягом 16 годин. Розчин концентрують і хроматографують (елюювання з градієнтом: EtOAc-гексани 0-100%), з одержанням 28 мг (27%) тіобіурету у вигляді білої твердої речовини, т. пл. 204-212C. 1 Н ЯМР (ДМСО) 11,30 (с, 1H), 10,20 (с, 1H), 9,52 (с, 1H), 9,51 (с, 1H), 8,19 (д, J=8,4 Гц, 2H), 8,11 (д, J=8,7 Гц, 2H), 7,99 (д, J=8,6 Гц, 2H), 7,62 (д, J=8,8 Гц, 2H), 7,20-7,09 (м, 3H), 2,20 (с, 6H); + МС (ESI) m/z 511 ([M+H] ). Приклад 13. Одержання 1-(2-ізопропілфеніл)-3-[[4-[1-[4-(трифторметокси)феніл]-1,2,4триазол-3-іл]феніл]карбамоїл]сечовини (молекула A13) Сполуку молекули A5 (500 мг, 0,78 ммоль) додають до суміші 10 мл ТГФ і 2 мл 1н. HCl і отриманий розчин перемішують протягом 24 годин. Потім розчин розподіляють між EtOAc (30 мл) і насиченим розчином NaHCО3 (15 мл). Розділення шарів і сушіння органічного шару з наступним видаленням розчинника приводять до одержання неочищеної твердої речовини, що очищають хроматографією на силікагелі, з одержанням 160 мг (38%) вказаної в заголовку сполуки у вигляді білої твердої речовини, т. пл. 300ºС (розклад.); 1 H ЯМР (ДМСО-d6) 9,86 (с, 1H), 9,57 (с, 1H), 9,37 (д, J=13,8 Гц, 2H), 8,15-7,98 (м, 4H), 7,74 (дд, J=7,9, 1,5 Гц, 1H), 7,67-7,53 (м, 4H), 7,33 (дд, J=7,5, 1,8 Гц, 1H), 7,24-7,06 (м, 2H), 3,20-2,99 + (м, 1H), 1,22 (д, J=6,8 Гц, 6H); МС (ESI) m/z 525 ([M+H] ). Приклад 14. Одержання (Z)-1-(3-(2,6-диметилфеніл)-4-оксотіазолідин-2-іліден)-3-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)сечовини (молекула A14) До суспензії сполуки молекули A11 (200 мг, 0,38 ммоль) у 5 мл EtOH додають ацетат натрію (200 мг, 2,43 ммоль) і метилбромацетат (0,14 г, 0,91 ммоль), отриманий розчин нагрівають до 60С і витримують при вказаній температурі протягом 3 годин. Охолоджений розчин розбавляють 2 мл води, твердий осад, що утворився, збирають фільтруванням і сушать на повітрі, з одержанням 142 мг (64%) вказаної в заголовку сполуки, т. пл. 190-196C. 1 H ЯМР (CDCl3) 8,54 (с, 1H), 8,12 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,1 Гц, 2H), 7,62 (д, J=8,8 Гц, + 2H), 7,44-7,29 (м, 4H), 7,22 (д, J=7,5 Гц, 2H), 4,01 (с, 2H), 2,17 (с, 6H); МС (ESI) m/z 567 ([М+Н] ). Сполуки молекул А35-А37, A65, A66, A69, A74-A77, A85-A88, A92-A95, A103-A105, A108A111, A115, A117, A120-A121 і A125, представлені в таблиці 1, одержують відповідно до методик, описаних у прикладі 14. Приклад 15. Одержання (Z)-2-((2,6-диметилфеніл)іміно)-N-(4-(1-(4-(трифторметокси)феніл)1Н-1,2,4-триазол-3-іл)феніл)тіазолідин-3-карбоксамід (молекула А15) До розчину сполуки молекули A11 (350 мг, 0,665 ммоль) у 7 мл ацетону додають карбонат калію (200 мг, 1,44 ммоль) і 1-хлор-2-брометан (0,20 г, 1,40 ммоль), отриманий розчин нагрівають до 50С і витримують при вказаній температурі протягом 5 годин. Охолоджений 19 UA 115126 C2 5 10 15 20 25 30 35 40 розчин адсорбують на силікагель і хроматографують (елюювання з градієнтом: EtOAc-гексани 0-80%), з одержанням 99 мг (26%) сполуки молекули A15: т. пл. 145-150C. 1 H ЯМР (CDCl3) 8,51 (с, 1H), 8,07 (д, J=7,9 Гц, 2H), 7,81-7,74 (м, 2H), 7,59 (д, J=6,8 Гц, 2H), 7,36 (д, J=8,3 Гц, 2H), 7,19 (м, 3H), 7,12 (с, 1H), 3,81 (т, J=7,7 Гц, 2H), 3,37 (т, J=7,6 Гц, 2H), 2,23 + (с, 6H); МС (ESI) m/z 553 ([М+H] ). Приклад 16. Одержання (Z)-2-((2,6-диметилфеніл)іміно)-N-(4-(1-(4-(трифторметокси)феніл)1Н-1,2,4-триазол-3-іл)феніл)-1,3-тіазинан-3-карбоксамід (молекула А16) До розчину сполуки молекули A11 (150 мг, 0,28 ммоль) у 5 мл ацетону додають карбонат калію (150 мг, 1,08 ммоль) і 1-хлор-3-бромпропан (0,16 г, 1,00 ммоль), отриманий розчин нагрівають до 50С і витримують при вказаній температурі протягом 5 годин. Охолоджений розчин адсорбують на силікагель і хроматографують (елюювання з градієнтом: EtOAc-гексани 0-70%), з одержанням 22 мг (12%) тіазинану: т. пл. 121-125C. 1 H ЯМР (CDCl3) 12,81 (с, 1H), 8,54 (с, 1H), 8,16-8,09 (м, 2H), 7,79 (д, J=9,2 Гц, 2H), 7,63 (д, J=8,8 Гц, 2H), 7,38 (д, J=8,3 Гц, 2H), 7,18-6,96 (м, 3H), 4,22-4,09 (м, 2H), 3,00 (т, J=6,9 Гц, 2H), + 2,25-2,13 (м, 8H); МС (ESI) m/z 567 [M+H] ). Сполуки молекул A39 і A41, представлені в таблиці 1, одержують відповідно до методики, описаної в прикладі 16. Приклад 17. Одержання (Z)-2-((2,6-диметилфеніл)іміно)-N-(4-(1-(4-(трифторметокси)феніл)1Н-1,2,4-триазол-3-іл)феніл)тіазолідин-3-карбоксамід (молекула А17) До розчину сполуки молекули A11 (150 мг, 0,28 ммоль) у 5 мл ацетону додають карбонат калію (100 мг, 0,72 ммоль) і 1,2-дибромпропан (0,07 г, 1,20 ммоль), отриманий розчин нагрівають до 50C і витримують при вказаній температурі протягом 12 годин. Охолоджений розчин адсорбують на силікагель і хроматографують (елюювання з градієнтом: EtOAc-гексани 0-80%), з одержанням 29 мг (18%) вказаної в заголовку сполуки у вигляді світло-коричневої твердої речовини, т. пл. 105-115C. 1 H ЯМР (CDCl3) 8,52 (с, 1H), 8,07 (д, J=8,3 Гц, 2H), 7,83-7,73 (м, 2H), 7,59 (д, J=8,2 Гц, 2H), 7,37 (д, J=8,3 Гц, 2H), 7,20 (м, 4H), 4,24 (дд, J=14,5, 6,6 Гц, 1H), 3,58-3,41 (м, 4H), 3,02 (дд, + J=11,0, 8,6 Гц, 1H), 2,25 (с, 3H), 2,21 (с, 3H), 1,21 (д, J=6,4 Гц, 3H); МС (ESI) m/z 567 ([М+Н] ). Сполуки молекул A38 і A40, представлені в таблиці 1, одержують відповідно до методик, описаних у прикладі 17. Приклад 18. Одержання (Z)-1-(3-(2-(втор-бутил)феніл)-4-оксотіазолідин-2-іліден)-3-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)сечовини (молекула А18) До суспензії 1-(2-(S-втор-бутил)фенілтіосечовини (1,40 г, 6,72 ммоль) у 5 мл ацетону додають метилбромацетат (1,23 г, 1,20 ммоль) і отриманий розчин перемішують при температурі навколишнього середовища протягом 18 годин. Потім розчин розбавляють 8 мл діетилового ефіру, перемішують протягом 30 хвилин, розчинник обережно декантують від смолистої олії. Проміжну HBr сіль метил-2-((N-(2-(втор-бутил)феніл)карбамімідоїл)тіо)ацетату (В8) розчиняють у 8 мл сухого тетрагідрофурану, до отриманого розчину додають 4-нітрофеніл(4-(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)карбамат (3,26 г, 6,72 ммоль) з наступним додаванням основи Хеніга (2,6 г, 20 ммоль). Розчин перемішують при температурі навколишнього середовища протягом 3 годин, потім концентрують, і залишок хроматографують 20 UA 115126 C2 5 10 15 20 25 30 35 40 (силікагель, елюювання з градієнтом: EtOAc-гексани 0-70%), з одержанням 730 мг (18%) вказаної в заголовку сполуки у вигляді твердої речовини, т. пл. 169-177C; 1 H ЯМР (CDCl3) 8,53 (с, 1H), 8,12 (д, J=8,7 Гц, 2H), 7,81-7,74 (м, 2H), 7,63-7,56 (м, 2H), 7,52 (м, 1H), 7,45 (д, J=7,9 Гц, 1H), 7,41-7,32 (м, 3H), 7,28 (с, 1H), 7,11 (д, J=7,9 Гц, 1H), 4,03-3,95 (м, 2H), 2,43 (дд, J=13,5, 6,8 Гц, 1H), 1,73-1,56 (м, 2H), 1,20 (перекривний д, J=7,6 Гц, 3H), 0,78 + (перекривний т, J=7,4 Гц, 3H); МС (ESI) m/z 594 ([M+H] ). Сполуку молекули, представленої нижче, одержують в умовах, використовуваних у попередньому прикладі. Приклад 19. Одержання (Z)-1-(3-(2-ізопропілфеніл)-4-оксотіазолідин-2-іліден)-3-(4-(1-(4трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)фенілсечовини (молекула А19) Виходячи з 0,70 г (2,0 ммоль) проміжної HBr солі (Е)-метил-2-((N’-(2ізопропілфеніл)карбамімідоїл)тіо)ацетату (B9) і 850 мг (1,75 ммоль) 4-нітрофеніл-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)карбамату одержують 320 мг (31%) сполуки молекули A19 у вигляді світло-коричневої твердої речовини, т. пл. 180-183ºС; 1 H ЯМР (CDCl3) 8,53 (с, 1H), 8,12 (д, J=8,7 Гц, 2H), 7,80-7,74 (м, 2H), 7,60 (д, J=8,8 Гц, 2H), 7,54-7,45 (м, 2H), 7,40-7,34 (м, 3H), 7,32 (с, 1H), 7,10 (д, J=7,5 Гц, 1H), 3,98 (д, J=2,5 Гц, 2H), 2,73 + (гептет, J=6,9 Гц, 1H), 1,22 (дд, J=6,8, 5,0 Гц, 6H); МС (ESI) m/z 581 ([М+Н] ). Приклад 20. Одержання (Е)-3-гідрокси-2-((2-ізопропілфеніл)карбамотіоїл)-N-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)бут-2-енаміду (молекула А20) Стадія 1. Розчин 4-(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)аніліну (1,0 г, 3,12 ммоль) і трет-бутилацетоацетату (0,494 г, 3,12 ммоль) у 8 мл толуолу нагрівають до 90С і витримують при вказаній температурі протягом 2 годин, потім охолоджують. Твердий осад, що утворився, збирають фільтруванням і сушать на повітрі, з одержанням 1,12 г (89%) 3-оксо-N-(4(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)бутанаміду у вигляді жовтуватокоричневої твердої речовини (B10), т. пл. 159-164C. 1 H ЯМР (CDCl3) 9,35 (с, 1H), 8,55 (с, 1H), 8,19-8,09 (д, J=8,7 Гц, 2H), 7,83-7,74 (д, J=9,1 Гц, 13 2H), 7,74-7,63 (д, J=8,7 Гц, 2H), 7,43-7,32 (д, J=8,3 Гц, 2H), 3,62 (с, 2H), 2,34 (с, 3H); С ЯМР (101 МГц, CDCl3) 205,34, 163,43, 163,02, 148,34, 141,49, 138,84, 135,55, 127,37, 126,50, 122,37, + 121,67, 121,16, 120,03, 49,56, 31,36; МС (ESI) m/z 581 ([М+Н] ). Стадія 2. Порцію твердої речовини, отриманої на стадії 1 (0,50 г, 1,24 ммоль), розчиняють у 5 мл сухого N,N-диметилформаміду (ДМФА) і до отриманого розчину при перемішуванні при температурі навколишнього середовища додають карбонат калію (0,25 г, 1,81 ммоль) і 2ізопропілфенілізотіоціанат (0,25 г, 1,41 ммоль). Розчин перемішують протягом 18 годин, потім виливають у 15 мл води, екстрагують ефіром і розчинник випарюють. Хроматографія неочищеного продукту (елюювання з градієнтом: EtOAc-гексани 0-70%) приводить до одержання 350 мг вказаної в заголовку сполуки у вигляді не зовсім білої твердої речовини, т. пл. 141-144С. 1 H ЯМР (CDCl3) 15,35-14,58 (м, 1H), 10,93 (с, 1H), 8,57 (м, 3H), 8,31-8,11 (м, 6H), 7,71 (м, 12H), 7,56-7,30 (м, 15H), 5,35 (с, 1H), 3,02 (гептет, J=6,9 Гц, 1H), 2,52 (с, 3H), 1,35-1,11 (м, 6H); + МС (ESI) m/z 582 ([М+Н] ). Приклад 21. Одержання 3-((2-ізопропілфеніл)аміно)-3-тіоксо-N-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)пропанаміду (молекула А21) 45 21 UA 115126 C2 5 10 15 20 25 30 35 40 Розчин сполуки молекули A20 (0,410 г, 0,71 ммоль) у 5 мл МеОН нагрівають протягом 90 хвилин, потім охолоджують, концентрують і хроматографують (елюювання з градієнтом: EtOAcгексани 0-70%), з одержанням 288 мг (75%) сполуки молекули А21 у вигляді жовтої твердої речовини, т. пл. 173-178С. 1 Н ЯМР (CDCl3) 10,46 (с, 1H), 8,57 (с, 1H), 8,38 (с, 1H), 8,19 (д, J=8,7 Гц, 2H), 7,80 (д, J=9,1 Гц, 2H), 7,67 (д, J=8,8 Гц, 2H), 7,47-7,31 (м, 6H), 4,10 (с, 2H), 3,04 (гептет, J=6,7 Гц, 1H), 1,22 (д, + J=6,9 Гц, 6H). MC (ESI) m/z 540 ([М+Н] ). Умови, описані в прикладах 20 і 21, використовують для одержання сполук молекул прикладів 22 і 23. Приклад 22. Одержання 3-тіоксо-3-(о-толіламіно)-N-(4-(1-(4-(трифторметокси)феніл)-1H1,2,4-триазол-3-іл)феніл)пропанаміду (молекула А22) Використовуючи 2-метилфенілізотіоціанат замість 2-ізопропілфенілізотіоціанату на стадії 2 приклади 20, одержують 33 мг (52%) сполуки молекули A22; 1 H ЯМР (CDCl3) 10,76 (с, 1H), 8,84 (с, 1H), 8,56 (с, 1H), 8,15-8,13 (д, J=8,4 Гц, 2H), 7,81-7,74 (м, 3H), 7,66-7,33 (д, J=8,4 Гц, 2H), 7,58-7,50 (м, 1H), 7,43-7,20 (м, 4H), 4,10 (с, 2H), 2,28 (с, 3H); + МС (ESI) m/z 511 ([М+Н] ). Приклад 23. Одержання 3-((2,6-диметилфеніл)аміно)-3-тіоксо-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)пропанаміду (молекула А23) Використовуючи 2,6-диметилфенілізотіоціанат замість 2-ізопропілфенілізотіоціанату на стадії 2 приклади 20, одержують 185 мг (41%) сполуки молекули A23 у вигляді світло-жовтої твердої речовини, т. пл. 178-182C; 1 H ЯМР (CDCl3) 10,41 (с, 1H), 8,88 (с, 1H), 8,58 (с, 1H), 8,15 (д, J=8,7 Гц, 2H), 7,85-7,76 (м, 2H), 7,65 (д, J=8,7 Гц, 2H), 7,38 (д, J=8,4 Гц, 2H), 7,22-6,99 (м, 3H), 4,14 (с, 2H), 2,22 (с, 6H); МС + (ESI) m/z 526 ([M+H] ). Приклад 24. Одержання (Z)-2-(3-(2-ізопропілфеніл)-4-оксотіазолідин-2-іліден)-N-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)ацетаміду (молекула A24) Сполуку молекули A21 (0,031 г, 0,057 ммоль) розчиняють у 4 мл EtOH і обробляють 20 мг (0,13 ммоль) метилбромацетату і 20 мг (0,24 ммоль) ацетату натрію й отриманий розчин кип'ятять зі зворотним холодильником протягом 2 годин. Потім розчин охолоджують, концентрують і хроматографують (елюювання з градієнтом: EtOAc-гексани 0-70%), з одержанням 27 мг (73%) сполуки молекули А24 у вигляді оранжувато-коричневої твердої речовини, т. пл.>250C (розклад.). 1 H ЯМР (CDCl3) 8,53 (с, 1H), 8,13-8,07 (м, 2H), 7,81-7,76 (м, 2H), 7,61 (д, J=8,6 Гц, 2H), 7,53 (д, J=3,9 Гц, 2H), 7,42-7,33 (м, 2H), 7,23-7,16 (м, 1H), 7,13 (д, J=7,7 Гц, 1H), 6,97 (с, 1H), 5,01 (с, + 1H), 3,91 (с, 2H), 2,83-2,68 (м, 1H), 1,31-1,16 (м, 6H); МС (ESI) m/z 580 ([М+Н] ). Приклад 25. Одержання (Z)-2-ціано-3-((2-ізопропілфеніл)аміно)-3-меркапто-N-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)акриламіду (молекула А25) 22 UA 115126 C2 5 10 15 20 25 30 35 Стадія 1. Ціанооцтову кислоту (0,30 г, 3,53 ммоль) і 4-(1-(4-(трифторметокси)феніл)-1H1,2,4-триазол-3-іл)анілін (1,00 г, 3,12 ммоль) розчиняють у 30 мл дихлорметану і потім однією порцією додають дициклогексилкарбодіімід (0,695 г, 3,37 ммоль) у вигляді твердої речовини. Розчин перемішують протягом 2 годин, потім розчинник видаляють, залишок нагрівають у 75 мл EtOAc, охолоджують і фільтрують для видалення дициклогексилсечовини. Фільтрат концентрують, твердий продукт перекристалізовують з етанолу, з одержанням 0,82 г (66%) 2ціано-N-(4-(1-(4-(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)ацетаміду (B11) у вигляді білої твердої речовини, т. пл. 250-252C. 1 Н ЯМР (ДМСО-d6) 10,51 (с, 1H), 9,39 (с, 1H), 8,13-8,00 (м, 4H), 7,75-7,66 (м, 2H), 7,62 (д, J=8,3 Гц, 2H), 3,95 (с, 2H). МС (ESI) m/z 388 (М+Н). Стадія 2. Ціаноацетанілід, отриманий на стадії 1 (0,30 г, 0,775 ммоль), і 2ізопропілфенілізотіоціанат (0,16 г, 0,903 ммоль) розчиняють у 5 мл ДМФА, до отриманої суміші при перемішуванні в атмосфері N2 однією порцією додають NaH (60%; 62 мг, 1,55 ммоль). Розчин перемішують при кімнатній температурі протягом 1 години, потім виливають у 20 мл 1н. розчину НСl. Смолисту тверду речовину збирають і кристалізують із суміші EtOH/вода, з одержанням 0,32 г (71%) вказаної в заголовку сполуки у вигляді світло-жовтої твердої речовини, т. пл. 159-162C. 1 H ЯМР (CDCl3) 12,56 (с, 1H), 8,56 (с, 1H), 8,18 (д, J=8,7 Гц, 2H), 7,85-7,77 (м, 2H), 7,68-7,60 (м, 3H), 7,45-7,36(м, 4H), 7,32-7,27 (м, 1H), 7,20 (д, J=7,7 Гц, 1H), 4,42 (с, 1H), 3,11 (гептет, J=6,9 + Гц, 1H), 1,26 (д, J=6,9 Гц, 6H); МС (ESI) m/z 565 ([М+Н] ). Сполуки наступних молекул (приклади 26-30) одержують відповідно до методики, описаної в попередньому прикладі. Приклад 26. (Z)-2-ціано-3-меркапто-3-((4-метокси-2-метилфеніл)аміно)-N-(4-(1-(4(трифторметоксифеніл)-1H-1,2,4-триазол-3-іл)феніл)акриламід (молекула A26) Сполуку молекули A26 виділяють у вигляді світло-жовтої твердої речовини, 103 мг (58%), т. пл. 174-177C; 1 H ЯМР (CDCl3) 12,27 (с, 1H), 8,56 (с, 1H), 8,18 (д, J=8,7 Гц, 2H), 7,80 (д, J=9,1 Гц, 2H), 7,63 (д, J=8,9 Гц, 2H), 7,61 (с, 1H), 7,39 (д, J=8,3 Гц, 2H), 7,12 (д, J=8,6 Гц, 1H), 6,92 6,73 (м, 2H), 4,40 + (с, 1H), 3,83 (с, 3H), 2,28 (с, 3H); МС (ESI) m/z 567 ([M+H] ). Приклад 27. (Z)-3-([1,1'-Біфеніл]-2-іламіно)-2-ціано-3-меркапто-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)акриламід (молекула А27) Сполуку молекули A27 виділяють у вигляді світло-жовтої твердої речовини, 60 мг (32%), т. пл. 162-166C; 1 H ЯМР (CDCl3) 12,52 (с, 1H), 8,55 (с, 1H), 8,15 (д, J=8,6 Гц, 2H), 7,80 (м, 3H), 7,57-7,28 (м, + 13H), 4,29 (с, 1H); МС (ESI) m/z 599 ([М+Н] ). Приклад 28. (Z)-2-ціано-3-меркапто-3-((2,6-диметилфеніл)аміно)-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)акриламід (молекула A28) 40 23 UA 115126 C2 5 10 15 20 25 30 35 40 45 Сполуку молекули A28 виділяють у вигляді світло-жовтої твердої речовини, 103 мг (59%), т. пл. 196-199C; 1 H ЯМР (CDCl3) 12,24 (с, 1H), 8,56 (с, 1H), 8,18 (д, J=8,8 Гц, 2H), 7,80 (д, J=9,1 Гц, 2H), 7,64 (д, J=8,7 Гц, 2H), 7,42-7,33 (м, 2H), 7,23 (м, 1H), 7,17 (д, J=7,7 Гц, 2H), 4,30 (с, 1H), 2,28 (с, 6H); + МС (ESI) m/z 551 ([М+Н] ). Приклад 29. (Z)-2-ціано-3-меркапто-3-(о-толіламіно)-N-(4-(1-(4-(трифторметокси)феніл)-1Н1,2,4-триазол-3-іл)феніл)акриламід (молекула А29) Сполуку молекули A29 виділяють у вигляді світло-жовтої твердої речовини, 121 мг (71%), т. пл. 157-160C; 1 H ЯМР (CDCl3) 12,51 (с, 1H), 8,56 (с, 1H), 8,18 (д, J=8,8 Гц, 2H), 7,84-7,73 (м, 2H), 7,67-7,60 (м, 3H), 7,39 (д, J=8,3 Гц, 2H), 7,32 (м, 3H), 7,23 (м, 1H), 4,42 (с, 1H), 2,33 (с, 3H); МС (ESI) m/z + 537 ([М+Н] ). Приклад 30. (Z)-2-ціано-3-((2,6-дифторфеніл)аміно)-3-меркапто-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)акриламід (молекула A30) Сполуку молекули A30 виділяють у вигляді світло-жовтої твердої речовини, 53 мг (28), т. пл. 135-142C; 1 H ЯМР (CDCl3) 12,31 (с, 1H), 8,64-8,50 (м, 1H), 8,19 (дд, J=13,9, 7,1 Гц, 2H), 7,80 (м, 2H), + 7,65 (м, 2H), 7,39 (м, 3H), 7,14-6,86 (м, 3H), 4,97-4,11 (м, 1H); МС (ESI) m/z 559 ([М+Н] ). Приклад 31. (Z)-2-ціано-2-(3-(2-ізопропілфеніл)-4-оксотіазолідин-2-іліден)-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)ацетамід (молекула A31) Сполуку молекули A25 (0,058 г, 0,103 ммоль) розчиняють у 3 мл EtOH, розчин обробляють 35 мг (0,23 ммоль) метилбромацетату і 30 мг (0,37 ммоль) ацетату натрію й отриманий розчин кип'ятять зі зворотним холодильником протягом 1 години. Потім розчин охолоджують, твердий продукт збирають фільтруванням і сушать на повітрі, з одержанням 46 мг (71%) тіазолінону у вигляді світло-коричневої твердої речовини, т. пл. 250-255C; 1 H ЯМР (CDCl3) 8,55 (с, 1H), 8,16 (д, J=8,8 Гц, 2H), 7,95 (с, 1H), 7,79 (д, J=9,1 Гц, 2H), 7,62 (д, J=8,8 Гц, 3H), 7,53 (дд, J=7,8, 1,2 Гц, 1H), 7,42-7,34 (м, 3H), 7,18 (дд, J=7,9, 1,2 Гц, 1H), 3,92 (д, J=1,3 Гц, 2H), 2,71 (гептет, J=6,8 Гц, 1H), 1,33 (д, J=6,9 Гц, 3H), 1,23 (д, J=6,8 Гц, 3H); МС + (ESI) m/z 605 ([М+Н] ). Приклад 32. Одержання (Z)-3-(2,6-диметилфеніламіно)-3-гідрокси-1-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)феніл)акриламіду (молекула А32) Стадія 1. До розчину 4-(1-(4-(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)аніліну (0,19 г; 0,593 ммоль) і монобензилмалонової кислоти (0,138 г; 0,712 ммоль) у ДМФА (6 мл) при перемішуванні додають 1-гідроксі-7-азабензотриазол (HOAt, 0,5 М в ДМФА; 2,14 мл; 1,068 ммоль) з наступним додаванням гідрохлориду 1-(3-диметиламінопропіл)-3-етилкарбодііміду (EDCI; 0,21 г; 1,068 ммоль) і N-метилморфоліну (0,46 мл, 4,15 ммоль). Суміш перемішують протягом ночі. Потім додають воду (25 мл) і розчин екстрагують EtOAc (310 мл). Органічний розчин промивають водою (510 мл) і насиченим розчином солі (10 мл), потім сушать над MgSО4, фільтрують і концентрують. Залишок очищають хроматографією (колонка Isolute SCX-2, 1 г, елюювання: CHCl3/MeOH 9:1), з одержанням аміду (B12), забрудненого приблизно 10% диметиламіду вихідної оксопропанової кислоти (0,26 г, 88%). 24 UA 115126 C2 H ЯМР (CDCl3) 9,35 (с, 1H), 8,55 (с, 1H), 8,15 (д, J=8,7 Гц, 2H), 7,78 (д, J=9,0 Гц, 2H), 7,67 13 (д, J=8,7 Гц, 2H), 7,35 (м, 7H), 5,23 (с, 2H), 3,54 (с, 2H). С ЯМР (101 МГц, CDCl3) 169,59, 167,45, 162,84, 141,53, 138,91, 135,58, 134,81, 128,77, 128,60, 128,52, 128,41, 128,36, 127,37, + 122,39, 121,17, 119,97, 67,65, 41,76, 35,58. МС (ESI) m/z 496 ([М+Н] ). Стадія 2. Бензиловий ефір, отриманий на стадії 1 (0,26 г, 0,524 ммоль), розчиняють у 4 мл МеОН і елююють через гідрогенізатор (Н-cube) при 50ºС (1 мл/хв.) з використанням картриджа 10% Pd/C як каталізатора. MeOH упарюють і неочищену кислоту сушать у високому вакуумі протягом ночі. Кислоту (B13) (0,162 г; 76%) використовують безпосередньо на наступній стадії без додаткового очищення. 1 Н ЯМР (ДМСО-d6) 10,35 (с, 1H), 9,38 (с, 1H), 8,06 (дд, J=8,9, 3,3 Гц, 4H), 7,74 (д, J=8,8 Гц, + 2H), 7,62 (д, J=8,4 Гц, 2H), 7,37 (с, 1H), 3,39 (с, 2H). МС (ESI) m/z 406 ([M+H] ). Стадія 3. До розчину карбонової кислоти, отриманої на стадії 2 (62 мг, 0,153 ммоль), і 2,6диметиланіліну (20 мкл; 0,153 ммоль) у ДМФА (1,6 мл) додають HOAt (0,5М в ДМФА; 0,55 мл; 0,275 ммоль), EDCI HCl (53 мг; 0,275 ммоль) і N-метилморфолін (0,18 мл; 1,068 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі. Розчин розбавляють водою й екстрагують етилацетатом. Органічний розчин промивають водою (5) і насиченим розчином солі. Потім розчин сушать над MgSО4, фільтрують і концентрують. Залишок очищають радіальною хроматографією (елюювання: CHCl3/МеОН 97,5:2,5 (Rf=0,2). Фракція, що містить продукт, забруднена диметиламідом вихідної карбонової кислоти. Цю суміш очищають хроматографією зі зворотною фазою (елюювання з градієнтом: CH 3CN/H2O), з одержанням чистого вказаного в заголовку діаміду (9 мг, 12%). 1 H ЯМР (CDCl3; суміш резонансних форм, записані основні) 10,53 (с, 1H), 9,71 (с, 1H), 8,55 (с, 1H), 8,13 (м, 3H), 7,79 (д, J=9,1 Гц, 2H), 7,71 (д, J=8,7 Гц, 1H), 7,65 (д, J=8,7 Гц, 1H), 7,37 (д, + J=8,3 Гц, 2H), 7,12 (м, 1H), 3,49 (с, 2H), 3,12 (с, 3H), 3,04 (с, 3H). МС (ESI) m/z 509 ([M+H] ). Приклад 33. Одержання (Z)-3-гідрокси-3-(4-метокси-2-метилфеніламіно)-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)акриламіду (молекула А33) 1 5 10 15 20 25 30 35 40 45 Використовуючи стадію 3 приведеної вище методики і замінюючи 2,6-диметиланілін 2метил-4-метоксіаніліном, одержують 83 мг (56%) вказаного діаміду у вигляді оранжуватокоричневої твердої речовини, т. пл. 168-171С. 1 Н ЯМР (ДМСО-d6) 10,39 (с, 1H), 9,48 (с, 1H), 9,38 (с, 1H), 8,07 (д, J=8,9 Гц, 4H), 7,77 (д, J=8,8 Гц, 2H), 7,62 (д, J=8,3 Гц, 2H), 7,28 (д, J=8,7 Гц, 1H), 6,81 (д, J=2,8 Гц, 1H), 6,74 (дд, J=8,7, + 2,9 Гц, 1H), 3,73 (с, 3H), 3,51 (с, 2H), 2,21 (с, 3H). МС (ESI) m/z 525 (M ). Приклад 34. Одержання (Z)-3-гідрокси-3-(2-ізопропіл-4-метоксифеніламіно)-N-(4-(1-(4(трифторметокси)феніл)-1H-1,2,4-триазол-3-іл)феніл)акриламіду (молекула A34) Використовуючи стадію 3 приведеної вище методики і замінюючи 2,6-диметиланілін 2ізопропіл-4-метоксіаніліном, одержують 38 мг (36%) вказаного в заголовку діаміду. 1 H ЯМР (CDCl3) 9,81 (с, 1H), 8,92 (с, 1H), 8,58 (с, 1H), 8,12 (д, J=8,6 Гц, 2H), 7,79 (д, J=9,0 Гц, 2H), 7,69 (д, J=8,7 Гц, 2H), 7,50-7,10 (м, 3H), 6,84 (д, J=2,8 Гц, 1H), 6,72 (дд, J=8,7,2,9 Гц, 1H), 13 4,02 (с, 3H), 3,80 (с, 2H), 3,08 (дт, J=13,6, 6,8 Гц, 1H), 1,20 (д, J=6,9 Гц, 6H). С ЯМР (101 МГц, CDCl3) 166,81, 166,13, 162,98, 158,40, 144,30, 141,54, 139,02, 135,54, 127,30, 127,05, 126,87, 126,52, 126,30, 122,36, 121,13, 120,10, 111,97, 110,85, 56,04, 55,36, 44,26, 28,37, 23,06. МС (ESI) + m/z 553 ([M+H] ). Приклад 35. Одержання 4-фтор-2-нітро-1-(проп-1-ен-2-іл)бензолу (B14) 25 UA 115126 C2 5 10 15 20 25 30 35 40 45 До 1-хлору-4-фтору-2-нітробензолу (1,03 г, 5,87 ммоль) у круглодонній колбі об’ємом 100 мл, оснащеній магнітною мішалкою і заповненій азотом, додають карбонат натрію (0,746 г, 7,04 ммоль), діоксан (23,47 мл) і воду (5,87 мл). До суміші додають 4,4,5,5-тетраметил-2-(проп-1-ен2-іл)-1,3,2-діоксаборолан (1,323 мл, 7,04 ммоль) і потім біс(трифенілфосфін)паладій(II)хлорид (0,329 г, 0,469 ммоль). Реакційну суміш вакуумують і знову колбу заповнюють азотом (3×). Реакційну суміш нагрівають до 80ºС і витримують при вказаній температурі протягом ночі. Реакцію контролюють ТШХ (10% EtOАс/гексан). Реакційну суміш охолоджують, фільтрують через целіт, промивають EtOAc і концентрують. Залишок переносять у дихлорметан, пропускають через роздільник фаз і концентрують. Очищення колонковою флешхроматографією приводить до одержання вказаного в заголовку 4-фтор-2-нітро-1-(проп-1-ен-2іл)бензолу (0,837 г, 75%) у вигляді жовтої олії: ІЧ (тонка плівка) 3091 (шир.), 2979 (шир.), 2918 -1 (шир.), 1642 (шир.), 1530 (с), 1350 (с) см ; 1 H ЯМР (400 МГц, CDCl3) 7,60 (дд, J=8,2, 2,5 Гц, 1H), 7,37-7,21 (м, 2H), 5,19 (п, J=1,5 Гц, 13 1H), 4,97-4,89 (м, 1H), 2,11-2,04 (м, 3H); С ЯМР (101 МГц, CDCl3) 160,96 (д, JCF=250,8 Гц), 148,46, 141,88 , 135,18 (д, JCF=4,1 Гц), 132,09 (д, JCF=7,8 Гц), 119,98 (д, JCF=20,9 Гц), 115,99 , 111,63 (д, JCF=26,4 Гц), 23,35. Сполуки наступних молекул (B15 і В16) одержують відповідно до методик, описаних у прикладі 35. Фтор-3-нітро-2-(проп-1-ен-2-іл)бензол (В15) -1 ІЧ (тонка плівка) 3091 (шир.), 2978 (шир.), 2922 (шир.), 1645 (шир.), 1528 (с), 1355 (с) см ; 1 H ЯМР (400 МГц, CDCl3) 7,64 (дт, J=8,1, 1,2 Гц, 1H), 7,39 (тд, J=8,2, 5,4 Гц, 1H), 7,31 (тд, 13 J=8,5, 1,2 Гц, 1H), 5,28 (п, J=1,5 Гц, 1H), 4,91 (п, J=1,0 Гц, 1H), 2,16 (т, J=1,3 Гц, 3H); C ЯМР (101 МГц, CDCl3) 159,59 (д, JCF=249,3 Гц), 149,81, 136,14, 128,57 (д, J CF=9,0 Гц), 127,02 (д, JCF=22,0 Гц), 119,84 (д, JCF=23,4 Гц), 119,41 (д, JCF=3,6 Гц), 117,25, 23,10 (д, JCF=1,9 Гц). 4-фтор-1-нітро-2-(проп-1-ен-2-іл)бензол (В16) ІЧ (тонка плівка) 3085 (шир.), 2979 (шир.), 2919 (шир.), 1617 (м), 1580 (с), 1523 (с), 1344 (с) -1 см ; 1 H ЯМР (400 МГц, CDCl3) 7,96 (дд, J=9,0, 5,1 Гц, 1H), 7,08 (ддд, J=9,0, 7,4, 2,8 Гц, 1H), 7,02 (дд, J=8,7, 2,8 Гц, 1H), 5,20 (п, J=1,5 Гц, 1H), 4,96 (п, J=1,0 Гц, 1H), 2,11-2,06 (м, 3H). Приклад 36. Одержання 5-фторізопропіланіліну (B17) До 4-фтор-2-нітро-1-(проп-1-ен-2-іл)бензолу (0,837 г, 4,62 ммоль) у круглодонній колбі об’ємом 250 мл, оснащеній магнітною мішалкою і каучуковою мембраною, додають EtOAc (46,2 мл) і потім паладій на вугіллі (0,983 г, 0,462 ммоль). Колбу вакуумують і продувають воднем (балон) (2×), потім реакційну суміш перемішують в атмосфері водню при кімнатній температурі протягом ночі. Реакцію контролюють ТШХ (10% EtOAc/гексан). Суміш фільтрують через целіт, промивають етилацетатом і концентрують. 5-Фтор-2-ізопропіланілін (673 мг, 4,40 ммоль, 95%) одержують у вигляді прозорої жовтої олії: ІЧ (тонка плівка) 3480 (шир.), 3390 (шир.), 2962 (м), -1 2872 (шир.), 1622 (м), 1504 (с), 1431 (м) см ; 1 H ЯМР (400 МГц, CDCl3) 7,05 (дд, J=8,5, 6,4 Гц, 1H), 6,45 (тд, J=8,5, 2,6 Гц, 1H), 6,37 (дд, 13 J=10,6, 2,6 Гц, 1H), 3,74 (шир.с, 2H), 2,83 (гепт, J=6,8 Гц, 1H), 1,24 (д, J=6,8 Гц, 6H); С ЯМР (101 МГц, CDCl3) 161,75 (д, JCF=241,3 Гц), 144,76 (д, JCF=10,3 Гц), 128,11 (д, JCF=2,8 Гц), 126,53 (д, JCF=9,6 Гц), 105,06 (д, JCF=20,7 Гц), 102,26 (д, JCF=24,2 Гц), 27,27, 22,35. Сполуки представлених нижче молекул одержують відповідно до методик, описаних у прикладі 36. 26 UA 115126 C2 3-фтор-2-ізопропіланілін (B18) 5 10 15 20 25 30 35 ІЧ-спектр (тонка плівка) 3478 (шир.), 3386 (шир.), 2963 (м), 2934 (шир.), 2934 (шир.), 1624 (с), -1 1466 (с), 1453 (с) см ; 1 H ЯМР (400 МГц, CDCl3) 6,92 (тд, J=8,1, 6,1 Гц, 1H), 6,44 (ддд, J=10,4, 8,1, 1,1 Гц, 2H), 3,72 13 (шир. с, 2H), 3,06 (гептд, J=7,1, 1,3 Гц, 1H), 1,35 (дд, J=7,1, 1,5 Гц, 6H); C-ЯМР (101 МГц, CDCl3) 162,83 (д, JCF=243,4 Гц), 145,29 (д, JCF=8,8 Гц), 127,08 (д, JCF=11,2 Гц), 119,64 (д, JCF=16,1 Гц), 111,77 (д, JCF=2,3 Гц), 106,47 (д, JCF=24,2 Гц), 25,65, 20,97 (д, Jc=3,8 Гц). 4-Фтор-2-ізопропіланілін (B19) ІЧ (тонка плівка) 3455 (шир.), 3373 (шир.), 2962 (м), 2870 (шир.), 1625 (шир.), 1609 (шир.), -1 1497 (с), 1429 (м) см ; 1 H ЯМР (400 МГц, CDCl3) 6,85 (дд, J=10,3, 2,9 Гц, 1H), 6,72 (тд, J=8,3, 2,9 Гц, 1H), 6,60 (дд, 13 J= 8,6, 5,1 Гц, 1H), 3,49 (шир.с, 2H), 2,88 (гепт, J=6,8 1H), 1,24 (д, J=6,8 Гц, 6H); C-ЯМР (101 МГц, CDCl3) 156,92 (д, JCF=235,0 Гц), 139,17 (д, JCF=2,1 Гц), 15 134,61 (д, JCF=6,2 Гц), 116,55 (д, JCF=7,5 Гц), 112,69 (д, JCF=22,5 Гц), 112,17 (д, JCF=22,4 Гц), 27,90, 22,11. Приклад 37. Одержання N-((2-циклопропілфеніл)карбамотіоїл)бензаміду (B20) До 2-циклопропіланіліну (498 мг, 3,74 ммоль) в ацетоні (10 мл) додають бензоїлізотіоціанат (0,53 мл, 3,93 ммоль), отриману суміш нагрівають до 50С і витримують при вказаній температурі протягом 8 годин. Реакційну суміш концентрують, з одержанням N-((2циклопропілфеніл)карбамотіоїл)бензаміду у вигляді жовтогарячої олії (1,249 г, 100%): 1 H ЯМР (400 МГц, CDCl3) 12,59 (с, 1H), 9,14 (с, 1H), 8,07 (дд, J=7,8, 1,3 Гц, 1H), 7,92 (дд, J=8,4, 1,2 Гц, 2H), 7,69-7,63 (м, 1H), 7,59-7,52 (м, 2H), 7,31-7,26 (м, 1H), 7,23 (тд, J=7,5, 1,5 Гц, 1H), 7,13 (дд, J=7,6, 1,5 Гц, 1H), 1,95 (квт, J=12,3, 4,4 Гц, 1H), 1,09-1,01 (м, 2H), 0,76-0,69 (м, 2H); 13 C-ЯМР (101 МГц, CDCl3) 178,70, 166,72, 137,59, 137,06, 133,71, 131,72, 129,22, 127,51, 127,20, 126,93, 126,12, 125,26, 11,72, 7,03; МС (ESI) m/z 295 ([МН] ). Сполуки представлених нижче молекул одержують відповідно до методик, описаних у прикладі 37. N-((2-хлор-6-ізопропілфеніл)карбамотіоїл)бензамід (B21) Т. пл. 177-181ºС; 1 H ЯМР (400 МГц, CDCl3) 11,92 (с, 1H), 9,25 (с, 1H), 7,98-7,89 (м, 2H), 7,72-7,62 (м, 1H), 7,62-7,51 (м, 2H), 7,40-7,28 (м, 3H), 3,17 (гепт, J=6,9 Гц, 1H), 1,33 (д, J=6,8 Гц, 3H), 1,21 (д, J=6,9 + Гц, 3H); МС (ESI) m/z 333 ([М+Н] ). N-((5-фтор-2-ізопропілфеніл)карбамотіоїл)бензамід (B22) Т. пл. 134C (розклад.); 27 UA 115126 C2 H ЯМР (400 МГц, CDCl3) 12,31 (с, 1H), 9,17 (с, 1H), 7,96-7,87 (м, 2H), 7,73-7,62 (м, 1H), 7,61-7,49 (м, 3H), 7,33 (дд, J=8,8, 6,1 Гц, 1H), 7,03 (тд, J=8,3, 2,8 Гц, 1H), 3,13 (гепт, J=6,9 Гц, 1H), 1,27 (д, J=7,0 Гц, 6H); МС (ESI) m/z 315 ([МН] ). N-((2-ізопропіл-5-метилфеніл)карбамотіоїл)бензамід (B23) 1 5 10 15 H ЯМР (400 МГц, CDCl3) 12,14 (с, 1H), 9,18 (с, 1H), 7,97-7,87 (м, 2H), 7,73-7,61 (м, 1H), 7,61-7,50 (м, 2H), 7,42-7,34 (м, 1H), 7,31-7,23 (м, 1H), 7,16 (дд, J=7,9, 1,8 Гц, 1H), 3,11 (гепт, J=6,9 13 Гц, 1H), 2,36 (с, 3H), 1,26 (д, J=6,9 Гц, 6H); С ЯМР (101 МГц, CDCl3) 180,23, 166,97, 140,94, 136,03, 134,89, 133,75, 131,67, 129,22, 129,20, 127,71, 127,55, 126,01, 28,17, 23,38, 20,90; МС (ESI) m/z 311 ([М-Н] ). N-((2-ізопропіл-4-метилфеніл)карбамотіоїл)бензамід (B24) 1 Т. пл. 136C (розклад.); 1 H ЯМР (400 МГц, CDCl3) 12,11 (с, 1H), 9,17 (с, 1H), 7,97-7,86 (м, 2H), 7,72-7,61 (м, 1H), 7,60-7,49 (м, 2H), 7,44 (д, J=8,0 Гц, 1H), 7,18 (д, J=1,9 Гц, 1H), 7,09 (дд, J=8,1, 2,0 Гц, 1H), 3,11 (гепт, J=6,8 Гц, 1H), 2,38 (с, 3H), 1,27 (д, J=6,9 Гц, 6H); МС (ESI) m/z 311 ([М-Н] ). N-((2-ізопропіл-3-метилфеніл)карбамотіоїл)бензамід (B25) H ЯМР (400 МГц, CDCl3) 12,12 (с, 1H), 9,18 (с, 1H), 7,99-7,86 (м, 2H), 7,71-7,60 (м, 1H), 7,60-7,50 (м, 2H), 7,32 (дд, J=6,6, 2,8 Гц, 1H), 7,21-7,09 (м, 2H), 3,46-3,31 (м, 1H), 2,42 (с, 3H), 13 1,37 (д, J=7,2 Гц, 6H); С ЯМР (101 МГц, CDCl3) 180,41, 166,88, 141,79, 137,22, 136,15, 133,76, 131,65, 130,94, 130,53, 129,23, 127,57, 126,02, 28,69, 21,17, 21,05; МС (ESI) m/z 311 ([М-Н] ). N-((3-фтор-2-ізопропілфеніл)карбамотіоїл)бензамід (B26) 1 20 25 30 35 H ЯМР (400 МГц, CDCl3) 12,11 (с, 1H), 9,20 (с, 1H), 8,00-7,85 (м, 2H), 7,73-7,62 (м, 1H), 7,62-7,50 (м, 2H), 7,32-7,18 (м, 2H), 7,11-6,98 (м, 1H), 3,27-3,14 (м, 1H), 1,38 (дд, J=7,1, 1,4 Гц, 13 6H); C ЯМР (101 МГц, CDCl3) 180,87, 167,04, 162,36 (д, JCF=247,2 Гц), 136,61 (д, JCF=8,8 Гц), 133,88, 132,02 (д, JCF=15,2 Гц), 131,50 , 129,27 , 127,57, 127,06 (д, J CF=10,2 Гц), 123,77 (д, JCF=3,0 Гц), 116,04 (д, JCF=23,5 Гц), 27,36, 21,35, 21,31; МС (ESI) m/z 315 ([М-Н] ). N-((4-фтор-2-ізопропілфеніл)карбамотіоїл)бензамід (B27) 1 Т. пл. 96-102ºС; 1 H ЯМР (400 МГц, CDCl3) 12,11 (с, 1H), 9,18 (с, 1H), 7,97-7,87 (м, 2H), 7,73-7,63 (м, 1H), 7,60-7,48 (м, 3H), 7,07 (дд, J=10,0, 2,9 Гц, 1H), 6,97 (ддд, J=8,7, 7,7, 2,9 Гц, 1H), 3,20-3,06 (м, 1H), 1,27 (д, J=6,8 Гц, 6H); МС (ESI) m/z 315 ([М-Н] ). N-((1-ізопропіл-1H-піразол-5-іл)карбамотіоїл)бензамід (B28) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPesticidal compositions and processes related thereto
Автори англійськоюCrouse, Gary D., Demeter, David A., Sparks, Thomas C., Wang, Nick X., Dent, William Hunter, Deamicis, Carl, Niyaz, Noormohamed M., Baum, Erich W., Fischer, Lindsey Gayle, Giampietro, Natalie Christine
Автори російськоюКрауз Гари Д., Деметер Дэвид А., Спаркс Томас К., Ван Ник Х., Дэнт Уилльям Хантер, Деамикис Карл, Нияз Ноормохамед М., Баум Эрих В., Фишер Линдси Гэйл, Джампьетро Натали Кристин
МПК / Мітки
МПК: A01N 47/36, C07D 249/10, A01N 43/78, A01N 43/653
Мітки: стосуються, способи, композиції, пестицидні
Код посилання
<a href="https://ua.patents.su/129-115126-pesticidni-kompozici-i-sposobi-yaki-kh-stosuyutsya.html" target="_blank" rel="follow" title="База патентів України">Пестицидні композиції і способи, які їх стосуються</a>
Попередній патент: Синергічна гербіцидна комбінація, що містить темботріон
Наступний патент: Спосіб лікування інфекції pseudomonas aeruginosa у хворого з кістозним фіброзом складом ліпосомального амікацину
Випадковий патент: Тест-система для діагностики грипу а в реакції затримки гемаглютинації (рзга)












