Пестицидні композиції і способи, що їх стосуються
Номер патенту: 114611
Опубліковано: 10.07.2017
Автори: Хантер Рікі, Траллінгер Тоні К., Лоу Крістіан Т., Кубота Асако, Ніяз Ноормохамед М., Джонсон Тімоті К., Ньюеппел Деніел, Гаріці Негар, Байсс Енн М., Лепла Поль Рене, Деметер Девід А., Перніх Ден, Чжан Юй
Формула / Реферат
1. Композиція для контролю сільськогосподарських шкідників, що містить сполуку в кількості, достатній для контролю таких шкідників, де вказана сполука представлена однією з наступних структур:
596
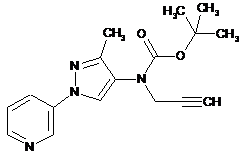
597
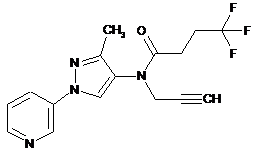
598
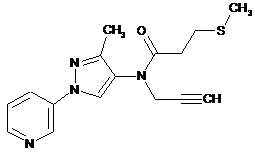
599
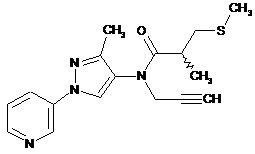
600

601
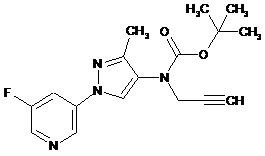
602

603

604
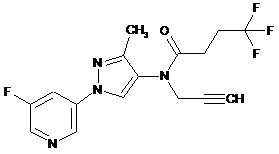
605

606
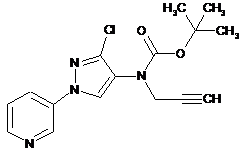
609
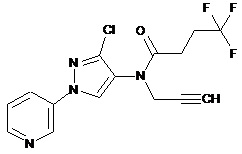
610

611
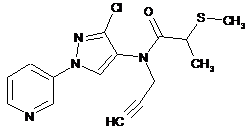
612
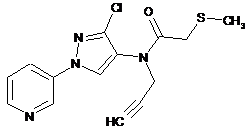
613
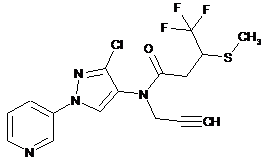
614
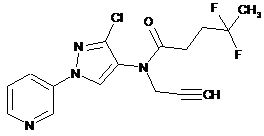
615
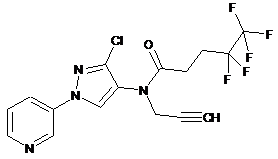
616
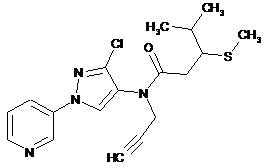
617
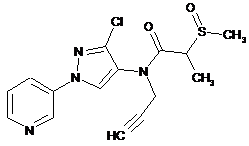
618
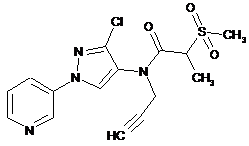
619
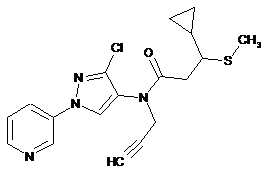
620
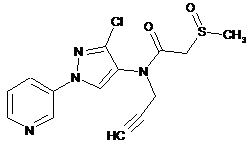
621
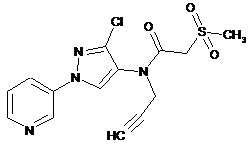
622
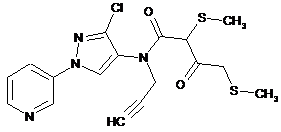
623
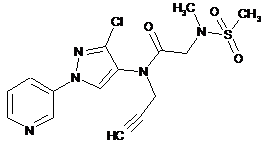
626
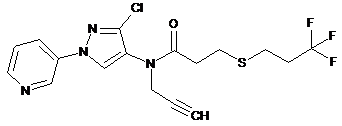
627
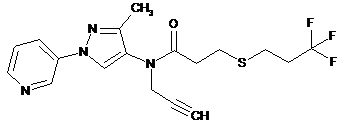
2. Композиція для контролю сільськогосподарських шкідників, що містить сполуку в кількості, достатній для контролю таких шкідників, де вказана сполука має наступну структуру:
611

3. Композиція для контролю сільськогосподарських шкідників, що містить сполуку в кількості, достатній для контролю таких шкідників, де вказана сполука має наступну структуру:
612

4. Композиція для контролю сільськогосподарських шкідників, що містить сполуку в кількості, достатній для контролю таких шкідників, де вказана сполука має наступну структуру:
617

5. Композиція для контролю сільськогосподарських шкідників, що містить сполуку в кількості, достатній для контролю таких шкідників, де вказана сполука має наступну структуру:
618

6. Спосіб контролю сільськогосподарського шкідника, який включає нанесення композиції за будь-яким з пп. 1, 2, 3, 4 або 5 на ділянку для контролю такого шкідника в кількості, достатній для такого шкідника.
Текст
Реферат: У даному документі розкриваються сполуки, представлені нижче формулою 1, і пов'язані з ними способи. R7 A N R6 R8 (1) UA 114611 C2 (12) UA 114611 C2 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка на патент запитує пріоритет попередньої заявки на патент США 61/551585, поданої 26 жовтня 2011 року. Повний зміст зазначеної попередньої заявки введено в даний опис у вигляді посилання. Галузь техніки, до якої належить винахід Даний винахід належить до галузі техніки, пов'язаної зі способами одержання сполук, які можуть застосовуватися як пестициди (наприклад, акарициди, інсектициди, молюскоциди і нематоциди), такими сполуками і способами застосування зазначених сполук для контролю сільськогосподарських шкідників. Передумови створення винаходу Щорічно сільськогосподарські шкідники викликають мільйони людських смертей в усьому світі. Крім того, існує більш десяти тисяч різновидів сільськогосподарських шкідників, що завдають значної шкоди сільському господарству. В усьому світі сільське господарство щорічно втрачає мільярди доларів США. Терміти викликають ушкодження усіх видів приватних і державних споруд. Збиток від ушкоджень, завданих термітами, щорічно становить мільярди доларів США. Шкідники в харчових продуктах, що зберігаються, поїдають і заражають ці продукти. Щорічно в усьому світі збиток від втрат харчових продуктів при їхньому збереженні становить мільярди доларів США, але що ще більш важливо - позбавляє населення необхідної їжі. Існує реальна потреба в нових пестицидах. Деякі сільськогосподарські шкідники виробляють резистентність до пестицидів, які застосовуються в даний час. Сотні видів шкідників є резистентними до одного або декількох пестицидів. Розвиток резистентності до деяких традиційно застосовуваних пестицидів, таких, як ДДТ, карбамати і фосфорорганічні сполуки, добре відомий, але резистентність виробляється навіть до деяких більш нових пестицидів. Таким чином, з багатьох причин, включаючи згадані вище, існує потреба в нових пестицидах. Визначення Приклади, дані в розділі "Визначення", у цілому не є вичерпними і не повинні розглядатися як обмеження винаходу, розкритого в даному документі. Варто уявляти, що замісник повинний відповідати правилам утворення хімічних зв'язків і обмежень стеричної сумісності відносно конкретної молекули, до якої він приєднаний. Термін "алкеніл" означає ациклічний ненасичений (що містить щонайменше один подвійний вуглець-вуглецевий зв'язок) розгалужений або нерозгалужений замісник, який складається з атомів вуглецю і водню, наприклад, вініл, аліл, бутеніл, пентеніл і гексеніл. Термін "алкенілокси" означає алкеніл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, алілокси, бутенілокси, пентенілокси, гексенілокси. Термін "алкокси" означає алкіл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси і трет-бутокси. Термін "алкіл" означає ациклічний насичений розгалужений або нерозгалужений замісник, що складається з атомів вуглецю і водню, наприклад, метил, етил, (С3)алкіл, який являє собою н-пропіл і ізопропіл, (С4)алкіл, що являє собою н-бутил, втор-бутил, ізобутил і трет-бутил. Термін "алкініл" означає ациклічний ненасичений (що містить щонайменше один потрійний вуглець-вуглецевий зв'язок) розгалужений або нерозгалужений замісник, який складається з атомів вуглецю і водню, наприклад, етиніл, пропаргіл, бутиніл і пентиніл. Термін "алкінілокси" означає алкініл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, пентинілокси, гексинілокси, гептинілокси й октинілокси. Термін "арил" означає циклічний ароматичний замісник, що складається з атомів водню і вуглецю, наприклад, феніл, нафтил і біфеніліл. Термін «(Сх-Cy)», де індекси "x" і "y" являють собою цілі числа, такі, як 1, 2 або 3, і означають інтервал кількості атомів вуглецю для замісника - наприклад, (C1-C4)алкіл означає метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил і трет-бутил, кожний окремо. Термін "циклоалкеніл" означає моноциклічний або поліциклічний, ненасичений (що містить щонайменше один подвійний вуглець-вуглецевий зв'язок) замісник, який складається з атомів вуглецю і водню, наприклад, циклобутеніл, циклопентеніл, циклогексеніл, норборненіл, біцикло[2.2.2]октеніл, тетрагідронафтил, гексагідронафтил і октагідронафтил. Термін "циклоалкенілокси" означає циклоалкеніл, що додатково включає вуглець-кисневий одинарний зв'язок, наприклад, циклобутенілокси, циклопентенілокси, норборненілокси і біцикло[2.2.2]октенілокси. Термін "циклоалкіл" означає моноциклічний або поліциклічний насичений замісник, що складається з атомів вуглецю і водню, наприклад, циклопропіл, циклобутил, циклопентил, норборніл, біцикло[2.2.2]октил і декагідронафтил. 1 UA 114611 C2 5 10 15 20 25 Термін "циклоалкокси" означає циклоалкіл, що додатково включає вуглець-кисневий одинарний зв'язок, наприклад, циклопропілокси, циклобутилокси, циклопентилокси, норборнілокси і біцикло[2.2.2]октилокси. Термін "галоген" означає фтор, хлор, бром і йод. Термін "галогеналкокси" означає алкокси, що додатково включає від одного до максимально можливого числа однакових або різних атомів галогенів, наприклад, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторетокси і пентафторетокси. Термін "галогеналкіл" означає алкіл, що додатково включає від одного до максимально можливого числа однакових або різних атомів галогенів, наприклад, фторметил, трифторметил, 2,2-дифторпропіл, хлорметил, трихлорметил, 1,1,2,2-тетрафторетил. Термін "гетероцикліл" означає циклічний замісник, який може бути повністю насиченим, частково ненасиченим або повністю ненасиченим, де циклічна структура містить щонайменше один атом вуглецю і щонайменше один гетероатом, де зазначений гетероатом являє собою атом азоту, сірки або кисню. У випадку, коли гетероатом являє собою атом сірки, даний атом може бути представлений і в інших станах окислювання, таких, як сульфоксид і сульфон. Приклади ароматичних гетероциклілів включають, але без обмеження, бензофураніл, бензізотіазоліл, бензізоксазоліл, бензоксазоліл, бензотієніл, бензотіазоліл, цинолініл, фураніл, імідазоліл, індазоліл, індоліл, ізоіндоліл, ізохінолініл, ізотіазоліл, ізоксазоліл, оксадіазоліл, оксазолініл, оксазоліл, фталазиніл, піразиніл, піразолініл, піразоліл, піридазиніл, піридил, піримідиніл, піроліл, хіназолініл, хінолініл, хіноксалініл, тетразоліл, тіазолініл, тіазоліл, тієніл, триазиніл і триазоліл. Приклади повністю насичених гетероциклілів включають, але не без обмеження, піперазиніл, піперидиніл, морфолініл, піролідиніл, оксетаніл, тетрагідрофураніл, тетрагідротієніл і тетрагідропіраніл. Приклади частково ненасичених гетероциклілів включають, але без обмеження, 1,2,3,4-тетрагідрохінолініл, 4,5-дигідрооксазоліл, 4,5-дигідро-1H-піразоліл, 4,5-дигідроізоксазоліл і 2,3-дигідро-[1,3,4]-оксадіазоліл. Додаткові приклади включають наступні тієтаніл 30 тієтаніл-діоксид Докладний опис Даний винахід розкриває сполуки представленої нижче формули ("Формула один"): , де (а) А являє собою або 2 UA 114611 C2 5 10 15 20 25 30 35 40 (b) R1 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=Х1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nR9, S(O)nOR9, S(O)nN(R9)2 або R9S(O)nR9, де кожний зазначений R1, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); (с) R2 являє собою H, F, Cl, Br, I, CN, NO 2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=Х1)R9, C(=Х1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 або R9S(O)nR9, де кожний зазначений R2, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); (d) R3 являє собою H, F, Cl, Br, I, CN, NO 2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=Х1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 або R9S(O)nR9, де кожний зазначений R3, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); (е) коли А являє собою (1) А1, тоді А1 являє собою або (а) А11 , де R4 являє собою Н, NO2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або 3 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, C(=X1)R9, C(=Х1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nOR9 або R9S(O)nR9, де кожний зазначений R4, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9), або (b) A12 , де R4 являє собою C1-C6 алкіл, (2) A2, тоді R4 являє собою Н, F, Cl, Br, I, CN, NO 2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 або R9S(O)nR9, де кожний зазначений R4, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); (f) R5 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, OR9, C(=X1)R9, C(=Х1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 або R9S(O)nR9, де кожний зазначений R5, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9 або C6-C20 арилу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); (g) (1) коли А являє собою A1, тоді R6 являє собою R11, заміщений або незаміщений C 1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=Х1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O) nOR9, R9S(O)nR9, C1-C6 алкіл C6-C20 арил (де алкіл і арил можуть бути незалежно заміщеними або незаміщеними), C(=X2)R9, C(=X1)X2R9, R9 × 2C(=X1)R9, R9 × 2R9, C(=О)(C1-C6 алкіл)S(O)n(C1-C6 алкіл), C(=О)(C1-C6 алкіл)C(=О)О(C1-C6 алкіл), (C1-C6 алкіл)OC(=O)(C6-C20 арил), (C1-C6 алкіл)ОС(=О)(C1-C6 алкіл), C1-C6 алкіл-(C3-C20 циклогалогеналкіл) або (C1-C6 алкеніл)С(=О)О(C1-C6 алкіл) або R9 × 2C(=X1)X2R9, де кожний зазначений R6 (за винятком R11), що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкіл, C2-C6 алкеніл, C1-C6 галогеналкіл, C2-C6 галогеналкеніл, C1-C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкіл, C3-C10 циклоалкеніл, C3-C10 галогенциклоалкіл, C3-C10 галогенциклоалкеніл, OR9, S(O)nOR9, C6-C20 арил або C1-C20 гетероцикліл, R9-арил (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9), 4 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 60 необов'язково R6 (за винятком R11) і R8 можуть з'єднуватися з утворенням циклічного фрагмента, де необов'язково такий циклічний фрагмент, який з'єднує R6 і R8, може містити в циклі один або декілька гетероатомів, вибраних з атомів O, S або N, і (2) коли А являє собою A2, тоді R6 являє собою R11, H, заміщений або незаміщений C 1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, С(=Х1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-C6 алкіл C6-C20 арил (де алкіл і арил незалежно можуть бути заміщеними або незаміщеними), C(=X2)R9, C(=X1)X2R9, R9 × 2C(=X1)R9, R9 × 2R9, C(=О)(C1-C6 алкіл)S(O)n(C1-C6 алкіл), C(=О)(C1-C6 алкіл)C(=О)О(C1-C6 алкіл), (C1-C6 алкіл)OC(=O)(C6-C20 арил), (C1-C6 алкіл)ОС(=О)(C1-C6 алкіл), C1-C6 алкіл-(C3-C10 циклогалогеналкіл) або (C1-C6 алкеніл)С(=О)О(C1-C6 алкіл) або R9 × 2C(=X1)X2R9, де кожний зазначений R6 (за винятком R11), що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO 2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2C6 галогеналкенілу, C1-C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O) nOR9, C6C20 арилу, C1-C20 гетероциклілу, R9-арилу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9), необов'язково R6 (за винятком R11) і R8 можуть з'єднуватися з утворенням циклічного фрагмента, де необов'язково такий циклічний фрагмент, що з'єднує R6 і R8, може містити в циклі один або декілька гетероатомів, вибраних з атомів O, S або N, і; (h) R7 являє собою O, S, NR9 або NOR9; (i) R8 являє собою заміщений або незаміщений C 1-C6 алкіл, заміщений або незаміщений C2C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C 6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, OR9S(O)nR9, C(=X1)R9, С(=Х1)OR9, R9C(=X1)0R9, R9 × 2C(=X1)R9 × 2R9, C(=X1)N(R9)2, N(R9)2, N(R9)(R9S(O)nR9), N(R9)C(=X1)R9, SR9, S(O) nOR9, R9S(O)nR9 або R9S(O)n(NZ)R9, де кожний зазначений R8, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, N(R9)S(O)nR9, оксо, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); (j) R9 (кожний незалежно) являє собою H, CN, заміщений або незаміщений C 1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, заміщений або незаміщений S(O) n1-C6 алкіл, заміщений або незаміщений N(C1-C6 алкіл)2, де кожний зазначений R9, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OC1-C6 алкілу, OC1-C6 галогеналкілу, S(O)n1C6 алкілу, S(O)nOC1-C6 алкілу, C6-C20 арилу або C1-C20 гетероциклілу; (k) n дорівнює 0, 1 або 2; (l) X являє собою N або СRn1, де Rn1 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C1-C6 алкокси, заміщений або незаміщений C 2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nR9, S(O)nOR9 або R9S(O)nR9, де кожний зазначений Rn1, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9); 5 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 (m) X1 (кожний незалежно) являє собою O або S; (n) X2 (кожний незалежно) являє собою O, S, =NR9 або =NOR9; (о) Z являє собою CN, NO2, C1-C6 алкілN(R9), C(=X1)N(R9)2; (р) R11 являє собою Q1(C≡C)R12, де Q1 являє собою зв'язок, заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C2-C6 алкеніл, заміщений або незаміщений C2-C6 алкініл, заміщений або незаміщений С3-С10 циклоалкіл, заміщений або незаміщений C2-C10 циклоалкокси, заміщений або незаміщений C1-C6 алкіл-ОR9, заміщений або незаміщений C 1-C6 алкілS(O)nR9, заміщений або незаміщений C1-C6 алкілS(О)n(=NR9), заміщений або незаміщений C1-C6 алкіл-N(R9) (де (C≡C) з'єднаний зв'язком безпосередньо з атомом N), заміщений або незаміщений C1-C6 алкіл-N(R9)2, заміщений або незаміщений C2-C6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений C0-C6 алкілC(=R7)C0-C6 алкілR9, заміщений або незаміщений C0-C6 алкілC(=R7)OR9, заміщений або незаміщений C1-C6 алкілOC0-C6 алкілC(=R7)R9, заміщений або незаміщений C1-C6 алкілN(R9)(C(=R7)R9), заміщений або незаміщений C1-C6 алкілN(R9)(C(=R7)OR9), заміщений або незаміщений C 0-C6 алкілC(=R7)C0-C6 алкілN(R9) (де (C≡C) з'єднаний зв'язком безпосередньо з атомом N), заміщений або незаміщений C0-C6 алкілC(=R7)C0-C6 алкілN(R9)2, OR9, S(O)nR9, N(R9)R9, заміщений або незаміщений C6-C20 арил, заміщений або незаміщений C 1-C20 гетероцикліл, де кожний зазначений Q1, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6 алкілу, C2-C6 алкенілу, C2-C6 алкінілу, C1-C6 галогеналкілу, C2-C6 галогеналкенілу, C1-C6 галогеналкілокси, C2-C6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, SR9, S(O)nR9, S(O)nOR9, C6-C20 арилу або C1-C20 гетероциклілу, R9арилу, C1-C6 алкілOR9, C1-C6 алкілS(O)nR9 (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9), необов'язково Q1 і R8 можуть з'єднуватися з утворенням циклічного фрагмента, де необов'язково такий циклічний фрагмент, що з'єднує Q 1 і R8, може містити в циклі один або декілька гетероатомів, вибраних з атомів O, S або N, і; (q) R12 являє собою Q1 (за винятком випадків, коли Q1 являє собою зв'язок), F, Cl, Br, I, Si(R9)3 (де кожний R9 незалежно вибраний) або R9; і (r) при подальших умовах: (1) R6 і R8 обоє не можуть являти собою C(=O)CH3, (2) що, коли A1 являє собою A11, тоді R6 і R8 разом не утворюють конденсовану циклічну систему, (3) що R6 і R8 не зв'язані з утворенням циклічного фрагмента з єдиною групою -CH2-, (4) що, коли А являє собою A2, тоді R5 не є C(=O)OH, (5) коли А являє собою A2, і R6 являє собою Н, то R8 не є -(C1-C6 алкіл)-O-(заміщений арил), і (6) коли А являє собою A2, то R6 не є -(C1алкіл)(заміщений арил). В іншому варіанті здійснення даного винаходу А являє собою A1. У ще одному варіанті здійснення даного винаходу А являє собою A2. У ще одному варіанті здійснення даного винаходу R1 являє собою Н. У ще одному варіанті здійснення даного винаходу R2 являє собою H. У ще одному варіанті здійснення даного винаходу R3 вибраний з Н або заміщеного або незаміщеного C1-C6 алкілу. У ще одному варіанті здійснення даного винаходу R3 вибраний з Н або СН 3. У ще одному варіанті здійснення винаходу, коли А являє собою A1, тоді A1 являє собою А11. У ще одному варіанті здійснення винаходу, коли А являє собою A1, і A1 являє собою A11, тоді R4 вибраний з Н, або заміщеного або незаміщеного C 1-C6 алкілу, або заміщеного або незаміщеного C6-C20 арилу. У ще одному варіанті здійснення винаходу, коли А являє собою A1, і A1 являє собою A11, тоді R4 вибраний з СН3, СН(СН3)2 або фенілу. У ще одному варіанті здійснення винаходу, коли А являє собою A1, A1 являє собою А12, тоді R4 являє собою СН3. У ще одному варіанті здійснення даного винаходу, коли А являє собою A2, тоді R4 вибраний з Н або заміщеного або незаміщеного C 1-C6 алкілу, заміщеного або незаміщеного C2-C6 алкенілу, заміщеного або незаміщеного C3-C10 циклоалкілу, заміщеного або незаміщеного C6C20 арилу, де кожний зазначений R4, що є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br або I. 6 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 У ще одному варіанті здійснення даного винаходу, коли А являє собою A2, тоді R4 являє собою Н або C1-C6 алкіл. У ще одному варіанті здійснення даного винаходу, коли А являє собою A2, тоді R4 являє собою Н, СН3, СН2СН3, СН=СН2, циклопропіл, CH2Cl, CF3 або феніл. У ще одному варіанті здійснення даного винаходу, коли А являє собою A2, тоді R4 являє собою Cl. У ще одному варіанті здійснення даного винаходу R5 являє собою Н, F, Cl, Br, I або заміщений або незаміщений C1-C6 алкіл, заміщений або незаміщений C1-C6 алкокси. У ще одному варіанті здійснення даного винаходу R5 являє собою Н, ОСН 2СН3, F, Cl, Br або CH3. У ще одному варіанті здійснення даного винаходу, коли А являє собою A1, тоді R6 являє собою заміщений або незаміщений C1-C6 алкіл. У ще одному варіанті здійснення даного винаходу, коли А являє собою A2, тоді R6 вибраний із заміщеного або незаміщеного C1-C6 алкілу, заміщеного або незаміщеного C2-C6 алкенілу, заміщеного або незаміщеного C3-C10 циклоалкілу, C(=X1)R9, C(=X1)X2R9, R9 × 2R9, C(=O)(C 1C6 алкіл)S(O)n(C1-C6 алкіл), (C1-C6 алкіл)OC(=O)(C6-C20 арил), (C1-C6 алкіл)OC(=O)(C1-C6 алкіл) або R9 × 2C(=X1)X2R9. У ще одному варіанті здійснення даного винаходу, коли А являє собою A2, тоді R6 і R8 з'єднані з утворенням циклічного фрагмента, де необов'язково такий циклічний фрагмент, що з'єднує R6 і R8, може містити в циклі один або декілька гетероатомів, вибраних з атомів O, S або N. У ще одному варіанті здійснення даного винаходу R6 являє собою C1-C6 або алкіл C1-C6 алкілфеніл. У ще одному варіанті здійснення даного винаходу R6 являє собою Н, СН3, CH2CH3, CH2CH2CH3, CH(CH3)2, CH2-феніл, CH2CH(CH3)2, CH2циклопропіл, C(=O)CH2CH2SCH3, C(=O)OC(CH3)3, CH2CH=CH2, C(=O)OCH2CH3, C(=O)CH(CH3)CH2SCH3, циклопропіл, CD3, CH2 °C(=O)феніл, C(=O)CH3, C(=O)CH(CH3)2, CH2 °C(=O)CH(CH3)2, CH2 °C(=O)CH3, C(=O)феніл, CH2OCH3, CH2 °C(=O)CH2OCH2CH3, CH2CH2OCH3, CH2 °C(=O)OCH(CH3)2, CH2CH2OCH2OCH3, CH2CH2OCH3, CH2CH2 °C(=O)CH3, CH2CN. У ще одному варіанті здійснення даного винаходу R6 являє собою метил або етил. У ще одному варіанті здійснення даного винаходу R7 являє собою О або S. У ще одному варіанті здійснення даного винаходу R8 вибраний із заміщеного або незаміщеного C1-C6 алкілу, заміщеного або незаміщеного C2-C6 алкенілу, заміщеного або незаміщеного C3-C10 циклоалкілу, заміщеного або незаміщеного C6-C20 арилу, заміщеного або незаміщеного C1-C20 гетероциклілу, R9C(=X1)OR9, SR9, S(O)nOR9, R9S(O)nR9 або R9S(O)n(NZ)R9. У ще одному варіанті здійснення даного винаходу R8 являє собою CH(CH3)CH2SCH3, CH(CH3)2, C(CH3)2CH2SCH3, CH2CH2SCH3, CH2CF3, CH2CH2C(=O)OCH3, N(H)(CH2CH2SCH3), OCH2CH2SCH3, CH(CH2SCH3)(CH2феніл), тіазоліл, оксазоліл, ізотіазоліл, заміщений фураніл, СН3, C(CH3)3, феніл, CH2CH2OCH3, піридил, CH2CH(CH3)SCH3, °C(CH3)3, C(CH3)2CH2SCH3, CH(CH3)CH(CH3)SCH3, CH(CH3)CF3, CH2CH2-тієніл, CH(CH3)SCF3, CH2CH2Cl, CH2CH2CH2CF3, CH2CH2S(=O)CH3, CH(CH3)CH2S(=O)CH3, CH2CH2S(=O)2CH3, CH(CH3)CH2S(=O)2CH3, NCH2CH3, N(H)(CH2CH2CH3), C(CH3)=C(H)(CH3), N(H)(CH2CH=CH2), CH2CH(CF3)SCH3, CH(CF3)CH2SCH3, тієтаніл, CH2CH(CF3)2, CH2CH2CF(OCF3)CF3, CH2CH2CF(CF3)CF3, CF(CH3)2, CH(CH3)феніл-Cl, CH(CH3)феніл-F, CH(CH3)феніл-OCF3, CH2N(CH3)(S(=O)2N(CH3)2, CH(CH3)OCH2CH2SCH3, CH(CH3)OCH2CH2OCH3, OCH3, CH(CH3)SCH3, CH2SCH3, N(H)CH3, CH(Br)CH2Br, CH2CH2SCH2CH2CF3, CH2CH2SH, CH2CH2SC(феніл)3, CH2N(CH3)S(O)2CH3, CH(SCH3)(C(=O)CH2SCH3), CH2S(O)CH3, CH2CH(циклопропіл)SCH3 або CH(CH3)CH2SCD3. У ще одному варіанті здійснення даного винаходу R8 вибраний із (заміщений або незаміщений C1-C6 алкіл)-S(O)n-(заміщений або незаміщений C1-C6 алкіл), де зазначені замісники на заміщених алкілах вибрані з F, CI, Br, I, CN, NO 2, N(R9)S(O)nR9, OR9, S(O)nOR9, R9(O)n9, S(O)nR9, C6-C20 арил або C1-C20 гетероцикліл (де кожний із зазначених замісників, що може бути заміщеним, може бути необов'язково заміщений R9). У ще одному варіанті здійснення даного винаходу Х являє собою СR n1, де Rn1 являє собою Н або галоген. У ще одному варіанті здійснення даного винаходу Х являє собою СR n1, де Rn1 являє собою Н або F. У ще одному варіанті здійснення даного винаходу X1 являє собою O. У ще одному варіанті здійснення даного винаходу X2 являє собою O. 7 UA 114611 C2 5 10 15 20 25 30 35 У ще одному варіанті здійснення даного винаходу R11 являє собою заміщений або незаміщений C1-C6 алкілC≡ CR12. У ще одному варіанті здійснення даного винаходу R11 являє собою СН 2C≡CH. У ще одному варіанті здійснення даного винаходу R11 переважно являє собою CH 2C≡CH, і R8 переважно являє собою (заміщений або незаміщений C 1-C6 алкіл)-S(O)n-(заміщений або незаміщений C1-C6 алкіл), де зазначені замісники на заміщених алкілах вибрані з F, Cl, Br, I. У ще одному варіанті здійснення даного винаходу R11 переважно являє собою CH 2C≡CH, і R8 переважно являє собою (незаміщений C1-C6 алкіл)-S(O)n-(заміщений C1-C6 алкіл), де зазначені замісники на заміщених алкілах вибрані з F, Cl, Br, I. У ще одному варіанті здійснення даного винаходу R11 переважно являє собою CH 2C≡CH, і R8 переважно являє собою (незаміщений C1-C2-алкіл)-S(O)n(заміщений C1-C3-алкіл), де зазначені замісники на заміщених алкілах являють собою F. Звичайно молекулярна маса сполучення молекул формули один становить від приблизно 100 дальтонів до приблизно 1200 дальтонів. Однак переважно молекулярна маса становить від приблизно 120 дальтонів до приблизно 900 дальтонів, і ще більш переважно молекулярна маса становить від приблизно 140 дальтонів до приблизно 600 дальтонів. Наведені далі схеми ілюструють підходи до одержання амінопіразолів. На стадії а схеми I обробка 3-ацетопіридину або 5-ацетопіримідину формули II, де R1, R2, R3 і X приймають значення, визначені вище, сірковуглецем і йодметаном у присутності основи, такої, як гідрид натрію, у розчиннику, такому, як диметилсульфоксид, приводить до одержання сполуки формули III. На стадії b схеми I сполука формули III може піддаватися обробці аміном або гідрохлоридом аміну в присутності основи, такої, як триетиламін, у розчиннику, такому, як етиловий спирт, з одержанням сполуки формули IV, де R1, R2, R3, R6 і Х приймають значення, визначені вище. Сполука формули IV може піддаватися перетворенню в амінопіразол формули Va, де R5=H, як представлено на стадії с схеми I і описано в публікації Peruncheralathan, S. et al. J. Org. Chem. 2005, 70, 9644-9647, шляхом взаємодії з гідразином, таким, як метилгідразин, у полярному протонному розчиннику, такому, як етиловий спирт. Схема I . Інший підхід до одержання амінопіразолів представлений на схемі II. На стадії а нітрил формули VI, де Х, R1, R2 і R3 приймають значення, визначені вище, і R5 являє собою водень, піддається конденсації, як описано в публікації Dhananjay, B. Kendre et al. J. Het Chem 2008, 45, (5), 1281-86, з гідразином формули VII, таким, як метилгідразин, з одержанням суміші амінопіразолів формули Vb, де R5 і R6=H, з якої були виділені обидва компоненти. Схема II 8 UA 114611 C2 5 10 15 20 25 . Одержання амінопіразолів, таких, як сполуки формули XIIa, представлено на схемі III. Сполука формули X може бути отримана, як представлено на стадії а і як описано в публікації Cristau, Henri-Jean et al. Eur. J. Org. Chem. 2004, 695-709, за допомогою N-арилування піразолу формули IX відповідним арилгалогенідом формули VIIIa, де Q являє собою бром, у присутності основи, такої, як карбонат цезію, мідного каталізатора, такого, як оксид міді (II), і ліганду, такого, як саліцилальдоксим, у полярному апротонному розчиннику, такому, як ацетонітрил. Сполуки формули IX, як представлено на схемі III, де R4=Cl і R5=H, можуть бути отримані як описано у WO 2007/045868 A1 (Pelcman, B. et al.). Нітрування піридилпіразолу формули X, як показано на стадії b схеми III і як описано в публікації Khan, Misbanul Ain et al. J. Heterocyclic Chem. 1981, 18, 9-14, взаємодією з азотною кислотою і сірчаною кислотою приводить до одержання сполуки формули XIa. Відновлення функціональної нітрогрупи сполук формули XIa у присутності водню за допомогою каталізатора, такого, як 5 % Pd/C, у полярному апротонному розчиннику, такому, як тетрагідрофуран, приводить до одержання аміну формули XIIa, як показано на стадії с схеми III. Відновлення функціональної нітрогрупи сполук формули XIa, де R1, R2, R3, R4 і Х приймають значення, визначені вище, і R5=H, у присутності водню за допомогою каталізатора, такого, як 10 % Pd/C, у полярному протонному розчиннику, такому, як етанол, приводить до одержання аміну формули XIIa, де R5=H, а також аміну формули XIIa, де R5=OEt, як представлено на стадії d на схемі III. Сполуки формули XIa, де R1, R2, R3, R5 і Х приймають значення, визначені вище, і R4=Cl, можуть піддаватися відновленню в присутності відновника, такого, як залізо, у суміші полярних протонних розчинників, таких, як оцтова кислота, вода і етанол, з одержанням амінів формули XIIa, де R1, R2, R3, R5 і Х приймають значення, визначені вище, R4=Cl, як представлено на стадії е схеми III. Сполуки формули XIa, де R1, R2, R3, R5 і Х приймають значення, визначені вище, і R4=Cl, можуть піддаватися взаємодії з бороновою кислотою, такою, як фенілборонова кислота, в умовах реакції сполучення Сузукі, у присутності каталізатора, такого, як тетракиспаладій, основи, такої, як 2М водний розчин карбонату калію, і в системі суміші розчинників, таких, як етанол і толуол, для одержання перехресно зв'язаних піразолів формули XIb, як представлено на стадії f схеми III. Схема III 9 UA 114611 C2 5 10 15 20 . На стадії a схеми IV сполуки формули XIIb можуть піддаватися обробці триетилортоформіатом і кислотою, такою, як трифтороцтова кислота. Подальше додавання відновника, такого, як борогідрид натрію, у полярному протонному розчиннику, такому, як етанол, приводить до одержання сполуки формули XIIIa, де R6 = метил. На стадії b схеми IV сполука формули XIIb може піддаватися обробці ацетоном у розчиннику, такому, як ізопропілацетат, кислотою, такою, як трифтороцтова кислота, і триацетоксиборогідридом натрію з одержанням сполук формули XIIIa, де R6 = ізопропіл. На стадії c схеми IV сполуки формули XIIb можуть піддаватися ацилюванню хлорангідридом кислоти, таким, як ацетилхлорид, у полярному апротонному розчиннику, такому, як дихлорметан, в умовах, описаних на схемі V. Відновлення аміду за допомогою відновника, такого, як алюмогідрид літію, у полярному апротонному розчиннику, такому, як тетрагідрофуран, приводить до одержання сполуки формули XIIIa, де R6 = етил. Альтернативно, на стадії d схеми IV сполуки формули XIIb можуть піддаватися обробці бензотриазолом і альдегідом у етанолі з подальшим відновленням із використанням, наприклад, борогідриду натрію, для одержання сполук формули XIIIa. На стадії е схеми IV сполуки формули XIIb можуть піддаватися обробці альдегідом, таким, як пропіоновий альдегід, і триацетоксиборогідридом натрію в полярному апротонному розчиннику, такому, як дихлорметан, з одержанням сполук формули XIIIa, де R6 = пропіл. Як представлено на стадії f, ацилювання сполук формули XIIIa на схемі IV з використанням умов, описаних на схемі IX, приводить до одержання сполуки формули Iа, де R1, R2, R3, R4, R5, R6, R8 і Х приймають значення, що визначені вище. Схема IV 10 UA 114611 C2 5 10 15 20 . На стадії а схеми V сполуки формули Vc, де R1, R2, R3, R4, R5 і R6 і X приймають значення, визначені вище, можуть піддаватися обробці хлорангідридом формули XIV у присутності основи, такої, як триетиламін або N, N-диметиламінопіридин, у полярному апротонному розчиннику, такому, як дихлоретан (DCE), з одержанням сполуки формули Ib, де R8 приймає значення, визначені вище. Крім того, коли R6=H, 2 амід може послідовно піддаватися алкілуванню на стадії b схеми V за допомогою алкілгалогеніду, такого, як йодетан, у присутності основи, такої, як гідрид натрію, у полярному апротонному розчиннику, такому, як N, Nдиметилформамід (DMF), з одержанням сполуки формули Ib. Хлорангідриди кислот, використовувані тут у реакціях ацилювання, є комерційно доступними або можуть синтезуватися фахівцями даної галузі техніки. Схема V . На стадії а схеми VI, як описано в публікації Sammelson et al. Bioorg. Med. Chem. 2004, 12, 3345-3355, амінопіразоли формули Vd, де R1, R2, R3, R4, R6 і Х приймають значення, визначені вище, і R5=H, можуть піддаватися галогенуванню з використанням джерела галогену, такого, як N-хлорсукцинімід або N-бромсукцинімід, у полярному апротонному розчиннику, такому, як ацетонітрил, для одержання R5-заміщеного піразолу. На стадії b ацилювання цієї сполуки в умовах, описаних на схемі V, приводить до одержання сполуки формули Ic, де R1, R2, R3, R4, R5, R6, R8 і Х приймають значення, визначені вище. Схема VI 11 UA 114611 C2 5 10 15 20 На стадії а схеми VII з амінопіразолів формули Ve одержують сечовини і карбамати. Сполуки формули Ve, де Х, R1, R2, R3, R4, R5 і R6 приймають значення, визначені вище, піддають взаємодії з фосгеном з одержанням проміжного карбамоїлхлориду, який далі обробляють аміном, як представлено на стадії b, або спиртом, як представлено на стадії с, відповідно, для одержання сечовини формули Id або карбамату формули Ie відповідно, де R9 приймає значення, визначені вище. Схема VII . На стадії а схеми VIII сполуки формули XIIc, де X, R1, R2, R3, R4 і R5 приймають значення, визначені вище, можуть піддаватися обробці ди-трет-бутилдикарбонатом (Вос2О) і основою, такою, як триетиламін, у полярному апротонному розчиннику, такому, як дихлорметан (DCM), з одержанням сполуки формули XVIa. Обробка карбаматної функціональної групи алкілгалогенідом, таким, як йодметан або Boc-ангідрид, у присутності основи, такої, як гідрид натрію, і в полярному апротонному розчиннику, такому, як DMF, приводить до одержання карбаматів формули XVII, як представлено на стадії b схеми VIII, де R6 приймає значення, визначені вище, за винятком значення, де R6 являє собою водень. Boc-група може бути видалена в умовах, добре відомих у даній галузі техніки, наприклад, у кислих умовах, таких, як трифтороцтова кислота (TFA), у полярному апротонному розчиннику, такому, як дихлорметан, з одержанням сполук формули XIIIb, як представлено на стадії с. Схема VIII 12 UA 114611 C2 5 10 15 20 25 30 . На стадіях a, b і c схеми IΧ сполуки формули XIIIc, де X, RI, R2, R3, R4, R5 і R6 приймають значення, визначені вище, можуть піддаватися обробці сполукою формули XVIII, де R8 приймає значення, визначені вище, R10 являє собою OH, OR9 або О(C=О)OR9, з одержанням сполук формули Id. Коли R10=OH, сполуки формули XIIIс можуть піддаватися перетворенню в сполуки формули Id у присутності конденсуючого реагенту, такого, як 1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид (EDС·HCl), і основи, такої, як N, N-диметиламінопіридин (DMAP), у полярному апротонному розчиннику, такому, як дихлоретан (DCE), як представлено на стадії а. Коли R10=OR9, сполуки формули XIIIс можуть піддаватися перетворенню в сполуки формули Id у присутності 2,3,4,6,7,8-гексагідро-1H-піримідо[1,2-a]піримідину в полярному апротонному розчиннику, такому, як 1,4-діоксан, при підвищеній температурі, як представлено на стадії b. Коли R10=O(C=O)OR9, сполуки формули XIIIc можуть піддаватися перетворенню в сполуки формули Id у полярному апротонному розчиннику, такому, як дихлорметан (DCM), як представлено на стадії с. Ацилювання амідів формули Id, коли R6 = Η, хлорангідридом кислоти в присутності основи, такої, як діізопропілетиламін, у полярному апротонному розчиннику, такому, як дихлоретан (DCE), приводить до одержання імідів формули Iе, як представлено на стадії d. Крім того, алкілування амідів формули Id, коли R6 = Н, алкілгалогенідом у присутності основи, такої, як гідрид натрію, у полярному апротонному розчиннику, такому, як N, Nдиметилформамід (DMF), приводить до одержання алкілованих амідів формули Iе, як представлено на стадії е. Галогенування сполук формули Id, де R1, R2, R3, R4, R6, R8 і Х приймають значення, визначені вище, і R5=H, з використанням джерела галогену, такого, як Nбромсукцинімід, у полярному апротонному розчиннику, такому, як DCE, або джерела галогену, такого, як N-хлорсукцинімід, у полярному апротонному розчиннику, такому, як DCE або ацетонітрил, або джерела галогену, такого, як Selectfluor®, у суміші полярних апротонних розчинників, таких, як ацетонітрил і DMF, приводить до одержання галогенованих піразолів формули Iе, де R5 являє собою галоген, як представлено на стадії f схеми IX. Аміди формули Id можуть піддаватися перетворенню в тіоаміди формули If у присутності агента тіонування, такого, як реагент Лавесона, у полярному апротонному розчиннику, такому, як дихлоретан (DCE), як представлено на стадії g. Схема IX 13 UA 114611 C2 5 10 15 . На стадії а схеми X сполуки формули XIIId, де X, R1, R2, R3, R4, R5 приймають значення, визначені вище, можуть піддаватися обробці сполуками формули XIX, де R8 приймає значення, визначені вище, у полярному апротонному розчиннику, такому, як дихлоретан (DCE), з одержанням сполук формули XX. Крім того, коли R6=H і R8 містить галоген, сполуки формули XX можуть піддаватися обробці основою, такою, як гідрид натрію, у полярному апротонному розчиннику, такому, як ТГФ, з одержанням сполук формули XXI, де М являє собою ціле число, вибране з 1, 2, 3, 4, 5 або 6, як представлено на стадії b схеми X. Схема Х . Окислювання сульфіду до сульфоксиду або сульфону проводиться відповідно до схеми XI, де (~S~) може являти собою будь-який сульфід, як визначено вище в описі для R8. Сульфід формули XXIIa, де X, R1, R2, R3, R4, R5 і R6 приймають значення, визначені вище, піддається обробці окислювачем, таким, як тетрагідрат перборату натрію, у полярному протонному розчиннику, такому, як крижана оцтова кислота, з одержанням сульфоксиду формули XXIII, як представлено на стадії а схеми XI. Альтернативно, сульфід формули XXIIa може піддаватися окислюванню за допомогою окислювача, такого, як пероксид водню, у полярному протонному 14 UA 114611 C2 5 10 15 20 розчиннику, такому, як гексафторізопропанол, з одержанням сульфоксиду формули XXIII, як представлено на стадії d схеми XI. Сульфоксид формули XXIII може піддаватися додатковому окислюванню до сульфону формули XXIV за допомогою тетрагідрату перборату натрію в полярному протонному розчиннику, такому, як крижана оцтова кислоти, як представлено на стадії с схеми XI. Альтернативно, сульфон формули XXIV може бути отриманий відповідно до одностадійної методики із сульфіду формули XXIIa відповідно до зазначених вище умов з >2 екв. тетрагідрату перборату натрію, як представлено на стадії b схеми XI. Схема XI Окислювання сульфіду до сульфоксиміну проводиться, як показано на схемі XII, де (~S~) може являти собою будь-який сульфід, як визначено вище в описі для R8. Сульфід формули XXIIb, де X, R1, R2, R3, R4, R5 і R6 приймають значення, визначені вище, піддається окислюванню на стадії а за допомогою діацетату йодбензолу в присутності ціанаміду в полярному апротонному розчиннику, такому, як метиленхлорид (DCM), з одержанням сульфіліміну формули XXV. Сульфілімін формули XXV може піддаватися додатковому окислюванню до сульфоксиміну формули XXVI за допомогою окислювача, такого, як метахлорпероксибензойна кислота (mСРВА), у присутності основи, такої, як карбонат калію, у системі протонних полярних розчинників, таких, як етанол і вода, як показано на стадії b схеми XII. Схема XII 15 UA 114611 C2 5 10 15 20 . Йодування піразолу формули Xb, як представлено на стадії а схеми XIII і описано в публікації Potapov, A. et al. Russ. J. Org. Chem. 2006, 42, 1368-1373, взаємодією з йодуючим агентом, таким, як йод, у присутності кислот, таких, як йодна кислота і сірчана кислота, у полярному протонному розчиннику, такому, як оцтова кислота, приводить до одержання сполуки формули XXVII. На стадії b схеми XIII і як описано в публікації Wang, D. et al. Adv. Synth. Catal. 2009, 351, 1722-1726, амінопіразоли формули XIIIe можуть бути отримані з йодопіразолів формули XXVII за допомогою реакції крос-сполучення з відповідним аміном у присутності основи, такої, як карбонат цезію, мідного каталізатора, такого, як бромід міді(I), і ліганду, такого, як 1-(5,6,7,8-тетрагідрохінолін-8-іл)етанон, у полярному апротонному розчиннику, такому, як ДМСО. Схема XIII . На стадії а схеми XIV сполуки формули XXIX, де R4 являє собою Cl, R5 являє собою Н, і Х являє собою Cl , можуть бути отримані відповідно до методів, описаних у публікації Tolf, BoRagnar, Dahlbom, R. Acta. Pharm. Suec. 22, 147-156 (1985). Аналогічно, сполуки формули XXIX, де R4 являє собою Br, X являє Br , і R5 приймає значення, визначене вище, можуть бути отримані обробкою сполук формули XXVIII газоподібним воднем у присутності металевого каталізатора, такого, як 5 % Pd на оксиді алюмінію, і 50 % водним розчином HBr у розчиннику, такому, як етанол. Альтернативно, на стадії а схеми XIV сполуки формули XXIX, де R4 являє 16 UA 114611 C2 5 10 15 20 25 собою Cl або Br, X являє собою Cl або Br , і R5 приймає значення, визначене вище, можуть бути отримані обробкою сполук формули XXVIII, де R5 приймає значення, визначене вище, гідросиланом, таким, як триетилсилан, у присутності металевого каталізатора, такого, як 5 % Pd на оксиді алюмінію, і кислоти, такої, як НСl або HBr відповідно, у розчиннику, такому, як етанол. На стадії b схеми XIV сполуки формули XXX, де R4 являє собою Cl або Br, і R5 приймає значення, визначене вище, можуть бути отримані обробкою сполук формули ΧΧIΧ, де R4 являє собою Cl або Br, X являє Cl або Br , і R5 приймає значення, визначене вище, з ди-третбутилдикарбонатом (Boc2О) у присутності суміші розчинників, таких, як ТГФ і вода, і основи, такої, як бікарбонат натрію. На стадії с схеми XIV сполуки формули XVIa, де Х, R1, R2, R3 і R5 приймають значення, визначені вище, і R4 являє собою Cl або Br, можуть бути отримані обробкою сполук формули XXX, де R4 являє собою Cl або Br, і R5 приймає значення, визначене вище, сполуками формули VIIIb, де X, R1, R2 і R3 приймають значення, визначені вище, і Q являє собою бром або йод, у присутності каталітичної кількості солі міді, такої, як CuCl 2, і похідним етан-1,21 2 діаміну, таким, як N ,N -диметилетан-1,2-діамін, і основою, такою, як K3PO4, у полярному апротонному розчиннику, такому, як ацетонітрил, при прийнятній температурі. Boc-група сполук формули XVIa може бути видалена в умовах, добре відомих у даній галузі, таких, як кислі умовах, наприклад, у TFA, у полярному апротонному розчиннику, такому, як дихлорметан, з одержанням сполук формули XIId, як представлено на стадії d схеми XIV. Схема XIV . Бромпіразоли формули XXXI, де R1, R2, R3, R5, R8 і Х приймають значення, визначені вище, можуть піддаватися зв'язуванню зі складним ефіром боронової кислоти, таким, як пінаколовий ефір вінілборонової кислоти або піноколовий ефір циклопропілборонової кислоти, в умовах реакції сполучення Сузукі в присутності каталізатора, такого, як тетракиспаладій, основи, такої, як 2М водний розчин карбонату калію, у системі змішаних розчинників, таких, як етанол і толуол, з одержанням сполук формули XXXII, як представлено на стадії а схеми XV. Схема XV 17 UA 114611 C2 5 10 15 . Вінільна група сполук формули XXXIII, де R1, R2, R3, R5, R6, R8 і Х приймають значення, визначені вище, може піддаватися відновленню в присутності водню за допомогою каталізатора, такого, як 10 % Pd/C, у полярному протонному розчиннику, такому метанол, з одержанням сполуки формули XXXIV, як представлено на стадії а схеми XVI. Окислювання вінільної групи сполук формули XXXIII за допомогою окислювача, такого, як осмій тетроксид, у присутності періодату натрію в суміші полярного протонного розчинника, такого, як вода, і полярного апротонного розчинника, такого, як ТГФ, приводить до одержання сполуки формули XXXV, як представлено на стадії b схеми XVI. Відновлення альдегідної групи сполук формули XXXV, як представлено на стадії с схеми XVI, відновником, таким, як борогідрид натрію, у полярному протонному розчиннику, такому, як метанол, приводить до одержання відповідного спирту формули XXXVI. Обробка сполук формули XXXVI хлоруючим агентом, таким, як тіонілхлорид, у полярному апротонному розчиннику, такому, як дихлорметан, приводить до одержання сполук формули XXXVII, як представлено на стадії d схеми XVI. Схема XVI . 18 UA 114611 C2 На стадії а схеми XVII α,β-ненасичена кислота XXXVIII може піддаватися обробці нуклеофілом, таким, як тіометоксид натрію, у полярному протонному розчиннику, такому, як метанол, з одержанням кислоти XXXIX. Схема XVII 5 10 15 20 25 30 . На стадії a схеми XVIII обробка сполук формули Ig, де А являє собою A2, R7 являє собою О, R8 являє собою трет-бутокси, реагентом, таким, як пропаргілбромід, у присутності основи, такої, як гідрид натрію, у полярному апротонному розчиннику, такому, як DMF, приводить до одержання сполук формули Ih, де R6=R11. Схема XVIII . Сульфонамідні сполуки формули Ii, де (~N) може являти собою будь-який амін, визначений для значень R8 даного винаходу, можуть бути отримані відповідно до стадій а, b і с, як показано на схемі XIX. На стадії а ацилювання сполук формули XIIIf відповідно до методів, представлених на схемі IX, приводить до одержання сполук формули XXXX, де R1, R2, R3, R4, R5, R9, X приймають значення, визначені вище, і R6=R11, як визначено вище. Видалення Восгрупи зі сполук формули XXXX, як представлено на стадії b, може проводитися в умовах, описаних на схемі XIV, з одержанням сполук формули XXXXI, де R1, R2, R3, R4, R5, R9, X приймають значення, визначені вище, і R6=R11, як визначено вище. Сполуки формули XXXXI можуть піддаватися обробці сульфонілхлоридами формули XXXXII, такими, як метансульфонілхлорид, у присутності основи, такої, як діізопропілетиламін, у полярному апротонному розчиннику, такому, як дихлорметан, з одержанням сполук формули Ii, як представлено на стадії с схеми XIX. Схема XIX Приклади Приклади наведені для ілюстрації і не повинні розглядатися як обмеження винаходу, розкритого в даному документі, тільки варіантами здійснення, представленими в цих прикладах. Вихідні речовини, реагенти і розчинники, які були отримані з комерційних джерел, використовувалися без додаткового очищення. Безводні розчинники були отримані у формі Sure/Seal™ від Aldrich і використовувалися такими, якими були отримані. Температури плавлення одержували на апараті капілярного визначення температури плавлення Thomas Hoover Unimelt або OptiMelt Automated Melting Point System від Stanford Research Systems і не 19 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 коректувалися. Наведено відомі назви сполук, отримані відповідно до програмного забезпечення ISID Draw, ChemDraw або ACD Name Pro. Якщо такі програми не могли дати назву сполуці, назва було складена відповідно до стандартних правил номенклатури. Усі зрушення ЯМР представлені в м. ч. (δ) і записувалися при 300, 400 або 600 МГц, якщо не зазначено інше. Приклад 1, стадія 1: Одержання 3,3-біс-метилсульфаніл-1-піридин-3-ілпропенону До суспензії гідриду натрію (NaH, 60 % суспензія в мінеральному маслі; 4,13 г, 86 ммоль) у сухому диметилсульфоксиді (ДМСО, 60 мл) в атмосфері азоту (N 2) при кімнатній температурі протягом 30 хвилин (хв.) по краплях додають 3-ацетилпіридин (5,00 г, 41,3 ммоль). Суміш перемішують протягом додаткових 30 хвилин при тій же температурі. До суміші з енергійним перемішуванням по краплях додають сірковуглець (CS2, 3,27 г, 43 ммоль) з подальшим додаванням по краплях протягом 45 хвилин йодметану (12,21 г, 86 ммоль). Перемішування продовжують протягом додаткових 18 годин в атмосфері N2. Реакцію гасять холодною водою (Н2О, 50 мл). Темну тверду речовину фільтрують і промивають охолодженим льодом етиловим спиртом (EtOH), доти, поки промивні води не стають безбарвними. Продукт у вигляді твердої не зовсім білої речовини сушать у вакуумі при 60 °C, одержуючи 3,3-біс-метилсульфаніл-1-піридин3-ілпропенон у вигляді твердої речовини коричневого кольору (4,8 г, 51 %): 1 1 Н ЯМР (300 МГц, CDCl3) δ H ЯМР (300 MГц, CDCl3) δ 9,13 (д, J=1,8 Гц, 1H), 8,72 (дд, J=4,8, 1,6 Гц, 1H), 8,23 (ддд, J=7,9, 2, 2 Гц, 1H), 7,40 (дд, J=7,9, 4,8 Гц, 1H), 6,73 (с, 1H), 2,58 (д, J=9,4 Гц, 6H); МС m/z 226,2 (M+1). 1-(5-Фторпіридин-3-іл)-3,3-біс(метилтіо)проп-2-ен-1-он одержують відповідно до методики, описаної в прикладі 1 стадії 1: т. пл. 150-152 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,93 (т, J=1,6 Гц, 1H), 8,58 (д, J=2,8 Гц, 1H),7,94 (ддд, J=8,9, 2,8, 1,7 Гц, 1H), 6,69 (с, 1H), 2,60 (с, 3H), 2,57 (с, 3H). Приклад 1, стадія 2: Одержання (Z)-3-метиламіно-3-метилсульфаніл-1-піридин-3ілпропенону Розчин 3,3-біс-метилсульфаніл-1-піридин-3-ілпропенону (18,6 г, 82,5 ммоль) в абсолютному спирті (400 мл) в атмосфері N2 обробляють гідрохлоридом метиламіну (27,86 г, 412 ммоль), потім триетиламіном (Et3N; 58,5 мл, 412 ммоль). Суміш кип'ятять зі зворотним холодильником протягом 3 годин, охолоджують до кімнатної температури і концентрують при зниженому тиску. Твердий залишок розчиняють у етилацетаті (EtOAc; 150 мл). Розчин промивають Н2О (250 мл) і насиченим розчином солі (50 мл), сушать над Na2SО4, концентрують при зниженому тиску, і залишок очищують хроматографією на силікагелі, елююючи 10 % EtOAc у петролейному ефірі, з одержанням (Z)-3-метиламіно-3-метилсульфаніл-1-піридин-3-ілпропенону у вигляді твердої речовини блідо-жовтого кольору (8,6 г, 50 %): 1 Н ЯМР (300 МГц, CDCl3) δ 11,8 (ушир. с, 1H), 9,06 (с, 1H); 8,67 (д, J=3,9 Гц, 1H), 8,26 (д, J=8,0 Гц 1H), 7,46 (дд, J=7,6, 4,9 Гц 1H), 5,62 (с, 1H), 3,10 (д, J=5,2 Гц, 3H), 2,52 (с, 3H); МС (m/z) 209,2 [M+1]. (Z)-3-(Етиламіно)-3-(метилтіо)-1-(піридин-3-іл)проп-2-ен-1-он одержують відповідно до методики, описаної в прикладі 1, стадія 2: 1 H ЯМР (400 МГц, CDCl3) δ 11,81 (ушир. с, 1H), 9,04 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,29–7,98 (м, 1H), 7,35 (ддд, J=7,9, 4,8, 0,9 Гц, 1H), 3,45 (кв, J=7,2, 5,6 Гц, 2H), 2,50 (с, 3H), 1,35 (т, J=7,2 Гц, 3H). (Z)-3-(Циклопропілметил)аміно-3-(метилтіо)-1-(піридин-3-іл)проп-2-ен-1-он одержують відповідно до методики, описаної в прикладі 1 стадії 2: 1 H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 9,05 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,16 (дт, J=7,9, 2,0 Гц, 1H), 7,35 (ддд, J=7,9, 4,8, 0,8 Гц, 1H), 5,62 (с, 1H), 3,27 (дд, J=7,0, 5,5 Гц, 2H), 2,50 (с, 3H), 1,20–1,07 (м, 1H), 0,73–0,49 (м, 2H), 0,41–0,17 (м, 2H). Приклад 1, стадія 3: Одержання метил-(2-метил-5-піридин-3-піразол-3-іл)аміну 20 UA 114611 C2 5 10 15 20 25 30 35 40 45 Розчин (Z)-3-метиламіно-3-метилсульфаніл-1-піридин-3-ілпропенону (3,00 г, 14 ммоль) і метилгідразину (729 мг, 15,4 ммоль) в абсолютному EtOH (64 мл) кип'ятять зі зворотним холодильником при перемішуванні протягом 18 годин в атмосфері N2, потім охолоджують до кімнатної температури й упарюють при зниженому тиску. Залишок розчиняють у EtOAc (50 мл), і органічний шар промивають Н2О (230 мл) і (30 мл), сушать над Na2SО4, концентрують при зниженому тиску й очищують хроматографією на силікагелі, елююючи з градієнтом 0-1 % EtOH у EtOAc, з одержанням двох регіоізомерів у співвідношенні 1:2, де основний регіоізомер являє собою тверду речовину коричневого кольору (1,0 г, 27 %): 1 Н ЯМР (300 МГц, CDCl3) δ 8,97 (д, J=1,3 Гц, 1H), 8,51 (дд, J=3,6, 1,0 Гц, 1H), 8,07 (ддд, J=5,9, 1,4, 1,4 Гц, 1H), 7,30 (дд, J=5,9, 3,6 Гц, 1H), 5,82 (с, 1H), 3,69 (с, 3H), 2,93 (с, 3H); МС (m/z) 188,6 [M+1]. 1-Етил-N-метил-3-(піридин-3-іл)-1H-піразол-5-амін одержують відповідно до методики, описаної в прикладі 1 стадії 3: МС (ESI) (m/z) 204 ([Μ+2H]). N-етил-1-метил-3-(піридин-3-іл)-1Н-піразол-5-амін одержують відповідно до методики, описаної в прикладі 1 стадії 3: МС (ESI) (m/z) 203 ([M+Н]). N-Метил-1-феніл-3-(піридин-3-іл)-1Н-піразол-5-амін одержують відповідно до методики, описаної в прикладі 1 стадії 3: МС (ESI) (m/z) 252 ([Μ+2H]). N-(Циклопропілметил)-1-метил-3-(піридин-3-іл)-1Н-піразол-5-амін одержують відповідно до методики, описаної в прикладі 1 стадії 3: МС (ESI) (m/z) 230 ([Μ+2Η]). 1-Ізопропіл-N-метил-3-(піридин-3-іл)-1Н-піразол-5-амін одержують відповідно до методики, описаної в прикладі 1 стадії 3: 1 Н ЯМР (300 МГц, CDCl3) δ 8,53 (с, 1H), 8,06–7,90 (м, J=7,2 Гц, 2H), 7,13 (дд, J=7,9, 5,6 Гц, 1H), 5,33 (с, 1H), 3,70 (ушир. с, 1H), 3,65 (дт, J=13,2, 6,6 Гц, 1H), 2,31 (с, 3H), 0,88 (д, J=6,6 Гц, 6H); МС (ESI) (m/z) 217 ([M+H]). 3-(5-Фторпіридин-3-іл)-N, 1-диметил-1Н-піразол-5-амін одержують відповідно до методики, описаної в прикладі 1 стадії 3: 1 Н ЯМР (300 МГц, CDCl3) δ 8,28 (с, 1H), 7,87 (т, J=1,3 Гц, 1H), 7,60 (м, 1H), 6,66 (с, 1H), 5,28 (ушир. с, 2H), 3,12 (с, 3H), 2,34 (с, 3H); МС (ESI) (m/z) 206 ([М+Н]). Приклад 2: Одержання (4-хлор-2-метил-5-піридин-3-іл-2Н-піразол-3-іл)метиламіну Суміш метил-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)аміну (0,35 г, 1,8 ммоль) і Nхлорсукциніміду (0,273 г, 2 ммоль) поєднують в ацетонітрилі (3 мл), перемішують при кімнатній температурі протягом 30 хвилин, концентрують при зниженому тиску й очищують хроматографією на силікагелі, елююючи з градієнтом EtOAc у гексанах, одержуючи зазначену в -1 заголовку сполуку у вигляді масла жовтого кольору (0,096 г, 23 %): ІЧ (тонка плівка) 1581,6 см ; 1 H ЯМР (400 МГц, CDCl3) δ 9,12 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,3 Гц, 1H), 8,15 (ддд, J=7,8, 2,0, 2,0 Гц, 1H), 7,33 (дд, J=8,1, 5,1 Гц, 1H), 3,80 (с, 3H), 2,91 (д, J=5,8 Гц, 3H); МС (ESI) (m/z) 225,6 [М+2]. У результаті реакції також одержують 4-хлор-2-метил-5-піридин-3-іл-2Н-піразол-3-іламін у -1 вигляді смоли зеленого кольору (0,046 г, 13 %): ІЧ (тонка плівка) 1720,5 см ; 1 H ЯМР (400 МГц, CDCl3) δ 9,13 (ушир. с, 1H), 8,57 (ушир. с, 1H), 8,16 (дт, J=8,0, 2,0 Гц, 1H), 7,33 (дд, J=7,8, 4,8 Гц, 1H), 3,76 (с, 3H); МС (ESI) (m/z) 207,0 [М-1]. Приклад 3: Одержання 2,N-диметил-N-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)-3метилсульфанілпропіонаміду (сполука 1) 21 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 До розчину метил-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)аміну (150 мг, 0,8 ммоль) в охолодженому на крижаній лазні дихлоретані (DCE, 2 мл) в атмосфері N 2 по краплях за допомогою піпетки додають розчин 2-метил-3-метилсульфанілпропіонілхлориду (146 мг, 0,9 ммоль) у DCE (1,5 мл). Після перемішування протягом 10 хвилин до суміші по краплях додають розчин 4-N, N-диметиламінопіридину (DMAP; 107 мг, 0,9 ммоль) у DCE (2 мл). Крижану лазню видаляють через 30 хвилин, і суміш перемішують при кімнатній температурі протягом 90 хвилин і потім кип'ятять зі зворотним холодильником протягом 14 годин. Суміш концентрують при зниженому тиску, і залишок очищують хроматографією на силікагелі, елююючи з градієнтом EtOAc у гексані. Продукт, 2,N-диметил-N-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)-3метилсульфанілпропіонамід, виділяють у вигляді напівтвердої речовини жовтого кольору (44 мг, 24 %): 1 H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,58 (с, 1H), 8,08 (ушир. д, J=7,0 Гц, 1H), 7,35 (ушир. дд, J=7,3, 4,8 Гц, 1H), 6,58 (ушир. с, 0,5 H), 6,49 (ушир. с, 0,5 H), 3,89-3,79 (м, 3H), 3,25 (с, 3H), 2,96-2,80 (м, 1H), 2,42-2,40 (м, 1H), 2,02-1,99 (м, 3H), 2,62 (м, 1H), 1,15 (д, J=6,0 Гц, 3H); МС (m/z) 305,0 [М+1]. Сполуки 2-6, 9-10, 12, 18-21, 24-33, 477, 487, 509, 520, 556-557, 562-568 одержують з відповідних амінів відповідно до методики, описаної в прикладі 3. Приклад 4: Одержання 1-метил-1-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)-3-(2метилсульфанілетил)сечовини (сполука 7) До розчину метил-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)аміну (150 мг, 0,8 ммоль) у крижаному DCE (2 мл) в атмосфері N2 додають розчин фосгену в толуолі (20 %, 0,43 мл, 0,88 ммоль). Крижану лазню видаляють через 30 хвилин, і суміш перемішують при кімнатній температурі протягом 1 години і потім кип'ятять зі зворотним холодильником протягом 2 годин. Суміш охолоджують до кімнатної температури і потім додають ще одну порцію фосгену (0,86 мл, 1,76 ммоль). Суміш перемішують при кип'ятінні зі зворотним холодильником протягом 90 хвилин, потім охолоджують на крижаній лазні. До отриманого розчину додають розчин 2метилтіоетиламіну (80 мг, 0,88 ммоль) у DCE (2 мл). Через 10 хвилин крижану лазню видаляють, реакційну суміш перемішують при кип'ятінні зі зворотним холодильником протягом 14 годин, охолоджують і розбавляють DCE (30 мл). Розведену реакційну суміш промивають насиченим NaHCО3 (20 мл), сушать над MgSО4, адсорбують на силікагель і очищують хроматографією на силікагелі, елююючи з градієнтом метанолу в дихлорметані, з одержанням 1-метил-1-(2-метил-5-піридин-3-іл-2Н-піразол-3-іл)-3-(2-метилсульфанілетил)сечовини у вигляді смоли жовтого кольору (14 мг, 6 %): 1 H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,5 Гц, 1H), 8,08 (ддд, J=8,1, 2,1, 2,1 Гц, 1H), 7,34 (дд, J=7,9, 4,8 Гц, 1H), 6,52 (с, 1H), 4,88 (ушир.т, J=5,5 Гц, 1H), 3,80 (с, 3H), 3,41 (кв, J=6,3 Гц, 2H), 3,24 (с, 3H), 2,61 (т, J=6,3, 2H), 2,06 (с, 3H); МС (ESI) (m/z) 292,2 [М+2]. Сполуку 8 одержують відповідно до методики, описаної в прикладі 4, але з використанням 2(метилтіо)етанолу замість 2-метилтіоетиламіну. Приклад 5: Одержання 1-метил-5-(піридин-3-іл)-1Н-піразол-3-аміну і 1-метил-3-(піридин-3іл)-1Н-піразол-5-аміну До етанолу (8,53 мл) додають 3-оксо-3-(піридин-3-іл)пропаннітрил (0,82 г, 5,61 ммоль) і метилгідразин (0,25 г, 5,61 ммоль) і отриману суміш перемішують при кип'ятінні зі зворотним холодильником протягом 2 годин. Реакційну суміш охолоджують до кімнатної температури і концентрують досуха. Сирий продукт очищують хроматографією на силікагелі, елююючи з градієнтом 0-20 % МеОН/дихлорметан, з одержанням двох продуктів: 1 1-метил-5-(піридин-3-іл)-1Н-піразол-3-аміну (0,060 м; 6,14 %): Н ЯМР (300 МГц, CDCl3) δ 8,72 (с, 1H), 8,53 (д, 1H), 7,76-7,63 (м, 1H), 7,43-7,33 (м, 1H), 5,75 (с, 1H), 3,76-3,57 (м, 5H); і 1 1-метил-3-(піридин-3-іл)-1Н-піразол-5-аміну (0,150 г, 15,35 %): H ЯМР (300 MГц, CDCl3) δ 8,88 (с, 1H), 8,48 (д, 1H), 7,99 (д, 1H), 7,38-7,07 (м, 1H), 585 (с, 1H), 3,80-3,59 (м, 5H). Приклад 6, стадія 1: Одержання 3-піразол-1-ілпіридину 22 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 До розчину 3-бромпіридину (5 г, 0,031 моль) у 50 мл ацетонітрилу в атмосфері N 2 додають піразол (2,6 г, 0,038 моль), Cs2CО3 (16,5 г, 0,050 моль), Cu2О (0,226 г, 0,0016 моль) і саліцилальдоксим (0,867 г, 0,006 моль). Реакційну масу кип'ятять зі зворотним холодильником протягом 24 годин при 80 °C. Реакційну масу концентрують, і неочищений продукт очищують колонковою хроматографією, використовуючи етилацетату:гексан (1:1), з одержанням зазначеного піразолілпіридину у вигляді рідини темно-коричневого кольору (2 г, 43 %): 1 H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=2,8 Гц, 1H), 8,48 (дд, J=4,8, 1,2 Гц, 1H), 8,11–8,08 (м, 1H), 7,99 (д, J=1,2 Гц, 1H), 7,78 (д, J=1,2 Гц, 1H), 7,38–7,35 (м, 1H), 6,53 (т, J=1,2 Гц, 1H); МС (m/z) 146 [М+1]. 3-(3-хлор-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадія 1: т. пл. 98-106 °C; 1 H ЯМР (400 MГц, CDCl3) δ 8,93 (д, J=2,6 Гц, 1H), 8,57 (дд, J=4,8, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,90 (д, J=2,5 Гц, 1H), 7,42 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 6,46 (д, J=2,5 Гц, 13 1H); C (ДМСО-d6) 148, 142, 140, 136, 131, 126, 125, 108. 2-Метил-3-(3-метил-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадія 1: 1 H ЯМР (400 MГц, CDCl3) δ 8,53 (д, J=4,7 Гц, 1H), 7,67 (д, J=7,9 Гц, 1H), 7,54 (т, J=8,0 Гц, 1H), 7,27-7,19 (м, 1H), 6,27 (д, J=1,4 Гц, 1H), 2,53 (с, 3H), 2,38 (с, 3H). 3-(3-(Трифторметил)-1Н-піразол-1-іл)піридин одержують з відповідних вихідних матеріалів відповідно до методики, описаної в прикладі 6, стадія 1: т. пл. 59,0-61,0 °C; 1 H ЯМР (400 MГц, CDCl3) δ 9,00 (с, 1H), 8,70-8,59 (м, 1H), 8,11 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,05-7,98 (м, 1H), 7,46 (дд, J=8,3, 4,8 Гц, 1H), 6,79 (д, J=2,4 Гц, 1H); МС (ESI) (m/z) 213. 3-Фтор-5-(3-метил-1Н-піразол-1-іл)піридин одержують з відповідних вихідних матеріалів відповідно до методики, описаної в прикладі 6, стадія 1: т. пл. 70,0-72,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,76-8,73 (м, 1H), 8,37-8,33 (м, 1H), 7,88-7,85 (м, 1H), 7,84-7,79 (м, 1H), 6,34-6,29 (м, 1H), 2,37 (с, 3H); МС (ESI) (m/z) 177. 3-(3-хлор-1Н-піразол-1-іл)-5-фторпіридин одержують з відповідних вихідних матеріалів відповідно до методики, описаної в прикладі 6, стадія 1: т. пл. 77,0-82,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,75 (д, J=1,8 Гц, 1H), 8,43 (д, J=2,3 Гц, 1H), 7,92 (д, J=2,6 Гц, 1H), 7,84 (дт, J=9,3, 2,4 Гц, 1H), 6,48 (д, J=2,6 Гц, 1H); МС (ESI) (m/z) 198. 3-(3-Метил-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадія 1: 1 H ЯМР (400 МГц, CDCl3) δ 8,94 (ушир. с, 1H), 8,51 (д, J=3,9 Гц, 1H), 8,02 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,90–7,79 (м, 1H), 7,39 (дд, J=8,2, 5,1 Гц, 1H), 6,30 (д, J=2,4 Гц, 1H), 2,39 (с, 3H). 3-(5-Метил-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадія 1: 1 H ЯМР (400 МГц, CDCl3) δ 8,77 (д, J=2,5 Гц, 1H), 8,65 (дд, J=4,8, 1,5 Гц, 1H), 7,84 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,63 (д, J=1,6 Гц, 1H), 7,44 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 6,225 (дд, J=1,6, 0,7 Гц, 1H), 2,40 (с, 3H). Приклад 6, стадія 2: Одержання 3-(4-нітропіразол-1-іл)піридину 3-Піразол-1-ілпіридин (2 г, 0,032 моль) розчиняють у концентрованій H 2SO4 (32 мл 0,598 ммоль) і охолоджують до -5 °C на крижаній лазні. До реакційної суміші по краплях протягом 30 хвилин додають суміш (1:1) концентрованої HNO 3 (30 мл, 0,673 ммоль) і концентрованої H2SO4 (30 мл, 15 об.). Охолодження видаляють, і реакційну суміш перемішують при кімнатній температурі протягом ночі. Після завершення реакції суміш виливають на дроблений лід і нейтралізують насиченим розчином NaHCО3, фільтрують, промивають водою і сушать, одержуючи в підсумку нітропіразол у вигляді твердої речовини блідо-жовтого кольору (1,8 г, 68 %): 1 H ЯМР (400 МГц, ДМСО-d6) δ 9,03 (д, J=2,8 Гц, 1H); 8,70 (дд, J=4,8, 1,6 Гц, 1H), 8,69 (с, 1H), 8,33 (с, 1H), 8,11-8,08 (м, 1H), 7,51 (дд, J=8,4, 4,8 Гц, 1H); МС (m/z) 191 [М+1]. 23 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 3-(3-Хлор-4-нітро-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадії 2: т. пл. 139-142 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,0 Гц, 1H), 8,73 (д, J=4,9 Гц, 2H), 8,08 (ддд, J=8,3, 2,5, 1,3 Гц, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H), МС (ESI) (m/z) 224. 3-(5-Метил-4-нітро-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадії 2: 1 H ЯМР (400 МГц, CDCl3) δ 8,81–8,71 (м, 2H), 8,32 (с, 1H), 7,83 (ддд, J=8,2, 2,5, 1,6 Гц, 1H), 7,54 (дд, J=8,2, 4,8 Гц, 1H), 2,72 (с, 3H). 2-Метил-3-(3-метил-4-нітро-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадії 2: 1 H ЯМР (400 МГц, ДМСО-d6) δ 14,01 (с, 1H), 9,37 (д, J=4,0 Гц, 1H), 8,69 (т, J=17,3 Гц, 1H), 13 8,21 (дд, J=7,7, 4,8 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H); C 154, 150, 146, 135, 134,9, 134,8, 134,3, 122, 21, 14; МС (ESI) (m/z) 218. 3-(3-Метил-4-нітро-1Н-піразол-1-іл)піридин одержують відповідно до методики, описаної в прикладі 6, стадії 2: т. пл. 122-124 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,77-8,56 (м, 2H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56-7,37 (м, 1H), 2,66 (с, 3H); МС (ESI) (m/z) 208. 3-Фтор-5-(3-метил-4-нітро-1Н-піразол-1-іл)піридин одержують з відповідних вихідних речовин відповідно до методики, описаної в прикладі 6, стадії 2: т. пл. 90,0-92,0 °C; 1 1 H ЯМР (400 МГц, CDCl3) δ H ЯМР (400 MГц, CDCl3) δ 8,82 (д, J=2,0 Гц, 1H), 8,69 (с, 1H), 8,54 (д, J=2,5 Гц, 1H), 7,89 (дт, J=8,9, 2,4 Гц, 1H), 2,66 (с, 3H); МС (ESI) (m/z) 222. 3-(4-Нітро-3-(трифторметил)-1Н-піразол-1-іл)піридин одержують з відповідних вихідних речовин відповідно до методики, описаної в прикладі 6, стадії 2: т. пл. 121,0-123,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,5 Гц, 1H), 8,79 (с, 1H), 8,77 (д, J=0,9 Гц, 1H), 8,13 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,55 (дт, J=10,8, 5,4 Гц, 1H); МС (ESI) (m/z) 258. 3-(3-Хлор-4-нітро-1Н-піразол-1-іл)-5-фторпіридин одержують з відповідних вихідних речовин відповідно до методики, описаної в прикладі 6, стадії 2: т. пл. 109,5-111,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,83 (д, J=2,1 Гц, 1H), 8,75 (с, 1H), 8,60 (д, J=2,4 Гц, 1H), 7,89 (дт, J=8,6, 2,4 Гц, 1H); МС (ESI) (m/z) 242. 3-(3-Бром-4-нітро-1Н-піразол-1-іл)піридин одержують із відповідних вихідних речовин відповідно до методики, описаної в прикладі 6, стадії 2: т. пл. 139,0-141,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,73 (дд, J=4,7, 1,1 Гц, 1H), 8,71 (с, 1H), + 8,15-8,00 (м, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H); МС (ESI) (m/z) 271 ([M+2] ). Приклад 6, стадія 3: Одержання 1-піридин-3-іл-1Н-піразол-4-іламіну До розчину 3-(4-нітропіразол-1-іл)піридину (1,8 г, 0,009 моль) у сухому ТГФ (18 мл) в атмосфері азоту додають 5 % Pd/C (180 мг). Потім суміш перемішують в атмосфері водню до завершення реакції. Реакційну суміш фільтрують через шар целіту і концентрують досуха з одержанням сирого продукту у вигляді твердої речовини темно-коричневого кольору (1,76 г): 1 H ЯМР (400 МГц, ДМСО-d6) δ 8,89 (дд, J=2,8, 0,4 Гц, 1H); 8,48 (дд, J=4,8, 1,2 Гц, 1H), 7,99– 7,96 (м, 1H), 7,54 (д, J=1,2 Гц, 1H), 7,45 (д, J=0,4 Гц, 1H), 7,38–7,35 (м, 1H), 4,81 (ушир. с, 1H); МС (ESI) (m/z) 161 [М+1]. 5-Метил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 6, стадія 3: 1 H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=2,3 Гц, 1H), 8,63-8,50 (м, 1H), 7,81 (ддд, J=8,2, 2,5, 1,5 13 Гц, 1H), 7,46-7,33 (м, 2H), 2,64 (ушир.с, 1H), 2,29 (с, 3H); C (ДМСО-d6) 147, 144, 137, 133, 130, 129, 124, 123, 10; МС (ESI) (m/z) 174. 3-Метил-1-(піримідин-5-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 6, стадія 3: т. пл. 211-215 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,10-8,87 (м, 3H), 7,51 (с, 1H), 3,24 (ушир. с, 2H), 2,29 (с, 3H); МС (ESI) (m/z) 176 ([M+H]). 3-Хлор-1-(піримідин-5-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в 1 прикладі 6, стадія 3: т. пл. 146-148 °C; H ЯМР (400 МГц, CDCl3) δ 9,07 (с, 1H), 9,02 (с, 2H), 7,52 (с, 1H), 3,45 (с, 2H), МС (ESI) (m/z) 196 ([M+H]). Приклад 7: Одержання метил-(1-піридин-3-іл-1Н-піразол-4-іл)аміну 24 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 Спосіб А: У круглодонну колбу об'ємом 25 мл, що містить 1-піридин-3-іл-1Н-піразол-4-іламін (1,76 г, 0,011 моль) у етанолі (26,4 мл) додають бензотриазол (1,31 г, 0,011 моль). Реакційну суміш охолоджують до 0 °C-10 °C, до суміші повільно додають формальдегід (0,36 мл, 0,0121 моль), і отриману суміш витримують протягом 30 хвилин при зазначеній температурі. Реакційну суміш фільтрують і концентрують досуха. Сирий продукт (2,56 г, 0,009 моль) розчиняють у сухому тетрагідрофурані (25,6 мл), охолоджують до 0 °C і до розчину протягом 15 хвилин додають борогідрид натрію (0,326 г, 0,00882 моль). Реакційну суміш нагрівають до кімнатної температури і перемішують протягом 2 годин. Реакційну суміш виливають у воду й екстрагують дихлорметаном, органічний шар сушать над безводним Na2SО4 і концентрують досуха. Сирий продукт очищують хроматографією на силікагелі, елююючи сумішшю 20 % метанол/хлороформ, з одержанням цільового продукту у вигляді твердої речовини коричневого кольору (0,610 г, 32 %): 1 H ЯМР (400 МГц, ДМСО-d6) δ 8,92 (д, J=2,4 Гц, 1H), 8,47 (дд, J=4,8, 1,6 Гц, 1H), 8,01-7,98 (м, 1H), 7,45 (с, 1H), 7,30 (с, 1H), 7,37 (дд, J=8,0, 4,4 Гц, 1H), 2,84 (с, 3H); МС (ESI) (m/z) 175 ([M+1]). Спосіб B: 1-піридин-3-іл-1Н-піразол-4-іламін (1,0 г, 6,2 ммоль) розчиняють у триетилортоформіаті (5 мл, 30 ммоль), і до отриманого розчину додають трифтороцтову кислоту (3-4 краплі). Реакційну суміш кип'ятять зі зворотним холодильником при 120 °C протягом 3 годин і потім концентрують. Сирий продукт розчиняють у етанолі (5 мл), охолоджують до 0 °C і обробляють борогідридом натрію (0,6 г, 15,7 ммоль). Після нагрівання до кімнатної температури суміш кип'ятять зі зворотним холодильником протягом 3 годин. Суміш концентрують, і залишок суспендують у суміші води і діетилового ефіру. Шар діетилового ефіру відокремлюють і концентрують досуха. Сирий продукт очищують хроматографією на силікагелі, елююючи сумішшю 5 % метанол/хлороформ, з одержанням цільового продукту у вигляді твердої речовини блідожовтого кольору (0,3 г, 27 %): т. пл. 65-67 °C; 1 Н ЯМР (300 МГц, CDCl3) δ 8,91 (ушир. с, 1H), 8,46 (д, J=4,5 Гц, 1H), 7,99 (д, J=8,3 Гц, 1H), 7,43 (с, 1H), 7,41 (с, 1H), 7,36 (дд, J=8,3, 4,7 Гц, 1H), 2,86 (д, J=12,4 Гц, 3H); МС (ESI) (m/z) 175 ([M+1]). Приклад 8: Одержання етил-(1-піридин-3-іл-1Н-піразол-4-іл)аміну Спосіб А: До 1-піридин-3-іл-1Н-піразол-4-іламіну (0,5 г, 3,12 ммоль) у дихлорметані (5 мл) послідовно додають ацетилхлорид (0,28 г, 3,75 ммоль) і DMAP (0,57 г, 4,68 ммоль) і перемішують при кімнатній температурі протягом 3 годин. Реакційну суміш концентрують і очищують колонковою хроматографією на силікагелі. Виділений продукт розчиняють у тетрагідрофурані (5 мл), додають алюмогідрид літію (0,23 г, 6,25 ммоль) і перемішують при кімнатній температурі протягом 12 годин. Реакцію гасять насиченим Na2SО4 і фільтрують через целіт. Фільтрат збирають і концентрують досуха. Сирий продукт очищують колонковою хроматографією на силікагелі, елююючи з градієнтом 0-5 % метанол/хлороформ, і отриманий продукт знову очищують хроматографією на силікагелі, елююючи з градієнтом 0-100 % етилацетат/гексани, одержуючи цільовий продукт (0,080 г, 14 %): 1 H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,7 Гц, 1H), 8,46 (дд, J=4,7, 1,3 Гц, 1H), 7,98 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,41 (дт, J=13,3, 6,6 Гц, 2H), 7,36 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,10 (кв, J=7,1 Гц, 2H), 1,27 (т, 3H). Спосіб B: До розчину трет-бутилетил-(1-(піридин-3-іл)-1Н-піразол-4-іл)карбамату (3,4 г, 11,79 ммоль) у дихлорметані (4,54 мл) додають трифтороцтову кислоту (9 мл), і реакційну суміш перемішують протягом 1 години при кімнатній температурі. До суміші додають толуол, і реакційну суміш концентрують майже досуха. Реакційну суміш виливають у ділильну лійку, і обережно гасять насиченим водним розчином NaHCО3 і екстрагують дихлоретаном. Органічний шар сушать 25 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 60 (MgSО4), фільтрують і концентрують досуха. Сирий продукт очищують хроматографією на силікагелі (0-10 % MeOH/дихлорметан) з одержанням цільового продукту у вигляді масла блідожовтого кольору (2,10 г, 95 %): 1 H ЯМР (400 МГц, CDCl3) δ 8,90 (дд, J=1,8, 0,8 Гц, 1H), 8,51-8,39 (м, 1H), 7,97 (ддт, J=8,3, 2,7, 1,3 Гц, 1H), 7,41 (д, J=0,8 Гц, 2H), 7,38-7,30 (м, 1H), 3,21-2,93 (м, 2H), 1,34-1,19 (м, 3H). 3-Хлор-N-етил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб B): 1 H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,2 Гц, 1H), 7,96 (ддд, J=8,4, 2,6, 1,4 Гц, 1H), 7,38-7,32 (м, 2H), 3,11 (кв, J=7,1 Гц, 2H), 2,97 (ушир. с, 1H), 1,31 (т, J=7,1 Гц, 3H). 3-Хлор-N-метил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 108-118 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,4 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,41-7,29 (м, 2H), 2,87 (с, 3H); МС (ESI) (m/z) 208. N, 3-диметил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб B): 1 H ЯМР (400 МГц, CDCl3) δ 9,03-8,73 (м, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,42-7,27 (м, 2H), 2,85 (с, 4H), 2,25 (с, 3H); МС (ESI) (m/z) 189. 3-хлор-N-(циклопропілметил)-1-(піридин-3-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб В): 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,03-7,89 (м, 1H), 7,40-7,29 (м, 2H), 3,21 (с, 1H), 2,91 (д, J=4,4 Гц, 2H), 1,18-1,02 (м, 1H), 0,65-0,45 (м, 2H), 0,41-0,12 (м, 2H). 3-Хлор-N-пропіл-1-(піридин-3-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб В): 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,01-7,89 (м, 1H), 7,42-7,27 (м, 2H), 3,23-2,84 (м, 3H), 1,77-1,59 (м, 2H), 1,03 (т, J=7,4 Гц, 3H). 1-(5-Фторпіридин-3-іл)-N, 3-диметил-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 142,0-143,5 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,26 (д, J=2,3 Гц, 1H), 7,73 (дт, J=10,0, 2,4 Гц, 1H), + 7,27 (с, 1H), 2,92-2,81 (м, 4H), 2,24 (с, 3H); МС (ESI) (m/z) 207 ([М+Н] ). N-Етил-1-(5-фторпіридин-3-іл)-3-метил-1Н-піразол-4-амін одержують з відповідного Bocаміну відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 85,0-86,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,66 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,72 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 3,07 (кв, J=7,1 Гц, 2H), 2,71 (с, 1H), 2,25 (с, 3H), 1,30 (т, J=7,1 Гц, 3H); МС (ESI) (m/z) + 221 ([М+Н] ). 3-Метил-N-пропіл-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 65,0-67,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 3,00 (т, J=7,1 Гц, 2H), 2,26 (с, 3H), 1,76-1,58 (м, 2H), 1,03 + (т, J=7,4 Гц, 3H); МС (ESI) (m/z) 217 ([М+Н] ). N-(Циклопропілметил)-3-метил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 73,0-75,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,3 Гц, 1H), 7,94 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 2,87 (д, J=6,9 Гц, 2H), 2,75 (с, 1H), 2,28 (с, 3H), 1,22-1,05 + (м, 1H), 0,63-0,56 (м, 2H), 0,26 (кв, J=4,7 Гц, 2H); МС (ESI) (m/z) 229 ([М+Н] ). N-ізопропіл-3-метил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну -1 відповідно до методики, описаної в прикладі 8 (спосіб B): ІЧ (тонка плівка) 3303 см ; 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,3 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,36-7,28 (м, 2H), 3,30 (гептет, J=6,3 Гц, 1H), 2,25 (с, 3H), 1,24 (д, J=6,3 Гц, 6H); МС (ESI) (m/z) 216. 5-Етокси-1-(5-фторпіридин-3-іл)-N, 3-диметил-1Н-піразол-4-амін одержують з відповідного -1 Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): ІЧ (тонка плівка) 3340 см ; 1 H ЯМР (400 МГц, CDCl3) δ 8,91 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,88-7,80 (м, 1H), 4,24 (кв, J=7,1 Гц, 2H), 2,79 (с, 3H), 2,24 (с, 3H), 1,36 (т, J=7,1 Гц, 3H); МС (ESI) (m/z) 250. 5-Бром-N-метил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 77,0-79,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,0 Гц, 1H), 8,63 (д, J=3,9 Гц, 1H), 7,93 (ддд, J=8,2, 2,4, 1,5 Гц, 1H), 7,51 (с, 1H), 7,43 (дд, J=8,2, 4,8 Гц, 1H), 4,49 (с, 1H), 2,91 (с, 3H); МС (ESI) (m/z) 255 + ([M+2] ). 26 UA 114611 C2 5 10 15 20 25 30 35 40 45 50 55 5-Фтор-N, 3-диметил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): 1 H ЯМР (400 МГц, CDCl3) δ 8,91 (т, J=2,1 Гц, 1H), 8,50 (дд, J=4,8, 1,5 Гц, 1H), 7,93 (ддт, J=8,3, 2,8, 1,5 Гц, 1H), 7,37 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,86 (д, J=1,6 Гц, 3H), 2,43 (с, 2H), 2,24 (с, 3H); МС (ESI) (m/z) 206. 5-Бром-N, 3-диметил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,5, 0,5 Гц, 1H), 8,59 (дд, J=4,8, 1,5 Гц, 1H), 7,88 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 2,85 (с, 3H), 2,69 (с, 1H), 2,35 (с, 3H); МС + (ESI) (m/z) 268 ([М+Н] ). 5-Хлор-N, 3-диметил-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб B): 1 H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,59 (дд, J=4,8, 1,3 Гц, 1H), 7,90 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,6 Гц, 1H), 2,87 (с, 3H), 2,45-2,19 (м, 4H); МС (ESI) (m/z) 223. 3-Хлор-1-(5-фторпіридин-3-іл)-N-метил-1Н-піразол-4-амін одержують з відповідного Bocаміну відповідно до методики, описаної в прикладі 8 (спосіб В): т. пл. 117,5-119,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=1,1 Гц, 1H), 8,33 (д, J=2,5 Гц, 1H), 7,75 (дт, J=9,6, 2,4 + Гц, 1H), 7,31 (с, 1H), 3,14 (с, 1H), 2,87 (с, 3H); МС (ESI) (m/z) 227 ([М] ). 3-Хлор-N-етил-1-(5-фторпіридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб В): 1 H ЯМР (400 МГц, CDCl3) δ 8,70-8,63 (м, 1H), 8,32 (д, J=2,4 Гц, 1H), 7,74 (дт, J=9,7, 2,4 Гц, 1H), 7,31 (с, 1H), 3,11 (кв, J=7,2 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H). 1-(5-Фторпіридин-3-іл)-N-метил-3-вініл-1Н-піразол-4-амін одержують з відповідного Bocаміну відповідно до методики, описаної в прикладі 8 (спосіб В): 105,0-107,0 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,72 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,8, 2,4 Гц, 1H), 7,33 (с, 1H), 6,75 (дд, J=18,0, 11,6 Гц, 1H), 5,83 (дд, J=18,0, 1,1 Гц, 1H), 5,46 (дд, J=11,6, 1,1 Гц, + 1H), 2,86 (с, 3H); МС (ESI) (m/z) 219 ([М+Н] ). 3-Циклопропіл-1-(5-фторпіридин-3-іл)-N-метил-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб В): т. пл. 118,0-119,5 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,66-8,58 (м, 1H), 8,23 (д, J=2,5 Гц, 1H), 7,75-7,68 (м, 1H), 7,25 (с, + 1H), 3,09 (с, 1H), 2,86 (с, 3H), 1,78-1,63 (м, 1H), 0,99-0,90 (м, 4H); МС (ESI) (m/z) 233 ([М+Н] ). 3-Хлор-1-(піридин-3-іл)-1Н-піразол-4-амін одержують з відповідного Boc-аміну відповідно до методики, описаної в прикладі 8 (спосіб В): т. пл. 137,9-139,9C; 1 H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); МС (ESI) (m/z) + 196 ([М+Н] ). 2-((3-Хлор-1-(піридин-3-іл)-1Н-піразол-4-іл)аміно)ацетонітрил одержують з трет-бутил-(3хлор-1-(піридин-3-іл)-1Н-піразол-4-іл)(ціанометил)карбамату відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 141-143 °C; 1 Н ЯМР (300 МГц, CDCl3) δ 8,91 (д, J=2,7 Гц, 1H), 8,54 (дд, J=5,1, 1,8 Гц, 1H), 7,97 (м, 1H), 7,62 (с, 1H), 7,38 (дд, J=12,0, 7,5 Гц, 1H), 4,97 (д, J=6,9 Гц, 2H), 3,52 (м, 1H); МС (ESI) (m/z) 235 + ([М+1] ). N-3-диметил-1-(піримідин-5-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 139-143 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,02 (с, 2H), 9,00 (с, 1H), 7,30 (с, 1H), 2,87 (д, J=11,5 Гц, 3H), 2,27 (с, 3H); МС (ESI) (m/z) 190 ([M+H]). 3-Хлор-N-метил-1-(піримідин-5-іл)-1Н-піразол-4-амін одержують відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 111-114 °C; 1 H ЯМР (400 МГц, CDCl3) δ 9,09-9,04 (м, 1H), 9,02 (с, 2H), 7,30 (с, 1H), 3,14 (ушир. с, 1H), 2,88 (с, 3H); МС (ESI) (m/z) 196 ([M+H]). 1-(5-Фтор-3-піридил)-3-метил-N-(тридейтеріометил)піразол-4-амін одержують зі сполуки 380 відповідно до методики, описаної прикладі 8 (спосіб B): т. пл. 146-148 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,73 (дт, J=10,0, 2,3 Гц, 1H), + -1 7,27 (с, 1H), 2,87 (с, 1H), 2,24 (с, 3H); МС (ESI) (m/z) 210 ([М+Н] ); ІЧ (тонка плівка) 1599 см . 3-Хлор-1-(3-піридил)-N-(тридейтеріометил)піразол-4-амін одержують зі сполуки 381 відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 104-106 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=1,9 Гц, 1H), 8,47 (д, J=4,7 Гц, 1H), 8,00-7,90 (м, 1H), + -1 7,40-7,30 (м, 2H), 3,10 (с, 1H); МС (ESI) (m/z) 212 ([М+Н] ); ІЧ (тонка плівка) 1579 см . 27 UA 114611 C2 5 10 15 20 25 30 35 40 45 3-Хлор-N-(циклопропілметил)-1-(піридин-3-іл)-1Н-піразол-4-амін одержують зі сполуки 361 відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 82-83 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,38-7,32 (м, 2H), 3,22 (с, 1H), 2,90 (д, J=6,9 Гц, 2H), 1,23-1,06 (м, 1H), + 0,65-0,53 (м, 2H), 0,31-0,19 (м, 2H); МС (ESI) (m/z) 249 ([М+Н] ); 3-Хлор-N-пропіл-1-(піридин-3-іл)-1Н-піразол-4-амін одержують зі сполуки 360 відповідно до методики, описаної в прикладі 8 (спосіб B): т. пл. 92-94 °C; 1 H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 7,33 (с, 1H), 3,22-2,94 (м, 3H), 1,75-1,52 + (м, 2H), 1,02 (т, J=7,4 Гц, 3H); МС (ESI) (m/z) 237 ([М+Н] ). Приклад 9: Одержання ізопропіл-(1-піридин-3-іл-1Н-піразол-4-іл)аміну 1-піридин-3-іл-1Н-піразол-4-іламін (0,6 г, 3,7 ммоль) розчиняють у ізопропілацетаті (8,5 мл). До суміші додають ацетон (0,261 г, 4,5 ммоль), трифтороцтову кислоту (0,855 г, 7,5 ммоль) і триацетоксиборогідрид натрію (0,945 г, 4,5 ммоль). Реакційну суміш перемішують в атмосфері азоту при кімнатній температурі протягом 4,5 годин, і потім гасять 10 % розчином гідроксиду натрію до досягнення рН значення ~9. Шари розділяють, і водну фазу екстрагують етилацетатом. Органічні екстракти поєднують, сушать над сульфатом натрію і концентрують досуха. Сирий продукт очищують хроматографією на силікагелі (елюювання з градієнтом 5 % метанол/дихлорметан) з одержанням зазначеної в заголовку сполуки у вигляді твердої не зовсім білої речовини (0,35 г, 46 %): т. пл. 105-107 °C; 1 Н ЯМР (300 МГц, CDCl3) δ 8,82 (д, J=2,2 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,13 (д, J=1,8 Гц, 1H), 8,03 (д, J=2,7 Гц, 1H), 7,94-7,77 (м, 1H), 7,38 (дт, J=15,2, 7,6 Гц, 1H), 6,99 (т, 1H), 3,72 (м, 1H), 1,30 (т, J=10,0 Гц, 6H). МС (ESI) 214 (m/z) (М+1). Приклад 10: Одержання пропіл-(1-піридин-3-іл-1Н-піразол-4-іл)-аміну До 1-піридин-3-іл-1Н-піразол-4-іламіну (0,5 г, 3,12 ммоль) у дихлорметані (5 мл) додають пропіоновий альдегід (0,18 г, 3,12 ммоль) і триацетоксиборогідрид натрію (0,99 г, 4,68 ммоль) і перемішують при кімнатній температурі протягом 16 годин. Реакційну суміш переносять у дихлорметан і промивають водою і насиченим розчином солі. Органічний шар сушать (MgSО 4), фільтрують і концентрують досуха. Сирий продукт очищують хроматографією на силікагелі, елююючи з градієнтом 0-5 % МеОН/дихлорметан, і знову піддають хроматографії на силікагелі, елююючи з градієнтом 0-100 % етилацетат/гексани, з одержанням зазначеної в заголовку сполуки у вигляді темного масла (0,05 г, 7 %): 1 Н ЯМР (300 МГц, CDCl3) δ 8,92 (д, J=2,6 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 8,00 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,47-7,40 (м, 2H), 7,37 (дд, J=8,3, 4,7 Гц, 1H), 3,04 (т, J=7,1 Гц, 3H), 1,921,46 (м, 2H), 1,03 (т, J=7,4 Гц, 3H). Приклад 11: Одержання N-метил-N-(1-піридин-3-іл-1Н-піразол-4-іл)ізобутираміду (сполука 42) Розчин ізобутирилхлориду (0,138 г, 1,3 ммоль) у дихлоретані (1 мл) піпеткою по краплях додають в охолоджену льодом суспензію метил-(1-піридин-3-іл-1Н-піразол-4-іл)аміну (0,15 г, 0,86 ммоль) у дихлоретані (5 мл), перемішують протягом 10 хвилин і потім обробляють розчином, що додається по краплях, 4-N, N-диметиламінопіридину (0,11 г, 0,9 ммоль) у дихлоретані (1,5 мл). Через 30 хвилин охолоджувальну лазню видаляють, перемішування продовжують в атмосфері азоту при кімнатній температурі протягом 14 годин, розбавляють 28
ДивитисяДодаткова інформація
Автори англійськоюNiyaz, Noormohamed M., Garizi, Negar, Zhang, Yu, Trullinger, Tony K., Hunter, Ricky, Buysse, Ann M., Kubota, Asako, Leplae, Paul Renee, Knueppel, Daniel, Lowe, Christian T., Pernich, Dan, Demeter, David A., Johnson, Timothy C.
Автори російськоюНияз Ноормохамед М., Гарицы Негар, Чжан Юй, Траллингер Тони К., Хантер Рики, Байсс Энн М., Кубота Асако, Лепла Поль Рене, Ньюэппел Дэниел, Лоу Кристиан Т., Перних Дэн, Деметер Дэвид А., Джонсон Тимоти К.
МПК / Мітки
МПК: A01N 43/80
Мітки: композиції, стосуються, пестицидні, способи
Код посилання
<a href="https://ua.patents.su/252-114611-pesticidni-kompozici-i-sposobi-shho-kh-stosuyutsya.html" target="_blank" rel="follow" title="База патентів України">Пестицидні композиції і способи, що їх стосуються</a>












