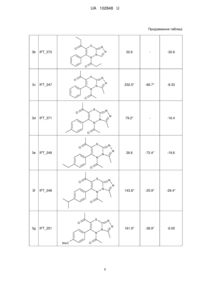
5,7-діацил-3-н(алкіл)-6-арил-5н-[1,2,4,]триазоло[3,4-b][1,3,4]тіадіазини, що проявляють анальгетичні властивості
Номер патенту: 102848
Опубліковано: 25.11.2015
Автори: Янченко Віктор Олексійович, Бобкова Людмила Станіславівна, Демченко Діана Анатоліївна, Ядловський Олег Євгенович, Демченко Анатолій Михайлович, Коваль Андрій Ярославович
Формула / Реферат
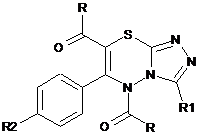
5,7-Діацил-3-Н(алкіл)-6-арил-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини формули:
 ,
,
де R=CH3, C2H5, H-C3H7; R1=H, CH3, С2Н5, цикло-С6Н11; R2 = Н, СН3, СН2СН3, СН(СН3)2, цикло-С6Н11, ОСН3, ОС2Н5, OCHF2, Сl, Вr, що проявляють анальгетичні властивості.
Текст
Реферат: 5,7-Діацил-3-Н(алкіл)-6-арил-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини формули: R S O N N N N R1 R2 O R , де R=CH3, C2H5, H-C3H7; R1=H, CH3, С2Н5, цикло-С6Н11; R2 = Н, СН3, СН2СН3, СН(СН3)2, циклоС6Н11, ОСН3, ОС2Н5, OCHF2, Сl, Вr, що проявляють анальгетичні властивості. UA 102848 U (12) UA 102848 U UA 102848 U 5 10 15 20 25 30 Корисна модель належить до фармацевтичної хімії та медицини, зокрема, одержання біологічно активних 5,7-діацил-3-Н(алкіл)-6-арил-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазинів, які виявляють анальгетичну активність і можуть стати основою для розробки нових анальгетичних засобів. Анальгетичні засоби (такі як морфін, кеторолак, анальгін) - це лікарські засоби, що застосовують для боротьби з болем. Анальгетики поділяються на наркотичні, що діють на ЦНС та, зазвичай, викликають звикання, наприклад, опіоїди, і на ненаркотичні, що діють на периферичні центри, знижуючи утворення простагландинів шляхом блокування циклооксигенази. При незначному болю та болю середньої інтенсивності застосовують ненаркотичні (неопіоїдні) анальгетики, такі, як анальгін, парацетамол, кеторолак, або їх поєднання з наркотичними анальгетиками з невисокою активністю, таких, як кодеїн, дигідрокодеїн та інші. Існують додаткові засоби, що посилюють дію анальгетиків. Препарати цієї групи самі по собі не є анальгетиками, але при болю використовуються у поєднанні з останніми, оскільки можуть змінювати ставлення до сприйняття болю, знижувати тривогу, страх та депресію. Такими засобами можуть бути психотропні препарати, а також ті, що діють на механізм больових відчуттів, наприклад, усувають спазми гладкої мускулатури. При сильному болю використовують високоактивні опіоїди, такі, як морфін [1]. Кеторолак - сполука з групи гетероциклічних похідних оцтової кислоти - є широко відомим знеболювальним нестероїдним протизапальним засобом та, зазвичай, використовується як анальгетик широкого спектру дії. Кеторолак може застосовуватися або у вигляді таблеток, або у вигляді розчину для внутрішньом'язових ін'єкцій, і є рацемічною сумішшю (S)-(-)-форми (активна) та (R)-(+)-форми [2]. Кеторолак пригнічує активність циклооксигенази (ЦОГ-1 та ЦОГ-2) та блокує синтез простагландинів. Подібно до інших анальгетиків, кеторолак проявляє ряд негативних побічних ефектів, а саме, з боку органів шлунково-кишкового тракту (діарея, нудота, гастралгія, диспепсія), з боку нервової системи (сонливість, головний біль, запаморочення) та інші. Також можливі прояви алергічних реакцій. В основу корисної моделі поставлене завдання пошуку нових біологічно активних нестероїдних сполук з анальгетичною активністю. Поставлене завдання вирішується тим, що в якості нових біологічно активних сполук запропоновано ряд 5,7-діацил-3-Н(алкіл)-6-арил-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазинів формули: R S O N N N N R1 R2 35 40 O R , де R = СН3, С2Н5, н-С3Н7; R1 = Н, СН3, С2Н5, цикло-С6Н11; R2 = Н, СН3, СН2СН3, СН(СН3)2, цикло-С6Н11, ОСН3, ОС2Н5, OCHF2, Cl, Вr, які виявляють анальгетичну активність. Заявлені сполуки отримують за загальною схемою кип'ятінням відповідних 3-R1-6-арил-7Н[1,2,4]триазоло[3,4-b]тіадіазинів 2 а-о з ангідридами аліфатичних кислот. Останні синтезують при конденсації 4-аміно-5-R1-4H-[1,2,4]триазол-3-тіолів 1 a-d [3-6] із заміщеними фенацилбромідами та подальшою обробкою проміжних гідробромідів триетиламіном [7-12]. Синтез 5,7-діацил-3-Н(алкіл)-6-арил-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазинів 3. 1 UA 102848 U N N S 1. ArCOCH2Br HS N R1 2. TEA N NH2 N N N (RCO)2O R1 R2 1 a-d 2 a-o R S O N N N N R1 R2 O R 3 5 10 15 20 25 30 35 40 , де 1-3 R=CH3, C2H5, н-С3Н7; R1=H, CH3, C2H5, цикло-С6Н11; R2=H, CH3, CH2CH3, CH(CH3)2, цикло-С6Н11, OCH3, OC2H5, OCHF2, Cl, Br. Первинну оцінку анальгетичної активності проведено на моделях термічної ("гаряча пластина") [13] та хімічної ("оцтовокислі корчі") [14] стимуляції. Дослідження виконані на білих нелінійних мишах-самках масою 20±2 г, розпліднених у віварії Державної установи "Інститут фармакології та токсикології Національної академії медичних наук України". Тварини утримувались на стандартному харчовому раціоні, отримували їжу та воду ad libitum. Тест-речовини (досліджувана речовина та речовина порівняння кеторолак) вводили тваринам у тест-дозі 25 мг/кг маси тіла внутрішньошлунково з використанням як розчинника водно-спиртової суміші (5 % спирту) з додаванням емульгатора 5 % твіну-20. Об'єм отриманої водно-спиртової емульсії, що вводилася тваринам, не перевищував 0,2 мл на тварину. Приклади конкретного виконання. 4-Аміно-4Н-[1,2,4]триазоліл-3-тіол 1а отримано за методом [3] взаємодією тіокарбогідразиду з формамідом, 4-аміно-5-метил(етил)-4Н-[1,2,4]триазоліл-3-тіоли 1b та 1с були одержані за методами [4, 5] взаємодією тіокарбогідразиду з відповідною кислотою. 4-Аміно-5-циклогексил4Н-[1,2,4]триазол-3-тіол 1d було одержано за методом [6] з гідразиду цикло-гексилкарбонової кислоти, CS2 та гідразину. 1 6-Феніл-7Н-[1,2,4]триазоло[3,4-b]тіадіазин 2а одержано за методом [7], 6-(4 -толіл)-7Н[1,2,4]триазоло[3,4-b]тіадіазин 2b одержано за методом [8], 3-метил-6-феніл-7Н1 [1,2,4]триазоло[3,4-b]тіадіазин 2с - за методом [9], 3-метил-6-(4 -метоксифеніл)-7Н1 [1,2,4]триазоло[3,4-b]тіадіазин 2d - за методом [10], 3-метил-6-(4 -хлорфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазин 2е - за методом [11], 3-етил-6-феніл-7Н-[1,2,4]триазоло[3,4b]тіадіазин 2f - за методом [12]. Інші заміщені 7Н-[1,2,4]триазоло[3,4-b]тіадіазин 2g-o були синтезовані за одним із вищенаведених методів та використані без додаткового очищення та ідентифікації. Приклад 1. Синтез 5,7-діацетил-6-феніл-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазину 3а: 3,0 г. (0,01 моля) 6-феніл-7Н-[1,2,4]триазоло[3,4-b]тіадіазину 2а кип'ятили в 10 мл оцтового ангідриду протягом 3 годин із зворотнім холодильником. Реакційну суміш охолоджували і виливали у воду. Продукт відфільтровували та перекристалізовували із ізопропанолу. Вихід 81 %. Тпл. = 1 111-2 °C. Спектр ЯМP Н, δ, м.ч. (CDCl3): 2.39 (с, 3Н, NCOCH3), 2.65 (с, 3Н, ССОСН3), 7.44-7.69 (м, 5Н, С6Н5), 8.32 (с, 1Н, 3-Н). Знайдено, %: N 18.3; S 10,5. C14H12N4O2S. Вирахувано, %: N 18,6; S 10,7. Приклад 2. Синтез 5,7-Дипропіоніл-6-феніл-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3b: 3,0 г. (0,01 моля) 6-феніл-7Н-[1,2,4]триазоло[3,4-b]тіадіазину 2а кип'ятили в 10 мл пропіонового ангідриду протягом 3 годин із зворотнім холодильником. Реакційну суміш охолоджували і виливали у воду. Продукт відфільтровували та перекристалізовували із ізопропанолу. Вихід 1 72 %. Тпл. = 118-9 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 1.05 (т, 3Н, СН3), 1.15 (т, 3Н, СН3), 2.64 (кв, 2Н, СН2), 3.04 (кв, 2Н, СН2), 7.46-7.69 (м, 5Н, С6Н5), 9.43 (с, 1Н, 3-Н). Знайдено, %: N 17,3; S 9,56. C16H16N4O2S. Вирахувано, %: N 17,1; S 9,74. 2 UA 102848 U 5 10 15 20 25 30 35 40 45 50 55 Приклад 3. 5,7-Діацетил-3-метил-6-феніл-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3с був одержаний згідно з прикладом 1 з 3-метил-6-феніл-7Н-[1,2,4]триазоло[3,4-b]тіадіазину та 1 оцтового ангідриду. Вихід 79 %. Тпл. = 151-2 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 2.34 (с, bН, NCOCH3), 2.57 (с, bН, ССОСН3), 2.67 (с, bН, 3-СН3), 7.48-7.71 (м, 5Н, С6Н5). Знайдено, %: N 17,9; S 10,1. C15H14N4O2S. Вирахувано, %: N 17,8; S 10,2. 1 Приклад 4. 5,7-Діацетил-3-метил-6-(4 -толіл)-5Н-[1,2,4]триазоло [3,4-b][1,3,4] тіадіазин 3d 1 був одержаний згідно з прикладом 1 з 3-метил-6-(4 -толил-7Н-[1,2,4]триазоло[3,4-b]тіадіазину та 1 оцтового ангідриду. Вихід 73 %. Тпл =°С. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 2.32 (с, 3Н, NCOCH3), 2.36 (с, 3Н, СН3), 2.56 (с, 3Н, ССОСН3), 2.66 (с, 3Н, 3-СН3), 7.30 і 7.57 (д-д, 4Н, С6Н4). Знайдено, %: N 17,0; S 9,68. C16H16N4O2S. Вирахувано, %: N 17,1; S 9,75. 1 Приклад 5. 5,7-Діацетил-3-метил-6-(4 -етилфеніл)-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 1 3е був одержаний згідно з прикладом 1 з 3-метил-6-(4 -етилфеніл)-7Н-[1,2,4]триазоло[3,41 b]тіадіазину та оцтового ангідриду. Вихід 78 %. Тпл. = 166-7 °C. Спектр ЯМР Н, δ, м.ч. (DMSOd6): 1.21 (т, 3Н, СН3), 2.33 (с, 3Н, NCOCH3), 2.56 (с, 3Н, ССОСН3), 2.66 (с, 3Н, 3-СН3), 2.67 (кв, 2Н, СН2), 7.33 і 7.60 (д-д, 4Н, С6Н4). Знайдено, %: N 16,5; S 9,49. C17H18N4O2S. Вирахувано, %: N 16,4; S 9,35. 1 Приклад 6. 5,7-Діацетил-3-метил-6-(4 -ізопропілфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3f був одержаний згідно з прикладом 1 з 3-метил-6-(4 -ізопропілфенил)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та оцтового ангідриду. Вихід 71 %. Тпл. = 161-2 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 1.23 (д, 6Н, 2СН3), 2.34 (с, 3Н, NCOCH3), 2.56 (с, 3Н, ССОСН3), 2.66 (с, 3Н, 3-СН3), 2.96 (м, 1Н, СН), 7.37 і 7.61 (д-д, 4Н, С6Н4). Знайдено, %: N 15,9; S 9,07. C18H20N4O2S. Вирахувано, %: N 15,7; S 8,97. 1 Приклад 7. 5,7-Діацетил-3-метил-6-(4 -метоксифеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3g був одержаний згідно з прикладом 1 з 3-метил-6-(4 -метоксифеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та оцтового ангідриду. Вихід 85 %. Тпл. = 178-9 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 2.33 (с, 3Н, NCOCH3), 2.56 (с, 3Н, ССОСН3), 2.66 (с, 3Н, 3-СН3), 3.81 (с, 3Н, ОСН3), 7.05 і 7.63 (д-д, 4Н, С6Н4). Знайдено, %: N 16,2; S 9,21. C16H16N4O3S. Вирахувано, %: N 16,3; S 9,29. 1 Приклад 8. 5,7-Діацетил-3-метил-6-(4 -хлорфеніл)-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 1 3h був одержаний згідно з прикладом 1 з 3-метил-6-(4 -хлорфеніл)-7Н-[1,2,4]триазоло[3,41 b]тіадіазину та оцтового ангідриду. Вихід 84 %. Тпл. = 142-3 °C. Спектр ЯМР Н, δ, м.ч. (DMSOd6): 2.35 (с, 3Н, NCOCH3), 2.57 (с, 3Н, ССОСН3), 2.67 (с, 3Н, 3-СН3), 7.57 і 7.71 (д-д, 4Н, С6Н4). Знайдено, %: N 16,3; S9,22. C15H13ClN4O2S. Вирахувано, %: N 16,1; S 9,17. 1 Приклад 9. 5,7-Діацетил-3-метил-6-(4 -дифторметоксифеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3і був одержаний згідно з прикладом 1 з 3-метил-6-(4 -дифторметоксифеніл)7Н-[1,2,4]триазоло[3,4-b]тіадіазину та оцтового ангідриду. Вихід 73 %. Тпл =123-4 °C. Спектр 1 ЯМР Н, δ, м.ч. (DMSO-d6): 2.34 (с, 3Н, NCOCH3), 2.57 (с, 3Н, ССОСН3), 2.67 (с, 3Н, 3-СН3), 7.34 (т, 1Н, OCHF2, J=72.4 Гц), 7.30 і 7.76 (д-д, 4Н, С6Н4). Знайдено, %: N 14,8; S 8,49. C16H14F2N4O3S. Вирахувано, %: N 14,7; S 8,41. 1 Приклад 10. 5,7-Діацетил-3-метил-6-(4 -циклогексилфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3j був одержаний згідно з прикладом 1 з 3-метил-6-(4 -циклогексилфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та оцтового ангідриду. Вихід 76 %. Тпл =142-3 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 1.25-1.82 (м, 10Н, (СН2)5), 2.34 (с, 3Н, NCOCH3),2.56 (с, 3Н, ССОСН3), 2.66 (с, 3Н, 3-СН3), 7.34 і 7.61 (д-д, 4Н, С6Н4). Знайдено, %: N 14,3; S 8,22. C21H24N4O2S. Вирахувано, %: N 14,1; S 8,07. Приклад 11. 5,7-Діацетил-3-етил-6-феніл-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3k був одержаний згідно з прикладом 1 з 3-етил-6-феніл-7Н-[1,2,4]триазоло[3,4-b]тіадіазину та 1 оцтового ангідриду. Вихід 74 %. Тпл = 113-4 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 1.44 (т, 3Н, СН3), 2.35 (с, 3Н, NCOCH3), 2.58 (с, 3Н, ССОСН3), 3.08 (кв., 2Н, СН2), 7.48-7.70 (м, 5Н, С6Н5). Знайдено, %: N 17,0; S 9,61. C16H16N4O2S. Вирахувано, %: N 17,1; S 9,74. Приклад 12. 5,7-Діацетил-3-циклогексил-6-феніл-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3l був одержаний згідно з прикладом 1 з 3-цикло-гексил-6-феніл-7Н-[1,2,4]триазоло[3,41 b]тіадіазину та оцтового ангідриду. Вихід 76 %. Тпл =138-9 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 1.28-2.21 (м, 10Н, (СН2)5), 2.33 (с, 3Н, NCOCH3), 2.56 (с, 3Н, ССОСН3), 3.21 (с, 1Н, СН), 7.45-7.68 (м, 5Н, С6Н5). Знайдено, %: N 14,4; S 8,23. C20H22N4O2S. Вирахувано, %: N 14,6; S 8,37. 1 Приклад 13. 5,7-Дипропіоніл-6-(4 -толіл)-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3m був 1 одержаний згідно з прикладом 2 з 6-(4 -толіл)-7Н-[1,2,4]триазоло[3,4-b]тіадіазину та 1 пропіонового ангідриду. Вихід 69 %. Тпл = 119-21 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 1.06 (т, 3Н, СН3), 1.15 (т, 3Н, СН3), 2.36 (с, 3Н, СН3), 2.64 (кв, 2Н, СН2), 3.03 (кв, 2Н, СН2), 7.30 і 7.57 (д-д, 3 UA 102848 U 5 10 15 20 25 30 35 40 45 50 55 60 4Н, С6Н4), 9.40 (с, 1Н, 3-Н). Знайдено, %: N 16,2; S 9,27. C17H18N4O2S. Вирахувано, %: N 16,3; S 9,35. 1 Приклад 14. 5,7-Дипропіоніл-3-метил-6-(4 -хлорфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3n був одержаний згідно з прикладом 2 з 3-метил-6-(4 -хлорфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та пропіонового ангідриду. Вихід 72 %. Тпл = 146-7 °C. Спектр 1 ЯМР Н, δ, м.ч. (DMSO-d6): 1.06 (т, 3Н, СН3), 1.14 (т, 3Н, СН3), 2.64 (кв, 2Н, СН2), 2.67 (с, 3Н, 3СН3), 2.99 (кв, 2Н, СН2), 7.57 і 7.71 (д-д, 4Н, С6Н4). Знайдено, %: N 14,7; S 8,38. C17H17ClN4O2S. Вирахувано, %: N 14,9; S 8,49. 1 1 Приклад 15. 5,7-Дипропіоніл-3 -метил-6-(3 ,4 -диметоксифеніл)-5Н-[1,2,4]триазоло[3,41 1 b][1,3,4]тіадіазин 3о був одержаний згідно з прикладом 2 з 3-метил-6-(3 ,4 -диметоксифеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та пропіонового ангідриду. Вихід 79 %. Тпл = 141-2 °C. Спектр 1 ЯМР Н, δ, м.ч. (DMSO-d6): 1.06 (т, 3Н, СН3), 1.15 (т, 3Н, СН3), 2.64 (кв, 2Н, СН2), 2.68 (с, 3Н, 3СН3), 2.99 (кв, 2Н, СН2), 3.77 (с, 3Н, ОСН3), 3.82 (с, 3Н, ОСН3), 7.04 і 7.28 (д-д, 4Н, С6Н4). Знайдено, %: N 14,0; S 8,04. C19H22N4O4S. Вирахувано, %: N 13,9; S 7,95. 1 Приклад 16. 5,7-Дипропіоніл-3-метил-6-(4 -ізопропілфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3р був одержаний згідно з прикладом 2 з 3-метил-6-(4 -ізопропілфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та пропіонового ангідриду. Вихід 77 %. Тпл = 110-11 °C. Спектр 1 ЯМР Н, δ, м.ч. (DMSO-d6): 1.06 (т, 3Н, СН3), 1.14 (т, 3Н, СН3), 1.24 (д, 6Н, 2СН3), 2.63 (кв, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.95 (м, 1Н, СН), 2.99 (кв, 2Н, СН2), 7.35 і 7.62 (д-д, 4Н, С6Н4). Знайдено, %: N 14,5; S 8,27. C20H24N4O2S. Вирахувано, %: N 14,6; S 8,32. Приклад 17. 5,7-Дибутироніл-3-метил-6-феніл-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3q: 3,0 г. (0,01 моля) 6-фенил-7Н-[1,2,4]триазоло[3,4-b]тіадіазину 2а кип'ятили в 10 мл масляного ангідриду протягом 3 годин із зворотнім холодильником. Реакційну суміш охолоджували і виливали у воду. Продукт відфільтровували та перекристалізовували із ізопропанолу. Вихід 1 69 %. Тпл. = 93-4 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 0.86 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.56 (м, 2Н, СН2), 1.68 (м, 2Н, СН2), 2.60 (т, 2Н, СН2), 2.67 (с, 3Н, 3-СН3), 2.96 (т, 2Н, СН2), 7.47-7.69 (м, 5Н, С6Н5). Знайдено, %: N 15,2; S 8,76. C19H22N4O2S. Вирахувано, %: N 15,1; S 8,64. 1 Приклад 18. 5,7-Дибутироніл-3-метил-6-(4 -толіл)-5Н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазин 3r 1 був одержаний згідно з прикладом 17 з 3-метил-6-(4 -толіл)-7Н-[1,2,4]триазоло[3,4-b]тіадіазину 1 та масляного ангідриду. Вихід 71 %. Тпл = 108-9 °C. Спектр ЯМР Н, δ, м.ч. (DMSO-d6): 0.86 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.56 (м, 2Н, СН2), 1.67 (м, 2Н, СН2), 2.36 (с, 3Н, СН3), 2.60 (т, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.97 (т, 2Н, СН2), 7.28 і 7.57 (д-д, 4Н, С6Н4). Знайдено, %: N 14,5; S 8,23. C20H24N4O2S. Вирахувано, %: N 14,6; S 8,32. 1 Приклад 19. 5,7-Дибутироніл-3-метил-6-(4 -етилфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3s був одержаний згідно з прикладом 17 з 3-метил-6-(4 -етилфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 66 %. Т пл = 107-8 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 0.86 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.21 (т, 3Н, СН3), 1.55 (м, 2Н, СН2), 1.68 (м, 2Н, СН2), 2.50 (кв, 2Н, СН2), 2.59 (м, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.95 (т, 2Н, СН2), 7.31 і 7.59 (д-д, 4Н, С6Н4). Знайдено, %: N 14,3; S 8,12. C21H26N4O2S. Вирахувано, %: N 14,1; S 8,03. 1 Приклад 20. 5,7-Дибутироніл-3-метил-6-(4 -ізопропілфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3t був одержаний згідно з прикладом 17 з 3-метил-6-(4 -ізопропілфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 70 %. Т пл =121-2 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 0.85 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.23 (д, 6Н, 2СН3), 1.56 (м, 2Н, СН2), 1.67 (м, 2Н, СН2), 2.60 (м, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.95 (м, 3Н, СН+СН2), 7.34 і 7.60 (д-д, 4Н, С6Н4). Знайдено, %: N 13,7; S 7,75. C22H28N4O2S. Вирахувано, %: N 13,6; S 7,76. 1 Приклад 21. 5,7-Дибутироніл-3-метил-6-(4 -метоксифеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3u був одержаний згідно з прикладом 17 з 3-метил-6-(4 -метоксифеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 73 %. Т пл = 120-1 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 0.86 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.57 (м, 2Н, СН2), 1.67 (м, 2Н, СН2), 2.59 (м, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.95 (т, 2Н, СН2), 3.81 (с, 3Н, ОСН3), 7.03 і 7.63 (д-д, 4Н, С6Н4). Знайдено, %: N 14,1; S 8,06. C20H24N4O3S. Вирахувано, %: N 14,0; S 7,99. 1 Приклад 22. 5,7-Дибиутіроніл-3-метил-6-(3 -метоксифеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3v був одержаний згідно з прикладом 17 з 3-метил-6-(3 -метоксифеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 67 %. Тпл = 91-2 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 0.87 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.58 (м, 2Н, СН2), 1.67 (м, 2Н, СН2), 2.60 (м, 2Н, СН2), 2.67 (с, 3Н, 3-СН3), 2.96 (т, 2Н, СН2), 3.80 (с, 3Н, ОСН3), 7.03-7.42 (м, 4Н, С6Н4). Знайдено, %: N 13,9; S 7,87. C20H24N4O3S. Вирахувано, %: N 14,0; S 7,99. 1 1 Приклад 23. 5,7-Дибутироніл-3-метил-6-(3 ,4 -диметоксифеніл)-5Н-[1,2,4]триазоло[3,41 1 b][1,3,4]тіадіазин 3w був одержаний згідно з прикладом 17 з 3-метил-6-(3 ,4 -диметоксифеніл)7Н-[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 66 %. Тпл = 128-9 °C. Спектр 4 UA 102848 U 1 5 10 15 20 25 30 35 ЯМР Н, δ, м.ч. (DMSO-d6): 0.87 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.55 (м, 2Н, СН2), 1.68 (м, 2Н, СН2), 2.61 (м, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.95 (т, 2Н, СН2), 3.79 (с, 3Н, ОСН3), 3.81 (с, 3Н, ОСН3), 7.03-7.26 (м, 3Н, С6Н3). Знайдено, %: N 13,1; S 7,51. C21H25N4O4S. Вирахувано, %: N 13,0; S 7,43. 1 Приклад 24. 5,7-Дибутироніл-3-метил-6-(4 -етоксифеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3х був одержаний згідно з прикладом 17 з 3-метил-6-(4 -етоксифеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 71 %. Т пл = 128-30 °C. Спектр 1 ЯМР Н, δ, м.ч. (DMSO-d6): 0.87 (т, 3Н, СН3), 0.96 (т, 3Н, СН3), 1.36 (т, 3Н, СН3), 1.57 (м, 2Н, СН2), 1.68 (м, 2Н, СН2), 2.60 (м, 2Н, СН2), 2.66 (с, 3Н, 3-СН3), 2.95 (т, 2Н, СН2), 4.08 (кв, 2Н, СН2), 7.01 і 7.62 (д-д, 4Н, С6Н4). Знайдено, %: N 13,4; S 7,68. C21H26N4O3S. Вирахувано, %: N 13,5; S 7,72. 1 Приклад 25. 5,7-Дибутироніл-3-метил-6-(4 -хлорфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3у був одержаний згідно з прикладом 17 з 3-метил-6-(4 -хлорфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 78 %. Т пл = 129-30 °C. Спектр 1 ЯМР Н, δ, м.ч. (DMSO-d6): 0.86 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.56 (м, 2Н, СН2), 1.67 (м, 2Н, СН2), 2.60 (м, 2Н, СН2), 2.67 (с, 3Н, 3-СН3), 2.96 (т, 2Н, СН2), 7.55 і 7.71 (д-д, 4Н, С6Н4). Знайдено, %: N 13,9; S 7,98. C19H21ClN4O2S. Вирахувано, %: N 13,8; S 7,90. 1 Приклад 26. 5,7-Дибутироніл-3-метил-6-(4 -бромфеніл)-5Н-[1,2,4]триазоло[3,41 b][1,3,4]тіадіазин 3z був одержаний згідно з прикладом 17 з 3-метил-6-(4 -бромфеніл)-7Н[1,2,4]триазоло[3,4-b]тіадіазину та масляного ангідриду. Вихід 75 %. Т пл = 125-6 °C. Спектр ЯМР 1 Н, δ, м.ч. (DMSO-d6): 0.86 (т, 3Н, СН3), 0.95 (т, 3Н, СН3), 1.56 (м, 2Н, СН2), 1.68 (м, 2Н, СН2), 2.60 (м, 2Н, СН2), 2.67 (с, 3Н, 3-СН3), 2.96 (т, 2Н, СН2), 7.63 і 7.71 (д-д, 4Н, С6Н4). Знайдено, %: N 12,3; S 6,98. C19H21BrN4O2S. Вирахувано, %: N 12,5; S 7,12. Приклад 27. У тесті "гарячої пластини" на приладі Hot-plate metter (Ugo Basile, Італія) тестування проводили на мишах (по 5 у групі), у яких вихідне значення латентного періоду реакції "облизування" лапки не перевищувало 20 с. Латентний період реакції в секундах вимірювали через 1 год. після введення тест-речовин. Розраховували процент зміни до вихідного латентного періоду реакції в кожній групі. Моделювання вісцерального болю проводили шляхом внутрішньоочеревинного введення мишам 0,6 % розчину оцтової кислоти із розрахунку 0,1 мл/10 г маси тіла через 1 год. після введення тваринам тест-речовин (дослідні групи, по 7 мишей у групі) або розчинника (контрольна група, 10 мишей в групі). Підрахунок кількості "корчів" проводили з 5 по 15 хв після введення оцтової кислоти. Вираховували процент інгібіції числа "корчів" у дослідних групах відносно контролю. Статистичну обробку отриманих результатів здійснювали за методом Стьюдента. Достовірними вважали зміни при Р
ДивитисяДодаткова інформація
Назва патенту англійською5,7-diacyl-3-h(alkyl)-6-aryl-5h-[1,2,4]triazolo[3,4-b][1,3,4]thiadiazines exhibiting analgetic properties
Автори англійськоюDemchenko Anatolii Mykhailovych, Yadlovskyi Oleh Yevhenovych, Koval Andrii Yaroslavovych, Bobkova Liudmyla Stanislavivna, Yanchenko Viktor Oleksiiovych, Demchenko Diana Anatoliivna
Назва патенту російською5,7-диацил-3-н(алкил)-6-арил-5н-[1,2,4,]триазоло[3,4-b][1,3,4]тиадиазины, которые проявляют анальгетические свойства
Автори російськоюДемченко Анатолий Михайлович, Ядловский Олег Евгениевич, Коваль Андрей Ярославич, Бобкова Людмила Станиславовна, Янченко Виктор Алексеевич, Демченко Диана Анатолиевна
МПК / Мітки
МПК: A61K 31/41, C07D 417/00, C07B 43/04, A61P 25/04
Мітки: анальгетичні, властивості, проявляють, 5,7-діацил-3-н(алкіл)-6-арил-5н-[1,2,4,]триазоло[3,4-b][1,3,4]тіадіазини
Код посилання
<a href="https://ua.patents.su/13-102848-57-diacil-3-nalkil-6-aril-5n-124triazolo34-b134tiadiazini-shho-proyavlyayut-analgetichni-vlastivosti.html" target="_blank" rel="follow" title="База патентів України">5,7-діацил-3-н(алкіл)-6-арил-5н-[1,2,4,]триазоло[3,4-b][1,3,4]тіадіазини, що проявляють анальгетичні властивості</a>
Попередній патент: Чесальна установка з системою радіочастотної ідентифікації тварин
Наступний патент: Спосіб дугового зварювання
Випадковий патент: Пристрій для автоматичного керування процесом відцентрового лиття труб