Спосіб одержання 5-трифторметил-5,6-дигідро-7н-[1,2,4]триазоло[5,1-b] [1,3,5]-тіадіазин-7-онів
Номер патенту: 27173
Опубліковано: 25.10.2007
Автори: Вовк Михайло Володимирович, Толмачова Валентина Сергіївна
Формула / Реферат
Спосіб одержання 5-трифторметил-5,6-дигідро-7Н-[1,2,4]триазоло[5,1-b][l,3,5]тіадіазин-7-онів загальної формули:
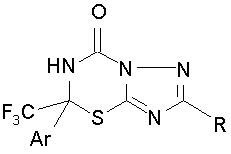 ,
,
де R=H, Et, цикло-С3Н5, C6H5, 4-BrC6H5, 4-EtC6H4, 4-ClC6H4OCH2, 2-тієніл,
Ar=Ph, 4-FC6H4, 4-MeC6H4, 4-MeOC6H4,
який відрізняється тим, що 1,2,4-триазол-5-тіони піддають взаємодії з 1-арил-1-хлор-2,2,2-трифторетилізоціанатами при 110 °С в органічному розчиннику в толуолі в присутності триетиламіну з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання 5-трифторметил-5,6дигідро-7Н-[1,2,4]триазоло[5,1-b][l,3,5]тіадіазин-7онів загальної формули: [1,3,5] 3 27173 біс(трихлорометил)карбонатом (трифосгеном) [2]. Окрім цього, відомий метод має суттєві синтетичні обмеження і не дає змоги вводити в положення 5 біциклічної системи замісники, які відіграють істотну роль в наданні органічній молекулі ліпофільності та метаболічної стабільності [5]. До них, зокрема, відноситься трифторметильна група, наявність якої сприяє полегшенню сорбції та транспортуванню молекул в середині біологічних систем і таким чином поліпшує фармакокінетичні властивості речовин, які є кандидатами в лікарські препарати. Задачею корисної моделі є пошук нових трифторметилвмісних похідних [1,2,4]триазоло[1,5-b][1,3,5]тіадіазину загальної формули: O HN N N F3C S N R Ar де R=H, Et, цикло-С3Н5, С6Н5, 4-BrC6H5, 4EtC6H4, 4-СlС6Н4ОСН2, 2-тієніл; Ar=Ph, 4-FC6H4, 4-MeC6H4, 4-MeOC6H4 Спосіб отримання сполук, які заявляються, полягає в тому, що 1,2,4-триазоло-5-тіони піддають взаємодії з 1-арил-1-хлор-2,2,2трифторетилізоціа-натами в толуолі при 110°С в присутності триетиламіну. Цільові продукти відділяють з реакційної суміші стандартними методами. Виходи становлять 68-87%. O Ar N HN S N H + N=C=O F3C R Et3N, 110oC HN F3C Ar Cl N S N N R де R=H, Et, циклo-С3Н5, С6Н5, 4-BrC6H5, 4EtC6H4, 4-СlС6Н4ОСН2, 2-тієніл; Ar=Ph, 4-FC6H4, 4-MeC6H4, 4-MeOC6H4 Такий підхід відкриває шлях до сполук, які можуть знайти практичне застосування як агрохімічні або фармацевтичні препарати, а також, завдяки наявності в 1,3,5-тіадіазиновому циклі схильного до модифікації карбамоїльного фрагмента, як вихідні речовини в синтезі раніше не відомих типів сполук. Отриманий результат не є заздалегідь передбачуваним, оскільки, виходячи із біцентрового характеру як 1-хлоралкілізоціанатів [6], так і 1,2,4-триазоло-5-тіонів [7,8], можна було очікувати утворення окрім цільових сполук регіоізомерних до них 7-трифторметил-6,7дигідро-5Н-[1,2,4]триазоло[5,1-b][1,3,5]тіадіазин-5онів формули: F3C HN O Ar N S N N R або їх суміші з цільовими сполуками. 4 Одначе, дані вимірів спектрів ЯМР 19F (наявність сигналу CF3-гpyпи в інтервалі - 74 - 75м.ч.) однозначно підтверджують утворення 1,3,5-тіадіазин-7-онової структури, в якій CF3-гpyпa зв'язана з атомом вуглецю тріади N-C-S [9], а не N-C-N [10]. Такий перебіг процесу циклоконденсації, найімовірніше, пов'язаний з тим, що на першій стадії взаємодії відбувається алкілування більш нуклеофільного екзоциклічного атома сірки 1,2,4-триазол-5-тіону, а не атома азоту в положенні 1 циклу, що узгоджується з результатами взаємодії 1-хлоралкілізоціанатів з іншими типами N,S-бінуклеофільних реагентів [9, 13]. Будова та склад всіх отриманих 5трифторметилвмісних [1,2,4]триазоло[5,1b][1,3,5]тіадіазин-7-онів доведені даними елементного аналізу, ІЧ-спектрів ( поглинання зв'язків С=О та N-H), спектрів ЯМР 1Н та ЯМР 19F. Корисна модель ілюструється загальним методом отримання 5-трифторметил-5,6-дигідро7Н-[1,2,4]триазоло[5,1-b][1,3,5]тіадіазин-7-онів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 5-трифторметил5,6-дигідро-7Н-[1,2,4]триазоло[5,1b][1,3,5]тіадіазин-7-онів. До суміші 50ммоль 1,2,4-триазол-5-тіону та 50ммоль 1-арил-1-хлор-2,2,2трифторетилізоціанату в 40мл толуолу додають при перемішуванні розчин 0,7мл (50ммоль) триетиламіну в 10мл толуолу. Реакційну суміш кип’ятять при перемішуванні впродовж 2год, охолоджують, а затим випарують досуха. До залишку додають 50мл води, осад відфільтровують, висушують і кристалізують із 80%-ного водного етанолу. Приклад 1 2,5-Дифеніл-5-трифторметил-5,6-дигідро-7Н[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7-он. Вихід 68%, т.пл. 220-221°С. Знайдено, %: С 54,02; Н 3,14; N 12,03. Вирахувано, %: 54,25; Н 2,95; N 11,89. C17H11F3N4OS. ІЧ-спектр (КВr):1745 (C=О), 3270 (N-H). Спектр ЯМР 1Н (ДМСО-d6): Спектр ЯМР 19F (ДМСО-d6): -74,57 с (CF3). Приклад 2 2-(4-Бромфеніл)-5-трифторметил-5-феніл-5,6дигідро-7Н-[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7он. Вихід 87%, т.пл. 287-289°С. Знайдено, %: С 44,53; Н 2,35; N 12,26. Вирахувано, %: С 44,85; Н 2,21; N 12,31. C17H10F3N4OS. ІЧ-спектр (КВr): 1745 (С=О ), 3260 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 7,55-7,95м (9Наром.), 10,94 с (1H,NH). Спектр ЯМР 19 F (ДМСО-d6): -74.09 с (CF3). Приклад 3 2-(Тієніл-2)-5-трифторметил 5-феніл-5,6дигідро-7Н-[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7он. Вихід 74%, т.пл. 232-233°С. Знайдено, %: С 46,89; Н 2,52; N 14,60. C15H9F3N4OS2. Вирахувано, %: С 47,12; Н 2,37; 14,65. ІЧ-спектр (КВr): 1750 (С=O), 3260 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 7,17 (1Hаром.), 7,54-7,81м (7Наром.), 10,94 с (1H,NH). Спектр ЯМР 19F (ДМСО-d6): -74.59 с (CF3). Приклад 4 5 5-Трифторметил-5-(4-фторфеніл)-5,6-дигідро7Н-[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7-он. Вихід 79%, т.пл. 189-190°С. Знайдено, %: С 41,79; Н 2,08. N 17,45. С11Н6F4N4OS. Вирахувано, %: С 41,51; Н 1,90; N 17,61. ІЧ-спектр (КВr): 1755 (С=О), 3255 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 7,34 т (2Наром.), 7,82-7,86 м (2Наром.), 8,23 с (1Нтриазол), 10,88 с (1H,NH). Спектр ЯМР 19F (ДМСО-d6): -74,87 с (CF3). Приклад 5 2-Етил-5-трифторметил-5-(4-фторфеніл)-5,6дигідро-7Н-[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7он. Вихід 83%, т.пл. 186-187°С. Знайдено, %: С 45,33; Н 2,84; N 16,43. C13H10F4N4OS. Вирахувано, %: С 45,10; Н 2,91; N 16,18. ІЧ-спектр (КВr): 1760 (С=О), 3260 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 1,21 т (3Н,СН3), 2,65 д (2Н,СН2), 7,32 т (2Наром.), 7,767,80 м (2Н аром.), 10,81 с (1Н, NH). Спектр ЯМР 19 F (ДМСО-d6): -74,49 с (CF3). Приклад 6 2-Феніл-5-трифторметил-5-(4-фторфеніл)-5,6дигідро-7Н-[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7он. Вихід 70%, т.пл. 225-227°С. Знайдено, %: С 51,50; Н 2,68; N 14,30. C17H10F4N4OS. Вирахувано, %: 51,78; Н 2,56; N 14,21. ІЧ-спектр (КВr): 1750 (С=О ), 3260 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 7,32-8,03 м (9Наром.), 10,90 с (1H,NH). Спектр ЯМР 19F (ДМСО-d6): -74,77 с (CF3). Приклад 7 2-(Тієніл-2)-5-трифторметил 5-(4-фторфеніл)5,6-дигідро-7Н-[1,2,4]триазоло-[5,1b][1,3,5]тіадіазин-7-он. Вихід 69%, т.пл. 197-198°С. Знайдено, %: С 44,73; Н 2,09; N 14,51. C15H8F4N4OS2. Вирахувано, %: 45,00; Н 2,01; N 14,65. ІЧ-спектр (КВr): 1760 (С=О ), 3255 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 7,19 т (1Наром.), 7,36 т (2Наром.), 7,71-7,88м (4Наром.), 10,92 с (1H,NH). Спектр ЯМР 19F (ДМСО-d6): -74,77 с (CF3). Приклад 8 2-Циклопропіл-5-трифторметил-5-(4-толіл)-5,6дигідро-7Н-[1,2,4]триазоло-[5,1-b][1,3,5]тіадіазин-7он. Вихід 77%, т.пл. 175-176°С. Знайдено, %: С 51,11; Н 3,61; N 15,94. C15H13F3N4OS. Вирахувано, %: С 50,85; Н 3,70; N 15,81. ІЧ-спектр (КВr): 1755 (С=О ), 3250 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 0,88-1,01 м (4Н, 2СН2), 2,02 пент (1H, СН), 2,36 с (3Н, СН3), 7,32 д (2Наром.), 7,62 д (2Н аром.), 10,62 с (1Н, NH). Спектр ЯМР 19F (ДМСО-d6): 74,52 с (CF3). Приклад 9 2-(4-Етилфеніл)-5-трифторметил-5-(4метоксифеніл)-5,6-дигідро-7Н-[1,2,4]триазоло-[5,1b][1,3,5]тіадіазин-7-он. Вихід 81%, т.пл. 188-190°С. Знайдено, %: С 55,03; Н 4,08; N 13,73. Вирахувано, %: 55,29; Н 3,94; N 12,90. ІЧ-спектр (KBr): 1755 (C=O), 3255 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 1,24 т (3Н, СН3), 2,69 кв (2Н, СН2), 3,81 с (3Н, СН3О), 7,05 д (2Наром.), 7,32 д (2Наром.), 7,71 д (2Наром.), 7,94 д (2Наром.), 10,76 с (1H,NH). Спектр ЯМР 19F (ДМСО-d6): -74,80 с (CF3). Приклад 10 2-(4-Хлорфеноксиметил)-5-трифторметил-5(4-метоксифеніл)-5,6-дигідро-7Н-[1,2,4]триазоло[5,1-b][1,3,5]тіадіазин-7-он. Вихід 74%, т.пл. 164165°С. Знайдено, %: С 48,19; Н 2,88; N 12,07. 27173 6 C19H14F3ClN4O3S. Вирахувано, %: С 48,47; Н 2,99; N 11,90. ІЧ-спектр (КВr): 1760 (С=О ), 3260 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 3,81 с (3Н, СН3О), 5,13 с (2Н, СН2), 7,01-7,05 м (4Наром.), 7,29 д (2Наром.), 7,70 д (2Наром.), 10,78 с (1H, NH). Спектр ЯМР 19F (ДМСО-d6): -74.85 с (CF3). Література: 1. Liu S., Qian X., Chen J., Song G. Novel Fused Heterocycles: Synthesis and Activity of 5,6-Dihydro-7thia-1,3,3a,5-tetraazainden-4-one and 1-Thia-3,4a,9triazafluoren-4-one Derivatives // Monatsh. Chem. 2000. - Vol.131. - P.953-957. 2. Liu S., Qian X., Song G., Chen J., Chen W. Fluorine containing heterocyclic compounds: synthesis of 6-substituted-2-substituted-aryl-1,2,4triazolo[5,1-b]1,3,5-thiadaazin-7-one derivatives // J. Fluor. Chem. -2000. - Vol.105. - P.111-115. 3. Ulrich H., Richter R., Whitman P.J., Sayigh A.A.R. Reaction of Phosgene with N-Methyleneaniline Derivatives // J. Org. Chem. - 1974. - Vol.39, N19. P.2897-2899. 4. Pat. Belg. 621,378. 22 May 1962. N-Alkyl-Nhalomethylcarbamoyl chlorides, - carbamates and acetamides / Kritzler H, Wagner K., Holtschmidt H. Chem. Abstr. - 1963. - Vol.59, 9816g. 5. Filler R., Kobayashi Y., Yagupolski L.M. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications. - Elsevier, Amsterdam. 1993. 6. Gorbatenko V.I., Samarai L.I. Synthesis and Reactions of a-Haloalkyl Isocyanates // Synthesis. 1980. - N2. - P.85-110. 7. Hoggarth E. Compounds related to Thiosemicarbazide. P.II. 1-Benzoylthiosemicarbazides // J.Chem.Soc. - 1949. - N6. P.1163-1167. 8. Sandtrom R., Wennerberk I. Cycle Thiones. P.II. Tautomerizm, Acidity and Electronoc Spectra of Thioamides of the Oxadiazole, Thiadiazole and Triazole Groups // Acta Chem. Scand. - 1966. Vol.20, N1. - P.57-71. 9. Вовк М.В., Давидюк Ю.И., Самарай Л.И. 1Хлоралкилизоцианаты в синтезе 2Н-3,4-дигидро1,3,5-тиадиазинов // Укр. хим. журн. - 1992. - Т.58, №1. - С.54-57. 10. Вовк М.В., Бальон Я.Г., Крайникова І.Г., Самарай Л.І. Будова продуктів циклоконденсації 1хлоралкілізоціанатів з 2-амінопіридином і 2амінотіазолом // Укр. хім. журн. - 1995. - Т.61, №7. С.63-68. 11. Вовк М.В., Давидюк Ю.Н., Самарай Л.И. Реакции 1-хлоралкилизо-цианатов с тризамещенными тиомочевинами // Укр. хим. журн.- 1991. - Т.57, №12. - С.1316-1321.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 5-trifluoromethyl-5,6-dihydro-7h-[1,2,4]triazolo[5,1-b][1,3,5]-7-ones
Автори англійськоюVovk Mykhailo Volodymyrovych, Tolmachova Valentyna Sergiivna
Назва патенту російськоюСпособ получения 5-трифторметил-5,6 дигидро-7н-[1,2,4]триазоло[5,1-b] [1,3,5]-тиадиазин-7-онов
Автори російськоюВовк Михаил Владимирович, Толмачова Валентина Сергеевна
МПК / Мітки
МПК: C07D 513/02
Мітки: одержання, 5-трифторметил-5,6-дигідро-7н-[1,2,4]триазоло[5,1-b, 1,3,5]-тіадіазин-7-онів, спосіб
Код посилання
<a href="https://ua.patents.su/3-27173-sposib-oderzhannya-5-triftormetil-56-digidro-7n-124triazolo51-b-135-tiadiazin-7-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-трифторметил-5,6-дигідро-7н-[1,2,4]триазоло[5,1-b] [1,3,5]-тіадіазин-7-онів</a>
Попередній патент: Імуномодулюючий засіб для лікування маститів у корів
Наступний патент: Спосіб експериментальної терапії виразки шлунка







