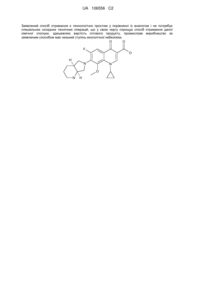
Спосіб одержання (1-циклопропіл-6-фтор-1,4-дигідро-8-метоксі-7-[(4as,7as)-октагідро-6н-піроло[3,4-b]-4-оксо-3-хінолінкарбонової кислоти
Формула / Реферат
1. Спосіб одержання сполуки формули (6)
 , (6)
, (6)
який відрізняється тим, що здійснюють стадії:
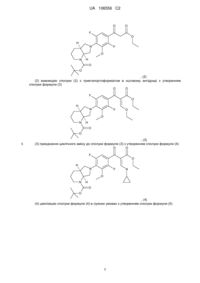
(1) введення в сполуку формули (1)
 (1)
(1)
трет-бутилоктагідро-1Н-піроло[3,4-b]піридин-1-кабоксилату з утворенням сполуки формули (2)
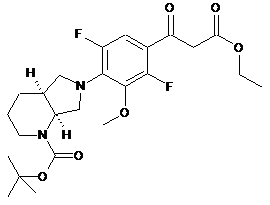 , (2)
, (2)
(2) взаємодії сполуки (2) з триетилортоформіатом в оцтовому ангідриді з утворенням сполуки формули (3)
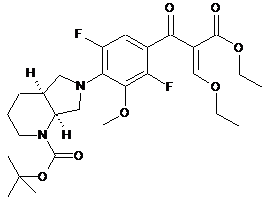 , (3)
, (3)
(3) приєднання циклічного аміну до сполуки формули (3) з утворенням сполуки формули (4)
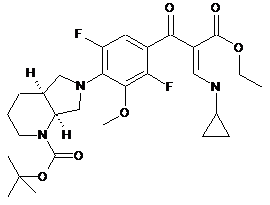 , (4)
, (4)
(4) циклізації сполуки формули (4) в лужних умовах з утворенням сполуки формули (5)
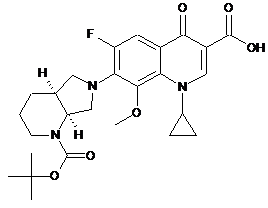 , (5)
, (5)
(5) відщеплення Вос захисної групи від сполуки формули (5) з утворенням кінцевої сполуки формули (6)
 . (6)
. (6)
2. Спосіб за пунктом 1, який відрізняється тим, що стадію (1) здійснюють в присутності основи.
3. Спосіб за пунктом 1, який відрізняється тим, що стадію (2) здійснюють в оцтовому ангідриді при температурі 130 °C.
4. Спосіб за пунктом 1, який відрізняється тим, що стадію (3) здійснюють при кімнатній температурі.
5. Спосіб за пунктом 1, який відрізняється тим, що стадію (4) здійснюють в присутності 3N гідроксиду калію при температурі 50 °C.
Текст
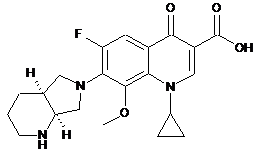
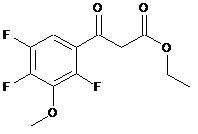
Реферат: Даний винахід стосується способів одержання такої хімічної сполуки як (1-циклопропіл-6-фтор1,4-дигідро-8-метокси-7-[(4аS,7аS)-октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3хінолінкарбонової кислоти, який полягає в приєднанні гетероциклічного аміну, який містить захисну групу, до етил-3-оксо-3-(2,4,5-трифлуоро-3-метоксифеніл)пропаноату, наступною взаємодією з триетилортоформіатом, приєднанні циклічного аміну, подальшій циклізації та отриманні цільового продукту. UA 106556 C2 (12) UA 106556 C2 Заявлений спосіб отримання є технологічно простим у порівнянні із аналогом і не потребує спеціальних складних технічних операцій, що у свою чергу спрощує спосіб отримання даної хімічної сполуки, здешевлює вартість готового продукту, промислове виробництво за заявленим способом має низький ступінь екологічної небезпеки. O O F O H N N O N H UA 106556 C2 5 10 15 20 25 30 35 40 Даний винахід належить до способів одержання такої хімічної сполуки як (1-циклопропіл-6фтор-1,4-дигідро-8-метокси-7-[(4аS,7аS)-октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3хінолінкарбонової кислоти. Похідні хінолонкарбонової кислоти широко застосовуються як синтетичні антибактеріальні ліки в медицині. Сполуки з групи фторхінолонів мають бактерицидну дію та проявляють активність щодо широкого спектра грампозитивних і грамнегативних мікроорганізмів, анаеробних, кислотостійких і атипових бактерій: Mycoplasma spp., Chlamydia spp., Legionella pp. Протимікробний засіб на основі (1-циклопропіл-6-фтор-1,4-дигідро-8-метокси-7-[(4аS,7аS)октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3-хінолінкарбонової кислоти ефективний по відношенню до більшості штамів мікроорганізмів, резистентних до беталактамних антибіотиків і макролітів. Способи одержання сполуки 1-циклопропіл-6-фтор-1,4-дигідро-8-метокси-7-[(4аS,7аS)октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3-хінолінкарбонової кислоти описані у заявці DE 4200414 А1 (опубл. 15.07.1993). Сполуку отримують двома способами. За першим способом (1-циклопропіл-6-фтор-1,4-дигідро-8-метокси-7-[(4аS,7аS)-октагідро6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3-хінолінкарбонової кислоти отримують із солей похідних хінолон- і нафтиридонкарбонової кислоти (кислотно-адитивні солі, лужні солі, лужноземельні солі, срібні і гуанідинові солі відповідних кислот), які містять циклічні аміни, шляхом взаємодії зі сполуками, що містять галоген, при наявності засобу, що зв'язує кислоту. За другим способом ті ж самі похідні хінолонкарбонової кислоти піддають взаємодії з акцептором Міхаеля, наприклад діалкіловим ефіром ацетилендикарбонової кислоти, аліловим ефіром пропіолової кислоти. В цих способах рацемічні проміжні сполуки взаємодіють з енантіомерночистим допоміжним реагентом, одержані діастереомери розділяють за допомогою хроматографії, знову відщеплюють у одержаного діастереомеру допоміжну хіральну групу. Рацемічні біциклічні аміни можуть перетворюватись при взаємодії з енантіомерночистими кислотами чи сульфокислотами в суміш діастереомерних солей, які розділяються фракційною кристалізацією на діастереомерночисті солі. Молярне співвідношення аміну і енантіомерночистої кислоти може змінюватись в широкому діапазоні. Обробкою цих солей гідроксидами лужних і лужноземельних металів виділяють енантіомерночисті аміни. Аналогічно проводять розщеплення рацематів основних проміжних сполук, які утворюються при отриманні рацемічних біциклічних амінів з енантіомерночистими кислотами. Рацемічні аміни і проміжні сполуки можуть бути розділені хроматографічно на хіральних носіях, можуть бути переведені хімічним зв'язуванням з хіральним ацильним залишком в суміші діастереомерів, які розділяють дистиляцією, кристалізацією чи хроматографією на діастереомерночисті ацильні похідні, з яких виділяють омиленням енантіомерночисті аміни. Недоліком зазначених способів є те, що в процесі здійснення способів утворюється як рацемічна суміш проміжних сполук, так і рацемічна суміш кінцевих сполук, які необхідно розділяти хроматографічно, що у свою чергу вимагає великих затрат розчинників та часу. Відомий спосіб одержання похідних 3-хінолінкарбонової кислоти, в яких сполуки загальної формули O X 1 HaI X3 F X2 45 50 піддають взаємодії з діетиловим ефіром малонової кислоти в середовищі розчинника в присутності метилату магнію з утворенням відповідних складних ефірів, в яких відповідні замісники Х1, Х2, Х3, Hal, що являють собою різноманітні замісники, в тому числі хлор, фтор, метоксигрупу, можуть бути однаковими чи різними, піддаються частковому омиленню і декарбоксилюванню у водному середовищі в присутності каталітичних кількостей сірчаної кислоти чи п-толуолсульфокислоти. Отримані сполуки піддають взаємодії з триетиловим ефіром орто-мурашиної кислоти в присутності оцтового ангідриду. Утворені проміжні сполуки дальше піддають взаємодії з циклопропіламіном, потім відбувається стадія циклізації, після якої приєднують необхідний амін (заявка ЕР 0167763 А1, опубл. 15.01.1986). Недоліком цього способу є незадовільний вихід продукту. Крім того, при лужному омиленні можуть утворюватись побічні продукти, які здатні утворювати полімери, що є небажаним. Також омилення в кислих 1 UA 106556 C2 5 умовах призводить до виділення фтористого водню, який викликає корозію виробничої установки і забруднень продукту комплексними фторидами металів. У патенті на винахід UA 41323 С2 описаний спосіб одержання похідних 3-хінолонкарбонової кислоти, який включає стадії взаємодії галогенангідриду кислоти з ефіром карбонової кислоти в розчиннику в присутності основного агента, взаємодію з гетероциклічним аміном, лужного омилення і виділення продукту у вільній формі чи у вигляді солі. Галогенангідрид кислоти формули O F HaI X2 10 A X1 , де Х1, Х2, Hal являють собою хлор чи фтор, а А є СН, CF, ССl, піддають омиленню з аміноакриловою кислотою, потім з циклопропіламіном, наступним омиленням, що призводить до циклізації, яка відбувається в присутності карбонату калію. Кожну стадію проводять без попереднього виділення і очищення проміжних продуктів. Як гетероциклічний амін використовують сполуку H N N 15 20 25 30 H . Виділення кінцевого продукту здійснюють таким чином, що після лужного омилення реакційну суміш нейтралізують кислотою і відділяють утворений продукт. Недоліком цього способу є те, що при взаємодії з ефіром акрилової кислоти утворюються побічні продукти, які здатні приєднуватись до ненасиченого зв'язку акрилової кислоти з утворення продуктів полімеризації, які є отруйними і вибухонебезпечними. Крім того, проведення наступних стадій способу без виділення і очищення проміжних продуктів призводить до утворення суміші побічних продуктів, які можуть брати участь в наступних стадіях способу, що у свою чергу призводить до утворення малої кількості кінцевого продукту. Кінцевий продукт містить значну кількість домішок і тому виникає необхідність значних витрат на його відділення від домішок. Тому здійснення способу вимагає значних витрат на реагенти, розчинники, та є технологічно складним. Задачею винаходу є удосконалення способу отримання сполуки (1-циклопропіл-6-фтор-1,4дигідро-8-метокси-7-[(4аS,7аS)-октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3хінолінкарбонової кислоти шляхом зміни дій та реагентів у способі отримання цієї сполуки. Задача вирішується способом одержання (1-циклопропіл-6-фтор-1,4-дигідро-8-метокси-7[(4аS,7аS)-октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3-хінолінкарбонової кислоти, який включає стадії: (1) введення в сполуку формули (1) O O F O F F O (1) трет-бутилоктагідро-1Н-піроло[3,4-b]піридин-1-кабоксилату з утворенням сполуки формули 35 (2) 2 UA 106556 C2 O O F O H N F O N H O O , (2) (2) взаємодію сполуки (2) з триетилортоформіатом в оцтовому ангідриді з утворенням сполуки формули (3) O O F O H N F O O N H O O 5 , (3) (3) приєднання циклічного аміну до сполуки формули (3) з утворенням сполуки формули (4) O O F O H N F N O N H O O , (4) (4) циклізацію сполуки формули (4) в лужних умовах з утворенням сполуки формули (5) 3 UA 106556 C2 O O F O H N N O N H O O , (5) (5) відщеплення Вос захисної групи від сполуки формули (5) з утворення кінцевої сполуки формули (6) O O F O H N N O N 5 10 15 20 25 H . (6) Крім того, за заявленим способом стадія (1) може бути здійснена в присутності основи. Крім того, за заявленим способом стадія (2) може бути здійснена в оцтовому ангідриді при температурі 130 °C. Крім того, за заявленим способом стадія (3) може бути здійснена при кімнатній температурі. Крім того, за заявленим способом стадія (4) може бути здійснена в присутності 3N гідроксиду калію при температурі 50 °C. Стадія (1) включає таку дію як приєднання хірального аміну, в даному випадку (4аS,7аS)трет-бутилоктагідро-1Н-піроло[3,4-b]піридин-1-кабоксилату до етил-3-оксо-3-(2,4,5-трифлуоро3-метоксифеніл)пропаноату (1) з утворенням (4аS,7аS)-третбутил-6-(4-(3-етоксипропанол)-3,6дифлюоро-2-метоксифеніл)октагідро-1Н-піроло[3,4-b]піридин-1-карбоксилату (2). В аміні захисна група може бути вибрана з групи, що містить алкоксикарбонільну групу, арилалкоксикарбонільну групу, ацильну групу, алкоксіалкільну групу чи заміщену силільну групу. Ніякі особливі обмеження не накладаються на тип аміно-захисних груп, і деякі групи можуть бути застосовані в реакції до тих пір, поки не почнуть інгібувати взаємодію між сполукою (1) та аміносполукою. Доцільно застосовувати трет-бутоксикарбонільну групу та 2,2,2трихлороетоксикарбонільну, перевагу має трет-бутоксикарбонільна група. Для реакції використовують один або більше еквівалентів аміну. Реакцію здійснюють в присутності основи, оскільки HF утворюється під час проведення цієї стадії і може інгібувати реакцію зі сполукою (1), утворюючи сіль з аміном. Стадія (2) включає таку дію як взаємодія сполуки (2) з триетилортоформіатом в оцтовому ангідриді, що приводить до утворення сполуки формули (3). 4 UA 106556 C2 5 10 15 20 25 30 35 Алкілортоформіат і оцтовий ангідрид використовують в еквівалентній кількості. Алкілортоформіат може містити від однієї до шести алкільних груп. Перевагу надають таким сполукам як етилортоформіат і метилортоформіат. Алкілортоформіат використовують як реагент і розчинник одночасно. Реакцію здійснюють в інтервалі температур від кімнатної до температури кипіння розчинника від однієї до шести годин. Стадія (3) включає таку дію як взаємодія сполуки формули (3) з циклічним аміном з утворенням сполуки формули (4). Реакцію здійснюють в присутності основи, яка може бути вибрана з групи органічних, наприклад, триметиламін, триетиламін, 4-(диметиламіно)піридин і неорганічних, таких як амоній, карбонат калію, карбонат натрію, гідроксид натрію, гідроксид калію. Перевагу надають третинним амінам, зокрема триетиламіну. Амінова сполука може бути кислою сіллю. Кислу сіль можуть утворювати неорганічні кислоти, такі як соляна кислота, сірчана кислота, азотна кислота, бромистоводнева, фтористоводнева, йодистоводнева кислоти, а також органічні кислоти такі як толуолсульфонова, бензолсульфонова, метансульфонова (сульфонові кислоти можуть містити атом галогену чи алкільну групу в ролі замісника), трифтороцтову кислоту, малеїнову і фумарову кислоти. Нема також обмежень у виборі розчинника і багато розчинників використовуються до тих пір, поки вони не почнуть інгібувати реакцію. Можуть бути використані толуол, N,N-диметилацетамід, N,N-диметилформамід, диметилсульфоксид, N-метилпіролідон. Перевагу надають толуолу. Реакцію проводять при кімнатній температурі від 30 хвилин до 6 годин, в залежності від того, чи утворився кінцевий продукт і чи використані вихідні сполуки. Стадія (4) включає таку дію як циклізація сполуки формули (4) з утворенням сполуки формули (5): Стадію (4) проводять в присутності основи, міжфазний каталізатор може бути комбінований, хоча сполуку (4) не завжди вимагається виділяти і очищати. В реакції застосовують як органічні основи, такі як триметиламін, триетиламін, 4(диметиламіно)піридин, так і неорганічні основи, такі як амоній, карбонат калію, карбонат натрію, гідроксид натрію, гідроксид калію. Перевагу надають гідроксиду калію. Основу переважно використовують в кількості, необхідній для захоплення фтористого водню, який генерується під час замикання кільця і для гідролізу складного ефіру. Основу можна безпосередньо додавати в реакційну суміш або можна додавати у реакційну суміш у вигляді водного розчину. Основа чи розчин не є необхідною формою домішки з реакційним розчинником. 5 UA 106556 C2 5 10 15 20 25 30 35 40 45 50 Як розчинники використовують толуол, N,N-диметилацетамід, N,N-диметилформамід, диметилсульфоксид, N-метилпіролідон. Перевагу надають толуолу. Як каталізатор використовують тетрабутиламонію бромід. Реакцію можна проводити в температурному режимі від кімнатної до температури кипіння реакційної суміші. Час проведення реакції залежить від часу перетворення вихідних сполук у кінцеві і може становити від однієї до 24 годин. При здійсненні заявленого способу сполука (5) може бути виділена і очищена звичайними методами. В одному з методів рН реакційної суміші регулюють додаванням відповідної кислоти і суміш перемішують при охолодженні з льодом. Таким чином, кристали, які випадають, фільтрують. В іншому методі рН реакційної суміші регулюють додаванням відповідної кислоти і додаванням відповідного розчинника у реакційну суміш для екстрагування даної сполуки. Одержаний екстракт концентрують і сполуку (5) перекристалізовують з відповідного розчинника. У вищезгаданих процесах у вільній формі чи у формі солі. Приклади солей включають солі неорганічних кислот, таких як соляна кислота, сірчана кислота, азотна кислота, бромистоводнева, фтористоводнева, йодистоводнева кислоти, а також органічні кислоти такі як толуолсульфонова, бензолсульфонова, метансульфонова, трифтороцтова кислота, трихлороцтова кислота, оцтова кислота, мурашина кислота, фумарова кислота, і солі лужних металів і лужноземельних металів таких як натрій, калій, кальцій чи літій. Навіть коли сполука є сумішшю вільної форми і солі, сполука може бути виділена у формі сольвату. Сольват може бути утворений з водою, етанолом, пропанолом, ацетонітрилом, ацетоном чи може бути утворений поглинанням води. Стадію (5) проводять з відщепленням трет-бутилкабоксилату від сполуки формули (5) з утворенням сполуки формули (6): Стадію (5) здійснюють в розчиннику при нагріванні з соляною кислотою. Далі наведено приклади, які показують один із можливих варіантів здійснення заявленого способу отримання сполуки моксифлоксацин (1-циклопропіл-6-фтор-1,4-дигідро-8-метокси-7[(4аS, 7аS)-октагідро-6Н-піроло[3,4-b]піридин-6-іл]-4-оксо-3-хінолінкарбонової кислоти. Приклад 1 Одержання (4aS,7aS)-трет-бутил 6-(4-(3-етокси-3-оксопропанол)-3,6-дифлюоро-2метоксифеніл)октагідро-1Н-піроло[3,4-b]піридин-1-карбоксилату. (4aS,7aS)-Трет-бутилоктагідро-1Н-піроло[3,4-b]піридин-1-кабоксилат (4,10 г, 18,1 ммоль) додають до розчину, що містить (5 г, 18,1 ммоль) етил 3-оксо-3-(2,4,5-трифлуоро-3метоксифеніл)пропаноату, ацетонітрилу (50 мл), триетиламіну (5,1 мл, 2 екв.) і суміш перемішують при 25 °C три дні і при 50 °C чотири години. Після цього реакційну суміш охолоджують, розчинник випарюють при пониженому тиску. До залишку додають толуол (50 мл), насичують сольовим розчином (30 мл). Органічний залишок сушили над сульфатом магнію, розчинник вилучали при пониженому тиску. Отримують сполуку жовто-зеленого кольору 7,295 г (84 %). Сполука була ідентифікована за допомогою фізико-хімічних методів. Спектр ЯМРспектроскопії сполуки наведено на фіг. 1. Приклад 2 Одержання (4aS,7aS)-трет-бутил 6-(4-(Z)3-етокси-2-(етоксикарбоніл)-акрилоїл)-3,6дифлюоро-2-метоксифеніл)октагідро-1Н-піроло[3,4-b]піридин-1-карбоксилату. (4aS,7aS)-трет-бутил-6-(4-(3-етокси-3-оксопропанол)-3,6-дифлюоро-2метоксифеніл)октагідро-1Н-піроло[3,4-b]піридин-1-карбоксилат (1,033 г, 2,14 ммоль) розчиняють оцтовому ангідриді (1,21 мл, 6 екв.) і триетилортоформіаті (2,13 мл, 6 екв.), реакційну суміш перемішують 14 годин при температурі 130 °C. Після цього реакційну суміш охолоджували, розчинник вилучали при низькому тиску. До залишку додавали толуол (10 мл), реакційну суміш кип'ятили двічі. Оцтову кислоту, яка міститься в рідині, нейтралізували бікарбонатом натрію, і утворений неорганічний продукт відфільтровували. Розчинник, який залишився під час фільтрування, вилучають при пониженому тиску, утворюючи осад жовто-оранжевого кольору 933 мг (81 %). 6 UA 106556 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполука була ідентифікована за допомогою фізико-хімічних методів. Спектр ЯМРспектроскопії сполуки наведено на фіг. 2. Приклад 3 Одержання (4aS,7aS)-трет-бутил-6-(4-((7)3-циклопропіламіно)-2-(етоксикарбоніл)акрилоїл)3,6-дифлюоро-2-метоксифеніл)октагідро-1Н-піроло[3,4-b]піридин-1-карбоксилату. Циклопропіламін (390 мг, 6,83 ммоль) додають до розчину, що містить (4aS, 7aS)-третбутил-6-(4-((2)3-етокси-2-(етоксикарбоніл)акрилоїл)-3,6-дифлюоро-2-метоксифеніл)октагідро1Н-піроло[3,4-b]піридин-1-карбоксилат (787 мг, 1,45 ммоль), толуол (15,2 мл), триетиламін (0,22 мл, 1,1 екв.), реакційну суміш перемішують 10 хвилин при температурі 25 °C. Органічний залишок промивають водою (10 мл 2) і сольовим розчином (10 мл) і сушать над сульфатом магнію. Розчинник видаляють при пониженому тиску. Отримують (4aS, 7aS)-трет-бутил 6-(4((2)3-циклопропіламіно)-2-(етоксикарбоніл)акрилоїл)-3,6-дифлюоро-2-метоксифеніл)октагідро1Н-піроло[3,4-b]піридин-1-карбоксилат 789 мг (99 %) жовто-оранжевого кольору. Сполука була ідентифікована за допомогою фізико-хімічних методів. Спектр ЯМРспектроскопії сполуки наведено на фіг. 3. Приклад 4 Одержання 7-((4aS,7aS)-1-трет-бутоксикарбоніл)гексагідро-1Н-піроло[3,4-b]-піридин-6-(2Н)іл)-1-циклопропіл-6-флюоро-8-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти. Тетрабутиламонію бромід (ТВАВ, 8 мг) додають до розчину, що містить (4aS, 7aS)-третбутил-6-(4-((2)3-циклопропіламіно)-2-(етоксикарбоніл)акрилоїл)-3,6-дифлюоро-2метоксифеніл)октагідро-1Н-піроло[3,4-b]піридин-1-карбоксилат (736 мг, 1, 34 ммоль), толуол (14, 8 мл) і 3N гідрохлориду калію (2,23 мл, 5 екв.) і реакційну суміш перемішують чотири години при температурі 50 °C. 3N гідрохлориду калію (2,23 мл, 5 екв.) ще додають до реакційної суміші і перемішують дві години. Потім реакційну суміш виливають на лід, трошки підкислюють 3N розчином соляної кислоти до утворення суспензії, до якої додають воду (15 мл) та сольовий розчин (5 мл) до розділення. Водний залишок екстрагують толуолом (20 мл2), таким чином відновлюють органічні компоненти і всі органічні шари поєднують. Поєднані органічні залишки сушать над сульфатом натрію, розчинник вилучають на роторі при пониженому тиску. Залишок кристалізують, розчинник видаляють при пониженому тиску. Потім залишок розчиняють в толуолі (1,5 мл) і гексані (15 мл). Суміш перемішують три години при 25 °C. Отримані осади відфільтровують і сушать. В результаті отримують 558 мг (83 %) сполуки з жовто-оранжевими кристалами. Сполука була ідентифікована за допомогою фізико-хімічних методів. Спектр ЯМРспектроскопії сполуки наведено на фіг.4. Приклад 5 Одержання 1-циклопропіл-6-флюоро-7-((4аS,7аS)-гексагідро-1Н-піроло[3,4-b]піридин-6(2Н)іл)-8-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти. Суспендують в етанолі 7-((4аS,7аS)-1-трет-бутоксикарбоніл)-гексагідро-1Н-піроло[3,4b]піридин-6(2Н)-іл)-1-циклопропіл-6-флюоро-8-метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту (727 мг, 1,45 ммоль) при температурі 22-30 °C, обробляють 21,70 мг соляної кислоти (37 мас. %), і кип'ятять зі зворотним холодильником протягом 2 годин. Після завершення перетворення більшу частину спирту відганяють. Сіль, яка утворилася, осаджують, нагрівають розчин до 40 °C і додають дихлорметан. Осадження 7-((4аS, 7аS)-1-трет-бутоксикарбоніл)гексагідро-1Н-піроло[3,4-b]піридин-6(2Н)-іл)-1-циклопропіл-6-флюоро-8-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти проводять, розчиняючи хлороводневу сіль у суміші розчинників EtOН/вода, 1:1. При температурі 0-7 °C додають порціями 30 % розчин гідроксиду натрію доти, поки величина рН не досягне р>12,5. Через 4-48 годин речовину, що випала в осад, відфільтровують, промивають водою й сушать у вакуумі. Спосіб дає порошок від білого до жовтуватого кольору 518 мг (89 %) з температурою топлення 324-325 °C. Сполука була ідентифікована за допомогою фізико-хімічних методів. Спектр ЯМРспектроскопії сполуки наведено на фіг. 5. Як видно із наведених прикладів, при здійсненні заявленого способу отримання 1циклопропіл-6-флюоро-7-((4аS,7аS)-гексагідро-1Н-піроло[3,4-b]піридин-6(2Н)-іл)-8-метокси-4оксо-1,4-дигідрохінолін-3-карбонової кислоти використовуються більш доступні діючі реагенти, під час проведення стадій у заявленому способі внаслідок приєднання хірального аміну, який містить захисну групу, на першій стадії, не утворюються рацемічні суміші, які необхідно розділяти, очищати на хроматографічній колонці з силікагелем. Таким чином, в заявленому способі утворюються енантіомерночисті проміжні сполуки, які легко кристалізують і очищають, і використовують в наступних стадіях. Завдяки цьому підвищуються виходи як проміжних сполук, так і кінцевого продукту. В заявленому способі відпадає необхідність додаткових витрат на 7 UA 106556 C2 5 10 розчинники, силікагель, реагентів, часу, що є економічно вигідним. Самі технологічні операції під час дій здебільшого відбуваються у звичайних умовах (без додаткового нагрівання чи значного зниження температури) та без необхідності точного дотримання значень рН, спосіб здійснюється без використання дорогих розчинників. Зазначене вище призводить до того, що заявлений спосіб отримання є технологічно простим у порівнянні із аналогом і не потребує спеціальних складних технічних операцій, що у свою чергу спрощує спосіб отримання даної хімічної сполуки, здешевлює вартість готового продукту, промислове виробництво за заявленим способом має низький ступінь екологічної небезпеки. Наведені приклади здійснення заявленого способу отримання 1-циклопропіл-6-флюоро-7((4аS,7аS)-гексагідро-1Н-піроло[3,4-b]піридин-6(2Н)-іл)-8-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти лише ілюструють винахід, але не обмежують його. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб одержання сполуки формули (6) O O F OH H N N O H N H , (6) який відрізняється тим, що здійснюють стадії: (1) введення в сполуку формули (1) O O F O F F O 20 (1) трет-бутилоктагідро-1Н-піроло[3,4-b]піридин-1-кабоксилату з утворенням сполуки формули (2) O O F O H N F O N H O O , (2) (2) взаємодії сполуки (2) з триетилортоформіатом в оцтовому ангідриді з утворенням сполуки формули (3) 8 UA 106556 C2 O O F O H N F O O H N O O , (3) (3) приєднання циклічного аміну до сполуки формули (3) з утворенням сполуки формули (4) O O F O H N F N O H N O O , (4) (4) циклізації сполуки формули (4) в лужних умовах з утворенням сполуки формули (5) O O F OH H N N O H N O O 5 , (5) (5) відщеплення Вос захисної групи від сполуки формули (5) з утворенням кінцевої сполуки формули (6) O O F OH H N N O N H 10 H . (6) 2. Спосіб за пунктом 1, який відрізняється тим, що стадію (1) здійснюють в присутності основи. 3. Спосіб за пунктом 1, який відрізняється тим, що стадію (2) здійснюють в оцтовому ангідриді при температурі 130 °C. 4. Спосіб за пунктом 1, який відрізняється тим, що стадію (3) здійснюють при кімнатній температурі. 9 UA 106556 C2 5. Спосіб за пунктом 1, який відрізняється тим, що стадію (4) здійснюють в присутності 3N гідроксиду калію при температурі 50 °C. 10 UA 106556 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Автори англійськоюDerkach Nataliia Mykolaivna
Автори російськоюДеркач Наталья Николаевна
МПК / Мітки
МПК: C07D 215/28, C07D 215/06, C07D 215/54, C07D 215/18, C07D 215/26, C07D 215/58, C07D 215/233, C07D 401/04
Мітки: кислоти, 1-циклопропіл-6-фтор-1,4-дигідро-8-метоксі-7-[(4as,7as)-октагідро-6н-піроло[3,4-b]-4-оксо-3-хінолінкарбонової, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/13-106556-sposib-oderzhannya-1-ciklopropil-6-ftor-14-digidro-8-metoksi-7-4as7as-oktagidro-6n-pirolo34-b-4-okso-3-khinolinkarbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання (1-циклопропіл-6-фтор-1,4-дигідро-8-метоксі-7-[(4as,7as)-октагідро-6н-піроло[3,4-b]-4-оксо-3-хінолінкарбонової кислоти</a>
Попередній патент: Автономний пристрій самоліквідації ракети
Наступний патент: Система для непрямого визначення антенної складової ефективної поверхні розсіювання апертурних антен
Випадковий патент: Імпульсний водомет