Спосіб одержання акрилової та метакрилової кислоти
Номер патенту: 107815
Опубліковано: 25.02.2015
Автори: Джонсон Девід Вільям, Поляков Мартін, Хаддл Томас Ендрю, Істхем Грехем Рональд
Формула / Реферат
1. Спосіб одержання сполуки формули (і):
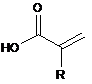 , формула (і)
, формула (і)
в якій R = Н або СН3,
де спосіб включає піддавання джерела сполуки формули (іі) реакції, в умовах температури і тиску:
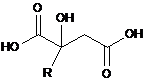 , формула (іі)
, формула (іі)
в якій R має значення, як визначено вище,
де, коли R = СН3, джерело сполуки формули (іі) піддають реакції при температурі і тиску під час знаходження в рідкій фазі, необов'язково, водній фазі.
2. Спосіб за п. 1, в якому умови реакції включають температуру принаймні 100 °C і менше, ніж приблизно 425 °C.
3. Спосіб за п. 1 або 2, в якому умови реакції включають тиск від приблизно 1,38×106 до 6,89×107 Па.
4. Спосіб за будь-яким з попередніх пунктів, в якому умови реакції включають температуру і тиск, при яких реакційне середовище знаходиться у рідкій фазі.
5. Спосіб за будь-яким з попередніх пунктів, в якому джерело сполуки формули (іі) піддають реакції при температурі і тиску у присутності каталізатора.
6. Спосіб за п. 5, в якому каталізатор є основним каталізатором, кислотним каталізатором або кислотним і основним каталізатором.
7. Спосіб за будь-яким з попередніх пунктів, в якому джерело сполуки формули (іі) піддають дії умов реакції протягом періоду часу між приблизно 0,1 секунди і 300 секундами.
8. Спосіб за будь-яким з попередніх пунктів, в якому умови реакції загалом є кислотними.
9. Спосіб перетворення яблучної кислоти на акрилову кислоту, який включає піддавання джерела яблучної кислоти умовам реакції тиску і температури.
10. Спосіб перетворення цитрамалевої кислоти на метакрилову кислоту, який включає піддавання джерела цитрамалевої кислоти у рідкій фазі умовам реакції тиску і температури.
11. Спосіб одержання алкілового естеру сполуки формули (і), де спосіб включає стадії:
(і) одержання сполуки формули (і)
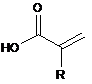 , формула (і)
, формула (і)
в якій R = Н або СН3,
що передбачає піддавання джерела сполуки формули (іі) реакції, в умовах температури і тиску:
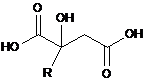 , формула (іі)
, формула (іі)
в якій R має значення, як визначено вище,
де, коли R = СН3, джерело сполуки формули (іі) піддають реакції при температурі і тиску під час знаходження в рідкій фазі, необов'язково, водній фазі;
(іі) естерифікацію сполуки, одержаної на стадії (і), з утворенням відповідного естеру.
12. Спосіб одержання поліметилметакрилату, який включає стадії:
(і) одержання сполуки формули (і)
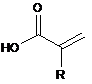 , формула (і)
, формула (і)
в якій R = Н або СН3,
що передбачає піддавання джерела сполуки формули (іі) реакції, в умовах температури і тиску:
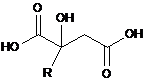 , формула (іі)
, формула (іі)
в якій R має значення, як визначено вище,
де, коли R = СН3, джерело сполуки формули (іі) піддають реакції при температурі і тиску під час знаходження в рідкій фазі, необов'язково, водній фазі;
(іі) естерифікацію сполуки, одержаної на стадії (і), з утворенням відповідного естеру;
(ііі) полімеризацію естеру, одержаного на стадії (іі), з утворенням поліметилметакрилату.
13. Спосіб одержання полімерів або співполімерів метакрилової кислоти, акрилової кислоти, естерів метакрилової кислоти та/або естерів акрилової кислоти, що включає стадії
(і) одержання сполуки формули (і) відповідно до пункту 1;
(іі) необов'язкову естерифікацію сполуки, одержаної на стадії (і), одержуючи відповідний естер;
(ііі) полімеризацію сполуки, одержаної на стадії (і) та/або естеру, одержаного на стадії (іі), необов'язково з одним або більше співмономерами, одержуючи їх полімери або співполімери.
Текст
Реферат: Спосіб одержання сполуки формули (і): O HO R , формула (і) в якій R = Н або СН3, спосіб включає піддавання джерела сполуки формули (іі) умовам реакції температури і тиску: O OH OH HO R O , формула (іі) в якій R має значення, як визначено вище, UA 107815 C2 (12) UA 107815 C2 де, коли R = СН3, джерело сполуки формули (іі) піддають реакції під дією температурного режиму і тиску під час знаходження у рідкій фазі. UA 107815 C2 5 10 15 20 25 30 35 40 45 50 55 60 Представлений винахід стосується способу одержання акрилової та метакрилової кислоти, і поширюється на акрилову та метакрилову кислоту, одержані за допомогою способу, та на їх алкілові естери, особливо метилметакрилат. Акрилова кислота (проп-2-еноєва кислота, АК) та метакрилова кислота (2-метилпроп-2еноєва кислота, МАК) є важливими промисловими хімічними речовинами, головним чином як прекурсори їх естерів, таких як, наприклад, метилакрилат (МА) і метилметакрилат (ММА). Їх головне використання полягає в одержанні пластмас для різноманітного застосування. Найбільш важливим полімеризаційним застосуванням є лиття, формування або екструдування поліметилметакрилату (ПММА) для одержання пластмас високої оптичної прозорості. Крім того, використовують багато співполімерів, важливими співполімерами є співполімери метилметакрилату з α-метилстиролом, етилакрилатом і бутилакрилатом. Насьогодні ММА, МАК та АК виробляють цілковито з сировини нафтохімії. МАК і ММА одержують на великомасштабному виробництві за допомогою різноманітних способів. Наприклад, шляхом використання ацетонціангідрину (АЦГ), де використовують ацетон і ціанід водню як реагенти та, де проміжний ціангідрин обробляють сірчаною кислотою, перетворюючи на сульфатний естер метакриламіду, метаноліз якого надає бісульфат амонію і ММА. Однак, цей спосіб є не тільки дорогим, але й обидва реагенти, особливо ціанід водню представляють велику загрозу здоров‘ю і безпеці, а процес призводить до одержання великого об‘єму небажаного сульфату амонію як побічного продукту. Відомо, що у ще одному процесі, альтернативно, виходять з ізобутилену або, еквівалентно, трет-бутанолового реагента, який потім оксидують до метакролеїну, а потім до метакрилової кислоти. Зовсім недавно, стало відомим одержання ММА безпосередньо за допомогою двостадійного процесу шляхом карбонілювання етилену, утворюючи метилпропіонат, з наступною реакцією з формальдегідом, одержуючи ММА. Цей процес є відомим як Альфа процес. Стадія I описана у WO96/19434 і стосується використання ліганду 1,2-біс-(ди-тбутилфосфінометил)бензолу при карбонілюванні етилену до метилпропіонату, у присутності паладієвого каталізатора, з високим виходом і селективністю. Заявник також розробив процес для каталітичного перетворення метилпропіонату (МЕП) на ММА, використовуючи формальдегід. Прийнятним каталізатором для цього є цезієвий каталізатор на носії, наприклад, силікагелі. Однак, хоча цей шлях перетворення на ММА забезпечує чудову селективність продукту і є порівняно дешевим, реагенти, зокрема, етилен, постачають як фракцію неочищеної нафти природного походження. Протягом багатьох років, біомаса пропонувалась як альтернатива викопним видам палива, не тільки як потенціальній альтернативний енергетичний ресурс, але і як альтернативний ресурс для вихідної сировини хімічного процесу. Відповідно, одним з очевидних рішень для відходу від залежності від викопних видів палива є здійснення будь-яких відомих процесів для одержання ММА або метакрилової кислоти, використовуючи сировину, одержану з біомаси. В цьому відношенні, добре відомо, що синтетичний пальний газ (сингаз) (монооксид вуглецю і водень) може бути одержаний з біомаси і, що метанол може бути вироблений з сингазу. На деяких промислових підприємствах одержують метанол із сингазу на цій основі, наприклад, у Lausitzer Analytik GmbH Laboratorium für Umwelt und Brennstoffe Schwarze Pumpe in Germany, Biomethanol Chemie Holdings, Delfzijl, Netherlands. Nouri і Tillman, Evaluating synthesis gas based biomass to plastics (BTP) technologies, (ESA-Report 2005:8 ISSN 1404-8167) досліджують ефективність використання метанолу, одержаного з газу для хімічного синтезу як безпосередньої вихідної сировини або для одержання іншої вихідної сировини, такої як формальдегід. Існує також багато патентних і не патентних публікацій про одержання сингазу, придатного для одержання хімічних речовин з біомаси. Одержання етилену шляхом дегідратації етанолу, одержаного з біомаси, також добре налагоджено на промислових підприємствах, особливо, у Бразілії. Одержання пропіонової кислоти при карбонілюванні етанолу і перетворення гліцерину, одержаногоз біомаси на молекули, такі як акролеїн і акрилова кислота також добре висвітлені у патентній літературі. Таким чином, шлях виробництва етилену, монооксиду вуглецю і метанолу з біомаси є добре налагодженим. Хімічні речовини, одержані за допомогою цього процесу або реалізовували за такою ж специфікацією як і матеріали, одержані з нафти/газу, або використовували в процесах, де є необхідним такий самий ступінь чистоти. Таким чином, у принципі не існує перешкоди для здійснення так званого Альфа процесу згаданого вище, для одержання метилпропіонату з вихідної сировини, одержаної з біомаси. Фактично, використання в процесі простої вихідної сировини, такої як етилен, моноксид вуглецю і метанол в деякій мірі робить його ідеальним вибором. 1 UA 107815 C2 5 10 15 20 25 Акрилова кислота може бути одержана з пропену або шляхом гідрокарбоксилювання ацетилену. Обидва ці способи потребують вихідних матеріалів, які є найбільш легкодоступними як фракції неочищеної нафти. В цьому відношенні, міжнародна публікація WO2010/058119 стосується безпосередньо використання вихідної сировини з біомаси для згаданого вище Альфа процесу і каталітичного перетворення одержаного метилпропіонату (МЕП) на ММА, використовуючи формальдегід. Ця вихідна сировина, МЕП і формальдегід можуть бути отримані з джерела з біомаси, як зазначено вище. Однак, таке рішення все ще передбачає значну обробку і очищення ресурсу з біомаси для одержання вихідної сировини, і в цих стадіях обробки залучене значне використання викопних палив. Крім того, Альфа процес потребує великої кількості вихідної сировини в одній місцевості, що може призвести до проблем з її наявності. Таким чином, було б перевагою, якщо в будь-якому біохімічному шляху була можливість уникнути великої кількості вихідної сировини або зменшеної кількості вихідної сировини. Таким чином, до сих пір існує потреба у покращеному альтернативному не викопному виді палива, заснована на напрямку одержання акрилатних мономерів, таких як метилметакрилат, акрилова кислота і метакрилова кислота. Враховуючи наявність величезних обсягів і зниження доступності до неочищеної нафти, і шкідливу дію видобування неочищеної нафти на оточуюче середовище, вартість сировини для продовження цього напрямку стає підвищуватися. Таким чином, існує потреба до винайдення способу одержання алкілакрилату та метакрилату, або їх проміжних прекурсорів, таких як акрилова і метакрилова кислота, який є дешевим і ефективним, і без використання будь-якої фракції неочищеної нафти як реагента. Це є об‘єктом аспектів представленого винаходу для вирішення проблеми, зазначеної вище, або інших проблем, і забезпечення одного або більше рішень. Відповідно до першого аспекту представленого винаходу забезпечується спосіб одержання сполуки формули (i): O HO 30 R формула (i) в якій R = H або CH3 спосіб, що включає піддавання джерела сполуки формули (ii) реакції в умовах температури і тиску: O OH OH HO 35 40 45 R O формула (ii) в якій R має значення, як визначено вище де, коли R = CH3, джерело сполуки формули (ii) піддають реакційним умовам при температурі і тиску під час знаходження в рідкій фазі. Переважно, було знайдено, що за певних умов температури і тиску, сполуки формули (ii) розкладаються на різноманітні складові, одна з яких представляє собою сполуку формули (i). Слід розуміти, що сполука формули (i), в якій R=H, представляє собою акрилову кислоту, а сполука формули (i), в якій R=CH 3, представляє собою метакрилову кислоту. Відповідно, представлений винахід стосується альтернативного шляху одержання акрилової і метакрилової кислот. Сполуки формули (ii) є доступними з джерел не викопних видів палива. Наприклад, сполука, в якій R=CH3, може бути одержана з лимонної кислоти шляхом декарбоксилювання при прийнятно високих температурах. Лимонна кислота може бути одержана з використанням відомих процесів ферментації. Відповідно, процес згідно з винаходом в тій або іншій мірі сприяє 2 UA 107815 C2 5 10 15 20 25 30 35 40 45 50 55 60 забезпеченню біологічного або частково біологічного шляху для продукування акрилатів безпосередньо при зведенні до мінімуму залежності від викопних видів палива. Переважним чином, умови проведення реакції включають температуру принаймні 100 °C, більш переважно, принаймні 150 °C, більш переважно, принаймні 175 °C, більш переважно, принаймні 200 °C і ще більш переважніше, принаймні 225 °C. Переважним чином, умови проведення реакції включають температуру менше, ніж приблизно 550 °C, більш переважно менше, ніж приблизно 500 °C, більш переважно менше, ніж приблизно 475 °C, більш переважно менше, ніж приблизно 450 °C, і ще більш переважніше менше, ніж приблизно 425 °C. Переважним чином, умови проведення реакції включають температуру в діапазоні між приблизно 200 і 450 °C, більш переважно між приблизно 225 °C і 425 °C і найбільш переважно між приблизно 250 °C і 400 °C. Переважним чином, умови проведення реакції включають температуру, при якій реакційне середовище знаходиться у рідкій фазі. Для підтримання реагентів у рідкій фазі при зазначених вище температурних умовах реакцію здійснюють при прийнятних величинах тиску, вище атмосферного тиску. Прийнятні значення тиску, при яких реагенти будуть підтримуватись у рідкій фазі у зазначених вище діапазонах температур складають більше, ніж 200 псі, більш прийнятно, більше, ніж 300 псі, найбільш прийнятно, більше, ніж 450 псі і у будь-якому випадку при тиску більш вищому ніж той, нижче якого реакційне середовище буде кипіти. Не існує верхньої границі тиску, але фахівець в даній галузі буде керуватись в рамках практичного обмеження і дотримуючись припустимих відхилень, наведених у довідкових даних, наприклад, при менш, ніж 10000 псі, більш типово, при менш, ніж 5000 псі, найбільш типово, при менш, ніж 4000 псі. Переважним чином, реакція відбувається при тиску між приблизно 200 і 10000 псі. Більш переважно, реакція відбувається при тиску між приблизно 300 і 5000 псі і ще більш переважніше між приблизно 450 і 3000 псі. У переважному втіленні, реакція відбувається при тиску, при якому реакційне середовище знаходиться у рідкій фазі. Переважним чином, умови проведення реакції включають температуру і тиск, при яких реакційне середовище знаходиться у рідкій фазі. Переважним чином, джерело сполуки формули (ii) піддають реакції під дією температурного режиму і тиску у присутності каталізатора. Каталізатор може бути основним каталізатором, кислотним каталізатором або кислотним і основним каталізатором. Переважним чином, коли каталізатор включає основний каталізатор, каталізатор містить джерело OH іонів. Переважним чином, основний каталізатор включає оксид металу, гідроксид, карбонат, ацетат (етаноат), алкоксид або гідрокарбонат, або сіль металу, здатної до розкладання ди- або три-карбонової кислоти, або одну з наведених вище сполуку четвертинного амонію; більш переважно оксид металу Групи I або Групи II, гідроксид, карбонат, ацетат, алкоксид, гідрокарбонат, або сіль металу ди- або три-карбонової кислоти. Основа може містити один або більше амінів. Переважним чином, основу вибирають з однієї або більше таких: LiOH, NaOH, KOH Mg(OH)2, Ca(OH)2, Ba(OH)2, CsOH, Sr(OH)2, RbOH, NH4OH, Li2CO3, Na2CO3, K2CO3, Rb2CO3, Cs2CO3, MgCO3, CaCO3, SrCO3, BaCO3, (NH4)2CO3, LiHCO3, NaHCO3, KHCO3, RbHCO3, CsHCO3, Mg(HCO3)2, Ca(HCO3)2, Sr(HCO3)2, Ba(HCO3)2, NH4HCO3, Li2O, Na2O, 1 1 1 1 1 1 K2O, Rb2O, Cs2O, MgO, CaO, SrO, BaO, Li(OR ), Na(OR ), K(OR ), Rb(OR ), Cs(OR ), Mg(OR )2, 1 1 1 1 1 Ca(OR )2, Sr(OR )2, Ba(OR )2, NH4(OR ), де R представляє собою будь-яку C1 - C6 розгалужену, нерозгалужену або циклічну алкільну групу, необов‘язково заміщену однією або більше функціональними групами; Li(RCO2), Na(RCO2), K(RCO2), Rb(RCO2), Cs(RCO2), Mg(RCO2)2, Ca(RCO2)2, Sr(RCO2)2 або Ba(RCO2)2, де RCO2 вибирають з ітаконату, цитрату, оксалату або ацетату; метиламіну, етиламіну, пропіламіну, бутиламіну, пентиламіну, гексиламіну, циклогексиламіну, аніліну або R4NOH, де R вибирають з метилу, етилпропілу або бутилу. Більш переважно, основу вибирають з однієї або більше наступних: LiOH, NaOH, KOH, Mg(OH) 2, Ca(OH)2, Ba(OH)2, CsOH, Sr(OH)2, RbOH, NH4OH, Li2CO3, Na2CO3, K2CO3, Rb2CO3, Cs2CO3, MgCO3, CaCO3, (NH4)2CO3, LiHCO3, NaHCO3, KHCO3, RbHCO3, CsHCO3, Mg(HCO3)2, Ca(HCO3)2, Sr(HCO3)2, Ba(HCO3)2, NH4HCO3, Li2O, Na2O, K2O, Rb2O, Cs2O,; Li(RCO2), Na(RCO2), K(RCO2), Rb(RCO2), Cs(RCO2), Mg(RCO2)2, Ca(RCO2)2, Sr(RCO2)2 або Ba(RCO2)2, де RCO2 вибирають з ітаконату, цитрату, оксалату або ацетату; гідроксиду тетраметиламонію, або гідроксиду тетраетиламонію. Найбільш переважно, основу вибирають з однієї або більше наступних: NaOH, KOH, Ca(OH)2, CsOH, RbOH, NH4OH, Na2CO3, K2CO3, Rb2CO3, Cs2CO3, MgCO3, CaCO3, (NH4)2CO3, Na(RCO2), K(RCO2), Rb(RCO2), Cs(RCO2), Mg(RCO2)2, Ca(RCO2)2, Sr(RCO2)2 або 3 UA 107815 C2 5 10 15 20 25 30 35 40 45 50 55 Ba(RCO2)2, де RCO2 вибирають з ітаконату, цитрату або оксалату; або гідроксиду тетраметиламонію. Приклади кислотних каталізаторів включають протонні кислотні каталізатори і каталізатори кислот Льюіса. У переважному втіленні, протонні кислотні каталізатори, прийнятні для використання в представленому процесі, включають, але не обмежуються ними, хлорводневу кислоту, азотну кислоту, оцтову кислоту, сірчану кислоту, трифторметансульфонову кислоту, трифтороцтову кислоту. Згаданий кислотний каталізатор може містити гетерогенне джерело кислот, таке як сильнокислотні іонобмінні смоли сульфонового типу. Приклади комерційно доступних сильнокислотних іонобмінних смол сульфонового типу є тими, що відомі під товарними знаками AMBERLYST A15, AMBERLYST 38 W, AMBERLYST 36, AMBERJET 1500H, AMBERJET 1200H, (AMBERJET є товарним знаком Rohm and Haas Company) DOWEX MSC-1, DOWEX 5OW (DOWEX є товарним знаком Dow Chemical Company), DELOXAN ASP I/9 (DELOXAN є товарним знаком Evonik), DIAION SK1B (DIAION є товарним знаком Mitsubushi), LEWATIT VP OC 1812, LEWATIT S 100 MB, LEWATIT S 100 G1 (LEWATIT є товарним знаком Bayer), NAFION SAC13, NAFION NR50 (NAFION є товарним знаком DuPont) і CT275 (макропориста смола з середнім діаметром пор в діапазоні 600 - 750, доступна від Purlite). В іншому втіленні, прийнятні каталізатори кислот Льюіса включають, але не обмежуються ними, ZnCl2, BeCl2, TiCl4, SnCl4, FeCl3, FeCl2, SbCl5, AlCl3 та інші галогеніди металів. Спів каталізатори, такі як оцтова кислота можуть також бути використані у процесі згідно з винаходом. Приклади кислотних і основних каталізаторів включають пористий силікагель з великою площею поверхні, що містить 1-10 мас.% лужного металу (що згадується як метал), де каталізатор містить принаймні один модифікуючий елемент, що вибирають з бору, магнію, алюмінію, цирконію і гафнію. Приклади таких каталізаторів детально пояснені в міжнародній публікації WO 99/52628, деталі якої включені в цей документ посиланням. Каталізатор може бути гомогенним або гетерогенним. В першому втіленні, каталізатор може бути розчиненим у рідкій реакційній фазі. Однак, каталізатор може бути суспендований на твердому носії, через який може проходити реакційна фаза. В такій ситуації, реакційна фаза переважно підтримується у рідкій фазі, більш переважно, у водній фазі. Процес представленого винаходу може бути періодичним або безперервним процесом. Переважно, один з побічних продуктів може бути 2-гідроксиізомасляною кислотою (ГІМ), що знаходиться в рівновазі з продуктом МАA. Відповідно, екстракція МАК зсуває рівновагу від HIB до МАК, таким чином, генеруючи протягом процесу додаткову МАК. У представленому винаході, де R=CH3, сполука формули (ii) представляє собою цитрамалеву кислоту, а де R=H, сполука формули (ii) представляє собою яблучну кислоту. Переважним чином, джерело сполуки формули (ii) містить дикарбонову кислоти формули (ii), але може також, додатково або альтернативно, містити одну або більше солей, що є сіллю металу будь-якої Групи I або Групи II. Переважним чином, джерело сполуки формули (ii) піддавали дії реакційних умов протягом періоду часу принаймні 0,01 секунди, більш переважно принаймні приблизно 0,05 секунди, ще більш переважніше принаймні приблизно 0,1 секунди і найбільш переважно принаймні приблизно 1 секунди. Переважним чином, джерело сполуки формули (ii) піддавали дії реакційних умов протягом періоду часу менше, ніж приблизно 1000 секунд, більш переважно менше, ніж приблизно 500 секунд, ще більш переважніше менше, ніж приблизно 300 секунд. Переважним чином, джерело сполуки формули (ii) піддавали дії реакційних умов протягом періоду часу між приблизно 0,1 секунди і 300 секундами, більш переважно між приблизно 0,5 секунди і 250 секундами, і найбільш переважно між приблизно 1 секундою і 200 секундами. Переважним чином, джерело сполуки формули (ii) додатково містить воду. Переважним чином, джерело сполуки формули (ii) є водним. Переважним чином, реакція відбувається у присутності води. Переважним чином, концентрація джерела сполуки формули (ii) складає принаймні 0,001 M, переважно в її водному джерелі; більш переважно принаймні приблизно 0,005 M, переважно в її водному джерелі; більш переважно принаймні приблизно 0,01 M, переважно в її водному джерелі. Переважним чином, концентрація джерела сполуки формули (ii) складає менше, ніж приблизно 10 M, переважно в її водному джерелі; більш переважно, менше, ніж приблизно 5 M, переважно в її водному джерелі; більш переважно менше, ніж приблизно 1 M, переважно в її водному джерелі. 4 UA 107815 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважним чином, концентрація джерела сполуки формули (ii) знаходиться в діапазоні 0,001 M-10 M, більш переважно, 0,005 M-5 M, найбільш переважно, 0,01 M-1 M, переважно в її водному джерелі. Каталізатор може бути здатним до розчинності у рідкому середовищі, яке може бути водою. Каталізатор може бути здатним до розчинності в реакційній суміші. Каталізатор може бути здатним до розчинності у водному розчині. Переважним чином, концентрація каталізатора в реакційній суміші складає принаймні приблизно 0,0001 M, більш переважно принаймні приблизно 0,0005 M, більш переважно принаймні приблизно 0,001 M. Переважним чином, концентрація каталізатора в реакційній суміші складає менше, ніж приблизно 5 M, більш переважно, менше, ніж приблизно 1 M, більш переважно менше, ніж приблизно 0,5 M. Переважним чином, концентрація каталізатора в реакційній суміші знаходиться в діапазоні 0,0001 M – 5 M, більш переважно, 0,0005 M - 1 M, найбільш переважно, 0,001 M - 0,5 M, переважно в її водному джерелі. У будь-якому випадку, якщо реакція відбувається у водному розчині, концентрація каталізатора становить переважно менше, ніж або дорівнює такій величині, яка б була у насиченому розчині, при температурі і тиску даної реакції. Переважним чином, співвідношення концентрації джерела сполуки формули (ii) до концентрації каталізатора знаходиться у діапазоні між приблизно 100:1 і 1:100, більш переважно між приблизно 10:1 і 1:10, і ще більш переважніше між приблизно 5:1 і 1:5. У найбільш переважному втіленні, співвідношення концентрації джерела сполуки формули (ii) до концентрації каталізатора знаходиться у діапазоні між приблизно 3:1 і 1:1, наприклад, переважно приблизно 2:1. Переважним чином, умови реакції є в основному кислотними. Переважним чином, умови проведення реакції включають показник pH між приблизно 1 і приблизно 6, більш переважно між приблизно 2 і приблизно 5. Відповідно до ще одного аспекту представленого винаходу, забезпечується спосіб перетворення яблучної кислоти на акрилову кислоту, спосіб включає піддавання джерела яблучної кислоти реакції в умовах тиску і температури. Відповідно до ще одного аспекту представленого винаходу, забезпечується спосіб перетворення цитрамалевої кислоти на метакрилову кислоту, спосіб включає піддавання джерела цитрамалевої кислоти у рідкій фазі реакції в умовах тиску і температури. Відповідно до ще одного аспекту представленого винаходу забезпечується сполука формули (i), одержана за допомогою будь-якого способу, наведеного в зазначених вище аспектах . Відповідно до ще одного аспекту представленого винаходу забезпечується спосіб одержання алкілового естеру сполуки формули (i), спосіб включає естерифікацію сполуки формули (i), одержаної відповідно до будь-якого з наведених вище аспектів. Відповідно до ще одного аспекту представленого винаходу забезпечується спосіб одержання поліметилметакрилату (ПММА), спосіб включає естерифікацію метакрилової кислоти, одержаної відповідно до будь-якого з наведених вище аспектів, одержуючи метилметакрилат, з наступною полімеризацією згаданого метилметакрилату. Відповідно до ще одного аспекту представленого винаходу забезпечується поліметилметакрилат (ПММА), одержаний за допомогою способу, наведеного у зазначеному вище аспектіё. Як визначено вище, продукт метакрилової кислоти або акрилової кислоти може бути естерифікований з одержанням його естеру. Потенційні естери можуть бути вибрані з C 1-C12 алкілового або C2-C12 гідроксиалкілового, гліцидилового, ізоборнілового, диметиламіноетилового, трипропіленгліколевого естерів. Відповідно до ще одного аспекту представленого винаходу забезпечується спосіб одержання полімерів або співполімерів метакрилової кислоти, акрилової кислоти, естерів метакрилової кислоти та акрилової кислоти, що містить такі стадії: (i) одержання сполуки формули (i) відповідно до першого аспекту представленого винаходу; (ii) необов‘язкову естерифікацію сполуки, одержаної на стадії (i) для одержання відповідного естеру; (iii) полімеризацію сполуки, одержаної на стадії (i) та/або естеру, одержаного на стадії (ii), необов‘язково з одним або більше спів-мономерів для одержання їх полімерів або співполімерів. Переважним чином, естер, одержаний в наведеній вище стадії (ii), вибирають з C1-C12 алкілового або C2-C12 гідроксиалкілового, гліцидилового, ізоборнілового, диметиламіноетилового, трипропіленгліколевого, акрилового і метакрилового естерів, більш 5 UA 107815 C2 5 10 15 20 25 30 переважно, етилового, н-бутилового, і-бутилового, гідроксиметилового, гідроксипропілового або метилакрилатного і метакрилатного, найбільш переважно, метилметакрилатного. Переважно, такі полімери можуть складати значну частину, якщо не всі мономерні залишки, походять від джерела іншого, ніж джерело викопних видів палива. У будь-якому випадку, переважні спів-мономери включають, наприклад, моноетиленненасичені карбонові кислоти і дикарбонові кислоти, та їх похідні, такі як естери, аміди і ангідриди. Особливо переважними спів-мономерами є акрилова кислота, метилакрилат, етилакрилат, пропілакрилат, н-бутилакрилат, ізо-бутилакрилат, т-бутилакрилат, 2-етилгексилакрилат, гідроксиетилакрилат, ізо-борнілакрилат, метакрилова кислота, метилметакрилат, етилметакрилат, пропілметакрилат, н-бутилметакрилат, ізо-бутилметакрилат, тбутилметакрилат, 2-етилгексилметакрилат, гідроксиетилметакрилат, лаурил метакрилат, гліцидилметакрилат, гідроксипропілметакрилат, ізо-борнілметакрилат, диметиламіноетилметакрилат, трипропіленглікольдіакрилат, стирол, α-метилстирол, вінілацетат, акрилонітрил, бутадієн, бутадієн і стирол (МБС) і АБС піддають дії будь-якого з наведених вище спів-мономерів, що не є мономером, вибраним з метакрилової кислоти або естеру метакрилової кислоти в наведених вище (i) або (ii), в будь-якій наведеній співполімеризації згаданого кислотного мономеру в (i) або згаданого естеру мономеру в (ii) з одним або більше спів-мономерів. Звичайно також можливо використовувати суміші різноманітних спів-мономерів. Самі по собі спів-мономери можуть бути одержані за допомогою такого ж процесу як і мономери з наведених вище (i) або (ii), або за допомогою іншого процесу. Винахід також поширюється на блок-співполімери, одержані з наведених вище мономерів додаткового аспекту (i) або (ii), при необхідності, з спів-мономерами і одним або більше вихідних полімерних або співполімерних блоків та/або додаткових полімеризованих або співполімеризованих блоків. Відповідно до ще одного аспекту представленого винаходу забезпечується поліметилметакрилатні (ПММА) гомополімери або співполімери, утворені за допомогою способу в наведеному вище аспекті. Для уникнення неправильного тлумачення, під терміном цитрамалева кислота, мають на увазі наступну сполуку формули (iii) O * OH HO HO 35 O формула (iii) Цитрамалева кислота має хіральний центр у положенні “*”, однак, для цілей представленого винаходу є неважливим, яку з двох “R” або “S” цитрамалеву кислоту використовують. Для уникнення неправильного тлумачення, під терміном яблучна кислота, мають на увазі наступну сполуку формули (iv) O * OH HO H 40 45 O формула (iv) Яблучна кислота має хіральний центр у положенні “*”, однак, для цілей представленого винаходу є неважливим, яку з двох “R” або “S” яблучну кислоту використовують. Всі наведені тут ознаки можуть бути скомбіновані з будь-яким в наведених вище аспектів, у будь-якій комбінації. Для кращого розуміння винаходу і демонстрації яким чином можуть бути здійснені його втілення, надалі буде наведене посилання шляхом прикладу, на наступні фігури і приклади. Фігура 1 демонструє схематичне зображення можливого реактора. 6 UA 107815 C2 5 10 15 20 25 30 35 40 45 50 55 Посилання на фігуру 1 демонструє схематичне зображення схеми реактора 102. Викладаючи стисло, реакційна суміш із ємності 104 проходить через реактор 106, охолоджується потоком охолоджувальної води із ємності 108 і накопичується в ємності для збирання 110. Більш детально, реакційну суміш водної цитрамалевої кислоти, що містить кількість каталізатора, нагнітають з ємності 104 насосом 112 через клапан 114, датчик тиску 116 (під‘єднаний до автоматичного вимикача тиску 118) і запобіжний клапан тиску 120 до ємності реактора 106. Ємність реактора 106 під‘єднують до регулятора температури 119 і нагрівача 121 для зміни температурних умов всередині. Продукти виходять з реактору і охолоджуються потоком холодної води з ємності 108 (що нагнітається насосом охолоджувальної води 122, через клапан 124). Охолоджені продукти проходять через перший фільтр 126, теплообмінник 128 і другий фільтр 130 через регулятор зворотного тиску 132 і прямують до ємності для збирання 110. Швидкості насосів 112 і 122 можуть бути змінені і температура реактора може ретельно контролюватися для зміни реакційних умов усередині ємності реактора 106 і часу знаходження всередині ємності реактора 106. ПРИКЛАДИ Наступні приклади були здійснені таким чином. Вихідний розчин одержували шляхом розчинення твердої (R)-(-)-цитрамалевої кислоти (комерційно доступної від VWR International) з гідроксидом натрію як каталізатором в наночистій воді до необхідної концентрації. Вихідний розчин нагнітали до системи, використовуючи насос Gilson аналітичної ВЕРХ. Розчин нагнітали до нагрівальної установки (змійовик з нагрівальним елементом і кожухом), яку розміщували у печі. Піч слугує для зменшення коливань температури нагрівальної установки, забезпечуючи підвищену температуру навколишнього середовища. Температуру печі в наступних прикладах встановлювали при температурі 200 °C, але температуру нагрівальної установки встановлювали до необхідної температури реакції. Після виходу із нагрівача, потік одержаного продукту спрямовували з печі і змішували з іншим потоком води (при кімнатній температурі) для гасіння подальшої реакції. Охолоджувальну воду вводили до системи через інший насос Gilson ВЕРХ. Об‘ємом реактора вважається об‘єм між початком нагрівача і охолоджувального контуру. Охолоджений розчин продукту потім пропускали через теплообмінник для додаткового зниження температури, перед виходом системи через регулятор зворотного тиску для збирання і аналізу. Аналіз продуктів у рідкій фазі здійснювали, використовуючи метод високо-ефективної рідинної хроматографії. Всі продукти з наперед відомого списку, попередньо градуювали на ВЕРХ системі, і встановлювали діапазон лінійної характеристики концентрації для кожної сполуки. Для аналізу кожного зразку, зазвичай необхідне додаткове розбавлення для одержання концентрацій, що знаходяться в межах цього діапазону лінійної характеристики. Розділення сполук у ВЕРХ аналізі забезпечували, використовуючи колонку Phenomex RHMmonosaccharide і 0,0005 M H2SO4 як рухому фазу. Відомо також, що в цій реакції будуть утворюватися газоподібні продукти (не обмежуючись вуглекислим газом). Якісний аналіз цих продуктів здійснювали за допомогою газової хроматографії, використовуючи Varian CP-4900 microGC. Однак, на даний момент кількість цих продуктів не врахована, і тому вони не наведені в цих результатах. Було підтверджено, що це буде мати вплив на значення наведених масових балансів. Виходи продукту виражали як абсолютний вихід в мольних відсотках (100 x молів продукт/моль витраченого реактанту) Експеримент 1 Розкладення цитрамалевої кислоти при 250 °C. Умови: Вихідна речовина: 0,01 M Цитрамалева кислота Каталізатор: 0,005 M гідроксид натрію Температура: 250 °C Тиск: 5070 псі Результати експерименту 1 при різному часі утримання наведені в таблиці 1, нижче. Час утримання (с) 23,5 64,3 123,1 Перетворення ЦМ (%) 25,96 70,85 100,00 7 Вихід МА (%) 17,87 32,26 33,52 UA 107815 C2 190,6 5 10 100,00 Таблиця 1 Ключ: ЦМ = Цитрамалева кислота МА = Метакрилова кислота Експеримент 2 Розкладення цитрамалевої кислоти при 300 °C Умови: Вихідна речовина: 0,01 M Цитрамалева кислота Каталізатор: 0,005 M Гідроксид натрію Температура: 300 °C Тиск: 5070 псі Результати експерименту 2 при різному часі утримання наведені в таблиці 2, нижче. Час утримання (с) 21 63,9 1234,6 191,7 15 20 25 30 18,03 Перетворення ЦМ (%) 100,00 100,00 100,00 100,00 Таблиця 2 Як продемонстровано в наведених вище результатах експериментів, цитрамалеву кислоту перетворювали на метакриловукислоту в одностадійному процесі, піддаючи її дії надлишкового тепла і тиску, у присутності основного каталізатора. Експеримент 3 В експерименті 3, розкладання яблучної кислоти здійснювали, використовуючи спосіб, наведений у прикладах 1 і 2, але показник pH змінювали для оцінки дії pH на рівні продукування акрилової кислоти. Умови: Вихідна речовина: 0,1 M Яблучна кислота Каталізатор: [NaOH] – змінний Температура: 260 °C Час утримання: 350 секунд Тиск: 5070 пcі Результати експерименту 3 при різних рівнях pH (шляхом змінювання концентрації NaOH каталізатора), наведені нижче в таблиці 3. pH 40 45 Перетворення яблучної кислоти Вихід акрилової кислоти 2,12 2,52 2,72 3,19 3,9 5,8 35 Вихід МА (%) 80,80 24,50 36,94 31,69 42,11 43,36 50,73 55,19 68,04 47,60 0,88 2,16 3,26 6,37 7,87 1,61 Вихід малеїнової кислоти 8,20 11,35 13,73 20,42 20,53 7,77 Вихід фумарової кислоти 12,60 15,77 18,92 29,44 33,34 21,26 Таблиця 3 Експеримент 4 В експерименті 4, розкладення яблучної кислоти здійснювали, використовуючи спосіб, наведений в прикладах 1 і 2, але температуру змінювали для оцінки дії температури на рівні продукування акрилової кислоти. Умови: Вихідна речовина: 0,1 M Яблучна кислота Каталізатор: [NaOH] – 0,05 M pH: 3,17 Температура: змінна Час утримання: 100 секунд Тиск: 2500 псі Результати експерименту 4 наведені нижче в Таблиці 4. 8 UA 107815 C2 Температура (°C) 10 15 Вихід акрилової кислоти 280 290 300 310 320 330 340 5 Перетворення яблучної кислоти 57,33 70,40 81,11 86,76 90,97 95,90 95,11 7,87 13,36 19,09 27,62 36,97 41,78 59,23 30 35 Перетворення яблучної кислоти 330 335 340 345 350 355 360 365 25 Вихід фумарової кислоти 24,77 32,87 34,98 34,53 27,12 12,58 6,88 Таблиця 4 Експеримент 5 Експеримент 5 є подібним до експерименту 4 - розкладення яблучної кислоти здійснювали, використовуючи спосіб, наведений в прикладах 1 і 2, але температуру змінювали для оцінки дії температури на продукування акрилової кислоти. Умови: Вихідна речовина: 0,1 M Яблучна кислота Каталізатор: [NaOH] – 0,05 M pH: 3,31 Температура: змінна Час утримання: 100 секунд Тиск: 3500 псі Результати експерименту 5 наведені нижче в Таблиці 5. Температура (°C) 20 Вихід малеїнової кислоти 18,30 24,48 26,13 26,44 23,92 16,11 10,52 95,41 96,34 97,48 98,26 98,54 100,00 100,00 100,00 Вихід акрилової кислоти 43,66 52,30 53,22 56,18 57,73 49,02 44,68 42,21 Вихід малеїнової кислоти 16,36 13,40 8,68 5,22 2,68 0,59 0,17 0,02 Вихід фумарової кислоти 13,35 9,56 5,72 3,24 1,42 0,00 0,00 0,00 Таблиця 5 Як продемонстровано в експериментах 3 - 5, акрилова кислота може бути одержана шляхом термічного розкладання яблучної кислоти в присутності основного каталізатора. Переважним чином, представлений винахід забезпечує альтернативний шлях одержання акрилової і метакрилової кислоти. Увагу спрямовували на всі статті та документи, які зареєстровані одночасно з або раніше цього опису щодо цієї заявки, і які є викладеними для публічного ознакомлення з цим описом, і вміст всіх таких статей і документів включений в цей документ посиланням. Всі ознаки викладені в цьому описі (включаючи будь-які додану формулу винаходу, реферат та рисунки), та/або всі стадії будь-якого способу або процесу описані таким чином, що можуть бути скомбіновані в будь-яку комбінацію, за винятком комбінацій, де принаймні деякі з таких ознак та/або стадій є взаємно виключальними. Кожна ознака, розкрита в цьому описі (включаючи будь-яку додану формулу винаходу, реферат та рисунки), може бути замінена альтернативними ознаками, що забезпечують такий самий, еквівалентний або подібний результат, за винятком, якщо не встановлено інше. Таким чином, якщо не встановлено інше, кожна наведена ознака є тільки одним прикладом подібного ряду еквівалентних або подібних ознак. Винахід не обмежується деталями вище згаданого втілення (втілень). Винахід поширюється на будь-яку нову ознаку або на будь-яку нову комбінацію ознак, що наведені в цьому описі (включаючи будь-яку додану формулу винаходу, реферат та рисунки), або на будь-яку стадію, або будь-яку нову комбінацію стадій будь-якого наведеного способу або процесу. 9 UA 107815 C2 ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання сполуки формули (і): O HO 5 R , формула (і) в якій R = Н або СН3, де спосіб включає піддавання джерела сполуки формули (іі) реакції, в умовах температури і тиску: O OH OH HO R 10 15 20 25 30 O , формула (іі) в якій R має значення, як визначено вище, де, коли R = СН3, джерело сполуки формули (іі) піддають реакції при температурі і тиску під час знаходження в рідкій фазі, необов'язково, водній фазі. 2. Спосіб за п. 1, в якому умови реакції включають температуру принаймні 100 °C і менше, ніж приблизно 425 °C. 6 3. Спосіб за п. 1 або 2, в якому умови реакції включають тиск від приблизно 1,38×10 до 7 6,89×10 Па. 4. Спосіб за будь-яким з попередніх пунктів, в якому умови реакції включають температуру і тиск, при яких реакційне середовище знаходиться у рідкій фазі. 5. Спосіб за будь-яким з попередніх пунктів, в якому джерело сполуки формули (іі) піддають реакції при температурі і тиску у присутності каталізатора. 6. Спосіб за п. 5, в якому каталізатор є основним каталізатором, кислотним каталізатором або кислотним і основним каталізатором. 7. Спосіб за будь-яким з попередніх пунктів, в якому джерело сполуки формули (іі) піддають дії умов реакції протягом періоду часу між приблизно 0,1 секунди і 300 секундами. 8. Спосіб за будь-яким з попередніх пунктів, в якому умови реакції загалом є кислотними. 9. Спосіб перетворення яблучної кислоти на акрилову кислоту, який включає піддавання джерела яблучної кислоти умовам реакції тиску і температури. 10. Спосіб перетворення цитрамалевої кислоти на метакрилову кислоту, який включає піддавання джерела цитрамалевої кислоти у рідкій фазі умовам реакції тиску і температури. 11. Спосіб одержання алкілового естеру сполуки формули (і), де спосіб включає стадії: (і) одержання сполуки формули (і) O HO R , формула (і) в якій R = Н або СН3, що передбачає піддавання джерела сполуки формули (іі) реакції, в умовах температури і тиску: O OH OH HO 35 40 R O , формула (іі) в якій R має значення, як визначено вище, де, коли R = СН3, джерело сполуки формули (іі) піддають реакції при температурі і тиску під час знаходження в рідкій фазі, необов'язково, водній фазі; (іі) естерифікацію сполуки, одержаної на стадії (і), з утворенням відповідного естеру. 12. Спосіб одержання поліметилметакрилату, який включає стадії: (і) одержання сполуки формули (і) 10 UA 107815 C2 O HO R , формула (і) в якій R = Н або СН3, що передбачає піддавання джерела сполуки формули (іі) реакції, в умовах температури і тиску: O OH OH HO R 5 10 15 O , формула (іі) в якій R має значення, як визначено вище, де, коли R = СН3, джерело сполуки формули (іі) піддають реакції при температурі і тиску під час знаходження в рідкій фазі, необов'язково, водній фазі; (іі) естерифікацію сполуки, одержаної на стадії (і), з утворенням відповідного естеру; (ііі) полімеризацію естеру, одержаного на стадії (іі), з утворенням поліметилметакрилату. 13. Спосіб одержання полімерів або співполімерів метакрилової кислоти, акрилової кислоти, естерів метакрилової кислоти та/або естерів акрилової кислоти, що включає стадії: (і) одержання сполуки формули (і) відповідно до пункту 1; (іі) необов'язкову естерифікацію сполуки, одержаної на стадії (і), одержуючи відповідний естер; (ііі) полімеризацію сполуки, одержаної на стадії (і) та/або естеру, одержаного на стадії (іі), необов'язково з одним або більше співмономерами, одержуючи їх полімери або співполімери. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of producing acrylic and methacrylic acid
Автори англійськоюJohnson, David, William, Eastham, Graham, Ronald, Poliakoff, Martyn, Huddle, Thomas, Andreew
Автори російськоюДжонсон Дэвид Вильям, Истхем Грэхем Рональд, Поляков Мартин, Хаддл Томас Эндрю
МПК / Мітки
МПК: C07C 57/04, C07C 67/08, C07C 51/38, C07C 69/54
Мітки: акрилової, кислоти, метакрилової, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/13-107815-sposib-oderzhannya-akrilovo-ta-metakrilovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання акрилової та метакрилової кислоти</a>
Попередній патент: Спірооксіндольні антагоністи мdм2
Наступний патент: Спосіб хонінгування та інструмент для його реалізації
Випадковий патент: Низькопрофільні подушка, працююча на зсув, і адаптер

















