Застосування фармацевтичної композиції або добавки, яка містить фосфатидилсерин і куркумін (варіанти)
Формула / Реферат
1. Застосування фармацевтичної композиції або добавки, яка містить фосфатидилсерин або його сіль і куркумін, для попередження або лікування хвороби Альцгеймера, сенільної або пресенільної деменції або судинної деменції, фосфатидилсерин знаходиться в формі натрієвої солі і присутній в кількості від 50 до 400 мг на дозу, і куркумін присутній в кількості від 50 до 1000 мг на дозу, при цьому композиція або добавка не містить продукти деградації.
2. Застосування фармацевтичної композиції або добавки, що містить фосфатидилсерин або його сіль і куркумін, для попередження або лікування первинного і вторинного остеопорозу або остеоартриту.
3. Застосування фармацевтичної композиції або добавки за п. 2, де фосфатидилсерин знаходиться в формі натрієвої солі.
4. Застосування фармацевтичної композиції або добавки за п. 2, де фосфатидилсерин присутній в кількості від 50 до 400 мг на дозу, і куркумін присутній в кількості від 50 до 1000 мг на дозу.
5. Застосування фармацевтичної композиції або добавки за п. 1 або п. 4, де фосфатидилсерин присутній в кількості від 100 до 200 мг на дозу, і куркумін присутній в кількості від 100 до 600 мг на дозу.
6. Застосування фармацевтичної композиції або добавки за будь-яким з пп. 1-5, де фосфатидилсерин отримують в двофазній системі, утвореній водним розчином і органічним розчинником у присутності оксиду кальцію.
7. Застосування фармацевтичної композиції або добавки за будь-яким з попередніх пунктів, яка також містить одну або більше ліпідних допоміжних речовин, таких, як жирні кислоти, тригліцериди і/або фосфоліпіди, і/або поверхнево-активні речовини, і/або адсорбуючі засоби, і/або консерванти/антиоксиданти, і/або регулятори рН.
8. Застосування фармацевтичної композиції або добавки за будь-яким з попередніх пунктів, яка також містить один або більше фармакологічно і/або біологічно активних засобів натурального і/або синтетичного походження, таких як вітаміни, мінеральні солі, тонічні засоби, протизапальні засоби і амінокислоти.
9. Застосування фармацевтичної композиції або добавки за будь-яким з попередніх пунктів, в формі м'яких капсул, саше, таблеток, батончиків, розчинів або дисперсій.
10. Застосування фармацевтичної композиції або добавки за будь-яким з пп. 2-8 для попередження або лікування первинного і вторинного остеопорозу.
11. Застосування фармацевтичної композиції або добавки за будь-яким з пп. 2-8 для попередження або лікування остеоартриту.
Текст
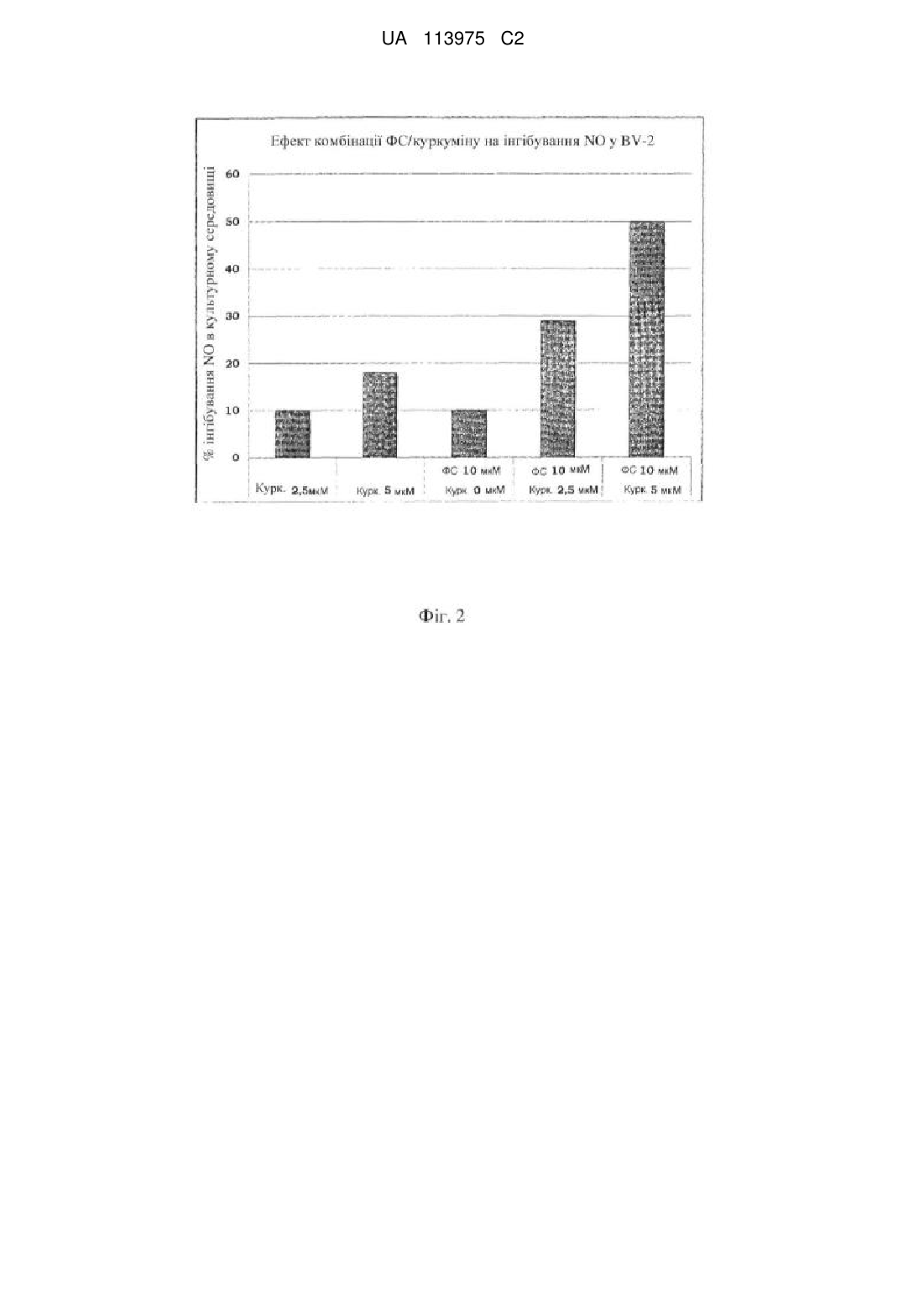
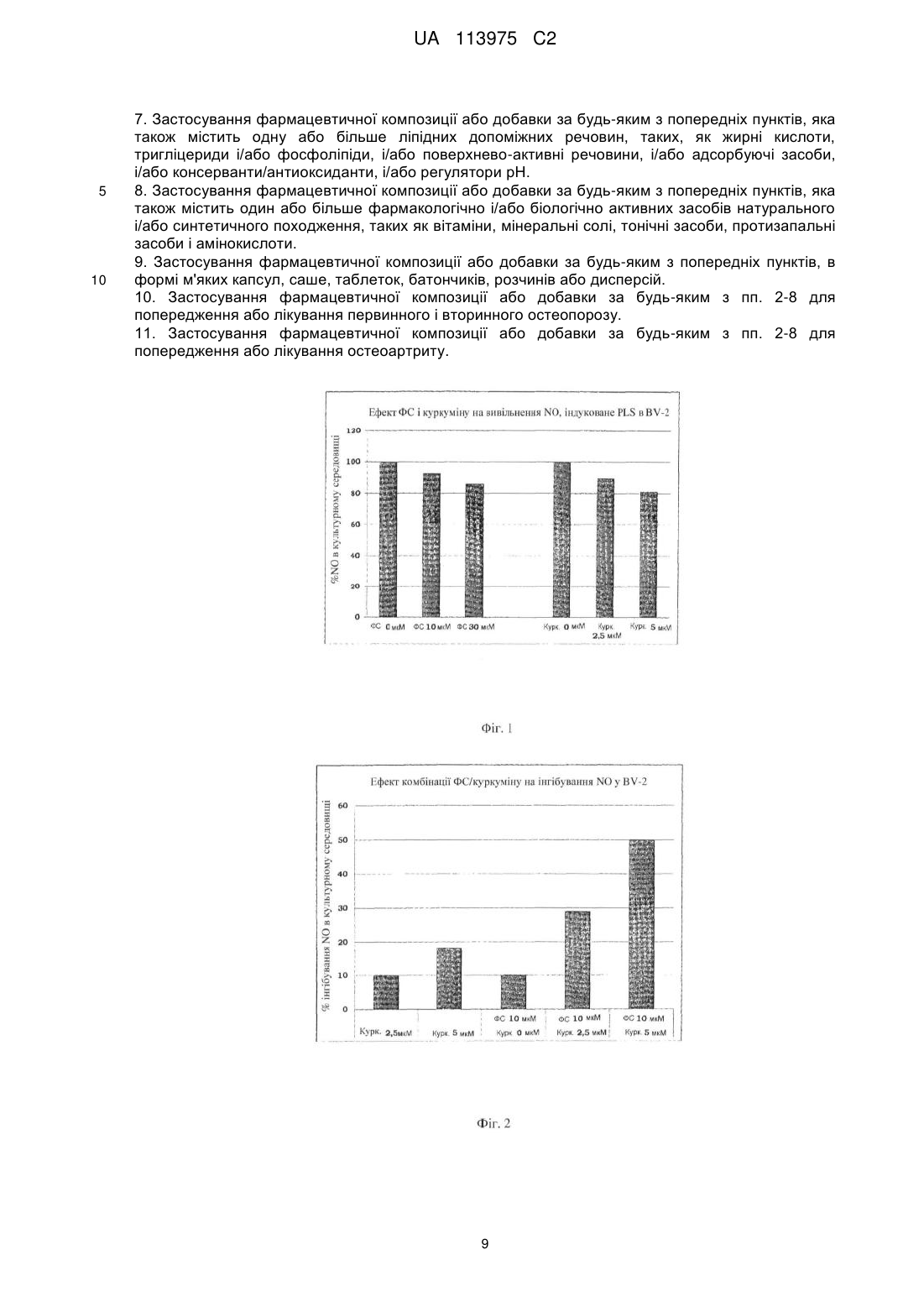
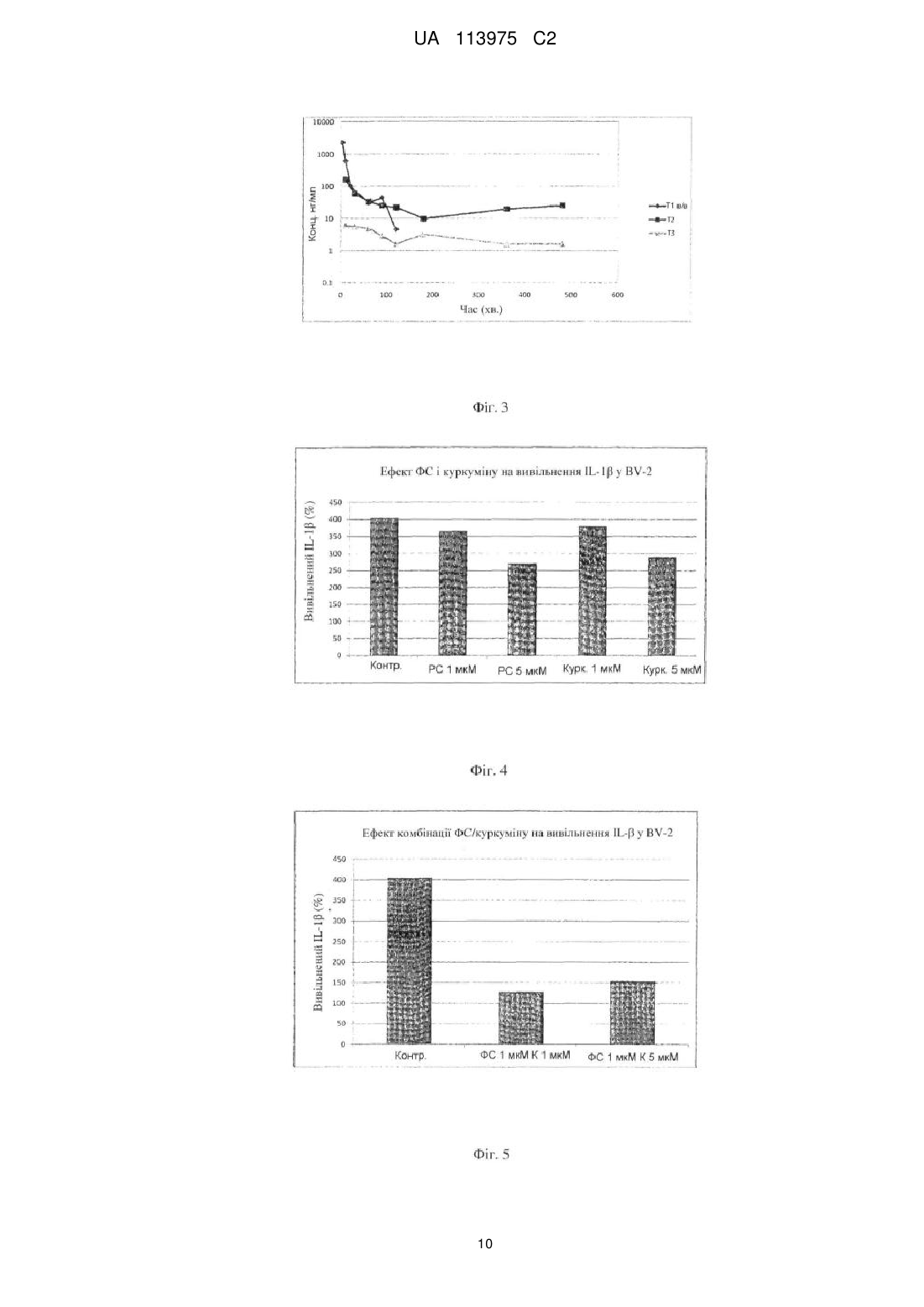
Реферат: Винахід стосується застосування фармацевтичної композиції або добавки на основі фосфатидилсерину (ФС) і куркуміну, для попередження і лікування хвороби Альцгеймера, сенільної або пресенільної деменції або судинної деменції, а також для попередження і лікування остеопорозу або остеоартриту. UA 113975 C2 (12) UA 113975 C2 UA 113975 C2 5 10 15 20 25 30 35 40 45 50 55 ПРЕДМЕТ ВИНАХОДУ Даний винахід описує і заявляє стабільні фармацевтичні композиції і/або харчові добавки на основі фосфатидилсерину (ФС) і куркуміну, які в результаті не містять продуктів деградації, для застосування для попередження і лікування розладів, асоційованих зі старінням головного мозку, і для попередження і лікування остеопорозу і/або остеоартриту. ГАЛУЗЬ ВИНАХОДУ Функціональне погіршення центральної нервової системи (ЦНС), яке має місце при фізіологічному процесі старіння головного мозку, часто спричиняє погіршення когнітивних функцій у немолодих людей, що може приймати форму поведінкових розладів зі змінами тимчасової і просторової пам'яті. Таке функціональне погіршення асоційоване з біохімічними і структурними змінами ліпідного складу мембран нейронів і зі зниженою активністю ферментів головного мозку, що може приводити до зменшення синаптичних ущільнень. Оскільки фосфатидилсерин (ФС) є основним кислим фосфоліпідом в головному мозку, в наукових дослідженнях довго шукали фармакологічне лікування пов'язаних з віком когнітивних розладів на основі фосфоліпідів, яке може запобігати (і/або частково відновлювати) такому структурному і функціональному дефіциту старіючих нейрональних мембран. Доклінічні і клінічні дослідження, які проводяться на людях, продемонстрували, що особливо у немолодих людей пероральне застосування ФС може спричиняти істотне підвищення здатності до навчання і тимчасової і просторової пам'яті, навіть у випадку особливо інвалідизуючих розладів, таких, як стареча деменція і хвороба Альцгеймера (Cenacchi T. et al.; Aging Clin Exp Res; 1993; 5: 123-133; Nunzi MG et al.; Adv Exp Med Biol; 1992; 318:393-8). Фізіологічне і патологічне погіршення когнітивних функцій немолодих людей часто може бути асоційоване зі зниженням гормонів через нормальне зниження ендокринної функції (таке, як менопауза або андропауза), або раптове припинення продукції певних гормонів через хірургічне видалення секретуючого органа (таке, як часткова або повна оварієктомії). За вказаною ситуацією часто слідують інші розлади, такі, як остеопороз. Термін "остеопороз" означає стан, внаслідок якого скелет отримує більший ризик переломів через зниження маси і модифікації мікроархітектури кістки. Остеопороз визначають як втрату більш ніж 30 % кістки. Він головним чином розвивається в трабекулярних кістках, які зазнають найбільшої кількості переломів, і починається зі зниження вмісту кальцію кісткової маси (остеопенія). Кістки, що найчастіше уражаються зниженням вмісту кальцію, являють собою поперекові хребці, стегно і зап'ясток. При прогресуванні остеопенії може розвиватися руйнування хребців або перелом шийки стегна. Остеопороз класифікують як первинний (оригінальний) або вторинний, тобто який виникає внаслідок супутнього явища; однак, первинна форма визначає майже всі випадки (95 %). Первинний остеопороз включає пост-менопаузальний остеопороз і сенільний остеопороз (останній розвивається внаслідок різних причин, які включають відсутність рухливості і низьке споживання кальцію, магнію, вітаміну D і інших важливих мікроелементів). Вторинний остеопороз може бути класифікований як викликаний тривалою імобілізацією, ревматоїдним артритом, злоякісними пухлинами або зниженою абсорбцією поживних речовин в кишечнику. Він найбільш широко поширений серед різних кісткових захворювань, вражає людей обох статей, але переважно жінок у постменопаузі; у США більшість дорослих старше 50 років страждають від остеопорозу або зниженої щільності кістки. Причиною є дисбаланс між остеобластами і остеокластами; перша категорія клітин бере участь в утворенні кістки, тоді як друга бере участь в резорбції кістки, так що якщо остеокласти працюють швидше, ніж остеобласти, кістка руйнується. Під час менопаузи продукція остеокластів збільшується через втрату естрогенів, що приводить до підвищення рівня цитокінів, який корелює з продукцією остеокластів. При другій формі активність остеобластів знижується з віком. Доступні профілактичні і лікувальні заходи включають: - введення холекальциферолу для забезпечення абсорбції кальцію в кишечнику, - добавку кальцію і магнію, - введення бісфосфонатів, які інгібують активність остеокластів, - замісну гормональну терапію естрогенами і прогестогенами для жінок в менопаузі і тестостероном для чоловіків, - інгібування остеокластів кальцитоніном, - клодронат із підшкірним кальцитоніном для лікування болю при переломах. 1 UA 113975 C2 5 10 15 20 25 30 35 40 45 50 55 60 Остеоартрит (OA) часто асоційований з остеопорозом у немолодому віці; це високо інвалідизуюче захворювання характеризується прогресуючим руйнуванням суглобового хряща через деградацію матриці суглоба і втрату клітинних компонентів. Фізіологічний процес старіння поверхні суглобів ймовірно включає ферментативні механізми OA. Відомо, що механічний дисбаланс, який впливає на суглоб, загалом може запускати розвиток вказаного розладу. Така нестабільність суглоба може по суті бути викликана різними факторами (такими, як травма, запалення суглобової системи, ерозія хряща, неправильна хода або поза), і може приводити до змін тонкого балансу між синтезом і руйнуванням позаклітинного матриксу, який головним чином синтезується хондроцитами і синовіоцитами. Коли такий стан повного, але крихкого гомеостазу порушується, руйнування матриці перевершує її синтез і починається повільний, але прогресуючий процес деградації, який погано компенсується відповідним процесом синтезу внаслідок втрати хондроцитів. Надмірне і/або неправильне навантаження на суглоб може викликати відповідь хондроцитів, що виявляється синтезом ферментів, які відповідають за руйнування хряща. Протеазні ферменти, які відповідають за деградацію хряща, називаються матриксними металопротеїназами (MMP), і синтезуються хондроцитами, при стимуляції запальними цитокінами, такими, як IL-1 і TNF-α, які продукуються і вивільняються в суглобову порожнину, особливо в дебюті запального захворювання. IL-1 стимулює синтез великої кількості оксиду азоту (який відповідає за смерть хондроцитів в результаті апоптозу), і також інгібує синтез хондроцитами протеогліканів (компоненти матриці) (Dozin B. et al., Matrix Biology, 2002, 21:449459). Доступні методи лікування включають введення стероїдних і нестероїдних лікарських препаратів у поєднанні із введенням у суглоб препаратів, які поліпшують ковзання суглобових поверхонь. Фармацевтичні композиції, які містять антиоксиданти, такі, як куркумін, в цей час продаються як профілактичні або лікувальні засоби для вищезазначених нейродегенеративних розладів і запальних захворювань загалом. Куркумін (диферулоїлметан; 1,7-біс[4-гідрокси-3-метоксифеніл]-1,6-гептадієн-3,5-діон) являє собою жиророзчинну молекулу і його разом з моно- і диметоксипохідними, відомими як куркуміноїди, отримують шляхом екстракції розчинником із висушеного і подрібненого кореневища рослини Curcuma longa (куркума). Куркуму історично використовували в Індійській Аюрведичній медицині для лікування великої кількості захворювань, але до 20 століття не було клінічних досліджень, які ідентифікують куркумін як фактор, відповідальний за основну частку її біологічних дій. Куркумін став предметом множини доклінічних і клінічних досліджень, так що його протизапальна і антиоксидантна ефективність добре задокументована: він має здатність регулювати окислювальний баланс клітин, беручи участь у множині механізмів різними шляхами; зокрема, він інгібує ряд факторів з сильною запальною активністю (COX 1 і 2, TNF, ліпоксигеназа і інтерферон-гамма). Нарешті, його ефективність як протипухлинного засобу була продемонстрована in vitro (Bengmark S., JPEN, 2006, 30(1):45-51). Однак його клінічне застосування обмежене дуже низькою біодоступністю при пероральному введенні внаслідок низької абсорбції в шлунково-кишковому тракті, зумовленої ліпофільністю вказаного активного інгредієнта. Із вказаних причин, була зроблена множина спроб підвищення біодоступності куркуміну, таких, як комбінація його з піперином (який є токсичним) або з іншими оліями Curcuma longa (US7736679), або його інкапсуляція в ліпосоми або фітосоми, що складаються з фосфоліпідів/лецитину (EP 1991244). Однак пероральна біодоступність куркуміну залишається обмеженою. Фосфатидилсерин являє собою кислий фосфоліпід з трьома іонізованими групами (аміно, фосфат і карбоксил), які переважно присутні у внутрішній частині плазматичної мембрани; множина досліджень продемонструвала його ефективність в поліпшенні нейрональної активності, яка залежить від мембран клітин, і в нормалізації щільності нейрональних рецепторів для відновлення нормальних рівнів ацетилхоліну і допаміну. ФС, який існує зараз на ринку, оснований на процесах продукції і очищення (відомих фахівцеві), які включають ферментативну конверсію фосфатидилхоліну (ФХ) і/або фосфатидилетаноламіну (ФЕ) у ФС за допомогою реакції трансфосфатидилування, каталізованої ферментом фосфоліпазою D (PLD), з подальшим очищенням за допомогою кінцевої екстракції органічними розчинниками. ФС отримують у вигляді порошку, але продають переважно в рідкій формі, звичайно змішаним з масляними розчинниками, які містять тригліцериди, для його рецептування у вигляді м'яких капсул. 2 UA 113975 C2 5 10 15 20 25 30 35 40 45 50 55 60 Однак вказаний фосфоліпід має істотні проблеми стабільності композиції з трьох основних причин: - присутність слідів ферменту PLD в кінцевій композиції м'яких капсул, що приводить до швидкого розкладання ФС з подальшим утворенням фосфатидової кислоти (ФК) і/або фосфатидилгліцерину, внаслідок заміни серину гліцерином, присутнім в капсулі (EP1663157); - в присутності вільних радикалів (ROS) ФС може зазнавати процесу перекисного окислення ліпідів поліненасичених жирних кислот молекули (Bochkov V., Antioxidants & Redox Signaling; 2010, 12(8): 1009-1058); - нарешті, ФС також може зазнавати процесу окислення на полярній головці, серині, що приводить до накопичення ФК (Maciel E. et al., J Am Soc Mass Spectrom, 201 1, 22(10): 1804-14). Предметом даного винаходу є нова фармацевтична композиція, яка містить комбінацію ФС і куркуміну, оскільки Заявники виявили, що вона стабілізує вказаний фосфоліпід шляхом сповільнення і/або зупинки процесів його множинного розпаду і окислення (раніше описаних), таким чином допускаючи рецептування стабільної комбінації ФС/куркумін, позбавленої продуктів деградації, для отримання фармацевтичних композицій (і добавок) у всіх фармацевтичних і нефармацевтичних формах, відомих фахівцеві в цей час (капсули, батончики, розчини/дисперсії для ампульних препаратів). ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід описує і заявляє нові фармацевтичні композиції або харчові добавки на основі ФС і куркуміну для застосування для попередження і лікування розладів, асоційованих зі старінням головного мозку, описаних вище, і для попередження і лікування остеопорозу і/або остеоартриту. Заявники виявили, що комбінація куркуміну з фосфатидилсерином стабілізує вказаний фосфоліпід таким чином, що фармацевтичні композиції (або інші композиції), які містять вказану комбінацію, не містять ФС в деградованій/окисленій формі або навіть продуктів деградації ФС, описаних вище, таким чином зберігаючи незмінними всі фармакологічні властивості ФС. Заявники також описали нові фармацевтичні форми, такі, як м'які капсули або таблетки, розчини і/або дисперсії, батончики або інші композиції, відомі фахівцеві, які містять нову стабільну комбінацію, що складається з ФС/куркуміну. Предметом даного винаходу є нове терапевтичне застосування фармацевтичних композицій, які містять ФС і куркумін: - застосування для попередження і лікування нейродегенеративних розладів зі зниженням когнітивних аспектів і порушеннями пам'яті, таких, як хвороба Альцгеймера, сенільна або пресенільна деменція і судинна деменція; - застосування для попередження і лікування первинного і вторинного остеопорозу; - застосування для попередження і лікування остеоартриту (OA). Заявники продемонстрували синергічний ефект нової стабільної комбінації ФС/куркуміну в зниженні продукції оксиду азоту (NO). Отримані результати є надзвичайно важливими, оскільки NO залучений в патогенез: - окислювального пошкодження клітин, яке розвивається, наприклад, при реперфузії після ішемії; - нейродегенеративних розладів, таких, як хвороба Альцгеймера, сенільна і пресенільна деменція і судинна деменція; - порушень структури кісток і суглобів, таких, як остеопороз і остеоартрит. У ЦНС патогени, стан стресу, вік або нейродегенеративні розлади можуть запускати запальну відповідь, зумовлену активацією гліальних клітин (зокрема, мікрогліальних клітин), яка, за допомогою секреції прозапальних молекул, нейротрансмітерів і реактивних форм, таких, як NO, модулює вказані запальні процеси. Зокрема, високі концентрації NO були виявлені в нейронах і глії, де він бере участь в підтримці і прогресуванні нейрозапального процесу через його певну здатність створювати вільні радикали, які пошкоджують цілісність клітини, піддаючи її окислювальному стресу (Fernandez AP et al., Curr Pharm Des, 2010, 16(25):2837-50). Крім того, NO також ймовірно залучений до процесів розвитку кістки шляхом збільшення диференціювання остеокластів, таким чином змінюючи мінеральну щільність кістки (Ninomiya JT, Poster Session-Bone Cell Biology, 2001, 47th AM of Orthopaedic Research Society, California). Нарешті, була продемонстрована присутність і активна роль NO в тканині суглобів пацієнтів, які страждають від OA: висока концентрація NO інгібує мітохондріальну активність хондроцитів і синовіоцитів і спричиняє утворення вільних радикалів і внаслідок - клітинну смерть. Запальні речовини, сильно залучені до описаних процесів, включають цитокіни, особливо інтерлейкіни. Вони продукуються активованими макрофагами і відповідають за ряд функцій клітини, включаючи апоптоз. Зокрема, було продемонстровано, що в клітинах нервової системи 3 UA 113975 C2 5 10 15 20 25 30 35 40 45 50 55 60 інтерлейкіни залучені до запального каскаду, який впливає на розвиток і протікання дегенеративних розладів, таких, як хвороба Альцгеймера (Kitazawa et al., J Immunol, 201 1, 187, 6539-6549). Роль ФС в інгібуванні ферменту, який відповідальний за синтез NO і подальше сповільнення процесу остеокластогенезу, який викликає втрату трабекулярної кістки, добре відома (Aramaki Y, Biochem Biophys Res Commun, 2001, 280(4):982-7). Нарешті, здатність куркуміну інгібувати продукцію NO шляхом регуляції ферменту NOсинтази також відома; через його протизапальну активність, таким чином, куркумін тестували при нейродегенеративних розладах, OA і для попередження пошкодження кістки (Kim WK, J Cell Biochem, 2011, 112(11):3159-66). Заявники в цей час несподівано виявили і згодом продемонстрували синергічний ефект нової стабільної комбінації ФС/куркуміну в зниженні продукції оксиду азоту (NO) в клітинах мікроглії після стимуляції прозапальними засобами (LPS). Такий результат був повністю несподіваним і в світлі відомих ефектів NO, описаних вище, підтримує нове терапевтичне застосування фармацевтичної композиції, яка містить стабільну комбінацію ФС/куркуміну і при нейродегенеративних розладах і при таких, які залучають кісткову систему. Предметом даного винаходу, отже, є нові методи застосування і методи лікування наступних захворювань, які включають щоденне введення 1 або більше фармакологічно активних доз фармацевтичної композиції на основі ФС/куркуміну: - попередження і лікування нейродегенеративних розладів, які включають зниження когнітивних аспектів і порушення пам'яті, таких, як хвороба Альцгеймера, сенільна і пресенільна деменція і судинна деменція; - попередження і лікування первинного і вторинного остеопорозу; - попередження і лікування остеоартриту (OA). ФС, що застосовуються в описаній комбінації, отримують за допомогою ферменту PLD, який каталізує трансфосфатидилування між ФХ і серином, реакцію, яка має місце у водному оточенні (EP1231213, EP 1048738) або двофазній системі води/розчинника (EP0776976, EP 1890706). Однак переважно використовувати ФС, що отримується відповідно до патенту EP 1890706, де ФС отримують у присутності оксиду двовалентного металу у водно-спиртовому реакційному оточенні, або в оточенні, що містить апротонний розчинник або двофазну систему; отримання ФС в двофазній системі, утвореній водним розчином і органічним розчинником в присутності оксиду кальцію, є ще більш переважним, оскільки така система допускає отримання ФС з високою концентрацією і високим ступенем чистоти. Куркумін (з його похідними, такими, як складні ефіри, які діють як проліки), що застосовується в даному винаході, може бути використаний як такий (звичайно асоційований з іншими куркуміноїдами, присутніми в менших пропорціях, таких, як Curcumin Complex), або у вигляді Biocurcumin (BCM-95®), асоційований з оліями і полімерами, які збільшують його біодоступність (US20070148263), або рецептованим в комбінації з піперином (Shobha et al., Planta Med, 1998, 64: 353-56), або отриманим у вигляді мікро- або наноемульсій/нанодисперсій, в яких використовують лецитин і/або жирні кислоти і/або тригліцериди і необов'язково також поверхнево-активні речовини, такі, як Tween 80, для стабілізації молекули і підвищення її біодоступності. Нова стабільна комбінація, яка є предметом даного винаходу, складається з: - ФС (переважно у вигляді натрієвої солі) в концентрації від 50 до 400 мг на дозу фармацевтичної композиції, переважно від 100 до 200 мг; - куркуміну в концентрації від 50 до 1000 мг на дозу активного інгредієнта, переважно від 100 до 600 мг, залежно від вихідної композиції активного інгредієнта, що використовується в комбінації з ФС. Переважними фармацевтичними (і нефармацевтичними) формами є м'які капсули, саше, таблетки, батончики або розчини/дисперсії для ампульних препаратів. Особливо переважними фармацевтичними формами є м'які капсули і саше; комбінація ФС і куркуміну може бути рецептована в композиціях, отриманих як відомо фахівцеві, з використанням, наприклад, ліпідних допоміжних речовин (таких, як жирні кислоти, тригліцериди і/або фосфоліпіди); поверхнево-активних речовин (таких, як полісорбати); адсорбуючих засобів (таких, як сорбіт і маніт); консервантів/антиоксидантів (таких, як аскорбінова кислота); регуляторів pH (таких, як лимонна кислота); і нарешті нові композиції за винаходом також можуть містити фармацевтично/біологічно активні речовини натурального і/або синтетичного походження, такі, як вітаміни, мінеральні солі, тонізуючі речовини (такі, як женьшень і гінгко білоба), протизапальні засоби і амінокислоти. 4 UA 113975 C2 Деякі приклади композиції нової комбінації ФС і куркуміну за винаходом показані нижче як приклад, але не обмеження, разом з результатами дослідження in vitro. Приклад 1: Отримання саше, які містять 200 мг ФС/400 мг куркуміну Інгредієнти 5 Натрієва сіль ФС Куркумін (95 %) Аспартам Колоїдний діоксид кремнію Соєвий лецитин Натуральний лимонний ароматизатор Маніт Фруктоза q.s. для 10 15 20 200 мг 400 мг 10 мг 20 мг 20 мг 60 мг 200 мг 6000 мг Саше повинні містити однорідний, текучий гранулят, який приємно приймати, і стабільний з плином часу. Діоксид кремнію робить гранулят текучим і запобігає утворенню агрегатів; маніт і лецитин полегшують диспергування активного інгредієнта у воді, тоді як фруктоза, переважно з розміром частинок менш ніж 150 мкм, допускає отримання однорідної суміші ФС/куркуміну з допоміжними речовинами. Процес отримання: змішування інгредієнтів ФС, заздалегідь змішаний із відповідним чином просіяним лецитином і куркуміном, завантажували в мішалку з кубічним барабаном і потім додавали всі допоміжні речовини, які залишилися, після просіювання. Атмосферу робили інертною за допомогою потоку фільтрованого азоту і змішування продовжували протягом 30 хвилин. Потім суміш використовували для заповнення саше (знову під потоком азоту), які герметизували жаром. Приклад 2: Отримання м'яких капсул, які містять 100 мг ФС/200 мг куркуміну Інгредієнти Натрієва сіль ФС Куркумін (95 %) Лецитин Рослинна олія 25 100 мг 200 мг 50 мг 300 мг Інгредієнти оболонки Желатин Гліцерин Коричневий оксид заліза Е172 Червоний оксид заліза Е172 Етил п-гідроксибензоат натрію Пропіл п-гідроксибензоат натрію 30 35 40 360 мг 140 мг 3 мг 1,2 мг 1,6 мг 0,9 мг Процес отримання: Змішування інгредієнтів Для вказаної процедури використовували турбоемульгатор FPYNA VME 400; спочатку в нього вливали описану кількість рослинної олії, і нагрівали до однорідної температури 25 °C. Додавали половину загальної кількості ФС, куркуміну і інгредієнтів, що залишилися. Прилад закривали і створювали вакуум; потім турбіну запускали протягом 15 хвилин. Додавали другу половину інгредієнтів і знову створювали вакуум. Турбіну запускали протягом додаткових 40 хвилин. Температура не повинна перевершувати 40 °C. Потім також активували гомогенізуючий млин протягом всього 90 хвилин, поки активні складові і інгредієнти, що залишилися, повністю і рівномірно диспергувалися. Млин вимикали, тоді як турбіна залишалася такою, що працює, протягом додаткових 10 хвилин. Отриману суміш потім використовували для заповнення капсул. Приклад 3: ФС/куркумін: синергічне інгібування продукції NO 5 UA 113975 C2 5 10 15 20 25 30 35 40 45 Вказаний експеримент проводили для оцінки здатності стабільної комбінації ФС/куркуміну модулювати активацію мікроглії in vitro порівняно з ефектом, що створюється окремо ФС і окремо куркуміном. МАТЕРІАЛИ І МЕТОДИ ФС (натрієву сіль), продуковану і очищену відповідно з EP 1890706 (приклад 3), ресуспендували в 2:1 хлороформі/метанолі, сушили випарюванням і ресуспендували в PBS в кінцевій концентрації 100 мкМ. 95 % чистий куркумін, отриманий в DMSO в кінцевій концентрації активного інгредієнта 20 мM, використовували для експерименту, що проводиться. Експериментальна модель Модель активації глії in vitro з використанням мишачої клітинної лінії мікроглії BV-2 вибирали для вказаного експерименту: 50000 клітин/комірку початково сіяли в 96-ямкові планшети і культивували в DMEM, що містить 10 % FCS, глютамін і антибіотики при 37 °C. При активації LPS (ліпополісахаридом, ендотоксином грам-негативних бактерій, що звичайно використовується як прозапальний стимул і in vitro і in vivo), такі клітини вивільняли NO в культуральному середовищі; отже, в експерименті використовували їх стимуляцію з допомогою 0,1 мкг/мл LPS протягом ночі в присутності або відсутності ФС (10 і 30 мкМ) або куркуміну (2,5 і 5 мкМ) в різних концентраціях. Нарешті, для оцінки синергії між двома активними складовими комбінацію ФС/куркуміну досліджували в присутності LPS 0,1 мкг/мл (як описано вище): 10 мкΜ ФС + 2,5 мкΜ куркуміну, і 10 мкΜ ФС + 5 мкΜ куркуміну. Кінцевий вміст NO в середовищі вимірювали за допомогою тестуГрісса: коротко, аліквоти середовища змішували з однаковими об'ємами реагенту Грісса (0,1 % дигідрохлориду N(1нафтил)етилендіаміну, 1 % сульфаніламіду і 0,4 M HCl). Через 15 хвилин реакції поглинання вимірювали при 570 нм. Результати На фіг. 1 показаний ефект, викликаний ФС і куркуміном (у вищезазначених концентраціях), відносно вивільнення NO в культуральному середовищі клітинами мишачої мікроглії BV-2: обидві молекули інгібували вивільнення NO в середовище дозозалежно, так обидва ФС і куркумін знижували продукцію NO в клітинах, активованих LPS, таким чином підтверджуючи їх протизапальну ефективність, описану в літературі і раніше згадану. На фіг. 2 чітко і зрозуміло продемонстрований синергічний ефект, що проявляється новою стабільною комбінацією ФС/куркуміну в інгібуванні вивільнення NO активованою мікроглією: дійсно, 10 мкΜ ФС в комбінації з 5 мкΜ куркуміну інгібують 50 % вивільнення NO в культуральне середовище, тоді як одиночне лікування 10 мкΜ ФС не перевершувало 10 %, і одиночне лікування 5 мкΜ куркуміну викликало менш ніж 20 % інгібування. Синергічний ефект зумовлений (щонайменше, частково) стабілізацією ФС. Приклад 4: Біодоступність комбінацій ФС/куркуміну Біодоступність куркуміну визначали після перорального введення композицій, які містять екстракт Curcuma longa, в поєднанні з фосфоліпідами в різних співвідношеннях. Фосфоліпідами, що використовуються, були фосфатидилсерин (ФС) і фосфатидилхолін (ФХ), які звичайно використовують комерційно для збільшення абсорбції куркуміну. Порівняння проводили порівняно з в/в введенням куркуми окремо. Композиції і дози Композиції отримували, як вказано далі В/в введення (Т1): 3 мг/кг Пероральне введення (Т2): 340 мг/кг Пероральне введення (Т3): 340 мг/кг 50 Куркума (10 % DMSO, 5 % розчин в H2O): 2 мг/кг Ліпосоми куркума/ФС - 1:4 мас./мас., фосфатний буфер рН 7,4: 10 мл/кг Ліпосоми куркума/ФС/РС - 1:2:2 мас./мас./мас., фосфатний буфер рН 7,4: 10 мл/кг Композиції T2 і T3 отримували шляхом розчинення куркуми в етанолі (500 мг куркуми/75 мл EtOH), нагрівання розчинів до 60 °C і додавання фосфоліпідів до отриманого розчину. Потім розчин перемішували протягом 3 годин, для індукції утворення ліпосом. Розчинник екстрагували у вакуумі. Композиції отримували перед кожною обробкою шляхом ресуспендування суміші ліпосом у фосфатному буфері pH 7,4 (14,7 мл). Тварини і лікування 6 UA 113975 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовували щурів Sprague-Dawley (маса тіла - 225-250 г). Усіх тварин зважували кожний день лікування і моніторувати з регулярними інтервалами для виявлення будь-яких реакцій на лікування. Кожну тварину ідентифікували барвником, що розпилюється на спину перед експериментом. У кінці експерименту тварин умертвляли під анестезією за допомогою в/в наддози пентоталу натрію, Intervet. Експеримент проводили відповідно до застосовного Італійського законодавства (Законодавчий акт 1 16/92). Зразки крові В/в лікування (T1): зразки крові забирали з хвостової вени через 3, 10, 20, 60, 90, 120, 180 і 360 хв. Пероральне лікування (T2-T3): зразки крові забирали з хвостової вени через 10, 30, 60, 90, 120, 180, 360 і 480 хв. Фармакокінетичний аналіз Наступні параметри оцінювали для кожного пацієнта: Cmax - максимальна концентрація в плазмі. Cmax/D - максимальна концентрація в плазмі, нормалізована по дозі (фіг. 3). tmax - час, що потрібен для досягнення максимальної концентрації в плазмі. Результати і висновки Біодоступність куркуміну оцінювали шляхом порівняння композицій в ліпосомах ФС або ФХ/ФС у різних співвідношеннях при в/в введенні. Як очікували, абсолютна біодоступність виявилася загалом дуже низькою через метаболізм у печінці (наприклад, через утворення кон'югатів). Аналіз даних, представлених на фіг. 3, чітко показує, що композиція T2 має чудову біодоступність, яка відразу після введення чітко порівнянна з такою в/в лікування. Концентрація в плазмі залишається високою, стабільною і постійною протягом тривалого періоду часу, таким чином дозволяючи знизити кількість введень на добу. Композиція T3, однак, індукує більш низький рівень у крові. Очевидно, що фосфатидилсерин має ефект, який чітко забезпечує абсорбцію куркуми, в більшій мірі, ніж фосфатидилхолін. Дійсно, оскільки загальне співвідношення куркуми/фосфоліпідів становить 1:4 в обох пероральних композиціях, поліпшення біодоступності композиції T2, очевидно, залежить не тільки від простої присутності фосфоліпідів, використання яких добре відоме для такої мети, а також природи фосфоліпіду, що використовується. Приклад 5: ФС/куркумін: синергічне інгібування вивільнення IL-Ιβ Експеримент проводили у дві стадії і він був створений для оцінки ефекту на in vitro вивільнення IL-Ιβ з клітин мікроглії BV-2, стимульованих LPS, після введення ФС і куркуміну. ILΙβ являє собою цитокін, чітко залучений до запальних процесів, які лежать в основі і кістковосуглобових захворювань, і нейродегенерації. Матеріали і методи Мишачі клітини мікроглії BV-2 стимулювали, як описано в прикладі 3 (0,1 г/мл LPS протягом 16 годин), і потім обробляли ФС і куркуміном в концентрації 1 мкΜ або 5 мкΜ. Рівні IL-Ιβ визначали за допомогою аналізу ELISA. Контроль (контр.) представлений клітинами, стимульованими LPS, але не лікованими. На фіг. 4 чітко показане, що ні ФС, ні куркумін, які вводяться окремо, достовірно не інгібували вивільнення IL-Ιβ з клітин BV-2, стимульованих LPS; обмежений ефект виникає при більш високих концентраціях (5 мкΜ) для обох речовин. На другій стадії експерименту ефекти комбінації двох речовин оцінювали за тим же параметром відповідно до того ж протоколу. Для демонстрації синергії було вирішено скомбінувати концентрації, які давали найменший інгібуючий ефект при окремому введенні. Результати показані на фіг. 5. Комбінація ФС/куркуміну достовірно і синергічно інгібувала вивільнення IL-Ιβ; синергія була навіть більш очевидною в світлі того факту, що найкраще інгібування отримували з концентраціями, які давали найгірший результат в першій частині експерименту (1 мкΜ ФС + 1 мкΜ куркуміну). Приклад 6: ФС/куркумін: підвищене вивільнення βΙΙΙ тубуліну Метою експерименту було досліджувати модулюючу роль ФС і куркуміну на ефекти нейрозапальних процесів, які сильно інгібують диференціювання нейронів, шляхом оцінки експресії білка βΙΙΙ тубуліну, індикатора диференціювання. Матеріали і методи 7 UA 113975 C2 5 10 15 20 25 30 35 40 45 50 55 60 Експеримент проводили відповідно до застосовного Італійського законодавства. Використовували культури стовбурових клітин/клітин попередників нейронів (NPC), отримані з суправентрикулярної зони дорослих мишей. NPC культивували в умовах диференціювання за допомогою механічної дисоціації нейросфер і посіву окремих клітин на планшети, покриті поліорнітином і ламініном у культуральному середовищі, яке містить тільки фактор bFGF, відповідно до сучасних існуючих методик. Культури NPC, отримані таким чином, ділили на аліквоти, кожну з яких обробляли окремо, як вказано далі: a) вплив на культуральне середовище клітин мікроглії, активованих LPS, для індукції запального пошкодження, яке запобігає або сильно інгібує диференціювання; b) обробка a) і введення ФС і куркуміну послідовно в різних концентраціях; c) обробка a) і ФС/куркуміном, комбінованими в різних відносних концентраціях. Контроль був представлений необробленими NPC клітинами. Диференціювання нейронів оцінювали через 6 днів, за допомогою імуноцитохімічного аналізу з антитілами, направленими проти специфічного маркера βΙΙΙ тубуліну, екстраполюючи % концентрації білка, присутнього в середовищі. Результати представлені на фіг. 6. Концентрації виражали у мкМ. Як очікувалося в світлі їх відомих властивостей, в присутності ліпосом тільки ФС (1 і 5 мкΜ) і тільки куркуміну (1 і 5 мкΜ), процентне відношення клітин, позитивних до βΙΙΙ тубуліну, було вже трохи підвищене при найменшій концентрації для обох речовин, але достовірно не відрізнялося від такого, що спостерігається в присутності тільки LPS. Несподівано, однак, комбінація ФС/куркуміну повністю відміняла інгібування диференціювання нейронів, індуковане LPS, відновлюючи її до контрольних значень при мінімальних концентраціях, що використовуються. Такі останні результати демонструють, що комбінація ФС і куркуміну має незаперечний синергічний ефект у відновленні диференціювання нейронів, зниженого в умовах запалення, на відміну від двох речовин, що використовуються окремо. На закінчення в даному винаході Заявники продемонстрували: - що фармацевтичні композиції, які містять нову стабільну комбінацію ФС/куркуміну, описану в даному описі, мають дуже високу біодоступність після перорального введення; - що нова стабільна комбінація ФС/куркуміну має синергічний ефект в зниженні продукції оксиду азоту (NO); - що нова стабільна комбінація ФС/куркуміну має синергічний ефект у зниженні вивільнення IL-1β, цитокіну, сильно залученого до запальних процесів; - що нова стабільна комбінація ФС/куркуміну має синергічний ефект у забезпеченні диференціювання нейронів у клітинах, підданих нейрозапальній стимуляції; і, отже, описує і заявляє застосування фармацевтичних композицій, які містять вказану комбінацію для попередження захворювань, асоційованих зі старінням головного мозку, описаних вище, і для попередження і лікування остеопорозу і/або остеоартриту. ФОРМУЛА ВИНАХОДУ 1. Застосування фармацевтичної композиції або добавки, яка містить фосфатидилсерин або його сіль і куркумін, для попередження або лікування хвороби Альцгеймера, сенільної або пресенільної деменції або судинної деменції, фосфатидилсерин знаходиться в формі натрієвої солі і присутній в кількості від 50 до 400 мг на дозу, і куркумін присутній в кількості від 50 до 1000 мг на дозу, при цьому композиція або добавка не містить продукти деградації. 2. Застосування фармацевтичної композиції або добавки, що містить фосфатидилсерин або його сіль і куркумін, для попередження або лікування первинного і вторинного остеопорозу або остеоартриту. 3. Застосування фармацевтичної композиції або добавки за п. 2, де фосфатидилсерин знаходиться в формі натрієвої солі. 4. Застосування фармацевтичної композиції або добавки за п. 2, де фосфатидилсерин присутній в кількості від 50 до 400 мг на дозу, і куркумін присутній в кількості від 50 до 1000 мг на дозу. 5. Застосування фармацевтичної композиції або добавки за п. 1 або п. 4, де фосфатидилсерин присутній в кількості від 100 до 200 мг на дозу, і куркумін присутній в кількості від 100 до 600 мг на дозу. 6. Застосування фармацевтичної композиції або добавки за будь-яким з пп. 1-5, де фосфатидилсерин отримують в двофазній системі, утвореній водним розчином і органічним розчинником у присутності оксиду кальцію. 8 UA 113975 C2 5 10 7. Застосування фармацевтичної композиції або добавки за будь-яким з попередніх пунктів, яка також містить одну або більше ліпідних допоміжних речовин, таких, як жирні кислоти, тригліцериди і/або фосфоліпіди, і/або поверхнево-активні речовини, і/або адсорбуючі засоби, і/або консерванти/антиоксиданти, і/або регулятори рН. 8. Застосування фармацевтичної композиції або добавки за будь-яким з попередніх пунктів, яка також містить один або більше фармакологічно і/або біологічно активних засобів натурального і/або синтетичного походження, таких як вітаміни, мінеральні солі, тонічні засоби, протизапальні засоби і амінокислоти. 9. Застосування фармацевтичної композиції або добавки за будь-яким з попередніх пунктів, в формі м'яких капсул, саше, таблеток, батончиків, розчинів або дисперсій. 10. Застосування фармацевтичної композиції або добавки за будь-яким з пп. 2-8 для попередження або лікування первинного і вторинного остеопорозу. 11. Застосування фармацевтичної композиції або добавки за будь-яким з пп. 2-8 для попередження або лікування остеоартриту. 9 UA 113975 C2 10 UA 113975 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions containing phosphatidylserine and curcumin
Автори англійськоюGennari, Giovanni, Panfilo, Susi
Автори російськоюДжэннари Джованни, Панфило Сузи
МПК / Мітки
МПК: A61K 31/685, A61K 31/12
Мітки: фосфатидилсерин, застосування, фармацевтично, містить, куркумін, добавки, варіанти, композиції, яка
Код посилання
<a href="https://ua.patents.su/13-113975-zastosuvannya-farmacevtichno-kompozici-abo-dobavki-yaka-mistit-fosfatidilserin-i-kurkumin-varianti.html" target="_blank" rel="follow" title="База патентів України">Застосування фармацевтичної композиції або добавки, яка містить фосфатидилсерин і куркумін (варіанти)</a>